一種長喙毛茛澤瀉微繁方法與流程
本發明涉及一種長喙毛茛澤瀉微繁方法,屬于園藝林業技術領域。
背景技術:
長喙毛茛澤瀉(Ranalisma rostratum)是一種瀕危的水生草本植物,隸屬澤瀉科毛茛澤瀉屬,產于我國浙江、江西、湖南及越南和馬來西亞,國內目前只在江西、湖南發現了零散的小群居,而且群居數目和個體仍在減小,說明這種植物已處于嚴重的瀕危狀態。目前,關于長喙毛茛澤瀉的組織工程育苗鮮有報道。而如何擴大其種群數量,并對該植物進行保護,是迫切解決的問題。
基于此,做出本申請。
技術實現要素:
針對現有長喙毛茛澤瀉的現狀,本申請提供一種可實現無性人工繁殖、成活率高的長喙毛茛澤瀉微繁方法。
為實現上述目的,本申請采取的技術方案如下:
一種長喙毛茛澤瀉微繁方法,將清洗后的長喙毛茛澤瀉作為外植體進行滅菌得到無菌苗,在無菌苗上選取微繁器官進行生根培養,得到的組培苗移栽即可。
進一步的,作為優選:
所述的微繁器官為無菌苗的莖段、葉片或葉柄,該微繁器官進行芽誘導后再進行生根培養。更優選的,所述的莖段選用帶有分生組織的莖段。所述的誘導培養基是由MS培養基和6BA(6-芐氨基嘌呤)、KT(激動素)、IBA(吲哚丁酸)、ZT(玉米素)中的至少兩種構成,6BA、KT、IBA、ZT中的至少兩種添加在MS培養基中;所述6BA的添加濃度為0.2-4mg/L,所述KT的添加濃度為0.2-2mg/L,所述IBA的添加濃度為0.4-1mg/L,所述ZT的添加濃度為0.2-1mg/L。
所述的微繁器官為無菌苗的匍匐莖,該匍匐莖直接生芽繁殖得到組培苗。
所述的無菌苗培養基是由MS培養基和特美汀和/或頭孢霉素,特美汀和/或頭孢霉素添加在MS培養基中。更優選的,所述的MS培養基先滅菌后再添加特美汀和/或頭孢霉素。
所述的生根培養基為未添加激素的MS培養基。
所述的MS培養基的pH為5.8-6.0,其化學成分及用量如下(工作液濃度單位:mg/L):大量元素:NH4NO3(1650),KNO3(1900),CaCl2·2H2O(440),MgSO4·7H2O(370),KH2PO4(170);微量元素:KI(0.83),H3BO3(6.2),MnSO4·4H2O(22.3),ZnSO4·7H2O(8.6),Na2MoO4·2H2O(0.25),CuSO4·5H2O(0.025),CoCl2·6H2O(0.025);鐵鹽:FeSO4·7H2O(27.8),Na2-EDTA·2H2O(37.3);有機物質:肌醇(100),煙酸(0.5),鹽酸吡哆醇(維生素B6)(0.5),鹽酸硫胺素(維生素B1)(0.1),甘氨酸(2.0)。
所述的MS培養基中添加有瓊脂,瓊脂的添加濃度為5.4-5.8g/L。
附圖說明
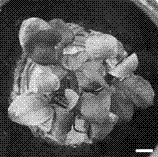
圖1為本申請中長喙毛茛澤瀉外植體接種6天的狀態圖;
圖2為本申請中外植體培育30天時得到的無菌苗側面圖;
圖3為本申請中外植體培育30天時得到的無菌苗俯視圖;
圖4為圖3中的無菌苗單株;
圖5為圖3中的無菌苗纖匍枝;
圖6為本申請中長喙毛茛澤瀉葉片培育20天時的狀態圖;
圖7為本申請中長喙毛茛澤瀉葉柄培育20天時的狀態圖;
圖8為本申請中長喙毛茛澤瀉帶分生組織的莖段誘導30天時的狀態圖(培養基:MS+6BA 2.0mg/L+KT 2.0mg/L+IBA 0.4mg/L);
圖9為圖8中誘導培養得到的單株狀態圖(箭頭指示不定芽);
圖10為生根狀態圖(即圖8的仰視圖);
圖11為移栽效果圖。
具體實施方式
1.材料與方法
1.1實驗材料
長喙毛茛澤瀉幼苗由浙江林業科學院石從廣博士提供,本實驗室人工氣候室培養,實驗材料采用該植物的葉片、葉柄和帶有分生組織的莖段。
1.2培養基與培養條件
1.2.1 MS培養基配方
MS培養基作為基本培養基,其化學成分及用量如下(工作液濃度單位:mg/L):大量元素:NH4NO3(1650),KNO3(1900),CaCl2·2H2O(440),MgSO4·7H2O(370),KH2PO4(170);微量元素:KI(0.83),H3BO3(6.2),MnSO4·4H2O(22.3),ZnSO4·7H2O(8.6),Na2MoO4·2H2O(0.25),CuSO4·5H2O(0.025),CoCl2·6H2O(0.025);鐵鹽:FeSO4·7H2O(27.8),Na2-EDTA·2H2O(37.3);有機物質:肌醇(100),煙酸(0.5),鹽酸吡哆醇(維生素B6)(0.5),鹽酸硫胺素(維生素B1)(0.1),甘氨酸(2.0)。
1.2.2抗生素培養基/無菌苗培養基
可選用三種作為比對案例:(1)MS+特美汀200mg/L(單位下同)+頭孢霉素200;(2)MS+特美汀200;(3)MS+頭孢霉素400。
1.2.3芽誘導培養基
可選用十種作為比對案例:(4)MS+6BA 2.0mg/L(單位下同)+KT 2.0+IBA 0.4;(5)MS+6BA 4.0+KT 2.0+IBA 0.4;(6)MS+KT 4.0+IBA 0.4;(7)MS+ZT 0.2+6BA 2.0+KT 2.0+IBA 0.4;(8)MS+ZT 0.4+IBA 0.4;(9)MS+ZT 1.0+IBA 0.4;(10)MS+ZT 0.2+KT 2.0+IBA 0.4;(11)MS+ZT 0.2+6BA 2.0+IBA 0.4;(12)MS+ZT 0.2+IBA 1.0;(13)MS+6BA 0.2+KT 0.2+IBA 1.0。
1.2.4生根培養基:未加激素的MS培養基。
上述所有MS培養基中都添加蔗糖30g/L,pH值5.8-6.0;由于長喙毛茛澤瀉是沼澤植物,我們通過控制瓊脂添加濃度進行培養基硬度的調整,本實施例以分三個檔次的瓊脂濃度為例,分別是:5.4g/L的軟培養基,強度:1000;5.6g/L的正常培養基;5.8g/L的硬培養基;培養基滅菌條件:115℃,15min,培養基滅完菌后,冷至60℃添加特美汀、頭孢霉素等抗生素。
1.2.5培養條件
組織培養室與人工氣候室內的溫度為25±2℃;光照周期為14小時光照/10小時黑暗,光照強度為2000-2500lux。
表1不同激素組合對莖段不定芽的誘導
表1中的編號是指培養基的編號,表1中的各參數均為接種20天統計,每個組合統計21塊外植體,采用t-test方法檢測差異度,設定每個外植體有1個不定芽為參照;“*”代表p<0.05,“**”代表p<0.01。
1.3方法
本申請的微繁過程具體如下:
1.3.1外植體滅菌和無菌苗的培養:長喙毛茛澤瀉去除淤泥、老的根和葉,用自來水沖洗兩小時,濃洗潔精溶液浸泡5分鐘,不斷震蕩,清水沖洗掉洗潔精后移入超凈工作臺。外植體用升汞(0.1%)消毒8分鐘,無菌水清洗5分鐘(重復四次),無菌水沖洗三次,除凈升汞。然后將帶有嫩葉的莖段移入3種添加不同抗生素的培養基中,一周后判斷除菌的效果。然后每2周更換新的培養基,3次后移入無抗生素的MS培養集中,一周后判斷除菌的效果。
1.3.2芽誘導培養:超凈工作臺中,無菌苗的葉切成0.5cm x 0.5cm長度的葉盤,葉柄切成0.5cm長度的葉柄段,帶有分生組織的莖縱切0.2cm-0.4cm直徑的莖段,把這些莖段移入芽誘導培養基中,組織培養室中培養。20-30天統計芽誘導的情況。
1.3.3生根培養:芽長到1.5-3cm時,把芽切下來移入未加激素的MS培養基中生根。
1.3.4組培苗移栽:組培苗不定根長到約0.5cm時,移入溫室,打開蓋子,加入適量自來水,隔斷空氣中的菌類,3天后清除掉根部的培養基,栽植于培養基質(蛭石:腐植土=1:1)中,20天統計成活率。
1.4統計方法
采用SPSS 22.0軟件進行數據統計,顯著性差異采用Student's t test。
“*”表示差異顯著(p<0.05);“**”表示差異極顯著(p<0.01)。
2.結果
2.1無菌組培苗的獲得
我們采用特美汀和頭孢霉素來清除長喙毛茛澤瀉體內的內生菌,發現兩者混合使用(即1.2.2中的培養基(1)效果最好(參見圖1),抗生素中繼代3次,然后在無菌的培養基上培養2周后統計,其外植體除菌效率達到85%(153個無菌苗/180個外植體),無菌苗見圖2-5。而其它2個培養基一般在初代培養中全部長出菌斑,無菌苗培養效果沒有培養基(1)的好。而不同濃度的瓊脂對無菌苗的生長影響較大,生長狀態最好的是瓊脂濃度為5.4g/L的軟培養基。在此培養基中,無菌苗生長狀態良好,30天時發現有匍匐莖的發生,以及生長出新的不定芽(圖5)。
2.2不定芽的誘導
長喙毛茛澤瀉的葉片、葉柄在所有設計的10個培養基中都沒有愈傷和器官的發生(圖6、圖7),只有帶有分生組織的莖段能誘導出不定芽,也沒有愈傷的發生(圖9、圖10)。通過對不同激素配方的培養基(表1)誘導不定芽的數量發現1.2.3中的培養基(4)芽誘導數量最多,平均每個外植體達到2.4個不定芽(圖8)。隨著促細胞分裂激素(ZT,6BA和KT)總量的增加,抑制不定芽的誘導(表1中培養基(5)、(6)和(7)),培養基中激素含量低時,誘導不定芽(表1中培養基(8)、(9)和(10))的效率較低,培養基中IBA增加時,則能促進不定芽的發生(表1中培養基(11),(12)和(13))。
2.3生根
不定芽在不同培養基中都有不同程度的生根現象,特別是無菌苗獲得過程中組培苗生根情況良好,我們把培養出的不定芽轉入生根培養基(MS)中進行培養,生根率達95%以上(圖10)。
2.4組培苗移栽
長喙毛茛澤瀉種植到基質中,蓋上透明蓋子保濕,放入人工氣候室培養。2天后,植物葉片開始直立并返綠,拿走蓋子,打開日光燈,讓其正常生長。后期植株生長加速,葉片變綠,長勢旺盛。20天統計移栽成活率在95%以上(圖11)。
長喙毛茛澤瀉的繁殖方式有兩種:無性和有性,本申請在獲得無菌組培苗時,發現有匍匐莖的發生,并且匍匐莖上有不定根產生,最后形成一連串直線排列的新植株(圖3和圖5)。這說明可以模擬長喙毛茛澤瀉的自然營養繁殖方式,通過組培瓶內培養匍匐莖來微繁長喙毛茛澤瀉。
植物激素的濃度和配比對植物組織培養影響很大,細胞分裂素促進芽的分化,生長素促進愈傷組織的形成,不同的植物其適合的濃度配比不同。我們發現帶有分生組織的莖能誘導出不定芽,葉片和葉柄誘導出愈傷組織和不定芽(圖6和圖7)的效果不明顯。因此,通過莖段誘導不定芽的微繁方式可以作為長喙毛茛澤瀉人工繁殖的方式之一。
本申請通過對無菌苗、培養基硬度、不定芽誘導、生根和移栽等工藝條件的研究,上述各培養方法中,組培瓶內匍匐莖微繁方式和莖段不定芽微繁方式兩種微繁方法的誘導效果最佳、最有效,可為該物種的保護提供了有效的技術。
以上內容是結合本發明創造的優選實施方式對所提供技術方案所作的進一步詳細說明,不能認定本發明創造具體實施只局限于上述這些說明,對于本發明創造所屬技術領域的普通技術人員來說,在不脫離本發明創造構思的前提下,還可以做出若干簡單推演或替換,都應當視為屬于本發明創造的保護范圍。
- 還沒有人留言評論。精彩留言會獲得點贊!