阿魏菇多糖作為制備樹突狀細(xì)胞疫苗佐劑的應(yīng)用的制作方法
本發(fā)明屬于醫(yī)藥領(lǐng)域,具體涉及阿魏菇多糖作為制備樹突狀細(xì)胞疫苗佐劑的應(yīng)用。
背景技術(shù):
樹突狀細(xì)胞(dendritic cell;DC)是機(jī)體專職的抗原遞呈細(xì)胞,可以識(shí)別、捕獲和加工抗原,并將抗原遞呈給na?ve T細(xì)胞,激活抗原特異性的免疫反應(yīng),從而連接固有免疫系統(tǒng)和獲得性免疫系統(tǒng)。在抗原遞呈過程中,不同的信號(hào)參與了抗原特異性T細(xì)胞的激活,包括MHC-多肽復(fù)合物、DC和T細(xì)胞表面共刺激分子之間的相互作用、DC分泌的細(xì)胞因子等。DC分泌的白細(xì)胞介素-12(IL-12)可促進(jìn)CD4+ Th1型免疫反應(yīng)及細(xì)胞毒性T淋巴細(xì)胞反應(yīng),這兩種免疫反應(yīng)在腫瘤治療中起著重要作用。DC疫苗(DC-based vaccine)是一種具有前景的腫瘤治療性疫苗形式,在臨床上可以誘導(dǎo)產(chǎn)生抗原特異性的免疫反應(yīng),安全性高。然而,由于DC未達(dá)到最佳成熟狀態(tài),并且分泌的IL-12水平較低,導(dǎo)致DC疫苗的臨床效果有限。因此,需要通過佐劑提高DC成熟狀態(tài)及IL-12分泌水平,從而提高DC疫苗的臨床效果。
佐劑(如鐘樣受體激動(dòng)劑:toll-like receptor (TLR) agonists)被廣泛應(yīng)用于新型疫苗(如多肽/蛋白疫苗、DNA疫苗及DC疫苗等),以提高疫苗的免疫原性。但是大部分佐劑具有毒副作用,不適合臨床應(yīng)用。目前美國(guó)FDA及歐洲批準(zhǔn)用于臨床應(yīng)用的佐劑種類非常少,僅包括鋁化合物佐劑、MF59、AS03、AF03及AS04。因此,急需開發(fā)新型、安全、高效的免疫佐劑增強(qiáng)疫苗的免疫原性,提高抗原特異性免疫反應(yīng),發(fā)揮疫苗良好的預(yù)防和治療效果。
中草藥已經(jīng)有幾千年的臨床應(yīng)用歷史,臨床效果與其有效成分對(duì)機(jī)體的免疫調(diào)節(jié)作用,尤其是對(duì)抗原遞呈細(xì)胞的成熟狀態(tài)及功能的調(diào)節(jié)密切相關(guān),其安全性得到了充分的驗(yàn)證,并具有多效性,無依賴性等特征,是篩選安全、高效佐劑的理想來源。
技術(shù)實(shí)現(xiàn)要素:
本發(fā)明的目的是將從中藥阿魏菇(Pleurotus ferulae)中提取純化得到的阿魏菇多糖(PFPS)作為樹突狀細(xì)胞疫苗佐劑,刺激樹突狀細(xì)胞成熟,從而促進(jìn)樹突狀細(xì)胞疫苗免疫反應(yīng),提高抗腫瘤效果。
為了解決上述技術(shù)問題,本發(fā)明提供了如下的技術(shù)方案:
阿魏菇多糖作為制備樹突狀細(xì)胞疫苗佐劑的應(yīng)用。
優(yōu)選地,所述阿魏菇多糖為均一多糖,分子量為1500~1600kDa。
阿魏菇多糖的提取純化方法,包括:
(1)采用水提醇沉法得到阿魏菇粗多糖;
(2)將阿魏菇粗多糖溶解于水中,然后過二乙氨基乙基纖維素柱,流動(dòng)相為水和/或鹽水。
優(yōu)選地,所述鹽水為濃度為0.05~0.3mol/L的氯化鈉溶液。
優(yōu)選地,所述鹽水為濃度為0.05mol/L的氯化鈉溶液。
附圖說明
附圖用來提供對(duì)本發(fā)明的進(jìn)一步理解,并且構(gòu)成說明書的一部分,與本發(fā)明的實(shí)施例一起用于解釋本發(fā)明,并不構(gòu)成對(duì)本發(fā)明的限制。在附圖中:
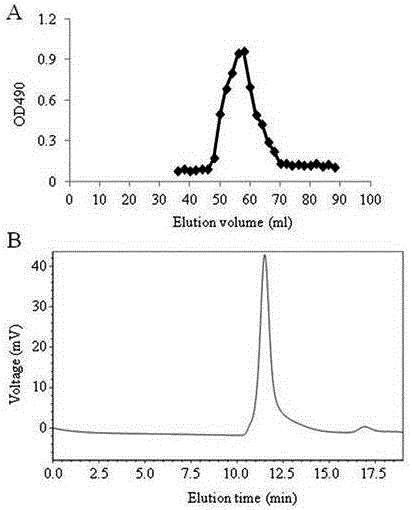
圖1 (A)阿魏菇粗多糖的洗脫曲線及洗脫液多糖含量,(B)不同流動(dòng)相所得的洗脫液體外刺激DC成熟的活性。
圖2 (A)為PFPS-0.05的純化及分子量檢測(cè)過丙烯葡聚糖凝膠S-300HR的洗脫曲線,(B)PFPS-0.05的高效凝膠滲透色譜圖。
圖3 為PFPS-0.05對(duì)DC成熟及細(xì)胞因子表達(dá)的影響。收集體外培養(yǎng)的不成熟DC,用10、50、100 μg/ml的PFPS-0.05 或者 20 ng/ml的LPS刺激12小時(shí)。(A)通過流式細(xì)胞術(shù)檢測(cè)DC表面CD40、CD80、 CD86和MHC II的表達(dá)。圖中顯示了這些蛋白的平均熒光強(qiáng)度(MFI)。(B)酶聯(lián)免疫吸附法(ELISA)測(cè)定DC培養(yǎng)上清中白細(xì)胞介素-12(IL-12)及腫瘤壞死因子-α(TNF-α)的表達(dá)量。數(shù)據(jù)來自4個(gè)獨(dú)立的實(shí)驗(yàn),并進(jìn)行單因素方差分析,*P<0.05、**P<0.01、***P <0.001,處理組與未處理組比較得出。
圖4 為TLR4抑制劑對(duì)DC成熟及細(xì)胞因子表達(dá)的影響。收集體外培養(yǎng)的不成熟DC,用TLR4抑制劑(TAK-242)進(jìn)行預(yù)處理,然后用10、50 、100 μg/ml的PFPS-0.05 或者 20 ng/ml的LPS刺激12小時(shí)。(A)通過流式細(xì)胞術(shù)檢測(cè)DC表面CD40的表達(dá)。上邊重疊峰圖為CD40表達(dá)水平,下邊為CD40的平均熒光強(qiáng)度(MFI)。(B)ELISA測(cè)定DC培養(yǎng)上清中IL-12及TNF-α的表達(dá)量。數(shù)據(jù)來自3個(gè)獨(dú)立的實(shí)驗(yàn),并進(jìn)行成對(duì)t檢驗(yàn)。
圖5 為TLR4信號(hào)通路分子磷酸化水平檢測(cè)。收集體外培養(yǎng)的不成熟DC,用50 μg/ml的PFPS-0.05進(jìn)行刺激,在不同時(shí)間點(diǎn)收集DC,提取細(xì)胞質(zhì)及細(xì)胞核蛋白,通過Western blot檢測(cè)TLR4信號(hào)通路分子的磷酸化水平。
圖6 為PFPS-0.05刺激的DC與人乳頭瘤病毒(HPV)多肽孵育后(HPV+PFPS+DC)對(duì)腫瘤的治療效果。腫瘤模型建立后,治療分為早期治療及晚期治療,早期治療組在第5天及第12天注射HPV+PFPS+DC,晚期治療組在第12天及第19天注射HPV+PFPS+DC。對(duì)照組分別為在第5天及第12天注射PFPS+DC,或不治療組。(A)左邊為腫瘤體積生長(zhǎng)曲線,右邊為計(jì)算的曲線下面積(AUC)。(B)實(shí)驗(yàn)結(jié)束后,分離腫瘤并稱重。數(shù)據(jù)進(jìn)行單因素方差分析,*P<0.05、**P<0.01,治療組與不治療組比較得出。
圖7 為腫瘤小鼠脾臟中CD4+和CD8+ T細(xì)胞比例及亞群比例。實(shí)驗(yàn)結(jié)束后,分離脾臟細(xì)胞,通過流式細(xì)胞術(shù)檢測(cè)CD4+(A)和CD8+(B)T細(xì)胞比例及亞群比例。*P<0.05、**P<0.01,治療組與不治療組比較得出。(C)CD4+和CD8+ Tem細(xì)胞比例與腫瘤體積相關(guān)性。
圖8 為HPV特異性細(xì)胞免疫反應(yīng)及骨髓來源的抑制性細(xì)胞(MDSCs)和巨噬細(xì)胞的比例。實(shí)驗(yàn)結(jié)束后,分離脾臟細(xì)胞。(A)脾臟細(xì)胞用HPV多肽刺激過夜,通過流式細(xì)胞術(shù)檢測(cè)HPV特異性細(xì)胞免疫反應(yīng)。(B)CD8+ IFN-γ+ 細(xì)胞比例與腫瘤體積相關(guān)性。(C)MDSCs(CD11b+Gr-1+)及巨噬細(xì)胞(CD11b+Gr-1-)在腫瘤小鼠脾臟中的比例。(D)MDSCs比例與腫瘤體積相關(guān)性。*P<0.05、**P<0.01、***P<0.001,治療組與不治療組比較得出。
具體實(shí)施方式
以下結(jié)合附圖對(duì)本發(fā)明的優(yōu)選實(shí)施例進(jìn)行說明,應(yīng)當(dāng)理解,此處所描述的優(yōu)選實(shí)施例僅用于說明和解釋本發(fā)明,并不用于限定本發(fā)明。
阿魏菇多糖的提取純化
稱取100g阿魏菇凍干粉,用1 L 95%乙醇浸提2小時(shí)去脂,5000 rpm/min離心10 min收集沉淀,沉淀用1 L去離子水重懸,60℃水浴2小時(shí),超聲20min助溶,6000 rpm/min離心15 min,收集上清,濾渣反復(fù)浸提4次后,合并上清液,在60℃水浴溫度下真空旋轉(zhuǎn)濃縮至1/10體積后,用Sevage試劑法:按濃縮液:Sevage試劑(氯仿:正丁醇=4:1)=3:1比例混合,磁力攪拌30min后,6000rpm/min 離心10 min,保留上清,反復(fù)脫蛋白6次,所得上清加無水乙醇至終濃度為80%, 4℃過夜,6000rpm/min離心10 min,沉淀用無水乙醇,丙酮各洗滌一次,自然干燥3小時(shí)后得粗多糖。
稱取360 mg粗多糖重新溶解于去離子水中(濃度約5 mg/ml),經(jīng)0.22 μm超濾杯過濾后,真空旋轉(zhuǎn)濃縮至終濃度約為20 mg/ml,過DEAE-52纖維素柱層析(2.6×66 cm),依次用去離子水、0.05 M、0.1 M和0.3 M NaCl溶液階段洗脫柱子,流速為1.0 ml/min,5 ml/tube收集洗脫液,采用苯酚硫酸法在490 nm處測(cè)定多糖含量,繪制洗脫曲線(圖1A)。按照洗脫峰收集合并組分,透析冷凍干燥,分別命名為PFPS-W、PFPS-0.05、PFPS-0.1及PFPS-0.3,多糖純度分別為59%、96%、70%及35%。
阿魏菇多糖刺激DC成熟活性檢測(cè)
以不同濃度的純化的PFPS處理體外培養(yǎng)的不成熟DC,12小時(shí)后通過流式細(xì)胞術(shù)檢測(cè)DC表面CD40的表達(dá)(圖1B)。可以看出,PFPS-W、PFPS-0.05、PFPS-0.1均具有刺激DC成熟的活性,其中鹽洗脫的多糖刺激DC成熟的活性顯著高于水洗脫的多糖。
PFPS-0.05的分子量測(cè)定
基于多糖純度及刺激DC成熟活性,我們選取0.05 M NaCl洗脫的PFPS-0.05進(jìn)行進(jìn)一步的分析。PFPS-0.05經(jīng)0.22 μm濾膜過濾后,過丙烯葡聚糖凝膠S-300HR,以去離子水進(jìn)行洗脫,3 ml/tube收集洗脫液,流速為0.5 ml/min, 苯酚硫酸法測(cè)定吸光值,繪制洗脫曲線。根據(jù)洗脫曲線,得到一個(gè)純洗脫峰(圖2A)。我們采用高效凝膠滲透色譜法(high performance gel-permeation chromatography)檢測(cè)了PFPS-0.05的均一度及分子量檢測(cè)(圖2B)。移動(dòng)相為0.71%的硫酸鈉,流動(dòng)速率為0.5 ml/min。結(jié)果顯示,PFPS-0.05為成分均一的多糖。以分子量為9.75, 36.8, 135.35, 300.6 and 2000 kDa的右旋糖苷標(biāo)準(zhǔn)品制備標(biāo)準(zhǔn)曲線,計(jì)算PFPS-0.05的分子量大約為1500~1600 kDa。
PFPS-0.05促進(jìn)DC成熟及細(xì)胞因子表達(dá)
以不同濃度(10、50和100 mg/ml)的PFPS-0.05刺激體外培養(yǎng)的不成熟DC,12小時(shí)后收集細(xì)胞,采用流式細(xì)胞術(shù)檢測(cè)DC表面CD40、CD80、CD86和MHC II分子的表達(dá)。如圖3A所示,PFPS-0.05顯著提高了CD40及CD86的表達(dá)水平,并呈劑量依賴性。CD80及MHC II的表達(dá)水平也有一定的提高。收集上述細(xì)胞培養(yǎng)上清,采用酶聯(lián)免疫吸附法(ELISA)測(cè)定白細(xì)胞介素-12(IL-12)及腫瘤壞死因子-α(TNF-α)的表達(dá)量。如圖3B所示,PFPS-0.05顯著增加了IL-12及TNF-α的分泌水平,水平與陽性對(duì)照細(xì)菌脂多糖(LPS)相當(dāng)。結(jié)果顯示,PFPS-0.05促進(jìn)了DC的成熟及細(xì)胞因子表達(dá)。
PFPS-0.05通過TLR4信號(hào)通路刺激DC成熟
為了驗(yàn)證PFPS-0.05是否通過TLR4信號(hào)通路刺激DC成熟,我們用TLR4抑制劑(TAK-242)對(duì)DC進(jìn)行預(yù)處理,然后用不同濃度的PFPS-0.05或LPS刺激。12小時(shí)后檢測(cè)CD40表達(dá)及細(xì)胞因子分泌。如圖4A&B所示,TAK-242預(yù)處理顯著抑制了PFPS-0.05及LPS誘導(dǎo)的CD40的表達(dá)及IL-12和TNF-α的分泌水平,結(jié)果暗示PFPS-0.05通過TLR4信號(hào)通路刺激了DC成熟。
我們進(jìn)一步檢測(cè)了TLR4信號(hào)通路下游分子的活性狀態(tài)。50 mg/ml的PFPS-0.05處理后,在不同時(shí)間點(diǎn)收集細(xì)胞,提取細(xì)胞質(zhì)及細(xì)胞核蛋白,通過Western blot檢測(cè)TLR4信號(hào)通路分子的磷酸化水平。如圖5所示,JNK和ERK在10 min時(shí)被磷酸化,30 min時(shí)磷酸化水平開始降低。p38也在10 min時(shí)被磷酸化,并持續(xù)到了240 min。我們也觀察到,在30 min時(shí)被磷酸化并且持續(xù)到了240 min。結(jié)果顯示,PFPS-0.05激活了TLR4下游MAPK及信號(hào)通路。
PFPS-0.05刺激的DCs與人乳頭瘤病毒(HPV)多肽孵育后(HPV+PFPS+DCs)抑制了腫瘤的生長(zhǎng)
為了檢測(cè)PFPS-0.05刺激DC的抗腫瘤效果,我們用TC-1細(xì)胞建立了小鼠腫瘤模型。腫瘤模型建立后,治療分為早期治療及晚期治療,早期治療組在第5天及第12天注射HPV+PFPS+DCs(HPV+PFPS+DCs early),晚期治療組在第12天及第19天注射HPV+PFPS+DCs(HPV+PFPS+DCs late)。對(duì)照組分別為在第5天及第12天注射PFPS+DCs,或不治療組。每組8只小鼠,每隔一天測(cè)量一次腫瘤大小。對(duì)照組在27天時(shí)死了一只小鼠,腫瘤體積為3097 mm3,PFPS+DCs組在17天時(shí)死了一只小鼠,腫瘤體積為242 mm3,HPV+PFPS+DCs late組在31天時(shí)死了一只小鼠,腫瘤體積為1742 mm3,而HPV+PFPS+DCs early組所有小鼠均存活到了實(shí)驗(yàn)結(jié)束。如圖6A所示,與對(duì)照組相比,早期治療組和晚期治療組均顯著抑制了腫瘤的生長(zhǎng),抑制率分別為93%和62%。實(shí)驗(yàn)結(jié)束后,處死腫瘤小鼠,分離腫瘤,拍照并稱重。如圖6B所示,早期治療組和晚期治療組的腫瘤顯著小于對(duì)照組,腫瘤重量也顯著低于對(duì)照組。
HPV+PFPS+DCs改變了T細(xì)胞的數(shù)量及活性狀態(tài),誘導(dǎo)產(chǎn)生了HPV特異性的細(xì)胞免疫反應(yīng),并且降低了骨髓來源的抑制性細(xì)胞(MDSCs)的比例
采用流式細(xì)胞術(shù),檢測(cè)了腫瘤小鼠脾臟中T細(xì)胞的數(shù)量及活性狀態(tài),HPV特異性的細(xì)胞免疫反應(yīng)及MDSCs的比例。如圖7A&B所示,與對(duì)照組相比,早期治療組和晚期治療組小鼠脾臟中CD4+和CD8+ T細(xì)胞的比例顯著上升。以CD44和CD62L為標(biāo)志物,檢測(cè)T細(xì)胞活性狀態(tài)。與對(duì)照組相比,HPV+PFPS+DCs early組CD4+ Tem(效應(yīng)記憶細(xì)胞),CD8+ Tem和Tcm(中央記憶細(xì)胞)細(xì)胞的比例顯著上升。進(jìn)而發(fā)現(xiàn),CD4+和CD8+ Tem細(xì)胞的比例與腫瘤體積呈顯著負(fù)相關(guān)性(圖7C)。
我們接下來檢測(cè)了HPV特異性的細(xì)胞免疫反應(yīng),HPV+PFPS+DCs early及l(fā)ate在一定程度上增加了CD4+ T細(xì)胞反應(yīng),但顯著增加了CD8+ T細(xì)胞反應(yīng)(圖8A),并與腫瘤體積呈顯著負(fù)相關(guān)性(圖8B)。與對(duì)照組相比,HPV+PFPS+DCs early顯著降低了MDSCs的比例,但沒有改變巨噬細(xì)胞的比例(圖8C)。我們也觀察到MDSCs的比例與腫瘤體積呈顯著正相關(guān)性(圖8D)。結(jié)果顯示,HPV+PFPS+DCs增強(qiáng)了T細(xì)胞的活性狀態(tài),誘導(dǎo)產(chǎn)生了HPV特異性的細(xì)胞免疫反應(yīng),降低了MDSCs的比例,從而抑制了腫瘤的生長(zhǎng)。
最后應(yīng)說明的是:以上所述僅為本發(fā)明的優(yōu)選實(shí)施例而已,并不用于限制本發(fā)明,盡管參照前述實(shí)施例對(duì)本發(fā)明進(jìn)行了詳細(xì)的說明,對(duì)于本領(lǐng)域的技術(shù)人員來說,其依然可以對(duì)前述各實(shí)施例所記載的技術(shù)方案進(jìn)行修改,或者對(duì)其中部分技術(shù)特征進(jìn)行等同替換。凡在本發(fā)明的精神和原則之內(nèi),所作的任何修改、等同替換、改進(jìn)等,均應(yīng)包含在本發(fā)明的保護(hù)范圍之內(nèi)。
- 還沒有人留言評(píng)論。精彩留言會(huì)獲得點(diǎn)贊!
- 一種抗原致敏的樹突狀細(xì)胞的制備方法
- 一種可提高過繼性樹突狀細(xì)胞功能化過程的促進(jìn)劑及其制備方法與應(yīng)用
- 一種樹突狀細(xì)胞疫苗及其制備方法與應(yīng)用
- 一種人樹突狀細(xì)胞成熟和功能的特異性生物標(biāo)志物的制作方法
- 基于dc細(xì)胞的hpv病毒疫苗的制備方法
- 一種抗原特異性t淋巴細(xì)胞的分離和高效擴(kuò)增培養(yǎng)方法
- 樹突狀細(xì)胞抗原負(fù)載方法
- 一種樹突狀細(xì)胞腫瘤疫苗及其制備方法
- 一種無細(xì)胞百日破聯(lián)合疫苗及其制備方法
- 一種修飾樹突細(xì)胞以增強(qiáng)對(duì)抗原應(yīng)答反應(yīng)的方法