一種多西他賽聚合物納米膠束注射劑、其制備方法及其在制備治療腫瘤藥物中的應用與流程
本發明屬于藥物制劑領域,涉及一種多西他賽聚合物納米膠束注射劑、制備方法及其在治療腫瘤的藥物中的用途。
背景技術:
多西他賽(docetaxel)為第二代半合成紫杉醇衍生物,采用正丁醇基替代紫杉醇上的苯基,藥物作用機制是促進微管蛋白聚合并抑制微管解聚作用,形成穩定無功能性微管束,從而破壞腫瘤細胞有絲分裂,抑制腫瘤細胞生長。多西他賽對微管的親和力是紫杉醇的2倍,所以藥理作用和活性比紫杉醇強。多西他賽在體外細胞試驗中表現出高于紫杉醇2-10倍的抗癌活性,對非小細胞性肺癌,卵巢癌,前列腺癌,晚期乳腺癌、肝癌和胃癌等均有治療效果。
多西他賽和紫杉醇類似,屬于水中難溶藥物,水溶性差(約10~20μm),目前市售的多西他賽注射劑采用增溶劑吐溫-80,并用13%乙醇為稀釋液。多西他賽毒副作用包括神經毒性、骨骼毒性和嗜中性白細胞減少等,同時制劑中的增溶劑會產生嚴重的體液縮留和過敏反應等。除了溶解度問題以外,多藥耐藥性也是另一個限制紫杉醇類藥物臨床使用的重要因素。所以目前相關的給藥系統研究致力于提高多西他賽的溶解度,以新的無毒副作用的遞送介質取代現在的吐溫增溶劑,并試圖克服多藥耐藥性以及增加多西他賽在腫瘤部位的分布和濃度,并減少多西他賽在正常組織的分布,降低毒性。
國內外研究人員已針對多西他賽的衍生物及新制劑做了很多研究,比如高分子偶聯物(高分子如hpma、pluronic等);脂質體納米粒;和嵌段聚合物膠束等,以增加水溶性,雖然制劑方面取得很大進展,但目前能工業化生產和符合安全性評價的品種不多見。目前雖然脂質體紫杉醇制劑已經上市,但脂質體多西他賽產品正在臨床階段。另外白蛋白多西他賽制劑正處于臨床研究中,然而白蛋白制劑的成本較高。嵌段聚合物膠束在、上市的報道。
相比之下納米膠束制劑近二十年成為研究熱點。它可提高藥物的溶解度,控制藥物釋放,可通過epr效應被動靶向到腫瘤部位,也可以在膠束表面進行修飾以達到主動靶向作用。目前的納米膠束制劑主要是使用兩親性聚合物,載藥量比較高,穩定性好。兩親性聚合物為嵌段共聚物,包括親水嵌段和親脂嵌段,形成的納米膠束為殼核結構,親水嵌段為表面的殼,可以分散于水和生理鹽水中,親脂嵌段則形成膠束的核,用于裝載疏水性藥物。目前最常用的親水嵌段為聚乙二醇(peg),水溶性好,毒性低。然而25%的患者體內已經存在抗peg抗體(由于洗發水等其他日化產品以及有些食品中含大量的peg所致),并且在多次給藥后可能會產生抗peg抗體,從而限制了peg類聚合物膠束的臨床應用。兩性聚合物中親脂嵌段多為fda批準的藥品和醫用材料中廣泛使用的聚合物(如聚乳酸-羥乙基酸plga,聚乳酸pla等)。
技術實現要素:
本發明的目的是克服現有技術的不足,提供一種一種多西他賽聚合物納米膠束注射劑。
本發明涉及的兩親性聚合物采用了聚(2-甲基-2-噁唑啉)或聚(2-乙基-2-噁唑啉)作為親水嵌段以取代peg,用pla作為親脂嵌段,將聚合物納米膠束用作多西他賽的載體,為臨床提供一種穩定的多西他賽聚合物納米膠束注射劑,能大大增加多西他賽的水溶性和制劑的穩定性,延長多西他賽在血液中的循環時間,消除現有制劑中的增溶劑毒副作用,并通過epr效應被動靶向到腫瘤部位,從而提高多西他賽的抗腫瘤療效,并可以克服抗peg抗體和多次給藥后產生抗體等問題,意義重大。
本發明的技術方案如下:
一種多西他賽聚合物納米膠束注射劑,所述制劑中包含多西他賽1重量份;納米膠束聚合物10~100重量份。優選地,所述制劑中包含多西他賽1重量份;納米膠束聚合物10重量份。
所述的納米膠束聚合物為聚(2-乙基-2-噁唑啉)-聚乳酸,即peoz-pla,或者聚(2-甲基-2-噁唑啉)-聚乳酸,即pmoz-pla。
所述聚(2-乙基-2-噁唑啉)peoz或者聚(2-甲基-2-噁唑啉)pmoz的聚合度為20~60個單位,平均分子量在1700至5100da。優選地,所述聚(2-乙基-2-噁唑啉)peoz或者聚(2-甲基-2-噁唑啉)pmoz的聚合度為50個單位,平均分子量在4400da。
所述聚乳酸pla的聚合度為30~115個單位,平均分子量在850至3300da。優選地,所述聚乳酸pla的聚合度為115個單位,平均分子量在3300da。
所述多西他賽聚合物納米膠束注射劑的平均粒徑為20~200nm。優選地,所述多西他賽聚合物納米膠束注射劑的平均粒徑為30~100nm。最優選地,所述多西他賽聚合物納米膠束注射劑的平均粒徑為35nm。
所述的多西他賽聚合物納米膠束注射劑的制備方法,包括如下步驟:
1)將多西他賽和納米膠束聚合物分別溶于乙醇或乙腈,配成10mg/ml的儲備液,然后按照處方量取多西他賽和納米膠束聚合物儲備液混合,振蕩混勻;
2)將得到的多西他賽和納米膠束聚合物混合有機相注入到圓底燒瓶或其它樣品瓶中,在稍許加熱過程中,減壓或常壓下將有機溶劑緩慢揮發至完全干,在瓶底形成藥物和納米膠束聚合物材料混合薄層膜;
3)升溫至35~50攝氏度(優選45攝氏度),加入蒸餾水或者注射用水,輕微振蕩至薄層膜完全溶解成澄清溶液;
4)將澄清溶液放置冷卻至室溫,7000rpm離心5分鐘,將未裝載在膠束內的多西他賽離心沉淀除去,取上清液冷凍干燥得所述多西他賽聚合物納米膠束注射劑凍干粉。
優選地,所述的制備步驟4)中,冷凍干燥時加入保護劑,所述的凍干保護劑選自甘露醇、蔗糖、乳糖、海藻糖、麥芽糖和葡萄糖中的任一種或其混合物,所述的凍干保護劑的用量為5-20克/100毫升多西他賽聚合物納米膠束。加入凍干保護劑可以增加多西他賽聚合物膠束注射劑的穩定性,延長其有效期。
所述的多西他賽聚合物納米膠束注射劑在制備治療腫瘤藥物中的應用,所述腫瘤為非小細胞性肺癌、乳腺癌、卵巢癌、前列腺癌、肝癌或胃癌。
本發明具有如下技術效果:
本發明提供的多西他賽聚合物納米膠束的制備方法簡單,易于操作,重復性好,可實現工業化規模生產。
本發明提供了一種所述多西他賽聚合物納米膠束注射劑,在治療腫瘤、有抗peg抗體的患者以及多次給藥后產生peg抗體的患者中的用途,其中,優選地,所述腫瘤為非小細胞性肺癌、乳腺癌、卵巢癌、前列腺癌、肝癌與胃癌等。
相比于現有多西他賽注射劑,本發明提供的多西他賽聚合物納米膠束具有以下優勢:
1.所述聚合物材料生物相容性好,安全性高,不會產生現有制劑中使用吐溫-80作增溶劑帶來的過敏反應、體液縮留等毒副作用。
2.本發明將多西他賽包載于聚合物納米膠束中,提高了多西他賽的水溶性和穩定性,延長其有效期。
3.本發明提供的多西他賽聚合物納米膠束粒徑較小,能有效穿透腫瘤血管,通過epr效應聚集在腫瘤部位,實現被動靶向作用,從而提高藥物的治療效果。
4.本發明提供的多西他賽聚合物納米膠束注射劑能大大延長多西他賽在血液中的循環時間,改善多西他賽的組織分布及藥動學特征,大大提高多西他賽的抗腫瘤療效,降低其毒性。
5.本發明提供的多西他賽聚合物納米膠束注射劑涉及的兩親性聚合物中采用了聚(2-甲基-2-噁唑啉)或聚(2-乙基-2-噁唑啉)作為親水嵌段以取代peg,其親水性和peg相當,并和peg有類似的“隱形”作用,作為膠束的殼層,既可以保護膠束的內核和所載的藥物,又可以防止被單核巨噬細胞的吞噬。
6.本發明提供的多西他賽聚合物納米膠束注射劑可克服聚乙二醇(peg)作為殼層的聚合物納米膠束類制劑不適用的情況(例如治療對peg有抗體的患者或者多次給藥產生抗peg抗體的患者)。
7.本發明提供的多西他賽聚合物納米膠束注射劑的制備方法采用制備方法簡便易行,材料來源廣泛,產品質量穩定,便于實現工業化生產。并且相比于處于臨床研究中的白蛋白多西他賽注射劑中使用的藥物載體(即白蛋白),成本顯著降低。
附圖說明
圖1為本發明實施例中制備的多西他賽聚合物納米膠束掃描電鏡圖。
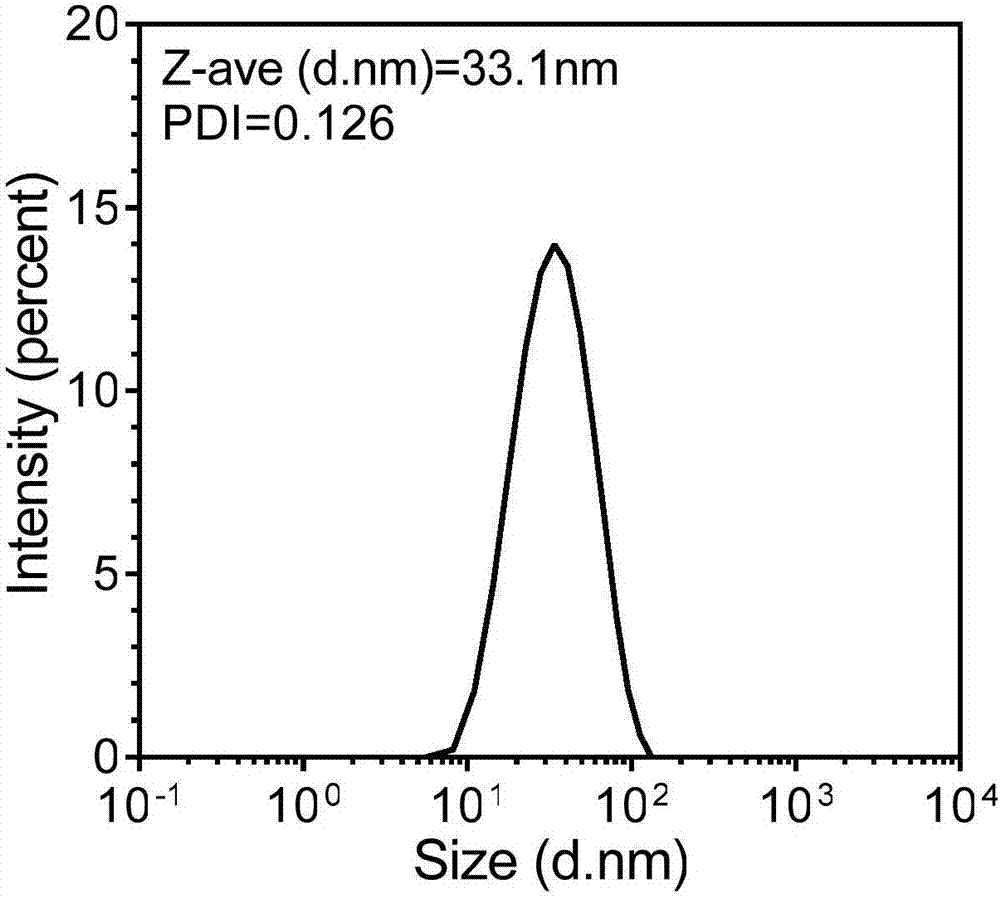
圖2為本發明實施例中制備的多西他賽聚合物納米膠束注射劑凍干粉再分散液的粒徑分布圖。
圖3為本發明實施例中制備的多西他賽聚合物納米膠束注射劑凍干粉再分散液體外釋放曲線圖。
圖4為本發明實施例中制備的多西他賽聚合物納米膠束注射劑在裸鼠中的最大耐受劑量mtd(50mg/kg)。
圖5為根據本發明實施例中制備的多西他賽聚合物納米膠束注射劑凍干粉再分散液在小鼠腫瘤模型中的藥效圖。
具體實施方式
下面結合實施例對本發明進一步說明,但該實施例并不意味著對本發明加以任何限制。
實施例1
本發明中,多西他賽聚合物納米膠束的制備,包括如下步驟:
1)稱取多西他賽10mg加入1ml無水己醇超聲溶解;稱取pmoz-pla聚合物100mg加入10ml無水乙醇超聲溶解;將多西他賽和pmoz-pla聚合物混合。pmoz的聚合度為50個單位,平均分子量在4400da。聚乳酸pla的聚合度為115個單位,平均分子量在3300da。
2)將混合液加入50毫升圓底燒瓶,在40攝氏度下減壓緩慢將溶劑揮發,并抽真空以除去溶劑殘留,在圓底燒瓶底部形成薄層膜(藥物+pmoz-pla聚合物)。
3)在45攝氏度情況下,加入蒸餾水10毫升,輕微振蕩至薄層膜完全溶解成澄清溶液;
4)將澄清溶液放置冷卻至室溫,7000rpm離心5分鐘,將未裝載在膠束內的多西他賽離心沉淀除去,取上清液冷凍干燥得所述多西他賽聚合物納米膠束注射劑凍干粉。
取實施例制得的多西他賽聚合物納米膠束凍干粉進行包封率的測定。
色譜條件:色譜柱nucleosilc18(4.6mmx250mm,5μm);流動相為乙腈-水=55:45;流速1ml/min;檢測波長227nm;進樣量20μ1。
取實施例制得的多西他賽聚合物納米膠束凍干粉,加入蒸餾水再分散成大約1毫克每毫升的多西他賽濃度,取分散液20微升,加入180微升乙腈,振蕩充分溶解,然后離心,取上清液20μ1于hplc進樣。另取取標準多西他賽儲備液,配成濃度為10,20,50,100,和200微克/毫升乙腈標準溶液,分別取20μ1于hplc進樣,對各濃度下所得峰面積進行曲線回歸的標準曲線。通過標準曲線以及納米膠束凍干粉再分散液中的多西他賽藥物濃度,計算得多西他賽聚合物納米膠束的包封率為91.5%。
取實施例制得的多西他賽聚合物納米膠束凍干粉,加入蒸餾水再分散成大約0.1毫克每毫升的多西他賽濃度,將一滴再稀釋500倍的多西他賽聚合物納米膠束凍干粉再分散液滴在銅網/碳膜上,放置5分鐘,去除多余的分散液,加上染劑1%乙酸鈾酰10秒鐘,于leoem910透射電鏡在80kv下檢測納米膠束的形態(見圖1)。電鏡結果顯示納米膠束為均一的球形結構,粒徑約30nm。將0.1毫克每毫升多西他賽聚合物納米膠束凍干粉再分散液于馬爾文納米粒徑儀中測定膠束的粒徑,獲得的平均粒徑在35nm,分散度為pdi=0.12(見圖2)。
精密移取實施例中制備的多西他賽聚合物納米膠束凍干粉的再分散液0.1ml,放入透析裝置中(截留分子量為3500),放入燒杯中,釋放介質為1oomlpbs緩沖液;設置溫度為37攝氏度,水平緩慢振蕩,于0.5、1、2、4、6、8、12小時后取樣,用hplc分別測量透析裝置中的未釋放藥物濃度多西他賽的濃度,計算藥物的累計釋放率和時間做出體外釋藥曲線,見圖3。
取6-8周雌性裸鼠,在小鼠皮下或者乳腺脂肪墊處注射5-8x106個卵巢癌a2780細胞(細胞分散于50%的培養基和50%的基質膠內)或者乳腺癌mda-mb-435細胞。當腫瘤體積約為200立方毫米時,將小鼠隨機分配到各治療組中并進行尾靜脈注射給藥,給藥方案為每四天注射一次,總共四次給藥。治療組包括生理鹽水空白對照組,多西他賽聚合物納米膠束和市售的多西他賽注射液。用卡尺測量各裸鼠腫瘤的長徑(a)及短徑(b),按(axb2)/2公式計算腫瘤體積。
由圖4可以看出,本發明實施例中制備的多西他賽聚合物納米膠束在裸鼠中的最大耐受劑量mtd為50mg/kg,是多西他賽市售制劑(mtd為20mg/kg)的2.5倍。
由圖5可以看出,多西他賽市售制劑及本發明實施例中制備的多西他賽聚合物納米膠束對裸鼠mda-mb-435乳腺癌模型中的腫瘤均有較好的抑制作用,兩組制劑腫瘤體積與對照組相比均顯著降低,同劑量的聚合物納米膠束組較市售制劑組具有更好的抑瘤效果(p<0.05)。
- 還沒有人留言評論。精彩留言會獲得點贊!