一種攜載抗腫瘤藥物連接CD22單抗靶向淋巴瘤的血小板靶向載藥體系的制備方法與流程
本發(fā)明屬于生物藥物載體制備領(lǐng)域,尤其涉及一種以連接cd22單抗靶向淋巴瘤細(xì)胞的血小板作為靶向藥物載體攜載抗腫瘤藥物的制備方法。
背景技術(shù):
惡性淋巴瘤是一組原發(fā)于淋巴組織的惡性腫瘤,按病理和臨床特點(diǎn)可分為兩大類:霍奇金淋巴瘤(hl)和非霍奇金淋巴瘤(nhl),后者占90%以上。nhl發(fā)病率近年來(lái)急劇增加,其中,b細(xì)胞淋巴瘤是與惡性b細(xì)胞單克隆擴(kuò)增相關(guān)的一組異質(zhì)性腫瘤,約占成人nhl的85%。高度異質(zhì)性血液惡性腫瘤的b細(xì)胞淋巴瘤表現(xiàn)出不同的臨床和生物學(xué)特征。盡管治療反應(yīng)有所進(jìn)展,但高水平b細(xì)胞nhl的5年生存率低于50%,化療依然是b細(xì)胞淋巴瘤的一線治療。但是化療具有明顯的副作用,包括骨髓抑制、免疫功能低下、消化道反應(yīng)等,提高藥物的靶向性、降低治療的毒副作用成為目前淋巴瘤診治的挑戰(zhàn),所以研究和開發(fā)能將抗淋巴瘤藥物靶向傳遞到腫瘤細(xì)胞內(nèi)部或周圍以期較少副反應(yīng)的藥物載體具有十分重要的意義。
目前而言,藥物載體主要包括磁性納米藥物載體、脂質(zhì)體載體、微粒載體等,但它們均存在諸多缺點(diǎn),如載藥率不高,穩(wěn)定性較差,毒性作用較強(qiáng)等,因而生物藥物載體憑借其良好的生物相容性、緩控釋藥等特點(diǎn)在眾多載藥體系中脫穎而出。
以生物作為藥物載體的研究已進(jìn)行了很多年,研究較為深入的包括白蛋白載藥和紅細(xì)胞載藥等。臨床上應(yīng)用成功的典型范例是以人血清白蛋白為載體的紫杉醇產(chǎn)品,研究顯示其可在腫瘤細(xì)胞和組織中蓄積,可用于治療乳腺癌、卵巢癌等。另外的研究顯示,經(jīng)紅細(xì)胞包載后釋放的甲氨蝶呤和長(zhǎng)春新堿等藥物,抑制腫瘤生長(zhǎng)及誘導(dǎo)其凋亡的效果較裸藥更為顯著。
血小板是從骨髓成熟的巨核細(xì)胞脫落下來(lái)的碎片,直徑約2um,在成人血液中數(shù)量約為(1-3)×1011個(gè)/l,其壽命約7-14天,平均9天,衰老的血小板大多被肝臟中的kupfer細(xì)胞清除,因而血小板具有良好的生物相容性、安全性及較長(zhǎng)的血循環(huán)時(shí)間。血小板在止血、愈合傷口、血栓形成等過程中起著重要作用,并且與腫瘤的發(fā)生發(fā)展也具有密切的關(guān)系。腫瘤細(xì)胞經(jīng)過一系列反應(yīng)活化血小板,活化的血小板通過腫瘤細(xì)胞誘導(dǎo)的血小板聚集(tcipa)作用聚集在腫瘤細(xì)胞周圍,形成血小板-腫瘤細(xì)胞復(fù)合物,正是這種作用促進(jìn)了血小板與腫瘤細(xì)胞的粘附,并且活化后的血小板將攝取的藥物釋放,而血小板攝取藥物及小顆粒的作用與巨噬系統(tǒng)的吞噬作用不同,即不會(huì)將內(nèi)吞的物質(zhì)殺死和清除,從而保證了藥物原有的結(jié)構(gòu)和活性,保留了藥效。另外研究顯示,血小板的載藥率遠(yuǎn)高于納米顆粒的載藥率,且血小板與細(xì)胞毒藥物具有協(xié)同作用,可以增加其殺傷作用。
然而血小板的特異性和精確靶向的挑戰(zhàn)限制了它們作為藥物載體的功效。相比之下,單克隆抗體(mab)是高度特異性和精確的靶向系統(tǒng)。結(jié)合了藥物的腫瘤特異性抗體可以將藥物引導(dǎo)到腫瘤細(xì)胞,證明其可能用于靶向藥物遞送。由于90%以上的b細(xì)胞淋巴瘤細(xì)胞上有cd22抗原表達(dá),且cd22抗原的表達(dá)率為80%-100%,遠(yuǎn)高于正常成熟b淋巴細(xì)胞,并且結(jié)合cd22的抗體可以被迅速內(nèi)化,cd22作為化學(xué)免疫偶聯(lián)物也因此引起了特別注意,被用于將細(xì)胞毒性藥物靶向遞送至腫瘤細(xì)胞。
因此,在這項(xiàng)工作中,我們建議使用連接cd22單抗的血小板作為治療b細(xì)胞淋巴瘤的新型藥物靶向遞送系統(tǒng),其具有含量豐富、生物相容性好、載藥率高、主動(dòng)靶向性好、對(duì)腫瘤細(xì)胞療效高而對(duì)正常組織損害小的優(yōu)勢(shì),這方面目前還沒有相關(guān)的研究報(bào)導(dǎo)。
技術(shù)實(shí)現(xiàn)要素:
為克服現(xiàn)有技術(shù)的不足,本發(fā)明的目的在于提供一種以連接cd22單抗的血小板作為藥物載體包載抗腫瘤藥物的制備方法,制成攜載抗腫瘤藥物連接cd22單抗的血小板靶向載藥體系,具有生物相容性好、載藥率高、主動(dòng)靶向性強(qiáng)、在腫瘤組織的酸性環(huán)境中釋放率高,從而增加藥物的抗腫瘤活性等優(yōu)點(diǎn)。
為達(dá)到上述目的,本發(fā)明是通過以下的技術(shù)方案來(lái)實(shí)現(xiàn)的。
一種攜載抗腫瘤藥物連接cd22單抗靶向淋巴瘤的血小板靶向載藥體系的制備方法,包括以下步驟:
(1)環(huán)境溫度為20±5℃,在全血中加入重量百分含量為2-4%檸檬酸鈉溶液,離心后得到血小板豐富血漿;
(2)將步驟(1)得到的血小板豐富血漿再深度離心,并用pbs緩沖液洗滌至不再含有血漿及其他血液成分,得到洗滌血小板;
(3)將步驟(2)得到的洗滌血小板與3-馬來(lái)酰亞胺基苯甲酸-n-羥基琥珀酰亞胺酯試劑(mbs)試劑在37±0.5℃的避光環(huán)境中震蕩反應(yīng)1~2小時(shí),離心洗滌,得到表面修飾(馬來(lái)酰亞胺基團(tuán))指向巰基的血小板。
(4)將抗cd22單抗與traut’s試劑在37±0.5℃的避光環(huán)境中震蕩反應(yīng)1~2小時(shí),然后超濾離心,得到富含巰基的抗cd22單抗。
(5)將步驟(3)得到的表面修飾為指向巰基的馬來(lái)酰亞胺基團(tuán)的血小板與步驟(4)得到的富含巰基的抗cd22單抗混合,在37±0.5℃的避光環(huán)境中震蕩反應(yīng)8~12小時(shí),經(jīng)離心洗滌,得到連接cd22單抗的血小板。
(6)將步驟(5)得到的連接cd22單抗的血小板與抗腫瘤藥物在37±0.5℃的避光環(huán)境中震蕩反應(yīng)1~2小時(shí),得到抗腫瘤藥物與連接cd22單抗的血小板反應(yīng)物。
(7)將步驟(6)得到的抗腫瘤藥物與連接cd22單抗的血小板反應(yīng)物通過瓊脂糖凝膠2b分離柱分離,并離心洗滌,得到攜載抗腫瘤藥物連結(jié)cd22單抗的血小板靶向載藥體系。
所述步驟(1)中,全血與重量百分含量為2-4%檸檬酸鈉溶液的體積比為7:1~10:1,優(yōu)選為9:1。
所述步驟(1)中離心為以1200rpm離心5~10min。
所述步驟(2)中深度離心為以3600rpm離心8~12min。
所述步驟(2)得到洗滌血小板計(jì)數(shù)控制在(2.5-3.0)×105/ul。
所述步驟(3)中洗滌血小板與mbs試劑體積比為50:1。
所述步驟(3)中離心洗滌是用pbs緩沖液以3600rpm離心洗滌2~3次,每次5~8分鐘。
所述步驟(4)中抗cd22單抗?jié)舛葹?mg/ml。
所述步驟(4)中抗cd22單抗與traut’s試劑的濃度比為50:1。
所述步驟(4)中超濾離心是于超濾離心管中3300rpm離心過濾20~30min。
所述步驟(5)中離心洗滌是用pbs緩沖液以3600rpm離心洗滌2~3次,每次5~8min。
所述步驟(6)中抗腫瘤藥物為蒽環(huán)類抗腫瘤藥物或烷化劑類抗腫瘤藥物的一種,抗腫瘤藥物的濃度為0.05~0.15mmol/l。
所述蒽環(huán)類抗腫瘤藥物優(yōu)選柔紅霉素,烷化劑類抗腫瘤藥物優(yōu)選環(huán)磷酰胺。
所述步驟(6)中抗腫瘤藥物與洗滌血小板的體積比為1~4:1,優(yōu)選為2:1。
所述步驟(7)中離心洗滌是用pbs緩沖液以3600rpm離心洗滌2~3次,每次5~8min。
有益效果:與現(xiàn)有技術(shù)相比,本發(fā)明的優(yōu)點(diǎn)在于:
(1)本發(fā)明將連接cd22單抗的血小板作為靶向生物載藥系統(tǒng),包載某些常見抗腫瘤藥物應(yīng)用于淋巴瘤的化學(xué)治療中。血小板作為機(jī)體的一部分,具有良好的生物相容性,包載藥物后不會(huì)引起免疫排斥反應(yīng),避免了作為外來(lái)物的納米載藥系統(tǒng)存在的排斥反應(yīng)問題,可使攜載的化療藥物血循環(huán)時(shí)間延長(zhǎng);同時(shí)血小板的含量豐富,其裝載藥物的量遠(yuǎn)遠(yuǎn)高于納米載體。
(2)通過將化療藥物包載于連接cd22單抗的血小板中,由于cd22單抗有主動(dòng)靶向遞送作用,實(shí)現(xiàn)了將藥物選擇性釋放于特定部位的目的,提高了藥物對(duì)腫瘤組織的靶向性,從而增加了藥物對(duì)腫瘤組織的療效而減少了其對(duì)正常組織的損害,同時(shí)以較少的藥物劑量即可達(dá)到相同的抗腫瘤作用,有效的減輕了藥物副作用。這些都對(duì)提高患者生活質(zhì)量和醫(yī)療質(zhì)量具有重要意義,并且具有一定的社會(huì)和經(jīng)濟(jì)效益,具有廣闊的應(yīng)用前景。
附圖說明
圖1為本發(fā)明制備的攜載柔紅霉素連接cd22單抗的血小板靶向載藥體系的蛋白電泳考馬斯亮藍(lán)染色結(jié)果;其中第一泳道為單純的血小板,第二泳道為攜載柔紅霉素的血小板,第三泳道為攜載柔紅霉素連接cd22單抗的血小板,第四泳道為單純的抗cd22單抗。
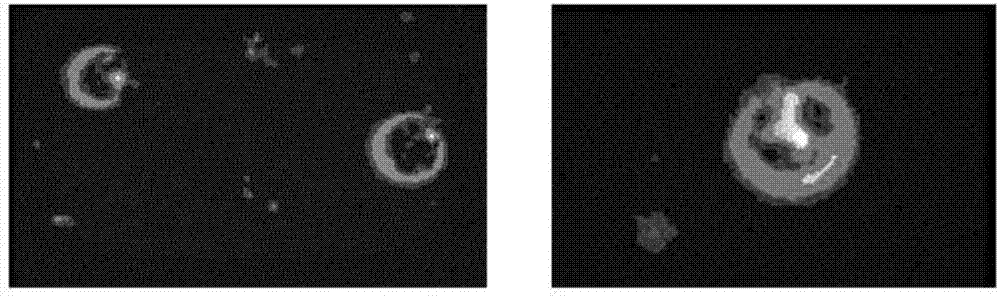
圖2為本發(fā)明制備的攜載柔紅霉素連接cd22單抗的血小板靶向載藥體系的熒光顯微鏡圖像;其中左圖為單純的血小板、右圖為連接cd22單抗的血小板攜載了柔紅霉素。
圖3為單獨(dú)血小板和連接cd22單抗的血小板攜載柔紅霉素后的掃描電鏡圖像;其中左圖為單純的血小板、右圖為連接cd22單抗的血小板攜載了柔紅霉素。
圖4為連接cd22單抗的血小板載柔紅霉素的藥物體外釋放曲線。
具體實(shí)施方式
下面結(jié)合附圖對(duì)本發(fā)明作進(jìn)一步的詳細(xì)說明。
實(shí)施例1
一種攜載柔紅霉素連接cd22單抗的血小板靶向載藥體系的制備方法,該方法包括如下步驟:
第一步:在環(huán)境溫度為20±5℃的室溫條件下,在取得的全血中加入重量百分比為3.2%檸檬酸鈉溶液抗凝,全血與檸檬酸鈉溶液的體積比為9:1,1200rpm離心5min后得到血小板豐富血漿;
第二步:血小板豐富血漿以3600rpm離心10min,并用pbs緩沖液洗滌三次,使其不再含有血漿及其他血液成分,棄去上清,得到洗滌血小板,控制血小板計(jì)數(shù)為(2.5-3.0)×105/ul。
第三步:將洗滌血小板500μl的重懸液與10μlmbs試劑在37±0.5℃的避光環(huán)境中震蕩反應(yīng)1小時(shí),3600rpm離心洗滌3次,每次8分鐘,得到表面修飾(馬來(lái)酰亞胺基團(tuán))指向巰基的血小板;將抗cd22單抗與traut’s試劑以濃度比50:1混合,在37±0.5℃的避光環(huán)境中震蕩反應(yīng)1小時(shí),然后3300rpm超濾離心20min,得到抗富含巰基的cd22單抗。
第四步:將表面修飾(馬來(lái)酰亞胺基團(tuán))指向巰基的血小板與富含巰基的抗cd22單抗混合,在37±0.5℃的避光環(huán)境中震蕩反應(yīng)8小時(shí),并以3600rpm,8min離心洗滌3次,得到連接cd22單抗具有靶向淋巴瘤細(xì)胞功能的血小板。
第五步:將0.1mmol/l的柔紅霉素與制得的連結(jié)cd22單抗的血小板混合,柔紅霉素與血小板的體積比為2:1,輕輕將其吹打至混合均勻。將混合物在37±0.5℃的避光環(huán)境中以100rpm震蕩反應(yīng)1小時(shí),然后通過瓊脂糖凝膠2b分離柱分離,再用pbs緩沖液以3600rmp離心洗滌3次,每次8分鐘,即得到新型攜載柔紅霉素連接cd22單抗的血小板靶向載藥體系。
采用上述方法制備出的攜載柔紅霉素的血小板靶向載藥體系,通過蛋白電泳考馬斯亮藍(lán)染色、熒光顯微鏡和掃描電鏡進(jìn)行表征,結(jié)果表明抗cd22單抗成功連接于血小板上、柔紅霉素可被包載于血小板內(nèi)且未影響血小板的形態(tài),如圖1、圖2、圖3所示。采用高效液相色譜法計(jì)算得到其包封率和包載率分別為61.3%和83.4%,表明藥物的包封率及包載率均較高。通過觀察不同ph環(huán)境中藥物的釋放率,證明酸性環(huán)境中藥物的釋放率明顯增加如圖4所示,表明血小板載藥體系可減少細(xì)胞毒藥物在正常細(xì)胞、組織的釋放,從而降低化療藥物的毒副作用。
下面通過試驗(yàn)對(duì)本實(shí)施例的有益效果作進(jìn)一步的詳細(xì)說明。
1、蛋白電泳考馬斯亮藍(lán)染色結(jié)果證明了抗cd22單抗成功連接于血小板載藥體系,如圖1所示。由于柔紅霉素具有自發(fā)熒光性,通過熒光顯微鏡觀察靶向血小板載藥體系,可見藥物被包載于血小板內(nèi)如圖2所示,通過高效液相色譜法定量計(jì)算其載藥率和包封率,分別為46.3%和86.6%,表明靶向血小板載藥體系對(duì)蒽環(huán)類抗腫瘤藥物具有較高的包載及包封率。通過掃描電鏡,發(fā)現(xiàn)載藥后的血小板形態(tài)與單純的血小板形態(tài)相似,無(wú)明顯改變?nèi)鐖D3所示,說明藥物不會(huì)對(duì)血小板造成明顯影響,另外通過cck-8法檢測(cè)到單純的血小板對(duì)腫瘤細(xì)胞無(wú)明顯影響,提示血小板可作為安全、高效的藥物載體。
2、本發(fā)明制備的攜載柔紅霉素連接cd22單抗的血小板靶向載體,藥物釋放曲線結(jié)果顯示由靶向血小板包載的藥物在腫瘤組織的酸性環(huán)境中釋放較多且具有緩釋作用,而在中性和堿性環(huán)境中的釋放明顯減少如圖4所示,因此降低了化療藥物對(duì)機(jī)體的毒副作用,并延長(zhǎng)了藥物在體內(nèi)的半衰期。
3、cck-8實(shí)驗(yàn)結(jié)果顯示:與裸藥相比,攜載柔紅霉素的血小板載藥體系和攜載柔紅霉素連接cd22單抗的血小板靶向載藥體系體外作用于人類淋巴瘤細(xì)胞株raji細(xì)胞株后,對(duì)細(xì)胞生長(zhǎng)的抑制作用更加明顯;并且后者抑制效果更顯著。
4、通過流式細(xì)胞術(shù)和dapi染色,發(fā)現(xiàn)與裸藥相比,攜載柔紅霉素的血小板載藥體系和攜載柔紅霉素連接cd22單抗的血小板靶向載藥體系體可促進(jìn)raji細(xì)胞的凋亡,且后者效果更顯著。并且用流式細(xì)胞術(shù)檢測(cè)到血小板靶向載藥體系顯著增加了腫瘤細(xì)胞內(nèi)的藥物濃度,從某種程度上解釋了由血小板攜載后的柔紅霉素抗腫瘤作用增加的原因。
實(shí)施例2
一種攜載環(huán)磷酰胺連接cd22單抗的血小板載藥體系的制備方法,該方法包括如下步驟:
第一步:在環(huán)境溫度為20±5℃的室溫條件下,在取得的全血中加入重量百分比為4%檸檬酸鈉溶液抗凝,全血與檸檬酸鈉溶液的體積比為10:1,1200rpm離心8min后得到血小板豐富血漿;
第二步:血小板豐富血漿以3600rpm離心12min,并用pbs緩沖液洗滌三次,使其不再含有血漿及其他血液成分,棄去上清,得到洗滌血小板,控制血小板計(jì)數(shù)為(2.5-3.0)×105/ul。
第三步:將洗滌血小板500μl的重懸液與10μlmbs試劑在37±0.5℃的避光環(huán)境中震蕩反應(yīng)1.5小時(shí),3600rpm離心洗滌2次,每次6分鐘,得到表面修飾(馬來(lái)酰亞胺基團(tuán))指向巰基的血小板;將抗cd22單抗與traut’s試劑以濃度比50:1混合,在37±0.5℃的避光環(huán)境中震蕩反應(yīng)1.5小時(shí),然后3300rpm超濾離心30min,得到抗富含巰基的cd22單抗。
第四步:將表面修飾(馬來(lái)酰亞胺基團(tuán))指向巰基的血小板與富含巰基的抗cd22單抗混合,在37±0.5℃的避光環(huán)境中震蕩反應(yīng)12小時(shí),并以3600rpm,6min離心洗滌2次,得到連接cd22單抗具有主動(dòng)靶向淋巴瘤細(xì)胞功能的血小板。
第五步:將0.05mmol/l的環(huán)磷酰胺與制得的連接cd22單抗的血小板混合,環(huán)磷酰胺與血小板的體積比為2:1,輕輕將其吹打至混合均勻。將混合物在37±0.5℃的避光環(huán)境中以100rpm震蕩反應(yīng)1.5小時(shí),然后通過瓊脂糖凝膠2b分離柱分離,再用pbs緩沖液以3600rmp離心洗滌2次,每次6分鐘,即得到新型攜載環(huán)磷酰胺連接cd22單抗的血小板靶向載藥體系。
通過高效液相色譜法定量計(jì)算其包封率和包載率,分別為41.3±3.4%和82.4±2.7%,表明血小板靶向載藥體系對(duì)烷化劑類抗腫瘤藥物具有較高的包封及包載率。
本發(fā)明按照上述實(shí)施例進(jìn)行了說明,應(yīng)當(dāng)理解,上述實(shí)施例不以任何形式限定本發(fā)明,凡采用等同替換或等效變換方式所獲得的技術(shù)方案,均落在本發(fā)明的保護(hù)范圍之內(nèi)。
- 還沒有人留言評(píng)論。精彩留言會(huì)獲得點(diǎn)贊!