用于生產蛋白的細胞培養方法與流程
本發明涉及用于生產糖基化蛋白的單相哺乳動物細胞培養條件。更具體地,它涉及在具有單相溫度條件的哺乳動物細胞培養條件下生產單克隆抗體和融合蛋白。更具體地,本發明涉及在用于生產蛋白(優選糖基化蛋白)的合適的細胞培養條件下培養哺乳動物細胞的方法。更具體地,它還涉及以用于生產糖基化蛋白的特別是維持單相溫度的合適的細胞培養條件下進行的細胞培養方法。
背景技術:
用于生物制藥應用的治療性蛋白的生產通常涉及已知的用于生產高水平糖基化蛋白的哺乳動物細胞培養物的使用。哺乳動物細胞培養條件的控制和優化對于糖基化蛋白的成功商業生產是至關重要的。照慣例,針對很多糖基化蛋白的哺乳動物細胞培養方法是兩相的;區別在于初始的生長期和隨后的生產期。這個雙重生產期提供高的細胞密度和更好的產品滴度(product titer)。
而且,控制和優化細胞培養條件一直是巨大的挑戰,因為這些條件極大地影響細胞存活率、期望的產率、純度和異質性。治療性蛋白分子的物化性質和藥物動力學性質極度地依賴于培養條件。
US7294481公開了用于生產融合蛋白即TNFR:Fc的方法。在生產期期間,在25至34℃的溫度下培養宿主細胞,與在37℃下進行的生產期相比,其顯示出所生產的TNFR:Fc的二硫化物加擾(disulfide scrambling)減少。另外,它公開了在鏈烷酸或其鹽的存在下進行生產期。
可以以很多方式實現生產期的開始,其中溫度和pH變化是最常見的。所使用的其他方法是加入誘導劑、改變進料底物或改變滲透壓。
本發明涉及通過在培養期間維持合適的培養條件的細胞培養方法。特別地,哺乳動物細胞在選自約34℃至約37℃的單一溫度下生長。本發明涉及以分批進料(fed-batch)模式通過在培養期間維持合適的培養條件的細胞培養方法。
技術實現要素:
在一個實施方案中,本發明涉及生產糖基化蛋白的單相哺乳動物細胞培養方法。
在另一個實施方案中,本發明涉及生產糖基化蛋白的單相溫度哺乳動物細胞培養方法。
在另一個實施方案中,本發明涉及生產糖基化蛋白的單相溫度哺乳動物細胞培養方法,其中溫度設定在34℃至37℃之間。
在另一個實施方案中,本發明涉及生產融合蛋白和單克隆抗體的、具有單相溫度條件的哺乳動物細胞培養方法。
在另一個實施方案中,本發明涉及在用于哺乳動物細胞培養的單相溫度下生產糖基化蛋白的方法,其中細胞培養物基本上不含鏈烷酸或其鹽。
在另一個實施方案中,本發明涉及在哺乳動物細胞培養物中生產糖基化蛋白的方法,該方法包括以下步驟:
a)在種子擴大培養(seed development)期間制備具有合適細胞濃度的接種體;
b)將具有合適細胞濃度的接種體接種到生產生物反應器(production bioreactor)中;
c)在合適的條件下將細胞在生產生物反應器中培養,其中合適的條件是單相溫度條件;以及
d)從細胞培養物中獲得糖基化蛋白。
在另一個實施方案中,本發明涉及在哺乳動物細胞培養物中生產糖基化蛋白的方法,該方法包括以下步驟:
a)在種子擴大培養期間制備具有合適細胞濃度的接種體;
b)將具有合適細胞濃度的接種體接種到生產生物反應器中;
c)在合適的條件下將細胞在生產生物反應器中培養,其中合適的條件是單相溫度條件;以及
d)從細胞培養物中獲得糖基化蛋白,
其中在步驟(c)期間單相溫度不具有溫度變化(temperature shift)。
在另一個實施方案中,本發明涉及在哺乳動物細胞培養物中生產糖基化蛋白的方法,該方法包括以下步驟:
a)在種子擴大培養期間制備具有合適細胞濃度的接種體;
b)將具有合適細胞濃度的接種體接種到生產生物反應器中;
c)在合適的條件下將細胞在生產生物反應器中培養,其中合適的條件是單相溫度條件;以及
d)從細胞培養物中獲得糖基化蛋白,
其中在步驟(c)中生產生物反應器不具有任何區分的生長期和生產期。
在另一個實施方案中,本發明涉及用單相溫度條件進行以生產糖基化蛋白的細胞培養方法,其中該溫度維持于在約32℃至約37℃之間的一個設定點。
在另一個實施方案中,本發明涉及用單相溫度條件進行以生產糖基化蛋白的細胞培養方法,其中該溫度維持于在約34℃至約37℃之間的一個設定點。
在某個實施方案中,本發明涉及用單相溫度條件進行以生產糖基化蛋白的細胞培養方法,其中該溫度維持在約33℃。
在某個實施方案中,本發明涉及用單相溫度條件進行以生產糖基化蛋白的細胞培養方法,其中該溫度維持在約34℃。
在某個實施方案中,本發明涉及用單相溫度條件進行以生產糖基化蛋白的細胞培養方法,其中該溫度維持在約35℃。
在某個實施方案中,本發明涉及用單相溫度條件進行以生產糖基化蛋白的細胞培養方法,其中該溫度維持在約36℃。
由本發明的方法生產的融合蛋白和單克隆抗體用于生物制藥應用。
以下闡明的本發明的一個或多個實施方案的細節僅僅是說明性的,并不意欲限制本發明的范圍。本發明的其他的特征、目的和優勢將從該描述中顯而易見。
附圖說明
圖1描繪了在依那西普生產期間所觀察到的CHO細胞的比較生長趨勢。
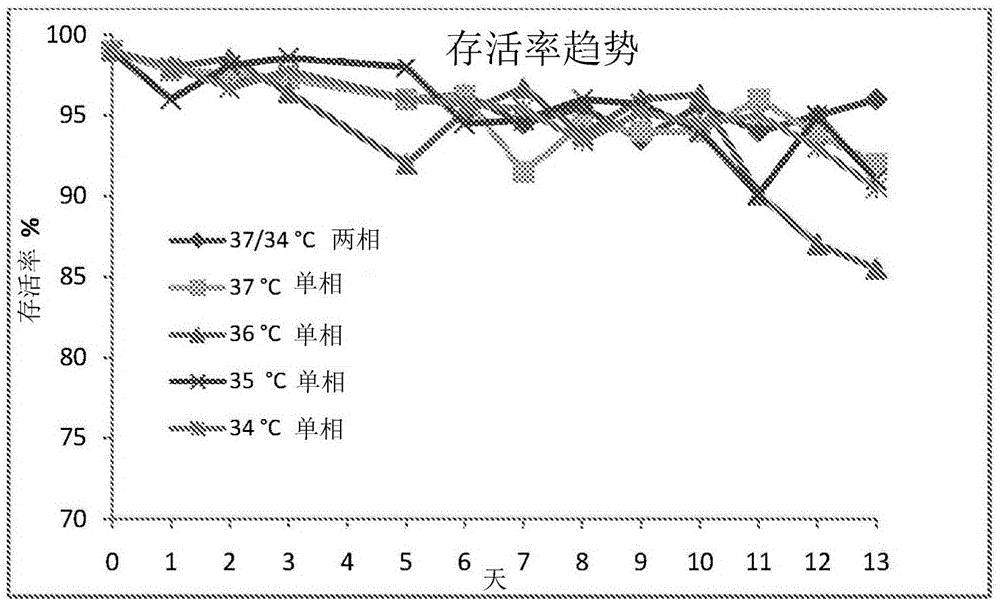
圖2描繪了在依那西普生產期間所觀察到的CHO細胞的比較存活率趨勢。
圖3描繪了在貝伐單抗生產期間所觀察到的CHO細胞的比較生長趨勢。
圖4描繪了在貝伐單抗生產期間所觀察到的CHO細胞在不同時間點的比較存活率趨勢。
圖5描繪了在利妥昔單抗生產中CHO細胞的生長趨勢。
圖6描繪了在利妥昔單抗生產中CHO細胞的存活率趨勢。
圖7描繪了在曲妥珠單抗生產中CHO細胞的生長趨勢。
圖8描繪了在曲妥珠單抗生產中CHO細胞的存活率趨勢。
具體實施方式
定義;
本文所涉及的術語“抗體”包括整個抗體和任何抗原結合片段或其單鏈。“抗體”是指包含由二硫鍵互連的至少兩個重(H)鏈和兩個輕(L)鏈的糖蛋白,或其抗原結合片段。每個重鏈由重鏈可變區(這里縮寫為VH)和重鏈恒定區組成。重鏈恒定區由三個結構域CH1、CH2和CH3組成。每個輕鏈由輕鏈可變區(這里縮寫為VL)和輕鏈恒定區組成。輕鏈恒定區由一個結構域CL組成。VH區和VL區可以進一步細分成高變區,稱為互補決定區(CDR),其是序列高變的和/或涉及抗原識別和/或通常形成結構上定義的環(structurally defined loop),穿插有稱為框架區(FR或FW)的更保守的區域。每個VH和VL由三個CDR和四個FW組成,從氨基端至羧基端以如下順序排列:FW1、CDR1、FW2、CDR2、FW3、CDR3、FW4。FW1、FW2、FW3、FW4的氨基酸序列一起構成這里涉及的VH或VL的“非CDR區”或“非擴展CDR區”。
“宿主細胞”被遺傳工程化(engineered)是指使得重組DNA或RNA以提高的水平或以降低的水平表達基因,或者表達基因的突變形式。換句話說,已經用重組多核苷酸分子轉染、轉化或轉導細胞,因此細胞被改變以使細胞改變期望多肽的表達。“遺傳工程”的常規方法是現有技術中已知的。
“生產培養基(production medium)”指被設計用于在生產期期間培養細胞的細胞培養基。
如本文使用的,“單相”是指不涉及維持培養的任何培養條件改變的細胞培養方法。培養條件包括但不限于溫度、pH、滲透壓或化學賦形劑。
如本文使用的,“單相溫度”是指在生產生物反應器中使用單個溫度設定點進行的細胞培養方法(稱為傳代(passage)“N”)。而且在生產生物反應器的運行期間將溫度維持在單個設定點以獲得單相生長條件。抑制單相移動(shift)。單相溫度在約34℃至約37℃之間。
如本文使用的,“糖基化蛋白”是指作為離散單元(discrete unit)起作用的一種或多種哺乳動物多肽。“糖基化蛋白”包括用于生物制藥應用的融合蛋白和單克隆抗體。融合蛋白的實例包括但不限于依那西普、阿巴西普、阿法西普(alefacept)、利納西普(rilonacept)、貝拉西普(belatacept)、阿柏西普等。單克隆抗體的實例包括但不限于利妥昔單抗(rituximab)、曲妥珠單抗、貝伐珠單抗、阿達木單抗(adalimumab)、狄諾塞麥、帕利珠單抗(palivizumab)、西妥昔單抗、奧馬珠單抗(omalizumab)、那他珠單抗(natalizumab)、帕尼單抗(panitumumab)、尤特克單抗(ustekinumab)、奧法木單抗(ofatumumab)、帕妥珠單抗(pertuzumab)等。
如本文使用的,“細胞密度”是指在給定體積的培養基中存在的細胞的數量。
如本文使用的,“哺乳動物細胞培養物”是指在適合于細胞群生存和/或生長的條件下在培養基中懸浮的細胞群。它指在多細胞生物或組織之外的哺乳動物細胞的生長和增殖。對于哺乳動物細胞合適的培養條件是現有技術中已知的。可以將哺乳動物細胞在懸浮液中或者在附著于固體基質時培養。
如本文使用的,“分批進料培養”是指培養細胞的方法,其中在培養過程開始之后的某一時間向培養物提供另外的組分。所提供的組分通常包括在培養過程期間已經被消耗的細胞營養補充劑。
如本文使用的,哺乳動物細胞培養方法涉及重組哺乳動物細胞系例如CHO DUKX-B11、CHO S、CHO K1、CHO DG44的使用。
如本文使用的,在將種子接種到單相的生產生物反應器中之后,起始VCC(活細胞計數)選自0.1×106細胞/mL至10×106細胞/mL和存活率>90%,更優選地為0.3×106細胞/mL至5×106細胞/mL和存活率>90%,甚至更優選地為1×106細胞/mL至2×106細胞/mL和存活率>90%。在該過程期間可以在合適的時間間隔測量VCC。
如本文使用的,關于溫度的“約”是指溫度值的偏差,其中它涵蓋±1℃,例如約33℃涵蓋32℃至34℃的溫度。
如本文使用的,關于pH的“約”是指pH值的偏差,其中它涵蓋±0.5,例如約pH6.7涵蓋6.2至7.2的pH。
在另一個實施方案中,本發明涉及使用單相溫度條件進行哺乳動物細胞培養以生產融合蛋白和單克隆抗體的方法。
在另一個實施方案中,本發明涉及使用單相溫度條件進行的生產糖基化蛋白的哺乳動物細胞培養方法,其中細胞培養物基本上不含有鏈烷酸或其鹽。
在另一個實施方案中,本發明涉及使用在約34℃至約37℃的單相溫度條件進行的生產糖基化蛋白的細胞培養方法,其提高糖基化蛋白的期望確認。
在另一個實施方案中,在發酵器或生物反應器中以分批、分批進料和連續模式在合適的培養基中進行哺乳動物細胞培養,優選分批進料模式。本發明涉及用于生產糖基化蛋白的培養哺乳動物細胞的方法。更具體地,本發明涉及在哺乳動物細胞培養過程期間維持的特定的培養條件。
雖然文獻中已經開發并報道了從哺乳動物細胞培養物中生產糖基化蛋白的很多方法,但是這些方法通常是兩相的,需要兩組的溫度和/或溶解氧和/或pH。在兩相細胞培養條件中,重組宿主細胞首先在促進快速細胞增殖的溫度下生長,稱為生長期。這通常由在34至37℃下生長細胞然后降低溫度至22至34℃以減少細胞生長同時促進重組蛋白的生產來實現,稱為生產期。
細胞培養方法需要各種參數以便以有效和高效的方式進行該方法。然而,本發明的主要方面是在培養期間使用單相溫度,其中單相溫度不具有溫度變化并且產生期望質量和數量的具有顯著細胞存活率的糖基化蛋白。
本發明通過使用本領域已知的技術研究溫度對蛋白生產、其質量和細胞存活率的影響。溫度選自37℃或36℃或35℃或34℃或33℃。
在另一個實施方案中,約34℃至約37℃的單相溫度條件提高糖基化蛋白的期望確認。
在另一個實施方案中,本發明涉及在單相細胞培養條件下用于生產糖基化蛋白的細胞培養方法,其中哺乳動物細胞在維持在約32℃至約37℃之間的溫度下培養。
在另一個實施方案中,本發明涉及在單相細胞培養條件下用于生產糖基化蛋白的細胞培養方法,其中哺乳動物細胞在維持在約34℃至約37℃之間的溫度下培養。
在本發明的一個實施方案中,單相溫度設定在約33℃。
在本發明的一個實施方案中,單相溫度設定在約34℃。
在本發明的一個實施方案中,單相溫度設定在約35℃。
在本發明的一個實施方案中,單相溫度設定在約36℃。
在本發明的另一個實施方案中,單相溫度設定在約37℃。
在一個實施方案中,本發明涉及在哺乳動物細胞培養物中生產糖基化蛋白的方法,該方法包括以下步驟:
a)在種子擴大培養期間制備具有合適細胞濃度的接種體;
b)將具有合適細胞濃度的接種體接種到生產生物反應器中;
c)在合適的條件下將細胞在生產生物反應器中培養,其中合適的條件是單相溫度條件;以及
d)從細胞培養物中獲得糖基化蛋白。
在一個實施方案中,本發明涉及在哺乳動物細胞培養物中生產糖基化蛋白的方法,該方法包括以下步驟:
a)在種子擴大培養期間制備具有合適細胞濃度的接種體;
b)將具有合適細胞濃度的接種體接種到生產生物反應器中;
c)在合適的條件下將細胞在生產生物反應器中培養,其中合適的條件是單相溫度條件;以及
d)從細胞培養物中獲得糖基化蛋白,
其中在步驟(c)期間單相溫度不具有溫度變化。
在一個實施方案中,本發明涉及在哺乳動物細胞培養物中生產糖基化蛋白的方法,該方法包括以下步驟:
a)在種子擴大培養期間制備具有合適細胞濃度的接種體;
b)將具有合適細胞濃度的接種體接種到生產生物反應器中;
c)在合適的條件下將細胞在生產生物反應器中培養,其中合適的條件是單相溫度條件;以及
d)從細胞培養物中獲得糖基化蛋白,
其中在步驟(c)中生產生物反應器不具有任何區分的生長期和生產期。
在另一個實施方案中,進行種子擴大培養步驟以發育具有合適細胞濃度的接種體。需要至少約72小時以發育成具有期望細胞濃度的接種體,然后將接種體接種到生產生物反應器中用于進一步的擴增(scale up)和蛋白生產。
在另一個實施方案中,在生產發酵器或生產生物反應器中進行細胞培養方法。可以在9至40天的總時期內培養細胞。在另一個實施方案中,至少在第15天之前,優選地在第13天,更優選地在第12天以及最優選地在第11天收獲蛋白。在另一個實施方案中,在細胞存活率達到小于≤90%之前收獲蛋白。在另一個實施方案中,在細胞存活率達到小于≤70%之前收獲蛋白。在另一個實施方案中,在細胞存活率達到小于≤50%之前收獲蛋白。在優選的實施方案中,合適的培養條件是不具有溫度變化的單相溫度。溫度選自約33℃至約37℃,優選地選自約33℃至約36℃。
在另一個實施方案中,在培養期間合適的條件可以進一步選自pH、滲透壓、溶解氧濃度和細胞密度。
以合適的細胞濃度開始種子制備(seed preparation),合適的細胞濃度選自合適的培養基中的0.1×106細胞/mL至0.5×106細胞/mL。在優選的實施方案中,以合適的培養基中0.3×106細胞/mL開始種子制備。在另一個優選的實施方案中,以合適的培養基中0.3×106細胞/mL開始種子制備并且進一步補充有合適濃度的谷氨酰胺和甲氨蝶呤。谷氨酰胺和甲氨蝶呤的合適濃度分別選自3mM至6mM,優選4mM,和70nM至100nM,優選80nM。
在另一個實施方案中,谷氨酰胺的合適濃度是6mM。
在某個實施方案中,種子培養物(seed culture)維持在約3%至8%CO2,優選5%CO2,溶解氧濃度選自約30%至約70%,優選50%,相對濕度選自約70%至約90%,優選85%,攪拌速度選自約0.2m/s至約0.4m/s,優選0.3m/s,以及溫度選自約34℃至約37℃之間,優選37℃。在某個實施方案中,通過以0.00至0.03vvm噴射空氣和以0.00至0.09vvm噴射氧氣來維持溶解氧濃度的濃度。在某個實施方案中,通過稀釋到至少0.1×106細胞/mL將種子培養物進一步傳代擴增。可以在種子培養的間隔期間進行稀釋。在另一個實施方案中,至少在第3天或在72小時進行稀釋。
在優選的實施方案中,通過補充進料進一步擴增種子培養物直到培養物生長至合適的細胞濃度。通過補充進料進一步擴增種子培養物直到培養物在合適的時間段內生長至合適的細胞濃度。可以通過在至少5天內補充進料進一步擴增種子培養物,并且細胞即接種體的合適的濃度選自約4×106細胞/mL至約7×106細胞/mL,優選5×106細胞/mL。
在實施方案中,將進料補充至在合適的生物反應器或發酵器中在合適的培養條件下培養的細胞。在某個實施方案中,在合適的培養條件下培養細胞,合適的培養條件為:選自約3%至6%CO2,優選5%CO2,溶解氧濃度選自約30%至約70%,優選50%,相對濕度選自約70%至約90%,優選85%,攪拌速度選自約0.2m/s至約0.4m/s,優選0.3m/s,以及溫度選自約34℃至約37℃之間,優選37℃。在某個實施方案中,通過以0.03vvm至0.09vvm噴射空氣來維持溶解氧濃度的濃度。
在實施方案中,在種子培養期間細胞的存活率維持至少>70%,優選>80%,更優選>90%。
在優選的實施方案中,細胞取自一個細胞庫并且在包含具有或不具有甲氨蝶呤的生長培養基的搖瓶(shake flask)中培養至起始活細胞濃度(VCC)為0.3×106細胞/mL。然后將種子培養瓶保持在37℃的設定溫度、5%CO2濃度、120rpm和約85%相對濕度下。在隨后的傳代期間通過在每72小時之后稀釋到0.3×106細胞/mL使種子體積得到體積擴增。在生物反應器(或瓶)中,在第1天和第3天向N-1種子額外地補充10%的進料(feed)并孵育120小時。來自VCC為2至2.5×106細胞/mL和存活率>90%的N-2生物反應器(或瓶)的對數期(log phase)細胞用于接種N-1生物反應器(或瓶)。將N-1生物反應器維持在~0.3m/s的葉尖速度(tip speed),并通過分別以0.00至0.03vvm噴射空氣和以0.00至0.09vvm噴射氧氣使溶解氧維持在溶解氧飽和度的約50%,以實現最終的VCC為2至10×106細胞/mL和存活率>90%,更優選為4至8×106細胞/mL和存活率>90%,甚至更優選為5至6×106細胞/mL和存活率>90%。
從種子培養物中獲得的合適濃度的細胞稱為接種體,其轉移到生物反應器或發酵器以在高密度下開始培養。在某個實施方案中,接種體的合適濃度選自約4×106細胞/mL至約7×106細胞/mL,優選5×106細胞/mL。
用具有合適細胞濃度的接種體啟動分批(batch)或生產生物反應器,該合適細胞濃度選自合適的培養基中的4×106細胞/mL至7×106細胞/mL。在優選的實施方案中,種子密度是1.2×106細胞/mL(其可以通過稀釋由種子制備獲得的5×106細胞/mL細胞/mL或6×106細胞/mL細胞/mL來獲得)。在另一個優選的實施方案中,種子密度是1×106細胞/mL。在某個優選的實施方案中,在合適的培養基中培養細胞并且進一步補充合適濃度的谷氨酰胺。谷氨酰胺的合適濃度選自3mM至6mM,優選4mM。
在某個實施方案中,將生產生物反應器維持在約pH值是約6至約8、優選約6.7至7.4、更優選7,3%至6%CO2、優選5%CO2,溶解氧濃度選自約30%至約70%、優選50%,攪拌速度選自約0.2m/s至約0.5m/s、優選0.3m/s,以及溫度選自約34℃至約37℃之間、優選34℃。在某個實施方案中,通過以0.03vvm至0.09vvm噴射空氣來維持溶解氧濃度的濃度。
碳酸氫鈉和CO2氣體用于控制培養物的pH。
在實施方案中,基于剩余葡萄糖水平在分批/生物反應器培養期間進行進料。將葡萄糖水平調整到至少2g/L,如果葡萄糖水平低于2g/L,則補充進料以維持合適的葡萄糖水平。每12小時或18小時或24小時監測培養物的葡萄糖濃度。
在實施方案中,進料可以包含約30至約35g/L的葡萄糖。
在另一個實施方案中,進料可以包含約180至約220mM的L-谷氨酰胺,優選200mM的L-谷氨酰胺溶液。在一個實施方案中,在第2天然后隨后地每2天直到第11天都將L-谷氨酰胺溶液以初始體積的1%加入到培養物中。在另一個實施方案中,在第4天然后在第7天和在第9天都將L-谷氨酰胺溶液以初始體積的1%加入到培養物中。
在另一個實施方案中,將D-葡萄糖作為進料補充到培養物中。D-葡萄糖的濃度選自約60g至約90g,優選80g。在某個實施方案,至少在9天以后或者至少從第10天開始將D-葡萄糖作為進料補充到培養物中。
在另一個實施方案中,至少在10天以后或者11天以后或者12天以后或者13天以后收獲期望的蛋白。
在另一個實施方案中,當培養物存活率降低到低于40%至70%,優選低于50%時進行培養物的收獲。
在另一個實施方案中,在單相生產生物反應器中,以起始VCC(在接種種子之后)為0.1至10×106細胞/mL和存活率>90%,更優選地VCC為0.3至5×106細胞/mL和存活率>90%,甚至更優選地VCC為1至2×106細胞/mL和存活率>90%,以最終分批體積(batch volume)的約55%,將N-1種子接種到包含生長培養基的生物反應器中開始生產生物反應器過程。通過添加8%碳酸氫鈉(NaHCO3)或者CO2氣體將培養物的pH維持在pH范圍為6.7至7.4之間。根據葉尖速度設定攪拌速度為0.3至0.5m/s,通過以0.00至0.03vvm噴射空氣和以0.00至0.09vvm噴射氧氣控制溶解氧濃度維持在50%的溶解氧飽和度。在整個生產生物反應器方法(單相)中,溫度設定于34℃至37℃之間的單一設定點,優選34℃。基于剩余葡萄糖水平進行反應器的進料。每24小時監測培養物的葡萄糖濃度,如果葡萄糖水平低于2g/L則通過添加進料來調整葡萄糖濃度至3g/L。進料含有33.5g/l葡萄糖。在48小時以及之后每48小時直到240小時都將200mM的L-谷氨酰胺溶液以初始體積的1%添加到培養物中。在264小時或者如果培養物的存活率降低至低于90%時,以先達到的條件為準,收獲培養物。
在生物反應器中開始細胞培養過程,其中活細胞濃度選自約1×106細胞/mL至2×106細胞/mL,優選1.2×106細胞/mL。在另一個實施方案中,活細胞濃度是1×106細胞/mL。在某個實施方案中,用于培養細胞的合適條件選自pH為6.7至7.4,優選7.0。在另一個實施方案中,滲透壓選自約250至約550mOSm/Kg。在另一個實施方案中,溶解氧選自約30%至約70%,優選在50%的設定點。
在優選的實施方案中,在生產生物反應器中生長和生產期是不區分的。
在另一個實施方案中,生產期可以是分批的或者分批進料的。
在實施方案中,通過本領域技術人員已知的技術來凈化(clarify)收獲的蛋白。在優選的實施方案中,收獲的蛋白質存在于從生物反應器或發酵器獲得的液體培養基(broth)中。以合適的濃度加入EDTA溶液,可以是5mM,然后使用POD系統通過深度過濾進行凈化。
培養基組成對于提高培養物壽命和生產力是非常重要的。基礎細胞培養基配方是本領域熟知的。根據待培養的宿主細胞的需求,本領域技術人員將向這些基礎培養基配方中加入諸如氨基酸、鹽、糖、維生素、激素、生長因子、緩沖劑、抗生素、脂質、痕量元素等成分。培養基可以或不可以包含血清和/或蛋白。包括無血清和/或限定(defined)培養基的各種組織培養基是用于細胞培養商業上可獲得的。為了本發明的目的,組織培養基限定為體外細胞培養中適合于動物細胞優選哺乳動物細胞生長的培養基。典型地,組織培養基包含緩沖劑、鹽、能量來源、氨基酸、維生素和痕量必需元素。使用在培養中能夠支持適當的真核細胞生長的任何培養基;本發明廣泛地應用于培養物中的真核細胞,尤其是哺乳動物細胞,培養基的選擇對于本發明不是決定性的。適用于本發明的組織培養基可從例如ATCC(Manassas,Va.)商業獲得。例如,使用如下培養基中的任何一種或組合:RPMI-1640培養基,RPMI-1641培養基,達爾伯克改良的伊格爾培養基(DMEM),Eagle最小必需培養基(Minimum Essential Medium),F-12K培養基,Ham F12培養基,Iscove改良的達爾伯克培養基,McCoy 5A培養基,Leibovitz L-15培養基,和無血清培養基例如EX-CELLTM 300系列。在優選的實施方案中,培養基是EX-CELLTM302培養基。
在另一個優選的實施方案中,混合進料培養基包括BalanCD CHO Feed 2、EX-CELL 302粉末培養基、NaHCO3、L-谷氨酰胺粉粉末、MEM氨基酸(50×)、MEM非必需氨基酸(100×)、MEM維生素溶液(100×)。
在本發明的方法和組合物中,細胞可以在無血清、無蛋白質、無生長因子和/或無蛋白胨的培養基中生長。應用于培養基的術語“無血清”包括不包含血清例如胎牛血清的任何哺乳動物細胞培養基。
本領域技術人員還可以選擇使用很多個性化培養基配方中的一種,這些個性化培養基已經被開發以使特定培養的宿主細胞的細胞生長、細胞存活率和/或重組多肽生產最大化。根據本發明的方法可以與商購的細胞培養基或者與單獨配制的配合特定細胞系使用的細胞培養基組合使用。
在優選的實施方案中,培養基是不含血清的。在另一個優選的實施方案中,培養基基本上不含鏈烷酸或其鹽。鏈烷酸和其鹽選自丁酸、丁酸鈉或二丁基cAMP。
在實施方案中,糖基化蛋白質選自阿昔單抗,阿巴西普、阿達木單抗,阿瑞魯單抗(Abrilumab),阿托珠單抗(Afutuzumab),阿柏西普,阿侖單抗(Alemtuzumab),阿法西普,培化阿珠單抗(Alacizumab pegol),阿那白滯素(Anakinra),阿西莫單抗(Arcitumomab),阿塞西普(Atacicept),托珠單抗(Atlizumab),阿托木單抗(Atorolimumab),巴利昔單抗(Basiliximab),貝奈西普(Baminercept),貝妥莫單抗(Bectumomab),貝利木單抗(Belimumab),貝索單抗(Besilesomab),貝伐珠單抗,比西單抗(Biciromab),貝拉西普,維汀-布侖妥昔單抗(Brentuximab vedotin),博達路單抗(Brodalumab),卡那單抗(Canakinumab),卡羅單抗噴地肽(Capromab pendetide),卡妥索單抗(Catumaxomab),賽妥珠單抗,西妥昔單抗,泰坦-克利妥珠單抗(Clivatuzumab tetraxetan),達利珠單抗(Daclizumab),狄諾塞麥,依庫珠單抗(Eculizumab),依決洛單抗(Edrecolomab),依法珠單抗(Efalizumab),依芬古單抗(Efungumab),Eloctate,厄妥索單抗(Ertumaxomab),依那西普,伊瑞西珠(Etaracizumab),法索單抗(Fanolesomab),法勒珠單抗(Farletuzumab),芳妥珠單抗(Fontolizumab),吉妥單抗(Gemtuzumab ozogamicin),吉侖妥昔單抗(Girentuximab),戈利木單抗(Golimumab),替伊莫單抗(Ibritumomab tiuxetan),伊戈伏單抗(Igovomab),英西單抗(Imciromab),英夫利昔單抗,易普單抗(Ipilimumab),拉貝珠單抗(Labetuzumab),美泊珠單抗(Mepolizumab),莫維珠單抗(Motavizumab),莫羅單抗-CD3(Muromonab-CD3),那他珠單抗,尼妥珠單抗,巰諾莫單抗(Nofetumomab merpentan),奧比妥珠單抗(Obinutuzumab),奧法木單抗,奧馬珠單抗,奧戈伏單抗(Oregovomab),帕利珠單抗,帕尼單抗,派土莫單抗(Pemtumomab),帕妥珠單抗,雷莫蘆單抗(Ramucirumab),雷珠單抗,雷昔庫單抗(Raxibacumab),利妥昔單抗,利納西普,羅維珠單抗(Rovelizumab),魯利珠單抗(Ruplizumab),硫索單抗(Sulesomab),他珠單抗(Tacatuzumab tetraxetan),替非珠單抗(Tefibazumab),托珠單抗,曲妥珠單抗,ado-曲妥珠單抗emtansine(Ado-Trastuzumab Emtansine),托西莫單抗(Tositumomab),TRBS07,尤特克單抗,維多珠單抗(Vedolizumab),維西珠單抗(Visilizumab),伏妥昔單抗(Votumumab),扎魯木單抗(Zalutumumab),扎木單抗(Zanolimumab)。
多肽的純化可以包括含有與多肽結合的試劑的親和柱;在如伴刀豆球蛋白A-瓊脂糖、肝素-(Toyo Soda Manufacturing Co.,Ltd.,日本)或者汽巴克隆藍(Cibacrom blue)3GA(Pharmacia Fine Chemicals,Inc.,紐約)的這些親和樹脂上的一個或多個柱步驟(column step);涉及洗脫的一個或多個步驟;和/或免疫親和層析。可以以利于純化的形式表達多肽。例如,它可以表達為融合多肽,例如麥芽糖結合多肽(MBP)、谷胱甘肽-S-轉移酶(GST)或硫氧還蛋白(TRX)的那些。用于這種融合多肽的表達和純化的試劑盒可以分別從New England BioLab(Beverly,Mass.)、Pharmacia(Piscataway,N.J.)和InVitrogen商購。多肽可以用表位標記然后通過使用針對這種表位的特異性抗體來純化。一種這樣的表位從Kodak(New Haven,Conn.)商購。還可以使用包含多肽結合蛋白(例如抗重組多肽、抗親和純化表達的多肽的單克隆抗體)的親和柱。其他類型的親和純化步驟可以是蛋白A(Protein A)或蛋白G(Protein G)柱,其中親和試劑結合包含Fc結構域的蛋白。可以使用傳統技術,例如以高鹽洗脫緩沖劑從親和柱上去除多肽然后透析到低鹽緩沖劑中以供使用或者根據所使用的親和基質通過改變pH或其他成分而從親和柱上去除多肽,或者可以使用親和部分(affinity moiety)的天然存在的底物而競爭性地去除多肽。
雖然可以通過以下實施例的方式說明以上詳細的某些實施方案和本發明,但是本領域技術人員將清楚地理解在實施方案和實施例中可以進行很多修改而不脫離其教導。
實施例
通過將二氫葉酸還原酶(dhfr)和轉染到dhfr缺陷型CHO細胞(DUKX-B11,ATCC CRL-9096)的感興趣基因的共轉染接著隨后進行dhfr/MTX-介導的基因擴增來建立CHO細胞系。根據與重組r-DNA技術相關的本領域已知的技術來制備克隆品。
實施例1:通過單相方法生產依那西普
種子擴大方法(Seed Expansion process)
在補充有4mM L-谷氨酰胺和MTX的生長培養基中,以0.3×106細胞/mL從細胞庫復活(revival)小瓶之后開始種子擴大。在整個種子擴大培養階段MTX的濃度維持在80nM。在搖瓶中將種子培養物維持在37℃、5%CO2濃度、120rpm以及約80%相對濕度。
在對數期通過每72小時之后稀釋至0.3×106細胞/mL而在每個隨后的傳代中充分地擴大種子體積。用0.3×106細胞/mL引發N-2種子,并且在24小時和72小時額外地補充(起始體積的)10%的混合進料并且培養120小時。
來自VCC為5.5×106細胞/mL和存活率>95%的N-2瓶的對數期細胞用于接種具有初始種子密度為1.2×106細胞/mL的N-1瓶。
將N-1種子瓶運行120小時,其中在24小時和72小時用(起始體積的)10%混合進料來進料以獲得6.6×106細胞/mL的活細胞密度和大于>95%的存活率。
生產生物反應器方法
在單相生產生物反應器中,以起始VCC(在種子接種之后)為1.2×106細胞/mL和存活率>98%,以最終批量體積的約55%將N-1種子接種到包含生長培養基的生物反應器中來開始分批方法。通過添加8%碳酸氫鈉(NaHCO3)或CO2氣體將培養物pH維持在pH范圍為6.7至7.4之間。根據葉尖速度設定攪拌速度范圍為0.3至0.5m/s,并且通過以0.00至0.03vvm噴射空氣和以0.00至0.09vvm噴射氧氣來控制溶解氧濃度維持在50%的溶解氧飽和度。在整個生產生物反應器方法(單相)中將溫度設定在單一設定點34℃之間。基于剩余葡萄糖水平進行反應器的進料。每24小時監測培養物的葡萄糖濃度,并且如果剩余葡萄糖水平低于2g/L,則每24小時添加進料(進料含有33.5g/l葡萄糖)來調節至3g/L。在48小時并且之后每48小時直到240小時都將200mM的L-谷氨酰胺溶液以初始體積的1%加入到培養物中。培養物到達約11×106細胞/mL的峰值VCC。在264小時收獲培養物。
實施例2:通過單相方法生產貝伐單抗
種子擴大方法
在補充有6mM L-谷氨酰胺的生長培養基中,以0.4×106細胞/mL從細胞庫復活小瓶之后開始種子的擴大。在搖瓶中將種子培養物維持在37℃、8%CO2濃度、150rpm以及約80%相對濕度。
在對數期通過每72小時之后稀釋至0.4×106細胞/mL而在每個隨后的傳代中充分地擴大種子體積。
將N-1種子燒瓶運行72小時以獲得5.5×106細胞/mL的活細胞密度和大于>95%的存活率。
生產生物反應器方法
在單相生產生物反應器中,以起始VCC(在種接種之后)為1×106細胞/mL和存活率>98%,以最終分批體積的約69%將N-1種子接種到包含生長培養基的生物反應器中來開始分批方法。通過添加8%碳酸氫鈉(NaHCO3)或CO2氣體將培養物pH維持在pH范圍為6.8至7.4之間。根據葉尖速度設定攪拌速度范圍為0.3至0.5m/s,并且通過以0.00至0.03vvm噴射空氣和以0.00至0.09vvm噴射氧氣來控制溶解氧濃度維持在50%的溶解氧飽和度。在整個生產生物反應器方法(單相)中將溫度設定在單一設定點34℃之間。基于剩余葡萄糖水平進行反應器的進料。每24小時監測培養物的葡萄糖濃度,并且如果剩余葡萄糖水平低于2g/L則每24小時添加進料(進料含有33.5g/l葡萄糖)來調節至4g/L。在96小時、168小時和216小時將200mM的L-谷氨酰胺溶液以初始體積的1%加入到培養物中。培養物到達約11×106細胞/mL的峰值VCC。在264小時收獲培養物。
實施例3:通過單相方法生產利妥昔單抗
種子擴大方法
將來自液氮的一瓶利妥昔單抗解凍,將細胞接種在包含生長培養基的125mL搖瓶中并于37℃、120rpm下在CO2孵育搖床中培養。隨著適合于接種生產生物反應器的培養物體積的增加,每72小時±24小時進行細胞傳代。在每個傳代中,接種密度維持在0.3×106細胞/mL,最終VCC目標為3.0±1.0×106細胞/mL。
生產生物反應器方法
在單相生產生物反應器中,以起始VCC(在種接種之后)為0.5±0.2×106細胞/mL和存活率>90%、更優選VCC為0.5×106細胞/mL和存活率>95%,以最終分批體積的約40±5%,將N-1種子接種到包含生長培養基的生物反應器中來開始分批方法。根據葉尖速度設定攪拌速度范圍為0.4至0.6m/s。在整個生產生物反應器方法(單相)中,將溫度設定在在單一設定點即36℃。在第2、3、5、6、7和8天進行生產生物反應器的進料用于細胞培養物的維持、生產力和產物質量屬性。在整個細胞培養期間將谷氨酰胺和葡萄糖分別維持在約2mM和2g/L用于細胞培養維持。在≤312小時或者如果培養物存活率降低至小于50%時,以先到達的為準,收獲培養物。
實施例4:通過單相方法生產阿達木單抗
種子擴大方法
將來自液氮的一瓶阿達木單抗解凍,將細胞接種在包含生長培養基的125mL搖瓶中并于37℃、120rpm下在CO2孵育搖床中培養。隨著適合于接種生產生物反應器的培養物體積的增加,每72小時±24小時進行細胞傳代。在每個傳代中,接種密度維持在0.3×106細胞/mL,最終VCC目標為3.0±1.0×106細胞/mL。
生產生物反應器方法
在單相生產生物反應器中,以起始VCC(在種接種之后)為0.5±0.2×106細胞/mL和存活率>90%、更優選VCC為0.5×106細胞/mL和存活率>95%,以最終分批體積的約60±10%,將N-1種子接種到包含生長培養基的生物反應器中來開始分批方法。根據葉尖速度設定攪拌速度范圍為0.6±0.2m/s。在整個生產生物反應器方法中,將溫度設定在單一設定點36℃。在第3、6、9和11天進行進料用于細胞培養物的維持、生產力和產物質量屬性。在整個細胞培養期間將谷氨酰胺和葡萄糖分別維持在約2mM和2g/L用于細胞培養維持。將收獲標準設定在≤50%細胞存活率或288小時±12小時,以先到達的為準。
實施例5:通過單相方法生產曲妥珠單抗
種子擴大方法
將來自液氮的一瓶曲妥珠單抗解凍,將細胞接種在包含生長培養基的125mL搖瓶中并在37℃、120rpm、5%CO2、85%相對濕度下在CO2孵育搖床中培養。隨著適合于接種生產生物反應器的培養物體積的增加,每72小時±24小時進行細胞傳代。在每個傳代中,接種密度維持在0.3×106細胞/mL,最終VCC目標為約3.0±1.0×106細胞/mL。
生產生物反應器方法
在單相生產生物反應器中,以起始VCC(在種接種之后)為0.5±0.2×106細胞/mL和存活率>90%、更優選VCC為0.5×106細胞/mL和存活率>95%,以最終分批體積的40±5%,將N-1種子接種到包含生長培養基的生物反應器中來開始分批方法。根據葉尖速度設定攪拌速度范圍為0.4至0.6m/s。在整個生產生物反應器方法中,溫度是34℃。在第2、4、6、8和10天進行反應器的進料用于維持細胞培養物的壽命、生產力和產物質量屬性。在整個細胞培養期間將谷氨酰胺和葡萄糖分別維持在約2mM和2g/L用于細胞培養的維持。在≤312小時或者當培養物存活率降低至小于50%進行培養物的收獲,以先到達的為準。
在該申請中所引用的所有專利、專利申請和公開文獻出于所有目的通過引用方式以其整體并入本文,具有與單獨表示的專利、專利申請和公開文獻相同的范圍。
- 還沒有人留言評論。精彩留言會獲得點贊!