基于高通量測序技術的小麥病原微生物檢測方法及其應用與流程
本申請涉及小麥病原微生物檢測領域,特別是涉及一種基于高通量測序技術的小麥病原微生物檢測方法及其應用。
背景技術:
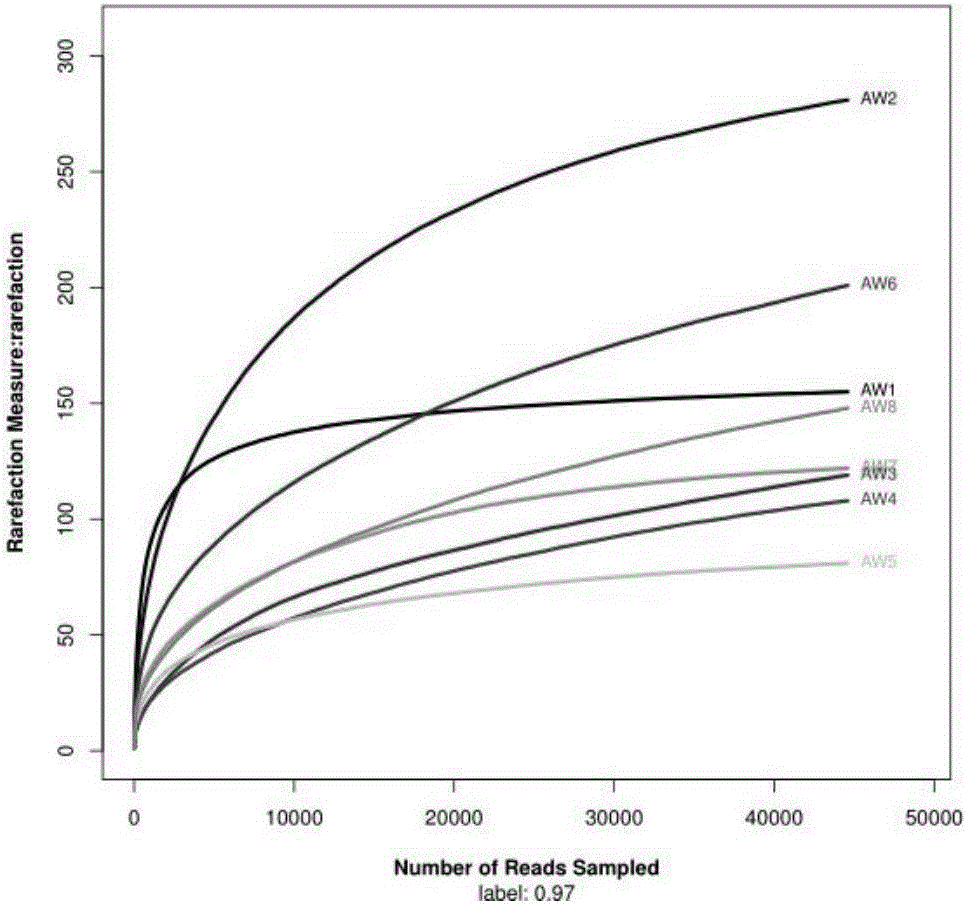
:中國是最大的小麥進口國,小麥進口量呈逐年增長態(tài)勢。小麥上攜帶的病原真菌通過貿(mào)易方式傳入、定殖會對我國的農(nóng)業(yè)生產(chǎn)安全帶來很大的風險。目前,全世界小麥上病害有200多種,其中可以通過輸入小麥傳播的有25種病原物,4種檢疫性病原物,此外還有一些潛在風險的病原物,這些種傳病害經(jīng)由貿(mào)易途徑傳帶,是植物檢疫和農(nóng)業(yè)主管部門重點關注的對象。目前,對小麥病原微生物的檢測主要有形態(tài)學、生化學、血清學和分子生物學方法。這些檢測手段大多都是基于對病原菌分離培養(yǎng)后的分析。以世界范圍內(nèi)廣泛關注的檢疫性病原真菌—小麥印度腥黑穗病菌檢疫鑒定的國際標準(ISPM27.2006Annex4:TilletiaindicaMitra(2004-014))和國家標準(GB/T28080-2011)為例,樣品前處理需先將冬孢子洗滌下來,再進行形態(tài)學和分子生物學的鑒定。正如已被分離培養(yǎng)的微生物只是微乎其微的極少部分,被人們分離培養(yǎng)并認知的病原微生物同樣極少。專性寄生、培養(yǎng)條件苛刻、生長速度慢、在群體中豐度低、特殊生態(tài)要求等影響了病原微生物的分離培養(yǎng),而這些限制就對研究病原菌的分類、多樣性、致病機理、檢測方法、風險分析及防控措施提出了挑戰(zhàn)。在植物檢疫領域,檢疫性物種及其近似種的區(qū)分、重要有害生物的漏檢、檢疫處理措施的制定等都受到微生物不能分離培養(yǎng)的制約,這一限制性因素對檢測方法的制定和結果的判定又有著更特殊、更重要的意義。因此,亟需對小麥上這些因不能分離培養(yǎng)的病原微生物進行認識和分析,評估其有害性和風險性,在傳統(tǒng)風險分析的基礎上,補充提出重點關注的有害生物名單,應對國際植物及植物產(chǎn)品貿(mào)易中的技術壁壘。高通量測序技術具有高效、快速、廉價并全面分析復雜的核苷酸的功能。目前,高通量測試技術已經(jīng)應用于臨床醫(yī)學,用以對疾病或用藥相關基因的突變進行全面檢測,進而指導用藥和預后。但是,在小麥病原微生物檢測方面,尚沒有利用高通量測序技術的高通量優(yōu)勢進行病原微生物檢測的研究和報道。技術實現(xiàn)要素:本申請的目的是提供一種基于高通量測序技術的小麥病原微生物檢測方法及其應用。為了實現(xiàn)上述目的,本申請采用了以下技術方案:本申請一方面公開了基于高通量測序技術的小麥病原微生物檢測方法,包括以下步驟,1)提取待檢小麥樣品或小麥篩下物樣品的基因組DNA;2)采用真菌ITS區(qū)通用引物對步驟1)的基因組DNA進行PCR擴增建庫;3)對步驟2)的PCR擴增產(chǎn)物進行高通量測序;4)將高通量測序結果根據(jù)97%以上相似性進行聚類分析,根據(jù)獲得的分類單元分析取待檢小麥樣品或小麥篩下物樣品的病原微生物群落。需要說明的是,本申請的檢測方法,創(chuàng)造性的將高通量測序技術引入小麥病原微生物的檢測,通過對基因組DNA進行ITS區(qū)測序和聚類分析,可以全面掌握小麥上所攜帶的幾乎所有病原微生物種類。本申請的檢測方法為全面的認識和分析小麥病原微生物奠定了基礎,進而為評估其有害性和風險性,在傳統(tǒng)風險分析的基礎上,補充提出重點關注的有害生物名單,應對國際植物及植物產(chǎn)品貿(mào)易中的技術壁壘提供了有力的科學依據(jù)。優(yōu)選的,本申請的小麥病原微生物檢測方法,還包括將步驟4)分析獲得的病原微生物群落在目或?qū)俚姆诸愃缴希瑢⑵浞譃閮?yōu)勢類群、常見類群、次常見類群和稀有類群四大類;優(yōu)勢類群為比例大于或等于總病原微生物群落10%的真菌群落;常見類群為比例大于或等于總病原微生物群落1%,并小于10%的真菌群落;次常見類群為比例大于或等于總病原微生物群落0.5%,并小于1%的真菌群落;稀有類群為比例小于總病原微生物群落0.5%的真菌群落。需要說明的是,在本申請的一種實現(xiàn)方式中,對進境小麥分析獲得了622個分類單元(縮寫OTU),這622個OTU分屬于5個門64個目201個屬的真菌;為了便于分析和認識,本申請創(chuàng)造性的提出將分析獲得的病原微生物群落分別在不同分類水平上將其分為優(yōu)勢類群、常見類群、次常見類群和稀有類群四大類,以便于深入研究。本申請的另一面公開了本申請的小麥病原微生物檢測方法在進境小麥樣品檢測中的應用。本申請的另一面公開了高通量測序技術在進境澳大利亞小麥病原微生物檢測中的應用,包括采用本申請的小麥病原微生物檢測方法對進境澳大利亞小麥或其篩下物中所攜帶的病原微生物群落進行全面分析和檢測。需要說明的是,本申請的一種實現(xiàn)方式中,對進境澳大利亞小麥進行了病原微生物檢測,分析獲得了分屬于5個門64個目201個屬的真菌,為全面了解進境澳大利亞小麥上所攜帶的病原微生物打下了堅實的基礎。由于采用以上技術方案,本申請的有益效果在于:本申請的基于高通量測序技術的小麥病原微生物檢測方法,利用高通量測序技術,對小麥或小麥篩下物的基因組DNA進行測序,并通過生物信息學分析得到OTU,進而全面的分析出小麥所攜帶的病原真菌情況,進而為評估其有害性和風險性奠定了基礎。本申請的檢測方法特別適用于進出境檢驗檢疫等部門,以便于全面的了解小麥病菌攜帶情況,進而突破或制定出相應的技術壁壘,保障小麥生產(chǎn)和貿(mào)易的安全。附圖說明圖1是本申請實施例中8個樣本的真菌稀釋曲線;圖2是本申請實施例中8個樣本的Shannon-Wiener曲線。具體實施方式本申請的關鍵在于將高通量測序技術應用于小麥病原微生物的檢測,基于高通量測序技術,通過對測序結果進行生物信息學分析,可以全面的了解小麥所攜帶的病原微生物情況,為評估其有害性和風險性,補充提出重點關注的有害生物名單,應對國際技術壁壘提供了有力的科學依據(jù)。需要說明的是,過去我們對病原微生物的學習和認識多從分類的角度入手,研究某一種病原物的分類、形態(tài)特征、寄主范圍、危害性狀等。而在植物病理學家、植物保護和植物檢疫工作人員鑒定病原種類時,通常以某一特定感病植株的分析入手。前者側重分類,是由點及面,并且主要是方法學層面;后者側重性狀,是由表及里,主要是系統(tǒng)論層面。本申請借鑒環(huán)境群體微生物生態(tài)學的思路,將一植物上的所有病原微生物視為一個群體,對其多樣性進行研究可以知曉其致病微生物的種類和數(shù)量,分析不同病原菌之間的生態(tài)關系是否對侵染、定殖、致病產(chǎn)生影響。因此,本申請的小麥病原微生物檢測方法,對掌握進口小麥或小麥產(chǎn)品上病原物的多樣性,對其進行風險評估,進而提出和完善重點關注有害生物名單,甚至突破技術壁壘,制訂新的技術壁壘等,都具有重大意義。還需要說明的是,在研究植物病原微生物多樣性時會遇到兩個問題:一是微生物多樣性的特殊性,不同產(chǎn)地、不同品種的同一種植物上的病原種類和數(shù)量都不同。某一特定的寄主上的病原物多樣性受內(nèi)、外多種因素影響,內(nèi)在因素有種子健康情況、植物生長發(fā)育階段、生長健康程度等,外界因素有自然條件,如水分、空氣、溫度等環(huán)境因子,某一病原物的近似寄主,田間管理措施,如殺菌劑的使用、病原物其他寄主的清除、灌溉情況等。第二個問題是,正如已被分離培養(yǎng)的微生物只是微乎其微的極少部分,目前,已知細菌4760種,估計總種數(shù)40000種,被分離培養(yǎng)的只有約12%;已知真菌72000,估計總種數(shù)1.5×106種,被分離培養(yǎng)的只有約5%,被人們分離培養(yǎng)并認知的病原微生物同樣極少。專性寄生、培養(yǎng)條件苛刻、生長速度慢、在群體中的豐度低、特殊生態(tài)關系等影響了病原微生物分離培養(yǎng),而這些限制就對研究病原菌多樣性的認識提出了挑戰(zhàn)。在植物檢疫領域,檢疫性物種及其近似種的區(qū)分、重要有害生物的漏檢、檢疫處理措施的制定等都受到微生物不能分離培養(yǎng)的制約,這一限制性因素對檢測方法的制定和結果的判定又有著更特殊、更重要的意義。而本申請的小麥病原微生物檢測方法,完全不受分離培養(yǎng)的制約,并且能夠更為全面的分析獲得小麥所攜帶的幾乎所有病原微生物的信息。這對進出境小麥的檢驗檢疫具有重大意義。下面通過具體實施例和附圖對本申請作進一步詳細說明。以下實施例和附圖僅對本申請進行進一步說明,不應理解為對本申請的限制。實施例本例以進境澳大利亞小麥為研究對象,樣品來源為,2015年5-7月從澳大利亞進境的小麥種子及其篩下物,分別采集不同船艙的混合樣品500g,具體的,編號AW1為2015年5月澳大利亞進境小麥,編號AW2為2015年5月澳大利亞進境小麥篩下物,編號AW3為2015年7月澳大利亞進境小麥,編號AW4為2015年7月澳大利亞進境小麥篩下物,編號AW5為2015年10月澳大利亞進境小麥,編號AW6為2015年10月澳大利亞進境小麥篩下物,編號AW7為2015年11月澳大利亞進境小麥,編號AW8為2015年11月澳大利亞進境小麥篩下物。一、小麥病原微生物檢測方法本例的小麥病原微生物檢測方法具體如下:(1)澳大利亞進境的小麥種子及其篩下物基因組DNA提取本例采用SoilDNAKit(D5625-01)對8份樣品進行基因組DNA提取。具體的對500g小麥種子進行常規(guī)檢疫的過篩,稱取過篩后的小麥種子及其對應的篩下物各1g進行基因組DNA提取。基因組DNA提取的具體步驟詳見說明書。獲得基因組DNA后采用NanoDrop2000對基因組DNA進行濃度檢測。(2)PCR擴增和高通量測序根據(jù)NanoDropND-2000熒光分光光度計測得的DNA濃度計算,取適量體積、總量約2μg的基因組DNA樣品,寄送美吉生物技術有限公司,由生物技術公司完成PCR擴增建庫和高通量測序。其中,PCR擴增采用真菌ITS區(qū)通用引物。測序分析過程在IlluminaMiseq第二代高通量測序平臺上進行。測序結果已上傳至NCBI的SRA數(shù)據(jù)庫,編號SRP077547。(3)測序結果生物信息學分析Miseq測序得到的PEreads首先根據(jù)overlap關系進行拼接,同時對序列質(zhì)量進行質(zhì)控和過濾,區(qū)分樣本后進行OTU聚類分析和物種分類學分析。其中,聚類分析使用upars方法在97%的相似水平下進行OTU聚類。采用RDPclassifier貝葉斯算法對97%相似水平的OTU代表序列進行分類學分析。并分別在各個分類水平:門、目、屬,統(tǒng)計各樣本的群落組成。此外,本例進一步在屬的水平上對小麥種子與篩下物的結果進行比較;并在屬的水平上將AW1與AW2數(shù)據(jù)整合、AW3與AW4數(shù)據(jù)整合、AW5與AW6數(shù)據(jù)整合、AW7與AW8數(shù)據(jù)整合,以驗證群落組成分析結果。(4)數(shù)據(jù)的合理性論證采用對測序序列進行隨機抽樣的方法,以抽到的序列數(shù)與它們所代表OTU的數(shù)構建曲線,即稀釋性曲線(RarefactionCurve)。稀釋曲線是利用克隆文庫中已知的各種系型的相對比例來計算抽取n條克隆時出現(xiàn)種系型數(shù)量的期望值,根據(jù)一組n值與其相對應的種系型數(shù)量的期望值做出曲線,當曲線趨向平坦時,說明測序數(shù)據(jù)量合理。本例中,各種系型即OUT單元,n小于庫容;本例在97%的相似水平下繪制稀釋曲線。本例的軟件,使用97%相似度的OTU,利用mothur做rarefaction分析,利用R語言工具制作曲線圖。(5)Shannon-Wiener曲線Shannon-Wiener曲線是反映樣本中微生物多樣性的指數(shù),本例利用各樣本的測序量在不同測序深度時的微生物多樣性指數(shù)構建曲線,以此反映各樣本在不同測序數(shù)量時的微生物多樣性。二、結果及分析(1)基因組DNA濃度采用NanoDrop2000對提取的8份基因組DNA濃度檢測結果顯示,AW1、AW2、AW3、AW4、AW5、AW、AW7、AW8的濃度依序為210ng/μL、163ng/μL、228ng/μL、180ng/μL、209ng/μL、175ng/μL、220ng/μL、178ng/μL。8份基因組DNA各取約15μL用于高通量測序檢測。(2)數(shù)據(jù)的合理性論證在97%的相似水平下繪制的稀釋曲線如圖1所示,圖中,曲線末端由上至下依序為樣品AW2、AW6、AW1、AW8、AW7、AW3、AW4、AW5的曲線。結果顯示,當AW1-AW8每個樣品隨機抽取的條帶數(shù)達到4500條時,8份樣品的OUT單元和多樣性指數(shù)稀釋曲線均已趨于平緩,說明本例的取樣基本合理,能真實地反映小麥樣本的真菌群落組成及多樣性變化。(3)Shannon-Wiener曲線本例的Shannon-Wiener曲線如圖2所示,圖中,曲線末端由上至下依序為樣品AW1、AW2、AW6、AW8、AW7、AW5、AW4、AW3的曲線。結果顯示,AW1-AW8樣品曲線趨向平坦,可見,其測序數(shù)據(jù)量足夠大,可以反映樣本中絕大多數(shù)的微生物信息。(4)真菌群落結構分析本例對8個基因組DNA進行了高通量測序,每個樣品測序獲得44604條序列。本例將8個基因組DNA的測序結果和OTU單元進行整合,共獲得622個OTU,分屬于5個門、64個目、201個屬。不同樣品間OTU種類數(shù)目各不相同:樣品AW1的OTU數(shù)為155,樣品AW2的OTU數(shù)為281,樣品AW3的OTU數(shù)為119,樣品AW4的OTU數(shù)為108,樣品AW5的OTU數(shù)為81,樣品AW6的OTU數(shù)為201,樣品AW7的OTU數(shù)為122,AW8的OTU數(shù)為148。本例進一步的,本例分別在門、目和屬三個水平對真菌菌落進行分類。結果如下:在門的分類水平上將真菌群落分為優(yōu)勢類群和稀有類群兩大類。優(yōu)勢類群為比例超過99%的真菌群落,包括子囊菌和擔子菌;稀有類群指那些比例小于1%的菌落,包括壺菌門Chytridiomycota、接合菌門Zygomycota。結果如表1所示。表1門的水平上澳大利亞小麥8個樣本的OUT數(shù)目門AW1AW2AW3AW4AW5AW6AW7AW8Ascomycota2861634915359617233216616496321524388Basidiomycota15507957685274385312183280911171220210Chytridiomycota00110000Fungi_unclassified429112972125516296692Zygomycota5211660184(5)各分類水平的群落組成分析在目的分類水平上將真菌群落分為優(yōu)勢類群、常見類群、次常見類群和稀有類群四大類。優(yōu)勢類群為比例超過10%的真菌群落,包括Tremellales(銀耳目)占32.0574%和Pleosporales(假球殼目)占34.9728%;常見類群指那些比例小于10%,大于或等于1%,但在大多數(shù)樣品中均出現(xiàn)的真菌群落,包括Capnodiales占7.2942%、Cystofilobasidiales占3.6160%、Fungi_unclassified占8.5757%、Hypocreales占3.4162%、Tremellomycetes占比4.6574%、Trichosphaeriales占1.3457%。次常見類群指那些比例大于或等于0.5%,小于1%的真菌群落,包括Dothideales(座囊菌目)占比0.7202%、Eurotiales(散囊菌目)占比0.7483%、Sporidiobolales(鎖擲酵母目)占比0.9654%。稀有類群指比例小于0.5%的真菌群落,包括Archaeorhizomycetales、Agaricales、Agaricomycetes、Agaricostilbales、Atheliales、Auriculariales、Boletales、Cantharellales、Cercozoa、Chaetothyriales、Corticiales、Cystobasidiales、Dothideomycetes、Dothideomycetes、Erythrobasidiales、Eurotiomycetes、Eurotiomycetes、Exobasidiomycetes、Exobasidiomycetes、Filobasidiales、Geminibasidiales、Glomerellales、Incertae、Leotiomycetes、Leucosporidiales、Malasseziales、Microbotryomycetes、Mortierellales、Olpidiales、Orbiliales、Xylariales、Ustilaginales、Thelephorales、Thelebolales、Sordariomycetes、Sordariales、Saccharomycetales、Rhytismatales、Polyporales、Pezizales等40種真菌類群,以及Ascomycota(子囊菌屬)占比0.2396%、Basidiomycota占比0.1317%、Erysiphales(白粉菌目)占比0.2186%、Helotiales(柔膜菌目)占比0.0816%、Microascales占比0.1617%、Russulales占比0.1415%、Sordariomycetes占比0.0930%、Trichosporonales占比0.1424%、Wallemiales占比0.0855%。在屬的分類水平上將真菌群落分為優(yōu)勢類群、常見類群、次常見類群和稀有類群四大類。優(yōu)勢類群為比例超過10%的真菌群落,包括Cryptococcus(隱球菌屬)占比31.57%、Alternaria(鏈格孢屬)占比18.21%、Pleospora(格孢腔菌屬)占比10.90%;常見類群為比例小于10%的大于1%的真菌群落,包括Fungiunclassified占比8.58%、Davidiella占比4.86%、Epicoccum(附球菌屬)占比2.94%、Cladosporium(枝孢屬)占比2.4023%、Cystofilobasidium占比2.2694%、Fusarium(鐮刀菌屬)占比1.6913%、Gibberella(赤霉菌屬)占比1.5467%、Incertaesedis占比1.3483%、Udeniomyces占比1.2964%、Pyrenophora(核腔菌屬)占比1.0122%、Tremellomycetes占比4.6574%。次常見類群指比例大于0.5%,小于1%的真菌類群:包括Aspergillus占比0.6490%,Dothioraceae占比0.7199%,Phoma占比0.7334%,Pleosporales占比0.5809%;比例小于0.5%,大于0.1%的稀有類群,包括Ascomycota占比0.2396%,Basidiomycota占比0.1317%,Blumeria占比0.2186%,Dioszegia占比0.1690%,Hannaella占比0.2735%,Lactarius占比0.1157%,Pseudallescheria占比0.1202%,Stagonospora占比0.1183%,Trichosporon占比0.1424%,Sporidiobolales占比0.1855%,Sporidiobolus占比0.4722%,Sporobolomyces占比0.2884%。另外,還有占比小于0.1%的超稀有類群151種,包括Incertae占比0.0930%,Leptosphaeria占比0.0115%,Microascus占比0.0359%,Mortierella占比0.0247%,Mycosphaerellaceae占比0.0227%,Trichothecium占比0.0185%,Wallemia占比0.0855%,Nectriaceae占比0.0580%,Penicillium占比0.0726%,Phaeosphaeriaceae占比0.0821%,Pleosporaceae占比0.0701%,Russula占比0.0258%,Sclerotiniaceae占比0.0717%,Setosphaeria占比0.0647%,Sordariomycetes占比0.0930%。(6)小麥種子與篩下物進行比較的結果在屬的分類水平上,可以看出澳大利亞小麥種子與篩下物病原真菌類群差異較大,種子優(yōu)勢類群依次為Alternaria,Pleospora,Cryptococcus,F(xiàn)ungi_unclassified,Tremellomycetes,F(xiàn)usarium,Cladosporium,Epicoccum,Udeniomyces,Dothioraceae,Pyrenophora,Davidiella。篩下物優(yōu)勢類群依次為Cryptococcus,Alternaria,Davidiella,Tremellomycetes_unclassified,Epicoccum,Cystofilobasidium,Gibberella,Pleospora,Phoma。詳細結果如表2所示。表2屬的水平上澳大利亞小麥和篩下物攜帶真菌OTU數(shù)目從表2可以看出種子攜帶病原真菌占比最高的依次是Alternaria(鏈格孢屬)占比21.38%,Pleospora占比20.40%,Cryptococcus(隱球菌屬)占比19.12%。篩下物攜帶病原真菌占比最高的依次是Cryptococcus(隱球菌屬)占比44.02%,Alternaria(鏈格孢屬)占比15.0384%,Davidiella占比8.6786%。可見種子和篩下物所攜帶病原真菌種類和比例是有差異的。本例進一步在屬的水平上將AW1與AW2數(shù)據(jù)整合,AW3與AW4數(shù)據(jù)整合,AW5與AW6數(shù)據(jù)整合,AW7與AW8數(shù)據(jù)整合。也就是將2015年5月、7月、10月、11月四批樣品包含種子與篩下物進行屬水平分類。結果顯示,四批樣品的整合結果,與8份樣品的整合結果一致,優(yōu)勢菌群依次為:Cryptococcus(隱球菌屬)、Alternaria(鏈格孢屬)、Pleospora(格孢腔菌屬);常見類群為比例小于10%的大于1%的真菌群落,包括Fungiunclassified占比8.58%、Davidiella占比4.86%、Epicoccum(附球菌屬)占比2.94%、Cladosporium(枝孢屬)占比2.4023%、Cystofilobasidium占比2.2694%、Fusarium(鐮刀菌屬)占比1.6913%、Gibberella(赤霉菌屬)占比1.5467%、Incertaesedis占比1.3483%、Udeniomyces占比1.2964%、Pyrenophora(核腔菌屬)占比1.0122%。綜上所述,本例的所有小麥種子和篩下物樣品中,通過高通量測序及分析得到可分類OTU共622個,分屬于5個門:Ascomycota、Basidiomycota、Chytridiomycota、Fungi_unclassified、Zygomycota;64個目,其中優(yōu)勢類群為Tremellales(銀耳目)、Pleosporales(假球殼目)、Capnodiales、Cystofilobasidiale、Fungi_unclassified、Hypocreales、Tremellomycetes、Trichosphaeriales;201個屬,其中優(yōu)勢類群為Cryptococcus(隱球菌屬)、Alternaria(鏈格孢屬)、Pleospora(格孢腔菌屬)、Fungi_unclassified、Davidiella、Epicoccum(附球菌屬)、Cladosporium(枝孢屬)、Cystofilobasidium、Fusarium(鐮刀菌屬)、Gibberella(赤霉菌屬)、Incertaesedis、Udeniomyces、Pyrenophora(核腔菌屬)、Tremellomycetes。并且,不同樣品間OTU種類數(shù)目各不相同:樣品AW1為155,樣品AW2為281,樣品AW3為119,樣品AW4為108,樣品AW5為81,樣品AW6為201,樣品AW7為122,AW8為148。可見篩下物的OTU數(shù)量是大于種子的OUT數(shù)量。并且種子與篩下物攜帶的病原真菌的種類和占比有小幅差異,種子攜帶的病原真菌比例最高依次為Alternaria(鏈格孢屬),Pleospora,Cryptococcus(隱球菌屬),這三個屬占篩下物攜帶病原真菌總量的60%。篩下物攜帶的病原真菌依次是Cryptococcus(隱球菌屬),Alternaria(鏈格孢屬),Davidiella,這三個屬占篩下物攜帶病原真菌總量的70%。通過高通量測序測得澳大利亞小麥種子攜帶的病原真菌共124個屬,篩下物攜帶的病原真菌共167個種屬,種子和篩下物都攜帶的病原真菌96個屬。可見篩下物攜帶的病原真菌數(shù)量和種類遠多于種子攜帶的病原真菌。通過高通量測序技術對進境澳大利亞小麥上病原真菌的檢測可以看出高通量測序技術克服了傳統(tǒng)分離培養(yǎng)方法中有些病原物專性寄生、培養(yǎng)條件苛刻、在群體中豐度低、微生物存活但不能培養(yǎng)的制約,克服了梯度凝膠電泳DGGE和TGGE、末端限制性片段長度多態(tài)性分析T-RFLP等基于PCR的分子技術耗時長、通量低、信息量小、成本高等缺陷,可以直接對進境小麥種子或者篩下物進行DNA的提取、文庫的構建、上機測序、數(shù)據(jù)分析,從而得到樣品中病原微生物的信息,簡化了研究步驟,縮短了研究周期,相對于過去方法能檢測到更多的基因和未知的轉(zhuǎn)錄組并且能檢測到表達豐度很低的基因,具有更好的準確性、靈敏性,為口岸通關節(jié)約的時間成本。以上內(nèi)容是結合具體的實施方式對本申請所作的進一步詳細說明,不能認定本申請的具體實施只局限于這些說明。對于本申請所屬
技術領域:
的普通技術人員來說,在不脫離本申請構思的前提下,還可以做出若干簡單推演或替換,都應當視為屬于本申請的保護范圍。當前第1頁1 2 3
相關技術
網(wǎng)友詢問留言
已有0條留言
- 還沒有人留言評論。精彩留言會獲得點贊!
1
- 一種構建Hi?C高通量測序文庫的方法與制造工藝
- 桑葚病原菌高通量鑒定及種屬分類方法及其應用與制造工藝
- 基于高通量測序技術檢測乳腺癌/卵巢癌易感基因的多重PCR特異性引物、試劑盒及方法與制造工藝
- 基于高通量測序檢測人EGFR基因變異的質(zhì)控方法及試劑盒與制造工藝
- 基于高通量測序技術的小麥病原微生物檢測方法及其應用與制造工藝
- 一種基于二代高通量測序技術的地中海貧血癥的基因檢測試劑盒的制造方法與工藝
- 一種基于集群的高通量數(shù)據(jù)分析方法與制造工藝
- 高通量雙折射干涉成像光譜儀裝置及其成像方法與制造工藝
- 高通量測序檢測人循環(huán)腫瘤DNA EGFR基因的捕獲探針及試劑盒的制造方法與工藝
- 一種高通量測序檢測無創(chuàng)親子鑒定的方法與制造工藝
- 口腔菌群多樣性的分析方法及與疾病相關的菌群標志物與制造工藝
- 基于高通量測序技術的小麥病原微生物檢測方法及其應用與制造工藝
- 一種基于二代高通量測序技術的地中海貧血癥的基因檢測試劑盒的制造方法與工藝
- 在片段化的基因組DNA樣品中保留基因組連接信息的制造方法與工藝
- 尋找樣本的染色體突變位點的分析方法和分析裝置與制造工藝
- 內(nèi)分泌與代謝系統(tǒng)對應的基因突變位點的獲取方法及裝置與制造工藝
- 腫瘤對應的基因的突變位點的獲取方法及裝置與制造工藝
- 呼吸系統(tǒng)對應的基因的突變位點的獲取方法及裝置與制造工藝
- 皮膚對應的基因的突變位點的獲取方法及裝置與制造工藝
- 飲食與健康對應的基因的突變位點的獲取方法及裝置與制造工藝