一種小肽及其應用的制作方法
本發明涉及生物技術領域,具體涉及一種小肽及其應用。
背景技術:
糖尿病是一組以慢性血糖水平增高為特征的代謝疾病群。高血糖引起的葡萄糖自動氧化、蛋白質糖基化作用的增強及脂代謝異常是糖尿病患者體內自由基,特別是活性氧(ROS)增加的主要原因,同時也導致一些抗氧化酶的活性明顯降低,從而使糖尿病患者體內處于一定程度的氧化應激狀態。氧化應激不僅參與了糖尿病的發生、發展以及惡化的全部過程,而且還參與了糖尿病并發癥的重要病理改變--多種器官的動脈粥樣硬化(AS)。血管壁的重要構成成分是血管平滑肌細胞(VSMCs),位于血管中層及內膜。在動脈粥樣硬化等血管病變中,血管平滑肌細胞的異常增殖是血管壁增厚的主要原因。增生的VSMCs還可以導致冠狀動脈內膜的病變,進而發生動脈粥樣硬化。在AS的發生和發展過程中,VSMCs的增殖和凋亡的平衡程度也會隨病變的進展發生相應改變。AS的病變初期,血管壁細胞數量增多、內膜增厚、管腔變窄除了與VSMCs過度增殖有關,還與調亡率下降導致細胞累積、數量增多密切相關。平滑肌細胞的調亡不足也是內膜損傷后動脈粥樣硬化早期進展的重要原因。現有技術中缺乏藥物、功能食品能夠調節高糖誘導的VSMCs異常增殖、調節高糖環境下平滑肌細胞的凋亡使其趨于正常狀態,以緩解糖尿病并發癥,延緩或阻止AS的發展。
技術實現要素:
本發明的主要目的是提供一種能夠調節高糖誘導的VSMCs異常增殖、高糖環境下平滑肌細胞的凋亡、且具有抗氧化活性的小肽。
本發明再一目的是提供所述小肽的應用。
本發明的目的采用如下技術方案實現。
一種小肽,其氨基酸序列如SEQ ID NO:1所示。申請人設計了多個小肽序列,由生工生物工程(上海)股份有限公司提供各小肽。通過大量的篩選工作,發現氨基酸序列為AREGEM(SEQ ID NO:1)的小肽(以下簡稱本發明小肽),不僅具有較好的抗氧化性,而且能夠調節高糖誘導的VSMCs異常增殖、調節高糖環境下平滑肌細胞的凋亡,最終使其趨于正常狀態。
本發明還提供所述小肽在制備緩解糖尿病并發癥的功能食品、抗動脈粥樣硬化形成的功能食品、抗氧化功能產品、清除自由基產品、抑制脂質過氧化產品中的應用。
本發明還提供含有所述小肽、用于緩解糖尿病并發癥的功能食品。
本發明還提供含有所述小肽、用于抗動脈粥樣硬化形成的功能食品。
本發明還提供含有所述小肽的抗氧化功能產品。
本發明還提供含有所述小肽的清除自由基產品。
本發明還提供含有所述小肽的抑制脂質過氧化產品。
有益效果:
本發明小肽,不僅具有較強的抗氧化能力,而且能夠調節高糖誘導的VSMCs異常增殖、調節高糖環境下平滑肌細胞的凋亡,最終使其趨于正常狀態,因此,能夠緩解糖尿病并發癥,延緩或阻止AS的發展。本發明還提供該小肽在制備緩解糖尿病其他并發癥的功能食品、抗動脈粥樣硬化形成的功能食品、抗氧化功能產品、清除自由基產品、抑制脂質過氧化產品等方面的應用。
附圖說明
圖1(a)不同濃度的本發明小肽對高糖誘導的VSMCs增殖的影響,其中G表示高糖組,G+7.5/15/30/45/60表示加入不同濃度本發明小肽的實驗組,數字表示加入小肽的最終濃度;(b)不同濃度的本發明小肽對正常糖孵育的VSMCs存活率的影響,橫坐標為本發明小肽的最終濃度。##:與正常組相比有高度差異(p<0.01);*:與高糖組相比有顯著差異(p<0.05);**:與高糖組相比有高度差異(p<0.01),下同。
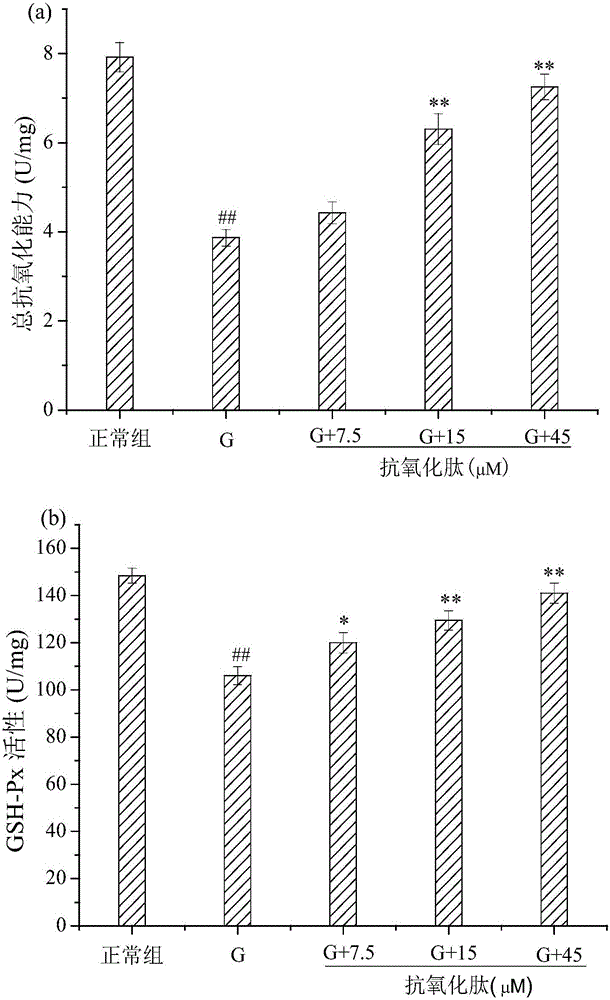
圖2不同濃度的本發明小肽對VSMCs中T-AOC(圖2(a)))、GSH-Px(圖2(b))、SOD(圖2(c))、MDA(圖2(d))水平的影響,其中G表示高糖組,G+7.5/15/45表示加入不同濃度本發明小肽的實驗組,數字表示加入的本發明小肽的終濃度。
圖3(a)不同濃度的本發明小肽對高糖誘導的VSMCs內ROS的影響,其中G表示高糖組,G+7.5/15/30/45表示加入不同濃度本發明小肽的實驗組,數字表示加入小肽的最終濃度;(b)不同濃度的本發明小肽對正常糖孵育的VSMCs內ROS的影響,橫坐標為本發明小肽的最終濃度。
圖4本發明小肽對細胞凋亡的影響,圖4(a)表示正常組,圖4(b)表示高糖組;圖4(c)表示加入了終濃度為15μM本發明小肽的實驗組;圖4(d)表示加入了終濃度為45μM本發明小肽的實驗組;圖4(e)統計學分析各實驗組細胞的凋亡率,其中G表示高糖組,G+15/45表示加入不同濃度本發明小肽的實驗組,數字表示加入本發明小肽的最終濃度。
具體實施方式
1材料:ABTS、熒光素鈉鹽FL、AAPH、Trolox、噻唑藍(MTT)、熒光探針DCFH-DA、二甲基亞砜(DMSO)、45%葡萄糖購自美國Sigma公司;血管平滑肌細胞(VSMCs)購自北京市疾控中心;胎牛血清(FBS)、低糖DMEM培養基(含糖量為1g/L)、Penicillin-Streptomycin(100×)、Trypsin EDTA(0.05%)、Hank平衡鹽溶液(HBSS)購自美國Gibco公司;總抗氧化能力(T-AOC)試劑盒、超氧化物酶(SOD)試劑盒、谷胱甘肽過氧化物酶(GSH-Px)試劑盒、丙二醛(MDA)試劑盒、微量蛋白含量測定(BCA法)試劑盒購自南京建成生物工程研究所;Annexin V-FITC細胞凋亡檢測試劑盒、RIPA細胞裂解液購自碧云天生物試劑公司。
2主要儀器與設備:Spectra Max M2e多功能酶標儀,美國Bio Tek公司;MSC-Advantage-1.2生物安全柜,HERA-cell CO2培養箱,美國Thermo Fisher公司;WH-2微型漩渦混合儀,上海滬西分析儀器廠有限公司;JY92-Ⅱ超聲波細胞粉碎儀,寧波新藝超聲設備有限公司;THZ-C恒溫培養振蕩器,太倉市實驗設備廠;H1850R高速冷凍離心機,湖南湘儀實驗室儀器開發有限公司;流式細胞儀Accuri C6,美國BD公司。
實施例1本發明小肽的抗氧化性
本實施例考察本發明小肽的抗氧化性。
1.氧自由基吸收能力(ORAC)測定
吸取20μL待測樣品溶液(反應體系中的最終濃度為50μM)和80μL熒光素鈉溶液(反應體系中熒光素鈉的最終濃度為175nM)于黑色96微孔板的各孔中,混勻,在37℃孵育15min后。用多道移液器向微孔板的各孔中加入100μL AAPH(偶氮二異丁脒鹽酸鹽,反應體系中AAPH最終濃度為24mM)啟動反應。然后將微孔板放置于酶標儀中,振蕩混勻后于37℃、485nm激發波長、538nm發射波長下進行測定。每2min測定一次熒光強度,每次讀數前振板2s,測定時間設置在熒光值衰減至基線后,設定時間為100min。
以濃度分別為0、6.25、12.5、25、50、100μM的Trolox(水溶性維生素E)制作標準曲線。標準品Trolox和待測樣品(最終濃度為50μM)均用75mM的磷酸鹽緩沖液(pH 7.4)溶解和稀釋。每個實驗組設置6個平行,并用磷酸鹽緩沖液代替樣品作為對照組。ORAC值一般以Trolox當量(Trolox equivalent,TE)來表示,單位為μM TE/μM Peptides。結果發現,本發明小肽(如SEQ ID NO:1所示)的ORAC值為2.13±0.07μM TE/μM Peptides。
2.ABTS+·自由基清除活性測定
用蒸餾水配制過硫化鉀溶液(儲備液中過硫化鉀的終濃度為2.45mM),然后用該溶液與ABTS(2,2-聯氮-二(3-乙基-苯并噻唑-6-磺酸)二銨鹽)水溶液混合,配制得到ABTS+·儲備液(ABTS+·濃度為7mM)。在室溫條件下避光靜置24h后,用0.1M的磷酸鹽緩沖液(PBS,pH 7.4)將ABTS+·儲備液稀釋一定的倍數,使其在734nm下的吸光度值在0.7±0.02,得到ABTS+·工作液。實驗組:用移液器吸取190μL的ABTS+·工作液至96孔板各孔中,然后每孔加入10μL的樣品溶液,混合均勻后在25℃的環境下避光反應20min,反應完成后測定反應體系在734nm下的吸光值。對照組:以0.1M的磷酸鹽緩沖液(PBS,pH 7.4)替代樣品溶液。ABTS+·自由基的清除率=[(A0-A)/A0]×100%,其中,A0表示對照組的吸光值;A表示實驗組的吸光值。
表1不同濃度本發明小肽清除ABTS+·自由基能力(X±S,n=3)%
注:表1中的X表示平均數,S表示標準偏差。
從表1可以看出,本發明小肽隨著濃度的增加,其清除ABTS+·自由基能力逐漸增強,在濃度為5、7.5、10、12.5、15mM時,其清除率分別為11.70±3.45%、25.90±4.27%、36.05±3.26%、55.65±5.12%、73.10±4.68%。
實施例2本發明小肽對高糖誘導的VSMCs異常增殖的保護作用
采用本發明小肽進行如下實驗。
1.噻唑藍(MTT)法檢測細胞增殖
取對數生長期的VSMCs,用含2%FBS的低糖DMEM培養基將細胞懸液調至5×104個/mL,接種于96孔板中,每孔100μL(空白對照組加入100μL含2%FBS的低糖DMEM培養基),細胞數目為5×103個/孔,置于37℃、5%CO2培養箱中培養48h后,吸去培養液,每孔加入100μL低糖DMEM培養基。空白對照組不加任何物質,其他孔隨機分為三大組:正常組不添加任何物質;高糖組(G)加入適量的45%的葡萄糖溶液,使葡萄糖最終濃度為25mM;實驗組加入最終濃度為25mM的葡萄糖和不同濃度的本發明小肽,每組設6個平行。繼續培養24h后,每孔加入10μL、5mg/mL的MTT溶液(PBS溶液配制,過0.22μm無菌膜除菌),培養4h;棄上清液加入100μL異丙醇溶解液,37℃恒溫振蕩器中避光反應15min后,在酶標儀于波長570nm處測定吸光值(A)。細胞增殖率=[(As-A0)/(An-A0)]×100%,其中,As為實驗組吸光值,An為正常組吸光值,A0為空白對照組吸光值。采用X±S(X表示平均數,S表示標準偏差)形式表示各數據。
圖1(a)為不同濃度的本發明小肽對高糖誘導的VSMCs增殖的影響。以正常組作為對照組,高糖環境條件下能明顯促進VSMCs的增殖,細胞數量高出對照組的42.58±3.78%(p<0.01)。經過不同濃度的本發明小肽(7.5、15、30、45和60μM)孵育24h后,細胞增殖率分別下降至138.93±5.14%、132.64±4.76%、122.55±5.91%、104.41±4.36%和103.95±5.29%。當本發明小肽的濃度為45、60μM時,VSMCs的增殖率幾乎達到了和正常組一致的水平。實驗結果表明,一定濃度的本發明小肽可以保護細胞,有效抑制高糖引起的VSMCs增殖過快。
為了弄清本發明小肽對VSMCs的生長是否具有影響,檢測了在正常糖孵育條件下(即本實施例標題1中第一段中的正常組)加入不同濃度本發明小肽對VSMCs存活率的影響,結果如圖1(b)所示。從該圖可以看出,在7.5、15、30、45和60μM的濃度條件下,本發明小肽對正常糖孵育的VSMCs的生長無任何不良影響,說明7.5-60μM的本發明小肽對細胞沒有任何毒性(p>0.05),對VSMCs既無促進生長作用,也無抑制生長作用。
2.細胞總抗氧化能力(T-AOC)、抗氧化酶活(谷胱甘肽過氧化物酶GSH-Px和超氧化物歧化酶SOD)和丙二醛(MDA)的檢測
取對數生長期的VSMCs,用0.05%EDTA-胰蛋白酶溶液消化后,用含10%FBS的低糖DMEM培養基將細胞懸液調至1×105個/mL,接種于24孔板,每孔500μL,使細胞數目為5×104/孔,待細胞完全貼壁后,換用不含血清的低糖DMEM培養基培養24h,使細胞同步于G0期。隨機分為三大組:正常組不添加任何物質;高糖組(G)加入適量的45%的葡萄糖溶液,使葡萄糖的最終濃度為25mM;實驗組加入最終濃度為25mM的葡萄糖和不同濃度的本發明小肽,每組設6個平行。繼續孵育48h。然后除去上清液,各孔加入200μL細胞裂解液,冰上裂解細胞15min后,用細胞刮將細胞及裂解液刮下來,轉移到離心管中,然后在冰水浴條件下超聲波破碎(功率300W,3~5s/次,間隔10s,重復3次),吸取各組細胞勻漿液,按試劑盒(總抗氧化能力(T-AOC)試劑盒、超氧化物酶(SOD)試劑盒、谷胱甘肽過氧化物酶(GSH-Px)試劑盒、丙二醛(MDA)試劑盒均購自南京建成生物工程研究所)說明書測定各實驗組細胞裂解液的T-AOC、SOD和GSH-Px活性和MDA含量,采用X±S(X表示平均數,S表示標準偏差)形式表示各數據。
圖2(a)為不同濃度的本發明小肽對VSMCs中T-AOC含量的影響。總抗氧化能力(T-AOC)包括酶與非酶在內的全部抗氧化物,是一個能夠全面反映抗氧化能力的指標。經過25mM的葡萄糖處理后,VSMCs中的T-AOC與正常組相比有顯著的降低(p<0.01)。低濃度的本發明小肽具有一定的提高T-AOC的作用,但效果不明顯(p>0.05)。與高糖組相比,加入濃度為15μM和45μM的本發明小肽后,VSMCs中的T-AOC分別提高到了6.31±0.34U/mg和7.25±0.39U/mg(p<0.01)。表明本發明小肽可以通過提高細胞抗氧化能力來保護細胞。
由圖2(b)和2(c)可知,正常組VSMCs中的GSH-Px和SOD活性均在較高的水平,經過25mM的葡萄糖處理48h后,高糖組(G)細胞中的GSH-Px和SOD活性顯著降低(p<0.01))。同高糖組相比,各實驗組細胞中GSH-Px和SOD的活性隨著本發明小肽濃度的升高,酶活性均有不同程度的提高。各不同濃度的本發明小肽組(7.5、15和45μM)谷胱甘肽過氧化物酶的活力分別為119.96±4.30U/mg、129.47±4.09U/mg、141.04±4.23U/mg;超氧化物歧化酶的活力分別為127.87±5.16U/mg、142.29±4.88U/mg、159.79±5.54U/mg。統計分析結果表明,15μM和45μM本發明小肽實驗組的GSH-Px和SOD酶活較高糖組的酶活性均有極顯著性提高(p<0.01)。
丙二醛(MDA),作為氧自由基攻擊生物膜中的多不飽和脂肪酸引發的脂質過氧化反應的最終產物,其含量的變化可以間接的反映細胞的受損程度。由圖2(d)可知。高糖組的MDA含量與正常組相比顯著升高(p<0.01)),說明高糖環境使質膜脂質過氧化而積累大量產物MDA。當加入不同濃度的本發明小肽(7.5、15、和45μM)孵育48h后,各組細胞內MDA的含量分別下降至1.40±0.05、1.17±0.04和0.87±0.04nmol/mg。統計分析結果表明,不同濃度的(7.5、15和45μM) 本發明小肽對細胞中的MDA含量具有極顯著的清除作用(p<0.01)。細胞內MDA含量的變化,表明本發明小肽在一定程度上抑制了細胞內的脂質過氧化作用,增強了細胞的抗氧化防御系統。
3.VSMCs內活性氧(ROS)含量的檢測
取對數生長期的VSMCs,用0.05%EDTA-胰蛋白酶溶液消化后,用含10%FBS的低糖DMEM培養基將細胞懸液調至1×105個/mL,接種于24孔板,每孔500μL,使細胞數目為5×104/孔,置于37℃、5%CO2培養箱中培養48h后,吸去培養液,換用不含血清的低糖DMEM培養基。16h后,隨機分為三大組:正常組不添加任何物質;高糖組(G)加入適量的45%的葡萄糖溶液,使葡萄糖最終濃度為25mM;實驗組加入最終濃度為25mM的葡萄糖和不同濃度的本發明小肽,每組設3個平行。繼續培養8h后,吸棄孔內液體,用HBSS(Hank平衡鹽溶液)溶液清洗2遍之后,每孔加入300μL濃度為10μM的熒光探針DCFH-DA(2',7'-二氯熒光黃雙乙酸鹽)溶液,放入CO2培養箱中培養1h后;在酶標儀中于激發波長485nm,發射波長530nm處測定熒光值。采用X±S(X表示平均數,S表示標準偏差)形式表示各數據。
實驗結果如圖3(a)所示。以正常組細胞內ROS的含量為100%,將其作為對照組,高糖組細胞內的ROS含量顯著高于正常組(p<0.01),其細胞內的ROS含量達到了118.32±2.85%。經過不同濃度的本發明小肽(7.5、15、30和45μM)處理后,各組細胞內的ROS水平分別下降至105.24±3.32%、98.28±4.63%、96.39±3.59%和96.96±4.23%。實驗結果表明:通過在高糖中加入不同濃度的本發明小肽后,與高糖組相比,可以顯著降低細胞內ROS的水平。說明本發明小肽能有效抑制高糖引起的VSMCs內ROS水平增高,抑制氧化應激的發生。
為了探究本發明小肽本身對VSMCs內ROS含量的影響,我們檢測了在正常糖孵育條件下(本實施例標題3中第一段的正常組)加入不同濃度本發明小肽后VSMCs內ROS的含量。從圖3(b)可以看出,加入不同濃度本發明小肽的實驗組和正常組細胞內的ROS含量無顯著性差異(p>0.05),證明一定濃度的本發明小肽對正常糖孵育的VSMCs內ROS的含量沒有任何影響。實驗結果表明本發明小肽本身對實驗結果無干擾作用。同時證明,本發明小肽對高糖誘導的VSMCs的保護作用是通過抑制氧化應激實現的。
本發明小肽不僅可以顯著提高高糖孵育的VSMCs中總抗氧化能力(T-AOC)、谷胱甘肽過氧化物酶(GSH-Px)和超氧化物歧化酶(SOD)的活性,降低脂質過氧化產物丙二醛(MDA)的含量,有效抑制高糖引起的VSMCs內活性氧(ROS)水平增高,抑制氧化應激的發生,而且能夠抑制高糖誘導的血管平滑肌細胞增殖。
實施例3本發明小肽對高糖孵育的VSMCs凋亡的影響
采用本發明小肽進行如下實驗。
Annexin V-FITC/PI雙染法檢測細胞凋亡率:各組細胞的凋亡率采用Annexin V-FITC細胞凋亡檢測試劑盒(碧云天生物試劑公司),即Annexin V-FITC/PI雙染法。取對數生長期的VSMCs,用0.05%EDTA-胰蛋白酶溶液消化后,用含10%FBS的低糖DMEM培養基將細胞懸液調至5×104個/mL,接種于6孔板,每孔2mL,使細胞數目為1×105個/孔,置于37℃、5%CO2的培養箱中培養48h后,吸去培養液,換用不含血清的低糖DMEM培養基,并隨機分為三大組:正常組不添加任何物質;高糖組(G)加入適量的45%的葡萄糖溶液,使葡萄糖的最終濃度為25mM;實驗組加入最終濃度為25mM的葡萄糖和不同濃度的本發明小肽,每組設3個平行。繼續培養48h后,將細胞培養液吸出至離心管中,用PBS緩沖液洗滌細胞一次,除去上清液后,用0.05%EDTA-胰蛋白酶溶液消化收集細胞,吸除胰蛋白酶溶液后加入收集的細胞培養液,稍混勻,轉移到離心管中,將細胞懸液在4℃、以800g離心5min后棄上清,收集細胞,然后用PBS緩沖液輕輕重懸細胞,在4℃、以800g離心5min,除去上清液,加入195μL Annexin V-FITC結合液輕輕重懸細胞,然后加入5μL Annexin V-FITC和10μL碘化丙啶染色液,輕輕混勻,在室溫下避光孵育20min。隨后置于冰浴中,隨即進行流式細胞儀檢測細胞,獲得的數據用Annexin V-FITC熒光強度(FLl-A通道)為X軸,PI為熒光強度(FL2-A通道)為Y軸的散點圖分析細胞凋亡情況。
圖4為本發明小肽對細胞凋亡的影響。各組細胞絕大部分出現在Annexin-/PI -雙陰性區域,說明細胞處于正常狀態。與正常組細胞相比,高糖組Annexin+/PI -細胞和Annexin+/PI+細胞比例下降,說明高糖環境抑制平滑肌細胞的凋亡。加入不同濃度的本發明小肽處理后,Annexin+/PI-細胞和Annexin+/PI+細胞的比例逐漸上升。實驗結果表明:本發明小肽可以減弱這種抑制作用。進一步分析各組細胞的凋亡率(采用X±S形式表示各數據,X表示平均數,S表示標準偏差)。加入25mM的葡萄糖處理后,細胞凋亡率由正常組的21.30±1.41%降低到高糖組的14.20±0.88%(p<0.01),加入本發明小肽(15(M和45(M)孵育48h后,細胞凋亡率分別上升至17.60±0.85%(p<0.05)、20.80±1.13%(p<0.01)。實驗結果表明:高糖環境抑制平滑肌細胞的凋亡,本發明小肽可以減弱這種抑制作用。
綜上所述,本發明小肽具有良好的抗氧化活性,能夠調節高糖誘導的VSMCs異常增殖使其趨向于正常狀態,能夠調節高糖環境下平滑肌細胞的凋亡趨于正常狀態,因此,本發明小肽可以應用于制備緩解糖尿病并發癥的功能食品、抗動脈粥樣硬化形成的功能食品、抗氧化功能產品、清除自由基產品和抑制脂質過氧化產品中。
SEQUENCE LISTING
<110> 南京財經大學
<120> 一種小肽及其應用
<130> 20161206
<160> 1
<170> PatentIn version 3.3
<210> 1
<211> 6
<212> PRT
<213> artificial
<220>
<223> 小肽
<400> 1
Ala Arg Glu Gly Glu Met
1 5
- 還沒有人留言評論。精彩留言會獲得點贊!