基于特異序列的大腸桿菌和志賀菌檢測引物、試劑盒及檢測方法與流程
本發明涉及一種基于特異序列的大腸桿菌和志賀菌檢測引物,同時還涉及包含該引物的試劑盒以及大腸桿菌、志賀菌檢測方法,屬于分子生物學技術領域。
背景技術:
大腸桿菌(Escherichia coli)是臨床上最常見的致病菌之一,也是近年來食品衛生和流行病學領域的重要研究對象。由于該菌經常出現在糞便污染的地方,因此被作為水源和食品糞便污染的指示菌。雖然大多數的大腸桿菌是人和動物的腸道兼性厭氧寄居菌群,在正常情況下不具有致病能力,但是某些特殊血清型的大腸桿菌具有致病性。這些致病性菌一般攜帶有特定的毒力基因,可以編碼相應的毒性物質,引起腹瀉、尿路感染、敗血癥和腦膜炎等病癥,使寄主的健康遭受威脅(Gao Q,Wang X,Xu H,Xu Y,Ling J,Zhang D,Gao S.&Liu X.(2012).Roles of iron acquisition systems in virulence of extraintestinal pathogenic Escherichia coli:salmochelin and aerobactin contribute more to virulence than heme in a chicken infection model.BMC Microbiol 12:143.)。嚴重的甚至引起血性腹瀉和溶血性尿毒綜合征等(Genotypic and phenotypic changes in the emergence of Escherichia coli O157:H7.J Infect Dis 177:1750-3;Cheung,M.K.,Li,L.,Nong,W.&Kwan,H.S.(2011).2011 German Escherichia coli O104:H4outbreak:whole-genome phylogeny without alignment.BMC Res Notes 4:533.)。
志賀菌是引起夏、秋季細菌性痢疾的主要病原體,傳染性極強,20~100個CFU便能引起感染(封會茹,曲梅,耿榮,秦萌,余紅,尉秀霞,趙偉,邢洪光,楊軍勇,董曉根,趙建忠.2010-2012年北京市豐臺區感染性腹瀉病原菌分布及耐藥性分析[J].疾病監測,2013,02:96-100.)。該病主要在發展中國家流行,在我國屬于常見病,發病率位于我國傳染病發病率的前三位(Wang Y,Song C,Duan G,et al.Transposition of ISEcp1 modulates blaCTX-M-55-mediated Shigella flexneri resistance to cefalothin[J].Int J Antimicrob Agents,2013,42(6):507-512.)。
目前,大腸桿菌和志賀菌的檢測方法主要有常規檢測法和分子生物學檢測法,常規檢測法又包括形態學鑒定和生化試驗鑒定,其中形態學鑒定輔以生化試驗在細菌鑒定中具有重要意義,但是該方法也存在一些缺點,比如重現率低,辨識能力低,相似的表型特征無法等同于相似或者關系密切的基因型等。所以對于那些通過表型特征難以區別的菌種,常規的檢測方法就不能準確鑒定到種,并且該方法操作繁瑣,實驗周期長(鄧梅葵,孫迎,韓雯晴.細菌鑒定方法[J].生物醫學工程學進展,2014(02):84-88)。分子生物學檢測法包括DNA(G+C)mol%、核酸雜交、16S rRNA序列分析、MLST(多位點序列分型,Multi Locus SequenceTyping)、全基因組測序以及核酸指紋圖譜等(-Sánchez B,Priego-Capote F,de Castro M L.Metabolomics analysis I.Selection of biological samples and practical aspects preceding sample preparation[J].TrAC Trends in Analytical Chemistry,2010,29(2):111-119.),具有快速、簡便等特點,且能從本質上闡明細菌間的親緣關系。
技術實現要素:
本發明的目的是提供一種基于特異序列的大腸桿菌和志賀菌檢測引物。
同時,本發明還提供一種包含上述引物的檢測試劑盒。
最后,本發明再提供一種基于特異序列的大腸桿菌和志賀菌檢測方法。
為了實現以上目的,本發明所采用的技術方案是:
大腸桿菌(種系B2除外,下同)和志賀菌檢測引物,根據特異序列或者與該序列同源性達96%以上的同源序列設計合成,特異序列如SEQ ID NO.3所示,同源序列如SEQ ID NO.4所示。引物設計遵循本領域通用準則,采用常規引物設計軟件完成。
具體的,大腸桿菌和志賀菌檢測引物如下所示:
上游引物:5'-GTTATCAGCAACGCGCAAAA-3';
下游引物:5'-ACTGGATGCGATGATGGATA-3'。
基于特異序列的大腸桿菌和志賀菌檢測試劑盒,包含以下引物:
上游引物:5'-GTTATCAGCAACGCGCAAAA-3';
下游引物:5'-ACTGGATGCGATGATGGATA-3'。
所述試劑盒還可以包括:2×Taq PCR Master Mix(0.1U/μL Taq DNA Polymerase,2×PCR反應緩沖液,0.4mM dNTP,4mM MgSO4)、滅菌超純水、陽性對照(大腸桿菌、志賀菌全基因組DNA)、10×PCR菌落增強劑以及DNA Marker DL 2000等。
基于特異序列的大腸桿菌和志賀菌檢測方法,包括以下步驟:
1)以待測樣本基因組DNA或單菌落為模板,利用引物進行PCR擴增,擴增產物經電泳分析與陽性對照有相同條帶的判定為疑似陽性;
2)回收疑似陽性的擴增產物,進行測序分析,與SEQ ID NO.3(252bp)所示序列相同或同源性達96%以上的判定為細菌陽性;
步驟1)中引物如下所示:
上游引物:5'-GTTATCAGCAACGCGCAAAA-3';
下游引物:5'-ACTGGATGCGATGATGGATA-3'。
步驟1)中待測樣本基因組DNA可采用煮沸法或DNA提取試劑盒提取。
步驟1)中PCR擴增的反應體系為:2×Taq PCR Master Mix(0.1U/μL Taq DNA Polymerase,2×PCR反應緩沖液,0.4mM dNTP,4mM MgSO4)12.5μL,8μmol/L上、下游引物各1μL,10~20ng/μL待測樣本基因組DNA 2μL,滅菌超純水8.5μL,總計25μL。
或者,PCR擴增的反應體系為:2×Taq PCR Master Mix(0.1U/μL Taq DNA Polymerase,2×PCR反應緩沖液,0.4mM dNTP,4mM MgSO4)12.5μL,8μmol/L上、下游引物各1μL,單菌落,1×PCR菌落增強劑2.5μL,滅菌超純水補足至25μL。
步驟1)中PCR擴增的反應程序為:94℃預變性5min;94℃變性30s,52℃退火30s,72℃延伸30s,共32個循環;72℃繼續延伸10min。
步驟1)中陽性對照為大腸桿菌和/或志賀菌。
本發明的有益效果:
本發明通過對CRISPR database數據庫中大腸桿菌和志賀菌全基因組測序結果進行分析以及對實驗室保存的大腸桿菌和志賀菌檢測發現,其具有一段共同的特異序列。針對該特異序列設計上、下游引物,PCR擴增后進行電泳分析,與陽性對照有相同條帶的判定為疑似陽性,回收疑似陽性的擴增產物,進行測序分析,與SEQ ID NO.3所示序列相同或同源性達96%以上的判定為大腸桿菌、志賀菌陽性。該檢測方法操作簡單,敏感性和特異性高,與大腸桿菌、志賀菌的種屬結果一致,檢測費用低,具有良好的推廣應用價值。
附圖說明
圖1為試驗例1中大腸桿菌、志賀菌擴增產物的電泳圖;
圖2為試驗例2中擴增產物的電泳圖。
具體實施方式
下述實施例僅對本發明作進一步詳細說明,但不構成對本發明的任何限制。
實施例1
本實施例中基于特異序列的大腸桿菌和志賀菌檢測引物如SEQ ID NO.1、SEQ ID NO.2所示。
實施例2
本實施例中基于特異序列的大腸桿菌和志賀菌檢測試劑盒,包含:2×Taq PCR Master Mix(0.1U/μL Taq DNAPolymerase,2×PCR反應緩沖液,0.4mM dNTP,4mM MgSO4)20mL,滅菌超純水30mL,陽性對照DNA(大腸桿菌和志賀菌各一支)100μL、8μmol/L上、下游引物各5mL,DNA Marker DL 2000(250μL)及試劑盒說明書一份;
所述上、下游引物為:
上游引物:5'-GTTATCAGCAACGCGCAAAA-3';
下游引物:5'-ACTGGATGCGATGATGGATA-3'。
檢測原理:試劑盒中含有聚合酶鏈式反應所需的各種試劑組分,如引物、dNTPs、緩沖液、Taq酶等,在PCR反應液中加入檢測樣品,進行PCR擴增,擴增產物經電泳分析出現與陽性對照相同條帶的判定為疑似陽性,膠回收擴增產物,進行測序分析,與SEQ IDNO.3所示序列相同的判定為細菌陽性。可用于獲知各種待檢測樣本(如糞便、食物等)中大腸桿菌、志賀菌的污染狀況。
操作說明:
1)提取待檢測樣本的基因組DNA或者挑取單菌落;
2)利用上、下游引物進行PCR擴增,配制如下反應體系:
2×Taq PCR Master Mix(0.1U/μL Taq DNA Polymerase,2×PCR反應緩沖液,0.4mM dNTP,4mM MgSO4)12.5μL,8μmol/L上、下游引物各1μL,10~20ng/μL待測樣本基因組DNA 2μL,滅菌超純水8.5μL,總計25μL;
或者,2×Taq PCR Master Mix(0.1U/μL Taq DNA Polymerase,2×PCR反應緩沖液,0.4mM dNTP,4mM MgSO4)12.5μL,8μmol/L上、下游引物各1μL,單菌落,1×PCR菌落增強劑(市售商品,主要成分為甜菜堿,為10倍濃度,使用時需稀釋為1倍濃度)2.5μL,滅菌超純水補足至25μL;
反應程序:94℃預變性5min;94℃變性30s,52℃退火30s,72℃延伸30s,共32個循環;72℃繼續延伸10min;
3)PCR產物凝膠電泳分析,條件:2.0%瓊脂糖凝膠,電壓5V/cm,時間20min;在紫外燈下觀察結果,若出現與陽性對照相同的條帶即為疑似陽性,陰性對照沒有特異性擴增條帶或者條帶不一致;
4)回收疑似陽性的擴增產物,進行測序分析,與SEQ ID NO.3(252bp)所示序列相同或同源性達96%以上的判定為細菌陽性,即樣本中包含大腸桿菌和/或志賀菌陽性。
實施例3
本實施例中基于特異序列的大腸桿菌和志賀菌檢測方法,包括以下步驟:
(1)樣本的收集和預處理
將500μL待檢測樣本(食物)加入到10mL增菌液中,37℃增菌5h(4~6h均可),臺式高速離心機12000rpm/min離心5分鐘,棄上清,沉淀用作檢測模板;
(2)PCR擴增
利用上、下游引物進行PCR擴增,引物如下所示:
上游引物:5'-GTTATCAGCAACGCGCAAAA-3',
下游引物:5'-ACTGGATGCGATGATGGATA-3';
PCR擴增的反應體系為:2×Taq PCR Master Mix(0.1U/μL Taq DNA Polymerase,2×PCR反應緩沖液,0.4mM dNTP,4mM MgSO4)12.5μL,8μmol/L上、下游引物各1μL,增菌沉淀2μL,1×PCR菌落增強劑2.5μL,無菌超純水補足至25μL;
PCR擴增反應程序:94℃預變性5min;94℃變性30s,52℃退火30s,72℃延伸30s,共32個循環;72℃繼續延伸10min;
(3)檢測結果
取5μL PCR擴增產物,于20g/L瓊脂糖凝膠中電泳,用DNA Marker DL 2000作分子量標記,電壓5V/cm,電泳20min后,在紫外燈下觀察結果,出現與陽性對照相同的條帶,也即疑似陽性;
回收疑似陽性的擴增產物,進行測序分析,結果顯示與SEQ ID NO.3所示序列相同,判定該樣本受到大腸桿菌和/或志賀菌污染。
試驗例1
一、試驗中使用的細菌菌株
大腸桿菌2002001和2014001分別分離于河南睢縣和河南新鄉,志賀菌2014030分離于河南睢縣。
二、試驗中使用的試劑及儀器
(1)LB培養基
LB液體培養基:稱取1.0g胰蛋白胨、0.5g酵母浸粉、1.0g氯化鈉,溶于100mL蒸餾水中,用10mol/L NaOH調pH值至7.2,121℃高壓滅菌20min,置4℃保存備用。
LB固體培養基:稱取1.0g胰蛋白胨、0.5g酵母浸粉、1.0g氯化鈉、1.5g瓊脂粉,溶于100mL蒸餾水中,用10mol/L NaOH調pH值至7.2,121℃高壓滅菌20min,冷卻至約50℃時傾注平板,保存備用。
(2)PCR反應試劑盒購自生工生物工程(上海)股份有限公司,瓊脂糖為BIOWEST公司進口分裝,酵母浸粉、胰蛋白胨購自英國Oxoid公司,瓊脂粉購自Sigma公司,其他常用試劑均為國產分析純級試劑。
PTC-100型基因體外擴增儀購自MJRESEARCH公司,DYY-8C型穩壓穩流定時電泳儀購自北京六一儀器廠,Gene snap圖像掃描儀購自美國Syngene公司。
未作特別說明的試驗材料和方法均為公知技術,可在常用工具書包括《分子克隆實驗指南》(J.薩姆布魯克、D.W拉塞爾著,第三版,科學出版社,2002)等中查找。
三、大腸桿菌和志賀菌特異序列基因的檢測
采用煮沸法從大腸桿菌和志賀菌菌液中提取全基因組DNA,具體操作為:從-80℃冰箱內取出大腸桿菌和志賀菌凍存保種管,置于4℃冰箱復溫5小時(4~6小時均可),超凈臺中用無菌接種環快速取菌液,以分段劃線法轉種于LB固體培養基平板上,37℃恒溫箱孵育21小時(18~24小時均可),挑取LB瓊脂平板上單菌落,接種于LB液體培養基中,37℃振蕩培養7小時(6~8小時均可),取1mL菌液于1.5mL的Eppdorf管中,轉速14000r/min下離心1分鐘,棄上清,加入超純水100μL,震蕩混勻,煮沸10min,轉速14000r/min下再次離心10分鐘,取上清,即得大腸桿菌和志賀菌基因組DNA,置于-20℃貯存備用。
(2)PCR引物設計與合成
根據大腸桿菌和志賀菌的特異序列基因設計引物,如下所示:
上游引物:5'-GTTATCAGCAACGCGCAAAA-3',
下游引物:5'-ACTGGATGCGATGATGGATA-3';
引物由上海生工生物工程有限責任公司合成,預期擴增產物長度為252bp。
(3)PCR擴增
參照PCR反應試劑盒(上海生工生物工程有限責任公司)產品說明,配制25μL反應體系:2×Taq PCR Master Mix(0.1U/μL Taq DNA Polymerase,2×PCR反應緩沖液,0.4mM dNTP,4mM MgSO4)12.5μL,8μmol/L上、下游引物各1μL,大腸桿菌或志賀菌基因組DNA 2μL,加滅菌超純水至25μL。
反應程序為:94℃預變性5min;94℃變性30s,52℃退火30s,72℃延伸30s,共32個循環;72℃繼續延伸10min。
(4)PCR擴增產物分析
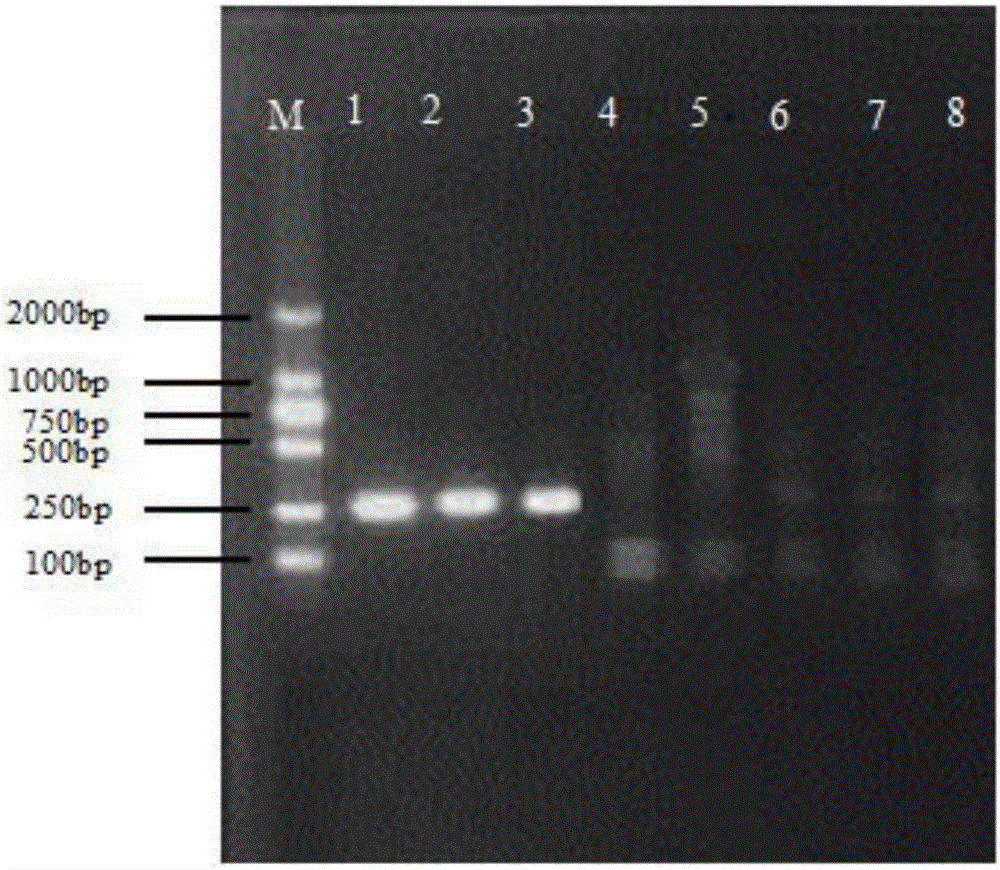
取5μL PCR擴增產物,于20g/L瓊脂糖凝膠中電泳,用DNA Marker DL2000作分子量標記,電壓5V/cm,電泳20min后,用凝膠圖像掃描儀進行分析,電泳結果見圖1(圖中M:DL2000 marker,1:大腸桿菌e2014001,2:大腸桿菌e2002002,3:志賀菌sh2014030)。
從圖1中可以看出,PCR擴增產物的長度與預期長度(252bp)符合,證實PCR擴增特異序列成功。
(5)PCR擴增產物測序鑒定
將PCR擴增產物交由生工生物工程(上海)股份有限公司進行測序,測序結果如SEQ ID NO.3所示。
試驗例2
模擬樣品的的檢測,包括以下步驟:
1)模擬樣品的制備
將10g全脂奶粉溶于90mL生理鹽水中,滅菌,然后分別加入8種細菌的菌液(8中細菌分別為:1:大腸桿菌e2014001,2:大腸桿菌e2002002,3:志賀菌sh2014030,4:沙門菌sa2014001,5:肺炎克雷伯桿菌kl2015001,6:銅綠假單胞菌pa2014002,7:檸檬酸桿菌cr2015001,8:金黃色葡萄球菌sau2014001),混勻作為樣品原液,放置2h;再吸取5mL混合液加入到45mL營養肉湯中,于37℃溫箱中培養,設置兩組平行對照,一組陰性對照,8h后各取10mL混合液進行檢測;
2)提取待檢測樣本的基因組DNA,利用上、下游引物進行PCR擴增,引物如下所示:
上游引物:5'-GTTATCAGCAACGCGCAAAA-3',
下游引物:5'-ACTGGATGCGATGATGGATA-3';
PCR擴增的反應體系為:2×Taq PCR Master Mix(0.1U/μL Taq DNA Polymerase,2×PCR反應緩沖液,0.4mM dNTP,4mM MgSO4)12.5μL,8μmol/L上、下游引物各1μL,10~20ng/μL細菌基因組DNA 2μL,滅菌超純水8.5μL,總計25μL;
PCR擴增的反應程序為:94℃預變性5min;94℃變性30s,52℃退火30s,72℃延伸30s,共32個循環;72℃繼續延伸10min;
3)PCR產物凝膠電泳分析,條件:2.0%瓊脂糖凝膠,電壓5V/cm,時間20min;在紫外燈下觀察結果(見圖2,圖中M:DL2000marker;1:大腸桿菌e2014001,2:大腸桿菌e2002002,3:志賀菌sh2014030,4:沙門菌sa2014001,5:肺炎克雷伯桿菌kl2015001,6:銅綠假單胞菌pa2014002,7:檸檬酸桿菌cr2015001,8:金黃色葡萄球菌sau2014001);
結果顯示:1~3出現與陽性對照相同的條帶,為疑似陽性,其他沒有出現特異性條帶或者條帶不一致;
4)回收疑似陽性的擴增產物,經測序均與SEQ ID NO.3所示序列相同。
對比例
本對比例采用API生化鑒定各種細菌,原理為:每種細菌具有各自獨特的酶系統,因而對底物的分解能力不同,其代謝產物也不同。用生物化學方法測定這些代謝產物,可用來區別和鑒定細菌的種類。
具體操作如下:
1)細菌分離和培養:在無菌操作臺中用灼燒過的無菌接種環蘸取少量樣本(同試驗例2),以三步劃線法接種在伊紅美藍培養皿上,放入隔水恒溫式培養箱中37℃過夜培養21小時(18~24小時均可),目標菌株為伊紅美藍培養基上顯示為黑色帶有金屬光澤或者只為黑色的單菌落;
2)革蘭染色:挑取疑似菌落進行革蘭染色,鏡下可見為紅色或粉紅色的桿狀細菌;
3)氧化酶試驗:在潔凈的載玻片上放置無菌濾紙片,移液器吸取少量滅菌生理鹽水,滴一滴至濾紙上,用灼燒過的接種環挑取單菌落涂在濾紙上,加一滴氧化酶試劑,迅速觀察濾紙的變化,如果1~2min內呈現深紫色為陽性反應,無變化為陰性,并將結果記錄于試紙條上;
4)API20E生化鑒定
a.分別準備一個培養盤和培養蓋,移液器轉移5mL滅菌生理鹽水于培養盤的蜂窩小凹中,將試紙條放入培養盤中,在培養盤側面記錄菌株編號;
b.用灼燒過的接種環挑取同一個菌落,加入試劑盒中配套的0.85%NaCl中,仔細研磨以得到均勻的細菌懸液;
c.用1mL移液器吸取細菌懸液加入并充滿CIT、VP、GEL管中,其余管中液體僅充滿管部即可,向ADH、LDC、URE、ODC、H2S中加入礦物油覆蓋,蓋上培養蓋,置于隔水恒溫培養箱中37℃培養21小時(18~24小時均可);
d.根據參考說明表判讀其結果;
e.在配套軟件中輸入結果即可得出細菌鑒定結果。
結果顯示為:1~2均為大腸桿菌,3~8依次為志賀菌、沙門菌、肺炎克雷伯桿菌、銅綠假單胞菌、檸檬酸桿菌和金黃色葡萄球菌。
序列表
SEQUENCE LISTING
<110> 鄭州大學、新鄉醫學院
<120> 基于特異序列的大腸桿菌和志賀菌檢測引物、試劑盒及檢測方法
<170> PatentIn version 3.5
<211> 20
<212> DNA
<213> 人工序列
<221> 上游引物
<222> (1)..(20)
<400> 1
GTTATCAGCA ACGCGCAAAA 20
<211> 20
<212> DNA
<213> 人工序列
<221> 下游引物
<222> (1)..(20)
<400> 2
ACTGGATGCG ATGATGGATA 20
<211> 252
<212> DNA
<213> 序列
<221> 特異序列
<222> (1)..(252)
<400> 3
GTTATCAGCA ACGCGCAAAA ACAGCCGCAT TCCCTGCGGG AAATAGCTGG CATGACGTAA 60
GACTGGATAA TCAACAGCAT ATTGATAAGG CACTTCCTGG AAGAATAGAA CGTCGCTGCC 120
GTGACGTTAT GCGGATAATG CTACCTCTGG TGAAGGAGTT GGCGAAGGCG TCTTGATGGG 180
TTTGAAAATG GGAGCTGGGT GTTCTACCGC AGGGGCGGGG AATTCTAAGT GATATCCATC 240
ATCGCATCCA GT 252
<211> 252
<212> DNA
<213> 序列
<221> 96%同源序列
<222> (1)..(252)
<400> 4
GTTATCAGCA ACGCGCAAAA ACACCTGCCT TCCCGGCGGG AAATAGCTGG CATGACGTAA 60
GACTGGATAA TCAACAACAT ATTGATAAGG CACTTCCTGG AAGAATAGAA CGTCGCTGCC 120
GTGACGTTAT GCGGATAATG CTACCGTTGG TGAAGGAGCT GGCGAAGGCG TCTTGATGGG 180
TTTGAAAATG GGAGCTGGGA GTTCTACCGC AGGGGCGGGG AATTCTAAGT GATACCCATC 240
ATCGCATCCA GT 252
- 還沒有人留言評論。精彩留言會獲得點贊!