核酸擴增的精度管理方法、精度管理用試劑及其試劑盒與流程
【
技術領域:
】本發明涉及核酸擴增的精度管理方法、精度管理用試劑及其試劑盒。
背景技術:
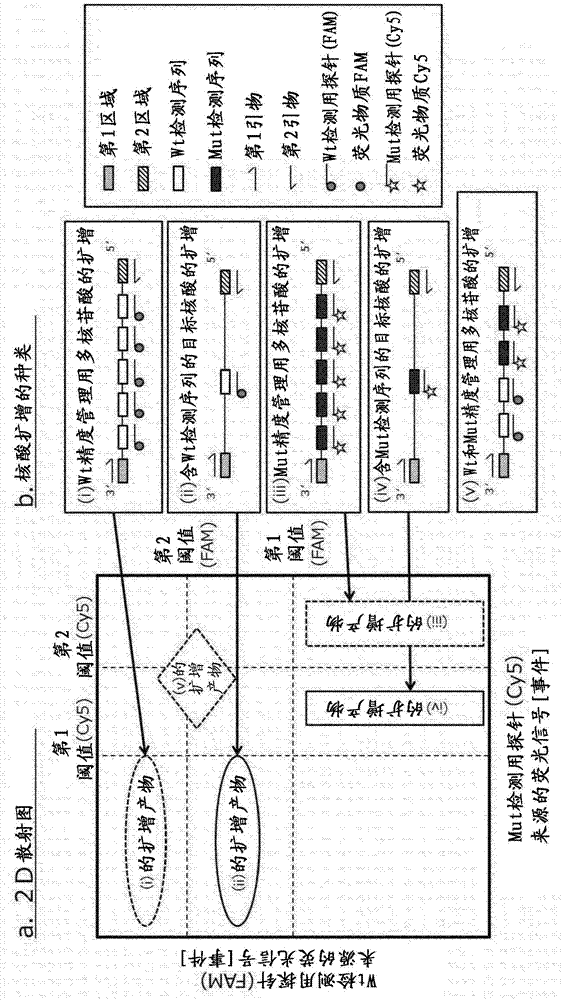
:在核酸擴增法中,有由聚合酶的擴增錯誤、由混雜物質等的擴增抑制、樣品調制時的誤操作等,由各種要因得不到適宜的結果的情況。因此,有對核酸擴增適宜地進行與否進行精度管理的必要。在appl.environ.mocrobiol.2001.67,3985-3993中公開有,有與目標核酸結合相同的引物組的區域,與檢測目標核酸的檢測用探針有結合不同的探針的區域的,對照多核苷酸。通過用檢測目標核酸的檢測用探針和檢測對照多核苷酸的探針標記不同的熒光染料,可在相同反應槽中同時區別檢測各自的擴增產物(第3986頁、右欄“primes,probes,andpcrassay”的項、及第3990頁、圖2)。技術實現要素:【發明要解決的技術課題】近年,作為檢測樣品中的成為目標的核酸分子(以下也稱為“目標核酸”)的方法,開發有數字核酸檢測。具體而言,在微孔或液滴等的隔區化的區域(以下也簡稱為“隔區”)中收容各1分子目標核酸,通過在各隔區中進行核酸擴增,高靈敏度地檢測核酸分子的方法。非專利文獻1中記載的方法被認為也能在數字核酸檢測法中應用,但為了在目標核酸和對照多核苷酸中使用不同的探針,難以評價用于檢測目標核酸的探針正常發揮功能與否。本發明人完成了在數字核酸檢測中適宜地使用的精度管理方法。即,本發明人發現,在數字核酸檢測中,在能結合與目標核酸相同的引物組的區域、能結合上述引物組的區域間,通過使用有與目標核酸不同的個數的寡核苷酸,可對能結合目標核酸檢測用探針的區域進行精度管理。【解決課題的技術方案】本發明的第1實施方式是核酸擴增的精度管理方法,其包括核酸檢測工序和判斷工序。上述核酸檢測工序包括:調制核酸樣品的工序,所述核酸樣品含目標核酸和精度管理用多核苷酸、調制含上述目標核酸一分子的隔區和含上述精度管理用多核苷酸一分子的隔區的工序、在上述各隔區中進行上述核酸樣品中所含的上述目標核酸或上述精度管理用多核苷酸的核酸擴增,使用檢測用探針檢測上述檢測用探針引發的信號的工序。在判斷工序中,基于上述信號檢測工序的結果,判斷上述核酸檢測工序適宜或不適宜。含上述目標核酸檢測序列。上述精度管理用多核苷酸是以下的(1)、(2)或(3)。(1)含以下第1區域、第2區域及第3區域的單鏈多核苷酸:上述第1區域含能結合目標核酸擴增用的第1引物的序列;上述第2區域含與能結合目標核酸擴增用的第2引物的序列互補的序列;及上述第3區域含檢測序列及與上述檢測序列互補的序列的任一方或兩方、(2)含與上述(1)的序列互補的序列的單鏈多核苷酸、(3)含上述(1)的多核苷酸和上述(2)的多核苷酸的雙鏈多核苷酸上述檢測用探針含與上述檢測序列互補的序列。上述(1)的精度管理用多核苷酸中的檢測序列和與上述檢測序列互補的序列的合計數與上述目標核酸中的檢測序列的數不同。【發明效果】由本發明提供數字核酸檢測法中的精度管理方法。【附圖說明】【圖1】顯示實施方式1涉及的核酸檢測工序的模式圖。【圖2】顯示實施方式2涉及的核酸擴增的種類(b)及檢測信號的2d散點圖(a)的模式圖。【圖3】顯示實施方式3涉及的核酸檢測工序的模式圖。【圖4】顯示實施方式4涉及的核酸檢測工序的模式圖。【圖5】顯示人kras基因的核酸擴增中的例示的精度管理方法的結果的2d散點圖。2d散點圖,在x軸顯示有精度管理用多核苷酸(wt,n=5)(+)的情況(a)及無(-)的情況(b)的反映變異型(mut)的kras基因來源的擴增產物的信號,在y軸顯示反映野生型(wt)的kras基因來源的擴增產物的信號。【圖6】在x軸顯示有精度管理用多核苷酸(mut,n=5)(+)的情況(a)及無(-)的情況(b)的反映變異型(mut)的kras基因來源的擴增產物的信號,在y軸顯示反映野生型(wt)的kras基因來源的擴增產物的信號的2d散點圖。【圖7】顯示向核酸擴增反應液中添加的精度管理用多核苷酸(a:wt,n=5、b:mut,n=5)的拷貝數和檢測信號強度的相關關系的分布圖。【圖8】顯示精度管理用多核苷酸中的檢測序列的數和檢測信號強度的相關關系的箱形圖。【圖9】在x軸顯示有精度管理用多核苷酸(wt,n=6)(+)的情況(a)及無(-)的情況(b)的反映變異型(mut)的kras基因來源的擴增產物的信號,在y軸顯示反映野生型(wt)的kras基因來源的擴增產物的信號的2d散點圖。【圖10】顯示1個實施方式涉及的精度管理用試劑盒的模式圖。【圖11】顯示1個實施方式涉及的目標核酸(a)及精度管理用多核苷酸(b)的模式圖。【實施方式】[精度管理方法]本發明的第1實施方式涉及包括核酸檢測工序和判斷工序的核酸擴增的精度管理方法。在第1實施方式的核酸檢測工序中,調制含目標核酸和精度管理用多核苷酸的核酸樣品。在1個實施方式中,核酸樣品調制工序通過將含目標核酸的樣品和含精度管理用多核苷酸的樣品混合,調制核酸樣品。在本說明書中,“核酸”是指dna或rna。核酸只要可核酸擴增,就不特別限定,可一部分或全部是核苷酸衍生物。作為核苷酸衍生物,可例示lockednucleicacid(lna),bridgednucleicacid(bna)等。“核酸樣品”只要含核酸的樣品,就不特別限定。作為核酸樣品,例如,可例示血液、淋巴細胞等的生物體樣品、尿、便等的排泄物、河川水、海水、土壤等的環境樣品等。核酸樣品由于通常是液狀,在樣品不是液狀時通過進行適宜預處理,優選作為液狀。其中,“液狀”的樣品不限于溶質完全地溶解的溶液,也含懸浮了細胞或細胞的碎片等的微細的固體物的懸浮液、溶膠等。預處理的方法選擇適宜公知的方法。例如,樣品是從生物體采集的組織時,通過在預處理液中破碎組織中的細胞、用離心分離等分離-除去破碎物,可調制核酸樣品。在本說明書中,“目標核酸”是有興趣對象的序列(以下也稱為“檢測序列”)。目標核酸不僅是核酸樣品中所含的核酸,也含擴增核酸樣品中的dna或rna的擴增產物(擴增子)或,從核酸樣品中的rna由逆轉錄反應合成的cdna等。目標核酸通常是生物來源或病毒來源的。本發明涉及的精度管理用多核苷酸可使用與可擴增含目標核酸中的檢測序列的區域的引物(以下也稱為“目標核酸擴增用引物”)相同的引物擴增。目標核酸擴增用引物組含第1目標核酸擴增用引物(以下也稱為“第1引物”)及第2目標核酸擴增用引物(以下也稱為“第2引物”)。在精度管理用多核苷酸中,將含能結合第1引物的序列的區域稱為第1區域,將含與能結合第2引物的序列互補的序列的區域稱為第2區域。在由上述目標核酸擴增用引物擴增的精度管理用多核苷酸的區域中,含檢測序列及與上述檢測序列互補的序列的任一方或其兩方。在精度管理用多核苷酸中,將含檢測序列及與上述檢測序列互補的序列的任一方或其兩方的區域稱為第3區域。精度管理用多核苷酸的第3區域中存在的檢測序列和與上述檢測序列互補的序列的合計數與由上述目標核酸擴增用引物擴增的上述目標核酸的區域中的檢測序列的數不同。由此,與精度管理用多核苷酸的擴增產物雜交的檢測用探針的數和與目標核酸的擴增產物雜交的檢測用探針的數變得不同。例如,含精度管理用多核苷酸的擴增產物的隔區或從珠發生的檢測用探針引發的信號的強度與含目標核酸的擴增產物的隔區或從珠發生的檢測用探針引發的信號強度變得不同。可區別含精度管理用多核苷酸的擴增產物的隔區或珠和含目標核酸的擴增產物的隔區或珠。當作為含上述第1區域、第2區域及第3區域的單鏈多核苷酸的精度管理用多核苷酸中的檢測序列和與上述檢測序列互補的序列的合計數比目標核酸中的檢測序列的數多時,含精度管理用多核苷酸的擴增產物的隔區或珠發生比含目標核酸的擴增產物的隔區或珠強的信號。當目標核酸中的檢測序列的數比上述精度管理用多核苷酸中的檢測序列和與上述檢測序列互補的序列的合計數更多時,含目標核酸的擴增產物的隔區或珠發生比含精度管理用多核苷酸的擴增產物的隔區或珠強的信號。以下,“檢測序列和與上述檢測序列互補的序列的合計數”是指作為含第1區域、第2區域及第3區域的單鏈多核苷酸的精度管理用多核苷酸中的檢測序列和與上述檢測序列互補的序列的合計數。精度管理用多核苷酸中的檢測序列和與上述檢測序列互補的序列的合計數不限定,但優選為比目標核酸中的檢測序列的數多至少1個。通常,由于目標核酸中的檢測序列的數是1,精度管理用多核苷酸中的檢測序列和與檢測序列互補的序列的合計數可設定為2以上。精度管理用多核苷酸中的檢測序列和與上述檢測序列互補的序列的合計數不限定,但可為20個以下,10個以下,優選為6個以下,也可為例如1個~10個、2個~10個、2個~6個。精度管理用多核苷酸不限定,但含至少2個檢測序列。精度管理用多核苷酸可為單鏈,也可為雙鏈。單鏈多核苷酸有容易制造,可廉價并且高純度地制造的益處。雙鏈多核苷酸可顯示比單鏈多核苷酸物理上穩定的傾向。本發明涉及的精度管理用多核苷酸可根據目的以單鏈形式提供,也可以雙鏈形式提供。精度管理用多核苷酸的鏈長不限定,但從調制的容易的觀點來看,可為1000bp以下,500bp以下,200bp以下。在1個實施方式中,精度管理用多核苷酸的鏈長是50bp以上200bp以下,80bp以上170bp以下,更優選為90bp以上160bp以下。精度管理用多核苷酸的鏈長和目標核酸的擴增產物的鏈長的差,例如,優選為在核酸擴增中有同等的擴增效率的范圍。在1個實施方式中,精度管理用多核苷酸在第3區域的上游含第1間隔子序列,在第3區域的下游含第2間隔子序列。在1個實施方式中,上述第1間隔子序列和上述第2間隔子序列是互相不同的序列,上述第1間隔子序列和上述第2間隔子序列不互補。其中,“第1間隔子序列和第2間隔子序列互相不同”是指與一方的序列完全地互補的序列在嚴格的條件下不與另一方的序列雜交。另外,“第1間隔子序列和第2間隔子序列不互補”是指這些序列不在嚴格的條件下雜交。當精度管理用多核苷酸中的檢測序列和與上述檢測序列互補的序列的合計數是2個以上時,精度管理用多核苷酸,例如在1個檢測序列和其他檢測序列之間,含進一步的間隔子序列。“進一步的間隔子序列”是與上述第1間隔子序列及上述第2間隔子序列各自不同的序列,上述第1間隔子序列及上述第2間隔子序列的各不互補。其中,進一步的關于間隔子序列的“序列互相不同的”及“序列不互補的”是與在上述的第1間隔子序列及第2間隔子序列中言及的“序列互相不同的”及“序列不互補的”同意義。進一步的間隔子序列的數可隨精度管理用多核苷酸的第3區域中存在的檢測序列及與上述檢測序列互補的序列的合計數增減。關于上述的“進一步的間隔子序列”的“序列互相不同”及“序列不互補”也適用于進一步的間隔子序列之間。各間隔子序列是相同或互補時,特別是,在核酸擴增反應的后半有間隔子序列與間隔子序列的互補鏈的雜交,或間隔子序列之間的雜交發生的可能性。為了降低此可能性,優選第1間隔子序列和第2間隔子序列互相不同,并且第1間隔子序列和第2間隔子序列不互補。對于進一步的間隔子序列也同樣。在1個實施方式中,上述間隔子序列的長度可為,例如,1bp以上20bp以下,1bp以上10bp以下,2bp以上10bp以下,3bp以上10bp以下,或者4bp以上10bp以下。為例示目的,1個實施方式涉及的精度管理用多核苷酸及目標核酸的模式圖示于圖11。圖11(a)顯示,擴增區域中的檢測序列的數是1的目標核酸。圖11(b)顯示雙鏈的精度管理用多核苷酸,上述精度管理用多核苷酸中的檢測序列和與上述檢測序列互補的序列的合計數是4。具體而言,上述精度管理用多核苷酸由含有含能結合第1引物的序列的第1區域;含與能結合第2引物的序列互補的序列的第2區域;及含2個檢測序列、含2個與上述檢測序列互補的序列的第3區域的多核苷酸和含與上述多核苷酸的序列互補的序列的多核苷酸構成。上述第3區域在第3區域的上游含第1間隔子序列,在第3區域的下游含第2間隔子序列。由于第3區域中的檢測序列和與上述檢測序列互補的序列的合計數是2以上,在檢測序列之間、在檢測序列和與上述檢測序列互補的序列之間、在與檢測序列互補的序列們之間含進一步的間隔子序列。在本說明書中,“雜交(hybridize)”或“雜交(hybridization)”是指堿基由氫鍵形成堿基對,形成雙鏈的核酸分子。檢測用探針和目標核酸的擴增產物的雜交,在序列和與其互補的序列之間有不形成堿基對的錯配時,以抑制或防止檢測用探針與具有有錯配的序列的核酸的雙鏈形成的程度在嚴格的條件下進行。在本說明書中,“嚴格的條件”是指進行多核苷酸的雜交時本領域技術人員一般使用的條件。嚴格的條件是某一單鏈多核苷酸和與所述單鏈多核苷酸有一定的互補性的別的單鏈多核苷酸雜交,基本上不與無互補性的單鏈多核苷酸雜交的條件。已知雜交時的嚴格度與溫度、鹽濃度、多核苷酸的鏈長、多核苷酸的gc含量、雜交緩沖液中的離液劑的濃度等相關。作為嚴格的條件,例如,參考sambrook,j.etal.(1998)molecularcloning:alaboratorymanual(2nded.),coldspringharborlaboratorypress,newyork中記載的條件,本領域技術人員可適宜設定。在核酸檢測工序中,在后述的隔區調制工序之前,也可進行樣品中的核酸的擴增(以下,此工序也稱為“預擴增工序”)。在樣品中的目標核酸是低濃度時等,通過在隔區調制工序之前擴增目標核酸,目標核酸的檢測可變得容易。預擴增工序中的核酸擴增的方法不特別限定。例如,可例示polymerasechainreaction(pcr)法、rt-pcr法、nucleicacidsequencebasedamplification(nasba)法、transcription-mediatedamplification(tma)法等。預擴增工序可在樣品調制工序前及/或樣品調制工序后進行。當預擴增工序在樣品調制工序后進行時,也由預擴增擴增了精度管理用多核苷酸。在第1實施方式的核酸檢測工序中,進行隔區調制工序。“隔區”,例如,可例示基板上的微孔或油相中的水性液滴等。具體而言,例示使用美國專利7842457號說明書或美國專利8048627號說明書中記載的方法調制的隔區。另外,也可為使用quantstudio(商標)3d數字pcr系統(thermofisherscientific公司)、q×200(商標)dropletdigital(商標)pcr解析系統(bio-rad公司)、biomark(商標)hdmx/hx系統(fluidigm公司)、raindrop系統(raindance公司)等市售的數字pcr裝置調制的隔區。通常使用比目標核酸或精度管理用多核苷酸的分子數大多數的隔區。由此,調制多個理論上每1隔區僅含一分子目標核酸或精度管理用多核苷酸的隔區。再者,目標核酸及精度管理用多核苷酸中的哪個都不含的隔區也調制多個。各隔區含有對于后述的核酸擴增必要的試劑。此試劑能由本領域技術人員適宜選擇通常含核酸擴增用的引物、dntps(datp、dctp、dgtp、及dttp或dutp)、聚合酶、緩沖劑等。引物也可固定在基板或珠等的固相載體上。在第1實施方式的核酸檢測工序中,在各隔區中進行核酸樣品中所含的核酸的核酸擴增。在隔區中存在目標核酸時,生成目標核酸的擴增產物。在隔區中存在精度管理用多核苷酸時,生成精度管理用多核苷酸的擴增產物。在該隔區內生成該擴增產物(本說明書中,也稱為“數字核酸擴增”)。核酸擴增的方法不限定,但可舉出pcr法、rt-pcr法、nasba法、tma法。在1個實施方式中,核酸擴增法是pcr。在核酸一分子水平的pcr也稱為數字pcr。作為數字pcr,可為例如,作為上述隔區使用液滴(droplets)的乳液pcr(以下也稱為“液滴型的數字pcr”)、或者使用反應孔的數字pcr(以下也稱為“孔型的數字pcr”)。pcr可進行例如(1)熱變性、(2)退火、(3)延伸的3步驟,也可以(2)在相同的溫度條件下進行退火或雜交和(3)延伸,(1)熱變性、(2’)退火和延伸的2步驟進行。各工序的條件適宜設定。各步驟的溫度變化,例如,可使用veriti熱循環儀(appliedbiosystems公司)等的熱循環儀自動控制。在第1實施方式的核酸檢測工序中,進行使用檢測用探針的信號檢測工序。在1個實施方式涉及的信號檢測工序中,首先檢測用探針和擴增產物在嚴格的條件下雜交。在檢測到顯示檢測序列的存在的信號時判斷為有含檢測序列的擴增產物。在檢測不到顯示檢測序列的存在的信號時判斷為無含檢測序列的擴增產物。“檢測用探針”包括含與檢測序列互補的序列的寡核苷酸。也可使用多種檢測用探針。例如,在分析目標序列的核苷酸的有無變異時,可使用與變異型的序列雜交的檢測用探針(以下也稱為“變異型檢測用探針”)和與野生型的序列雜交的檢測用探針(以下也稱為“野生型檢測用探針”)。這些檢測用探針發生互相不同的種類的信號。在一例中,變異型檢測用探針引發的熒光波長和野生型檢測用探針引發的熒光波長不同。通過何波長以何程度被檢測,可分析目標序列的有無變異。在本發明中使用的檢測用探針可為預先用標記物質標記的寡核苷酸,或者也可為非標記的寡核苷酸。從檢測靈敏度的觀點來看,優選使用標記的寡核苷酸。作為標記物質,可例示熒光物質、酶、半抗原等。在本說明書中,預先標記化的檢測用探針也稱為“標記化檢測用探針”。作為標記物質使用熒光物質時,作為信號可檢測到熒光。作為熒光物質,可舉出熒光素、若丹明、德克薩斯紅、四甲基若丹明、羧基若丹明、藻紅蛋白、6-fam(商標)、cy(注冊商標)3、cy(注冊商標)5、alexafluor(注冊商標)的系列等。作為標記物質使用酶時,使之與所述酶的底物反應,通過生成發生發光等的信號的反應產物,可檢測到信號。作為標記物質使用半抗原時,經特異性地結合于所述半抗原的物質使酶或熒光物質結合于檢測用探針。由此,可檢測到熒光或發光等的信號。再者,作為特異性地結合于半抗原的物質,可舉出抗半抗原抗體。另外,作為半抗原使用生物素時可使用親和素類(親和素、鏈霉親和素等)。由于認為對于標記化檢測用探針和含檢測序列的核酸的雜交的標記物質的影響(例如立體障礙)小,標記化檢測用探針中的標記物質優選在其5’末端及/或3’末端標記化(修飾)。檢測用探針可含追加到與檢測序列互補的序列的5’末端及/或3’末端的序列。標記化檢測用探針含追加到與檢測序列互補的序列的5’末端及/或3’末端的序列,其5’末端及/或3’末端也可被標記物質標記化。在這樣的標記化檢測用探針中,認為與不含追加的序列而其5’末端及/或3’末端用標記物質標記化的標記化檢測用探針相比,標記物質對標記化檢測用探針和含檢測序列的核酸的雜交的影響更得變小。上述追加的序列可為標記化檢測用探針與含檢測序列的核酸雜交時面對的序列,和其一部分或全部是不形成堿基對的非互補的序列,也可為其全部是形成堿基對的互補的序列。在1個實施方式中,標記化檢測用探針的5’末端由標記物質標記化。在別的實施方式中,檢測用探針是非標記的寡核苷酸。使用非標記的寡核苷酸時,可通過使用嵌入劑等進行熒光物質信號檢測。在其他實施方式中,作為標記物質,也可使用熒光物質和猝滅劑物質的組合。使用這樣2種標記物質時,例如,可在檢測用探針的5’末端標記化熒光物質及猝滅劑物質的任一方,在其3’末端標記化另一種標記物質。作為用2種標記物質標記化的檢測用探針,例如,可舉出taqman(商標)探針、分子信標等。這些探針是公知的,在多種刊物、專利文獻及其他文獻中有記載。例如,對于taqman(商標)探針,可參照例如美國專利第5538848號,對于分子信標,可參照例如美國專利第5925517號,這些公開內容通過引用并入本說明書中。在本說明書中,“猝滅劑物質”是指有降低或消光熒光的作用的物質。檢測用探針引發的信號的檢測不限定,但由對于檢測來自可多數(例如,數千萬個)存在的隔區或珠(參照后述的實施方式1)的信號適宜的檢測器實施。作為檢測器不限定,但可使用顯微鏡、流式細胞儀、像傳感器等。“流式細胞儀”是向流動池中的粒子(例如,珠)或隔區(例如,液滴)照射激發光,通過取得從每個粒子或隔區發出的熒光等的光學信息,可對粒子進行計數的裝置。流式細胞儀可在短時間內測定多數的粒子或隔區,從而優選。使用顯微鏡或像傳感器時,可對視野攝像,使用攝像的數據檢測每種珠或隔區。使用珠時,珠可靜止,也可流動。根據信號的種類,可使用熒光顯微鏡等。在維持隔區調制工序中調制的隔區的情況下進行信號檢測時,在隔區調制工序或其之前的工序中檢測用探針被添加到反應系統中。一方面,在向珠等固定化擴增產物時,也可在維持隔區的情況下進行信號檢測,可在信號檢測前從隔區取出珠而分散到水性溶劑中。信號檢測前從隔區取出珠的方法不特別限定。例如,將油相中的水性液滴作為隔區時,可除去油相而將液相分散于水性溶劑中。另外,在將含珠的孔作為隔區時,可清洗各孔而取出各孔中收容的珠,分散到水性溶劑中。在從隔區取出珠時,可在隔區調制工序中將檢測用探針添加到反應系統中,也可在取出珠之后使檢測用探針雜交于擴增產物。在第1實施方式的判斷工序中,基于信號檢測工序的結果,判斷上述核酸檢測工序適宜或不適宜。其中,對于從隔區發生信號時的例進行說明。在判斷工序中,首先判斷各隔區是生成核酸的擴增產物的隔區與否。檢測到信號的隔區(陽性隔區)判斷為生成核酸的擴增產物的隔區,檢測不到信號的隔區(陰性隔區)判斷為未生成核酸的擴增產物的隔區。在陽性判斷時,優選比較指定的閾值和從隔區檢測的信號強度(陽性判斷中使用的閾值也稱為“第1閾值”)。孔等的固相載體有時有其自體原本信號(例如自身熒光)。例如,當孔含珠,其珠自體有自身熒光時,作為信號從孔檢測到微弱的熒光。為了將這樣的隔區判斷為陰性隔區,使用上述的第1閾值。由于目標核酸的擴增產物引發的熒光強度與精度管理用多核苷酸的擴增產物引發的熒光強度不同,為了區別這些可使用第2閾值。第2閾值成為比第1閾值高的值。在精度管理用多核苷酸的擴增產物引發的熒光強度比目標核酸的擴增產物引發的熒光強度大時,可將第1閾值以上不足第2閾值的陽性隔區(以下也稱為“第1陽性隔區”)判斷為生成目標核酸的擴增產物的隔區。可將第2閾值以上的陽性隔區(以下也稱為“第2陽性隔區”)判斷為生成精度管理用多核苷酸的擴增產物的隔區。另外,也可將檢測不到信號的隔區(陰性隔區)判斷為未生成核酸的擴增產物的隔區。當信號不足第1閾值時可判斷為陰性隔區。當使用固定化引物的珠,檢測從珠發出的信號時,可從隔區取出珠,不是每隔區,而是珠每進行陽性-陰性的判斷。此時,也可與上述的隔區的陽性-陰性的判斷同樣地進行珠的陽性-陰性的判斷。即,可將第1閾值以上不足第2閾值的珠判斷為第1陽性珠,將第2閾值以上的珠判斷為第2陽性珠。再者,也可將發生不足第1閾值的信號的珠判斷為陰性珠。當使用流式細胞儀檢測從珠發出的信號時,使從隔區取出的珠流過流動池,檢測到從各珠發出的信號。此時,也可制成標繪各珠的信號強度的2維散點圖(以下也稱為“2d散點圖”),在散點圖上識別第1陽性珠的群集及第2陽性珠的群集,進行第1陽性珠及第2陽性珠的判斷。不管有無珠,在使隔區自體流過流動池而進行信號檢測時也是同樣。接下來,基于在判斷工序中陽性隔區或陽性珠的判斷結果,判斷上述核酸檢測工序適宜或不適宜。例如,對第2陽性隔區的個數進行計數,在計數結果在第3閾值以上時,可判斷核酸檢測工序適宜。由于在計數結果不足第3閾值時認為精度管理用多核苷酸不正常擴增,可判斷核酸檢測工序不適宜。另外,雖然在此例中進行第2陽性隔區的計數及計數結果和閾值的比較,但使用從第2陽性隔區發生的熒光強度的總和或發生熒光的面積的總和等也可進行同樣的判斷。另外,使用珠時也可進行同樣的判斷。第1閾值及第2閾值可由標記物質的種類或信號的強度等適宜設定。可使用多個核酸樣品預先檢測陽性隔區或陽性珠變成何程度的信號強度設定為可最高精度分類陰性和第1陽性和第2陽性的閾值。第3閾值可基于核酸樣品中的精度管理用多核苷酸的濃度(拷貝數)等適宜設定。[變異檢測中的精度管理]本發明的第1實施方式涉及的核酸擴增的精度管理方法能適用于目標核酸的變異檢測中的精度管理方法。從而,第1實施方式之一的實施方式是目標核酸的變異檢測中的精度管理方法。再者,在本說明書中,“變異”是指在核酸的堿基序列中與一般被識別為野生型的序列不同。例如,可舉出核酸中的核苷酸的取代、缺失、附加、染色體轉座等。更具體而言,可例示突變或單核苷酸多態性(snp)等。在變異檢測中,目標核酸被檢測為變異型核酸或野生型核酸。為了變異檢測,在目標核酸的擴增產物中使用與變異型核酸雜交的檢測用探針和與野生型核酸雜交的檢測用探針,由哪個雜交來判斷是變異型或野生型。在變異型的目標核酸中含變異型的檢測序列(以下也稱為“mut檢測序列”),在野生型的目標核酸中含野生型的檢測序列(以下也稱為“wt檢測序列”)。以下,作為本發明的一實施方式,對于目標核酸的變異檢測中的精度管理方法進行說明。此實施方式的方法包括核酸檢測工序和判斷工序。核酸檢測工序與上述同樣、包括核酸樣品的調制工序、隔區的調制工序、核酸擴增工序及信號檢測工序。在此實施方式涉及的核酸樣品的調制工序中,例如,通過將含目標核酸的樣品和含精度管理用多核苷酸的樣品混合,調制核酸樣品。作為精度管理用多核苷酸,使用mut檢測序列的檢測涉及的精度管理用多核苷酸(以下也稱為“mut精度管理用多核苷酸”)及wt檢測序列的檢測涉及的精度管理用多核苷酸(以下也稱為“wt精度管理用多核苷酸”)的任一方或兩方。mut精度管理用多核苷酸含結合后述的變異型檢測用探針的mut檢測序列及與mut檢測序列互補的序列的任一方或兩方。因此,mut精度管理用多核苷酸的擴增產物與變異型檢測用探針結合,發生變異型檢測用探針引發的信號。wt精度管理用多核苷酸含結合后述的野生型檢測用探針的wt檢測序列及與wt檢測序列互補的序列的任一方或兩方。因此,wt精度管理用多核苷酸的擴增產物與野生型檢測用探針結合,發生野生型檢測用探針引發的信號。在將后述的僅變異型檢測用探針作為檢測用探針使用時,優選使用至少mut精度管理用多核苷酸。當作為檢測用探針使用變異型檢測用探針及野生型檢測用探針的兩方時,使用mut精度管理用多核苷酸及wt精度管理用多核苷酸的任一方或兩方。與上述的精度管理用多核苷酸相關的其他特征也適用于mut精度管理用多核苷酸、wt精度管理用多核苷酸。此實施方式的隔區調制工序、核酸擴增工序及信號檢測工序如關于第1實施方式在上所述實施。作為檢測用探針使用含與mut檢測序列互補的序列的變異型檢測用探針。當目標核酸含變異時,由于變異型檢測用探針結合于目標核酸的擴增產物,檢測到變異型檢測用探針引發的信號。作為檢測用探針也優選使用還含與wt檢測序列互補的序列的野生型檢測用探針。變異型檢測用探針引發的信號與野生型檢測用探針引發的信號是互相不同的種類。例如,作為野生型檢測用探針,可使用標記fam的寡核苷酸,作為變異型檢測用探針,可使用標記cy5的寡核苷酸。關于野生型檢測用探針及變異型檢測用探針的特征也適用于這些變異型檢測用探針、野生型檢測用探針。在此實施方式的信號檢測工序中,進行檢測用探針引發的信號的檢測。在使用變異型檢測用探針和野生型檢測用探針時,檢測到變異型檢測用探針引發的信號和野生型檢測用探針引發的信號。在此實施方式的判斷工序中,基于信號檢測工序的結果,判斷有無變異和上述核酸檢測工序適宜或不適宜。其中,首先,作為檢測用探針,對于僅使用變異型檢測用探針的例進行說明。在此例中,在核酸樣品的調制工序中調制的核酸樣品含目標核酸和mut精度管理用多核苷酸和珠。在核酸擴增工序中,可得到結合了目標核酸的擴增產物的珠和結合了mut精度管理用多核苷酸的擴增產物的珠。其中,在信號檢測工序之前從隔區取出珠。在將從隔區取出的珠分散到水性介質之后,加變異型檢測用探針。在判斷工序中,如上所述,首先,判斷各珠是結合核酸的擴增產物的珠與否。目標核酸的擴增產物及精度管理用多核苷酸的擴增產物和檢測用探針的雜交在嚴格的條件下進行。從結合了含mut檢測序列的目標核酸的擴增產物的珠、結合了mut精度管理用多核苷酸的擴增產物的珠得到了變異型檢測用探針引發的信號。一方面,從結合了含wt檢測序列的目標核酸的擴增產物的珠得不到變異型檢測用探針引發的信號。檢測不到變異型檢測用探針引發的信號的珠(陰性珠)被判斷為未結合核酸的擴增產物的珠及結合了含wt檢測序列的目標核酸的擴增產物的珠的任何。檢測到變異型檢測用探針引發的信號的珠(陽性珠)被判斷為結合了含mut檢測序列的核酸的擴增產物的珠。在此陽性判斷中,如上所述,也可使用與信號強度相關的閾值(第1閾值)。如上所述,基于目標核酸的擴增產物的信號強度和基于精度管理用多核苷酸的擴增產物的信號強度不同。也可使用用于區別這些的第2閾值。當基于mut精度管理用多核苷酸的擴增產物的信號強度比基于含mut檢測序列的目標核酸的擴增產物的信號強度大時,可將第1閾值以上不足第2閾值的陽性珠(以下也稱為“第1陽性珠”)判斷為結合了含mut檢測序列的目標核酸的擴增產物的珠。可將第2閾值以上的陽性珠(以下也稱為“第2陽性珠”)判斷為結合了mut精度管理用多核苷酸的擴增產物的珠。在判斷工序中,進行目標核酸中的有無變異的判斷。在有無變異的判斷中,例如,對第1陽性珠的個數進行計數,在其計數結果在第3閾值以上時,可判斷為有變異(陽性)。對第1陽性珠的個數進行計數,其計數結果不足第3閾值時,可判斷為無變異(陰性)。在此例中進行第1陽性珠的計數結果和閾值的比較,但使用從第1陽性珠發生的熒光強度的總和等也可進行同樣的判斷。另外,在此例中,雖從隔區取出珠,但可在將珠保持在隔區的情況下,基于從隔區發出的信號檢測的結果進行同樣的判斷。也可不使用珠而進行核酸樣品的調制工序、隔區的調制工序、核酸擴增工序,接下來,維持隔區地進行信號檢測工序,基于從隔區發出的信號檢測的結果進行同樣的判斷工序。接下來,在判斷工序中,判斷核酸檢測工序適宜或不適宜。例如,對第2陽性珠的個數進行計數。在其計數結果在第3閾值以上時,可判斷上述核酸檢測工序適宜。在第2陽性珠的個數的計數結果不足第3閾值時,可判斷上述核酸檢測工序不適宜。對應于珠的個數的第3閾值可由核酸樣品中的精度管理用多核苷酸的濃度(拷貝數)等適宜設定。在判斷核酸檢測工序適宜時,可判斷目標核酸中的有無變異的判斷結果有信賴性。在判斷核酸檢測工序不適宜時,可判斷目標核酸中的有無變異的判斷結果缺信賴性。此時,目標核酸中的變異檢測的判斷結果,即陽性及陰性各自可判斷為有假陽性及假陰性的可能性。如此,由第1實施方式之一的實施方式,對目標核酸的變異檢測的判斷結果可提供懷疑假陽性或假陰性的結果。由此,可提高目標核酸的變異檢測的精度。而且,在判斷核酸檢測工序不適宜時,預測核酸檢測工序的任何工序不適宜。從而,由此實施方式,可通過提供核酸檢測工序不適宜的判斷結果,適宜驗證其目標核酸的變異檢測中的不適宜的工序。接下來,對于在判斷工序中使用變異型檢測用探針和野生型檢測用探針的例進行說明。在此例中,用核酸樣品的調制工序調制的核酸樣品含目標核酸、mut精度管理用多核苷酸和wt精度管理用多核苷酸和珠。在核酸擴增工序中,得到結合了目標核酸的擴增產物的珠、結合了mut精度管理用多核苷酸的擴增產物的珠和結合了wt精度管理用多核苷酸的擴增產物的珠。在信號檢測工序之前從隔區取出珠。在將從隔區取出的珠分散到水性介質之后,加變異型檢測用探針及野生型檢測用探針。雖從結合了含mut檢測序列的目標核酸的擴增產物的珠、結合了mut精度管理用多核苷酸的擴增產物的珠得到變異型檢測用探針引發的信號,但得不到野生型檢測用探針引發的信號。同樣地,從結合了含wt檢測序列的目標核酸的擴增產物的珠、wt精度管理用多核苷酸的擴增產物得到野生型檢測用探針引發的信號,但得不到變異型檢測用探針引發的信號。可將變異型檢測用探針引發的信號及野生型檢測用探針引發的信號都檢測不到的珠(陰性珠)判斷為未結合核酸的擴增產物的珠。檢測到變異型及野生型檢測用探針的任一方引發的信號,檢測不到另一方引發的信號的珠(陽性珠)可判斷為結合了核酸的擴增產物的珠。在此陽性判斷中,如上所述,也可使用與信號強度相關的閾值(第1閾值)。即,作為與野生型檢測用探針引發的信號強度比較的第1閾值也可使用“第1閾值(wt)”。另外,作為與變異型檢測用探針引發的信號強度比較的第1閾值,也可使用“第1閾值(mut)”。如上所述,基于目標核酸的擴增產物的信號強度和基于精度管理用多核苷酸的擴增產物的信號強度不同。用于區別這些的第2閾值可用于各檢測用探針引發的信號。即,作為關于野生型檢測用探針引發的信號強度的第2閾值,可使用“第2閾值(wt)”。作為關于變異型檢測用探針引發的信號強度的第2閾值,可使用“第2閾值(mut)”。對應于各信號的第2閾值各自成為比第1閾值高的值。以下在此例中,對于基于mut精度管理用多核苷酸的擴增產物的信號強度比基于含mut檢測序列的目標核酸的擴增產物的信號強度大,基于wt精度管理用多核苷酸的擴增產物的信號強度比基于含wt檢測序列的目標核酸的擴增產物的信號強度大的情況進行說明。可將第1閾值(mut)以上不足第2閾值(mut)且不足第1閾值(wt)的陽性珠(以下也稱為“第1陽性珠(mut)”)判斷為結合了含mut檢測序列的目標核酸的擴增產物的珠。可將第2閾值(mut)以上且不足第1閾值(wt)的陽性珠(以下也稱為“第2陽性珠(mut)”)判斷為結合了mut精度管理用多核苷酸的擴增產物的珠。可將第1閾值(wt)以上第2閾值(wt)不足且不足第1閾值(mut)的陽性珠(以下也稱為“第1陽性珠(wt)”)判斷為結合了含wt檢測序列的目標核酸的擴增產物的珠。可將第2閾值(wt)以上且不足第1閾值(mut)的陽性珠(以下也稱為“第2陽性珠(wt)”)判斷為結合了wt精度管理用多核苷酸的擴增產物的珠。在判斷工序中,如上所述,進行有無變異的判斷。在有無變異的判斷中,例如,可以在目標核酸的濃度(全拷貝數)之中,僅哪個濃度(拷貝數)的目標核酸含mut檢測序列(即,含mut檢測序列的目標核酸的拷貝數對目標核酸的全拷貝數的比例:(含mut檢測序列的目標核酸的拷貝數)/(目標核酸的全拷貝數))作為指標進行判斷。此比例通過用第1陽性珠(mut)的個數和第1陽性珠(wt)的個數的合計數除以第1陽性珠(mut)的個數來算出(=(第1陽性珠(mut)的個數)/[(第1陽性珠(mut)的個數+(第1陽性珠(wt)的個數)])。當算出的比例在對應于此比例的第3閾值以上時,可判斷為有變異(陽性)。當此比例不足指定的閾值時,可判斷為無變異(陰性)。作為判斷的指標,不限于此,如上所述,當第1陽性珠(mut)的個數在對應于珠的個數的第3閾值以上時可判斷為有變異(陽性),在不足上述第3閾值時可判斷為無變異(陰性)。在判斷工序中,判斷核酸檢測工序適宜或不適宜。例如,對第2陽性珠(mut)的個數及第2陽性珠(wt)的個數各自進行計數。在第2陽性珠(mut)的計數結果不足第3閾值(mut)或第2陽性珠(wt)的計數結果不足第3閾值(wt)時,可判斷為核酸檢測工序不適宜,可判斷為有無變異的檢測結果信賴性低。此時,可將有無變異的檢測結果記為“信賴性低”而輸出,也可不輸出。當第2陽性珠(mut)的計數結果是第3閾值(mut)以上,并且第2陽性珠(wt)的計數結果是第3閾值(wt)以上時,可判斷核酸檢測工序適宜,可賦予有無變異的檢測結果信賴性。另外,當第2陽性珠(mut)的計數結果不足對應于第2陽性珠(mut)的第3閾值時,可判斷關于含mut檢測序列的目標核酸的核酸檢測工序不適宜。由此,可判斷為目標核酸中的有無變異的判斷結果缺信賴性。此時,可判斷為目標核酸中的變異檢測的判斷結果,即陽性及陰性各自有假陽性及假陰性的可能性。如上所述,根據需要,也可進行用于驗證核酸檢測工序的任何的工序不適宜的追試。在上述例中,雖從隔區取出珠,但可在將珠保持在隔區的情況下,基于從隔區發出的信號檢測的結果進行同樣的判斷。另外,也可不使用珠而進行核酸樣品的調制工序、隔區的調制工序、核酸擴增工序,接下來,維持隔區地進行信號檢測工序,基于從隔區發出的信號檢測的結果同樣地進行判斷工序。雖在上述的變異檢測的精度管理方法中使用2種精度管理用多核苷酸,但在其中,對于可使用1種精度管理用多核苷酸,實施變異檢測的精度管理方法的例進行說明。此例中的精度管理用多核苷酸在第3區域含wt檢測序列及與上述檢測序列互補的序列的任一方或其兩方,并且含mut檢測序列及與上述檢測序列互補的序列的任一方或其兩方(以下也稱為“wt和mut精度管理用多核苷酸”)。在此例中,用核酸樣品的調制工序調制的核酸樣品含目標核酸、wt和mut精度管理用多核苷酸和珠。在核酸擴增工序中,可得到結合了目標核酸的擴增產物的珠和結合了wt和mut精度管理用多核苷酸的擴增產物的珠。其中,在信號檢測工序之前從隔區取出珠。在將從隔區取出的珠分散到水性介質之后,加變異型檢測用探針及野生型檢測用探針。在此實施方式中的檢測工序中,與上述同樣地,從結合了目標核酸的擴增產物的珠取得同樣的信號。wt和mut精度管理用多核苷酸含wt檢測序列和mut檢測序列的兩方。從而,使wt和mut精度管理用多核苷酸的擴增產物和檢測用探針在嚴格的條件下雜交,則可得到變異型檢測用探針引發的信號和野生型檢測用探針引發的信號。檢測不到變異型檢測用探針引發的信號,并且檢測不到野生型檢測用探針引發的信號的珠(陰性珠)被判斷為未結合核酸的擴增產物的珠。檢測到變異型檢測用探針和野生型檢測用探針引發的兩方的信號的珠被判斷為結合了wt和mut精度管理用多核苷酸的擴增產物的珠(以下也稱為“wt和mut陽性珠”)。在此陽性判斷中,如上所述,也可使用與信號強度相關的閾值(第1閾值)。即,作為與野生型檢測用探針引發的信號強度比較的第1閾值,可使用“第1閾值(wt)”。另外,作為與變異型檢測用探針引發的信號強度比較的第1閾值,可使用“第1閾值(mut)”。wt和mut精度管理用多核苷酸的擴增產物中的wt檢測序列和與上述檢測序列互補的序列的合計數與含wt檢測序列的目標核酸的擴增產物中的wt檢測序列和與上述檢測序列互補的序列的合計數不同。同樣地,wt和mut精度管理用多核苷酸的擴增產物中的mut檢測序列和與上述檢測序列互補的序列的合計數與含mut檢測序列的目標核酸的擴增產物中的mut檢測序列和與上述檢測序列互補的序列的合計數不同。從而,基于目標核酸的擴增產物的各檢測用探針引發的信號強度和基于wt和mut精度管理用多核苷酸的擴增產物的各檢測用探針引發的信號強度不同。用于區別這些各信號強度的差異的第2閾值可用于各檢測用探針引發的信號。即,作為關于野生型檢測用探針引發的信號強度的第2閾值,可使用“第2閾值(wt)”。作為關于變異型檢測用探針引發的信號強度的第2閾值,可使用“第2閾值(mut)”。對應于各信號的第2閾值各自成為比第1閾值高的值。以下在此例中,對于基于wt和mut精度管理用多核苷酸的擴增產物的信號強度比基于含wt檢測序列的目標核酸的擴增產物的信號大,并且基于wt和mut精度管理用多核苷酸的擴增產物的信號強度比基于含mut檢測序列的目標核酸的擴增產物的信號強度大的情況進行說明。可將第1閾值(mut)以上不足第2閾值(mut)且不足第1閾值(wt)的陽性珠(第1陽性珠(mut))判斷為結合了含mut檢測序列的目標核酸的擴增產物的珠。可將第1閾值(wt)以上第2閾值(wt)不足且不足第1閾值(mut)的陽性珠(第1陽性珠(wt))判斷為結合了含wt檢測序列的目標核酸的擴增產物的珠。可將是第2閾值(wt)以上,并且,第2閾值(mut)以上的陽性珠(以下也稱為“第2陽性珠(wt和mut)”)判斷為結合了wt和mut精度管理用多核苷酸的擴增產物的珠(wt和mut陽性珠)。在判斷工序中,與上述實施方式同樣地,判斷有無變異。例如,在第1陽性珠(mut)的個數對應于第1陽性珠(mut)的個數的第3閾值以上時判斷為有變異(陽性),在不足上述第3閾值時可判斷為無變異(陰性)。另外,如上所述,也可以在目標核酸的濃度(全拷貝數)之中,僅哪個濃度(拷貝數)的目標核酸含mut檢測序列作為指標判斷有無變異。這些是例示,判斷有無變異的方法不限于此。在判斷工序中,判斷上述核酸檢測工序適宜或不適宜。使用1種wt和mut精度管理用多核苷酸的精度管理方法中的判斷工序和使用上述的wt精度管理用多核苷酸和mut精度管理用多核苷酸這2種的精度管理方法中的判斷工序除下述情況外,同樣地進行。在使用上述的wt精度管理用多核苷酸和mut精度管理用多核苷酸這2種的精度管理方法中,從第2陽性珠(wt)判斷關于含wt檢測序列的目標核酸的核酸檢測工序適宜或不適宜。另外,從第2陽性珠(mut)判斷關于含mut檢測序列的目標核酸的核酸檢測工序適宜或不適宜。即,在使用2種精度管理用多核苷酸時,基于2種陽性珠,判斷與含wt檢測序列的目標核酸相關的核酸檢測工序和與含mut檢測序列的目標核酸相關的核酸檢測工序適宜或不適宜。與此相比,作為精度管理用多核苷酸,在使用1種wt和mut精度管理用多核苷酸的精度管理方法中,從1種陽性珠(wt和mut陽性珠),判斷與含wt檢測序列的目標核酸相關的核酸檢測工序和與含mut檢測序列的目標核酸相關的核酸檢測工序適宜或不適宜。例如,對wt和mut陽性珠的個數進行計數。當其計數結果在對應于wt和mu陽性珠的個數的第3閾值以上時,可判斷為核酸檢測工序適宜。當wt和mut陽性珠的個數的計數結果不足對應于wt和mut陽性珠的個數的第3閾值時,可判斷為核酸檢測工序不適宜。在判斷為核酸檢測工序不適宜時,假定含核酸樣品的調制工序、隔區的調制工序、核酸擴增工序及信號檢測工序的核酸檢測工序的哪個工序不適宜。哪個工序不適宜,如上所述,可通過進行追試等來進行適宜驗證。在使用1種wt和mut精度管理用多核苷酸的精度管理方法中,也與使用上述的2種精度管理用多核苷酸的精度管理方法同樣地,對目標核酸的變異檢測的判斷結果給使有信賴性或缺信賴性的判斷成為可能的結果。接下來,參照附圖,對于本發明之一的實施方式涉及的實施方式進行說明。再者,以下的說明全部旨在例示而非限制,不以任何方式限定隨附的專利權利要求中記載的發明。[實施方式1]圖1是顯示實施方式1涉及的核酸檢測工序的模式圖。在實施方式1中,向油相中的水性液滴封入珠而進行數字pcr,進行核酸檢測。本實施方式中使用的“珠”的材質不特別限定。可使用金屬制粒子、樹脂制粒子等。作為金屬制粒子的材質的具體例,可例示金、銀、銅、鐵、鋁、鎳、錳、鈦、這些的氧化物等。另外,也可為這些的合金。作為樹脂制粒子的材質的具體例,可例示聚苯乙烯、乳膠等。也可使珠帶磁性(以下也稱為“磁性珠”)。首先,調制含目標核酸、精度管理用多核苷酸、在表面結合目標核酸擴增用引物組之中的一方的引物的珠和對于此外的核酸擴增必要的試劑的核酸樣品(圖1(i))。實施方式1中使用的目標核酸含1個檢測序列(n=1),精度管理用多核苷酸含2個檢測序列(n=2)。將作為水相的核酸樣品、油相、及乳化劑混合,由攪拌等形成多個油相中的水性液滴(隔區)(圖1(ii))。由于此水性液滴比目標核酸或精度管理用多核苷酸的拷貝數大過量形成,從而在理論上單一的水性液滴中含精度管理用核酸一分子或目標核酸一分子。另外,由于水性液滴數還比珠數大過量形成,理論上變得在單一的水性液滴中含1個珠。通常,在數字pcr中,形成數千萬個液滴,在其中的0.1~1%左右含目標核酸一分子或精度管理用多核苷酸一分子和1個結合了引物的珠(圖1(ii)(b)、(c))。在此外的液滴中通常缺少任何的成分(圖1(ii)(a1)~(a4))、在珠上的核酸擴增不進行(圖1(iii)(a1)~(a4))。通過對水性液滴集團實施pcr法,在含目標核酸一分子或精度管理用多核苷酸一分子和結合引物的珠1個的水性液滴中,在珠上結合延伸的擴增產物(圖1(iii)(b)、(c))。接下來,將水性液滴(隔區)由公知的手段(例如,表面活性劑添加)破壞(破壞工序)、由離心分離等除去含未結合到珠的擴增產物或未反應成分的上清(b/f分離工序),回收珠。使得用熒光物質預先標記化的檢測用探針在嚴格的條件下雜交于回收的珠上的擴增產物。再次、進行b/f分離,除去未雜交的檢測用探針。其后,對每種珠照射激發光(λ1),測定來自各珠的熒光信號(λ2)(信號檢測工序)。由此,得到關于結合到珠上的擴增產物的信號。在信號的檢測中,使用流式細胞儀。在結合精度管理用多核苷酸的擴增產物的珠(圖1(iii)(c))中,比結合了目標核酸的擴增產物的珠(圖1(iii)(b))可雜交約2倍的數的檢測用探針。由此雜交的檢測用探針的數的差異,從結合了精度管理用多核苷酸的擴增產物的珠可得到計算上比從結合了目標核酸的擴增產物的珠得到的熒光信號強度強約2倍的熒光信號強度。其中,隔區的調制由微乳劑的形成進行。微乳劑可由移液器吸吐等的攪拌操作形成核酸樣品、油相及乳化劑的混合物。在1個實施方式中,形成的微乳劑不限定,但水相可為10~30%(v/v),油相可為60~85%(v/v),乳化劑可為5~10%(v/v)。由于數字pcr伴隨熱循環,乳化劑優選是熱穩定性的。在實施方式1中,在利用數字pcr的核酸擴增中,雖使目標核酸擴增用引物組的一方的引物結合到珠上,但在本發明的實施方式涉及的核酸擴增中結合于珠上的引物的種類不限于1種。在實施方式1的變形例中,也可使目標核酸擴增用引物組的兩方結合到珠上。在實施方式1中,破壞工序后,用熒光染料預先標記化,使用在探針單獨的狀態下顯示信號、雜交之后也顯示信號的檢測用探針。這樣的標記化檢測用探針在將不與擴增產物雜交的檢測用探針可由b/f分離除去的實施方式中有利地使用。在實施方式1的變形例中,可在隔區的調制前在核酸樣品中使用在探針單獨的狀態下不顯示信號,在雜交的狀態下顯示信號的探針、例如分子信標探針。由此變形例能不破壞水性液滴(隔區)而在維持隔區的狀態下,檢測關于來自各隔區的核酸擴增的信號。基于來自結合精度管理用多核苷酸的擴增產物的珠的信號的檢測結果,判斷核酸檢測工序適宜或不適宜。如上所述,在判斷為核酸檢測工序適宜時,可判斷為目標核酸的檢測結果有信賴性。在判斷為核酸檢測工序不適宜時,可判斷為目標核酸的檢測結果缺信賴性。如此,由實施方式1可管理核酸的檢測結果的精度-品質。[實施方式2]實施方式2關于目標核酸的變異檢測中的精度管理方法。圖2是顯示實施方式2中的核酸擴增的種類(b)及檢測信號的2d散點圖(a)的模式圖。在實施方式2中,對于使用變異型的目標核酸及野生型的目標核酸混在的樣品的情況進行說明。作為精度管理用多核苷酸,使用mut檢測序列的檢測用的精度管理用多核苷酸(mut精度管理用多核苷酸)和wt檢測序列的檢測用的精度管理用多核苷酸(wt精度管理用多核苷酸)的2種。mut精度管理用多核苷酸含5個mut檢測序列,wt精度管理用多核苷酸含5個wt檢測序列。在實施方式2中,核酸樣品的調制、隔區調制及核酸擴增工序與實施方式1同樣地實施。在實施方式2中的核酸擴增工序中,由目標核酸擴增用引物組(第1引物及第2引物),可擴增wt精度管理用多核苷酸(圖2(b)(i))、含wt檢測序列的目標核酸(圖2(b)(ii))、mut精度管理用多核苷酸(圖2(b)(iii))及含mut檢測序列的目標核酸(圖2(b)(iv))。由此,可得到結合了wt精度管理用多核苷酸的擴增產物的珠、結合了含wt檢測序列的目標核酸的擴增產物的珠、結合了mut精度管理用多核苷酸的擴增產物的珠、及結合了含mut檢測序列的目標核酸的擴增產物的珠。與實施方式1同樣地從隔區回收上述珠。使檢測用探針在嚴格的條件下雜交于回收的珠。在實施方式2中,使用向用熒光物質cy5標記化的mut檢測序列雜交的檢測用探針(以下也稱為“mut檢測用探針(cy5)”)和向用熒光物質fam標記化的wt檢測序列雜交的檢測用探針(以下也稱為“wt檢測用探針(fam)”)。通過將不同的熒光物質標記化,各檢測用探針發互相不同的熒光信號。在使上述檢測用探針雜交之后,進行b/f分離,除去未雜交的檢測用探針。由流式細胞儀,檢測來自珠的信號。圖2a是x軸示分配mut檢測用探針(cy5)來源的熒光信號強度,y軸示分配wt檢測用探針(fam)來源的熒光信號強度的2d散點圖。由于含mut檢測序列的目標核酸含1個mut檢測序列(n=1),mut精度管理用多核苷酸含5個mut檢測序列(n=5),1個mut檢測用探針(cy5)可雜交于結合了含mut檢測序列的目標核酸的擴增產物的珠,5個mut檢測用探針(cy5)可雜交于結合了mut精度管理用多核苷酸的擴增產物的珠。從而,從結合了mut精度管理用多核苷酸的擴增產物的珠得到的cy5來源的熒光信號強度比從結合了含mut檢測序列的目標核酸的擴增產物的珠得到的cy5來源的熒光信號強度大。目標核酸的擴增產物及精度管理用多核苷酸的擴增產物和檢測用探針的雜交在嚴格的條件下進行。從而,從含mut檢測序列的目標核酸的擴增產物和mut精度管理用多核苷酸的擴增產物,fam來源的熒光信號是檢測界限以下或即使有也僅略微檢測到。在圖2a中,將用于區別珠等的自身熒光和來自結合了含mut檢測序列的目標核酸的擴增產物的珠的熒光信號的閾值作為第1閾值(cy5)顯示。另外,將用于區別來自結合了含mut檢測序列的目標核酸的擴增產物的珠的熒光信號和來自結合了mut精度管理用多核苷酸的擴增產物的珠的熒光信號的閾值作為第2閾值(cy5)顯示。在結合了含mut檢測序列的目標核酸的擴增產物的珠可標繪在第1閾值(cy5)和第2閾值(cy5)之間,不足后述的第1閾值(fam)的區(iv)。結合了mut精度管理用多核苷酸的擴增產物的珠可標繪在第2閾值(cy5)以上且不足后述的第1閾值(fam)的區(iii)。同樣地,由于含wt檢測序列的目標核酸含1個(n=1)wt檢測序列,wt精度管理用多核苷酸含5個(n=5)wt檢測序列,1個wt檢測用探針(fam)可雜交于結合了含wt檢測序列的目標核酸的擴增產物的珠,5個wt檢測用探針(fam)可雜交于結合了wt精度管理用多核苷酸的擴增產物的珠。核酸的擴增產物和檢測用探針的雜交在嚴格的條件下進行。從而,從結合了wt精度管理用多核苷酸的擴增產物的珠得到的fam來源的熒光信號強度比從結合了含wt檢測序列的目標核酸的擴增產物的珠得到的fam來源的熒光信號強度大。另外,從它們擴增產物,cy5來源的熒光信號是檢測界限以下或即使有也僅略微檢測到。在圖2a中,將用于區別珠等的自身熒光和來自結合了含wt檢測序列的目標核酸的擴增產物的珠的熒光信號的閾值作為第1閾值(fam)顯示。另外,將用于區別來自結合了含wt檢測序列的目標核酸的擴增產物的珠的熒光信號和來自結合了wt精度管理用多核苷酸的擴增產物的珠的熒光信號的閾值作為第2閾值(fam)顯示。在結合了含wt檢測序列的目標核酸的擴增產物的珠可標繪在第1閾值(fam)和第2閾值(fam)之間,不足第1閾值(cy5)的區(ii)。結合了wt精度管理用多核苷酸的擴增產物的珠可標繪在第2閾值(fam)以上且不足第1閾值(cy5)的區(i)。在實施方式2的判斷工序中,判斷有無變異。例如,可以目標核酸的濃度(全拷貝數)之中僅哪個濃度(拷貝數)的目標核酸含mut檢測序列作為指標而進行判斷。在可標繪有結合了目標核酸的擴增產物的珠的區(ii)和區(iv)的兩方有點時,算出相對于區(ii)的點數和區(iv)的點數的合計的區(iv)的點數的比例(=(區(iv)的點數)/[(區(ii)的點數)+(區(iv)的點數)])。在其比例在指定的閾值以上時,可判斷為有變異。在判斷工序中,判斷核酸檢測工序適宜或不適宜。在實施方式2中,在可標繪有結合了mut精度管理用多核苷酸的擴增產物的珠的區(iii)中存在的點的數在指定的閾值以上時,可判斷為關于含mut檢測序列的目標核酸的核酸檢測工序適宜。此判斷結果提示目標核酸的有無變異的判斷結果有信賴性。在實施方式2中,也得到來自wt精度管理用多核苷酸的野生型檢測用探針引發的信號。在可標繪有結合了wt精度管理用多核苷酸的擴增產物的珠的區(i)中存在的點的數在指定的閾值以上時,可判斷為關于含wt檢測序列的目標核酸的核酸檢測工序適宜。基于此區(i)的判斷結果可給對于上述的基于區(iii)的判斷結果(關于含mut檢測序列的目標核酸的核酸檢測工序適宜)的信賴性。如此,通過使用2種精度管理用多核苷酸,與使用1種精度管理用多核苷酸的情況比,可使目標核酸中的精度管理的信賴性進一步提高,結果,目標核酸的變異檢測的精度可進一步提高。在區(iii)中存在的點的數不足指定的閾值時,可判斷為關于含mut檢測序列的目標核酸的核酸檢測工序不適宜。此判斷結果提示目標核酸的有無變異的判斷結果欠信賴性。鑒于核酸檢測工序不適宜的判斷結果,如需要,也可為了驗證核酸檢測工序的任何的工序是否不適宜而進行追試。其中,在區(i)中存在的點的數在指定的閾值以上時,可判斷為關于含wt檢測序列的目標核酸的核酸檢測工序適宜。此時,如上所述,作為上述追試,在核酸檢測工序之中,可假定為信號檢測工序不適宜。如此,通過使用2種精度管理用多核苷酸,與使用1種精度管理用多核苷酸的情況比,關于與目標核酸相關的核酸檢測工序的任何的工序不適宜而可得到附加的的信息,從而有利。[實施方式2的變形例]在實施方式2中,使用變異型檢測用探針、野生型檢測用探針的2種檢測用探針和2種精度管理用多核苷酸(mut精度管理用多核苷酸和wt精度管理用多核苷酸)。其中,說明使用1種精度管理用多核苷酸和上述的2種檢測用探針的目標核酸的變異檢測中的精度管理方法。在此變形例中,作為精度管理用多核苷酸,使用含2個wt檢測序列、2個mut檢測序列的多核苷酸(以下也稱為“wt和mut精度管理用多核苷酸”)。目標核酸,與實施方式2同樣、含1個mut檢測序列或wt檢測序列。檢測用探針,與實施方式2同樣,使用wt檢測用探針(fam)、mut檢測用探針(cy5)。在此變形例中,核酸檢測工序與實施方式2同樣地實施。在圖2a中,結合了含wt檢測序列的目標核酸的擴增產物的珠,與實施方式2同樣、標繪在區(ii)。另外,結合了含mut檢測序列的目標核酸的擴增產物的珠標繪在區(iv)。在結合了wt和mut精度管理用多核苷酸的擴增產物的珠中,可雜交2個wt檢測用探針(fam),可雜交2個mut檢測用探針(cy5)。從而,從結合了wt和mut精度管理用多核苷酸的擴增產物的珠得到的fam來源的熒光信號強度比從結合了含wt檢測序列的目標核酸的擴增產物的珠得到的fam熒光信號強度大。同樣地,從上述珠得到的cy5來源的熒光信號強度比從結合了含mut檢測序列的目標核酸的擴增產物的珠得到的cy5熒光信號強度大。在此變形例中,為了區別基于目標核酸的擴增產物的各檢測用探針引發的熒光信號強度和基于wt和mut精度管理用多核苷酸的擴增產物的各檢測用探針引發的熒光信號強度而使用第2閾值。對于mut檢測用探針(cy5)引發的信號稱為第2閾值(cy5),對于wt檢測用探針(fam)引發的信號稱為第2閾值(fam)(未在圖2a中圖示)。結合了wt和mut精度管理用多核苷酸的擴增產物的珠可標繪在第2閾值(fam)以上,并且,第2閾值(cy5)以上的區(圖2a、區(v))。此變形例中的有無變異的判斷,與實施方式2同樣、算出區(iv)的點數對區(ii)的點數和區(iv)的點數的合計的比例(=(區(iv)的點數)/[(區(ii)的點數)+(區(iv)的點數)]),其比例在指定的閾值以上時,可判斷為有變異。此變形例中的核酸檢測工序適宜與否的判斷,在可標繪有結合了wt和mut精度管理用多核苷酸的擴增產物的珠的區(v)的點的數不足指定的閾值時,可判斷為目標核酸的變異檢測中的核酸檢測工序不適宜。一方面,區(v)的點的數在指定的閾值以上時,可判斷為目標核酸的變異檢測中的核酸檢測工序適宜。基于這些判斷結果,可如在實施方式2中記載進行目標核酸的變異檢測的精度管理。[實施方式3]圖3是顯示實施方式3涉及的核酸檢測工序的模式圖。在實施方式3中,與實施方式1不同,顯示由液滴型的數字pcr進行核酸擴增之后,不破壞隔區而從各隔區檢測信號的例。在實施方式3中,調制含目標核酸、精度管理用多核苷酸、能與檢測序列雜交的taqman(商標)探針(檢測用探針)、有5’→3’外切核酸酶活性的聚合酶(未圖示)和對此外的核酸擴增必要的試劑的核酸樣品(圖3(i))。實施方式3中使用的目標核酸及精度管理用多核苷酸,與在實施方式1中使用的同樣、目標核酸含1個檢測序列(n=1),精度管理用多核苷酸含2個檢測序列(n=2)。在隔區調制工序中,與實施方式1同樣地,形成油相中的水性液滴(隔區)(圖3(ii))。在形成的多數的水性液滴之中,調制含目標核酸一分子或精度管理用多核苷酸一分子和多個taqman(商標)探針的水性液滴(圖3(ii)(b)、(c))。通過對水性液滴集團實施pcr法,在含目標核酸一分子或精度管理用多核苷酸一分子的水性液滴中,在其水性液滴中生成核酸的擴增產物(圖3(iii)(b)、(c))。在此外的水性液滴中通常缺目標核酸和精度管理用多核苷酸(圖3(ii)(a))、在這樣的水性液滴中,即使實施pcr法,也不進行核酸擴增(圖3(iii)(a))。在核酸擴增工序中,taqman(商標)探針由聚合酶的5’→3’外切核酸酶活性分解。伴隨taqman(商標)探針的分解而熒光物質與猝滅劑物質隔離,成為能發熒光的狀態。在目標核酸的情況中,由第一次的核酸擴增,由每一條鏈的擴增而一分子的taqman(商標)探針可分解。由此,成為一分子的熒光物質能發熒光的狀態。在精度管理用多核苷酸的情況中,由第一次的核酸擴增,由每1條鏈的擴增而二分子的taqman(商標)探針可分解。由此,成為二分子的熒光物質能發熒光的狀態。在信號檢測工序中,對每種水性液滴照射激發光(λ1),測定來自各水性液滴的熒光信號(λ2)。測定的熒光信號強度可反映成為能發熒光的熒光物質的數。認為可在含精度管理用多核苷酸一分子的水性液滴中存在的能發熒光的熒光物質的數比可在含目標核酸一分子的水性液滴中存在的能發熒光的熒光物質的數多約2倍。由此能發熒光的熒光物質的數的差異,從含精度管理用多核苷酸一分子的水性液滴可得到比從含目標核酸一分子的水性液滴得到的熒光信號強度計算上強約2倍的熒光信號強度。基于來自生成精度管理用多核苷酸的擴增產物的隔區(液滴)的信號的檢測結果,判斷核酸檢測工序適宜或不適宜。如上所述,當判斷為核酸檢測工序適宜時,可判斷為目標核酸的檢測結果有信賴性。當判斷為核酸檢測工序不適宜時,可判斷為目標核酸的檢測結果缺信賴性。如此,由實施方式3可管理核酸的檢測結果的精度-品質。[實施方式4]圖4是顯示實施方式4涉及的核酸檢測工序的模式圖。在實施方式4中,與實施方式3不同,顯示由孔型的數字pcr進行核酸擴增的例。在實施方式4中,調制含目標核酸、精度管理用多核苷酸和對于此外的核酸擴增必要的試劑的核酸樣品(圖4(i))。實施方式4中使用的目標核酸及精度管理用多核苷酸,與在實施方式3中使用的同樣、目標核酸含1個檢測序列(n=1),精度管理用多核苷酸含2個檢測序列(n=2)。在隔區調制工序中,與實施方式3不同,將核酸樣品分注于微滴定板的多數的孔(隔區)。在多個孔之中,調制含目標核酸一分子或精度管理用多核苷酸一分子的孔(圖4(ii)(b)、(c))。通過對分注到孔中的核酸樣品實施pcr法,在含目標核酸一分子或精度管理用多核苷酸一分子的孔中,在其孔中生成核酸的擴增產物(圖4(iii)(b)、(c))。在此外的孔中通常缺目標核酸和精度管理用多核苷酸(圖4(ii)(a))、在這樣的孔中即使實施pcr法也不進行核酸擴增(圖4(iii)(a))。在實施方式4中,核酸擴增后,將單獨不顯示信號、但通過雜交顯示信號的檢測用探針、例如分子信標加到孔中,在存在時在嚴格的條件下雜交于擴增產物。分子信標探針是一個末端被熒光物質標記化,另一末端被猝滅劑物質標記化的寡核苷酸,含能與檢測序列雜交的序列,是可取發夾型二級結構的寡核苷酸。分子信標探針通過與檢測序列雜交,發夾型二級結構破壞,可取延伸的結構。由此,標記化的熒光物質成為能發熒光的狀態。在目標核酸的情況中,由于檢測序列是1個(n=1),可雜交一分子的分子信標探針。在精度管理用多核苷酸的情況中,由于檢測序列是2個(n=2),可雜交二分子的分子信標探針。在信號檢測工序中,向每種孔照射激發光(λ1),測定來自各孔的熒光信號(λ2)。在熒光信號的檢測中,使用微滴定板讀取器。測定的熒光信號強度可反映與擴增產物雜交的分子信標探針的數(即,發熒光可能的熒光物質的數)。認為含精度管理用多核苷酸一分子的孔中與其擴增產物雜交的分子信標探針的數比含目標核酸一分子的孔中與其擴增產物雜交的分子信標探針的數多約2倍。由此雜交的分子信標探針的數的差異,從含精度管理用多核苷酸一分子的孔可得到比從含目標核酸一分子的孔得到的熒光信號強度計算上強約2倍的熒光信號強度。基于來自生成精度管理用多核苷酸的擴增產物的隔區(孔)的信號的檢測結果,判斷核酸檢測工序適宜或不適宜。如上所述,當判斷為核酸檢測工序適宜時,可判斷為目標核酸的檢測結果有信賴性。當判斷為核酸檢測工序不適宜時,可判斷為目標核酸的檢測結果缺信賴性。如此,由實施方式4可管理核酸的檢測結果的精度-品質。在實施方式4中,雖作為檢測用探針使用了分子信標探針,但本發明的實施方式不限于此。例如,在實施方式4的核酸調制中,也可調制還含實施方式3中使用的taqman(商標)探針及有5’→3’外切核酸酶活性的聚合酶的核酸樣品,將調制的核酸樣品如實施方式4所述分注到孔中(隔區調制)而核酸擴增。在信號檢測工序中,核酸擴增時從猝滅劑物質隔離而檢測到來自發熒光成為可能的熒光物質的熒光信號。另外,也可使用固定化引物的珠。此時,可微滴定板1孔收容各1個珠,與上述同樣地進行核酸擴增及信號檢測。[精度管理用試劑]本發明的第2實施方式提供含精度管理用多核苷酸的精度管理用試劑。在第1實施方式中關于精度管理用多核苷酸記載的特征也適用于上述試劑中所含的精度管理用多核苷酸。[精度管理用試劑盒]在本發明的第3實施方式之一的實施方式中,精度管理用試劑盒含收容精度管理用多核苷酸的試劑容器。此外,也可適宜含收容上述引物組、上述檢測用探針、聚合酶、dntps等必要的試劑的試劑容器。再者,也可含記載試劑的使用方法等的附帶文書。圖10是顯示本實施方式的精度管理用試劑盒的一例的模式圖。此試劑盒含收容精度管理用多核苷酸的試劑容器11;收容第1引物的試劑容器12;收容第2引物的試劑容器13;收容檢測用探針的試劑容器14;收容聚合酶的試劑容器15;收容核苷三磷酸(dntps)的試劑容器16;及附帶文書18。試劑容器11~16及附帶文書18收容到盒17中。在圖10所示的試劑盒中,各自的試劑類被收容到不同的容器中,但對于即使共存也對核酸擴增及信號檢測無問題的試劑而言,也可收容到相同容器內。本領域技術人員可適宜選擇共存何種試劑。例如,第1引物、第2引物及dntps可收容到相同容器內。在本說明書中,關于精度管理用多核苷酸及檢測用探針記載的特征也適用于上述試劑盒中所含的精度管理用多核苷酸及檢測用探針。本發明之一的實施方式是精度管理用多核苷酸用于上述的精度管理用試劑或精度管理用試劑盒的制造的用途。關于精度管理用試劑、精度管理用試劑盒、及精度管理用多核苷酸的特征如上所述。本發明之一的實施方式是本發明的第1實施方式涉及的核酸擴增的精度管理方法中的,上述的精度管理用多核苷酸、精度管理用試劑或精度管理用試劑盒的使用。其他實施方式是用于在本發明的第1實施方式涉及的核酸擴增的精度管理方法中使用的,上述的精度管理用多核苷酸、精度管理用試劑及精度管理用試劑盒。關于精度管理用試劑、精度管理用試劑盒、精度管理用多核苷酸、及精度管理方法的特征如上所述。以下,記載具體的實施例,但它們顯示本發明的優選的實施方式,不以任何方式限定隨附的專利權利要求中記載的發明。從本說明書中記載的具體的實施方式、材料、組合物及方法容易識別的均等物、或者變更、改變或變形在本發明的范圍內。【實施例】在實施例中,使用以下的試劑、裝置及解析軟件。<試劑>phusionii熱啟動高保真度dna聚合酶(thermoscientific公司)鉑taqdna聚合酶(lifetechonologies公司)quantitpicogreendsdna測定試劑盒(lifetechnologies)脫氧核苷三磷酸(各10mmol/l、lifetechnologies)10xpcr緩沖液(670mmol/ltris-hclph8.8、166mmol/l硫化銨、100mmol/l2-巰基乙醇、11.7mmol/l氯化鎂)emulsifire(7%(v/v)abilwe09,20%(v/v)礦物油,73%(v/v)tegosoftdec)te緩沖液ph7.5(10mmol/ltris-hclph7.0,1mmol/l乙二胺四醋酸)breaking緩沖液(10mmol/ltris-hclph7.5、1%tritonx-100、1%十二烷基硫酸鈉、100mmol/l氯化鈉、1mmol/l乙二胺四醋酸)0.1mol/l氫氧化鈉tk緩沖液(20mmol/ltris-hclph8.4,50mmol/l氯化鉀)5x雜交緩沖液(75mmol/ltris-hclph9.5、33.5mmol/l氯化鎂、25%甲酰胺)dynabeadsmyone鏈霉親和素c1(dynal)不銹鋼珠(5mm)<裝置>veriti熱循環儀(appliedbiosystems公司)bdaccuric6流式細胞儀(becktondickinson公司)<解析軟件>flowjo(flowjo公司)[實施例1]<kras擴增樣品dna的調制>調制將含野生型人kras的基因序列的質粒和含變異型人krasc.38g>a的基因序列的質粒以99:1的比率混合的dna樣品。將調制的dna樣品使用phusionii高保真度dna聚合酶(thermoscientific公司)及表1中顯示的引物組由pcr法擴增。pcr反應使用veriti熱循環儀(appliedbiosystems公司)實施。以下,對于實施pcr反應而言,同樣地使用veriti熱循環儀。【表1】表2示野生型人kras基因的外顯子2(seqidno:(8)及變異型人krasc.38g>a基因的外顯子2(seqidno:(9)。由上述pcr反應,表2中顯示的序列中,大文字中顯示的序列部分由使用表1中顯示的引物組的上述pcr擴增。表2中顯示的序列中,加下劃線的區域示后述的檢測序列,由四邊形框圍起來的區域示能雜交后述的共探針的區域。【表2】得到的擴增產物使用picogreen熒光嵌入劑定量(quantitpicogreendsdna測定試劑盒(lifetechnologies))。以下,將上述擴增產物稱為“kras擴增樣品dna”。<精度管理用多核苷酸的調制>作為精度管理用多核苷酸,調制含seqidno:10~seqidno:15的各序列的單鏈dna。上述單鏈dna由β-氰基乙基氨基亞磷酸酯法各自化學合成。將合成的各dna使用phusionii高保真度dna聚合酶(thermoscientific公司)及表1中顯示的引物組,由pcr法各自擴增。純化各擴增產物,使用紫外吸光法各自定量。上述擴增產物各自,如下所述命名(表3)。各精度管理用多核苷酸含表3中顯示的數的野生型(wt)及變異型(mut)人kras基因序列中的檢測序列(以下也各自稱為“wt檢測序列”及“mut檢測序列”)。wt檢測序列是在表2中顯示的seqidno:8的序列中加下劃線的序列,mut檢測序列是在表2中顯示的seqidno:9的序列中加下劃線的序列。在表3中,檢測序列加下劃線而表示。【表3】<引物結合磁性珠的調制>調制有seqidno:1的序列(5’-tcccgcgaaattaatacgac-3’)的單鏈dna。在上述單鏈dna的5’末端結合生物素二聚體,調制生物素化引物。將上述生物素化引物加到用鏈霉親和素修飾的磁性珠(dynabeadsmyone鏈霉親和素c1(dynal)),使上述引物結合于上述磁性珠,調制引物結合磁性珠。清洗上述引物結合磁性珠,除去未結合的生物素化引物。<beaming法>由作為利用磁性珠的液滴型的數字pcr的beaming(beads,emulsions,amplificationandmagnetics)法,進行核酸擴增。調制以下顯示的pcr反應溶液(濃度是終濃度)。kras擴增樣品dna1×107拷貝精度管理用多核苷酸(wt,n=5)100,000拷貝10×pcr緩沖液1.6μl脫氧核苷三磷酸(dntps)0.2mmol/l正向引物5(seqidno:1:5’-tcccgcgaaattaatacgac-3’)50fmol/l反向引物6(seqidno:2:5’-gctggagctctgcagcta-3’)8pmol/l引物結合磁性珠0.64μltaqdna聚合酶(lifetechnologies公司)5單位容量16μl接下來,向此pcr反應溶液添加64μl的emulsifire(7%(v/v)abilwe09、20%(v/v)礦物油、73%(v/v)tegosoftdec)。通過將上述溶液在不銹鋼珠(5mm)存在下顛倒混合,形成乳液。對于上述乳液,進行接下來顯示的條件的pcr反應。步驟熱變性退火延伸循環數194℃,2分鐘298℃,15秒鐘64℃,45秒鐘72℃,75秒鐘3398℃,15秒鐘61℃,45秒鐘72℃,75秒鐘3498℃,15秒鐘58℃,45秒鐘72℃,75秒鐘3598℃,15秒鐘57℃,45秒鐘72℃,75秒鐘50其中,結合于上述引物結合磁性珠的引物與上述pcr反應溶液中使用的正向引物5有相同的序列(seqidno:1記載的序列)。由上述pcr,例如,從結合于磁性珠的引物,以與該引物雜交的kras擴增樣品dna作為模板延伸其互補鏈。由此,得到結合kras擴增樣品dna的擴增產物的磁性珠。<檢測用探針溶液的調制>各自調制含表4中顯示的序列編號的序列的單鏈dna。使表4中顯示的熒光物質各自結合于上述單鏈dna的各5’末端,調制用熒光物質標記的檢測用探針。其中,共探針還能與使用表1中顯示的引物組擴增的野生型和變異型的人kras基因的擴增產物的任何雜交,seqidno:5的序列含與上述擴增產物的雙方共同的序列互補的序列(參照表2中顯示的序列中,由四邊形框圍起來的序列)。wt檢測用探針能與由上述引物組擴增的野生型的人kras基因的擴增產物雜交,seqidno:6的序列含與wt檢測序列互補的序列。mut檢測用探針能與由上述引物組擴增的變異型的人kras基因的擴增產物雜交,seqidno:7的序列含與mut檢測序列互補的序列。【表4】探針名序列編號序列5’→3’熒光物質共探針seqidno:5tgacgatacagctaattcacy3wt檢測用探針seqidno:6tgctggtggcgtaggcfammut檢測用探針seqidno:7tgctggtgacgtaggccy5向雜交溶液添加調制的3種檢測用探針至各探針的終濃度成0.1μmol/l,調制檢測用探針溶液(合計探針濃度0.3μmol/l)。<磁性珠的回收及與檢測用探針的雜交>將含結合由pcr反應合成的擴增核酸的磁性珠的上述乳液使用breaking緩沖液(10mmol/ltris-hclph7.5、1%tritonx-100、1%十二烷基硫酸鈉、100mmol/l氯化鈉、1mmol/l乙二胺四醋酸)破壞,回收上述磁性珠。將回收的磁性珠用0.1mol/l氫氧化鈉處理,清洗。將清洗后的磁性珠懸浮于上述檢測用探針溶液。將懸浮液于50℃處理15分鐘,使上述磁性珠上的擴增核酸和上述檢測用探針雜交。此后,將上述磁性珠使用tk緩沖液(20mmol/ltris-hclph8.4、50mmol/l氯化鉀)清洗,懸浮于tk緩沖液中。<流式細胞術解析>將上述懸浮液中的磁性珠由bdaccuric6流式細胞儀(becktondickinson公司)測定。在此實施例中,由流式細胞儀(fcm)測定而得到關于磁性珠的信號(前方散射光及測定散射光),再得到關于擴增核酸的信號(檢測用探針及共探針來源的熒光)。在實施例中,將共探針(cy3標記)來源的熒光用上述流式細胞儀的fl2通道接收,由fl1通道接收wt檢測用探針(fam標記)來源的熒光,由fl4通道接收mut檢測用探針(cy5標記)來源的熒光。基于得到的前方散射及側方散射,挑選反映非凝集性的磁性珠的測定數據。再者,基于共探針(cy3標記)來源的熒光信號(lf2通道),確認為是結合kras擴增樣品dna的擴增產物的磁性珠。實施例中使用的精度管理用多核苷酸不含共探針能雜交的區域,但利用含比kras擴增樣品dna多數倍的檢測序列,能排除磁性珠來源的自身熒光。例如,在結合了精度管理用多核苷酸(wt,n=5)的擴增產物的磁性珠中,如后所述,計算上可結合5倍于結合kras擴增樣品dna的擴增產物的磁性珠的數的wt檢測用探針(fam標記)。結果,從結合精度管理用多核苷酸(wt,n=5)的擴增產物的磁性珠得到數倍強的fam熒光信號強度。由此強的fma熒光信號強度,發生向lf2通道的漏溢。通過利用此fam熒光信號的向lf2通道的漏溢,可確認是結合精度管理用多核苷酸(wt,n=5)的擴增產物的磁性珠。通過使用共探針,在存在時可排除磁性珠來源的自身熒光,更高精度地進行kras擴增樣品dna的分析變得可能。另外,利用精度管理用多核苷酸中存在的檢測序列和與上述檢測序列互補的序列的合計數與目標核酸的擴增產物中存在的檢測序列和與上述檢測序列互補的序列的合計數不同,在存在時還能排除磁性珠來源的自身熒光。對于挑選的測定數據,制成在x軸分配mut檢測用探針來源的熒光信號強度,在y軸分配wt檢測用探針來源的熒光信號強度的2d散點圖(圖5a)。在制成的2d散點圖中,各自計數對應于發wt檢測用探針來源的熒光的磁性珠的區內的點數(對應于顯示野生型kras基因的存在的磁性珠的個數)、及對應于發mut檢測用探針來源的熒光的磁性珠的區內的點數(對應于顯示變異型kras基因的存在的磁性珠的個數)。在圖5a中,將2d散點圖分成4個區(q1~q4)、在各區表示計數的各區的點數相對于2d散點圖中的點總數的比例(%)。以下同樣地,在2d散點圖中表示各區(q1~q4)中的點的比例。[比較例1]在比較例1中,除了調制未添加精度管理用多核苷酸(wt,n=5)的pcr反應溶液之外,用與實施例1基本上相同的方法,進行beaming法、磁性珠的回收、雜交、及流式細胞術(fcm)解析(圖5b)。在顯示實施例1(含精度管理用多核苷酸(wt,n=5)(+))的結果的圖5a中,在y軸的值是3×103~1×104[事件]之間觀察到多數的點(實線圓圍起來的區)。在顯示比較例1(不含精度管理用多核苷酸(wt,n=5)(-))的結果的圖5b中也同樣地,在y軸的值是3×103~1×104[事件]之間觀察到多數的點(實線圓圍起來的區)。此區內的點集團顯示,wt檢測用探針(fam標記)來源的熒光信號強度比較強,一方面,mut檢測用探針(cy5標記)來源的熒光信號強度比較弱。由此提示,對應于此區內的點的磁性珠反映dna樣品中的野生型kras基因的存在。其中,可算出相對于2d散點圖中的點總數的此區內的點數的比例([區內的點數]/[點總數]×100)。上述比例可反映試驗的dna樣品中的野生型kras基因的含有率。在實施例1中,使用將含野生型人kras的基因序列的質粒和含變異型人krasc.38g>a的基因序列的質粒以99:1的比率混合的dna樣品的擴增產物。在圖5a及圖5b的2d散點圖中,在x軸的值是1×104~3×104之間觀察到點集團(被實線四角形圍起來的區)。此區內的點集團顯示,mut檢測用探針(cy5標記)來源的熒光信號強度比較強,一方面,wt檢測用探針(fam標記)來源的熒光信號強度比較弱。由此提示,對應于此區內的點的磁性珠反映dna樣品中的變異型kras基因的存在。如上所述,可算出相對于2d散點圖中的點總數的此區內的點數的比例。上述比例可反映試驗的dna樣品中的變異型kras基因的含有率。在圖5a(精度管理用多核苷酸(wt,n=5)(+))中,在y軸的值是1×104~3×104之間觀察到能與y軸的值是3×103~1×104之間的實線圓圍起來的區中存在的點集團區別的點集團(虛線圓圍起來的區)。在圖5b(精度管理用多核苷酸(mut,n=5)(-))中,對應于圖5a的虛線圓圍起來的區的區觀察不到點。圖5a的虛線圓圍起來的區內的點集團顯示,wt檢測用探針(fam標記)來源的熒光信號強度比實線圓圍起來的區內的點集團顯示的熒光信號強度大數倍。這提示,對應于圖5a、b的虛線圓圍起來的區的點的磁性珠比對應于實線圓圍起來的區的點的磁性珠,以數倍多種wt檢測用探針雜交。從而理解,圖5a的虛線圓圍起來的區內的點集團可反映結合了有5個wt檢測用探針能雜交的檢測序列的精度管理用多核苷酸(wt,n=5)的擴增產物的磁性珠。理解圖5a、b的實線圓圍起來的區內的點集團可反映結合了有1個wt檢測用探針能雜交的檢測序列的野生型的kras擴增dna的擴增產物的磁性珠。[實施例2及比較例2]在實施例2中,除了調制代替精度管理用多核苷酸(wt,n=5)而使用精度管理用多核苷酸(mut,n=5)的pcr反應溶液之外,用與實施例1基本上相同的方法,進行beaming法、磁性珠的回收、雜交、及fcm解析(圖6a)。在比較例2中,除了調制未添加精度管理用多核苷酸(mut,n=5)的pcr反應溶液之外,用與實施例2實質上相同的方法,進行beaming法、磁性珠的回收、雜交、及fcm解析(圖6b)。實施例2及比較例2的結果,與實施例1及比較例1的結果同樣地,在反映dna樣品中的野生型kras基因的存在的區內觀察到多數的點(圖6a及b、實線圓圍起來的區)、另外,在反映變異型kras基因的存在的區內觀察到點集團(圖6a及b、被實線四角形圍起來的區)。在圖6a(精度管理用多核苷酸(mut,n=5)(+))中,在x軸的值是3×104~6×105之間的被虛線四角形圍起來的區觀察到能與x軸的值是1×104~2×104之間的被實線四角形圍起來的區中存在的點集團區別的點集團。在圖6b(精度管理用多核苷酸(mut,n=5)(-))中,在對應于圖6a的被虛線四角形圍起來的區的區中觀察不到點。圖6a的被虛線四角形圍起來的區內的點集團顯示,mut檢測用探針(cy5標記)來源的熒光信號強度比被實線四角形圍起來的區內的點集團顯示的熒光信號強度大數倍。這提示,圖6a、b的對應于被虛線四角形圍起來的區的點的磁性珠比對應于被實線四角形圍起來的區的點的磁性珠,以數倍多種mut檢測用探針雜交。理解圖6a的被虛線四角形圍起來的區內的點集團可反映結合了有5個mut檢測用探針能雜交的檢測序列的精度管理用多核苷酸(mut,n=5)的擴增產物的磁性珠。理解圖6a、b的被實線四角形圍起來的區內的點集團可反映結合了有1個mut檢測用探針能雜交的檢測序列的變異型的kras擴增dna的擴增產物的磁性珠。從實施例1及實施例2的結果可理解,由本發明之一的實施方式涉及的核酸擴增的精度管理方法,為了使用能使用與用于擴增目標核酸的引物組相同的引物組核酸擴增,可使用與用于檢測目標核酸來源的擴增產物的檢測用探針相同的檢測用探針與目標核酸來源的擴增產物能區別地檢測的精度管理用多核苷酸,能判斷包括核酸調制、隔區調制、核酸擴增及信號檢測的一系列的工序是否適宜。另外,從實施例1及實施例2的結果理解,本發明之一的實施方式涉及的精度管理用多核苷酸也能在變異檢測的精度管理方法中使用。[實施例3]<精度管理用多核苷酸的拷貝數和fcm檢測信號強度的相關關系>在實施例1的pcr反應溶液中,各自添加25,000拷貝、50,000拷貝、100,000拷貝、200,000拷貝、400,000拷貝、800,000拷貝精度管理用多核苷酸(wt,n=5),用與實施例1基本上相同的方法,進行beaming法、磁性珠的回收、雜交、及fcm解析。還用flowjo軟件(flowjo公司)解析用fcm解析得到的數據,算出pcr反應后的各精度管理用多核苷酸來源的熒光信號強度的平均值(圖7a)。圖7a顯示,在x軸分配添加的精度管理用多核苷酸的拷貝數,在y軸分配用fcm測定檢測的熒光信號強度的分布圖。圖7a中的虛線示回歸直線,其方程式是y=0.0098x-357。圖7a顯示可對應于添加的精度管理用多核苷酸的擴增產物的量的熒光信號強度與添加的精度管理用多核苷酸的拷貝數成比例地增加。同樣地,在實施例2的pcr反應溶液中,各自添加25,000拷貝、50,000拷貝、100,000拷貝、200,000拷貝、400,000拷貝、800,000拷貝精度管理用多核苷酸(mut,n=5),用與實施例2基本上相同的方法,進行beaming法、磁性珠的回收、雜交、及fcm解析。還用flowjo軟件(flowjo公司)解析用fcm解析得到的數據,算出pcr反應后的各精度管理用多核苷酸來源的熒光信號強度的平均值(圖7b)。圖7b顯示在x軸分配添加的精度管理用多核苷酸的拷貝數,在y軸分配用fcm測定檢測的熒光信號強度的分布圖。圖7b中的虛線顯示回歸直線,其方程式是y=0.011x-68。圖7b也另外顯示,可對應于添加的精度管理用多核苷酸的擴增產物的量的熒光信號強度與添加的精度管理用多核苷酸的拷貝數成比例地增加。如圖7a、b所示,在添加的精度管理用多核苷酸的拷貝數和用fcm檢測的熒光信號強度之間有正的相關。結果證實使用本發明涉及的精度管理用多核苷酸的核酸擴增的精度管理方法的定量性。[實施例4]<精度管理用多核苷酸中的檢測序列的數和fcm檢測信號強度的相關關系>調制各自含40,000拷貝精度管理用多核苷酸(wt,n=5)、(wt,n=4)、(wt,n=3)、(wt,n=2)的pcr反應溶液、及不含精度管理用多核苷酸的pcr反應溶液(野生型人kras基因中的wt檢測序列的數(n)=1),用與實施例1基本上相同的方法,進行beaming法、磁性珠的回收、雜交、及fcm解析。還用flowjo軟件解析用fcm解析得到的數據,算出pcr反應后的各精度管理用多核苷酸來源的熒光信號強度的平均值及標準偏差(sd)(圖8)。圖8顯示,在x軸分配wt檢測序列的數,在y軸分配wt檢測用探針(fam標記)來源的熒光信號強度的箱形圖。在箱形圖中,箱的兩端表示平均值±1sd,須兩端表示平均值±3sd。如圖8所示,理解在可對應于擴增的精度管理用多核苷酸中的檢測序列的數的熒光信號強度與精度管理用多核苷酸中的檢測序列的數之間有正的相關。在實施例4中,將顯示能互相區別檢測精度管理用多核苷酸的基準,例如,作為熒光信號強度的平均值±1sd不重疊,參照圖8所示的結果。在假定目標核酸中存在1個檢測序列時(n=1)、提示如果在精度管理用多核苷酸中至少存在2個檢測序列(n≥2)、使用1種檢測用探針能區別檢測上述目標核酸和上述精度管理用多核苷酸。基于同樣的基準,可理解在假定例如存在2個目標核酸檢測序列時(n=2)、為了區別上述目標核酸和精度管理用多核苷酸,也可存在在精度管理用多核苷酸中1個檢測序列(n=1)、或者也可存在至少3個檢測序列(n≥3)。從實施例4理解,使用本發明之一的實施方式涉及的精度管理用多核苷酸的核酸擴增的精度管理方法通過使用與目標核酸中可存在的檢測序列和與上述檢測序列互補的序列的合計數不同的合計數的檢測序列和含與上述檢測序列互補的序列的精度管理用多核苷酸,使用1種檢測用探針能互相區別檢測。[實施例5及比較例3]在實施例5中,除了代替在實施例1的pcr反應溶液中添加100,000拷貝的精度管理用多核苷酸(wt,n=5)而添加50,000拷貝的精度管理用多核苷酸(wt,n=6)之外,用與實施例1基本上相同的方法,進行beaming法、磁性珠的回收、雜交、及fcm解析(圖9a)。在比較例3中,除了調制未添加精度管理用多核苷酸(wt,n=6)的pcr反應溶液之外,用與實施例5基本上相同的方法進行beaming法、磁性珠的回收、雜交、及fcm解析(圖9b)。在圖9a(精度管理用多核苷酸(wt,n=6)(+))中,在y軸的值是約1.5×104~約3×104之間的虛線圓圍起來的區中觀察到能與y軸的值是約3×103~約1×104之間的實線圓圍起來的區中存在的多數的點區別的點集團。在圖9b(精度管理用多核苷酸(wt,n=6)(-))中,在對應于圖9a的虛線圓圍起來的區的區中觀察不到點。圖9a的虛線圓圍起來的區內的點集團顯示,wt檢測用探針(fam標記)來源的熒光信號強度比實線圓圍起來的區內的點集團顯示的熒光信號強度大數倍。這提示,圖9a、b的對應于虛線圓圍起來的區的點的磁性珠比對應于實線圓圍起來的區的點的磁性珠,以數倍多種wt檢測用探針雜交。理解圖9a的虛線圓圍起來的區內的點集團可反映結合了有6個wt檢測用探針能雜交的檢測序列的精度管理用多核苷酸(wt,n=6)的擴增產物的珠。理解圖9a、b的實線圓圍起來的區內的點集團可反映結合了有1個wt檢測用探針能雜交的檢測序列的野生型的kras擴增dna的擴增產物的磁性珠。實施例5中使用的對照多核苷酸(wt,n=6)是,wt檢測序列之間的間隔子序列是2bp(參照表3、seqidno:15的序列中,加下劃線的檢測序列間的堿基的數(鏈長))。在實施例1~4中使用的對照多核苷酸(wt,n=5)、(wt,n=4)、(wt,n=3)、(wt,n=2)、及(mut,n=5)中,各檢測序列之間的間隔子序列是5bp(參照表3、seqidno:10~14的序列中,加下劃線的檢測序列間的鏈長)。從實施例5的結果理解,使用本發明之一的實施方式涉及的精度管理用多核苷酸的核酸擴增的精度管理方法,即使檢測序列或與上述檢測序列互補的序列間的間隔子序列是2bp,也能將精度管理用多核苷酸的擴增產物與目標核酸的擴增產物區別檢測。?序列表<110>sysmexcorporation<120>核酸擴增的精度管理方法、精度管理用試劑及其試劑盒<130>15-051cn<160>15<170>patentinversion3.5<210>1<211>20<212>dna<213>人工序列<220><223>引物5<400>1tcccgcgaaattaatacgac20<210>2<211>18<212>dna<213>人工序列<220><223>引物6<400>2gctggagctctgcagcta18<210>3<211>45<212>dna<213>人工序列<220><223>引物1<400>3gctggagctctgcagctatgactgaatataaacttgtggtagttg45<210>4<211>43<212>dna<213>人工序列<220><223>引物2<400>4tcccgcgaaattaatacgaccatattcgtccacaaaatgattc43<210>5<211>19<212>dna<213>人工序列<220><223>共探針<400>5tgacgatacagctaattca19<210>6<211>16<212>dna<213>人工序列<220><223>wt探針<400>6tgctggtggcgtaggc16<210>7<211>16<212>dna<213>人工序列<220><223>突變型探針<400>7tgctggtgacgtaggc16<210>8<211>122<212>dna<213>智人(homosapiens)<400>8ctctattgttggatcatattcgtccacaaaatgattctgaattagctgtatcgtcaaggc60actcttgcctacgccaccagctccaactaccacaagtttatattcagtcattttcagcag120gc122<210>9<211>122<212>dna<213>智人(homosapiens)<400>9ctctattgttggatcatattcgtccacaaaatgattctgaattagctgtatcgtcaaggc60actcttgcctacgtcaccagctccaactaccacaagtttatattcagtcattttcagcag120gc122<210>10<211>158<212>dna<213>人工序列<220><223>串聯dna,n=5(obq_r050-04)<400>10tcatattcgtccacaaaatgattcagatgcctacgccaccagctatcagcctacgccacc60agctcagtgcctacgccaccagctactagcctacgccaccagctatgagcctacgccacc120agctacgatgcaactaccacaagtttatattcagtcat158<210>11<211>158<212>dna<213>人工序列<220><223>串聯dna,n=4(obq_r040-11)<400>11tcatattcgtccacaaaatgattcagatgcctacgccaccagctatcagcctacgccacc60agctcagtgcctacgccaccagctactagcctacgccaccagctatgaacctctattgtt120ggatacgatgcaactaccacaagtttatattcagtcat158<210>12<211>158<212>dna<213>人工序列<220><223>串聯dna,n=3(obq_r030-12)<400>12tcatattcgtccacaaaatgattcagatgcctacgccaccagctatcagcctacgccacc60agctcagtgcctacgccaccagctactatattaaaacaagatttatgaacctctattgtt120ggatacgatgcaactaccacaagtttatattcagtcat158<210>13<211>158<212>dna<213>人工序列<220><223>串聯dna,n=2(obq_r020-13)<400>13tcatattcgtccacaaaatgattcagatgcctacgccaccagctatcagcctacgccacc60agctcagtgcaccagtaatatgcaactatattaaaacaagatttatgaacctctattgtt120ggatacgatgcaactaccacaagtttatattcagtcat158<210>14<211>150<212>dna<213>人工序列<220><223>串聯dna,n=5,突變型(obq_r005-03)<400>14tcatattcgtccacaaaatgattctgcctacgtcaccagctatcagcctacgtcaccagc60tcagtgcctacgtcaccagctactagcctacgtcaccagctatgagcctacgtcaccagc120tccaactaccacaagtttatattcagtcat150<210>15<211>155<212>dna<213>人工序列<220><223>串聯dna,n=6(obq_r060-01)<400>15tcatattcgtccacaaaatgattctgcctacgccaccagctagcctacgccaccagcttg60cctacgccaccagctggcctacgccaccagctcgcctacgccaccagctagcctacgcca120ccagctccaactaccacaagtttatattcagtcat155當前第1頁12
相關技術
網友詢問留言
已有0條留言
- 還沒有人留言評論。精彩留言會獲得點贊!
1