一種開關型二價銅離子熒光探針及其制備與應用的制作方法
本發明屬于重金屬離子檢測技術領域,具體涉及的是一種開關型二價銅離子熒光探針及其制備方法。
背景技術:
cu2+作為第三豐富的過渡金屬離子,在多種生理過程,如能量的產生和信號轉導等過程起著至關重要的作用。但是過量的銅離子可能導致神經退行性疾病,包括帕金森和老年癡呆癥等。隨著工業和農業的發展,cu2+已經成為一種重要的金屬污染物。因此,生物體和環境中銅離子的檢測跟蹤顯得格外重要。
目前測定銅離子的方法主要是原子吸收光譜法,原子吸收以及分光光度法,但前者需要復雜的儀器及熟練的技術人員及高昂的檢測費用,后者需要繁瑣的操作,這些都不適用實時體內分析。與上述方法相比,熒光探針靈敏度高、響應時間短、成本低及設備簡單等優點,已經引起越來越多的關注。但是由于cu2+的順磁性質,基于配位的熒光探針通常表現出熒光猝滅進而出現假性結果。同時基于不可逆化學反應的熒光探針檢測時需要溫度高、耗時長和非生理ph等條件。因此,迫切需要開發研究在常溫及生理條件下快速高效地檢測cu2+的新型熒光探針。
6-乙酰基-2-甲氨基萘因具有典型的“推拉”結構,表現出優良的光學性能。供電子羥基取代位置2上的甲氨基,即生成6-乙酰基-2-羥基萘,不改變其“推拉”結構。當羥基被吸電子基團2-吡啶甲酰基保護起來之后,6-乙酰基-2-羥基萘的“推”結構表現出的光學性能將會降低,產生熒光淬滅,同時吡啶羧酸基團很容易被cu2+水解。因此,本發明的二價銅離子探針是以6-乙酰基-2-羥基萘作為熒光報告基團,以吡啶甲酯作為識別單元的開關型熒光探針。經檢索沒有發現與本申請相近似的文獻及專利申請。
技術實現要素:
本發明的目的是針對現有技術的不足,通過分子設計,合成出一種具有響應時間短和較高選擇性的開關型cu2+熒光探針。
本發明還提供了上述二價銅離子熒光探針的制備方法。
本發明還提供了上述二價銅離子熒光探針的應用。
本發明解決其技術問題是采取以下技術方案實現的:
一種開關型二價銅離子熒光探針,它的分子式為c17h11no3,結構式如下:
一種如上所述的二價銅離子熒光探針的制備方法,包括步驟如下:
(1)6-乙酰基-2-甲氧基萘與三乙胺反應得到6-乙酰基-2-羥基萘,即化合物1,其結構式如下:
(2)將步驟(1)得到化合物1與2-吡啶甲酸反應得到目標產物6-乙酰-2-吡啶甲酯萘。
而且,所述步驟(1)具體采用下述方法完成:將6-乙酰-2-甲氧基萘溶于二氯甲烷后,逐滴滴入鹽酸溶液中,邊滴邊攪拌,再逐滴滴入三乙胺,然后在85℃下攪拌4h;反應完全后,過量的酸用氫氧化鈉中和,用乙酸乙酯萃取,并用飽和碳酸氫鈉和鹽水清洗,有機相用無水硫酸鈉干燥,減壓蒸餾去溶劑,并用硅膠色譜柱純化,石油醚和乙酸乙酯洗脫分離得到化合物1。
而且,所述6-乙酰-2-甲氧基萘與三乙胺的比例為1:1.1;所述柱色譜分離洗脫劑配比為乙酸乙酯:石油醚=1:5。
而且,所述步驟(2)具體采用下述方法完成:將化合物1溶于無水二氯甲烷,并用2-吡啶甲酸、1-乙基-3-(3-二甲氨基丙基)碳二亞胺鹽酸鹽和4-二甲氨基吡啶進行處理,將所得的溶液在室溫下攪拌2h,氬氣保護;反應完全后,分離有機相并用鹽酸和飽和鹽水洗滌,無水硫酸鈉干燥;水相用二氯甲烷提取,蒸發,得到粗固體,過硅膠色譜柱純化得到化合物2。
而且,所述化合物1與2-吡啶甲酸、1-乙基-3-(3-二甲氨基丙基)碳二亞胺鹽酸鹽和4-二甲氨基吡啶的比例為1:1.5:1.5:0.6;所述柱色譜分離洗脫劑配比為乙酸乙酯:石油醚=1:2-4。
一種如上所述的二價銅離子熒光探針的應用,該應用是將熒光探針與二價銅離子進行反應,利用反應溶液的顏色變化以及熒光變化來檢測二價銅離子的存在與否。
而且,在未加入二價銅離子前,所述反應溶液為無色并且無熒光發射,當加入二價銅離子后,所述反應溶液顏色變藍,并且發出熒光。
而且,所述檢測二價銅離子的檢出濃度下限為8.5nm。
本發明的優點及其效果
本發明探針的合成只需要兩步就可以完成,且后處理過程相對簡單。本發明熒光探針分子在二價銅離子與其他陽離子共存體系中,表現出較高的選擇性和靈敏度。
附圖說明
圖1為實施案例1中化合物2的1hnmr圖譜;
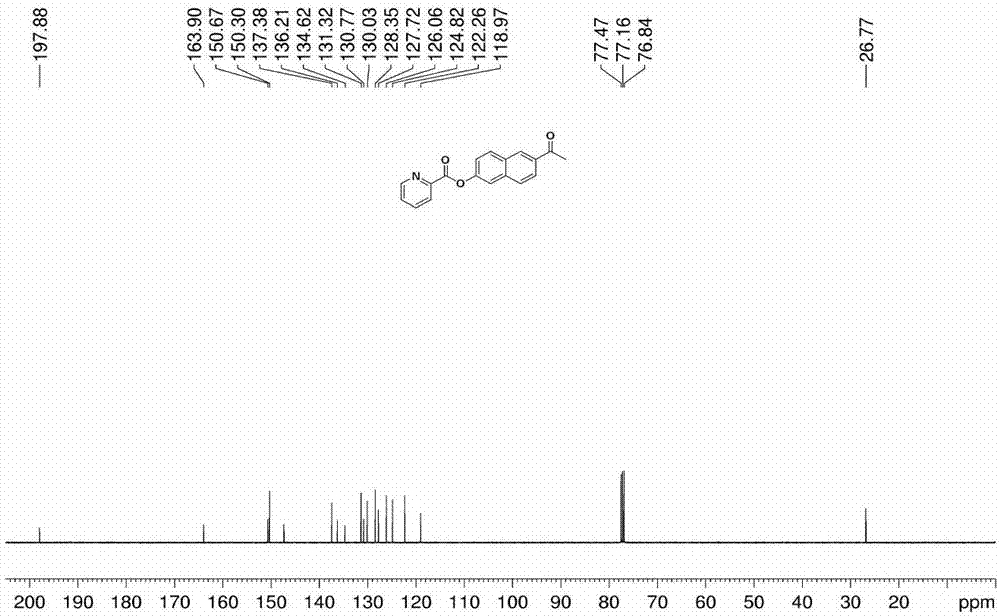
圖2為實施案例1中化合物2的13cnmr圖譜;
圖3為實施案例1中化合物2的esi-ms圖譜;
圖4中(a)為ph值對化合物1和2熒光強度的影響示意圖,(b)為ph值對化合物2與cu2+反應前后熒光強度的影響示意圖;
圖5中(a)為不同光譜條件下化合物2與cu2+反應后吸收光譜強度的變化示意圖,(b)為在316nm處化合物2與cu2+反應后吸光度隨時間的變化示意圖;
圖6中(a)為不同光譜條件下化合物2與cu2+反應后熒光光譜的變化示意圖,(b)為在443nm處化合物2與cu2+反應后熒光強度隨時間的變化示意圖;
圖7中(a)為不同cu2+濃度條件下化合物2與cu2+反應后在443nm處熒光強度隨時間的變化示意圖,(b)為在443nm處化合物2的熒光強度隨cu2+濃度的變化示意圖;
圖8為化合物2在443nm處與不同金屬離子反應前后的熒光強度變化示意圖,(灰柱代表探針只經標注的金屬離子處理,黑柱代表探針經cu2+處理后再添加標注的金屬離子;1.無金屬離子,2.na+,3.k+,4.ca2+,5.mg2+,6.ag+,7.zn2+,8.cd2+,9.hg2+,10.ba2+,11.co2+,12.ni2+,13.mn2+,14.pb2+,15.al3+,16.fe3+,17.sn4+,18.cu2+);
圖9為化合物2檢測的cu2+反應機理示意圖。
具體實施方式
以下對本發明實施例做進一步詳述:需要強調的是,本發明所述的實施例是說明性的,而不是限定性的,因此本發明并不限于具體實施方式中所述的實施例,凡是由本領域技術人員根據本發明的技術方案得出的其它實施方式,同樣屬于本發明保護的范圍。
實施例
(一)目標化合物二價銅離子熒光探針的制備
(1)化合物1的合成
將6-乙酰-2-甲氧基萘(1.00g,5mmol)溶于4ml二氯甲烷后,逐滴滴入36%鹽酸溶液(80ml,0.93mol)中,邊滴邊攪拌,再逐滴滴入三乙胺(0.75ml,5.4mmol),然后在85℃下攪拌4h;反應完全后,過量的酸用氫氧化鈉中和,用乙酸乙酯萃取,并用飽和碳酸氫鈉和鹽水清洗,有機相用無水硫酸鈉干燥,減壓蒸餾去溶劑,并用硅膠色譜柱純化,石油醚和乙酸乙酯洗脫分離,洗脫劑配比為乙酸乙酯:石油醚=1:5,產率為90.2%。
(2)化合物2的合成
將化合物1(186.2mg,1.0mmol)溶于10ml無水二氯甲烷,并用2-吡啶甲酸(183.2mg,1.5mmol)、1-乙基-3-(3-二甲氨基丙基)碳二亞胺鹽酸鹽(287.6mg,1.5mmol)和4-二甲氨基吡啶(73.3mg,0.6mmol)進行處理,將所得的溶液在室溫下攪拌2h,氬氣保護;反應完全后,分離有機相并用鹽酸和飽和鹽水洗滌,無水硫酸鈉干燥;水相用2×20ml二氯甲烷提取,蒸發,得到粗固體,過硅膠色譜柱純化,洗脫劑配比為乙酸乙酯:石油醚=1:2-4,產率為78%。
化合物2的1hnmr圖譜如圖1所示,1hnmr(400mhz,cdcl3,ppm)δ8.86(d,j=4.0hz,1h),8.47(s,1h),8.31(d,j=7.6hz,1h),8.05(t,j=9.2hz,2h),7.94(t,j=7.2hz,1h),7.88(d,j=8.8hz,1h),7.76(s,1h),7.58(dd,j1=5.2hz,j2=7.2hz,1h),7.48(dd,j1=7.2hz,j2=8.8hz,1h),2.71(s,3h)。
化合物2的13cnmr圖譜如圖1所示,13cnmr(100mhz,cdcl3,ppm)δ197.88,163.90,150.67,150.30,137.38,136.21,134.62,131.32,130.77,130.03,128.35,127.72,126.06,124.82,122.26,118.97,26.77。
化合物2的esi-ms圖譜如圖1所示,esi-msm/zforc18h14no3+([m+h]+):calcd:292.1,found:292.1。
(二)ph值變化對化合物1和化合物2熒光強度的影響
取實施例(一)中合成的化合物1和化合物2溶于二甲基亞砜中,分別制成2mmol/l的儲備液。當ph值不同時,在室溫下以443nm為激發光測量化合物1和2的熒光性質,熒光光譜圖如圖4(a)所示。添加cu2+前后,ph值變化對化合物2的熒光強度的影響,如圖4(b)所示。由圖4(a)和4(b)知,添加cu2+前,化合物2的熒光強度基本不變,ph值的影響很小;添加cu2+后,當ph=5.5-7.0時,化合物2的熒光強度迅速增加至最大,當ph值繼續增加,化合物2的熒光強度明顯降低。
(三)化合物2的吸收光譜和熒光光譜研究
在最優條件下,即20mmhepes,h2o/ch3cn,4:1,v/v,ph7.0,25℃,研究化合物2的熒光光譜和吸收光譜性質,結果如圖5和圖6所示,圖5中(a)為化合物2與cu2+反應后不同光譜條件下吸收光譜強度的變化,(b)為化合物2與cu2+反應后在316nm處的吸光度隨時間的變化;圖6中(a)為化合物2與cu2+反應后不同光譜條件下熒光光譜的變化,(b)為化合物2與cu2+反應后在443nm處的熒光強度隨時間的變化。實驗結果證明,化合物2與cu2+的反應會引起吡啶羧酸基團的水解,釋放熒光團6-乙酰基-2-羥基萘,如圖9所示。因此,化合物2適用于cu2+的快速檢測。
(四)化合物2檢測cu2+敏感性研究
為測試化合物2檢測cu2+敏感性,不同cu2+濃度條件(0-20μm)下化合物2與cu2+反應后在443nm處熒光強度隨時間的變化(如圖7(a))及化合物2在443nm處的熒光強度隨cu2+濃度的變化(如圖7(b))都進行了實驗研究。圖7(a)知,高濃度cu2+(0-10μm)提供更快和更戲劇性的熒光增強。由圖7(b)可以推算出化合物2檢測cu2+的檢測限為8.5nm,遠低于who標準(31μm)和美國環境標準(20μm)。
(五)化合物2檢測cu2+專一性研究
為測試化合物2檢測cu2+專一性,化合物2在443nm處與不同重金屬離子反應前后的熒光強度變化(如圖8)及熒光顏色的變化都進行了實驗研究。由圖8及熒光顏色變化知,其他潛在的競爭金屬離子的存在對化合物2與cu2+的熒光反應無明顯影響。
- 還沒有人留言評論。精彩留言會獲得點贊!