一種基于慣性原理分離細胞的芯片的制作方法
本發明屬于微流控領域,更具體地,涉及一種基于慣性原理分離細胞的芯片。
背景技術:
微流控芯片技術是一種在微尺度空間中對流體進行操控的科學技術,利用該技術分離細胞時,方法簡單、分離成功率高,易于推廣普及,受到廣泛關注。
在現有的文獻和專利中提出的依據慣性原理分離細胞的流道結構一般為:螺旋型和縮擴陣列結構。這兩種結構具有一些缺陷。對于螺旋型結構來說,由于芯片所能承受的壓強有限,所以該結構提供的fd(即,迪恩力)和fl(即,慣性升力)較小,限制了分離效率。對于縮擴陣列結構來說,雖然其依靠縮擴陣列能夠提供較大的fd和fl,但是不能在整個流道中一直提供fd,只有當細胞從拓寬段流入收縮段時才能受到fd的影響。
以螺旋結構為例,現有技術文獻【3】公開了一種基于慣性分離原理的螺旋結構用于從血液中分離出紅細胞。該結構采用一個樣品入口,一個螺旋式流道和一個二叉出口。該螺旋流道由5圈阿基米德螺旋形微通道組成,通道的橫截面為矩形面,該矩形面的寬為100um,高為50um,曲線總長13cm,螺旋最內側的曲率半徑為3mm。該學者將血液以0.15m/s的速率從樣品入口注入,在二叉口的下出口處收集7.32um顆粒,在二叉口的上出口處收集1.9um顆粒。
如圖3所示,該螺旋結構實現細胞分離原理為:在彎形流道中細胞會受到慣性升力fl和迪恩力fd兩個力的共同作用。fl和fd之間的平衡決定了細胞在微通道的平衡位置。當fl≥fd時,細胞往側壁s1移動,當fl<fd時,細胞往側壁s2移動;尺寸較大的細胞所受fl較大,尺寸較小的細胞所受fd較大。經過一定長度的流道,大粒子與小粒子就分離開來。
在上述方法中,由于芯片所能承受的壓強有限,所以該結構提供的fd和fl較小,限制了分離效率。再者,受其流道結構的限制,不同細胞所處的橫向平衡位置之間的間距較小。最后為了達到預期的分離效果,所需流道總長度往往較長,有其他文獻設計了單側縮擴陣列結構用于細胞分離,該結構所需的流道總長度較短,但是在該設計中,細胞只有在從拓寬段進入壓縮段時,才會受到fd和fl兩個力的共同作用。其余階段僅受慣性升力fl的影響。fd作用在細胞上的時間十分短暫,且不能保證在如此之短的時間內是否所有的細胞都受到了fd的影響。
下面針對單側縮擴陣列結構進行詳細分析,現有技術文獻【1】公開了一種單側縮擴陣列結構,該結構采用一個樣品入口,一個鞘液流入口,兩個出口,六個單側拓寬腔和五個收縮段,用以分離血細胞和血漿(尺寸為2um及2um以下的細胞);該學者以1.2ml/h的速率往樣品入口注入血液樣品,以12ml/h的速率往鞘液流入口注入磷酸鹽緩沖液,在兩個出口處分別收集到了血細胞(尺寸為2um以上的細胞)和血漿(尺寸為2um及2um以下的細胞),但是血漿(尺寸為2um及2um以下的細胞)分離效率僅為62.2%。
單側縮擴陣列結構實現細胞分離原理為:如圖4所示,在長直型矩形微通道中,細胞主要受慣性升力fl的影響,從而使細胞聚焦在靠近矩形長邊的上下兩個平衡位置;在彎形流道中,細胞會受到慣性升力fl和迪恩力fd兩個力的共同作用。當液體從拓寬段進入壓縮段時,拓寬段的液體以彎曲的路徑加速進入壓縮段,產生了迪恩渦流,細胞在此迪恩渦流中會受到迪恩力fd的影響,所以細胞在從拓寬段進入壓縮段時,將會受到fl和fd兩個力的共同作用。fl與fd的大小均與細胞在溝道的橫截面上所處的位置有關。fl和fd之間的平衡決定了細胞在微通道中的平衡位置。當fl≥fd時,細胞往側壁s1移動,當fl<fd時,細胞往側壁s2移動;尺寸較大的細胞所受fl較大,尺寸較小的細胞所受fd較大。經過若干個縮擴陣列,血細胞(尺寸為2um以上的細胞)和血漿(尺寸為2um及2um以下的細胞)就分離開來。
在上述方法中,細胞只有在從拓寬段進入壓縮段時,才會受到fd和fl兩個力的共同作用。其余階段僅受慣性升力fl的影響。fd作用在細胞上的時間十分短暫,且不能保證在如此之短的時間內是否所有的細胞都受到了fd的影響。
其次,由于在其他階段,細胞僅受fl的影響,fl會將移向側壁s1和s2的細胞拉向流道中心,使得已處于預期平衡位置的細胞偏離平衡位置,從而在一定程度上降低了分離效率。
參考文獻如下:
【1】"inertialbloodplasmaseparationinacontraction–expansionarraymicrochannel";
【2】"enhancedbloodplasmaseparationbymodulationofinertialliftforce";
【3】"continuousparticleseparationinspiralmicrochannelsusingdeanflowsanddifferentialmigration";
【4】"improvedunderstandingofparticlemigrationmodesinspiralinertialmicrofluidicdevices";
【5】"continuousinertialmicroparticleandbloodcellseparationinstraightchannelswithlocalmicrostructures"。
技術實現要素:
針對現有技術的以上缺陷或改進需求,本發明的目的在于提供一種基于慣性原理分離細胞的芯片,其中通過對其關鍵的流道結構的設置方式等(尤其是對流道內拓寬段與壓縮段的形狀及相關參數)進行改進,與現有技術相比能夠有效解決單一螺旋結構、以及單一單側縮擴陣列結構兩者細胞分離效率低的問題,并且本發明通過控制流道內每段拓寬段與壓縮段的長度、寬度、以及流道總長及高度,使得該芯片尤其能以3um和6um尺寸為界限,分離細胞。
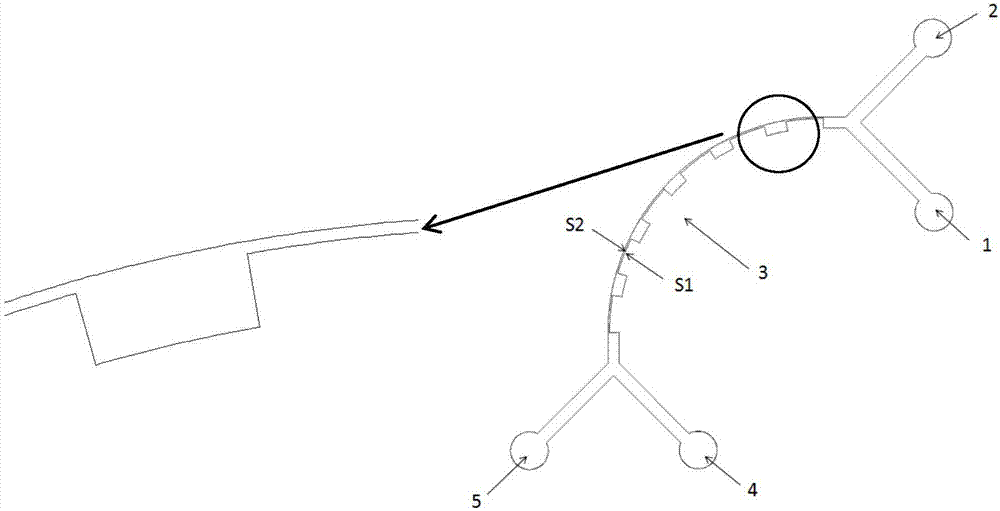
為實現上述目的,按照本發明,提供了一種基于慣性原理分離細胞的芯片,其特征在于,包括基體、以及位于該基體內的流道(3),該芯片還包括與所述流道(3)相連的樣品入口(1)、鞘液流入口(2)、大尺寸細胞出口(4)和小尺寸細胞出口(5);
其中,
所述樣品入口(1)用于向所述流道(3)的入口輸入待分離處理的細胞溶液;
所述鞘液流入口(2)用于向所述流道(3)的入口輸入鞘液流,該鞘液流用于與所述細胞溶液混合;
所述流道(3)為螺旋形或弧形;該流道(3)具有相對設置的第一側壁(s1)和第二側壁(s2),其中所述第一側壁(s1)位于靠近螺旋中心或弧形中心的內側,所述第二側壁(s2)位于遠離螺旋中心或弧形中心的外側;所述第一側壁(s1)上設置有沿該流道(3)間隔分布的凸槽,使得該流道(3)形成交錯分布的拓寬段與壓縮段,所述拓寬段對應第一側壁上分布有凸槽的區域,所述壓縮段則對應第一側壁上沒有凸槽的區域;該流道(3)用于對混合有鞘液流的細胞溶液中的細胞按大小進行分離;
所述大尺寸細胞出口(4)位于靠近螺旋中心或弧形中心的一側,用于從所述流道(3)的出口輸出含有大尺寸細胞的細胞分離液;
所述小尺寸細胞出口(5)位于遠離螺旋中心或弧形中心的一側,用于從所述流道(3)的出口輸出含有小尺寸細胞的細胞分離液;
此外,所述流道(3)的入口和出口分別位于該流道(3)的兩端。
作為本發明的進一步優選,所述流道(3)中,任意一段所述拓寬段的弧長為300~700um,任意一段所述壓縮段的弧長為300~1200um;優選的,所述拓寬段的寬度為350um,所述壓縮段的寬度為50um;該流道(3)的流道高度為20~25um;優選的,該流道(3)上第二側壁(s2)最靠近所述螺旋中心或所述弧形中心部分的曲率半徑為5mm~7mm。
作為本發明的進一步優選,所述流道(3)中,任意一段所述拓寬段的弧長為700um,任意一段所述壓縮段的弧長為1200um;所述流道(3)的高度為25um,該流道(3)的總長為23mm,所需壓縮段的個數為11個,所述拓寬段的個數為12個,該流道(3)上第二側壁(s2)最靠近所述螺旋中心或所述弧形中心部分的曲率半徑為7mm,所述大尺寸細胞的粒徑不小于6um,所述小尺寸細胞的粒徑不超過3um。
作為本發明的進一步優選,從所述樣品入口(1)輸入的所述待分離處理的細胞溶液的流速與從所述鞘液流入口(2)輸入的所述鞘液流的流速之比為1:5。
作為本發明的進一步優選,當所述流道(3)為螺旋形時,該流道(3)優選按阿基米德螺線分布。
作為本發明的進一步優選,所述基體包括上下疊加的上基體和下基體,所述流道(3)設于所述上基體和所述下基體之間。
作為本發明的進一步優選,所述鞘液流為磷酸鹽緩沖液。
作為本發明的進一步優選,所述流道(3)的截面為矩形。
本發明中基于慣性原理分離細胞的芯片通過將流道設置成具有單側縮擴陣列的螺旋/弧形結構,能夠有效提高細胞分離效率。本發明是在靠近流道螺旋中心或弧形中心的內側壁上設置沿該流道間隔分布的凸槽,形成具有交錯分布的拓寬段與壓縮段結構的流道,進一步挖掘了縮擴陣列結構與螺旋流道結構(或弧形流道結構)這兩種流道結構的優勢,充分利用流道不同區域內迪恩力與慣性升力的特點,使得縮擴陣列結構與螺旋流道結構(或弧形流道結構)兩者有機結合,有效的提高了細胞分離效率。
本發明是在靠近流道螺旋中心或弧形中心的內側壁上設置沿該流道間隔分布的凸槽,若沿外側壁上設置沿該流道間隔分布的凸槽則不能達到分離細胞的目的。當沿外側壁設置凸槽時,大顆粒所受的慣性升力是由側壁s1指向側壁s2,此時的慣性升力會將大粒子拽向側壁s2;與此同時,該溝道中小顆粒在拓寬段進入壓縮段時,受的迪恩力也從側壁s1指向側壁s2,從而將小顆粒也從側壁s1拽向側壁s2,達不到預期的分離效果。
表1:3um與6um顆粒在向內彎單側擴縮陣列圓弧結構與向外彎單側擴縮陣列圓弧結構相隔距離
注:此時的相隔距離為6um顆粒最下端與3um顆粒最上端在出口處的相隔距離,此圓弧形外側壁的曲率半徑均為7mm。表中所述6個拓寬段表示的是該溝道有6個拓寬段和5個壓縮段(壓縮段的數量一般比拓寬段的數量少一)。
本發明最靠近所述螺旋中心或所述弧形中心部分的曲率半徑為5mm~7mm。當本發明的曲率半徑小于5mm時,會導致最內側的溝道內容納不下入口1,入口2,就結構設計合理性而言,本發明的曲率半徑不小于5mm。當曲率半徑大于7mm時,會降低本發明的分離效率。
表2:3um與6um顆粒在不同曲率半徑下的分離效果
本發明的結構的高度一般在20~25um。當分離2um及2um以上的顆粒時,本結構的高度是25um。當分離2um以下的顆粒時,本結構的高度是20um。為保證粒子可在慣性升力作用下聚焦形成單列粒子束,顆粒直徑ap與流道特征尺寸即流道高度h需要滿足ap/h≥0.07。由于大顆粒在溝道中主要受慣性升力的影響,要想讓大顆粒在溝道中呈一條直線從出口流出,必須滿足ap/h≥0.07。故當分離顆粒尺寸變小時,溝道高度也應隨之變矮。
表3:3um與6um顆粒在不同高度下的相隔距離
注:此圓弧形外側壁的曲率半徑均為7mm。
相對于單一的螺旋結構,本發明中的單側縮擴陣列螺旋結構能夠在更短的流道中分離細胞。當細胞運動至拓寬流道段時,流道的拓寬使得細胞受到的壁面誘導慣性升力突然減小,小尺寸細胞會向s2側壁運動,并穩定在新的平衡位置,大尺寸細胞會向s1側壁運動,并穩定在新的平衡位置,造成大尺寸細胞的平衡位置與小尺寸的細胞平衡位置之間的間距變大。當液體從拓寬段進入壓縮段時,拓寬段的液體以彎曲的路徑加速進入壓縮段,該加速會使細胞所受的fl和fd在一定程度上加強,從而讓細胞能夠更快分離。
本發明中基于慣性原理分離細胞的芯片,其單側縮擴陣列螺旋形流道(或單側縮擴陣列弧形流道),能夠讓細胞在整個流道中都受到迪恩力的影響,相對于現有基于慣性原理分離細胞的縮擴陣列結構,能夠有效克服現有縮擴陣列結構只有當細胞從拓寬段流入收縮段時才能受到迪恩力的影響這一缺陷。
現有基于慣性原理分離細胞的縮擴陣列結構中,處于壓縮段中后部位的細胞僅受慣性升力的影響,粒子在純慣性升力作用下會如圖4所示聚焦在靠近長邊中心的兩個平衡位置上,故處于壓縮段中后部位的細胞會向流道中心偏移,偏離預期的聚焦平衡位置;而本發明中所采用的具有單側縮擴陣列螺旋形結構(或弧形結構)的流道,能夠讓細胞在整個流道中一直受到迪恩力和慣性升力的耦合作用,從而使細胞固定在預期的平衡位置上。
本發明采用單側縮擴陣列螺旋形流道,在一定程度上提高了螺旋結構的分離效率。對于螺旋結構來說,如圖5所示當細胞處于平衡位置時,不同細胞所處的橫向平衡位置之間的間距較小,易造成部分細胞混合,導致分離效率降低。本發明設計的單側縮擴陣列結構螺旋形流道中特殊的單側縮擴陣列能夠讓小尺寸細胞向s2側壁運動,大尺寸細胞會向s1側壁運動,造成大尺寸細胞的平衡位置與小尺寸的細胞平衡位置之間的間距變大,從而提高分離效率。
對于現有單一的螺旋結構,為達到預期的分離效果,所需流道總長度一般較長。在分離效果一致的情況下,本發明所設計的流道能夠在一定程度上縮短流道總長度。
對于單一的螺旋結構,由于該溝道尺寸較長,芯片所能承受的壓強有限,在一定流速內,該結構提供的fd和fl較小,限制了分離效率。本發明設計的縮擴陣列能解決這一缺陷,當細胞從拓寬段流入壓縮段時,流道突然變小使得流體加速進入壓縮段,且此時流體的速度呈幾倍增長,流速的增快提供能夠提供一個較大的fd和fl,使得細胞能夠更快的達到平衡位置。
另外,本發明中基于慣性原理分離細胞的芯片還具有以下優點:
(1)、微型化。整個芯片面積僅為幾平方厘米。所需試劑體積僅為微升級別。
(2)、提高了分離效率。應用上述微流控芯片使得大小不同的細胞經過若干個圓弧形壓縮拓寬陣列就能分離。
(3)、在線觀測。該微流控芯片可以直接在ccd倒置顯微鏡下進行觀察,用高速攝像機進行圖像記錄,操作方便。
(4)、價格低廉。芯片材質可以采用pdms和有機玻璃。試劑用量少,明顯地降低了試劑成本。
附圖說明
圖1是本發明具有單側縮擴陣列螺旋結構的分離細胞芯片其整體結構示意圖及局部放大示意;
圖2是本發明具有單側縮擴陣列圓弧結構的分離細胞芯片其整體結構示意圖及局部放大示意;
圖3是現有技術中螺旋結構的芯片實現細胞分離的原理示意圖;
圖4是現有技術中單種顆粒在直通道中只受慣性升力時所處位置示意圖;
圖5是現有技術中螺旋結構的芯片實現細胞分離的示意圖;
圖6a是6um的顆粒在沿外側壁分布凸槽的圓弧形結構中的分布仿真圖,圖6b是圖6a的局部放大圖;
圖7a是3um的顆粒在沿外側壁分布凸槽的圓弧形結構中的分布仿真圖,圖7b是圖7a的局部放大圖。
圖中各附圖標記的含義如下:1為樣品入口,2為鞘液流入口,3為細胞分離單元(即,流道),4為大尺寸細胞出口,5為小尺寸細胞出口,s1為內側壁(即,第一側壁),s2為外側壁(即,第二側壁)。
具體實施方式
為了使本發明的目的、技術方案及優點更加清楚明白,以下結合附圖及實施例,對本發明進行進一步詳細說明。應當理解,此處所描述的具體實施例僅僅用以解釋本發明,并不用于限定本發明。此外,下面所描述的本發明各個實施方式中所涉及到的技術特征只要彼此之間未構成沖突就可以相互組合。
本發明公開了一種基于慣性原理分離細胞的微流控芯片,該微流控芯片自上而下包括上基體、下基體,所述上基體可以通過鍵合的方法和下基體固聯為一體;流道凸槽位于上基板中(該流道凸槽在芯片平面上的投影如圖1所示;下基體在與上基體接觸的表面上可以不設置任何凸槽,同時下基體在與上基體接觸的表面平行于芯片平面),如圖1所示,所述流道層是一條單側縮擴陣列結構螺旋形流道,包括一個樣品入口1、一個鞘液流入口2、大尺寸細胞出口4以及小尺寸細胞出口5。細胞在流道中會受到迪恩力fd和慣性升力fl的耦合作用,流經一定長度的流道之后,不同尺寸的細胞聚焦于不同的橫向平衡位置,最終分離出不同尺寸的細胞。本芯片能夠在流速較高的情況下實現細胞分離,且所需流道結構簡單,操作簡單,通量極高,并在一定程度上提高了細胞分離效率。
本發明中基于慣性原理分離細胞的芯片,是種具有新型流道結構的細胞分離芯片,能夠高效、簡便、快速的分離細胞,該芯片的制備及使用方法可以采用如下步驟進行:
1、設計流道結構。該流道為一段具有單側縮擴陣列結構的螺旋流道,流道一端為一y字型的樣品和鞘液流入口,1為樣品入口,2為鞘液流入口,另一端為一y字型的大小細胞出口,3為大尺寸細胞的出口,4為小尺寸細胞的出口。所述的微通道截面為矩形。
2、設計流道尺寸。該流道縮擴陣列中,拓寬段弧長為300~700um,寬度為350um,壓縮段弧長為300~1200um,寬度為50um,流道高度為20~25um。
3、制作芯片。該芯片包括上基體和下基體,上基體的材質可以為聚二甲基硅氧烷(pdms),下基體材質可以為玻璃。兩個基體通過鍵合的方式結合在一起。流道凸槽設于上基體中。
4、處理細胞溶液。在該方案中一定程度稀釋的細胞樣品會大大減少流道堵塞的風險。
5、在該技術方案中,微流控芯片進樣需要動力系統。使用動力系統將細胞樣品和鞘液流以合適的速度同時從進樣口1和進樣口2注入。
6、觀察實驗結果。
以下為具體實施例:
實施例1
結合圖2所示,該細胞分離芯片包括基體、以及基體上的微通道,該通道包括細胞樣品進樣口1、鞘液流進樣口2、細胞分離單元3、大尺寸細胞出口4以及小尺寸細胞出口5。在該技術方案中,微流控芯片進樣需要動力系統,動力系統用于將細胞溶液和鞘液流分別從進樣口1和進樣口2連續注入到芯片中,本實例中的動力系統為注射器泵。鞘液流用于在入口之后的第一個拓寬段將細胞聚焦成一束并貼近s1側壁進入壓縮段。
細胞分離單元3為圓弧形通道,該通道自細胞進樣口1向內彎。外側壁s2向內彎的曲率半徑為7mm,該通道的尺寸為流道的任一拓寬段弧長為700um,寬度為350um,任一壓縮段弧長為1200um,寬度為50um,整個流道高度為25um,細胞分離單元3的長度23mm(還包括了入口部分和出口部分的長度)。細胞進樣口1、鞘液流進樣口2、大尺寸粒子出口4的直徑可優選為400um,以及小尺寸細胞出口5的直徑可優選為400um。
結合圖2所示,應用該流道分離不同尺寸的細胞原理為:在連續彎曲的微通道中,細胞主要受升力fl和迪恩力fd兩種力。fl和fd之間的平衡決定了細胞在微通道的平衡位置。當fl≥fd時,細胞往側壁s1移動,當fl<fd時,細胞往側壁s2移動;尺寸較大的細胞所受fl較大,尺寸較小的細胞所受fd較大。當細胞運動至拓寬流道段時,流道的拓寬使得細胞受到的壁面誘導慣性升力突然減小,小尺寸細胞會向s2側壁運動,并穩定在新的平衡位置,大尺寸細胞會向s1側壁運動,并穩定在新的平衡位置,造成大尺寸細胞的平衡位置與小尺寸的細胞平衡位置之間的間距變大。當液體從拓寬段進入壓縮段時,拓寬段的液體以彎曲的路徑加速進入壓縮段,該加速會使細胞所受的fl和fd在一定程度上加強,從而讓細胞能夠更快分離。
該技術方案中兩個樣品的流速會影響細胞分離效果,不同的流速比所產生的分離效率也不同。本實例中細胞樣品與鞘液流的速度比為1:5。使用兩個注射器泵將細胞樣品(稀釋的血液)和鞘液流(磷酸鹽緩沖液)分別以0.012m/s、0.06m/s的速度同時從進樣口1和進樣口2注入。(此時對應溝道中最大速度為0.8m/s)
檢測時,采用ccd倒置顯微鏡進行觀察,用高速攝像機進行視頻記錄。通過觀察,可以看見血細胞(尺寸為6um以上的細胞)逐漸往側壁s1移動,血漿(尺寸為3um及3um以下的細胞)逐漸往側壁s2移動。
微流控芯片工作流程包括:
1、準備好兩臺注射器泵,將注射器分別抽取已稀釋的血液細胞和磷酸鹽緩沖液,放在注射器泵上通過特氟龍管與芯片連接好。
2、將芯片放在ccd倒置顯微鏡下合適位置,調節焦距,進行清晰觀察。
3、打開注射器泵,調節流速,實現觀測不同尺寸的細胞分離。
表4:不同速度下,3um與6um顆粒在直溝道與單側擴縮陣列圓弧結構分離的距離
注:此時的相隔距離為6um顆粒最下端與3um顆粒最上端在出口處的相隔距離。此圓弧形結構的曲率半徑均為7mm。表中所述6個拓寬段表示的是該溝道有6個拓寬段和5個壓縮段。表中所述12個拓寬段表示的是該溝道有12個拓寬段和11個壓縮段。
表5:2um與7um顆粒在單側擴縮圓弧形結構與螺旋形結構中分離的距離
注:此時的相隔距離為7um顆粒最下端與2um顆粒最上端在出口處的相隔距離,此圓弧形結構的曲率半徑均為7mm。該螺旋形結構為continuousparticleseparationinspiralmicrochannelsusingdeanflowsanddifferentialmigration即文獻【3】中的結構,該結構模型高為50um,寬為100um,最內側曲率半徑為3mm,總長為13cm.,該表中的速度為對應模型分離效率最佳時的速度。
表6:3um與7um顆粒在三種不同模型中分離的距離
注:此時的相隔距離為6um顆粒最下端與3um顆粒最上端在出口處的相隔距離。兩個圓弧形結構的曲率半徑均為7mm。圓弧結構的尺寸為:寬50um,弧長21.6mm。此時這兩種圓弧形的弧長與直通道的長相等。
由上表可知,當次三種模型尺寸一致,速度一致時,本發明3um與7um顆粒相隔距離為141.6mm,大于另兩種結構分離距離之和。
本發明中,入口(包括樣品入口1、鞘液流入口2)與出口(包括大尺寸細胞出口4、小尺寸細胞出口5)的位置可以互換,此時,流道拓寬段對應的凸槽仍位于內側壁s1上,大尺寸細胞出口4仍位于內側壁s1的同一側上,小尺寸細胞出口5仍位于外側壁s2的同一側上。
本發明中的流道既可以是螺旋形,也可以是弧形,可根據具體待分離的細胞顆粒大小而定,例如,由表4可以看到,當單側擴縮螺旋形結構越長,粒子分離所需的最優速度就越小,如6個拓寬段單側擴縮陣列圓弧結構分離3um與6um顆粒所需最優速度為1.3m/s,而12個拓寬段單側擴縮陣列圓弧結構分離3um與6um顆粒所需最優速度為0.8m/s。由于芯片尺寸較小,且是由鍵和的方式將上下基體結合在一起,故芯所承受的壓強有限,當最優速度降低時,能夠有效降低由于溝道內部水壓過大,導致液體從入口處滲出的概率。在實際使用時,若對速度要求不那么高時,可以采用較長的溝道,用以降低由于芯片內壓強過大,而導致破裂和滲水的概率。
本發明中的流道的弧形可以為橢圓弧或正圓弧;當弧形為圓弧形時,弧形中心即圓弧圓心。另外,本發明中的流道高度也根據待分離粒子的直徑靈活調整,例如,分離10um到2um的粒子可使用高度為25um,分離1.7um到0.5um的粒子可使用高度為20um。
本發明中流道的曲率半徑均是以流道第二側壁s2的曲率半徑為基準;當流道為圓弧形,則流道各處的曲率半徑保持不變;當流道為螺旋形時,第二側壁s2最靠近螺旋中心部分的曲率半徑為5mm~7mm(即對應流道靠近螺旋中心的一端)。
本領域的技術人員容易理解,以上所述僅為本發明的較佳實施例而已,并不用以限制本發明,凡在本發明的精神和原則之內所作的任何修改、等同替換和改進等,均應包含在本發明的保護范圍之內。
- 還沒有人留言評論。精彩留言會獲得點贊!