一種利用自供氧和自酸化的電芬頓系統降解有機污染物的方法與流程
本發明屬于水處理技術領域,特別涉及一種利用自供氧和自酸化的電芬頓系統降解有機污染物的方法。
背景技術:
芬頓系統是由過氧化氫(h2o2)與激發劑組成的體系,它能生成強氧化性的羥基自由基(·oh),在水溶液中與有機物發生氧化反應使之結構破壞,最終氧化分解。芬頓氧化法可有效地處理含硝基苯、abs等的廢水,以及用于廢水的脫色、除惡臭等。因此,芬頓系統作為一種高效且環境友好的氧化系統,被廣泛地應用于環境污染治理領域。由于芬頓反應最佳的使用ph值范圍為2.8~3.0,所以在傳統的利用芬頓試劑處理廢水時需要先加入酸將廢水的ph值降低,然后將大量的fe2+與h2o2簡單混合后直接加入廢水中。在處理完成后,需要再加入堿將廢水的ph調至中性,才能達到排放標準。這種方法處理廢水需要使用大量的過氧化氫、酸和堿,不僅這些化學品的存儲運輸十分危險,而且三步法處理工藝也較為復雜。
利用兩電子氧還原反應直接制備過氧化氫是一個非常重要的化學反應。隨著芬頓試劑使用用量和使用范圍的不斷擴大,利用兩電子氧還原過程產生過氧化氫的電芬頓系統以及方法也在不斷增加,這些系統有一個共同特點,需要利用不同的方式引入空氣或純氧作為反應原料。然而在某些環境中(例如地下水),自身缺乏氧氣,同時引入空氣或純氧較為困難,從而導致傳統的電芬頓系統難以工作。
綜上所述,為了對廢水進行工藝簡單、安全、普適且高效的處理,有必要設計新的電芬頓系統與方法,實現在無外界供氧和簡單中性電解液條件下制備芬頓試劑,降解有機污染物。
技術實現要素:
為了克服上述現有技術的缺點,本發明的目的在于提供一種利用自供氧和自酸化的電芬頓系統降解有機污染物的方法,在傳統的電芬頓系統的基礎上,引入還原陰極,利用還原陰極的穩定工作來強化析氧陽極反應,以確保氧氣供應和h+離子生成,析氧陽極產生的氧氣在氧還原陰極上發生兩電子還原反應,生成過氧化氫,且不需要向體系中通入氧氣或空氣,而且析氧陽極產生的h+自由擴散到水相中,形成酸性環境,不需要向系統中加入酸調節ph值。
為了實現上述目的,本發明采用的技術方案是:
一種利用自供氧和自酸化的電芬頓系統降解有機污染物的方法,所述電芬頓系統擁有兩個陰極和一個共用陽極3,分別為氧還原陰極1,還原陰極2和析氧陽極,其中,析氧陽極位于氧還原陰極1下方,且還原陰極2可置于系統中任意位置。共用陽極3產生的氧氣自由擴散到氧還原陰極1上,在氧還原陰極1的催化層表面原位還原生成雙氧水,生成的雙氧水自由擴散到水相中,被激發產生·oh,高氧化性的·oh氧化降解有機污染物,而且共用陽極3產生的h+離子自由擴散到水相中,自發形成酸性環境。
所述還原陰極2采用析氫陰極、金屬離子還原陰極或微生物還原陰極中的任意一種或至少兩種的組合,其中,金屬離子中的金屬元素包括fe、co、ni、mn、cu中的一種或至少兩種的組合。
所述h2o2激發方式采用金屬離子、金屬含氧化合物或者紫外光中的任意一種或至少兩種的組合,其中,金屬離子和金屬含氧化合物中的金屬元素包括fe、co、ni、mn、cu中的一種或至少兩種的組合。
所述氧還原陰極1由催化劑、導電粘結劑和集流體組成,通過涂布法、輾壓法或相轉化法制備,其中,所述催化劑采用石墨、炭黑、碳纖維、碳納米管或活性炭中的任意一種或至少兩種的組合;所述集流體為碳布、不銹鋼網、鈦網或泡沫鎳中的任意一種或至少兩種的組合;所述導電粘結劑采用聚偏氟乙烯(pvdf)、聚四氟乙烯(ptfe)、聚二甲基硅氧烷(pdms)中任意一種或至少兩種的組合。
所述共用陽極為金屬電極或金屬氧化物電極,其中,金屬電極和金屬氧化物電極中金屬元素包括pt、ru、rh、fe、co、ni、mo中的任意一種或至少兩種的組合。
在電化學工作過程中,氧還原陰極1和還原陰極2采用恒壓、恒流或脈沖模式控制電極,析氧陽極作為共用對電極,電極上的電流為氧還原陰極1電流和還原陰極2電流之和。
對本發明的機理進行說明:
如圖1所示,在共用陽極3表面發生析氧反應,產生o2擴散到氧還原陰極1的表面,o2在氧還原陰極1的表面反應生成h2o2,生成的h2o2擴散進去水相,生成的雙氧水自由擴散到水相中,被激發產生·oh,高氧化性的·oh氧化降解有機污染物,而且共用陽極產生的h+離子自由擴散到水相中,自發形成酸性環境。
本發明中涉及到的主要反應式如下:
氧還原陰極:o2+2h++2e-→h2o2
析氧陽極:2h2o-4e-→o2+4h+
芬頓反應:fe2++h2o2+h+→fe3++·oh+h2o
有機物氧化反應:rh+·oh→···→氧化產物
與現有技術相比,本發明的有益效果是:
本方法以析氧陽極產生的氧氣為原料,代替主動曝氣,省去了傳統電芬頓系統中的曝氣環節。另外,本方法中的電解液可以為簡單中性電解液,在電化學過程中,自發形成的酸性環境,不需要向系統中加入酸調節ph值,省去了傳統電芬頓處理廢水中的酸化環節。
附圖說明
圖1是本發明原理示意圖。
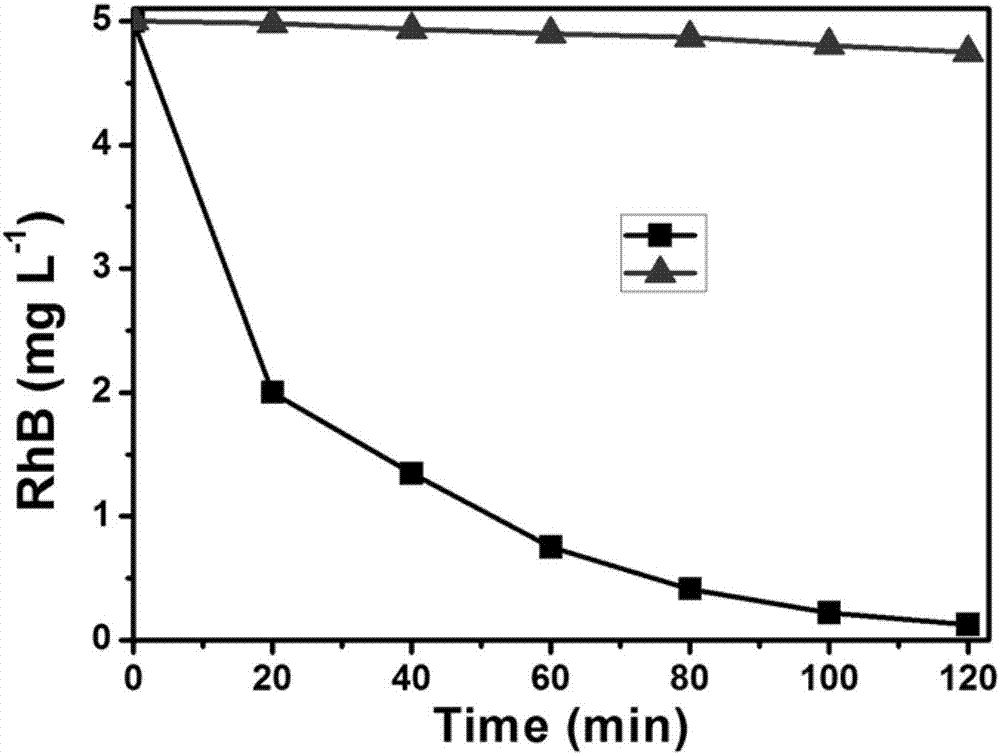
圖2是本發明實施1和對比例1中代表性有機污染物羅丹明b的時間-濃度曲線圖,其中方塊曲線表示本發明實施例1,三角塊曲線表示對比例1。
圖3是本發明實施2中析氧陽極與氧還原陰極1之間溶液的時間-ph值曲線圖。
具體實施方式
本發明生產方法通過如下實施例和對比例進行說明和驗證。
實施例1
在50mmoll-1na2so4、5mgl-1羅丹明b和0.5mmoll-1feso4的中性溶液中,利用電源向自供氧和自酸化的電芬頓系統供電,還原陰極2采用析氫陰極,析氫陰極采用恒電流模式,恒定電流為-5ma,氧還原陰極1采用恒電壓模式,恒定電壓為-0.4v(相對于ag/agcl參比電極,經過換算,-0.21v相對于標準氫電極電勢),析氧陽極作為共用對電極。取樣每隔20min取1ml,再注入1ml含羅丹明b的電解質溶液,重復7次,利用分光光度法測定羅丹明b溶度,如圖2所示。
對比例1
在50mmoll-1na2so4、5mgl-1羅丹明b和0.5mmoll-1feso4的中性溶液中,利用電源向傳統電芬頓系統供電,氧還原陰極采用恒電壓模式,恒定電壓為-0.4v(相對于ag/agcl參比電極,經過換算,-0.21v相對于標準氫電極電勢),析氧陽極作為對電極。取樣每隔20min取1ml,再注入1ml含羅丹明b的電解質溶液,重復7次,利用分光光度法測定羅丹明b溶度,如圖2所示。
實施例2
在50mmoll-1na2so4的中性溶液中,利用電源向自供氧和自酸化的電芬頓系統供電,還原陰極2采用析氫陰極,析氫陰極采用恒電流模式,恒定電流為-5ma,氧還原陰極1采用恒電壓模式,恒定電壓為-0.4v(相對于ag/agcl參比電極,經過換算,-0.21v相對于標準氫電極電勢),析氧陽極作為共用對電極。將ph計探頭放在析氧陽極與氧還原陰極1之間的溶液中,每隔20min讀取一次ph值,重復7次。在120min結束后,將溶液倒入燒杯中混合均勻,再測一次ph值,如圖3所示。
綜合實施例1和對比例1的結果可以看出,在無外界供氧(曝空氣、曝氧氣等)和初始羅丹明b濃度為5.00mgl-1的條件下,傳統氧電芬頓系統中120min后羅丹明b濃度仍高達4.76mgl-1,羅丹明b降解率僅為4.8%,而自供氧和自酸化的電芬頓系統中120min后羅丹明b濃度僅有0.18mgl-1,羅丹明b降解率高達96.4%。
綜合實施例2的結果可以看出,在溶液初始ph值為7.00且沒有加入酸調節的條件下,自供氧和自酸化的電芬頓系統中,隨電化學反應的進行,析氧陽極與氧還原陰極1之間的溶液ph值在不斷降低,自發形成酸性環境,120min后ph值降低到2.97。在還原陰極2采用析氫陰極時,混合后的ph值為6.96,近中性。
在本發明的實施例中,析氫陰極可以為硫化物電極、磷化物電極或金屬電極。氧還原陰極1由催化劑、導電粘結劑和集流體組成,通過涂布法、輾壓法或相轉化法制備,其中,催化劑采用石墨、炭黑、碳纖維、碳納米管或活性炭中的任意一種或至少兩種的組合;所述集流體為碳布、不銹鋼網、鈦網或泡沫鎳中的任意一種或至少兩種的組合;所述導電粘結劑采用聚偏氟乙烯(pvdf)、聚四氟乙烯(ptfe)、聚二甲基硅氧烷(pdms)中任意一種或至少兩種的組合。共用陽極為mmo電極或金屬電極。金屬電極包括pt、ru、rh、fe、co、ni、mo等以及以這些元素為基礎的合金電極。
申請人聲明,本發明通過上述實施例來說明本發明的詳細工藝設備和工藝流程,但本發明并不局限于上述詳細工藝設備和工藝流程,即不意味著本發明必須依賴上述詳細工藝設備和工藝流程才能實施。所屬技術領域的技術人員應該明了,對本發明的任何改進,對本發明產品各原料的等效替換及輔助成分的添加、具體方式的選擇等,均落在本發明的保護范圍和公開范圍之內。
- 還沒有人留言評論。精彩留言會獲得點贊!