一種檢測七種β?腎上腺素受體激動劑的免疫電化學傳感器及其制備方法和應用與流程
本發(fā)明屬于食品安全檢測和分析化學技術領域,具體涉及一種檢測七種β-腎上腺素受體激動劑的免疫電化學傳感器及其制備方法和應用。
背景技術:
β-腎上腺素受體激動劑,簡稱β-激動劑,是動物源性食品中檢出率最高、危害最嚴重的化學性殘留危害物,其中最著名的就是克倫特羅(clenbuterol,CL),俗稱“瘦肉精”。上世紀80年代,美國脂胺公司的科研人員意外發(fā)現(xiàn),“瘦肉精”能增強動物脂肪分解,促進蛋白質合成,大大縮短肉品上市周期,顯著提高胴體瘦肉率、飼料回報率和經濟效益。隨后在世界各地迅速推廣,80年代后期,傳入我國并在許多地區(qū)的飼料加工企業(yè)和養(yǎng)殖業(yè)推廣使用,很快成為養(yǎng)殖業(yè)應用最廣泛的“添加劑”。
“瘦肉精”除克倫特羅外,還包括沙丁胺醇(salbutamol,SAL)、萊克多巴胺(ractopamine,RAC)等20多個結構和性質相類似的化合物。這類化合物進入體內后選擇性作用于腺苷酸環(huán)化酶,導致人體產生低敏感現(xiàn)象,哮喘發(fā)生率和發(fā)病程度升高;還可導致內分泌紊亂,誘發(fā)染色體畸變及惡性腫瘤,嚴重時可致人死亡。因此我國和世界上大多數國家都明文禁止“瘦肉精”用作飼料添加劑。
目前,β-激動劑類獸藥殘留的檢測方法主要包括高效液相色譜法(HPLC)、液相色譜-質譜聯(lián)用法(LC-MS)、氣相色譜-質譜聯(lián)用法(GC-MS)、酶聯(lián)免疫法(ELISA)和熒光免疫法(FIA)等。
色譜法是β-激動劑獸藥殘留的主要檢測方法,但是色譜法檢測成本高、操作復雜、大量的陰性樣品重復檢測;而酶聯(lián)免疫法具有特異性強、樣品前處理簡單等優(yōu)點,但特異性強的特點同時也決定了它的致命缺點:一種酶聯(lián)免疫試劑盒或試紙條只能檢測一種獸藥殘留,而無法檢測其它的同類獸藥殘留,這就是容易出現(xiàn)漏檢的原因(如2011年轟動全國的“雙匯瘦肉精”事件);此外,隨著β-激動劑多種替代品的出現(xiàn),如果進行完全檢測,一個樣品需要使用多種檢測產品,大大提高了檢測成本和工作時間,失去了快速篩選的意義。
多殘留免疫分析能同時檢測一類藥物殘留,其低成本、高通量、快速現(xiàn)場的優(yōu)點是現(xiàn)有的色譜法和特異性免疫方法無法比擬的,是未來食品安全檢測領域的關鍵技術之一,逐漸引起重視。
技術實現(xiàn)要素:
針對現(xiàn)有技術的不足,本發(fā)明的目的在于提供一種檢測七種β-腎上腺素受體激動劑的免疫電化學傳感器及其制備方法和應用,所述電化學傳感器基于寬譜特異性抗體抗體的交叉反應來實現(xiàn)七種β-腎上腺素受體激動劑的檢測。
為解決現(xiàn)有技術問題,本發(fā)明采取的技術方案為:
一種檢測七種β-腎上腺素受體激動劑的免疫電化學傳感器,包括基底玻碳電極,和依次涂布在所述基底玻碳電極表面的石墨烯/殼聚糖混合膜層、檢測層,所述檢測層的材料為β-激動劑通用半抗原4-(4-(2-叔丁胺基)1-羥乙基)苯基丁酸(TBPBA)溶液,β-激動劑通用半抗原4-(4-(2-叔丁胺基)1-羥乙基)苯基丁酸的結構式為
作為改進的是,所述檢測曾上設有封閉層。
作為改進的是,所述封閉層的材料為牛血清蛋白溶液。
上述檢測七種β-腎上腺素受體激動劑的免疫電化學傳感器的制備方法為,在潔凈的基底玻碳電極表面滴涂石墨烯/殼聚糖分散液,晾干形成膜層,然后在膜層表面滴涂4-(4-(2-叔丁胺基)1-羥乙基)苯基丁酸溶液,晾干得免疫電化學傳感器。
作為改進的是,所述石墨烯/殼聚糖分散液的體積為2-20μl,濃度為5mg/ml。
作為改進的是,所述4-(4-(2-叔丁胺基)1-羥乙基)苯基丁酸溶液的濃度為0.2mg/ml。
上述一種檢測七種β-腎上腺素受體激動劑的免疫電化學傳感器在食品中β-腎上腺素受體激動劑檢測中的應用。
作為改進的是,所述所述β-腎上腺素受體激動劑為克倫特羅、沙丁胺醇、馬布特羅、溴布特羅、西布特羅、妥布特羅或特步他林。
有益效果
本發(fā)明的傳感器以K3[Fe(CN)6]為探針,基于抗TBPBA-BSA抗體對β-激動劑的交叉免疫反應,能實現(xiàn)對克倫特羅、沙丁胺醇、馬布特羅、溴布特羅、西布特羅、妥布特羅和特步他林七種β-激動劑的檢測。所述的傳感器快速、高效、靈敏度高,并且所述的方法具有較低的檢出限(0.3ng/ml~0.5ng/ml)和較寬的線性范圍(50~5000ng/ml或10~7000ng/ml)。本發(fā)明免疫電化學傳感器檢測前樣品處理簡單,檢測操作簡便,靈敏度高,可實現(xiàn)多殘留檢測等優(yōu)點,實用價值極強,市場潛力巨大。
附圖說明
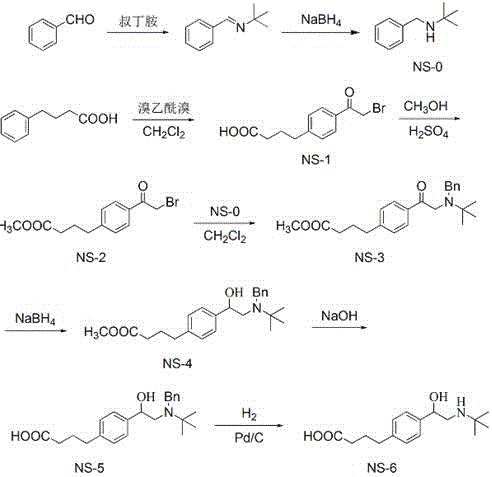
圖1為通用半抗原TBPBA的合成路線圖。
圖2為石墨烯/殼聚糖/TBPBA修飾的免疫電化學傳感器在含有效價濃度為1:6400的β-激動劑寬譜特異性抗體和不同濃度的游離的克倫特羅(a)6000ng/ml,(b)5000ng/ml,(c)4000ng/ml,(d)3000ng/ml,(e)1000ng/ml,(f)500ng/ml,(g)100ng/ml,(h)50ng/ml,(i)0的孵育液中孵育后,在2mmol/L的K3[Fe(CN)6]的磷酸緩沖溶液中的DPV曲線圖。
圖3為響應電流的變化ΔI與克倫特羅濃度的工作曲線圖。
圖4為石墨烯/殼聚糖/TBPBA修飾的免疫電化學傳感器在含有效價濃度為1:6400的β-激動劑寬譜特異性抗體和不同濃度的游離的沙丁胺醇(a)7000ng/ml,(b)5000ng/ml,(c)2000ng/ml,(d)1000ng/ml,(e)100ng/ml,(f)10ng/ml,(g)0ng/ml的孵育液中孵育后,在2mmol/L的K3[Fe(CN)6]的磷酸緩沖溶液中的DPV曲線圖。
圖5為響應電流的變化ΔI與沙丁胺醇濃度的線性曲線圖。
圖6為石墨烯/殼聚糖/TBPBA修飾的免疫電化學傳感器在含有效價濃度為1:6400的β-激動劑寬譜特異性抗體和不同濃度的游離的馬布特羅(a)5000ng/ml,(b)4000ng/ml,(c)3000ng/ml,(d)2000ng/ml,(e)1000ng/ml,(f)500ng/ml,(g)100ng/ml,(h)50ng/ml,(i)0ng/ml的孵育液中孵育后,在2mmol/L的K3[Fe(CN)6]的磷酸緩沖溶液中的DPV曲線圖。
圖7為響應電流的變化ΔI與馬布特羅濃度的線性曲線圖。
具體實施方式
實施例1β-激動劑通用半抗原4-(4-(2-叔丁胺基)1-羥乙基)苯基丁酸(TBPBA)的合成
(1)芐基叔丁胺(NS-0)
將4.8ml苯甲醛溶解于無水乙醇中,再加入5ml叔丁胺,室溫反應2h后再加入1.8g硼氫化鈉反應1h。用二氯甲烷萃取后經過硅膠柱純化,得到產物NS-06.2g。
(2)4-(4-溴乙酰基)苯基丁酸(NS-1)
將8.56g無水氯化鋁溶解于二氯甲烷中,加入1.64ml溴乙酰溴反應0.5h,再加入2.19g4-苯基丁酸反應3-5h。用二氯甲烷萃取后蒸去溶劑,得到產物3.5g。
(3)4-(4-溴乙酰基)苯基丁酸甲酯(NS-2)
將2.85g NS-1溶解于甲醇中,加入濃硫酸加熱回流3h。蒸去甲醇后用二氯甲烷萃取,除去溶劑并純化,得到產物2.6g。
(4)4-(4-(2-芐基叔丁胺基)乙酰基)苯基丁酸甲酯(NS-3)
將203mg NS-0和337mg NS-2溶解于乙腈中,加入314mg無水碳酸鉀反應過夜。加水后用二氯甲烷萃取,經過硅膠柱純化,得到產物187mg。
(5)4-(4-(2-芐基叔丁胺基)1-羥乙基)苯基丁酸甲酯(NS-4)
將74mg NS-3溶解于甲醇中,加入11mg硼氫化鈉反應1h。加酸后用二氯甲烷萃取,經過硅膠柱純化,得到產物41mg。
(6)4-(4-(2-芐基叔丁胺基)1-羥乙基)苯基丁酸(NS-5)
將45mg NS-4溶解于甲醇中,加入氫氧化鈉反應過夜。加酸后用二氯甲烷萃取,經過硅膠柱純化,得到產物39mg。
(7)4-(4-(2-叔丁胺基)1-羥乙基)苯基丁酸(TBPBA)
將37mg NS-5和適量鈀碳加入到盛有甲醇的反應瓶中,置換空氣后反應2h。過濾后過硅膠柱純化,得終產物,即通用半抗原TBPBA 39mg。
實施例2用半抗原-牛血清白蛋白(TBPBA-BSA)偶聯(lián)物的制備
將0.2mmol TBPBA溶于無水乙醇中,加入等量N-羥基琥珀酰亞胺(NHS)和1-[3-(二甲氨基)丙基]-3乙基碳二亞胺碳酸鹽(EDC),室溫下反應3~5h。將上述反應液緩慢加入到5~10ml含有5~10mg/ml牛血清白蛋白(BSA)的磷酸緩沖溶液中,室溫反應過夜。將上述反應液用磷酸緩沖溶液透析3~6次,冷凍干燥即可得到TBPBA-BSA偶聯(lián)物凍干粉。
實施例3寬譜特異性抗體(抗TBPBA-BSA抗體)的制備
用TBPBA-BSA偶聯(lián)物作為免疫原免疫體重約2kg的健康大白兔。首次免疫時將0.25mg免疫原與等量弗氏完全佐劑混合并充分乳化,背部皮下多點注射。兩周后用同樣劑量免疫原與等量弗氏不完全佐劑進行乳化并進行加強免疫,每兩周加強免疫一次,共加強三次。最后一次免疫10天后對大白兔進行頸靜脈采血,放在4℃環(huán)境下靜置30min,再用硫酸銨多級沉淀法進行純化,即可得到抗TBPBA-BSA多克隆抗體。
實施例4免疫電化學傳感器的制備
將直徑為3mm的玻碳電極依次用直徑為0.3μm和0.05μm的Al2O3拋光粉打磨,依次用無水乙醇-蒸餾水、蒸餾水超聲清洗5min,再用蒸餾水沖洗干凈。在電極上滴涂4μl石墨烯/殼聚糖(濃度為5mg/ml)分散液,然后將2μl的通用半抗原TBPBA溶液(濃度為0.2mg/ml)滴涂于電極表面,室溫下晾干。最后將電極浸泡在質量百分為濃度5%的BSA溶液中,在37℃烘箱中孵育30min,以封閉剩余的活性位點。
實施例5對克倫特羅的檢測
將實施例4中制備的免疫電化學傳感器浸入總體積為50μL的含有不同濃度的游離克倫特羅,和效價濃度為1:6400的抗TBPBA-BSA抗體的磷酸緩沖溶液中,在37℃孵育30min,用磷酸緩沖溶液沖洗后于2mmol/L的K3[Fe(CN)6]溶液中進行差分脈沖伏安(DPV)掃描(圖2)。
將在克倫特羅濃度為0的孵育液中孵育后的修飾電極的DPV峰電流定義為I0,在含有不同濃度克倫特羅的孵育液孵育后的修飾電極的DPV峰電流定義為IX,計算ΔI=IX-I0,以ΔI對克倫特羅濃度(C)作圖可得ΔI-C工作曲線(圖3)。采用線性回歸法得到ΔI-C線性回歸方程:Y=1.07415+0.00134X,克倫特羅的濃度在50~6000ng/ml范圍內與ΔI成正比,線性相關系數為0.9932。以大于噪音信號3倍的電流信號對應的濃度為最低檢出限,重復5次以上實驗得出,上述方法的最低檢出限為0.4ng/ml。
實施例6對沙丁胺醇的檢測
將實施例4中制備的免疫電化學傳感器浸入總體積為50μL的含有不同濃度的游離沙丁胺醇,和效價濃度為1:6400的抗TBPBA-BSA抗體的磷酸緩沖溶液中,在37℃孵育40min,用磷酸緩沖溶液沖洗后于2mmol/L的K3[Fe(CN)6]溶液中進行差分脈沖伏安(DPV)掃描(圖4)。
將在沙丁胺醇濃度為0的孵育液中孵育后的修飾電極的DPV峰電流定義為I0,在含有不同濃度沙丁胺醇的孵育液孵育后的修飾電極的DPV峰電流定義為IX,計算ΔI=IX-I0,以ΔI對沙丁胺醇濃度(C)作圖可得ΔI-C工作曲線(圖5)。采用線性回歸法得到ΔI-C線性回歸方程:Y=1.20866+0.0014X,沙丁胺醇的濃度在10~7000ng/ml范圍內與ΔI成正比,線性相關系數為0.99366。以大于噪音信號3倍的電流信號對應的濃度為最低檢出限,重復5次以上實驗得出,上述方法的最低檢測限為0.3ng/ml。
實施例7對馬布特羅的檢測
將實施例4中制備的免疫電化學傳感器浸入總體積為50μL的含有不同濃度的游離馬布特羅,和效價濃度為1:6400的抗TBPBA-BSA抗體的磷酸緩沖溶液中,在37℃孵育30min,用磷酸緩沖溶液沖洗后于2mmol/L的K3[Fe(CN)6]溶液中進行差分脈沖伏安(DPV)掃描(圖6)。
將在馬布特羅濃度為0的孵育液中孵育后的修飾電極的DPV峰電流定義為I0,在含有不同濃度馬布特羅的孵育液孵育后的修飾電極的DPV峰電流定義為IX,計算ΔI=IX-I0,以ΔI對馬布特羅濃度(C)作圖可得ΔI-C工作曲線(圖7)。采用線性回歸法得到ΔI-C線性回歸方程:Y=3.09399+0.0006734X,馬布特羅的濃度在50~5000ng/ml范圍內與ΔI成正比,線性相關系數為0.99645。以大于噪音信號3倍的電流信號對應的濃度為最低檢出限,重復5次以上實驗得出,上述方法的最低檢測限為0.5ng/ml。
實施例8豬肉樣品中加標妥布特羅的測定
步驟1,豬肉樣品的處理:稱取1±0.0050g豬肉于到10ml的樣品管中,加入妥布特羅標準液,和3ml乙腈-丙酮提取液(V:V=4:1),混合物超聲振蕩30分鐘,于2000r/m下離心10分鐘,將上清液轉移至氮吹管中,殘渣用3ml的相同提取液重復提取1次,上清液合并在氮吹管中。提取物在氮吹條件下于50℃溫度下濃縮蒸發(fā),濃縮物加入1ml的pH為7.4磷酸緩沖溶液溶解后用于電化學分析。
步驟2,豬肉樣品中加標妥布特羅的測定:分別取等量的不同豬肉提取液樣品,和抗TBPBA-BSA抗體溶液及磷酸緩沖溶液混合配成孵育液,使得總體積為50μl,且抗TBPBA-BSA抗體的濃度均相等。將石墨烯/殼聚糖/TBPBA修飾的免疫電化學傳感器浸入孵育液中,在37℃孵育25min,用磷酸緩沖溶液沖洗后于2mmol/L的K3[Fe(CN)6]溶液中進行差分脈沖伏安(DPV)掃描。定義空白樣品的峰電流為I0,其他樣品的峰電流IX,計算△I=IX-I0。以與實施例7中相同的方法得到的DPV峰電流差值ΔI與妥布特羅的濃度C的ΔI-C工作曲線,得到妥布特羅的濃度,檢測回收率結果如表1。
表1為免疫傳感器檢測加標豬肉中的妥布特羅濃度的回收率
實施例9鴨肉樣品中加標溴布特羅的測定
步驟1,鴨肉樣品的處理:稱取1±0.0050g鴨肉于到10ml的樣品管中,加入溴布特羅標準液,按照與實施例8步驟1)中相同的方法進行鴨肉樣品前處理。
步驟2,鴨肉樣品中加標溴布特羅的測定:分別取等量的不同鴨肉提取液樣品,和抗TBPBA-BSA抗體溶液及磷酸緩沖溶液混合配成孵育液,按照與實施例7步驟2)中相同的方法進行鴨肉樣品中加標溴布特羅的檢測,檢測回收率結果如表2。
表2為免疫傳感器檢測加標鴨肉中的溴布特羅濃度的回收率。
實施例10牛肉樣品中加標西布特羅的測定
步驟1,牛肉樣品的處理:稱取1±0.0050g牛肉于到10ml的樣品管中,加入西布特羅標準液,按照與豬肉樣品中加標妥布特羅的測定中步驟1)中相同的方法進行牛肉樣品前處理。
步驟2,牛肉樣品中加標西布特羅的測定:分別取等量的不同牛肉提取液樣品,和抗TBPBA-BSA抗體溶液及磷酸緩沖溶液混合配成孵育液,按照與豬肉樣品中加標妥布特羅的測定中步驟2)中相同的方法進行牛肉樣品中加標西布特羅的檢測,檢測回收率結果如表3。
表3為免疫傳感器檢測加標牛肉中的西布特羅濃度的回收率。
通過實驗檢測可知,本發(fā)明傳感器對克倫特羅和溴布特羅的檢測限為0.4ng/mL,線性范圍為50~6000ng/mL;對沙丁胺醇和特步他林的檢測限為0.3ng/mL,線性范圍為10~7000ng/mL;對馬布特羅和西布特羅的檢測限為0.5ng/mL,線性范線性范圍為50~5000ng/mL;對妥布特羅的檢測限為0.5ng/mL,線性范圍為50~6000ng/mL,為食品安全提供了保障。
- 還沒有人留言評論。精彩留言會獲得點贊!
- 包含與β-3-腎上腺素能受體激動劑組合的去氨加壓素的方法和組合物的制作方法
- 具有毒蕈堿受體拮抗體和β2腎上腺素能受體激動劑兩種活性的2-氨基-1-羥乙基-8-羥基 ...的制作方法
- 靶向于肌動蛋白結合蛋白Transgelin-2的化合物及其新用圖
- 一種α-2腎上腺素受體和σ受體配體的組合物的制作方法
- 天然植物皂苷功效組分的篩選方法及用圖
- 通過玻璃體內和前房內途徑用于治療眼內壓和眼部疾病的α-2腎上腺素能激動劑的制作方法
- 用于治療組織創(chuàng)傷的α-腎上腺素能激動劑的制作方法
- 具有β2腎上腺素能受體激動劑和M3毒蕈堿受體拮抗劑兩種活性的2-氨基-1-羥乙基-8-羥 ...的制作方法
- 具有毒蕈堿受體拮抗劑和β2腎上腺素能受體激動劑活性的化合物的制作方法
- 具有毒蕈堿受體拮抗劑和β2腎上腺素能受體激動劑活性的化合物的制作方法
- 用于吸入給藥包含皮質類固醇和beta-腎上腺素能藥物的干粉配制劑的制作方法
- 用于吸入給藥包含皮質類固醇和beta-腎上腺素能藥物的干粉配制劑的制作方法
- 一種米拉貝隆藥物組合物及其制備方法
- Adrb1,grk5基因多態(tài)性的檢測方法
- 包含與β-3-腎上腺素能受體激動劑組合的去氨加壓素的方法和組合物的制作方法
- 一種高靈敏度的納米氧化鋯摻雜的貝凡洛爾分子印跡電化學傳感器的制備方法
- 具有毒蕈堿受體拮抗體和β2腎上腺素能受體激動劑兩種活性的2-氨基-1-羥乙基-8-羥基 ...的制作方法
- 用于減少或防止轉移的組合物和方法
- 靶向于肌動蛋白結合蛋白Transgelin-2的化合物及其新用圖
- 一種鹽酸多培沙明注射液及其制備方法
- 腺苷a-的制作方法
- 用于治療或預防α-2B-腎上腺素受體介導疾病的化合物的制作方法
- 作為β-腎上腺素能受體激酶1抑制劑的吡唑并吡啶衍生物的制作方法
- 一種(±)-去甲腎上腺素的制備方法
- 有神經病痛治療用血清素和去甲腎上腺素再攝取綜合抑制作用的4-[2-(4-甲基苯硫基 ...的制作方法
- 去甲腎上腺素完全抗原的制備方法及偶聯(lián)摩爾比測定方法
- 用于調節(jié)β2腎上腺素受體活性的4-羥基-2-氧代-2,3-二氫-1,3-苯并噻唑-7-基化合物的制作方法
- 胺衍生物及其在β2腎上腺素受體介導的疾病中的用途的制作方法
- 具有血清素源性活性和/或去甲腎上腺素能活性的取代芳氧基丙胺的制作方法
- 可用作腎上腺素能受體的甲酰胺衍生物的制作方法