器官保存液的制作方法
本發明涉及器官保存液,更詳細而言,涉及配合有l-抗壞血酸和l-抗壞血酸磷酸酯而成的器官保存液。
背景技術:
器官保存液作為器官移植時用于對已切除的器官進行灌注并浸漬的液體是已知的。若長時間中斷血流,則生物體內的器官陷入壞死,因此,盡管已開發出了用于長時間運送為移植而摘取的器官的各種方法,但其中臨床上應用最多的是單純冷卻法。該單純冷卻法中主要使用的是器官保存液。對于已摘取的器官而言,通過利用器官保存液進行灌注,并在摘取后利用相同的已冷卻的器官保存液進行浸漬,從而預防壞死。
目前在器官移植的臨床實踐中通常使用的器官保存液是威斯康星大學液(universityofwisconsin:uw液/腎臟·肝臟·胰臟等)、euro-collins液(euro-collins:ec液/腎臟)、celsior(注冊商標/心臟)、lactateringer液(肺)、組氨酸-色氨酸-酮戊二酸鹽液(histidine-tryptophan-ketoglutarate:htk液/肝臟·心臟·胰臟·腎臟·小腸)、et-kyoto液等。除了作為緩沖液發揮作用以外,還設法為了防止因冰凍而導致的細胞膨脹而添加糖、或者添加抗氧化劑,由此防止缺血再灌注損傷的發生等。
此處所謂缺血再灌注損傷,是指對處于缺血狀態的器官、組織進行血液再灌注時,在該器官·組織內的微小循環中導致各種毒性物質產生從而引起的損傷,多見于器官移植后。作為引起損傷的機制,認為是下述機制:由超氧化物(o2-)、羥基自由基(ho·)等活性氧、一氧化氮(no)等自由基的產生而導致的損傷;由各種細胞因子、內皮素、花生四烯酸等各種化學介質的產生而導致的損傷;基于活化中性粒細胞與血管內皮細胞的相互作用的損傷等。
抗壞血酸是強抗氧化劑,因此,認為其在用于除去活性氧中是有用的,該活性氧產生于缺血再灌注損傷時,是損傷移植器官的原因之一。但是,由于抗壞血酸因自動氧化而迅速消失(例如,參見非專利文獻1),因而無法作為器官保存液的組成成分使用,已有在體外(invitro)添加被稱為抗壞血酸2-葡糖苷的穩定型抗壞血酸(其中通過與葡萄糖的鍵合而將與氧化還原反應相關的部位掩蔽)的研究(例如,參見非專利文獻2)。需要說明的是,抗壞血酸2-葡糖苷在沒有進入細胞內時是不具有效果的前體藥物,實際用于保存摘取器官時,未必能夠獲得保存器官的效果。
另一方面,雖然報道了通過向培養細胞的培養基中以特定的濃度比添加抗壞血酸和抗壞血酸磷酸酯,能夠使抗壞血酸穩定地存在(例如,參見非專利文獻3),但該結果只不過是顯示出在細胞培養時抗壞血酸穩定地存在,其并未體現摘取出的器官能否長期保持其功能。
另外,含有半胱氨酸(例如,參見非專利文獻4及5)的器官保存液、含有甘氨酸(例如,參見非專利文獻6及7)的器官保存液、在日本較頻繁使用的含有海藻糖的器官保存液et-kyoto(例如,非專利文獻8)中進一步含有蛋白酶抑制劑的m-kyoto是已知的。
作為其他器官保存液,已知有含有特定的類黃酮糖苷的器官保存液(專利文獻1),含有肝細胞增殖因子(hgf)的器官保存用溶液(專利文獻2),含有卵磷脂化超氧化物歧化酶的器官保存液(專利文獻3),以高含量含有硫酸鹽、以低含量含有氯的器官保存用溶液(專利文獻4),含有平均分子量為50萬~65萬的羥乙基淀粉、且鉀離子與鈉離子的摩爾比為0.4~0.8、ph值為7.1~7.5、滲透壓為280~330mosm/l、粘度為1.8~2.5cp的器官保存液(專利文獻5)、含有d-阿洛糖等稀有糖的保存液(專利文獻6)等。
現有技術文獻
專利文獻
專利文獻1:日本特開2009-221128
專利文獻2:日本特開2005-306749
專利文獻3:日本特開2002-60301
專利文獻4:日本特開平10-245301
專利文獻5:日本特開平9-328401
專利文獻6:wo2005/115141
非專利文獻
非專利文獻1:freeradicrescommun.1986;1(6):349-53.
非專利文獻2:celltransplant.2003;12(6):599-606.i
非專利文獻3:invitrocell.dev.biol.--animal37:26-30,january2001
非專利文獻4:transplantproc.2011oct;43(8):2897-9
非專利文獻5:jheartlungtransplant.2005sep;24(9):1369-77.
非專利文獻6:transplantation.2003mar15;75(5):591-8.
非專利文獻7:transplint.1994may;7(3):195-200
非專利文獻8:yonseimedj.2004dec31;45(6):1107-14.
技術實現要素:
發明要解決的課題
本發明的課題在于提供能夠有效地防止由總缺血時間的延長而導致的缺血再灌注損傷的發生的器官保存液。
用于解決課題的手段
本申請的發明人針對上文所述的以往提案的器官保存液中添加的各成分對其組合等進行了反復試驗,發現除了l-抗壞血酸及l-抗壞血酸磷酸酯以外還配合有磷酸氫二鈉及磷酸二氫鈉、以及氯化鉀和d-葡萄糖、進一步還配合有甘氨酸、l-半胱氨酸、鐵化合物而得到的器官保存液在防止發生缺血再灌注損傷方面比目前使用的器官保存液優異,從而完成了本發明。
即,本發明涉及下述各項限定的技術方案。
(1)一種器官保存液,其含有氯化鉀、磷酸氫二鈉、磷酸二氫鈉、l-抗壞血酸、l-抗壞血酸磷酸酯、及d-葡萄糖的配合物。
(2)如上述(1)所述的器官保存液,其特征在于,配合物還含有甘氨酸。
(3)如上述(2)所述的器官保存液,其特征在于,配合物還含有l-半胱氨酸。
(4)如上述(3)所述的器官保存液,其特征在于,配合物還含有鐵化合物。
(5)如上述(1)~(4)中任一項所述的器官保存液,其特征在于,配合物中的l-抗壞血酸濃度為0.2~0.3mm,l-抗壞血酸磷酸酯濃度為0.4~0.5mm。
(6)如上述(1)~(5)中任一項所述的器官保存液,其特征在于,配合物中的磷酸氫二鈉濃度為35~50mm,磷酸二氫鈉濃度為12~18mm。
(7)如上述(1)~(6)中任一項所述的器官保存液,其特征在于,其中配合有d-葡萄糖,至滲透壓為326~363mosm/kg。
(8)如上述(2)~(7)中任一項所述的器官保存液,其特征在于,配合物中的甘氨酸濃度為5~15mm。
(9)如上述(3)~(8)中任一項所述的器官保存液,其特征在于,配合物中的l-半胱氨酸濃度為0.5~0.7mm。
(10)如上述(4)~(9)中任一項所述的器官保存液,其特征在于,鐵化合物為硫酸亞鐵。
(11)一種保存器官的方法,其中,使用上述(1)~(10)中任一項所述的器官保存液。
發明的效果
通過將移植用器官浸漬于本發明的器官保存液中,能夠有效地防止由總缺血時間的延長而導致的缺血再灌注損傷的發生。
附圖說明
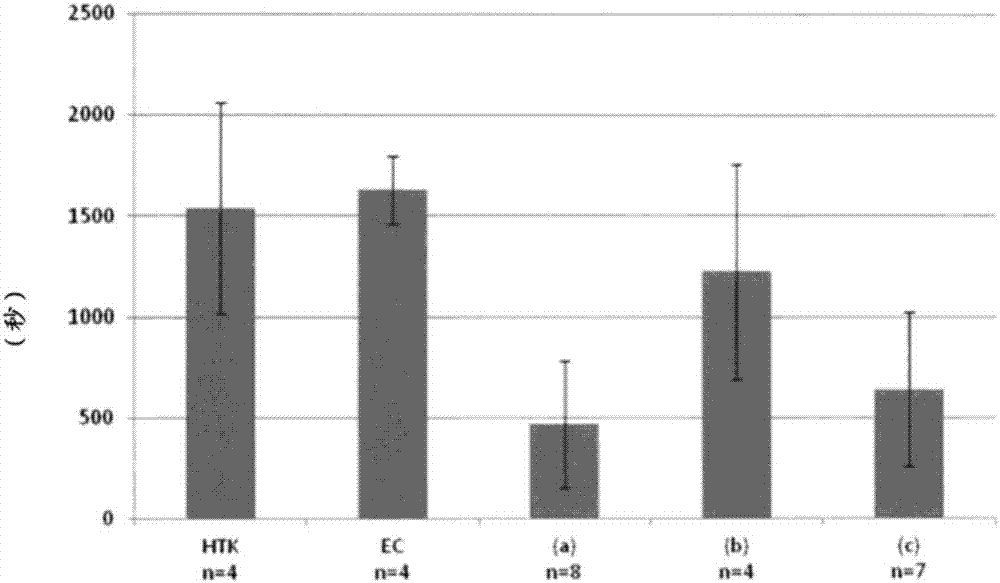
[圖1]是針對將在htk液、ec液、uw液及保存液(a)~(c)的各保存液的任一者中浸漬了24小時的心臟進行異位心臟移植后的各小鼠個體示出直到移植心臟開始跳動所經時間的測定結果的圖。
[圖2]是針對將在htk液、ec液及保存液(a)~(c)的各保存液的任一者中浸漬了48小時的心臟進行異位心臟移植后的各小鼠個體示出直到移植心臟開始跳動所經時間的測定結果的圖。
[圖3]是針對將在uw液、保存液(d)3及保存液(d)6的各保存液的任一者中浸漬了24小時的心臟進行異位心臟移植后的各小鼠個體示出對直到移植心臟開始跳動所經時間的測定結果的圖。
[圖4]是針對將在uw液、保存液(d)3及保存液(d)6的各保存液的任一者中浸漬了24小時的心臟進行異位心臟移植后的各小鼠個體示出移植后的經過天數與心臟成活率的關系的圖。
[圖5]是針對將在uw液、保存液(d)3、保存液(d)6、及保存液(d)7的各保存液的任一者中浸漬了48小時的心臟進行異位心臟移植后的各小鼠個體示出直到移植心臟開始跳動所經時間的測定結果的圖。
[圖6]是針對將在uw液、保存液(d)3、保存液(d)6、及保存液(d)7的各保存液的任一者中浸漬了48小時的心臟進行異位心臟移植后的各小鼠個體示出移植后的經過天數與心臟成活率的關系的圖。
[圖7]是針對進行了異位心臟移植的各小鼠個體示出直到經移植的心臟開始跳動所經時間的圖。
[圖8]是示出進行了異位心臟移植的各小鼠血清中的ldh及cpk的產生量的圖。
[圖9]是示出經移植的心臟的成活率的圖。
[圖10]是示出已摘取及/或經移植的心臟的atp量的圖。
[圖11]示出了經ttc染色的移植心臟切片。
[圖12](上部的圖)示出了血管周圍水腫區域相對于血管周圍區域的比例。(下部的照片)示出了經h/e(蘇木精/曙紅)染色的移植心臟切片。
[圖13]示出了使用抗cd68抗體(克隆:fa-11,biolegend公司制)、利用酶標記抗體法而染成藍紫色的移植心臟切片。
[圖14]示出了經tunel染色的移植心臟切片。
[圖15]是示出移植心臟切片中發生了細胞凋亡的細胞的比例的圖。
[圖16]示出了利用抗8-ohdg抗體以酶標記抗體法染色、同時還利用將核染成藍色的蘇木精進行了染色的移植心臟切片。
[圖17]是示出經移植的心臟的全部細胞中的8-ohdg陽性細胞的比例的圖。
[圖18]是示出進行了異位心臟移植的各小鼠血清中的8-ohdg量的圖。
[圖19]是示出將小鼠的移植心臟的組織破碎并進行定量rt-pcr時的各種炎癥·氧化應激標記物相關基因的mrna的表達量的圖。各圖的柱從左開始表示naive、fresh、htk-48hr-poh24、c-48hr-poh24。
具體實施方式
作為本發明的器官保存液,只要是含有氯化鉀、磷酸氫二鈉、磷酸二氫鈉、l-抗壞血酸、l-抗壞血酸磷酸酯、及d-葡萄糖的各成分的配合物的器官保存液(a)、含有氯化鉀、磷酸氫二鈉、磷酸二氫鈉、l-抗壞血酸、l-抗壞血酸磷酸酯、甘氨酸、及d-葡萄糖的各成分的配合物的器官保存液(b)、含有氯化鉀、磷酸氫二鈉、磷酸二氫鈉、l-抗壞血酸、l-抗壞血酸磷酸酯、l-半胱氨酸、甘氨酸、及d-葡萄糖的各成分的配合物的器官保存液(c)、含有氯化鉀、磷酸氫二鈉、磷酸二氫鈉、l-抗壞血酸、l-抗壞血酸磷酸酯、l-半胱氨酸、甘氨酸、鐵化合物、及d-葡萄糖的各成分的配合物的器官保存液(d)即可,沒有特別限制,本發明的器官保存液可以以向蒸餾水等中添加并溶解上述各成分而得到的配合物的形式進行制備。另外,各成分的配合濃度只要在作為移植用器官的保存液能夠達成本發明的課題的范圍內即可,沒有特別限定。
在上述成分中,無機鹽以電離狀態存在于溶液中,因此,本發明的器官保存液(a)含有氯化物離子、鉀離子、鈉離子、hpo42-、h2po4-、l-抗壞血酸、l-抗壞血酸磷酸酯、及d-葡萄糖,器官保存液(b)含有氯化物離子、鉀離子、鈉離子、hpo42-、h2po4-、l-抗壞血酸、l-抗壞血酸磷酸酯、甘氨酸、及d-葡萄糖,器官保存液(c)含有氯化物離子、鉀離子、鈉離子、hpo42-、h2po4-、l-抗壞血酸、l-抗壞血酸磷酸酯、l-半胱氨酸、甘氨酸、及d-葡萄糖,器官保存液(d)含有氯化物離子、鉀離子、鈉離子、hpo42-、h2po4-、l-抗壞血酸、l-抗壞血酸磷酸酯、l-半胱氨酸、甘氨酸、鐵離子、及d-葡萄糖而成。
例如,作為配合物中的氯化鉀的濃度,可合適地例舉5~25mm、優選10~20mm、更優選13~17mm。即,作為配合物中的氯化物離子、鉀離子的濃度,可合適地例舉5~25mm、優選10~20mm、更優選13~17mm。
作為配合物中的磷酸氫二鈉的濃度,可合適地例舉25~60mm,優選35~50mm、更優選40~45mm。即,作為配合物中的hpo42-的濃度,可合適地例舉25~60mm、優選35~50mm、更優選40~45mm。另外,作為配合物中的磷酸二氫鈉的濃度,可合適地例舉10~20mm、優選12~18mm、更優選14~16mm。即,作為h2po4-的濃度,可合適地例舉10~20mm、優選12~18mm、更優選14~16mm。并且,作為配合物中的鈉離子的濃度,可合適地例舉35~80mm、優選47~68mm、更優選54~61mm。
磷酸氫二鈉與氯化鉀的濃度比優選為4:1~2:1。另外,磷酸二氫鈉與氯化鉀的濃度比優選為1:2~2:1。并且,磷酸氫二鈉與磷酸二氫鈉的濃度比優選為4:1~2:1。
作為配合物中的l-抗壞血酸的濃度,可合適地例舉0.1~0.5mm、優選0.2~0.4mm、更優選0.2~0.3mm。另外,l-抗壞血酸與氯化鉀的濃度比優選為1:50~1:70。
作為配合物中的l-抗壞血酸磷酸酯的濃度,可合適地例舉0.3~0.6mm、優選0.4~0.5mm、更優選0.43~0.47mm。另外,l-抗壞血酸磷酸酯與氯化鉀的濃度比優選為1:25~1:40。并且,l-抗壞血酸與l-抗壞血酸磷酸酯的濃度比優選為1:1~1:3。
作為配合物中的甘氨酸的濃度,可合適地例舉3~20mm、優選5~15mm、更優選8~12mm。另外,甘氨酸與氯化鉀的濃度比優選為1:1~1:2。
作為配合物中的l-半胱氨酸的濃度,可合適地例舉0.3~0.9mm、優選0.5~0.7mm、更優選0.60~0.65mm。另外,l-半胱氨酸與氯化鉀的濃度比優選為1:20~1:25。
作為配合物中的d-葡萄糖的配合濃度,器官保存液的滲透壓可合適地例舉270~450mosm/kg、優選300~390mosm/kg、更優選326~363mosm/kg。
作為配合物中的鐵化合物,可以為有機鹽也可為無機鹽,作為無機鹽,可舉出氯化鐵、三氧化二鐵、硫酸亞鐵、焦磷酸亞鐵,作為有機鹽,可舉出羧酸鹽,例如作為羥基羧酸鹽的檸檬酸亞鐵、檸檬酸鐵鈉、檸檬酸亞鐵鈉、檸檬酸鐵銨等檸檬酸鹽、焦磷酸鐵、乳酸鐵、葡糖酸亞鐵、二亞乙基三胺五乙酸鐵鈉、二亞乙基三胺五乙酸鐵銨、亞乙基二胺四乙酸鐵鈉、亞乙基二胺四乙酸鐵銨、二羧基甲基谷氨酸鐵鈉、二羧基甲基谷氨酸鐵銨、富馬酸亞鐵、乙酸鐵、草酸鐵、琥珀酸亞鐵、琥珀酸檸檬酸鐵鈉等有機酸鹽、血紅素鐵、右旋糖酐鐵、三亞乙基四胺鐵、乳鐵蛋白鐵、轉鐵蛋白鐵、葉綠酸鐵鈉、鐵蛋白鐵、含糖氧化鐵、硫酸甘氨酸鐵,其中優選為硫酸亞鐵。作為鐵化合物的濃度即鐵離子濃度,可舉出0.1μm~10mm,優選為0.5μm~5mm。
在本發明的器官保存液中,除上述各成分外,可適當配合水、生理食鹽水、各種緩沖劑、維生素類、5-氨基乙酰丙酸、糖類、蛋白酶抑制劑、類黃酮糖苷、肝細胞增殖因子(hgf)、卵磷脂化超氧化物歧化酶、羥乙基淀粉、抗氧化劑、抗炎癥性細胞因子、調節性t細胞、單核細胞、樹狀細胞、巨噬細胞等。
作為本發明的器官保存液的ph,ph為6~8,優選ph為6.5~7.5,更優選ph為7左右。另外,本發明的器官保存液通常在0℃左右使用。將器官浸漬在本發明的器官保存液中的時間(即冷缺血(冷缺血時間))為48小時以內,優選24小時以內,更優選12小時以內,但即使浸漬時間為24~48小時,缺血再灌注損傷的發生也能被有效地防止。
作為成為本發明的器官保存液的適用對象的器官,只要是能夠進行移植的器官即可,沒有特別限制,不僅可以是從供體摘取的器官,還可以是在體外(invitro)制作的移植物、細胞、利用再生醫療技術人工構筑的組織·器官、以及由萬能細胞制作的器官等。另外,作為器官的種類,可例舉腎臟、肝臟、心臟、胰臟、肺、小腸、眼球、角膜、毛發、皮膚等,其中,可合適地例舉腎臟、肝臟、心臟、胰臟、肺、小腸。
使用本發明的器官保存液的器官移植可利用常規方法進行,其可以是將由供體等提供的器官浸漬于本發明的器官保存液中、然后除去受體的相應器官并將由供體等提供的器官移植到受體中的相同部位的原位器官移植,也可以是在保持殘留有受體的器官的狀態下將由供體等提供的器官移植到受體的其他部位的異位器官移植。
作為使用本發明的器官保存液的器官移植中的供體及/或受體,可舉出人、狒狒、牛、豬、狗、貓、兔、大鼠、小鼠等哺乳動物,作為所述器官移植的方式,只要是能夠將器官從供體移植到受體的方式即可,沒有特別限制,可舉出從小鼠到小鼠、從大鼠到大鼠、從兔到兔、從狗到狗、從貓到貓、從豬到豬、從猴到猴、從狒狒到狒狒、從人到人等同種器官移植;從豬到人、從牛到人、從猴到人、從狒狒到人等異種器官移植。
以下,通過實施例來更具體地說明本發明,但本發明的技術范圍并不限定于這些示例。
實施例1
(保存液的制備)
將新制備的3種器官保存液(保存液(a)~保存液(c))作為研究對象。將添加并溶解于蒸餾水中的成分的詳情示于以下的表1中。在將移植用器官以超出針對以往的保存液制品規定的最大缺血容許時間的方式浸漬于上述保存液中的情況下,對移植后能否維持器官的功能進行研究。具體而言,在將浸漬于上述3種保存液中的供體小鼠的心臟移植到同株系小鼠的情況下,將移植后直到開始再跳動所經過的時間作為指標。為了進行比較研究,使用3種作為公知的現有產品的保存液,即euro-collins液(ec液)、組氨酸-色氨酸-酮戊二酸鹽液(htk液)、威斯康星大學液(universityofwisconsin:uw液)。將上述3種現有產品的成分的詳情示于以下的表2中。
[表1]
[表2]
(小鼠異位心臟移植1)
作為提供將要移植的心臟的供體小鼠、及將要移植從供體小鼠摘取的心臟的受體小鼠,使用c57bl/6ncrslc(h2-kb)株系小鼠(雄性、6~10周齡)。小鼠異位心臟移植手術步驟以wu等(europeanheartjournal(2011)32,509-516)的記載為參考,以下示出概要。
將供體小鼠麻醉后開胸,將心臟的上腔靜脈結扎,并切斷頭臂動脈干(brachiocephalictrunk)。使用1ml肝素生理食鹽水(100iu/ml)進行灌注后,將1ml上述表1中記載的各保存液(a)~(c)或上述表2中記載的作為比較研究用的3種現有產品的保存液分別自各供體小鼠的下腔靜脈進行灌注,并從頭臂動脈干排出。將各供體小鼠的下腔靜脈結扎后,切斷升主動脈和肺動脈,并將其他全部血管結扎。接下來,將供體小鼠的摘取心臟于0℃在15ml上述保存液(a)~(c)及表2中記載的3種現有產品的各保存液的任一者中浸漬24小時。
將浸漬于上述各保存液中的供體小鼠的摘取心臟移植到受體小鼠。在全身麻醉下對受體小鼠開腹后,使供體小鼠的摘取心臟的升主動脈吻合于受體小鼠的腹部大動脈,使供體小鼠的下腔靜脈與受體小鼠的下腔靜脈吻合,完成手術。器官移植時的溫缺血時間統一為40分鐘。
(經異位心臟移植的心臟的再跳動時間1)
針對將在上述各保存液中浸漬了24小時后的摘取心臟進行了異位心臟移植的各小鼠個體,對直到經移植的心臟開始跳動所經過的時間進行測定。之后,通過觸診來判斷是否開始跳動。結果示于圖1中。
(結果1)
由圖1可見,uw液的再跳動開始時間為240秒左右,是3種現有產品中再跳動開始時間最短的,另一方面,保存液(c)的再跳動開始時間為100秒左右,時間縮短為uw液的一半以下。另外,對于從含有氯化鉀、磷酸氫二鈉·12水合物、磷酸二氫鈉·2水合物、l-抗壞血酸、l-抗壞血酸磷酸酯鎂鹽n水合物、l-半胱氨酸鹽酸鹽1水合物、甘氨酸、d(+)-葡萄糖的保存液(c)中除去了l-半胱氨酸鹽酸鹽1水合物的保存液(b)而言,為與uw液同等程度的再跳動開始時間。從保存液(c)中除去了l-半胱氨酸鹽酸鹽1水合物及甘氨酸的保存液(a)與ec液相比,再跳動開始時間也縮短。因此,確認了在將移植器官浸漬于保存液(a)~(c)中的任一保存液的情況下,與使用3種作為現有產品的htk液、ec液、uw液的情況相比,再跳動開始時間縮短,這表明與使用現有產品進行保存的情況相比,器官的最大缺血容許時間(從器官的血流停止到移植器官后血流能夠恢復為止的時間)變長。
實施例2
(小鼠異位心臟移植2)
將在各保存液中的浸漬時間設為48小時,為了進行比較研究使用了現有產品htk液、ec液,除此之外,按照上述實施例1(小鼠異位心臟移植1)的步驟進行小鼠異位心臟移植。針對進行了異位心臟移植的各小鼠個體,對直到經移植的心臟開始跳動所經過的時間進行測定。結果示于圖2中。
(結果2)
由圖2可見,htk液、ec液的再跳動開始時間均為1500秒以上,另一方面,保存液(a)的再跳動開始時間為500秒左右,保存液(b)的再跳動開始時間為1250秒左右,保存液(c)的再跳動開始時間為600秒左右。因此,與現有產品相比,保存液(a)~(c)均顯示出良好的縮短再跳動開始時間的效果。然而,在浸漬時間為48小時的情況下,受體小鼠的死亡率變高。
實施例3
(小鼠異位心臟移植3)
作為鐵添加系列保存液,進一步制備了在上述保存液(c)中添加有硫酸亞鐵的保存液(d),繼續進行研究。將各保存液的成分的詳情示于下表3中。
[表3]
作為鐵添加系列保存液,使用了保存液(d)3及保存液(d)6,為了進行比較研究使用了現有產品uw液,除此之外,按照上述實施例1(小鼠異位心臟移植1)的步驟進行小鼠異位心臟移植。在保存液中浸漬24小時后,針對進行了異位心臟移植的各小鼠個體,對直到移植心臟開始跳動所經過的時間進行測定。結果示于圖3中。
進而,對于進行了上述異位心臟移植的小鼠個體而言,在心臟移植后,針對進行了異位心臟移植的各小鼠個體,對直到移植心臟停止跳動所經過的時間進行計量。結果示于圖4中。
(結果3-1)
由圖3也可見,現有產品uw液的再跳動開始時間為230秒左右,另一方面,保存液(d)3的再跳動開始時間為12秒,保存液(d)6的再跳動開始時間約為144秒,與現有產品uw液相比,保存液(d)3和保存液(d)6顯示出明顯的縮短再跳動開始時間的效果。特別是保存液(d)3顯示出比上述實施例1中的保存液(c)更好的縮短再跳動開始時間的效果。
(結果3-2)
如上所述,在冷保存液中浸漬24小時后進行心臟移植,之后通過對心臟是否跳動進行觸診來判斷心臟是否成活,將確認了停止跳動的日期作為心臟脫落日。即,針對進行了上述異位心臟移植的小鼠個體,對直到移植心臟停止跳動所經過的時間進行計量。由圖4可知,保存液(d)3及保存液(d)6能夠與uw液同樣地確認心臟的成活。
實施例4
(小鼠異位心臟移植4)
作為鐵添加系列保存液,使用了保存液(d)3、保存液(d)6、保存液(d)7,為了進行比較研究,使用了現有產品uw液,將在各保存液中的浸漬時間設為48小時,除此之外,按照上述小鼠異位心臟移植1的步驟進行小鼠異位心臟移植。針對進行了異位心臟移植的各小鼠個體,對直到移植心臟開始跳動所經過的時間進行測定。結果示于圖5中。
進而,針對進行了上述異位心臟移植的小鼠個體,與實施例3同樣地對直到移植心臟停止跳動所經過的時間進行計量。結果示于圖6中。
(結果4-1)
在uw液的情況下,沒有移植心臟開始再跳動的個體。關于各保存液的再跳動開始時間,保存液(d)3為260秒左右,保存液(d)6為90秒左右,保存液(d)7為820秒左右,均發生了移植心臟的再跳動。
(結果4-2)
對于移植了浸漬于uw液中的摘取心臟的小鼠而言,沒有出現再跳動;
在移植了浸漬于保存液(d)3中的摘取心臟的小鼠(n=5)中,存在長時間跳動的小鼠。更詳細而言,雖然當日(第0日)有2只、第1天有1只、第2天有1只小鼠的移植心臟停止跳動,但存在1只在經過60天的時間點移植心臟仍持續跳動的個體;
在移植了浸漬于保存液(d)6中的摘取心臟的小鼠(n=1)中,存在長時間跳動的小鼠。更詳細而言,存在1只在經過60天的時間點移植心臟仍持續跳動的個體;
在移植了浸漬于保存液(d)7中的摘取心臟的小鼠(n=6)中,存在移植心臟長時間跳動的小鼠。更詳細而言,雖然在第7天有1只小鼠的移植心臟停止跳動,但存在5只在經過30天的時間點移植心臟仍持續跳動的個體;
之后,將htk作為對照,對上述保存液(c)進一步進行研究。
實施例5
(小鼠異位心臟移植5)
作為保存液,使用保存液(c)或htk液,將來自供體小鼠的摘取心臟在保存液中浸漬24小時或48小時,除此之外,按照上述實施例1(小鼠異位心臟移植1)的步驟完成小鼠異位心臟移植的手術,制備進行了異位心臟移植的小鼠。
(進行了異位心臟移植的心臟的再跳動時間2)
針對進行了異位心臟移植的各小鼠個體,對直到移植的心臟開始跳動所經過的時間進行測定。需要說明的是,所有的再跳動都是在30分鐘以內進行計量的。在再灌注后經30分鐘還未開始跳動的情況下,算作1800秒。結果示于圖7(a)(b)中。
(結果5)
由圖7可見,在摘取心臟在保存液中的浸漬時間為24小時(參照圖7(a))及48小時(參照圖7(b))中的任一者的情況下,與將摘取心臟浸漬于htk液中相比,將摘取心臟浸漬于保存液(c)中時,直到移植到受體小鼠的心臟開始再跳動所經過的時間縮短。在浸漬時間為24小時情況下,浸漬于保存液(c)中的移植心臟的再跳動開始時間(約100秒)是浸漬于htk液中的移植心臟的再跳動開始時間(約300秒)的約三分之一,在浸漬時間為48小時情況下,浸漬于保存液(c)中的移植心臟的再跳動開始時間(約600秒)是浸漬于htk液中的移植心臟的再跳動開始時間(約1500秒)的約五分之二。
實施例6
(小鼠異位心臟移植6)
按照與上述實施例5(小鼠異位心臟移植5)同樣的步驟完成手術,制備進行了異位心臟移植的小鼠。
(對剛剛移植后的抑制急性炎癥的效果的研究)
對以下的各小鼠進行研究。
(1)移植了在保存液(c)中浸漬了24小時的摘取心臟、并從手術完成開始經過了24小時的小鼠(c-24hr-poh24);
(2)移植了在保存液(c)中浸漬了48小時的摘取心臟、并從手術完成開始經過了24小時的小鼠(c-48hr-poh24);
(3)移植了在htk液中浸漬了24小時的摘取心臟、并從手術完成開始經過了24小時的小鼠(htk-24hr-poh24);
(4)移植了在htk液中浸漬了48小時的摘取心臟、并從手術完成開始經過了24小時的小鼠(htk-48hr-poh24);
(以下,有時將上述4種小鼠統稱為“(1)~(4)的小鼠”。)
進而,制備以下小鼠作為對照。
(5)未將摘取心臟浸漬在保存液中而直接進行移植、并從手術完成開始經過了24小時的小鼠(fresh);
(6)未進行移植手術的小鼠(naive);
針對上述各小鼠,從各小鼠進行采血并提取血清。針對得到的各血清,對用作對細胞的傷害的指標的cpk(肌酸磷酸激酶)和ldh(乳酸脫氫酶)的量進行測定。cpk使用fujidri-chemslidecpk-piii(fujifilm公司制)、ldh使用fujidri-chemslideldh-piii(fujifilm公司制)進行測定。結果示于圖8中。
(結果6)
由圖8也可見,對于血清中的ldh的產生量而言,c-48hr-poh24比htk-48hr-poh24明顯減少(參照圖8(a))。另外,對于血清中的cpk的產生量而言,c-48hr-poh24也比htk-48hr-poh24少(參照圖8(b))。對于c-24hr-poh24和htk-24hr-poh24而言,在血清中的ldh的產生量、cpk的產生量方面沒有產生差異。由以上結果可確認,在浸漬于保存液中48小時的情況下,較之用浸漬于htk液中的心臟進行異位移植的小鼠而言,在用浸漬于保存液(c)中的心臟進行異位移植的小鼠中,血清中ldh的產生被顯著抑制,另外,血清中cpk的產生也被抑制。
實施例7
(對經移植的心臟的長期成活率效果的研究)
針對上述(1)~(4)的小鼠、及未將摘取心臟浸漬在保存液中而直接進行移植并且從手術完成開始經過了24小時的小鼠(fresh)的各小鼠,確認已移植的心臟成活至何時。通過對移植心臟的跳動進行觸診來確認,若跳動停止,則視為因功能停止而導致器官脫落(未成活)。最初的2周中,每天進行觸診確認,之后2.5個月中,每周進行2次觸診確認。結果示于圖9中。
(結果7)
由圖9可見,移植了在保存液(c)中浸漬了24小時的摘取心臟、并且從手術完成開始經過了24小時的小鼠(c-24hr(n=4))在術后第60天100%成活,與此相對,移植了在htk中浸漬了24小時的摘取心臟、并且從手術完成開始經過了24小時的小鼠(htk-24hr(n=7))的成活率僅為50%多一點。另外,移植了在保存液(c)中浸漬了48小時的摘取心臟、并且從手術完成開始經過了24小時的小鼠(c-48hr(n=4))即使在60日后也有50%成活,與此相對,移植了在htk液中浸漬了48小時的摘取心臟、并且從手術完成開始經過了24小時的小鼠(htk-48hr(n=0))的移植心臟在當日(第0日)全部脫落。由以上結果可確認,在浸漬時間為24小時及48小時中的任一者的情況下,與浸漬于htk液的心臟相比,浸漬于保存液(c)的心臟的長期成活率高。
實施例8
(對提高移植心臟的atp量的效果的研究)
針對按照上述實施例1(小鼠異位心臟移植1)的步驟制備的摘取心臟,對提高atp量的效果進行研究。
1)在保存液(c)中浸漬了24小時的摘取心臟(未移植)
(c-24hr-w/oope);
2)在保存液(c)中浸漬了48小時的摘取心臟(未移植)
(c-48hr-w/oope);
3)在htk液中浸漬了24小時的摘取心臟(未移植)
(htk-24hr-w/oope);
4)在htk液中浸漬了48小時的摘取心臟(未移植)
(htk-48hr-w/oope);
5)將在保存液(c)中浸漬了48小時的摘取心臟移植到小鼠、并且從移植手術完成開始經過了24小時的移植心臟(c-48hr-poh24);
6)將在htk液中浸漬了48小時的摘取心臟移植到小鼠、并且從移植手術完成開始經過了24小時的移植心臟(htk-48hr-poh24);
7)未將摘取心臟浸漬于保存液中而直接進行移植、并且從移植手術完成開始經過了24小時的移植心臟(fresh);
8)剛切除的心臟,且為未進行移植的小鼠心臟(naive);
利用americ-atpkit(cat.632-23881和光純藥公司制)從上述各心臟中提取atp,比較各組的atp量。結果示于圖10中。
(結果8)
由圖10可見,從c-24hr-w/oope提取的atp量比從htk-24hr-w/oope提取的atp量少。另一方面,從c-48hr-w/oope提取的atp量和從htk-48hr-w/oope提取的atp量兩者沒有顯著差異。從c-48hr-poh24提取的atp量比從htk-48hr-poh24提取的atp量多。因此,就摘取后在保存液中浸漬48小時然后進行移植的心臟而言,從浸漬于保存液(c)中的心臟提取的atp量比從浸漬于htk中的心臟提取的atp量多。
實施例9
(基于組織染色的對抑制壞死部分的效果的研究)
按照與上述實施例5(小鼠異位心臟移植5)同樣的步驟完成手術,制備進行了異位心臟移植的小鼠。針對在保存液(a)中浸漬了24小時后移植到受體小鼠并經過了1小時的小鼠(c-24hr-poh1、n=2)的心臟和在htk液中浸漬了24小時后移植到受體小鼠并經過了1小時的小鼠(htk-24hr-poh1、n=2)的心臟,對抑制壞死部分的效果進行研究。進行ttc(2,3,5-三苯基氯化四氮唑(cat:0765;amresco公司制))染色(僅將組織的健康部分染成紅色),與未被染色仍保持呈白色狀態的壞死部分的表面積進行比較。作為對照,使用剛切除的且未進行移植的心臟(naive、n=2)。對分成3份的心臟內部進行拍攝(eos,canon股份公司制),將得到的照片示于圖11(a)~(c)。
(結果9)
由圖11可見,與htk-24hr-poh1的心臟(圖11(b))相比,c-24hr-poh1的心臟(圖11(c))的白色部分(表示壞死)少,確認了與將摘取心臟浸漬于htk液中相比,將摘取心臟浸漬于保存液(c)中可防止移植心臟的壞死。
實施例10
(基于組織染色的研究)
針對按照上述實施例5(小鼠異位心臟移植5)的步驟制備的摘取心臟,利用組織染色進行觀察。針對未將摘取心臟浸漬于保存液中而直接進行移植并且從移植手術完成開始經過了24小時的移植心臟(fresh)、在htk液中浸漬了24小時或48小時后移植到受體小鼠并且經過了24小時的小鼠(htk-24hr-poh24或htk-48hr-poh24)的心臟、和在保存液(c)中浸漬了24小時或48小時后移植到受體小鼠并經過了24小時的小鼠(c-24hr-poh24或c-48hr-poh24)的心臟,制作固定切片,進行h/e(蘇木精/曙紅)染色(其是將核染成藍色、將細胞質染成紅紫色的方法),通過用顯微鏡以200倍的倍率觀察心肌的形態從而進行比較。將對肌細胞損傷進行染色而得到的結果示于圖12(下部的照片)左側(肌細胞損傷;a-e),將對血管周圍水腫進行染色而得到的結果示于圖12(下部的照片)右側(血管周圍水腫;a'-e')。另外,圖12(上部的圖)示出了血管周圍水腫區域相對于血管周圍區域的比例。
(結果10)
由圖12(下部的照片)可確認,與htk-24hr-poh24或htk-48hr-poh24的心臟相比,c-24hr-poh24、c-48hr-poh24的心臟在心肌纖維間的水腫、心肌纖維的斷裂、壞死心肌細胞核的消失、中性粒細胞的浸潤等方面,心肌的損傷、血管周圍水腫均減輕。另外,由圖12(上部的圖)可知,與htk-24hr-poh24或htk-48hr-poh24的心臟相比,c-24hr-poh24、c-48hr-poh24的心臟的血管周圍水腫區域相對于血管周圍區域的比例大幅降低。
實施例11
(對抑制巨噬細胞積聚的效果的研究)
針對上述(1)~(4)的小鼠的經移植的心臟,制作各心臟的固定切片,使用抗cd68抗體(克隆:fa-11,biolegend公司制)并利用酶標記抗體法將其染成藍紫色,利用顯微鏡以200倍的倍率對cd68為陽性的巨噬細胞的分布進行觀察,對在組織中積聚的巨噬細胞的數目進行比較。巨噬細胞在組織中積聚暗示該組織產生炎癥。作為對照,使用剛切除且未進行移植的心臟(naive)、和未將摘取心臟浸漬在保存液中而直接進行移植并且經過了24小時的小鼠的心臟(fresh)。結果示于圖13中。
(結果11)
由圖13明顯可見,c-24hr-poh24的心臟與htk-24hr-poh24的心臟相比,以及,c-48hr-poh24的心臟與htk-48hr-poh24的心臟相比,cd68為陽性的巨噬細胞的染成藍紫色的部分的密度小,巨噬細胞向心臟的積聚少。由此,確認了在浸漬摘取心臟的時間為24小時及48小時中的任一者的情況下,與使用htk液作為浸漬摘取心臟的保存液相比,使用保存液(c)也可抑制組織中的炎癥。
實施例12
(對抑制細胞死亡的效果的研究)
針對上述(1)~(4)的各小鼠的經移植的心臟,制作各心臟的固定切片,對抑制細胞死亡的效果進行研究。使用cardiotacsinsituapoptosisdetectionkit(trevigen公司,cat.4827-30-k)進行tunel(terminaldeoxynucleotidyltransferasedutpnickendlabelling)染色(將發生凋亡的細胞染成藍紫色),然后利用顯微鏡以100、200倍的倍率進行觀察,對tunel陽性細胞的數目進行比較。另外,對任意的9hpf/sample(≥3只/組)中的進行了染色的凋亡細胞的數目進行計數,計算在全部細胞中的比例并進行比較。作為對照,使用剛切除的且未進行移植的心臟(naive)、和未將摘取心臟浸漬于保存液中而直接進行移植且經過了24小時的小鼠的心臟(fresh)。結果示于圖14和圖15的圖中。
(結果12)
由圖14明顯可見,就c-24hr-poh24的心臟(參照圖14(d))和htk-24hr-poh的心臟(參照圖14(c))而言,藍紫色的量沒有顯著差異,但與c-48hr-poh24的心臟(參照圖14(f))相比,htk-48hr-poh24的心臟(參照圖14(e))的藍紫色顯著增多。另外,由圖15明顯可見,與c-48hr-poh24的心臟、fresh的心臟相比,發生細胞凋亡的細胞的比例在htk-48hr-poh24的心臟中顯著增多。因此,確認了在摘取心臟的浸漬時間為48小時的情況下,與使用htk液作為保存液相比,使用保存液(c)可顯著地抑制細胞凋亡。
實施例13
(對抑制細胞中的dna損傷的效果的研究)
針對移植了在上述保存液(c)或htk液中浸漬了24小時的摘取心臟并且從手術完成開始經過了24小時的小鼠(c-24hr-poh24或htk-24hr-poh24)的各心臟,制作心臟的固定切片,對抑制dna損傷的效果進行研究。利用將核染成褐色的抗8-ohdg抗體并使用酶標記抗體法(mog-100p、japaninstituteforcontrolofaging、nikkenseilco.)進行染色,同時還利用將核染成藍色的蘇木精進行染色。利用顯微鏡以100、200倍的倍率對該切片進行觀察,對8-ohdg陽性細胞的數目進行比較。需要說明的是,8-ohdg為dna損傷標記物,顯示出由活性氧導致的細胞的損傷程度。作為對照,使用剛切除的心臟(naive)和切除后立即移植且經過了24小時的心臟(fresh-poh24)。另外,對任意的9hpf/sample(≥3只/組)中的進行了染色的8-ohdg陽性細胞數進行計數,計算在全部細胞中的比例。結果示于圖16的染色圖和圖17的圖中。
(結果13)
由圖16可見,與htk-24hr-poh24的心臟(參照圖16(c))相比,c-24hr-poh24的心臟(參照圖16(d))的被染成褐色的8-ohdg陽性細胞的數目少,因此,dna損傷被抑制,另外,由圖17可見,與c-24hr-poh24、fresh-poh24相比,htk-24hr-poh24的經染色的8-ohdg陽性細胞數明顯增多,確認了在摘取心臟的浸漬時間為24小時的情況下,與使用htk液作為保存液相比,使用保存液(c)可顯著地抑制由活性氧導致的dna傷害。需要說明的是,對于摘取心臟的浸漬時間為48小時時的數據而言,由于心肌組織破壞,背景噪聲(background)變高,無法對陽性細胞進行計數,因此未示出數據。
實施例14
(抑制血清中的dna損傷的效果的研究)
針對移植了在上述保存液(c)或htk液中浸漬了48小時的摘取心臟并且從手術完成開始經過了24小時的小鼠(c-48hr-poh24或htk-48hr-poh24),從各小鼠進行采血并提取血清,對抑制dna損傷的效果進行研究。從各小鼠進行采血并提取血清。使用highlysensitiveelisakitfor8-ohdg(kog-hs10/e,japaninstituteforcontrolofaging,nikkenseilco.公司制),對血清中的8-ohdg量進行比較。作為對照,使用未進行移植手術的小鼠(naive)、和摘取后立即進行移植并且經過了24小時的小鼠(fresh)。結果示于圖18中。
(結果14)
由圖18可以確認的是,在摘取心臟的浸漬時間為48小時的情況下,與使用htk液作為保存液相比,使用保存液(c)可顯著地抑制dna損傷。
實施例15
(炎癥·氧化應激標記物基因表達的變化的研究(定量rt-pcr))
針對移植了在上述保存液(c)或htk液中浸漬了48小時的摘取心臟并且從手術完成開始經過了24小時的小鼠(c-48hr-poh24或htk-48hr-poh24)的經移植的心臟,將組織破碎后提取總rna,使用primescript(注冊商標)rtreagentkit(takarabio公司制)將其逆轉錄為cdna,使用premixextaqtm(takarabio公司制)通過定量rt-pcr對與炎癥·氧化應激相關的基因簇的表達加以比較。
作為未處理組,使用剛切除的心臟(naive)和切除后立即移植并且經過了24小時的小鼠的心臟(fresh)。結果示于圖19中。在圖19中,對于il-6,從左起為naive(n=5)、fresh(n=3)、htk-48hr-poh24(n=5)、c-48hr-poh24(n=4);ho-1為naive(n=6)、fresh(n=3)、htk-48hr-poh24(n=4)、c-48hr-poh24(n=5);對于inos,從左起為naive(n=6)、fresh(n=3)、htk-48hr-poh24(n=4)、c-48hr-poh24(n=5);對于cd11b,從左起為naive(n=6)、fresh(n=3)、htk-48hr-poh24(n=4)、c-48hr-poh24(n=4);對于nrf2,從左起為naive(n=6)、fresh(n=3)、htk-48hr-poh24(n=3)、c-48hr-poh24(n=5);對于nf-kb,從左起為naive(n=6)、fresh(n=3)、htk-48hr-poh24(n=3)、c-48hr-poh24(n=5);對于tnf-α,從左起為naive(n=6)、fresh(n=3)、htk-48hr-poh24(n=3)、c-48hr-poh24(n=5);arg-1為naive(n=6)、fresh(n=3)、htk-48hr-poh24(n=3)、c-48hr-poh24(n=5);對于hif-1α,從左起為naive(n=6)、fresh(n=3)、htk-48hr-poh24(n=3)、c-48hr-poh24(n=5);對于tgf-β,從左起為naive(n=6)、fresh(n=3)、htk-48hr-poh24(n=3)、c-48hr-poh24(n=5)。
(結果15)
與htk-48hr-poh24的心臟相比,c-48hr-poh24的心臟的顯示出明顯低的值的項目是il-6:炎癥性細胞因子基因;ho-1:抗氧化蛋白基因;inos:抗氧化蛋白基因;cd11b:在損傷部位積聚的巨噬細胞的標記基因。另一方面,與htk-48hr-poh24的心臟相比,c-48hr-poh24的心臟的顯示出明顯高的值的項目是nrf2;nf-kb;hif-1α:細胞的與應激反應相關的轉錄因子;tgf-β:炎癥抑制性細胞因子基因。這表明使用保存液(c)作為保存液可抑制炎癥。
產業上的可利用性
本發明在器官移植這樣的醫療領域中有用。
- 還沒有人留言評論。精彩留言會獲得點贊!