一種利用茉莉酸甲酯進行雜交鵝掌楸體胚發生的方法與流程
本發明屬于組培苗
技術領域:
,具體涉及一種利用茉莉酸甲酯(meja)進行雜交鵝掌楸體胚發生的方法。
背景技術:
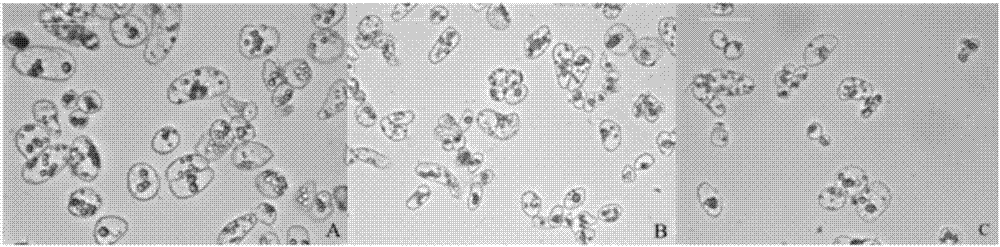
:近年來,人們不斷地加大對植物體細胞胚胎發生的研究,使其在幾十年內得到了快速的發展,并取得很大的成果。由于體細胞誘導產生的體胚具備發生數量多、生長速度快、結構完整、繁殖效率高等特點,使體胚發生技術成為植物快速繁殖的有效手段,有利于保存優良的林木品種、縮短優良品種培育時間、加快產業化的發展等,在林業的發展中具有重要意義。植物體細胞胚胎發生是細胞工程中植株再生的有效途徑,它可以在一些植物尤其是木本植物生長繁殖周期較長,或者有的植物種子難以萌發中發揮巨大作用。體胚發生主要分為誘導胚性愈傷組織的形成和體胚的形態建成。第一階段選擇外植體,選取未成熟胚、根、莖、葉、花器官等組織誘導形成胚性愈傷組織;第二階段誘導胚性愈傷組織分化形成體細胞胚。胚性細胞經過一系列的發育形成球形胚,最終形成子葉胚,子葉胚再經進一步培養形成完整的植株。植物直接的體細胞胚胎發生是在外植體包括器官、組織、細胞等直接發育分化成體細胞胚。而間接體胚發生是外植體形成愈傷愈傷組織后進一步發育成體細胞胚,或者形成胚性愈傷組織后經過懸浮培養后形成體細胞胚。林木體細胞胚胎研究起源于20世紀70年代rao等對檀香的體細胞胚胎發生的研究。盡管大部分木本植物的體胚發生存在一定難度,但幾十年的努力,木本植物通過體胚發生形成再生植株已經達到二百種以上,還有一些用材樹種的體胚發生的研究也取得新進展。馬尾松、火炬松等部分裸子植物的體細胞胚胎發生體系已經較成熟,能夠組織培養技術實現植株再生。陳金慧等首次成功建立雜交鵝掌楸體細胞胚胎發生體系,并進一步誘導出體胚苗,加快雜交鵝掌楸的產業化發展。體胚發生時,外界因素誘導內部發生變化或內部自身因素使調控基因表達,從而完成植物體胚的發生。其主要的影響因素有:外植體選擇、基因型、培養基的選擇、環境條件、生長調節物質等。其中植物激素在體胚發生中起到不可替代的作用。1)基因型與外植體的選擇只要是活的植物組織或器官都可作為組織培養的材料。體胚發生會因外植體的狀態、類型、基因型等因素的不同而存在很大差異。在進行組織培養過程中,選擇的外植體器官分化程度低并且生理狀態較好,可以大大提升體胚發生誘導率。因此在進行組織誘導時,通常選擇生理狀態好、品質優良的材料,可以加大植物體胚誘導的成功率。由于植物基因型的不同,使得體細胞胚誘導時在激素的使用、培養條件等方面都存在差異。不同基因型的體細胞胚誘導效率存在較大差異,有可能是因為不同基因型的最佳培養條件不同。黃璐等誘導胚性愈傷組織和體胚發生時,發現不同基因型的體胚誘導率存在差異。2)培養基的選擇通常培養基主要由碳水化合物、氮源、無機鹽、維生素等成分組成,每個組成部分都起到重要作用。其中氮源對體細胞胚胎發生有較大的影響。崔凱榮等在培養基中加不同比例的硝態氮及氨態氮誘導枸杞體胚發生時,發現當培養基中只加氨態氮不加硝態氮時,枸杞體細胞胚胎發生誘導率最高。3)環境條件通常暗培養環境下有利于木本植物胚性愈傷組織的誘導,待體胚進行成熟培養時則需要光照,光照也有利于降低畸形率。雖然黑暗與光照條件下都可以誘導胚性愈傷組織,但在光照條件下誘導產生的胚性愈傷組織可能會褐化或者體胚再生頻率不高。陳金慧等在研究雜交鵝掌楸體細胞胚胎發生時,發現暗環境有利于胚性愈傷組織生長和體胚發生,體胚發生后及時移至光照條件下培養,有利于體胚發育和植株再生。溫度也是影響體胚發生的重要因素。高溫或低溫都有可能影響胚性愈傷組織的體胚發生能力。陳小鵬在黃瓜的體胚發生研究中發現高溫會導致體胚數量減少,降低體胚誘導率。張宇等在研究水曲柳的體胚發生中,發現低溫處理后能夠促進體胚同步化。4)外源激素在體胚發生中的作用植物激素在一定濃度下能夠調控植物生理反應,在生長發育、成熟衰老等方面發揮最重要作用。在植物體胚發生過程中植物激素的選擇是至關重要的。植物體胚發生所需要的植物激素及含量是不同的,即使同種植物在誘導體胚發生中的不同階段所需植物激素也是不同的。從大多數的報道看,生長素是體細胞胚分裂所必需的,可促使內源生長素的增加,進而促進細胞分裂和內源激素平衡,最終促使細胞進入胚胎狀態。對大多數植物來說,除了生長素,體胚發生還需要細胞分裂素。6-ba(細胞分裂素)有利于愈傷組織的形成。kt則有助于改善愈傷組織的質量。近年有研究發現tdz活性更高,已經誘導出體胚,如花生的體胚誘導。許多研究都證實aba在許多植物體胚的不同階段都一定的促進作用。對一些植物的aba突變體進行研究,發現在植物體胚成熟階段aba發揮重要功能,有利于體細胞胚胎后期的發育。許多植物的體胚誘導過程中aba都能夠刺激體細胞胚成熟,能夠有效提高體胚發生率。由于樹種特性的不同,一些植物在體細胞胚胎發生中添加外源aba不利于體胚發生或者抑制體胚發生,如火炬松、白云松等。近年來茉莉酸類(ja)被越來越多的研究者關注,作為一種新型的生長調節劑,除了起到防御作用外,還能調控植物的生長發育。當ja濃度高時,對植物生長具有較強的抑制作用,包括葉片、下胚軸、根部的生長,還有抑制葉綠素的合成、卷須的形成等。但ja類物質濃度較低時,能夠促進下胚軸及根部的生長。除此之外,ja還能加快果實的成熟、調節氣孔的運動、使呼吸作用增強、還能促進馬鈴薯塊莖形成等形態建成。在植物受到脅迫時,包括外界刺激(高溫、低溫、干旱等)以及生物脅迫(病蟲害),此時ja響應機制開始發揮防御功能。當外施一定濃度的ja同樣能夠啟動ja的防御機制。當植物受到病蟲害等脅迫反應時,體內ja含量有所增加,它能在植物體內運輸,又具有很強的揮發性,傳遞信號給未受傷部位,從而啟動防御系統。技術實現要素:發明目的:針對現有技術中存在的不足,本發明的目的是提供一種利用茉莉酸甲酯進行雜交鵝掌楸體胚發生的方法,提高體胚誘導率、降低畸形率。技術方案:為了實現上述發明目的,本發明采用的技術方案為:一種利用茉莉酸甲酯進行雜交鵝掌楸體胚發生的方法,包括種子滅菌、胚性愈傷組織的誘導、胚性懸浮細胞系的建立、液體單細胞的獲得及過渡、誘導雜交鵝掌楸體胚的發生步驟,其中,在誘導雜交鵝掌楸體胚的發生時,在培養基中添加茉莉酸甲酯和aba,或單獨添加茉莉酸甲酯。所述的茉莉酸甲酯的用量為0.5×10-6~100×10-6mol/l,aba的用量為2mg/l。所述的培養基位液體培養基或固體培養基。所述的雜交鵝掌楸的基因型為c138、233012、253010。所述的雜交鵝掌楸的基因型為c138,在培養基中添加2mg/laba和1×10-6mol/lmeja。所述的雜交鵝掌楸的基因型為233012,在培養基中添加2mg/laba和1×10-6mol/lmeja。所述的雜交鵝掌楸的基因型為253010,在培養基中添加2mg/laba和1×10-6mol/l或5×10-6mol/lmeja。所述的茉莉酸甲酯的用量為12.5×10-6mol/lmeja。有益效果:與現有技術相比,本發明的利用茉莉酸甲酯進行雜交鵝掌楸體快繁的方法,在雜交鵝掌楸體細胞胚胎發生過程中,加入植物生長調節劑meja有助于提高培養細胞內源aba水平,有效提高體胚誘導率、降低畸形率、提高體胚成熟率,進一步的提高雜交鵝掌楸體胚發生效率,具有很好的實用性,利于雜交鵝掌楸快繁體系的建立。附圖說明圖1是未成熟胚誘導的愈傷組織圖;圖中,a為白色組織為非胚性愈傷組織,b、c為胚性愈傷愈傷組織;圖2是不同基因型雜交鵝掌楸過篩后的單細胞狀態圖;圖中,a、b、c分別為基因型c138、233012、253010;圖3是不同meja濃度下c138培養30d的體胚發生統計結果圖;圖4是不同meja濃度下c138的植株再生情況圖;圖中,a、b、c、d、e、f為1、2、4、10、7、12號培養基;圖5是不同meja濃度下233012培養30天的體胚發生統計結果圖;圖6是不同meja濃度下233012的植株再生情況圖;圖中,a為1號培養基、b為2號培養基、c為4號培養基、d為9號培養基;圖7是不同meja濃度下253010培養30天的體胚發生統計結果圖;圖8是不同基因型的雜交鵝掌楸體胚誘導情況結果圖;圖9是不同meja濃度對雜交鵝掌楸體胚苗根長的影響結果圖;圖10是不同濃度meja下c138體胚的發生圖;圖中,1-12為1-12號培養基;圖11是不同濃度meja下233012體胚的發生圖;圖中1-12為1-12號培養基;圖12是不同meja濃度處理下253010的體胚發生圖;圖中,1-12為1-12號培養基;圖13是不同meja濃度下253010的體胚發生結果圖;圖中,a、c、e、g為光照前體胚狀態,b、d、f、h為光照后體胚狀態;a、b為1號培養基,c、d為2號培養基,e、f為6號培養基,g、h為11號培養基。具體實施方式下面結合具體實施例,對本發明做進一步的說明。以下實施例中使用的供試材料選用本申請人的課題組于2012年及2013年的雜交鵝掌楸優良性狀組合的未成熟胚及未成熟胚誘導成的愈傷組織材料。選用雜交鵝掌楸的基因型為c138、233012、253010。本申請人選用中國馬褂木和北美鵝掌楸于花期(四五月份)進行的人工雜交控制授粉,獲得雜交幼胚。在南京地區授粉后約8周,進行采樣。將采集的聚合翅果進行低溫(4℃)冷藏。茉莉酸甲酯母液的配置:茉莉酸甲酯(sigma公司,液體狀,純度>95%)。用無水乙醇助溶,加水定容(使助劑溶液濃度為20%)配制成10μmol/ml的母液。采用水系、孔徑0.22μm的濾膜滅菌(若只用無水乙醇作溶劑,需要采用有機系濾膜除菌)。體胚發生率(%)=體胚發生總數/觀察細胞數(團)×100%;體胚成熟率(%)=成熟胚總數/觀察細胞數(團)×100%;畸形胚發生率(%)=畸形胚總數/觀察細胞數(團)×100%;再生植株率(%)=再生植株總數/體胚發生總數×100%。實施例1未成熟胚的胚性愈傷組織的誘導1、種子滅菌滅菌前應先剖開聚合翅果將種翅去除,先將種子用水沖洗30min。然后在超凈工作臺中進行滅菌處理,將種子置于無菌三角瓶中加入75%乙醇,滅菌30s,倒出75%乙醇并加入0.1%的氯化汞,滅菌8~10min,倒去氯化汞溶液,在用無菌水洗滌3~4次,處理結束封口放入4℃條件下保存,進行下一步處理。2、胚性愈傷組織的誘導在無菌環境下將種皮去除,將未成熟胚及胚乳放置添加有2,4-d、ba等激素的3/4ms培養基中進行愈傷誘導培養,培養條件為23℃,暗培養,繼代周期為25~30d。起初種子長出白色透明非胚性愈傷組織。繼代時將白色透明非胚性愈傷組織去除,剩余部分繼續培養。經過一段時間繼代培養,開始長出黃色細顆粒狀、質地結實的組織。繼續培養,直至達到穩定狀態。待其長出胚性愈傷組織并狀態良好時,將培養基中2,4-d的濃度應由原來的2.0mg/l降為1.0mg/l,將瓊脂粉改為水晶洋菜(2.3g/l)。如圖1所示,在培養初期,愈傷組織大多偏白,含水量多,這部分為非胚性愈傷組織。繼代時將其去除,之后長出的組織狀態呈黃色細顆粒狀、水分含量較少,組織較致密。3、胚性懸浮細胞系的建立液體培養基與胚性愈傷組織培養基一致,不加水晶洋菜。選取狀態較好的胚性愈傷組織,按照1:9的比例進行懸浮培養,即胚性愈傷組織5g,液體培養基45ml,在搖床中進行懸浮培養。懸浮培養條件為23℃、轉速95r/min下進行暗培養。繼代周期為7d。通常情況下繼代2~3次為宜。4、液體單細胞的獲得及過渡液體繼代2~3次后,獲得穩定性及均勻性較好的液體懸浮系。之后采取的是物理篩選的方法,利用特定目數的細胞篩獲得單細胞,根據此次雜交鵝掌楸愈傷組織的特性,選用400目(孔徑38μl)和150目(孔徑100μl)的篩子配合使用。用400目的篩子過濾掉細胞團,用150目的篩子將較小的細胞、破碎的細胞篩除,將收集到大小在38~100μl之間的單細胞,在加入aba(2mg/l)外源激素液體培養基中過渡培養兩天。懸浮培養條件為23℃、轉速95r/min下進行暗培養。選擇狀態較好的胚性愈傷組織,顏色為黃色且呈小顆粒狀,質地較為緊實。建立液體懸浮系,此過程設定轉速為95r/min,即能將細胞搖散,又不會因轉速太快使細胞破碎。繼代周期為7d,連續繼代2~3次,保證能夠獲得足夠的單細胞。然后選擇150目和400目的篩子進行物理篩選,從而獲得大小較為一致的單細胞,從圖2可以看到雜交鵝掌楸單細胞的狀態,細胞呈圓球形,內含物較多,分裂速度較快,符合雜交鵝掌楸胚性細胞的特點。在獲得單細胞進行過渡培養的階段,需要用顯微鏡對單細胞進行觀察,以確定其濃度。5、不同濃度meja誘導雜交鵝掌楸體胚的發生過渡培養2天后,用顯微鏡觀察細胞狀態及密度,并進行下一步體胚誘導。雜交鵝掌楸體胚誘導培養基:3/4ms+vc5mg/l+ch0.2g/l+活性炭2g/l+蔗糖40g/l+8g/l瓊脂粉,在培養基中加入不同濃度meja和aba2.0mg/l(如表1所示),以不加meja和aba及只添加2.0mg/laba的培養基為對照。用移液槍吸取液體細胞,均勻的鋪在體胚誘導固體培養基上,每皿2ml,在23℃暗培養。定期用體式顯微鏡等觀察不同胚期狀態,觀察體胚及再生植株的生長狀態。選擇三個基因型c138、253010、233012,每個濃度處理5皿。表1添加meja的體胚誘導培養基在體胚發育及萌發過程中,以正常的子葉胚為統計標準,觀察記錄各個meja不同濃度處理下體胚的生長發育狀況及體胚發生時間,分別統計成熟胚總數及在萌發過程中再生植株數量。用顯微鏡觀察雜交鵝掌楸體胚發生初期體細胞生長狀態,及長出體胚后觀察體胚的發育情況。觀察并拍照記錄體胚增殖分化速度、體胚出現時間及生長狀態,統計子葉胚的數量、畸形胚數量及幼苗數量。待其長出真葉后移入幼苗成熟培養基中。與對照相比在不同濃度meje的體胚誘導培養基上培養10d時,就能夠觀察到有體胚的產生,體胚主要為呈球形胚、心形胚。30d時已經發育為成熟的子葉胚。1)基因型c138的體胚發生情況如圖3所示,在添加aba和meja的體胚誘導培養基中,體胚誘導率隨著meja的濃度上升而上升,在meja濃度為1×10-6mol/l(4號培養基)時,達到最大值,而且其畸形發生率最低。從圖4可以看出,此時大部分體細胞胚形態正常。當meja濃度達到1×10-4mol/l時,體胚誘導率大幅下降,并產生較多的畸形胚,說明高濃度的meja不利于雜交鵝掌楸體胚的發生。添加aba和meja的培養基誘導體胚發生時,將每種處理的體胚誘導率進行差異性顯著分析,計算可知,p值為2.42e-08<0.05,差異性顯著。表明aba和meja配合使用對基因型c138的體胚誘導有較大影響。如圖3所示,在只添加meja的處理中,體胚誘導率均高于對照組(不添加激素),8、9、10號培養基均高于添加2.0mg/laba的對照組。10號培養基(1×10-6mol/lmeja)處理下體胚誘導率及體胚成熟率達到最高值。只添加meja的培養基誘導體胚發生時,將每種處理的體胚誘導率進行差異性顯著分析,計算可知,p值為2.63e-06<0.05,差異性顯著。單一添加meja對基因型c138體胚誘導有影響較大。相比較于兩組對照,4號和10號培養基的體胚發生率和體胚成熟率明顯高于兩組對照,10號培養基(meja5×10-6mol/l)的體胚誘導率和體胚成熟發生率為最高,但體胚發生畸形率比4號培養基高1.29%。而4號培養基(aba2mg/l和meja1×10-6mol/l)體胚發生率和體胚成熟發生率僅次于10號培養基,而且體胚畸形率最低。綜合考慮,2.0mg/laba和1×10-6mol/lmeja配合使用時,體胚誘導效果達到最佳水平。通過觀察c138再生植株的情況,從圖4可以看出,除了正常子葉苗之外,還有一些單子葉苗,后期將其轉入不添加任何激素的3/4ms培養基中進行培養,發現單子葉再生苗大部分能夠生長發育成正常植株。在進行體胚苗的統計時,觀察到只添加meja時,尤其meja(5×10-7mol/l)處于低濃度時,體胚苗根部明顯比對照長。由圖5可知,1×10-4mol/l的meja在體胚發生中對雜交鵝掌楸體胚苗根的生長起到明顯抑制作用。可見,c138進行體胚誘導時,meja能夠起到促進作用并能在一定程度對畸形胚起到抑制作用。2)基因型233012的體胚發生情況由圖5可知,在添加aba和meja的體胚誘導培養基中,基因型233012在4號培養基(aba2mg/l和meja1×10-6mol/l)上體胚發生率和體胚成熟率最高,而且體胚畸形發生率最低,體胚誘導效果達到最佳水平。添加aba和meja的培養基誘導體胚發生時,將每種處理的體胚誘導率進行差異性顯著分析,計算可知,p值為5.06e-08<0.05,差異性顯著。表明aba和meja配合使用對基因型233012的體胚誘導有較大影響。在單獨添加meja的體胚誘導培養基中,體胚誘導率隨著meja濃度的上升而升高,在9號培養基(meja1×10-6mol/l)時體胚誘導效果最佳,其體胚發生率為58.06%,體胚成熟率為36.67%,畸形胚發生率為5.27%。在高濃度meja(1×10-4mol/l)時誘導率大幅度下降,只有25.34%,而且會誘導出部分畸形胚,并伴隨有褐化現象。單獨添加meja的培養基誘導體胚發生時,將每種處理的體胚誘導率進行差異性顯著分析,計算可知,p值為0.0001<0.05,差異性顯著。表明單一添加meja對基因型233012的體胚誘導影響較大。4號和9號培養基的體胚發生率及成熟均高于對照,4號的體胚畸形率低于兩組對照。4號培養基的體胚發生率和成熟率均為最高,體胚畸形率最低。4號和9號中meja的濃度均為1×10-6mol/l,說明233012中meja的濃度為1×10-6mol/l時誘導效果最好。綜合考慮,2.0mg/laba和1×10-6mol/lmeja配合使用時,體胚誘導效果達到最佳水平。如圖6所示,經過液體懸浮培養體系誘導形成體胚,由暗環境轉入光環境培養,誘導出體胚苗,及時將其轉入不添加任何激素的3/4ms培養基中進行培養,經培養,發現233012的再生植株能夠正常生長。3)基因型253010的體胚發生情況從圖7中可以看出,添加aba和meja的體胚誘導培養基中,基因型253010的體胚發生率最高為4號培養基(aba2mg/l和meja1×10-6mol/l),其次是5號(aba2mg/l和meja5×10-6mol/l),但是4號的體胚成熟率比5號低1.96%。在添加aba和meja的培養基誘導體胚發生時,將每種處理的體胚誘導率進行差異性顯著分析,計算可知,p值為1e-06<0.05,差異性顯著。表明aba和meja配合使用對基因型253010的體胚誘導有較大影響。在只添加meja的體胚誘導培養基中,10號培養基(meja5×10-6mol/l)的體胚誘導率最高體胚發生率為37.52%,體胚成熟率為25.30%,畸形胚發生率為7.81%。體胚誘導率隨著meja濃度的上升而升高,濃度在5×10-6mol/l時達到最高,之后誘導率后開始下降。253010體胚發生時畸形率差別不大。高濃度meja(1×10-4mol/l)處理下誘導率有所下降,體胚畸形率升高。添加meja的培養基誘導體胚發生時,將每種處理的體胚誘導率進行差異性顯著分析,計算可知,p值為5.32e-05<0.05,差異性顯著。單一添加meja時對基因型253010體胚誘導有影響較大。對所有處理進行比較,發現10號的體胚發生率和成熟率略高于4號,但是10號的體胚畸形率高于4號。此次,4號和10號的體胚發生率和成熟率差異不大。綜合考慮,2.0mg/laba和1×10-6mol/lmeja配合使用時,體胚誘導效果達到最佳水平。4)不同基因型對體胚發生率的影響同一植物的不同基因型在誘導體胚發生時,結果可能存在較大差異。本發明通過建立懸浮培養體系,雜交鵝掌楸基因型c138、233012、253010在添加不同濃度meja的體胚誘導培養基中誘導體胚發生,誘導效果不太一致,但都在外施2mg/laba和1×10-6mol/lmeja的情況下,三者的誘導效果相對最佳,將這三個基因型在2mg/laba和1×10-6mol/lmeja處理下的體胚發生率進行方差分析,如表2,p值為0.0012<0.05,說明差異顯著。表明基因型是雜交鵝掌楸體胚發生的重要因素,如圖8所示。表2不同基因型的雜交鵝掌楸體胚發生的方差分析差異源ssdfmsfp-valuefcrit組間3463.9621731.9825.260.00125.1434組內411.43668.57總計3875.3985)雜交鵝掌楸體胚苗根長的測量如圖9所示,基因型c138在進行體胚苗發生,雜交鵝掌楸體胚誘導培養基中加入不同濃度的meja會體胚苗的根長產生影響。從圖9可知,在aba和meja共同誘導雜交鵝掌楸體胚發生時,促進根生長的效果不明顯。同樣meja濃度達到62.5×10-6mol/l時,不利于根的伸長生長。在只加meja共同誘導雜交鵝掌楸體胚發生時,8號培養基中體胚苗根最長,說明根長與meja濃度成負相關,當濃度達到62.5×10-6mol/l時,其根明顯短于其他濃度處理的體胚苗,說明高濃度meja對體胚苗的根的生長有抑制作用。可見,在植物組織培養過程中,植物激素對體胚發生起到至關重要的作用。c138、233012、253010三個基因型在不同濃度meja的雜交鵝掌楸體胚誘導培養基中誘導體胚過程,發現添加aba和meja或者單獨添加meja時,都能提高體胚誘導率以及植株再生率。但是,這三種基因型的體胚誘導率存在差異,其體胚誘導率從高到低依次為233012、c138、253010。6、再生植株的培養雜交鵝掌楸單細胞經過球形胚、心形胚、魚雷胚、子葉胚等階段的發育,60d后發育成體胚再生植株,比較再生植株生長狀況,并從每種體胚誘導培養基中隨機取50株再生植株,取出測量其根長,進行統計分析。隨后將再生植株接入不添加任何激素及附加物的3/4ms培養基。待再生苗高度達到4、5cm后,可進行煉苗及移栽到基質中繼續培養。實施例2在經過一定次數的繼代培養后,愈傷組織狀態呈現黃色細顆粒狀、質地結實、生長速度較為緩慢,此時雜交鵝掌楸的胚性愈傷組織狀態較好。待其長出胚性愈傷組織并狀態良好時,進行體胚誘導。直接利用固體培養基進行體細胞胚誘導,將狀態較好的愈傷組織直接鋪在體胚誘導培養基中進行培養,雜交鵝掌楸體胚誘導培養基:3/4ms+vc5mg/l+ch0.2g/l+活性炭2g/l+蔗糖40g/l+瓊脂粉8g/l,在培養基中加入不同濃度的meja和aba(如表3所示),以不加meja和aba及只添加2.0mg/laba的培養基為對照,觀察固體培養基中不同濃度茉莉酸甲酯對雜交鵝掌楸體胚發生的影響。選基因型為c138、233012、253010且狀態較好的愈傷組織,直接鋪在添加不同濃度meja的體胚誘導培養基中,進行體胚誘導培養,每種處理鋪4皿,每皿放置7塊愈傷組織。培養條件為23℃,暗培養,30d繼代一次。60d后統計c138、233012、253010體胚發生數及體胚苗數量,統計單位為個數/皿。繼代一次至二次后,待其長出成熟體胚及體胚苗時,將誘導體胚發生的愈傷組織分為兩部分,一部分入原來的培養基,一皿放7塊,23℃,暗培養;另一部分轉入不加任何激素的3/4ms基本培養基,并放入光照培養室中培養。用顯微鏡觀察雜交鵝掌楸體胚發生初期體細胞生長狀態,及長出體胚后觀察體胚的發育情況。觀察并拍照記錄體胚增殖分化速度、體胚出現時間及生長狀態,體胚以正常形態的子葉胚為統計標準。表3添加meja的體胚誘導培養基培養基型號aba(mg/l)meja(μmol/l)100220320.1420.5522.56212.57262.5800.1900.51002.511012.512062.5直接將基因型c138、233012、253010的胚性愈傷組織放在添加不同濃度meja的雜交鵝掌楸體胚誘導培養基中,進行體胚誘導培養。三個基因型c138、233012、253010都能成功誘導出體胚,但是其體胚誘導結果存在差異。在不同濃度meja的體胚誘導培養基中,基因型253010在20d時開始有胚狀體的產生;基因型233012在30d開始有胚狀體的產生;而基因型c138,在繼代培養一次后,50d左右開始產生胚狀體。如表4、圖10所示,基因型c138在不同濃度meja的體胚誘導培養基中體胚發生數目不多,最多只有41個/皿,再生植株率有31.71%。表4不同濃度meja下基因型c138的體胚發生情況如表5所示,基因型233012在添加aba和meja的體胚誘導培養基中,隨著meja濃度的上升,體胚數目持續增多。當meja達到12.5×10-6mol/l時,誘導效果達到最佳水平,此時體胚發生數為97個/皿,再生植株率達到49.48%。單獨添加meja時,誘導效果不如aba和meja配合使用。從圖11可知,愈傷組織變成團狀并在團狀組織上產生體胚。當meja濃度達到62.5×10-6mol/l時,組織變為較硬的團狀,很少能發育為成熟的子葉胚。因此,高濃度meja誘導體胚發生時,會抑制體胚的誘導及生長。表5不同meja濃度下基因型233012的體胚發生情況將基因型253010的胚性愈傷組織轉入添加不同meja濃度的體胚誘導培養基中,20d左右時253010開始出現胚狀體,在2mg/laba和12.5×10-6mol/lmeja的處理中最早發現體胚,隨后其他處理也開始長出體胚。圖12和表6可知,30d時基因型253010在不同濃度meja誘導下體胚的狀態,能明顯看到6號培養基中的體胚已經產生子葉胚且數目較多。體胚數量可達231個/皿,再生植株有136株/皿,再生植株率為58.87%,相比其它培養基最大值。在誘導體胚發生過程中隨著時間的增長,組織開始變硬,可能是由于含水量降低的緣故。當meja濃度達到62.5×10-6mol/l時,會抑制體胚的生長及發育,經過一定時間的生長后,組織狀態開始變褐。表6不同meja濃度下基因型253010的體胚發生情況基因型253010的體胚發育成熟后,將其轉入光照培養室中培養(23℃,16h光培養8h暗培養)。由圖13可知,4號培養基中再生植株數量最多,且明顯多于兩組對照組。基因型是體胚發生的一個重要影響因子。本實施例表明,不同基因型誘導體胚發生效果存在差異。基因型253010的體胚誘導能力最佳,其次是233012,最后是c138。直接使用固體體胚誘導培養過程中,無論是否添加2mg/laba,體胚誘導數量都是隨著meja濃度的升高而增加,當meja濃度達到12.5×10-6mol/l時,誘導出體胚數目最多。而aba和meja配合使用能夠誘導更多體胚發生。在誘導基因型c138、233012、253010的體胚發生途徑中,aba(2mg/l)和meja(12.5×10-6mol/l)配合使用,能夠提高體胚的發生效率及促進體細胞胚成熟,并且能夠提高其植株再生率。高濃度的meja(62.5×10-6mol/l)對體胚誘導和體胚生長有明顯抑制作用。黑暗中組織分化速度較快,雖然有體胚苗的產生,但存在一定的畸形苗。因此,當體胚成熟并長出部分再生植株后,應將其轉入光照下培養,體胚苗經過光合作用變綠。另外,由于外施激素的刺激,使體胚的下胚軸粗大,影響根系生長狀態。所以,在長出子葉胚后,應及時將其轉入不加任何激素的3/4ms基本培養基培養。當前第1頁12
相關技術
網友詢問留言
已有0條留言
- 還沒有人留言評論。精彩留言會獲得點贊!
1