一種檢測缺氧對果蠅的影響的檢測裝置和方法與流程
本發明總體上涉及生命科學領域,具體涉及用于檢測缺氧對果蠅的影響的檢測裝置和方法。本發明還公開了該裝置的用途。
基金支持
中國國家重點基礎研究計劃(2013cb530900)和國家自然科學基金(81371400;81571101;和81071026)。
背景技術:
氧氣對維持生命至關重要,而缺氧會對機體和組織造成不良后果。由于大腦對能量需求高,其相比其他器官對缺氧更加敏感。當腦部血流量減少時,大腦可能會產生中風,導致細胞和組織的死亡(moskowitz,m.a.,lo,e.h.&iadecola,c.heartdiseaseandstrokestatistics--2011update:areportfromtheamericanheartassociation.neuron67,181-198(2010).)。在60歲以上的人群中,中風是第二大致死原因(feigin,v.l.etal.globalandregionalburdenofstrokeduring1990–2010:findingsfromtheglobalburdenofdiseasestudy2010.thelancet383,245-255(2014).)。預計每三到四分鐘就會有人因中風而死亡,或因中風而患嚴重殘疾或其他神經系統疾病。這導致在世界范圍內為中風患者提供了護理和治療的巨大經濟負擔,因此,中風的預防和治療不僅是一個醫療問題,也是一個社會問題(johnston,s.c.,mendis,s.&mathers,c.d.globalvariationinstrokeburdenandmortality:estimatesfrommonitoring,surveillance,andmodelling.thelancet.neurology8,345-354(2009).)。
缺氧損傷可以由局部缺血造成缺氧和缺乏營養的組織血液供應減少而引起。缺血可通過激活細胞死亡而引起嚴重的組織損傷。然而,缺血后再灌注(恢復供血)會導致所謂的缺血/再灌注損傷中引起更多的損傷。長時間的缺氧后重復再灌注可能會損害線粒體活動和呼吸鏈,可引起氧化應激增加以及后續的損傷或炎癥(lighton,j.r.&schilman,p.e.oxygenreperfusiondamageinaninsect.plosone2,e1267(2007);idris,a.h.etal.oxidantinjuryoccursrapidlyaftercardiacarrest,cardiopulmonaryresuscitation,andreperfusion.criticalcaremedicine33,2043-2048(2005);hermes-lima,m.&zenteno-savin,t.animalresponsetodrasticchangesinoxygenavailabilityandphysiologicaloxidativestress.comparativebiochemistryandphysiology.toxicology&pharmacology:cbp133,537-556(2002);datta,g.,fuller,b.j.&davidson,b.r.molecularmechanismsofliverischemiareperfusioninjury:insightsfromtransgenicknockoutmodels.worldjournalofgastroenterology19,1683-1698(2013).)。
在過去幾十年中已經提出了一些關于缺血誘發損傷的假說,主要的假說是能量缺乏導致谷氨酸的大量釋放,離子平衡的破壞和氧化應激(moskowitz,m.a.,lo,e.h.&iadecola,c.heartdiseaseandstrokestatistics--2011update:areportfromtheamericanheartassociation.neuron67,181-198(2010).)。針對這些假說涉及的過程或分子,已經開發了超過1000種潛在的中風藥物或干預措施,對其中一部分進行了大約160次臨床試驗,但沒有一項在臨床中取得成功(ginsberg,m.d.currentstatusofneuroprotectionforcerebralischemia:synopticoverview.stroke40,s111-114(2009).)。改變這種狀況的一個方法是通過遺傳或化學篩選發現新的調節生物體的缺氧損傷易感性或對缺氧耐受能力的分子或信號通路。
果蠅壽命短,可以在消耗低資源的情況下繁殖出大量的后代。果蠅基因組包含大約14,000個基因,許多基因在哺乳動物中是保守的,約75%的已知人類疾病的基因在果蠅可找到同源基因。此外,果蠅研究界積累了各種突變體、轉基因品系和基因編輯工具/技術。因此,果蠅經常用于模擬人類疾病,特別是神經疾病(bilen,j.&bonini,n.m.drosophilaasamodelforhumanneurodegenerativedisease.annualreviewofgenetics39,153-171(2005);lloyd,t.e.&taylor,j.p.flightlessflies:drosophilamodelsofneuromusculardisease.annnyacadsci1184,e1-20(2010).),這些可以進一步用于遺傳和化學篩選,以鑒別介導/調節缺氧誘導的損傷和潛在藥物的新分子。
與哺乳動物相比,果蠅具有非常強的耐受長時間缺氧的能力。經過長時間缺氧的果蠅放置在室溫空氣中可以恢復并再次活躍(hermes-lima,m.&zenteno-savin,t.animalresponsetodrasticchangesinoxygenavailabilityandphysiologicaloxidativestress.comparativebiochemistryandphysiology.toxicology&pharmacology:cbp133,537-556(2002).)。然而,缺氧/再氧化(a/r)應激會在果蠅中產生損傷,因為一部分果蠅在缺氧數小時后的隨后幾天死亡(vigne,p.,tauc,m.&frelin,c.strongdietaryrestrictionsprotectdrosophilaagainstanoxia/reoxygenationinjuries.plosone4,e5422(2009);caraballo,j.c.etal.roleofponinanoxia-reoxygenationinjury:adrosophilamelanogastertransgenicmodel.plosone9,e84434(2014).)。這與上述優點一起,使得果蠅有助于研究體內對缺氧的易感性和耐受性的分子機制,并通過遺傳和化學篩選鑒定潛在的靶向藥物和治療氧缺乏誘導的損傷的藥物(bartholomew,n.r.,burdett,j.m.,vandenbrooks,j.m.,quinlan,m.c.&call,g.b.impairedclimbingandflightbehaviourindrosophilamelanogasterfollowingcarbondioxideanaesthesia.scientificreports5,15298(2015);haddad,g.g.tolerancetolowo2:lessonsfrominvertebrategeneticmodels.experimentalphysiology91,277-282(2006);zhou,d.,visk,d.w.&haddad,g.g.drosophila,agoldenbug,forthedissectionofthegeneticbasisoftoleranceandsusceptibilitytohypoxia.pediatricresearch66,239-247(2009).)。為了幫助這些研究,我們開發了一種完全剝奪果蠅氧氣的精密裝置,以及非常可靠的測定方法,用于定量檢查經歷缺氧的果蠅的死亡率和運動能力的恢復。
技術實現要素:
在本發明的一個方面,提供了一種缺氧裝置,其特征在于,所述缺氧裝置包括以下設備:
a.氣體流量指示器;
b.水箱;
c.缺氧室;
其中以上設備之間采用管道連接,且氣體依次通過以上設備;缺氧室中設置有倒置的塑料管。
在本發明的一個實施例中,所述缺氧室是一個雙層平臺,包括:網狀網、帶孔的塑料板、倒置漏斗;其中所述帶孔的塑料板位于網狀網的上方,所述倒置漏斗位于雙層平臺的中心且其大開口位于網狀網的下方,其小開口通過蛇形管連接入所述缺氧裝置的氣體管道中。
在本發明的一個具體實施例中,所述蛇形管的直徑為1.0厘米以下。
在本發明的一個實施例中,所述缺氧室還包括帶有中心孔的蓋子,連接倒置漏斗小開口的蛇形管穿過所述中心孔,且中心孔直徑大于所述連接倒置漏斗小開口的蛇形管的直徑。
在本發明的一個實施例中,連接缺氧室蓋子和水箱之間的蛇形管外層,套有更大直徑的蛇形管且與缺氧室蓋子上的中心孔緊密連接。
在本發明的一個具體實施例中,所述更大直徑的蛇形管的直徑為2.0厘米以上。
在本發明的一個實施例中,所述倒置塑料管為ep管,優選1.5mlep管。
在本發明的一個具體實施例中,所述倒置塑料管的開口用紗布覆蓋。
在本發明的一個實施例中,所述氣體選自氮氣。
在本發明中,所述裝置可用于檢測缺氧對果蠅的影響。
在本發明中,所述裝置可用于篩選缺氧損傷相關基因或揭示缺氧相關疾病組織損傷的機制。
在本發明的一個實施例中,所述缺氧相關疾病包括高血壓、糖尿病、心臟病、中風、癌癥,優選為缺血性卒中。
在本發明的另一方面,提供了一種檢測缺氧對果蠅影響的方法,其特征在于,使用如權利要求1至9任一項所述的裝置。
在本發明的一個實施例中,給予果蠅缺氧的時間優選2.5-3小時,缺氧處理后第4-6小時進行攀爬能力測定。
附圖說明
圖1示出缺氧裝置的示意圖和實際圖。(a)缺氧裝置的示意圖(頂部)和實際圖像(底部)。氮氣流動方向由綠色箭頭標記。來自密封的缺氧室的額外氣體排放通過黑色管道進入開放水箱(紅色箭頭和點)。(bi)將果蠅放入1.5mlep管中,蓋子被取出,并用紗布代替。(bii)ep管被倒置在2層平臺的孔中。
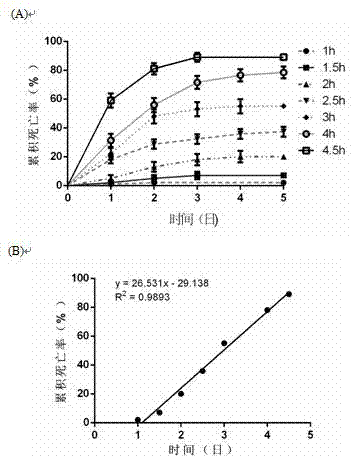
圖2示出缺氧期長度對a/r引起死亡率的影響。(a)經歷不同缺氧期的果蠅在后第-至第五天的累積死亡率百分比的曲線圖。對于每個數據點,n=5。(b)缺氧后第5天累積死亡率百分比相對于缺氧期(小時,h)的圖和直線擬合。顯示最佳擬合方程的線,r2和p值。數據以平均值±sem表示,統計學分析采用單因素方差分析,tukey多重比較t檢驗,*p<0.05。羽化后5天評估果蠅。
圖3示出使用爬管能力測定法檢測在缺氧/再氧化后果蠅運動能力的恢復。(a)缺氧后果蠅運動能力與恢復時間(再氧化時間的關系),通過分析每只果蠅的爬升高度(cm)來評估果蠅的運動能力。(b)為了進一步擴展研究,經歷不同缺氧時期(h)后再氧化5小時后,通過攀爬高度(cm)評估果蠅的運動能力。數據以平均值±sem表示,統計學分析采用單因素方差分析,tukey多重比較t檢驗,*p<0.05。羽化后5天評估果蠅,每組n=20只果蠅。
具體實施方式
下面結合具體實施方式對本發明進行進一步的詳細描述,給出的實施例僅為了闡明本發明,而不是為了限制本發明的范圍。下述實施例中的實驗方法,如無特殊說明,均為常規方法。下述實施例中所用的材料、試劑等,如無特殊說明,均可從商業途徑得到。
在本發明中,這種檢測方法優于其他傳統的缺氧篩選裝置,因為它易于使用,適用于大規模研究和產生可重復的結果。缺氧裝置可以快速,有效和低成本地使用。該裝置將有助于提供新的見解,以了解在暴露于受損氧供應(如缺血性卒中)后組織損傷的機制。
如本文所用,“缺血性卒中”是指缺血性腦卒中是指由于腦的供血動脈(頸動脈和椎動脈)狹窄或閉塞、腦供血不足導致的腦組織壞死的總稱。有四種類型的腦缺血:短暫性腦缺血發作(tia);可逆性神經功能障礙(rind);進展性卒中(sie);完全性卒中(cs)。tia無腦梗死存在,而rind、sie和cs有不同程度的腦梗死存在。
實施例
通過以下實施例進一步說明本發明。提供實施例僅用于說明目的,并且不應被解釋為以任何方式限制本發明的范圍或內容。
實施例1:果蠅家族和培養
將黑腹果蠅的基因野生型(wt)w1118果蠅保持在相對濕度為50-70%的標準玉米面-瓊脂-紅糖-酵母培養基中,在25℃下和12/12小時的晝夜循環下培養。培養基配方為:ddh2o0.65l/l、面包酵母16g/l、玉米粉80g/l、瓊脂6.5g/l、紅糖137.5g/l、啤酒酵母7.5g/l、對羥基苯甲酸甲酯2g/l,乙醇20ml/l,ddh2o100ml/l,丙酸6.25ml/l,防止霉菌生長。雄性和雌性果蠅在解剖顯微鏡下進行鑒定。在研究的時候,選擇在蛹化后4-6天之間的成年果蠅。
實施例2:缺氧裝置
缺氧裝置的設計和實際圖像如圖1所示,缺氧裝置由缺氧室(直徑12cm,高14cm的筒狀透明密閉容器)、水箱、氣體流量指示器和管道組成。在缺氧室中有一個雙層圓形平臺,底層是一個網狀網,上層是一個帶有孔的塑料板。在每個孔中,1.5mlep管可以坐下并容納10-20只果蠅。將ep管的蓋子取出,用紗布覆蓋并倒置在平臺上。一個塑料漏斗安裝在平臺的中心,漏斗的頭端連接到一個小的蛇形管(直徑為1.0cm),純氮氣(n2)通過該漏斗流向缺氧室的中心底部,氧氣(o2比n2重)在ep管中流動,并且在缺氧室中可以通過另一個更大的蛇形管(直徑為2.0厘米),通過蓋的中心的孔完全排出,其緊緊地附著在那個洞口。n2輸送蛇形管放置在較大的管道??中,兩條管道都進入水箱,這樣可以使來自缺氧室的氣體排出,但阻擋進入室內的空氣。載有n2的蛇形管從水箱中出來,與氣體流量指示器連接,并進一步連接到含有壓縮純n2氣的n2氣瓶中。硅膠和石蠟膜被用于防止連接處的氣體泄漏。在每個連接處的氣密性在水下測試。
實施例3:缺氧試驗
在二氧化碳(1-2分鐘)下快速收集5天齡的果蠅,并在缺氧處理前18-24小時用標準培養基在小瓶中回收,以盡量減少二氧化碳麻醉的混雜影響。每個小瓶包含相同數量的雌雄和雄蠅(總數為10或20)。恢復后,將一個小瓶中的所有果蠅用漏斗小心地轉移到1.5mlep管中,用紗布和橡皮筋快速覆蓋ep管,以避免逃逸。然后,將含有飛沫的ep管轉移到缺氧室中的平臺中,并將純n2以5l/分鐘的恒定流速引入到缺氧室中。記錄時間。每只小瓶中的果蠅僅經歷一次至缺氧期。將所有測定物保持在相同的室中,并在25℃、50-70%濕度下暴露于相同水平的光和噪聲中。
所有數據集均表示為平均值±sem。使用單因素方差分析進行統計學分析,p<0.05被認為具有統計學意義。軟件graphpadprism用于統計分析。所有實驗至少運行一式三份。
使用該系統,通過檢測缺氧時間長短對累計死亡率和爬管能力恢復的影響來檢測年輕w1118果蠅野生型(wt)中的a/r誘導的損傷。在n2以每分鐘5l的速度流入的缺氧室中,所有果蠅在3分鐘內因缺氧昏迷從ep管壁上倒下至紗布,此后保持靜止。經過指定的缺氧時間后,終止n2流入缺氧室,并從缺氧室中取出果蠅,在室溫空氣中,所有果蠅在缺氧后再供氧化后恢復活躍。恢復時間的長短取決于缺氧時間的長短。缺氧時間越長,需要恢復的時間越長(數據未顯示)。然而,當缺氧時間≥6小時時,絕大多數果蠅沒有恢復。相比之下,當缺氧時間小于1小時時,所有果蠅恢復,并且在隨后的5天內未死亡(數據未顯示)。
實施例4:死亡率分析
暴露于1.0、1.5、2、2.5、3、4和4.5小時的缺氧期后,將每個ep管中的果蠅被轉移回標準果蠅食物培養小瓶中。在隨后的5天內每天對每個小瓶中的死蠅進行計數,并計算每個小瓶的累積死亡率百分比。為了避免果蠅被培養基捕獲,培養瓶在缺氧后的第一天水平放置。
本研究定量研究了7個缺氧期,1、1.5、2、2.5、3、4和4.5小時對果蠅死亡率的影響。蛹化后的野生型5日齡果蠅被分為7組,每組都面臨7個缺氧期中的一期。對于每組,將100只野生果蠅分為5個亞組,每組有10只雄性和10只雌性。如圖2a所示,在暴露于缺氧≥1.5小時后的5天內,部分果蠅每天在死亡,累積死亡率在前3天隨時間增加而上升,第四天達到峰值。缺氧時間越長,累積死亡率越高。對缺氧時間-第五天的累積死亡率的數據點進行直線擬合,方程顯示累積死亡率與缺氧時間呈線性正相關。相關系數r2為0.9893,顯著性高(p<0.0001,圖2b)。值得注意的是,當缺氧時間為2.5-3小時時,第五天的累積死亡率約為50%。
實施例5:爬管能力測定
暴露于適當的缺氧期后,將果蠅轉移回其培養瓶中,并使其在常氧條件下恢復5小時或其它指示時間,然后進行如前所述的自動化ring(aring)測定。簡單來說,將同一組的10只果蠅轉移到一個測試小管中,該小管是內徑為2.0厘米,高度為20.0厘米的透明塑料圓筒。測試管垂直安裝在aring裝置上,該裝置通過步進控制馬達的驅動下自動上下震動4次將所有果蠅震倒到測試管的底部,隨后果蠅沿測試管壁爬升。將此錄像。將視頻轉移到計算機,并在攀爬開始后第5秒進行快照,并使用自制軟件rflydetection進行分析測量第5秒的每只飛行的爬升高度。
使用aring測定,還研究了缺氧后在空氣中再氧化時間對果蠅運動能力恢復的影響。將50只雄性和50只雌性5日齡雌性等分為10組,在缺氧裝置中進行2.5小時缺氧,然后轉移回含有標準培養基和空氣的培養管再氧化恢復。在再氧化后的第3、4、5、6、7小時,隨機測量10組中的2組,并用aring進行爬坡測定,并測量爬升起始后第5秒的每只果蠅的爬升高度。計算了20只果蠅的平均爬升高度。如圖3a所示,再氧化越長,遷移率恢復越好,但在再氧化后的第4-6小時內,攀爬高度保持穩定。
我們進一步研究了0、1.5、2、2.5和3小時不同缺氧時間對在空氣中再氧化后的第5小時爬管能力的影響。50只雄性和50只雌性5日齡果蠅等分為10組,10組中的2只經受0、1.5、2、2.5或3小時缺氧,然后轉移回含有標準培養基和空氣的培養管再氧化恢復,5小時后,通過使用aring檢測法檢測每只果蠅的爬坡能力。如圖3b所示,缺氧時間越長攀爬能力越差,顯示運動能力恢復越慢。結果顯示缺氧暴露與運動功能(1.5小時為5.19cm,2小時為3.35cm,2.5小時為1.54cm,3小時為0.85cm,而不暴露于缺氧為8.24cm)為負劑量依賴關系。
討論
缺氧損傷涉及一個尚未完全了解的復雜而動態的過程。為了進一步了解參與缺氧損傷的已知途徑,需要進一步研究確定參與缺氧和a/r誘導的損傷的新分子靶標。果蠅是一種強大的模型,用于各種遺傳篩選,用于鑒定涉及不同表型的新基因(queliconi,b.b.,kowaltowski,a.j.&nehrke,k.ananoxia-starvationmodelforischemia/reperfusioninc.elegans.journalofvisualizedexperiments:jove(2014).)。本發明測定方法和裝置提供了一種有效和可靠的方法來篩選參與缺氧誘導的損傷的基因,篩選可以減少缺氧誘導損傷的藥物化合物。
在本發明中,蛹化后5天齡的w1118,經過1小時的缺氧處理是致命的,缺氧后第5天的死亡率與缺氧期的時間長度呈線性正相關,達到約40-60%缺氧時間為2.5-3小時。因此,本發明證實,2.5-3.0小時的缺氧持續時間可以是量化遺傳操作或化學應用對死亡率的正面或負面影響的適當時間長度。另外,2.5小時缺氧處理后,遷移恢復緩慢,第4-6個小時的爬升高度基本保持不變。因此,我們建議在未來的缺氧測定的移動性分析之前,用2.5-3小時的缺氧處理和4-6小時的恢復。
傳統的缺氧裝置包括含有單個或多個果蠅的塑料管進行測試,并且可以在缺氧試驗期間使用特別設計的腔室監測氧氣水平和溫度(zhou,d.,visk,d.w.&haddad,g.g.drosophila,agoldenbug,forthedissectionofthegeneticbasisoftoleranceandsusceptibilitytohypoxia.pediatricresearch66,239-247,(2009))。因此,我們開發了一種簡單的缺氧試驗,用于研究飛行中的氧缺乏,這種效率更高效,可以同時量化許多不同基因型的果蠅的性能。該裝置可以有助于克服使用當前的缺氧試驗中已知的許多限制,并將有助于進一步了解缺氧性卒中等缺氧疾病的潛在機制。
通過引用并入
本文引用的每個專利文獻和科學文獻的全部公開內容通過引用并入本文用于所有目的。
等效
本發明可以在不脫離其基本特征的情況下以其他具體形式實施。因此,前述實施例被認為是說明性的,而不是對本文所述的本發明的限制。本發明的范圍由所附權利要求書而不是由前述說明書表示,并且意在將落入權利要求書的等同物的含義和范圍內的所有改變包括在其中。
- 還沒有人留言評論。精彩留言會獲得點贊!