雙特異性四價抗體及其制造和使用方法與流程
本申請要求2014年12月22號提交的美國臨時申請第62095348號,名稱為“雙特異性抗體”的優先權,該文件全部內容在此引入作為參考。序列表與本申請相關聯的序列表是以文本格式代替紙件副本的形式來提供,并且以引用方式并入本說明書中。包含所述序列表的文本文件名是序列表_ST25_0003PCT2.txt。所述文本文件大約227KB,在2015年12月18號創建,并經由EFS-Web進行電子提交。
技術領域:
本公開總體涉及抗體治療試劑
技術領域:
,尤其涉及針對EGFR家族兩個不同成員的雙特異性四價抗體。
背景技術:
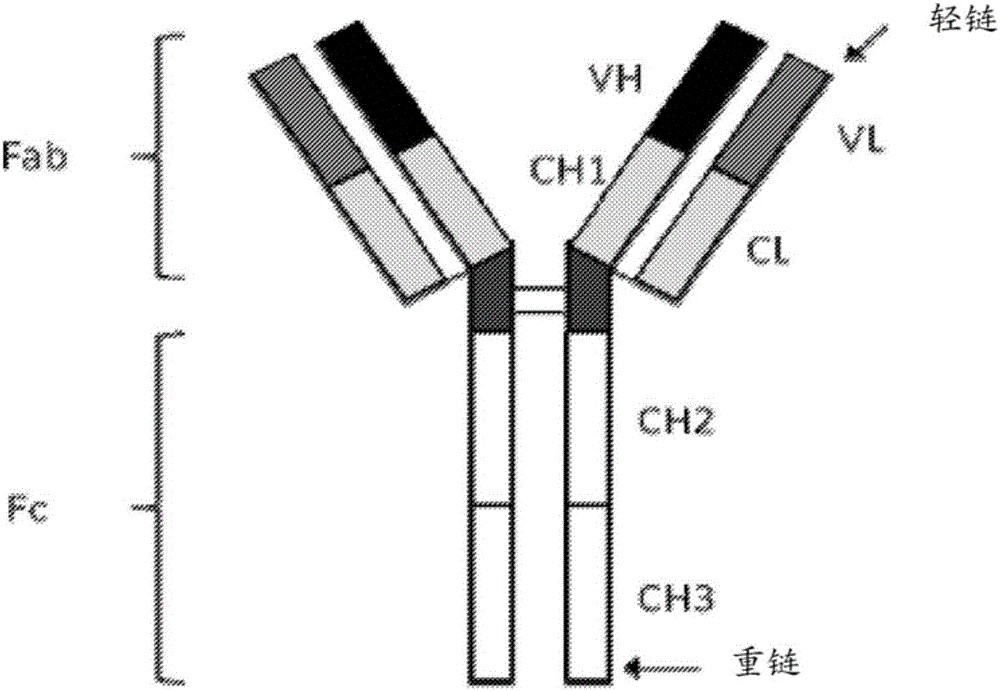
:ErbB/HER受體家族成員例如EGFR、HER2、HER3、HER4的過量表達和/或失調,已經表明在癌癥的腫瘤發生中起重要作用。EGFR或者HER2的突變和擴增產生異常生長信號,其激活促成腫瘤發生的下游信號途徑。針對EGFR和HER2的治療性抗體和小分子抑制劑已被批準用于癌癥的治療(Arteaga等人,NatureReviewsClinicalOncology916-32,January2012)。針對EGFR家族成員,如EGFR和HER2的單克隆抗體已經在結腸癌(Price等人.,TheLancetOncology15(6),Pages569-579,May2014)、頭頸部鱗狀細胞瘤(Cohen,CancerTreatmentReviews40(2014)567-577)、乳癌和胃癌(Arteaga等人,NatureReviewsClinicalOncology916-32,January2012)中表現出良好的臨床反應。幾種治療性抗EGFR抗體,包括西妥昔單抗、帕尼單抗和尼妥珠單抗是已獲準用于幾種癌癥包括轉移性結腸直腸癌、頭頸部鱗狀細胞癌和神經膠質瘤的療法(Price和Cohen,CurrTreatOptionsOncol.2012Mar;13(l):35-46;Bode等人,ExpertOpinBiolTher.2012Dec;12(12):1649-59)。令人遺憾的是最初對這些治療劑反應的許多腫瘤由于對藥劑的獲得性抗性而最終發生進展(Jackman等人.JClinOncol2010;8:357-60)。因此仍然存在著對更好的癌癥治療方法需求。技術實現要素:本公開提供了雙特異性四價抗體。雙特異性四價抗體可以包括具有兩條重鏈和兩條輕鏈的免疫球蛋白G(IgG)部分,以及與重鏈或輕鏈的C或N末端共價連接的兩個scFv部分。IgG部分可具有與EGFR家族第一成員結合的特異性。scFv部分可具有與EGFR家族第二成員結合的特異性。IgG部分和兩個scFv部分共價連接以作為雙特異性四價抗體起作用。為使本公開的目的和有益效果更加清楚,下面將結合相應的附圖詳細闡述優選實施例。附圖說明現在參考附圖詳細描述本公開的優選實施例,其中類似的參考標號表示類似的元件。圖1是示出了實例二價單特異性免疫球蛋白G(IgG)抗體的結構域結構的圖。圖2是示出了根據本發明的一個實施例,包含IgG部分和2個scFv部分的實例四價雙特異性抗體的結構域的圖。圖3示出了實例四價雙特異性抗體1X1、1X2、1X3、1X4、1X4.2、1X5和1X6的結構域結構圖。圖4示出了SI-1X4和SI-1X4.2之間的VH結構域序列比較,示出了5個氨基酸差異。圖5和6是示出了利用BLI的單體EGFR結合的圖。圖7、8和9是示出了雙特異性ELI結合的圖。圖10是示出了二聚EGFRELISA的圖。圖11示出了SI-1C5.2和SI-1X4.2與單體EGFR通過Octet分析的結合動力學。圖12示出了SI-1X抗體與A431細胞結合的流式細胞儀分析。圖13示出了SI-1X抗體與BxPC3細胞結合的流式細胞儀分析。圖14示出了SI-1X4.2抗體與Fadu細胞結合的流式細胞儀分析。圖15示出了SI-1X4.2抗體與A431細胞結合的流式細胞儀分析。圖16示出了SI-1X抗體對A431細胞增殖的作用。圖17示出了SI-1X抗體對A431細胞增殖的作用。圖18示出了SI-1X抗體對BxPC3細胞增殖的作用。圖19示出了SI-1X抗體對BxPC3細胞增殖的作用。圖20示出了SI-1X4.2抗體對Fadu細胞增殖的作用。圖21示出了SI-1X4.2抗體對A431細胞增殖的作用。圖22示出了SI-1X抗體對Fadu細胞的ADCC活性。圖23示出了SI-1X抗體對NCI-H1975細胞的ADCC活性。圖24示出了SI-1X抗體的熱熔性以展示其熱穩定性。圖25示出SI-1X抗體在七天時間內的血漿穩定性。圖26是示出經EGFR包被的ELISA用于大鼠PK研究的結果圖。圖27是示出經HER3包被的ELISA用于大鼠PK研究的結果圖。圖28是示出夾心ELISA用于大鼠PK研究的結果圖。圖29是示出小鼠異種移植研究中平均腫瘤體積對天數的曲線圖圖30是示出小鼠異種移植研究中相對體重對周數的曲線圖。具體實施方式本公開提供了較目前已知的抗EGFR抗體,具有更優異治療特性或者療效的雙特異性四價抗體。在一個實施例中,抗體靶向EGFR家族的兩個成員,包括但不限于EGFR和HER3。雙特異性四價抗體可同時抑制EGFR和HER3介導的信號傳導,因而克服EGFR抑制劑或單克隆抗體治療中的耐藥性。必須注意,如本文和所附權利要求書中所用,貫穿本說明書和權利要求書的單數形式“一(a)”、“一個(an)”以及“所述(the)”、單詞“包含(comprise)”或變形例如“包含(comprises)”或“包含(comprising)”應理解為意味著包括所敘述的整體或者整體的組合,但是并不排除任何其他的整體或者整體的組合,包括復數對象,除非上下文另外清楚地說明。“抗體片段”包含完整抗體的部分,優選完整抗體的抗原結合區或可變區。抗體片段的實例包括Fv、Fab、Fab'、F(ab')2、Fab'-SH;diabodies;線性抗體(參考美國專利第5641870號實例2;Zapata等,ProteinEng.8(10):1057-1062(1995));單鏈抗體分子(例如scFv)盡管在本描述中,并且在整個說明書中,提到了抗體和抗體的各種性質,但是相同的公開內容也適用于功能性抗體片段,例如,雙效Fab片段。在一方面,雙特異性四價抗體可以包括具有兩條重鏈和兩條輕鏈的免疫球蛋白G(IgG)部分,以及與重鏈或輕鏈的C或N末端共價連接的兩個scFv部分。IgG部分可具有與EGFR家族第一成員結合的特異性。scFv部分可具有與EGFR家族第二成員結合的特異性。IgG部分可以為scFv部分提供穩定性。雙特異性四價抗體可阻斷AKT和MAPK/ERK途徑的信號傳導,并且可以介導針對表達一種或兩種抗原的細胞的抗體依賴性細胞介導的細胞毒性(ADCC)。在一個實施例中,雙特異性四價抗體能夠同時結合兩種抗原。在一些實施例中,與單特異性抗體親本對照或單特異性抗體親本對照的組合相比,雙特異性四價抗體在體外和體內增殖試驗中提供更強的腫瘤抑制。在一個實施例中,本公開提供具有兩條IgGl重鏈、兩條κ輕鏈和兩條單鏈Fv(scFv)結構域的雙特異性四價抗體。兩條IgG1重鏈和κ輕鏈形成對EGFR家族的第一成員具有結合特異性的IgG部分。兩個scFv結構域具有對EGFR家族第二成員的結合特異性,并且每個scFv結構域通過具有氨基酸序列(gly-gly-gly-gly-ser)n(也稱為(G4S)2)的連接體連接到IgG1重鏈的C末端,以提供IgG1-連接體連接,n是至少為1的整數。例如,n可以是2、3、4、5、6、7、8、9、10或17。每個scFv結構域具有“N末端-可變重鏈-連接體-可變輕鏈-C末端”的結構順序。連接體可具有氨基酸序列(gly-gly-gly-gly-ser)m,也稱為(G4S)m。m可以是至少2或至少3的整數。例如m可以是3、4、5、6、11或12。在一些實施例中,IgGl重鏈中至少一個或兩個是人源化或人的。在一些實施例中,κ輕鏈中至少一個或兩個是人源化或人的。EGFR家族成員可包括EGFR、HER2、HER3、片斷或其衍生物。在一些實施例中,EGFR家族的第一成員可以是EGFR、HER2、其片段或衍生物。在一些實施例中,EGFR家族的第二成員可以是HER3、其片段或衍生物。在一個實施例中,IgG部分可具有針對HER3的結合特異性。在一個實施例中,scFv結構域可以具有針對EGFR的結合特異性。在一個實施例中,IgG部分可具有針對HER3的結合特異性,且scFv結構域可以具有針對EGFR的結合特異性。在一個實施例中,IgG部分可以具有針對EGFR的結合特異性。在一個實施例中,scFv結構域可以具有針對HER3的結合特異性。在一個實施例中,IgG部分可以具有針對EGFR的結合特異性,且scFv結構域可以具有針對HER3的結合特異性。在一些實施例中,IgGl重鏈中的一條或兩條的C末端缺失一個氨基酸殘基。例如在連接體被融合到C末端上之前,賴氨酸殘基可從IgGl鏈的C末端缺失。賴氨酸殘基的缺失導致IgGl-連接體連接對蛋白酶活性具有抗性。在一些實施例中,IgGl重鏈中的一條或兩條含有兩個在CH3結構域中的突變。例如,兩個突變可以回復成人CH3結構域中的通用殘基。在一些實施例中,IgG1重鏈可以具有與SEQIDNO7、15、23、31、39、47和127有至少95%、98%或99%相似性的氨基酸序列。在一些實施例中,IgG1重鏈、連接體和scFv結構域可以具有與SEQIDNO56、66、76、86、98、108、118和136有至少95%、98%或99%相似性的氨基酸序列。在一些實施例中,κ輕鏈可具有與SEQIDNO3、11、19、27、35、43、51、61、71、81、92、103、113、123和131有至少95%、98%或99%相似性的氨基酸序列。在一些實施例中,可變輕鏈可具有與SEQIDNO4、12、20、28、36、44、52、62、72、82、93、104、114、124和132有至少95%、98%或99%相似性的氨基酸序列。在一些實施例中,可變重鏈可具有與SEQIDNO8、16、24、32、40、48、57、67、77、87、99、109、119、128和137有至少95%、98%或99%相似性的氨基酸序列。在一些實施例中,IgG部分可以具有針對HER3的結合特異性,且scFv結構域可以具有針對EGFR的結合特異性。在一個實施例中,IgGl重鏈、連接體和scFv結構域具有SEQIDNO56的氨基酸序列,并且κ輕鏈具有SEQIDNO51的氨基酸序列。在一個實施例中,IgGl重鏈、連接體和scFv結構域具有SEQIDNO76的氨基酸序列,并且κ輕鏈具有SEQIDNO71的氨基酸序列。在一個實施例中,IgGl重鏈、連接體和scFv結構域具有SEQIDNO108的氨基酸序列,并且κ輕鏈具有SEQIDNO103的氨基酸序列。在一些實施例中,IgG部分具有針對EGFR的結合特異性,且scFv結構域具有針對HER3的結合特異性。在一個實施例中,IgGl重鏈、連接體和scFv結構域具有SEQIDNO66的氨基酸序列,并且κ輕鏈具有SEQIDNO61的氨基酸序列。在一個實施例中,IgGl重鏈、連接體和scFv結構域具有SEQIDNO86的氨基酸序列,并且κ輕鏈具有SEQIDNO81的氨基酸序列。在一個實施例中,IgGl重鏈、連接體和scFv結構域具有SEQIDNO98的氨基酸序列,并且κ輕鏈具有SEQIDNO92的氨基酸序列。在一個實施例中,IgGl重鏈、連接體和scFv結構域具有SEQIDNO118的氨基酸序列,并且κ輕鏈具有SEQIDNO113的氨基酸序列。在一個實施例中,IgGl重鏈、連接體和scFv結構域具有SEQIDNO136的氨基酸序列,并且κ輕鏈具有SEQIDNO131的氨基酸序列。雙特異性四價抗體具有抑制癌細胞生長的活性。在某些實施例中,本發明的抗體對其靶標EGRF或HER3具有解離常數(Kd)≤80nM、≤50nM、≤30nM、≤20nM、≤10nM、或≤0.1nM。抗體可同時結合兩個靶標。在一些實施例中,抗體以低于50nM的Kd結合EGRF和HER3。在一些實施例中,抗體以低于40、30、25、20、19、18或者10nM的Kd結合EGRF和/或HER3。在一個實施例中,抗體以低于30nM的Kd結合EGRF并且以低于30nM的Kd結合HER3。在一個實施例中,抗體以低于50nM的Kd結合EGRF并且同時以低于50nM的Kd結合HER3。在另一方面中,本公開提供了分離的核酸,其編碼在此公開的雙特異性四價抗體或其亞組分。亞組分可以是IgGl重鏈、κ輕鏈、可變輕鏈或可變重鏈。在另一方面中,本公開提供了具有分離的核酸的表達載體,核酸編碼在此公開的雙特異性四價抗體或其亞組分。載體在宿主細胞內是可表達的。宿主細胞可以是原核細胞或真核細胞。在另一方面中,本公開提供了宿主細胞,其具有分離的核酸或包括這些核酸序列的表達載體,核酸編碼在此公開的雙特異性四價抗體。在另一方面中,本公開提供產生雙特異性四價抗體的方法。在一個實施例中,該方法可包括培養上述宿主細胞使得產生抗體。在另一方面中,本公開提供免疫偶聯物,其包括本文所述的雙特異性四價抗體以及細胞毒性劑。在另一方面中,本公開提供了藥物組成。該藥物組成可包括本文所述的雙特異性四價抗體或免疫偶聯物和藥學上可接受的載劑。在一些實施例中,組成可進一步包括放射性同位素、放射性核素、毒素、治療劑、化學治療劑或其組合物。在另一方面,本公開提供治療癌癥受試者的方法。在一個實施例中,該方法包括給受試者施用有效量的本文所述的雙特異性四價抗體的步驟。該癌癥可以包括表達EGFR家族至少兩個成員(包括例如EGFR、HER2、HER3、其片段或衍生物)的細胞。癌癥可以是乳癌、結腸直腸癌、胰腺癌、頭頸癌、黑素瘤、卵巢癌、前列腺癌和非小細胞肺癌、神經膠質瘤、食管癌、鼻咽癌、肛門癌、直腸癌、胃癌、膀胱癌、子宮頸癌和腦癌。在一個實施例中,所述方法可進一步包括施用有效量的治療劑。該治療劑可以是例如抗體、化學治療劑、細胞毒性劑、酶或其組合物。在一些實施例中,該治療劑可以是抗雌激素劑、受體酪氨酸抑制劑或者其組合。在一些實施例中,該治療劑可以是生物制劑。在一個實施例中,該治療劑可以是檢查點抑制劑。在一些實施例中,治療劑可包括PD1、PDL1、CTLA4、4-1BB、OX40、GITR、TIM3、LAG3、TIGIT、CD40、CD27、HVEM、BTLA、VISTA、B7H4、其衍生物、偶聯物或片段。在一些實施例中,治療劑可以是卡培他濱、順鉑、曲妥單抗、氟維司群、他莫昔芬、來曲唑、依西美坦、阿那曲唑、氨魯米特、睪內酯、伏氯唑、福美司坦、法羅唑、來曲唑、埃羅替尼、拉法替尼、達沙替尼、吉非替尼、伊馬替尼、帕唑帕尼、拉帕替尼、蘇尼替尼、尼洛替尼、索拉非尼、納米微粒白蛋白結合型紫杉醇或其衍生物。在一些實施例中,有此治療需要的受試者是人。在一個實施例中,本公開提供了通過給受試者施用有效量的雙特異性四價抗體以抑制HER受體的生物活性來治療受試者的方法。在一實施例中,本公開提供具有有效濃度的雙特異性四價抗體的溶液。在一個實施例中,該溶液是受試者的血漿。IgG的一般結構圖在圖1中示出。根據一些實施例的雙特異性四價抗體典型結構圖在圖2中示出。在這個實例中,雙特異四價抗體包括兩條人IgGl重鏈、兩條人κ輕鏈和兩條單鏈Fv(scFv)結構域。兩條人IgG1重鏈和人κ輕鏈形成對EGFR家族的一個成員具有結合特異性的IgG部分,并且兩個scFv結構域中的每個通過具有氨基酸序列gly-gly-gly-gly-ser-gly-gly-gly-gly-ser((G4S)2)的連接體連接到人IgG1重鏈中的任一條的C末端殘基。每個scFv結構域按如下順序:N末端-可變重鏈-接頭-可變輕鏈-C末端。接頭由氨基酸序列為gly-gly-gly-gly-ser-gly-gly-gly-gly-ser-gly-gly-gly-gly-ser,也稱為(G4S)3構成。對于雙特異性四價抗體的一些實施例,CH1、CH2、CH3、CL、連接體和接頭氨基酸序列是相同的。每個雙特異性四價抗體在抗體的一個末端具有二價抗HER3結合的特異性和在另一個末端上具有二價抗EGFR結合特異性。一對抗HER3可變重鏈和可變輕鏈命名為1C1,且四對抗EGFR可變重鏈和可變輕鏈分別命名為1C3、1C5、1C5.2、1C6和1C6.4。雙特異性四價抗體命名為1X1、1X2、1X3、1X4、1X4.2、1X5、1X5.2、1X6和1X6.4。此外,參照物分子1C4(也命名為SI-1C4)在一些研究中使用。1C4是在由Schaefer等人2011(Schaefer等人,CancerCell.2011Oct18;20(4):472-86)所述的2-in-1平臺上針對EGFR和HER3構建的雙特異性抗體。IC4具有類似于單克隆抗體的結構。所述分子在每個Fab臂上能結合EGFR或HER3,但是不能在每個Fab臂上同時接合兩個靶標。可變輕鏈、可變重鏈和單鏈Fv(scFv)DNA片段經由外部供應商通過基因合成生成。人γ-1重鏈和人κ輕鏈DNA片段經由外部供應商通過基因合成生成。使用限制性位點通過DNA連接將片段裝配在一起,并克隆到設計用于在哺乳動物細胞中瞬時表達的載體中。載體含有強CMV衍生啟動子以及瞬時表達所需的其他上游和下游元件。通過DNA測序驗證所得IgG表達質粒含有預期的DNA序列。如在別處所述,使用線性PEI轉染懸浮適應的HEK293F細胞實現抗體構建體的瞬時表達(參見CSHProtocols;2008;doi:10.1101/pdb.prot4977)。如果有必要的話,從所得轉染上清液中使用蛋白親和層析和尺寸排阻層析純化抗體。通過Superdex200柱來分析蛋白質質量。用于所有試驗的蛋白質都具有大于90%的純度。雙特異性抗體可用于治療具有EGFR和HER3共表達的癌癥類型,包括但不限于結腸癌、頭頸部鱗狀細胞癌、肺癌、神經膠質瘤、胰腺癌、鼻咽癌和其他癌癥類型。雙特異性抗體具有四價雙重特異性。實例抗體可以包括一個IgG和兩個scFv,相比于單特異性抗體IgG,其提供了兩種不同的結合特異性。與僅使用scFv的其他雙特異性抗體例如BiTE技術(Lutterbuese等人,ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica107.28(2010):12605-12610.PMC.Web.2Dec.2014)和其他(例如,US7332585B2)相比,IgG組分提供了穩定性和改善的血漿半衰期。其還能夠介導ADCC,而不具有Fc組分的那些則不能(例如,US7332585B2)。四價雙重特異性性質為雙特異性抗體提供優于一些其他雙特異性抗體的同時結合能力,后者僅可一次結合一種抗原(Schanzer等人,Antimicrob.AgentsChemother.2011,55(5):2369;EP272942A1)。為了敘述方便,雙特異性抗體序列或其相關序列概括在下表1中。表1雙特異性抗體的核苷酸和氨基酸序列或其相關的核苷酸和氨基酸序列的概括實例雖然以下實例僅提供作為舉例說明而用,而非用于限制,但是本領域技術人員應該容易地識別各種各樣的非關鍵參數,這些參數可被更改或修改以生成基本上相同或相似的結果。實例1:SI-1X4和SI-1X4.2之間的序列差異SI-1X4.2為SI-1X4分子的變型,含有如下5個氨基酸變化:使用Kabat編號系統的V71A、T75S、N76S、A93T和S107T。對于一些位點,特別是75、76和93位,雖然這些位點不位于CDR區,但是它們能與抗原發生相互作用,對于結合和活性是必要的。圖4示出了SI-1X4.2和SI-1X4之間的5個氨基酸差異。實例2:使用BLI表征抗表皮生長因子受體(EGFR)抗體通過BLItz儀器(ForteBio公司)以生物膜層干涉法(BLI)結合試驗測定抗體與EGFR胞外結構域單體的結合能力。將25μg/mL的SI-1C3、SI-1C4、SI-1C6、SI-1X1、SI-1X2、SI-1X5和SI-1X6稀釋于PBS中并經120秒俘獲在抗人lgGFcBLItz生物傳感器的尖端上。尖端于PBS中洗滌30秒,然后轉移至588nMEGFR(ProSpecBio,PKA-344)樣品中用于結合。在120秒的結合時間內,EGFRECD與尖端的結合記錄為生物膜層干涉法信號(Δnm)。尖端移至PBS中并觀察解離240秒(觀察*SI-1C6的解離時間僅為120秒)。圖5和6記錄了從EGFR與負載抗體的生物傳感器的結合步驟開始的數據。各圖都示出了與作為基準抗體的SI-1C4的對比。由于SI-1C3和SI-1X2共用它們的以Fab示出的EGFR結合域,它們的結合譜相似并強于SI-1X1上示出的scFv形式(圖6)。與SI-1C4相比,每個均對EGFR具有非常慢的解離速率,且不受它們的結合速率的影響。SI-1X1在與EGFR結合時可能示出較弱的結合速率,但會保持極強的結合。在圖5中觀察到相同的趨勢,其中SI-1C6和SI-1X6上示出的EGFR結合域的Fab變體以比S1-1X5上示出的其典型的scFv高的速率結合。在雙特異性抗體的Fab側具有EGFR結合域似乎會以快于scFV變體的結合速率而結合,但表現出相似的解離速率。在這個試驗(數據未示出)中,SI-1X3和SI-1X4沒有表現出單體EGFR結合,在下面的ELISA中,進行二聚EGFR結合的研究。實例3:使用BLI表征抗EGFR和Her3的抗體與EGFR和Her3胞外域的雙特異性結合在BLItz儀器(ForteBio公司)上以生物膜層干涉法(BLI)結合試驗進行測量。將200nM的SI-1C1、SI-1C3、SI-1C4、SI-1C6、SI-1X1、SI-1X2、SI-1X3、SI-1X4、Sl-1X5和SI-1X6稀釋于IX動力學緩沖液KB(ForteBio公司)中并經120秒俘獲在抗人lgGFcBLItz生物傳感器的尖端上。尖端于KB中洗滌30秒,然后轉移至200nMEGFR樣品(ProSpecBio,PKA-344)中用于結合。在120秒的結合時間內,EGFRECD與尖端的結合記錄為生物膜層干涉法信號(Δnm)。尖端移至KB中并觀察解離60秒。用Her3ECD樣品(SinoBiological,10201-H08H-10)在200nM下重復該過程120秒,以及在KB中進行相似的解離步驟60秒。圖8-10、7-9記錄了從EGFR與負載抗體的生物傳感器的結合步驟開始的數據。抗體在通過Fc結合到傳感器上時能夠表現出同時特異性結合EGFR和Her3。如圖7和圖8中所觀察到的,示出為Fab(SI-1X2、SI-1X6)的EGFR結合域比它們的scFv形式(分別為SI-1X1、SI-1X5)在結合時具有更強的結合速率。此時,EGFR和Her3兩者都表現出相同的Fab>>scFv結合速率趨勢。SI-1X3和SI-1X4沒有表現出與單體EGFR結合,然而,正如所預期的那樣,各自都具有結合Her3的能力,這是由于每個分子使用相同的如SI-1X1、SI-1X2、SI-1X5和SI-1X6等aHer3結合域。在下面的ELISA中研究SI-1X3和SI-1X4的二聚EGFR結合。實例4:二聚EGFRELISA試驗正如早些時候所觀察到的,在BLI試驗中SI-1X3和SI-1X4不能結合單體形式的EGFR(圖9)。為了使SI-1C5、SI-1X3和SI-1X4中使用的aEGFR結合域在體外與EGFR結合,有人建議需進行二價結合(Perez等人,臨床腫瘤學雜志2014;3(1):5)。為了對其進行觀察,相對于其他使用EGFR二聚形式的EGFR結合抗體,我們將ELISA用于抗體結合。使用與實驗室自制的兔Fc融合的二聚EGFRECD試劑SI-2C1來進行ELISA。將EGFR以3μg/mL在PBS中在4℃下包被在Maxisorp免疫板(Nunc)上過夜。免疫板在室溫下用3%BSA和0.05%Tween20于PBS中封閉2小時。除了SI-1C5、SI-1X3和SI-1X4起始為50μg/mL(以nM記錄)外,抗體起始以10ug/mL在室溫下俘獲1小時,所有都在PBST(1%BSA)中進行3倍稀釋。使用山羊抗人IgG-HRP抗體(JacksonImmunoResearch,109-035-098)在PBST(1%BSA)中以1:2000稀釋度檢測抗體的Fc部分,并在TMB(ThermoScientific)中顯色5分鐘,用H2SO4作為終止溶液。在各個步驟之間用PBST(1%BSA)洗滌三次。所有的數據點都進行三次重復,并在450nm下收集(圖10)。與其他分子相比,在該ELISA方式中SI-1C5、SI-1X3和SI-1X4都以高濃度與二聚EGFRECD結合。實施例5:使用Octet測定1C5.2和1X4.2的結合動力學使用具有抗人Fc傳感器的ForteBioOctetRed96儀器(ForteBio,AHC#18#-5060)測定動力學。結合實驗在1000RPM的攪拌下于30℃下進行。EGFR蛋白質為人EGFR的胞外域(Met1-Ser645),其具有C末端多組氨酸標簽。所有樣品都稀釋于10X動力學緩沖液(ForteBio#18#-5032)中。1C5.2、1X6和1X4.2各自以10μg/ml加載到8個傳感器上,計300秒,然后在10X動力學緩沖液中檢測基線60秒。以單濃度的EGFR蛋白質(300、100、33.33、11.11、3.705、1.235、0.4116和0nM)用各個傳感器進行EGFR蛋白質結合300秒。然后,在10X動力學緩沖液中解離900秒。圖11中示出了1C5.2和1X4.2的典型結合和解離曲線。使用ForteBio數據分析軟件v9.0進行數據分析。進行軟件曲線擬合,對于各1C5.2(表2)、1X4.2(表3)和1X6(表4),使用四個最佳曲線擬合并取平均值以測定KD、k(結合)和k(解離)。SI-1C5.2和Sl-1X4.2的平均KD分別是19.2nM和18.4nM。SI-1C6的平均KD是3.04nM。如實例1中所述,與1C5和1X4相比,1C5.2和1X4.2含有5個氨基酸變化。當與圖10中針對1C5和1X4產生的數據相比時,這些變化導致對EGFRECD的結合改善。表21C5.2的KD、KON和KDIS的概括EGFR(NM)KD(M)KON(1/MS)KDIS(1/S)SI-1C5.23003.74E-084.61E+041.72E-03SI-1C5.21002.23E-087.89E+041.76E-03SI-1C5.233.39.94E-091.60E+051.59E-03SI-1C5.211.17.08E-092.12E+051.50E-03平均值1.92E-081.24E+051.64E-03表31X4.2的KD、KON和KDIS的概括EGFR(NM)KD(M)KON(1/MS)KDIS(1/S)SI-1X4.23003.69E-084.63E+041.71E-03SI-1X4.21003.69E-087.88E+041.65E-03SI-1X4.233.39.44E-091.58E+051.49E-03SI-1X4.211.16.19E-092.18E+055.14E-02平均值1.84E-081.25E+051.35E-03表41X6的KD、KON和KDIS的概括實例6:實例雙特異性抗體對腫瘤細胞系的的結合測試通過流式細胞術測試雙特異性抗體SI-1X1、SI-1X2、SI-1X3、SI-1X4、SI-1X5和SI-1X6,以及同型對照抗體與腫瘤細胞系A431(表皮樣癌,ATCCCRL-1555)和BxPC3(胰腺癌,ATCCCRL-1687)的結合。細胞生長于含有10%胎牛血清的RPMI-1640培養基中并在指數生長期時收集用于分析。5x106細胞的各等份在PBS中洗滌一次,然后重懸于250μl的PBS+1%胎牛血清(BSA)中并在4℃下培養15分鐘以阻止細胞膜進行非特異性結合。將在PBS/1%BSA中稀釋至10μg/ml的250μl的抗體加入各樣品中以達到5μg/ml的抗體終濃度。細胞在混勻后于4℃下在一抗中培養1小時。然后,細胞用1ml的PBS/1%BSA洗滌兩次,然后重懸于500μl的PE-偶聯小鼠抗人IgG-Fc中并在混勻后于4℃下孵育45分鐘。樣品用1ml的PBS/1%BSA再次洗滌兩次,重懸于300ml的PBS中并使用FACScalibur流式細胞儀分析。對于各樣品,在FL-2通道中收集10000個數據采集點。使用FCSExpress軟件生成直方圖,且SI-1X直方圖與同型對照抗體染色得到的直方圖疊加。所有六種雙特異性抗體顯示相對于指示細胞結合的對照染色的直方圖位移。該數據在圖12(A431細胞結合)和圖13(BxPC3細胞結合)中示出。實例7:通過細胞結合試驗表征SI-1C5.2和SI-1X4.2通過流式細胞術測試雙特異性抗體SI-1X4.2、單特異性抗體SI-1C5.2和SI-1C1以及同型對照抗體與腫瘤細胞系A431(表皮樣癌,ATCCCRL-1555)(圖14)和FaDu(BxPC3(下咽鱗癌,ATCCHTB-43)(圖15)的結合。細胞生長于含有10%胎牛血清的RPMI-1640培養基中并在指數生長期時收集用于分析。細胞在PBS中洗滌一次,然后以5x106個細胞/ml的濃度重懸于PBS+5%胎牛血清白蛋白(FBS)中并在4℃下培養15分鐘以阻止細胞膜進行非特異性結合。100μl等份細胞加入96孔板中的100μl等份抗體(也在PBS+5%FBS中稀釋)中。樣品于冰上在一抗中孵育45分鐘。然后,細胞用200μl的PBS+5%FBS洗滌兩次,然后重懸于100μl的PE偶聯小鼠抗人IgG-Fc中并于冰上孵育30分鐘。樣品用200μl的PBS+5%FBS再次洗滌兩次,重懸于200μl的PBS中并使用FACScalibur流式細胞儀分析。對于各樣品,在FL-2通道中收集10000個數據采集點。使用FCSExpress軟件生成直方圖,并測定各數據集合的幾何平均熒光強度(GMFI)。通過使用GraphpadPrism軟件對GMFI相對抗體濃度繪圖來測定EC50結合值。雙特異性抗體SI-1X4.2示出了與單特異性抗EGFR抗體SI-1C5.2相似的結合譜,在兩個細胞系中具有相似的EC50。其他單特異性抗Her3抗體SI-1C1與這兩個細胞系結合較弱,這可能是由于Her3在細胞表面上的表達水平較低。如實例1中所述,與1C5和1X4相比,1C5.2和1X4.2含有5個氨基酸變化。與親本分子1X4相比,這些變化可使得與靶細胞的結合改善。實例8:SI-1X抗體對腫瘤細胞系的抗增殖作用為了評價抗Her3/EGFR雙特異性抗體的生長抑制潛能,測試對于A431細胞(ATCCCRL-1555,Manassas,Va.)的增殖的作用,A431細胞是表皮樣癌腫瘤細胞系。還測試對于胰腺腺癌細胞系BxPC3(ATCCCRL-1687,Manassas,Va.)的增殖的作用。對于各個細胞系,細胞以6000個細胞/孔的密度接種到100μl的含1%胎牛血清的RPMI-1640培養基中的96孔組織培養板之中。4小時之后,加入0.0015nM至100nΜ之間范圍內的各個濃度的測試抗體。細胞在測試抗體存在下培養72小時。向各個孔中加入20μl的MTS試劑(Promega,Madison,Wl),且細胞在37℃下孵育2小時。MTS很容易地被活的增殖細胞攝入,還原成甲臜(其很容易地吸收490nM波長的光),然后分泌到培養基中。在孵育之后,使用BioTek(Winooski,VT)ELx800吸光度讀取儀測量OD490值。為建立基準代謝活動,也以這種方式加入抗體到細胞中,以此時的對照細胞OD490nM吸光值作為對照細胞吸光值。。增殖可通過從72小時OD490中減去對照基準OD490來計算。抗體滴定的數據根據以下公式以對照組的%來表示:對照組的%=(測試增殖/對照增殖)*100。各種雙特異性抗Her3/抗EGFR抗體對于A431細胞增殖的作用在圖16和圖17中示出。SI-1X2展示出比對照抗體SI-1C1(抗Her3)、SI-1C3(抗EGFR)或SI-1C1和SI-1C3聯用更有效的抗增殖作用。SI-1X1也表現出抗增殖作用,盡管未到可于SI-1C3和SI-1C1與SI-1C3的組合所見的程度。抑制曲線以及IC50值在圖17中示出。對于SI-1X5和SI-1X6觀察到相似結果,其中SI-1X6比SI-1X5和對照抗體S1-1C1(抗Her3)更有效,然而它卻示出出與對照抗體S1-1C6(抗EGFR)和SI-1C1與SI-1C6的組合相似的抗增殖潛能。這可連同IC50值一起見于圖17中。還測試這些分子在BxPC3細胞系中的抗增殖作用(圖18和圖19)。SI-1X2再次顯示出比對照抗體SI-1C1(抗Her3)、SI-1C3(抗EGFR)或SI-1C1和SI-1C3聯用更有效的抗增殖作用。SI-1X1比SI-1C1更有效,但比SI-1C3和SI-1C1與SI-1C3的組合弱。抑制曲線和IC50值示出在圖19中。與對照抗體SI-1C1(抗Her3)、SI-1C6(抗-EGFR)或SI-1C1和SI-ICS組合相比,BxPC3增殖被SI-1X5和SI-1X6兩者更強地抑制。該數據連同IC50值一起見于圖19中。實例9:SI-1C5.2和SI-1X4.2對腫瘤細胞系的抗增殖作用為了評價抗Her3/EGFR雙特異性抗體的生長抑制潛能,測試對于FaDu(鼻咽部鱗狀細胞癌系,ATCCHTB-43)和A431(表皮樣癌ATCCCRL-1555)細胞的增殖的作用。細胞以6000個細胞/孔的密度接種到100μl的含1%胎牛血清的RPMI-1640培養基中的96孔組織培養板之中。4小時之后,加入0.0015nM至100nΜ之間范圍內的各個濃度的測試抗體。細胞在測試抗體存在下培養72小時。在各個孔中加入11μl的阿爾瑪藍試劑(ThermoScientific),細胞在37℃下培養2小時。阿爾瑪藍很容易地被活的增殖細胞攝入,還原,然后分泌到培養基中。阿爾瑪藍的還原形式具有很強的熒光性。在培養之后,熒光使用分子儀器公司(Sunnyvale,CA)FilterMaxF5多模式板讀取儀進行測量,該讀取儀使用535nm的激發波長和595nm的發射波長。為建立基準代謝活動,也以這種方式加入抗體到細胞后,以此時的熒光值作為對照細胞熒光值。增殖可通過從72小時熒光值中減去對照基準熒光來計算。抗體滴定的數據根據以下公式以對照組的%來表示:對照組的%=(測試增殖/對照增殖)*100。SI-1C5.2和SI-1X4.2對于Fadu和A431細胞增殖的作用分別在圖20和圖21中示出。在這兩個細胞系中,SI-1X4.2展示出比對照抗體SI-1C5.2(抗EGFRMab)、SI-1C1(抗Her3Mab))或SI-1C1和SI-1C7聯用改善的有效的抗增殖作用。實例10:SI-1X雙特異性抗體的ADCC活性測試SI-1X抗體介導針對多個腫瘤細胞系的細胞毒性的能力。獲取正常、健康志愿者的全血。血液用等體積的磷酸緩沖鹽水(PBS)稀釋。將20ml等份的稀釋血液小心地分裝于15ml的FicolPacquePLUS(GELifeSciences目錄號17-1440-02;Pittsburgh,PA)上。試管在300g下不間斷離心40分鐘。在離心之后,小心地吸出大部分的血漿層,并用移液管以盡可能最小地體積小心地移除血沉棕黃色層(含有PBMC)。PBMC合并入50ml的試管內并加入PBS以使每個試管定容至50ml。試管在1300RPM下離心10分鐘,并小心地吸出上清。細胞重懸于40ml的PBS中并再次離心。該過程共重復兩次洗滌。在最后一次洗滌后,細胞重懸于30ml的RPMI-1630+10%FBS中并在37℃下在5%CO2中過夜培養。測試的靶細胞是頭頸部鱗狀細胞癌細胞系FaDu(ATCCHTB-43,Manassus,VA)和非小細胞肺腺癌細胞系NCI-H1975(ATCCCRL-5908,Manassus,VA)。如下所述,利用鈣黃綠素標記靶細胞。細胞以單層生長然后經細胞消化液孵育后去貼壁。在不含血清的RPMI中洗滌細胞兩次。將1ml4xl06個細胞/ml的細胞與1mlRPMI(不含血清)+20μΜ鈣黃綠素AM(Sigma目錄號C1359;St.Louis,MO)混合。將細胞在37℃下培養30分鐘,每隔10分鐘進行溫和混合。標記后,利用14mlRPMI+10%FBS+2.5mM丙磺舒(試驗培養基)洗滌細胞兩次。丙磺舒(Sigma目錄號P8761;St.Louis,MO)是一種陰離子轉運蛋白抑制劑并被認為減少細胞內鈣黃綠素的自發釋放。將細胞重懸在20ml試驗培養基中并允許在37℃,5%CO2下恢復2小時。然后,利用試驗培養基洗滌細胞一次并稀釋至200,000個細胞/ml。將50μl(10,000個細胞)鈣黃綠素標記的細胞的等份試樣等分量加到96孔圓底平板中。將50μl抗體(以3X最終濃度)加到細胞中并在冰上允許結合40分鐘。使來自前一天的PBMC在300g下離心5分鐘,重懸在20ml新鮮試驗培養基中,計數并稀釋至6x106個細胞/ml。將50μlPBMC(300,000)加入每個孔中并在37℃,5%CO2下,將平板培養4小時。將每個抗體通過10倍連續稀釋一式三份滴定,從50nM開始并遞減到0.00005nM。也建立在抗體和效應細胞不存在下含有標記靶細胞的對照孔以測定最大和自發鈣黃綠素釋放。在4小時的培養結束時,將50μl含有8%IGEPALCA-630(Sigma目錄號18896;St.Louis,MO)的試驗培養基加入只含有標記靶細胞的對照孔中(以測定最大鈣黃綠素釋放)。將50μl試驗培養基加入所有其他孔中以使每個孔的總體積到200μl。使平板在2000RPM下離心10分鐘并將150μl上清液小心地轉移到V型底96孔平板中。使這些平板在2000RPM下再離心10分鐘并將100ml上清液小心地轉移到黑色、透明底的96孔平板中。通過利用485nM的激發波長和535nM的發射波長測定每個樣品的熒光來定量上清液中的鈣黃綠素。將特異性裂解的百分比如下計算:%特異性裂解=[(測試樣品值-自發釋放)/(最大釋放-自發釋放)]*100數據示出在圖22和圖23中。對于兩種細胞系,SI-1X6.4介導細胞毒性,但并不特別地比對照抗體SI-1C6.2、SI-1C7、或SI-1C6.2+SI-1C7的組合更有效。Sl-1X6.4以比我們的基準抗體SI-1C4更低的EC50介導細胞毒性。對于兩種細胞系,SI-1X4.2以與對照抗體大致相同的程度介導細胞毒性。但是,其在介導細胞毒性方面,不像基準SI-1C4那么有效。這可能是因為SI-1X4.2的較低親和性。實例11:SI-1X雙特異性抗體的熱穩定性進行蛋白熱轉移研究用于蛋白熱穩定性分析。建立利用蛋白熱轉移緩沖液TM和蛋白熱轉移染料TM(AppliedBiosystems)的蛋白熔解反應。簡單地講,20μl反應混合物含有5μg蛋白、5μl蛋白熱轉移緩沖液TM和2.5μl8X稀釋的蛋白熱轉移TM染料。對于陰性對照,使用PBS來代替。將反應混合物加入MicroAmp光學反應平板中并利用MicroAmp光學粘合劑薄膜密封。每個樣品由4個重復樣組成。在AppliedBiosystem實時PCR系統上從25到90℃以1%增量運行蛋白熔解反應,然后利用蛋白熱轉移軟件TM分析。圖24示出了SI-1X2、SI-1X4.2、SI-1X6.4、SI-1C3、SI-1C3、SI-1C6.2、SI-1C5.2和SI-1C7的熔解曲線。表5示出了這些分子的Tm。Tm被定義為去折疊50%蛋白所需的溫度。雙特異性分子1X2、1X4.2和1X6都具有約66℃的Tm,這與所有MAb(1C3、1C6.2、1C5.2)和Fc-scFv(1C7)分子相當。表5蛋白名稱Tm(℃)SI-1X266.52SI-1C370.06SI-1X4.266.94SI-1C5.270.26SI-1X6.466.50SI-1C6.270.12SI-1C766.40實例12:SI-1X雙特異性抗體的血漿穩定性在37℃下在95%人類血漿(AtlantaBiologies,S40110)中以100μg/mL培養0、3和7天時間點以及第7天的55℃的額外時間點以提供發生降解的已知條件后,通過ELISA比較分子SI-1C5.2、SI-1C6.2、SI-1X4.2和Sl-1X6.4與單體EGFRECD的結合來測定這些分子的血漿穩定性。利用3μg/mL單體EGFRECD(SI-2R4)的PBS在4℃下包被ELISA平板過夜。在25℃下利用3%BSAPBST封閉包被的ELISA平板2小時,然后利用PBST洗滌3次。利用1%BSAPBST以1:10稀釋SI-1C6.2和SI-1X6.4并在整個平板上以4x稀釋。利用1%BSAPBST以1:2稀釋SI-1C5.2和SI-1X4.2并在整個平板上以4倍稀釋,以及在25℃下培養1小時。利用PBST再洗滌3次,然后利用1μg/mLHer3ECD兔IgGl(SI-1R1)在25℃下在1%BSAPBST中抗原俘獲1小時。利用PBST再洗滌3次,然后在25℃下施加以1:5000稀釋于1%BSAPBST中的山羊抗兔IgG-HRP(Bio-Rad172-1019)二抗,保持1小時。利用PBST洗滌最后3次,然后利用100μlPierce1-stepUltraTMBELISA(Pierce,34028)顯色10分鐘,利用100μl2MH2SO4最終終止反應。在450nm下讀取平板。將ELISA數據作圖并利用GraphPadPrism6產生曲線。ELISA的結果由圖25中的EC50記錄且當保持在37℃時表現出少許降解的有利特征。當置于55℃時,因為分子經歷降解條件,所以EC50移動約一個對數。在37℃下,SI-1C5.2的EC50值從第0天的589.7pM變成第7天的755.2pM(Δ165.5pM)且在55℃下變為第7天的6.522nM(Δ5932.3pM)。在37℃下,SI-1C6的EC50值從第0天的218.2pM變為第7天的226.6pM(Δ8.4pM)且在55℃下變為第7天的1.322nM(Δ1103pM)。在37℃下,SI-1X4.2的EC50值從第0天的429.3pM變為第7天的466.7pM(Δ37.4pM)且在55℃下變為第7天的4.248nM(Δ3818.7pM)。在37℃下,SI-1X6的EC50值從第0天的209.3pM變為第7天的237.3pM(Δ28pM)在55℃下偏移到第7天的4.112nM(Δ3902.7pM)。實例13:SI-1X分子的PK半衰期為了測試其體內半衰期,在SD大鼠中進行藥物動力學試驗。將雙特異性Abs的單次靜脈內尾靜脈注射(1C6lOmg/kg、1X6lOmg/kg、1X2lOmg/kg、1X432mg/kg)給予按體重隨機化(190-212g范圍)的4只雌性大鼠組。在每個時間點從眼眶血管叢抽取血液(~150μl),制備成血漿,并儲存在-80℃下直到分析。研究持續時間是28天。利用三個ELISA試驗測定抗體濃度。在試驗1中(EGFRECD包被的ELISA),將重組EGFR-兔Fc包被到平板上,利用PBST(具有0.05%吐溫的磷酸鹽緩沖鹽水)洗滌孔并利用1%BSA的PBST封閉。然后添加血清或血清稀釋的標準物,隨后PBST洗滌,添加HRP標記的兔抗人IgG(BOSTER),并再次PBST洗滌。然后添加TMB并在暗處將平板孵育2.5分鐘。通過添加2M硫酸終止顏色反應。在450nm波長下讀取平板。對于試驗2(Her3包被的ELISA),利用類似ELISA檢測血清,但是將重組HER3-His用作俘獲試劑。對于試驗3(夾心ELISA),包被重組HER3-His,添加血清或血清稀釋的標準物,然后PBST洗滌,添加含EGFR-兔Fc的PBST,再次PBST洗滌。然后添加HRP標記的山羊抗兔IgG(BOSTER)。利用非房室模型測定PK參數。圖26-28示出了分別利用三個不同試驗得到的四個抗體的血清濃度數據。表6中提供體內PK研究的擬合PK參數。PK數據包括半衰期,其表示表征抗體從血清去除的β相以及Cmax,Cmax表示觀察到的最大血清濃度,AUC,其表示濃度時間曲線下的面積。表6實例14:小鼠異種移植研究實例測試Fadu的臨床前模型(頭頸鱗狀細胞癌異種移植模型)中伴隨阻斷EGFR、HER3的SI-1X2、SI-1X4.2和SI-1X6的活性并對它們、西妥昔單抗、西妥昔單抗和抗-HER3抗體的組合的效力進行比較。所有小鼠研究通過研究所動物照管(InstitutionalAnimalcare)進行并根據指導方針使用委員會批準的動物方案。六周大的雌性Balb/c裸鼠從北京VitalRiverLaboratories購買并關在空氣過濾的層流柜中,進行12小時的白天循環并隨意獲取食物和水。計算動物組的尺寸以測量25%的安慰劑組與治療組之間的平均差異,具有80%的功效和0.01的P值。攜帶異種移植物的宿主小鼠被隨機地并同等地分配到對照或治療組。以受控及非盲性方式進行動物試驗。對于細胞系來源的異種移植物研究,對小鼠進行皮下注射含2x106Fadu的150μl的細胞懸液(每只小鼠)。一旦腫瘤達到100-250mm3的平均體積,將小鼠隨機化為9組,每組具有6只小鼠。媒劑對照,1C6(25mg/kg)、1C4(25mg/kg)、1C6+1C1(25mg/kg+50mg/kg)、SI-1X2(25mg/kg)、SI-1X6(10mg/kg)、SI-1X6(25mg/kg)和SI-1X4.2(10mg/kg)SI-1X4(25mg/kg)。通過靜脈內注射每周一次施用所有試驗制品。在整個治療期每隔3天通過數字式卡尺測定腫瘤并利用下式測定體積:l/2x長度x寬度2。在第一次給藥前記錄小鼠的體重以及隨后在治療期和恢復期每隔一周記錄。與陽性對照(除了低劑量SI-1X4.210mg/kg組)相比,SI-1X2、SI-1X6以及SI-1X4.2和SI-1X6組合的所有測試組明顯地產生腫瘤生長抑制(圖29-30)。并且,在治療停止后2周,沒有觀察到復發,除了低劑量SI-1X4.210mg/kg組外。藥物組合物術語“有效量”是指有效實現所需效果(例如改善受試者的疾病)的藥物的量。當疾病是癌癥時,有效量的藥物可抑制(例如,在一定程度上減緩、抑制或停止)以下實例特征的一個或多個,包括但不限于,癌細胞生長、癌細胞增殖、癌細胞運動、癌細胞滲入外周器官、腫瘤轉移和腫瘤生長。其中疾病是癌癥時,有效量的藥物當施用于受試者時或者可進行以下中的一種或多種:減緩或停止腫瘤生長、減小腫瘤尺寸(例如,體積或質量)、在一定程度上緩解與癌癥相關的一個或多個癥狀、延長無進展生存期、得到目標響應(包括,例如,部分響應或完全響應)、以及增加總存活時間。在一定程度上,藥物可阻止生長和/或殺死現有癌細胞,其具有細胞抑制性和/或細胞毒性。關于施用給受試者(例如需要治療的人類患者)的適宜組合物的調配,可將文中所公開的抗體與該領域已知的藥學上可接受的載劑混合或組合,這取決于所選擇的施用途徑。對文中公開的抗體的施用模式沒有特定的限制,適宜的施用途徑和適宜組合物的選擇在該領域是已知的,而無需過多試驗。雖然許多施用形式是可能的,但是一個實例施用形式會是注射用溶液,特別是用于靜脈內或動脈內注射。通常,用于注射的適宜藥物組合物包括藥學上的適宜載劑或賦形劑,例如但不限于緩沖液、表面活性劑或穩定劑。實例緩沖液可包括但不限于乙酸鹽、磷酸鹽或檸檬酸鹽緩沖液。實例表面活性劑可包括,但不限于聚山梨醇酯。實例穩定劑可包括但不限于人白蛋白。同樣,技術人員具有確定有效治療癥狀(例如癌癥)的文中所公開抗體的有效量或濃度的能力。其他參數(例如藥物組合物中多種組分的比例、施用劑量和頻率)可由技術人員得到,而無需過多試驗。例如,用于注射的適宜溶液可含有但不限于約1至約20、約1至約10mg抗體/ml。實例劑量可以是但不限于約0.1至約20、約1至約5mg/Kg體重。實例施用頻率可以是但不限于每天一次或每周三次。雖然本公開內容已參照特定實施例或實例加以描述,但是應了解,實施例是說明性的以及所公開內容范圍不如此受限。本公開的其他實施例對本公開所屬的該領域的技術人員是顯而易見的。這些其他實施例被視為涵蓋在本公開的范圍內。因此,本公開的范圍由所附的權利要求限定并由上述說明支持。當前第1頁1 2 3
相關技術
網友詢問留言
已有0條留言
- 還沒有人留言評論。精彩留言會獲得點贊!
1
- 用于治療HBV感染和相關病癥的三特異性結合分子的制造方法與工藝
- 對磺胺類藥物具有特異性的固相微萃取纖維的制備方法與流程
- 一種檢測豬初乳中抗PEDV特異性IgA抗體的夾心ELISA試劑盒的制造方法與工藝
- 用于施用CD19xCD3雙特異性抗體的給藥方案的制造方法與工藝
- 雙特異性抗?VEGF/抗?ANG?2抗體及其在治療眼血管疾病中的應用的制造方法與工藝
- 特異性人EWS?FLI1融合蛋白抗體的制備方法及在制備尤文肉瘤診斷抗體試劑的應用與制造工藝
- 雙特異性四價抗體及其制造和使用方法與制造工藝
- 利用特異性揮發物篩選昆蟲相關嗅覺蛋白的方法與制造工藝
- 使用與表面偶聯的單特異性四聚抗體復合物組合物從樣品中分離出靶實體的方法與制造工藝
- 抗-WT1/HLA雙特異性抗體的制造方法與工藝
- 與CD56分子特異性結合的多肽及其應用的制造方法與工藝
- 用于治療HBV感染和相關病癥的三特異性結合分子的制造方法與工藝
- 對磺胺類藥物具有特異性的固相微萃取纖維的制備方法與流程
- 避免信號干擾的肌原纖維蛋白絲氨酸磷酸化水平的測定方法與流程
- 一種檢測豬初乳中抗PEDV特異性IgA抗體的夾心ELISA試劑盒的制造方法與工藝
- 用于施用CD19xCD3雙特異性抗體的給藥方案的制造方法與工藝
- 雙特異性抗?VEGF/抗?ANG?2抗體及其在治療眼血管疾病中的應用的制造方法與工藝
- 特異性人EWS?FLI1融合蛋白抗體的制備方法及在制備尤文肉瘤診斷抗體試劑的應用與制造工藝
- 活化人CD40的抗體和針對人PD?L1的抗體的組合療法的制造方法與工藝
- 雙特異性四價抗體及其制造和使用方法與制造工藝