一種紫杉醇藥物組合物及其藥物制劑、制備方法和用途與流程
本發明涉及一種紫杉醇藥物組合物及其藥物制劑、制備方法和用途,具體涉及一種包含活性成分紫杉醇的藥物組合物以及包含所述藥物組合物的藥物制劑、制備方法和用途。
背景技術:
紫杉醇(paclitaxel,ptx)是從紅豆杉屬植物中提取的天然生物堿,其化學名稱為5β,20-環氧-1,2α,4,7β,10β,13α-六羥基紫杉烷-11-烯-9-酮-4,10-二乙酸酯-2-苯甲酸酯-13[(2’r,3’s)-n-苯甲酰-3-苯基異絲氨酸酯],結構式如下:
紫杉醇是一種新型的抗微管藥物,通過促進微管蛋白聚合抑制解聚,保持微管蛋白穩定,抑制細胞有絲分裂。體外實驗證明紫杉醇具有顯著的放射增敏作用,可使細胞中止于對放療敏感的g2和m期。由于紫杉醇具有穩定細胞微管的獨特作用機理,而且治療效果好、廣譜性強、副作用小,因而被國際上公認為是首選的抗癌藥物。目前,紫杉醇被廣泛用于多種惡性腫瘤,例如卵巢癌、子宮頸癌、乳腺癌、肺癌、喉癌和食道癌等的治療。
當前臨床上最常用的紫杉醇注射液主要有例如bristol-myerssquibb公司的
因此僅有少量紫杉醇制劑被批準用于臨床,例如
然而,研制適用于口服固體制劑的紫杉醇藥物組合物迄今仍受制于紫杉醇的低水溶性而進展緩慢。由于紫杉醇的pka為11.99,其在水中的溶解度低于約10μg/ml(據報道為0.1~<10μg/ml),而且紫杉醇結構中缺少功能性成鹽基團,使得其無法通過制備成鹽來改善溶解度。此外,由于胃腸道粘膜細胞中運轉外排蛋白p-glycoprotein(p-gp)的外排作用,使得吸收入血中的紫杉醇的量減少,導致紫杉醇的口服生物利用度進一步降低(約為2%)。
因此,目前亟需開發一種新型的紫杉醇藥物組合物及其口服固體制劑。
技術實現要素:
本發明一方面提供一種紫杉醇藥物組合物,其包含活性成分紫杉醇和載體材料羥丙基甲基纖維素衍生物。
另一方面,本發明還提供一種藥物制劑,其包含本發明的紫杉醇藥物組合物以及藥學上可接受的輔料。所述藥物制劑為口服固體制劑形式,例如散劑、顆粒劑、丸劑、膠囊劑或片劑的形式。
第三方面,本發明還提供所述紫杉醇藥物組合物及其藥物制劑的制備 方法,例如包括但不限于熱熔擠出法和噴霧干燥法。
最后,本發明還提供所述紫杉醇藥物組合物及其藥物制劑在制備用于預防和治療惡性腫瘤和相關疾病的藥物中的用途。
附圖說明
圖1為各產品的x-rd圖譜,其中1為原料藥紫杉醇,2為紫杉醇-pvpk30-tpgs的物理混合物,3為對比組合物1-1。
圖2為各產品的x-rd圖譜,其中1為原料藥紫杉醇,2為紫杉醇-hpmcas-tpgs的物理混合物,3為本發明的藥物組合物2-4。
具體實施方式
以下將對本發明進一步詳細說明,應理解,所述用語旨在描述目的,而非限制本發明。
定義
除非另有說明,本文使用的所有技術和科學術語具有與本發明所屬領域技術人員通常所理解的相同的含義。若存在矛盾,則以本申請提供的定義為準。當以范圍、優選范圍、或者優選的數值上限以及優選的數值下限的形式表述某個量、濃度或其他值或參數的時候,應當理解相當于具體揭示了通過將任意一對范圍上限或優選數值與任意范圍下限或優選數值結合起來的任何范圍,而不考慮該范圍是否具體揭示。除非另有說明,本文所列出的數值范圍旨在包括范圍的端點和該范圍內的所有整數和分數(小數)。
術語“約”、“大約”當與數值變量并用時,通常指該變量的數值和該變量的所有數值在實驗誤差內(例如對于平均值95%的置信區間內)或在指定數值的±10%內,或更寬范圍內。
術語“計量比”是將各種物質按一定的重量進行配比。例如在本發明中,將活性成分紫杉醇與載體材料羥丙基甲基纖維素衍生物、任選存在的聚乙二醇1000維生素e琥珀酸酯(tpgs)按照指定的重量比進行配比。
術語“藥學上可接受的”是指在正常的醫學判斷范圍內與患者的組織接觸而不會有不適當毒性、刺激性、過敏反應等,具有合理的利弊比且能有效用于目的用途。
術語“無定形狀態分散”是指藥物基本上以無定形形式分散于載體材料中,形成單一成相的物質。例如藥物可完全以無定形狀態存在,即在粉末x-衍射檢測中不存在明顯的晶體衍射特征峰。在本發明中,該術語是指活性成分紫杉醇以無定形形式完全分散于載體材料羥丙基甲基纖維素衍生物中,形成單一成相的藥物組合物(固體分散體或固體溶液)。
術語“溶解在”、“無定形狀態分散”、“固體分散體”、“固體溶液”在本發明中涵蓋了任何和所有這些形態,這些術語在本文中視方便使用以描述在制備的各階段和各種溫度下的本發明的藥物組合物。
術語“藥物制劑”、“藥劑產品”、“藥物劑型”、“劑型”等指被施予需要治療的患者的藥品,其可以為固體或液體等形式,例如散劑、顆粒劑、丸劑、膠囊劑、片劑、溶液劑或混懸劑、貼劑等。
術語“藥物組合物”是指包含活性成分紫杉醇、載體材料羥丙基甲基纖維素衍生物以及任選存在的tpgs的固體分散體形式的載藥組合物。
術語“空白組合物”是指相對于相應的藥物組合物,不含活性成分(即紫杉醇),但包含其它組分的固體分散體形式的組合物。
術語“物理混合物”是指將活性成分紫杉醇和載體材料羥丙基甲基纖維素衍生物以及任選存在的tpgs僅通過物理混合而制成的混合物。
藥物組合物及其藥物制劑和制備
本發明涉及一種紫杉醇藥物組合物,其包含活性成分紫杉醇和載體材料羥丙基甲基纖維素衍生物。
在本發明的一個實施方案中,載體材料羥丙基甲基纖維素衍生物選自醋酸羥丙基甲基纖維素琥珀酸酯(hpmcas)、羥丙基甲基纖維素鄰苯二甲酸酯(hpmcp)、羥丙基甲基纖維素丁二酸酯(hpmcs)、羥丙基甲基纖維素偏苯三甲酸酯(hpmct)、羥丙基甲基纖維素醋酸鄰苯二甲酸酯(hpmcap)以及醋酸羥丙基甲基纖維素馬來酸酯(hpmcam)中的一種或多種。
在本發明的一個優選的實施方案中,載體材料羥丙基甲基纖維素衍生物選自hpmcas、hpmct和hpmcam中的一種或多種。在本發明的一個更優選的實施方案中,載體材料羥丙基甲基纖維素衍生物選自hpmcas。
在本發明的一個優選的實施方案中,載體材料羥丙基甲基纖維素衍生 物選自具有以下乙酰基含量和琥珀酰基含量的hpmcas中的至少一種:
(i)基于hpmcas的總重量,具有5-9重量%的平均乙酰基含量和14-18重量%的平均琥珀酰基含量的hpmcas;
(ii)基于hpmcas的總重量,具有7-11重量%的平均乙酰基含量和10-14重量%的平均琥珀酰基含量的hpmcas;
(iii)基于hpmcas的總重量,具有10-14重量%的平均乙酰基含量和4-8重量%的平均琥珀酰基含量的hpmcas。
在本發明的一個特別優選的實施方案中,載體材料羥丙基甲基纖維素衍生物選自具有7-11重量%的平均乙酰基含量和10-14重量%的平均琥珀酰基含量的hpmcas,基于hpmcas的總重量。
更具體地,在本發明的一個非常特別優選的實施方案中,載體材料羥丙基甲基纖維素衍生物可選自例如shin-etsu公司的市售產品
在本發明的一個非常特別優選的實施方案中,載體材料羥丙基甲基纖維素衍生物選自
在本發明的一個實施方案中,活性成分紫杉醇與載體材料羥丙基甲基纖維素衍生物的重量比為約1:1-約1:10,優選為約1:1-約1:5,更優選為約1:1-1:3,例如包括但不限于1:1、1:2、1:3、1:4、1:5、1:6、1:7、1:8、1:9、1:10等。
此外,在本發明的另一個實施方案中,紫杉醇藥物組合物還可進一步包含聚乙二醇1000維生素e琥珀酸酯(d-α-tocopherolpolyethyleneglycol1000succinate,又稱作tpgs、vitaminetpgs或tocophersolan)。tpgs是維生素e的水溶性衍生物,其由維生素e琥珀酸酯(ves)與聚乙二醇(peg)1000酯化而成,相對分子量為約1513,已載入美國藥典。tpgs在本發明的藥物組合物中作為增溶劑起到增溶作用,并且可以進一步通過影響藥物的外排來提高口服生物利用度。
在本發明的另一個實施方案中,tpgs例如可以是購自basf公司的市售產品
在本發明的另一個實施方案中,tpgs是
在本發明的紫杉醇藥物組合物中,所使用的tpgs的量沒有特殊限制,可以根據實際情況進行調整。通常,tpgs以基于活性成分紫杉醇和載體材料羥丙基甲基纖維素衍生物的總重量的約1-20重量%的量存在,優選5-15重量%,更優選5-10重量%,甚至更優選10-15重量%,例如包括但不限于5重量%、8重量%、10重量%、12重量%、15重量%、20重量%等。
此外,本發明還涉及一種藥物制劑,其包含本發明的紫杉醇藥物組合物。
在本發明的又一個實施方案中,除了以上所述的藥物組合物之外,本發明的紫杉醇藥物制劑還可額外包含藥學上可接受的輔料。
在本發明的又一個實施方案中,藥學上可接受的輔料包括但不限于表面活性劑、ph調節劑、稀釋劑、崩解劑、粘合劑、潤滑劑中的一種或多種。
在本發明的又一個實施方案中,表面活性劑可以是陰離子型、陽離子型、兩性離子或非離子型的表面活性劑或它們的混合物。在本發明的又一個優選的實施方案中,表面活性劑為兩性離子或非離子型的表面活性劑或它們的混合物。在本發明的又一個更優選的實施方案中,表面活性劑是兩種或更多種表面活性劑的混合物。
表面活性劑的選擇可根據本發明的藥物制劑的具體組份及組成而變化。
在本發明的又一個優選的實施方案中,適合用于本發明的表面活性劑可選自以下物質中的一種或多種:
--聚氧乙烯蓖麻油衍生物,例如聚氧乙烯甘油三蓖麻醇酸酯、聚氧乙烯醚35蓖麻油(cremophorel,basf)。
--聚氧乙烯甘油基硬脂酸酯。
--聚乙二醇蓖麻油衍生物,例如聚乙二醇40氫化蓖麻油(cremophorrh40)或聚乙二醇60氫化蓖麻油(cremophorrh60)。
--環氧乙烷和環氧丙烷的嵌段共聚物,又稱作聚氧乙烯聚氧丙烯嵌段共聚物或聚氧乙烯聚丙二醇,例如poloxamer124、poloxamer188、poloxamer237、poloxamer388或poloxamer407(basf)。
--聚氧乙烯(20)失水山梨醇的單脂肪酸酯,例如聚氧乙烯(20)失水山梨 醇單油酸酯(tween80)、聚氧乙烯(20)失水山梨醇單硬脂酸酯(tween60)、聚氧乙烯(20)失水山梨醇單棕櫚酸酯(tween40)、聚氧乙烯(20)失水山梨醇單月桂酸酯(tween20)。
--聚乙二醇脂肪酸酯,例如peg-200單月桂酸酯、peg-200雙月桂酸酯、peg-300雙月桂酸酯、peg-400雙月桂酸酯、peg-300雙硬脂酸酯或pet-300二油酸酯。
--亞烷基二醇脂肪酸單酯,例如丙二醇單月桂酸酯。
--失水山梨醇脂肪酸單酯,例如失水山梨醇單月桂酸酯(span20)、失水山梨醇單油酸酯、失水山梨醇單棕櫚酸酯(span40)或失水山梨醇硬脂酸酯。
在本發明的又一個優選的實施方案中,適合用于本發明的表面活性劑為聚氧乙烯蓖麻油衍生物、環氧乙烷和環氧丙烷的嵌段共聚物中的一種或多種,特別優選cremophorrh40和/或poloxamer188。
在本發明的又一個實施方案中,適合用于本發明的ph調節劑可選自檸檬酸、乙酸、反丁烯二酸、順丁烯二酸、酒石酸、蘋果酸、琥珀酸、草酸、丙二酸、苯甲酸、苦杏仁酸和抗壞血酸中的一種或多種,優選檸檬酸。
在本發明的又一個實施方案中,適合用于本發明的稀釋劑可選自微晶纖維素、淀粉、預膠化淀粉、乳糖、甘露醇、磷酸氫鈣中的一種或多種。
在本發明的又一個實施方案中,適合用于本發明的崩解劑可選自羧甲基纖維素、羧甲基纖維素鈉、交聯羧甲基纖維素鈉、羧甲基纖維素鈣、羧甲基淀粉鈉、交聯聚乙烯基吡咯烷酮(即交聯聚維酮)、低取代羥丙纖維素(l-hpc)、羥甲基淀粉中的一種或多種。
在本發明的又一個實施方案中,適合用于本發明的粘合劑可選自羧甲基纖維素鈉、羥丙基纖維素、甲基纖維素、乙基纖維素或羥丙甲纖維素中的一種或多種。
在本發明的又一個實施方案中,適合用于本發明的潤滑劑可選自硬脂酸鎂、二氧化硅、滑石粉、硬脂酸、氫化植物油中的一種或多種。
應當說明的是,上述所列舉的藥學上可接受的輔料只是闡述性和代表性的。因此,本發明的藥物制劑并不限于本文以上所列舉的藥學上可接受的輔料。本領域技術人員可根據常規技術對上述輔料進行各種改變、調整 或等同替換,均未超出本發明的保護范圍。
在本發明的一個實施方案中,所述藥物制劑是口服固體制劑。例如散劑、顆粒劑、丸劑、膠囊劑或片劑的形式。
本發明還涉及一種制備所述紫杉醇藥物組合物的方法,其包括但不限于熱熔擠出法和噴霧干燥法。
在本發明的一個實施方案中,采用熱熔擠出法來制備紫杉醇藥物組合物,所述方法包括以下步驟:
將按照計量比的活性成分紫杉醇、載體材料羥丙基甲基纖維素衍生物以及任選存在的tpgs進料到預熱至約120℃-約180℃的熱熔擠出機中;
以及
將擠出后的混合物冷卻,粉碎并過篩,即得到本發明的紫杉醇藥物組合物。
在本發明的另一個實施方案中,采用熱熔擠出法來制備紫杉醇藥物組合物,但是對于進料順序沒有特別限制,只要能夠獲得本發明的目標產品即可。
在本發明的一個優選的實施方案中,采用熱熔擠出法來制備紫杉醇藥物組合物,其中在進料之前,將紫杉醇、載體材料羥丙基甲基纖維素衍生物以及任選存在的tpgs按照計量比混合;或者直接進料上述成分而無需事先混合。
在本發明的另一個實施方案中,對于冷卻方式沒有特別限制,其可包括風冷、水冷、機械冷卻等。
適用于本發明方法的擠出機的類型也沒有特別限制,其包括但不限于單螺桿或雙螺桿型熱熔擠出機。
在本發明的一個實施方案中,使用雙螺桿型擠出機來制備紫杉醇藥物組合物。在該情況下,對于螺桿轉動的類型沒有特別限制,其包括但不限于同向雙螺桿、異向雙螺桿和雙錐型螺桿轉動模式。
在本發明的一個優選的實施方案中,使用同向雙螺桿型擠出機來制備本發明的紫杉醇藥物組合物。
在本發明的一個優選的實施方案中,熱熔擠出機設定的熔融溫度為約120℃-約190℃,優選120℃-180℃,優選120℃-170℃,更優選120℃-160℃, 甚至更優選120-150℃,最優選140℃,例如包括但不限于120℃、130℃、140℃、150℃、160℃、170℃和180℃等。
在本發明的另一個優選的實施方案中,螺桿轉速為約50-約500rpm,優選100-500rpm,更優選150-500rpm,甚至更優選150-200rpm,最優選150rpm,例如包括但不限于50rpm、100rpm、150rpm、200rpm、250rpm、300rpm、350rpm、400rpm、450rpm、500rpm等。
在本發明的另一個優選的實施方案中,螺桿長度和直徑的比例(l/d)為約15-約40,優選約15-約35,更優選約15-約30,甚至更優選約15-約25,最優選約20-約30,最優選約25,例如包括但不限于15、18、20、25、30、35、40等。
如果熔融溫度過低,l/d過短,螺桿轉速過慢,則熱熔過程中熱能和機械能提供不足,進而導致紫杉醇、載體材料羥丙基甲基纖維素衍生物、任選存在的tpgs無法形成熔融態,從而使紫杉醇不能均勻分散于熔融的載體材料羥丙基甲基纖維素衍生物中。因為雖然紫杉醇與載體材料羥丙基甲基纖維素衍生物充分混合,但由于熔融溫度過低,不能得到以無定形狀態完全分散的、單一成相的固體分散體(固體溶液)。
然而,如果熔融溫度過高、l/d過長、螺桿轉速過快,則熱熔過程中熱能和機械能提供過量,即使得到的是以無定形狀態完全分散的、單一成相的固體分散體,也會造成紫杉醇、載體材料羥丙基甲基纖維素衍生物以及任選存在的tpgs的不必要的降解。
因此,選擇適合用于本發明方法的熱熔擠出機的熔融溫度、螺桿轉速、螺桿長度和直徑的比例是非常必要的。
試驗表明,在根據本發明方法制得的紫杉醇藥物組合物中,紫杉醇是以無定形狀態完全分散于或溶解在載體材料羥丙基甲基纖維素衍生物中的。
根據需要,可將本發明的紫杉醇藥物組合物與藥學上可接受的輔料混合,通過特定設備制成各種不同類型的口服固體制劑,例如使用單沖壓片機(上海天凡藥機制造廠dp-5型)進行壓片,制成片劑。或者還可以使用其它設備將其制成散劑、顆粒劑、丸劑或膠囊劑的形式,以方便臨床應用。
本發明還涉及紫杉醇藥物組合物及其藥物制劑在制備用于預防和治療 惡性腫瘤和相關疾病的藥物中的用途。
有益效果
與現有技術相比較,本發明的藥物組合物及其藥物制劑的制備工藝簡單、易操作,特別是熱融擠出工藝,容易研磨,具有較好的可壓性,重現性好,可大規模生產;并且試驗表明,采用該方法獲得的藥物組合物中,紫杉醇是以無定形狀態完全分散于載體材料羥丙基甲基纖維素衍生物中的。
本發明人還出人意料地發現,相對于原料藥紫杉醇以及相應的對比例1的組合物,本發明的包含活性成分紫杉醇和載體材料羥丙基甲基纖維素衍生物的藥物組合物的溶解度和體外溶出度明顯提高;當進一步加入tpgs時,所得到的藥物組合物的溶解度和體外溶出度更加增強。說明載體材料hpmcas和tpgs對藥物組合物具有協同增溶作用。
實施例
以下將通過具體實施例來進一步描述本發明的技術方案。應注意,所述實施例僅為示例性,而非對本發明保護范圍的限制。本發明還可有其他實施方案,或能夠以多種方式實踐或進行。
除非另有說明,本文中所有的百分比、份數、比值等均是按重量計。
紫杉醇藥物組合物的物理化學性質的評價測定方法
粉末x-衍射(x-rd):分別取適量的紫杉醇原料藥、物理混合物,和對比組合物或本發明的藥物組合物,在cu靶、45kv電壓、45ma電流的條件下,記錄它們的粉末x衍射圖譜(bruker制造的d8advance型x-射線衍射儀)。
表觀溶解度測定:稱取過量的藥物組合物放入容器中,分別加入約相當于容器體積2/3的ph6.8磷酸鹽緩沖液后,將其置于37℃的搖床中震蕩3h,將所得溶液用0.45μm濾膜過濾后,收集濾液,用適量的甲醇進一步稀釋,并經過渦旋混合后經hplc分析。
其中,hplc分析參數如下:
溶出度測定:
其中ph6.8表示模擬人體腸道(小腸)的環境。
溶出樣品分析:將溶出度測定試驗中獲得的溶液用0.45μm濾膜過濾后收集濾液,用適量的甲醇進一步稀釋,并經過渦旋混合后hplc進樣分析。溶出樣品的hplc分析方法與上述溶解度測定hplc分析方法相同。
對比例1紫杉醇-pvpk30藥物組合物(非本發明)
1、制備
1)組成:
紫杉醇-pvpk30藥物組合物/物理混合物的具體組成如表1-1所示。
2)制備:
紫杉醇-pvpk30藥物組合物:按照表1-1中的具體組成和用量,將紫杉醇和載體材料pvpk30(購自basf,商品名kollidon
紫杉醇-pvpk30物理混合物:按照表1-1中的具體組成和用量,將活性成分紫杉醇和載體材料pvpk30(購自basf,商品名kollidon
根據需要,將上述獲得藥物組合物/物理混合物與表1-2中的藥用輔料混合均勻并進行制劑,即獲得相應的藥物制劑。
表1-1紫杉醇-pvpk30藥物組合物/物理混合物的具體組成(重量份)
表1-2紫杉醇-pvpk30藥物組合物/物理混合物的輔料(重量份)
2、物理化學性質評價
1)粉末x-衍射(x-rd)測試:
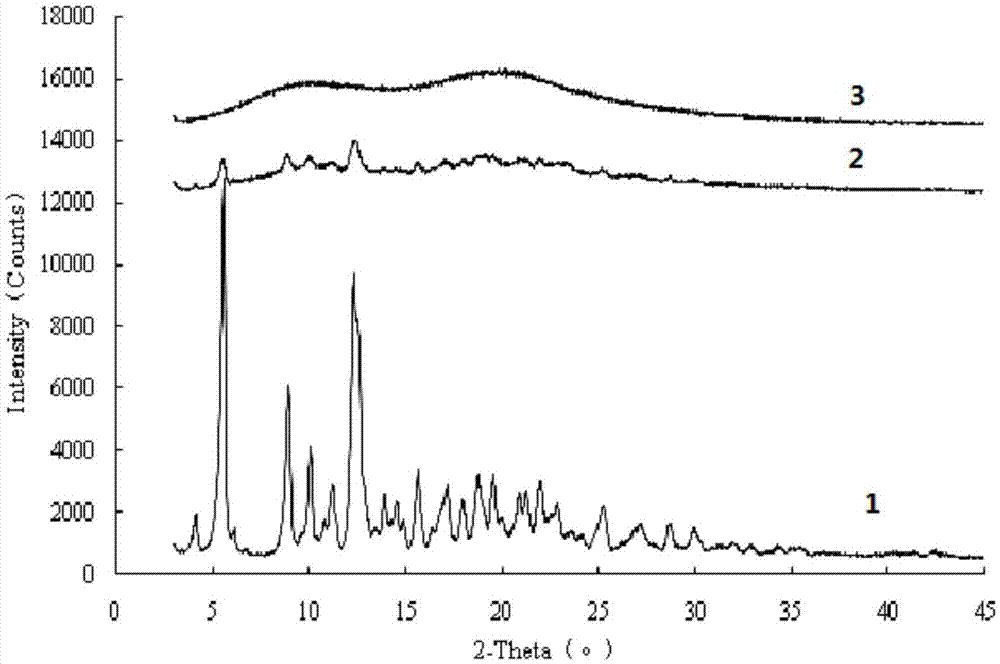
x射線粉末衍射(x-rd)用于進一步確認活性成分紫杉醇在原料藥/藥物組合物/物理混合物中的分散狀態/晶體結構。
從圖1可以看出,紫杉醇原料藥存在明顯的晶體衍射特征峰;包含紫杉醇、載體材料pvpk30和tpgs的物理混合物中也存在部分紫杉醇的晶體衍射特征峰,說明該物理混合物中有部分紫杉醇是以晶體狀態存在的;而在包含紫杉醇、載體材料pvpk30和tpgs的藥物組合物(即對比組合物1-1)中,紫杉醇的結晶特征峰消失,說明紫杉醇是以無定形狀態完全分散于該藥物 組合物中的。
試驗還表明,僅包含紫杉醇和載體材料pvpk30的物理混合物中仍然存在部分晶體衍射特征峰,說明該物理混合物中有部分紫杉醇是以晶體狀態存在;而包含紫杉醇和載體材料pvpk30的藥物組合物(即對比組合物1-2)的紫杉醇晶體特征峰消失,說明在該組合物中紫杉醇是以無定形狀態完全分散于藥物組合物中的。
2)表觀溶解度測定
根據上述方法,測定原料藥紫杉醇和對比組合物1-1、1-2的表觀溶解度。結果參看下表1-3。
表1-3在ph6.8磷酸鹽緩沖液中的表觀溶解度
由表1-3可以看出,與原料藥紫杉醇相比較,包含紫杉醇和載體材料pvpk30的藥物組合物(即對比組合物1-2)的溶解度有一定程度提高,當進一步加入
3)溶出度測定
根據上述方法,測定原料藥紫杉醇和對比組合物1-1、1-2的溶出度。結果參看下表1-4。
表1-4在ph6.8的介質轉換中的溶出度
由表1-4可以看出,原料藥在ph6.8條件下的溶出度非常低,60min時僅為14.8%,而包含紫杉醇和pvpk30的藥物組合物(即對比組合物1-2)在60min時的溶出度提高至33.6%。進一步加入
實施例1紫杉醇-hpmcas藥物組合物/物理混合物(本發明)
1、制備
1)組成:
紫杉醇-hpmcas藥物組合物/物理混合物的具體組成如表2-1所示。
2)制備:
紫杉醇-hpmcas藥物組合物:按照表2-1中的具體組成和用量,將紫杉醇和載體材料hpmcas(具體為
物理混合物:將活性成分紫杉醇和載體材料pvpk30以及任選存在的
根據需要,將上述獲得的藥物組合物與表2-2的藥用輔料混合均勻,即制得相應的藥物制劑。例如可以使用單沖壓片機(上海天凡藥機制造廠dp-5型)進行壓片,制成片劑。或者還可以使用其它設備將其制成散劑、顆粒劑、丸劑或膠囊劑的形式。
表2-1本發明的紫杉醇-hpmcas藥物組合物的組成(重量份)
表2-2本發明的紫杉醇-hpmcas藥物組合物的藥用輔料(重量份)
2、物理化學性質評價
1)粉末x-衍射(x-rd)測試:
x射線粉末衍射(xrd)用于進一步確認活性成分紫杉醇在原料藥/藥物組合物/物理混合物中的分散狀態/晶體結構。
從圖2可以看出,紫杉醇原料藥存在明顯的晶體衍射特征峰;包含紫杉醇和載體材料hpmcas的物理混合物中也仍然存在部分晶體衍射特征峰,說明該物理混合物中有部分紫杉醇是以晶體狀態存在;然而在本發明的藥物組合物(例如組合物2-4)中,紫杉醇的結晶特征峰消失,說明紫杉醇是以無定形狀態完全分散于藥物組合物中的。
試驗還表明,僅包含紫杉醇和載體材料hpmcas的物理混合物中也存在部分晶體衍射峰,說明該物理混合物中有部分紫杉醇是以晶體狀態存在;而包含紫杉醇和載體材料hpmcas的藥物組合物(例如組合物2-2、2-3)中,紫杉醇晶體特征峰消失,說明紫杉醇是以無定形狀態完全分散于該藥物組合物中的。
2)表觀溶解度測定
根據上述方法,測定各組合物的表觀溶解度。結果參看下表2-3。
表2-3在ph6.8磷酸鹽緩沖液中的表觀溶解度
由表2-3可以看出,與原料藥紫杉醇和對比例1相比較,包含紫杉醇和載體材料hpmcas的本發明的藥物組合物(例如組合物2-2)的溶解度明顯提高,說明載體材料hpmcas對紫杉醇具有增溶作用,可以明顯提高原料藥紫杉醇的溶解性和溶出度,當進一步加入
3)溶出度測定
根據上述方法,測定各組合物的溶出度。結果參看下表2-4。
表2-4在ph6.8的介質轉換中的溶出度
由表2-4可以看出,原料藥紫杉醇在ph6.8條件下的溶出度非常低,60min時僅為14.8%,本發明的藥物組合物2-1(紫杉醇:hpmcas=1:1,重量比)在60min時溶出度為38.7%左右,較好;并且隨著載體材料hpmcas的增加,本發明的組合物2-2(紫杉醇:hpmcas=1:3,重量比)和組合物2-3(紫杉醇:hpmcas=1:5,重量比)在60min的溶出度分別增加至55.8%和72.7%。然后進一步在組合物2-2的基礎(即紫杉醇:hpmcas=1:3,重量比)上分別加入相應量的
并且,從表2-4還可以看出,本發明的組合物從15min至120min,其溶出度都是在逐步提高,而原料藥紫杉醇則在該期間的溶出度并未有明顯變化。
以上試驗表明,與紫杉醇原料藥和對比例1相比較,本發明的藥物組合物能顯著提高紫杉醇的溶解性和溶出度。尤其是當進一步加入向本發明的藥物組合物加入
雖然本發明已闡述并描述了典型的實施方案,但本發明并不限于所述細節。由于各種可能的修改和替換沒有背離本發明的精神,本領域技術人員可使用常規試驗能夠想到的本發明的變型和等同物,因此所有這些變型和等同物都落入由以下權利要求書所定義的本發明的精神和范圍內。
- 還沒有人留言評論。精彩留言會獲得點贊!