使用固定于表面的多糖從血液中去除細(xì)胞因子的方法與流程
發(fā)明領(lǐng)域
本發(fā)明涉及從血液或血清(血液)中去除細(xì)胞因子和/或病原體的方法,所述方法通過使血液接觸固體的、基本無微孔的基質(zhì),所述基質(zhì)的表面已用多糖吸附劑,例如肝素、硫酸乙酰肝素和/或?qū)Υコ募?xì)胞因子或病原體(吸附物)具有結(jié)合親和力的其他分子或化學(xué)基團(tuán)(吸附介質(zhì)或介質(zhì))處理,其中用介質(zhì)表面積的量和在介質(zhì)上的結(jié)合位點(diǎn)的表面濃度平衡在所述介質(zhì)內(nèi)的間隙通道(interst itial channel)的大小,以提供足夠的吸附能力,同時也允許血液通過吸附介質(zhì)有相對高的流速。結(jié)果是,吸附質(zhì)至介質(zhì)上的結(jié)合位點(diǎn)的運(yùn)輸主要通過強(qiáng)制對流發(fā)生。(強(qiáng)制)對流的意思是,例如,通過泵產(chǎn)生的壓力梯度,通過對有彈性的容器應(yīng)用外部壓力(或?qū)傂匀萜鲬?yīng)用內(nèi)部壓力),通過重力高差(gravity head/elevation difference),或通過動脈壓和靜脈壓的差異在待治療患者中產(chǎn)生的流動。本發(fā)明提供了在一般在臨床體外血液循環(huán)(extracorporeal blood circuit),例如透析、體外循環(huán)(cardiopulmonary bypass)和血液的體外膜氧合中使用的安全流速范圍內(nèi)的臨床相關(guān)的吸附能力。所述方法與一般需要微孔吸附介質(zhì)的慢得多的吸附質(zhì)的擴(kuò)散運(yùn)輸形成直接對比,吸附質(zhì)的擴(kuò)散運(yùn)輸需要吸附質(zhì)在與介質(zhì)上、介質(zhì)后或介質(zhì)內(nèi)的吸附位點(diǎn)結(jié)合以前擴(kuò)散通過微孔膜,和/或進(jìn)入微孔中,因此其需要非常低的流速以在血液每次通過期間實(shí)現(xiàn)有效的分離。本發(fā)明也提供了通過從血液中去除細(xì)胞因子和/或病原體治療疾病的方法和實(shí)施所述方法和治療的設(shè)備,所述方法通過使血液接觸基本無孔的基質(zhì),所述基質(zhì)已用多糖吸附劑,例如肝素、硫酸乙酰肝素和/或其他吸附材料包被。
背景
很多疾病病癥以在血流中存在升高濃度的細(xì)胞因子和/或病原體為表征。一些這樣的病癥通過旨在殺死病原體的療法治療,例如通過施用藥物,例如抗感染藥物。一些其他病癥通過試圖降低患者中的血源性(blood-borne)細(xì)胞因子或病原體的濃度的療法治療。其他疾病通過試圖直接從患者血液中僅去除特定成分的療法治療。
例如,目前認(rèn)為Guillian-Barre綜合征是由病毒感染引起的刺激體內(nèi)免疫系統(tǒng)過度產(chǎn)生抗體或可攻擊患者神經(jīng)系統(tǒng)的其他蛋白質(zhì)的自身免疫疾病,其導(dǎo)致漸增水平的麻痹。大多數(shù)患者隨時間而恢復(fù),但是這些患者似乎在以后的病毒感染后容易復(fù)發(fā)病癥。治療Guillian-Barre綜合征的一種方法包括“清潔”患者血液的血漿去除法(plasmapheresis),這是通過去除被視為攻擊患者神經(jīng)系統(tǒng)的抗體。
某些生物活性的碳水化合物和多糖可從血液和生物液(biological fluid)中去除有害物質(zhì)。
肝素是可從哺乳動物組織中分離的多糖。其在哺乳動物組織中具有非常特定的分布;僅存在于肥大細(xì)胞的嗜堿性顆粒中。自從美國科學(xué)家McLean在1916年發(fā)現(xiàn)肝素以后,就已發(fā)現(xiàn)肝素能夠避免血液凝結(jié),和其在體內(nèi)相對短的半衰期。通過注射游離型藥物施用全身性肝素已在臨床上使用了超過50年,作為安全和有效的血液抗凝劑和抗血栓劑。肝素對血液凝固/凝結(jié)的作用在停止施用后非常迅速的減少,使其在手術(shù)和其他程序期間的使用有效和安全。也就是說,肝素的抗凝和抗血栓形成的性能在許多醫(yī)療程序中有用,例如以最小化血液和體外循環(huán)的人造表面之間的不理想的相互作用。一旦程序結(jié)束,就可終止肝素的施用。由于其在體內(nèi)的短半衰期,在患者血液中的肝素濃度在幾小時內(nèi)降低至安全水平。這在愈合取決于血液在手術(shù)位點(diǎn)凝結(jié)的能力以避免出血性并發(fā)癥的手術(shù)后特別重要。除了其在治療血栓栓塞(thromboembolic)疾病和預(yù)防表面誘發(fā)的血栓形成中的公認(rèn)和持續(xù)的應(yīng)用以外,最近發(fā)現(xiàn)肝素具有多種與其作為抗凝劑的功能明顯無關(guān)的功能。例如,現(xiàn)在知道血液中的大量蛋白質(zhì)以高親和力結(jié)合肝素和/或密切相關(guān)的多糖——硫酸乙酰肝素,其也在動物組織中發(fā)現(xiàn),包括健康血管接觸血液的腔表面(在那里其可能有助于避免循環(huán)血液在與血管壁接觸后凝結(jié))。一些例子是抗凝血酶(AT)、纖連蛋白、玻連蛋白、生長因子(例如成纖維細(xì)胞生長因子、胰島素樣生長因子等)。人血清白蛋白(HSA)也結(jié)合肝素,但具有較低的親和力,盡管其在血液中濃度高。
其他人已考慮過利用全身性游離肝素的選擇性吸附性能阻礙感染,通過將肝素片段和/或所謂的含唾液酸片段直接引入血管系統(tǒng)。此療法是基于以下假設(shè),即這些片段將結(jié)合微生物上的凝集素并阻斷它們,因此它們不能結(jié)合哺乳動物細(xì)胞表面上的受體。盡管許多科學(xué)家已經(jīng)研究了此方法,迄今為止僅報導(dǎo)了少數(shù)成功。最常見的問題是與為了實(shí)現(xiàn)病原微生物的臨床有效減少而引入(例如,通過注射)血流中的大量游離肝素相關(guān)的出血性并發(fā)癥。本發(fā)明不需要使用任何游離的、全身性肝素以產(chǎn)生療效,因此可消除出血性并發(fā)癥。這是通過使肝素或硫酸乙酰肝素永久地結(jié)合具有高表面積的固體基質(zhì),并在包含此吸附介質(zhì)的藥筒(cartridge)或濾器內(nèi)將所述基質(zhì)暴露于血液。
以下參考涉及上面討論的問題:
Weber等人(Weber V,Linsberger I,Ettenauer M,Loth F,等人Development of specific adsorbents for human tumor necros is factor-α:influence of antibody immobilization on performance and biocompatibility.Biomacromolecules 2005;6:1864-1870)報導(dǎo)了使用用單克隆抗TNF抗體包被的纖維素微顆粒的TNF的顯著的體外結(jié)合,而Haase等人(Haase M,Bellomo R,Baldwin I,Haase-Fielitz A,等人The effect of three different miniaturized blood purificat ion devices on plasma cytokine concentration in an ex vivo model of endotoxinemia.Int J Artif Organs 2008;31:722-729)報導(dǎo)了IL-1ra,但不是IL-6的顯著減少,使用和我們類似的離體方法,但使用多孔吸附設(shè)備。在體內(nèi),Mariano等人(Mariano F,F(xiàn)onsato V,Lanfranco G,Pohlmeier R,等人Tailoring high-cut-off membranes and feasible application in sepsis-associated acute renal fai lure:in vitro studies.Nephrol Dial Transplant 2005;20:1116-1126)能夠使用血液灌流和高截止聚砜(polysulphone)膜顯著減少若干循環(huán)細(xì)胞因子,但也報導(dǎo)了血清白蛋白的減少。Schefold等人(Schefold JC,von Haehling S,Corsepius M,Pohle C,等人A novel selective extracorporeal intervention in sepsis:immunoadsorption of endotoxin,interleukin 6,and complement-activating product 5a.Shock 2007;28:418-425)顯示了這些發(fā)現(xiàn)的假定的臨床相關(guān)性,他們在患有感染性休克的33位患者的隨機(jī)研究中能夠通過選擇性免疫吸附同時降低循環(huán)內(nèi)毒素、IL-6和C5a水平,得到改善的器官功能。
發(fā)明概述
本發(fā)明的一個目的是提供從哺乳動物血液中去除細(xì)胞因子和/或病原體的方法,所述方法通過使血液接觸用選擇性吸附分子、生物分子或化學(xué)基團(tuán)包被的固體的、基本無孔的基質(zhì)。這樣的選擇性吸附分子可包括多糖,例如肝素、硫酸乙酰肝素、聚乙烯亞胺(PEI)、唾液酸、透明質(zhì)酸和具有甘露糖序列的碳水化合物。當(dāng)預(yù)防性使用時,例如在庫存血的收集或輸血期間,或在直接的患者至患者輸血中,本發(fā)明的使用也可用于減少或消除疾病的傳播。因此本發(fā)明也可用于預(yù)防疾病和在之前已感染的患者中幫助治愈疾病。
本發(fā)明的一個目的是提供通過從哺乳動物血液中去除細(xì)胞因子和/或病原體,用于治療現(xiàn)有疾病的療法,所述方法通過使哺乳動物血液接觸用肝素和/或其他吸附分子包被的固體的、基本無孔的基質(zhì),并使血液返回患有疾病的患者。
上述目的不旨在以任何方式限制本發(fā)明的范圍。
發(fā)明詳述
1.從血液中去除細(xì)胞因子或病原體
本發(fā)明的第一個方面提供了從血液,例如哺乳動物血液中去除細(xì)胞因子和/或病原體的方法,所述方法通過使血液接觸固體基質(zhì),例如用肝素和/或其他吸附性碳水化合物和/或多糖包被的固體基質(zhì)。
在此方法的一個實(shí)施方案中,肝素被固定在基質(zhì)表面上。發(fā)明人發(fā)現(xiàn),與表面結(jié)合的固化肝素可有效用于從血液中去除大量細(xì)胞因子和病原體。然而,體外血液循環(huán)的一般流速要求將吸附“床”設(shè)計為允許相對高的流速以安全運(yùn)行。這部分是由于緩慢移動或停滯的血液形成危險的血塊的普遍傾向。在本發(fā)明中,將基質(zhì)設(shè)計為具有足夠大的間隙尺寸(interstitial dimension),以允許血液以高流速經(jīng)過基質(zhì)而沒有大的壓力下降。也就是說,當(dāng)從哺乳動物患者中取出血液后,其以一定流速流經(jīng)基質(zhì),其中主要通過強(qiáng)制對流完成吸附質(zhì)至吸附床表面的遞送。這與慢得多的分子擴(kuò)散形成對比,分子擴(kuò)散在使用高度多孔的吸附介質(zhì)(例如多孔二氧化硅、葡聚糖凝膠、交聯(lián)的聚苯乙烯和其他的大小排阻介質(zhì))和許多其他微孔介質(zhì)中發(fā)生。當(dāng)選擇性滲透障礙膜和吸附介質(zhì)一起使用時,例如在親和療法期間用于避免吸附介質(zhì)接觸血細(xì)胞和/或高分子量溶質(zhì)時需要分子擴(kuò)散。
在一般用于體外血液循環(huán)的(安全)運(yùn)行的相對高的流速條件下,例如當(dāng)用線性流速測量時≥8cm/min,優(yōu)選地約≥24cm/min,和更優(yōu)選地約24-329cm/分鐘,或,當(dāng)用流速測量時,約>50mL/分鐘和優(yōu)選地>150mL/分鐘但低于約2000mL/分鐘時,在對流運(yùn)輸中肝素和/或其他吸附分子結(jié)合細(xì)胞因子和病原體特別有效。相反地,在微孔介質(zhì)的孔內(nèi)吸附可能需要低得多的流速通過實(shí)際大小的吸附床以實(shí)現(xiàn)充分的分離或純化,即<50mL/min到低至<1mL/min。
嚴(yán)格來說,普遍認(rèn)為,當(dāng)與通過強(qiáng)制對流將吸附質(zhì)運(yùn)送到(在基本無孔介質(zhì)上的)結(jié)合位點(diǎn)所需的較短的停留時間相比,對需要吸附質(zhì)擴(kuò)散運(yùn)輸?shù)浇橘|(zhì)內(nèi)的吸附位點(diǎn)的介質(zhì)來說,在吸附柱上需要長得多的“停留時間”(residence time)。然而,安全和有效的吸附藥筒、柱、濾器等的尺寸有實(shí)際限制,特別是對于其可容納的血液的最大滯留體積,和經(jīng)過吸附介質(zhì)的血液或血清的流速。為此,通過吸附設(shè)備的平均流速被認(rèn)為是重要的設(shè)計變量。
在從流動的血液中去除細(xì)胞因子或病原體時可比較對流動力學(xué)和擴(kuò)散動力學(xué):依賴擴(kuò)散運(yùn)輸?shù)奈浇橘|(zhì)一般使用因為存在微觀孔而具有極高內(nèi)表面積的非常多孔的材料。另一方面,適合對流運(yùn)輸?shù)慕橘|(zhì)一般依賴宏觀(macroscopic)“通道”或固體的、基本無孔的材料之間的可見間隙,例如顆粒、珠、纖維、網(wǎng)狀泡沫體,或任選地螺旋纏繞的致密膜。
依賴強(qiáng)制對流運(yùn)輸?shù)慕橘|(zhì)一般更適合高流速,而依賴慢得多的擴(kuò)散運(yùn)輸?shù)慕橘|(zhì)在需要高流速和較短的停留時間時效率低得多。為此,在體外血液凈化設(shè)備中,更優(yōu)選不需要吸附質(zhì)緩慢擴(kuò)散進(jìn)吸附介質(zhì)內(nèi)的孔的吸附介質(zhì)。當(dāng)通過人造材料制造的循環(huán)泵送血液時,一般操作是應(yīng)用相對高的血液流速以避免停滯和減少凝血的風(fēng)險。另一方面,必須避免極高的流速,因為其可使血細(xì)胞暴露于可破壞或損傷血細(xì)胞的高剪切率和沖擊損害。因此,本發(fā)明提供了用于從血液中去除細(xì)胞因子和/或病原體的方法和設(shè)備,使用對流運(yùn)輸?shù)膬?yōu)選特征及其理想的、更快的動力學(xué)。這是通過使血液通過/流經(jīng)基本無微孔的基質(zhì),所述基質(zhì)的表面已用吸附分子,例如肝素處理,使其因此能夠結(jié)合期望的細(xì)胞因子或病原體,從而將它們從血液中去除。如果表面處理有效地使基質(zhì)無孔,在本發(fā)明中也可能使用微孔基質(zhì)。這可有意或無意地(在制造介質(zhì)時表面處理使孔堵塞)發(fā)生。這將微孔基質(zhì)轉(zhuǎn)化為不需要吸附質(zhì)擴(kuò)散進(jìn)孔以結(jié)合介質(zhì)的基質(zhì)。
要求保護(hù)的方法旨在主要應(yīng)用于體外療法或程序,盡管也可用于可植入的設(shè)備。“體外療法”的意思是在身體外面進(jìn)行的程序,例如可在體液中加入期望的產(chǎn)物如氧氣、抗凝血劑、麻醉劑等的療法。相反地,使用特定類型的體外循環(huán)也可從體液中去除不理想的產(chǎn)物,如天然存在的毒素或毒物。實(shí)例是血液透析和血液過濾,它們代表了減少血液中的廢產(chǎn)物的技術(shù)。在活性碳上的吸附已用于去除血源性毒物,等等。
在本發(fā)明中可使用來自哺乳動物全血和血清。沒有旨在限制在要求保護(hù)的方法中可使用的血液或血清的量。其范圍可從低于1mL至高于1L,直到包括患者的全部血容量(當(dāng)應(yīng)用返回患者的持續(xù)再循環(huán)時)。如果需要,可使用一次或多次“通過”吸附床。血液可為人或動物血液。
根據(jù)本發(fā)明優(yōu)化從血液中去除細(xì)胞因子或病原體的吸附介質(zhì),用于流速>50mL/min,和優(yōu)選地在約150-2000mL/min之間的傳統(tǒng)體外血液循環(huán)。如果用線性流速測量,則≥8cm/min,優(yōu)選地約≥24cm/min和更優(yōu)選地約24-329cm/min。這樣的高流速在吸附柱內(nèi)產(chǎn)生短停留時間,且對流運(yùn)輸比Brownian擴(kuò)散運(yùn)輸占優(yōu)勢。這對結(jié)合大分子量蛋白質(zhì)或細(xì)胞因子,例如TNF-α和較大顆粒,例如病毒、細(xì)菌和寄生蟲特別重要,因為它們擴(kuò)散得非常非常慢。在本發(fā)明中,可用于去除細(xì)胞因子和病原體的主要吸附位點(diǎn)位于介質(zhì)床間隙內(nèi)的表面,血液流經(jīng)或強(qiáng)制對流被遞送通過介質(zhì)床。為了處理血液,間隙通道需要足夠大以允許紅細(xì)胞的運(yùn)輸,紅細(xì)胞的直徑平均為6微米。為了允許在具有高血液流速的體外循環(huán)中放置填充的吸附藥筒,間隙通道必須比紅細(xì)胞的直徑大若干倍。這可避免導(dǎo)致溶血的高剪切率,而同時最小化流經(jīng)填充床或筒的血液中的壓力降低。另外,介質(zhì)優(yōu)選為剛性的,以最小化由于壓緊而可能堵塞過濾筒的形變。基于這些優(yōu)先選擇,優(yōu)化的剛性介質(zhì)平衡了間隙通道的大小和總表面積,例如用于在高流速體外血液循環(huán)中有效去除病原體和/或細(xì)胞因子。
2.在本發(fā)明中使用的基質(zhì)。
多種形狀和組成的材料可用作本發(fā)明中的基質(zhì)。所有合適的基質(zhì)提供較大的表面積,同時(主要)通過強(qiáng)制對流運(yùn)輸促進(jìn)吸附質(zhì)運(yùn)輸?shù)浇Y(jié)合其的吸附位點(diǎn)。一般提供填充在容器,例如柱中的介質(zhì),容器被設(shè)計為容納介質(zhì),使其不被流動的血液帶走(又稱介質(zhì)遷移)和允許血液流經(jīng)基本所有的介質(zhì)表面。制造吸附介質(zhì)的有用的基質(zhì)包括無孔剛性珠、顆粒或填充的網(wǎng)狀泡沫體,剛性整體式床(monolithic bed)(例如通過燒結(jié)的珠或顆粒形成的),填充編織或非編織織物的柱,填充紗線或?qū)嵭幕蚩招闹旅?非微孔)單絲纖維的柱,由平面薄膜或致密膜形成的螺旋纏繞筒,或介質(zhì)的組合,例如混合的珠/織物筒。用于本發(fā)明的一種合適基質(zhì)是起初微孔性的但在(例如通過末端連接的肝素)產(chǎn)生吸附位點(diǎn)之前、之中或之后表面經(jīng)處理后變得基本無孔的基質(zhì)。
柱具有大孔結(jié)構(gòu),其對血液或血清呈現(xiàn)大表面積,同時避免大的壓力降低和高剪切率。除了可能通過溶血損害血液以外,應(yīng)當(dāng)避免高的壓力降低,因為其可關(guān)閉裝備響應(yīng)壓力降低的自動關(guān)閉開關(guān)的體外循環(huán)。
基質(zhì)也可采用致密膜,又稱隔膜的形式。在此實(shí)施方案中,通過將肝素,硫酸乙酰肝素或另一種吸附性多糖和任選的不來源于肝素,硫酸乙酰肝素,或吸附性多糖的吸附組分一起結(jié)合至膜表面修飾無孔薄膜的表面。可選地,可通過用基本無孔的材料,例如聚合物在連接結(jié)合位點(diǎn)之前、之中或之后填充孔使微孔膜變得無孔或“致密”。薄片或(中空)纖維形式的膜可排列在外殼中以呈現(xiàn)用于在本發(fā)明的實(shí)踐中適用的血液接觸的大表面積。
2.1.珠作為基質(zhì)
一種有用的基質(zhì)是固體珠或顆粒的形式。“珠”可由足夠剛性以在承受的流速下抵抗形變/壓實(shí)的材料制造。抵抗形變是維持自由體積(freevolume)和隨后的填充床“開關(guān)”的小幅壓力降低所必需的。在基質(zhì)塊中基本缺乏可進(jìn)入的孔,消除了吸附質(zhì)在吸附前擴(kuò)散進(jìn)孔的需要。本發(fā)明的吸附位點(diǎn)主要在介質(zhì)的表面上,如此放置使其對于主要通過對流運(yùn)輸遞送到表面的血液中的吸附質(zhì)易于接近。合適的基質(zhì)在其表面上不需要完全的光滑,因為粗糙導(dǎo)致用于連接結(jié)合位點(diǎn)(例如通過肝素的共價或離子結(jié)合)的表面積的期望的增加。另一方面,很大程度上避免了具有分子尺寸的可進(jìn)入的內(nèi)部孔,以消除吸附質(zhì)在與結(jié)合位點(diǎn)連接以前擴(kuò)散進(jìn)入孔中的需要。在本發(fā)明中可使用多種類型的珠。有用的珠應(yīng)當(dāng)具有足夠的大小和剛性以避免在所述方法使用期間的形變/壓實(shí),并具有能夠被肝素包被的足夠的表面積,以用于所述方法。
足夠的基質(zhì)剛度的證據(jù)是在臨床使用的一般速度下,在約一小時的水或鹽水流期間穿過吸收床的壓力降低沒有顯著增加:例如,當(dāng)用類似流速的例如鹽水測量時,相對初始壓力降低(在流動的第一分鐘內(nèi)測量的)<10-50%的增加。
珠或其他高表面積基質(zhì)可由若干不同的生物相容性材料,例如天然或合成的聚合物或基本不含可濾取雜質(zhì)的非聚合材料,包括玻璃、陶瓷和金屬制造。一些代表性聚合物包括聚氨酯,聚甲基丙烯酸甲酯,聚乙烯或乙烯和其他單體的共聚物,聚乙烯亞胺,聚丙烯和聚異丁烯。有用的基質(zhì)實(shí)例包括無孔的超高分子量聚乙烯(Ultra High Molecular Weight PolyEthylene,UHMWPE)。其他合適的珠是聚苯乙烯,高密度和低密度聚乙烯,二氧化硅,聚氨酯和殼聚糖。
制造這些珠的方法是本領(lǐng)域已知的。聚乙烯珠和其他聚烯烴珠是在合成過程中直接產(chǎn)生的,通常無需進(jìn)一步減少尺寸即可使用。其他聚合物可能需要研磨或噴霧干燥和分類,或經(jīng)加工以產(chǎn)生期望的大小分布和性狀的珠。
如上所述,為了用于本發(fā)明的方法,應(yīng)當(dāng)優(yōu)化用于體外血液過濾的個體珠之間的通道或間隙空間的大小,以避免筒的入口和出口之間的大幅壓力減少,允許血液細(xì)胞在高流速環(huán)境中的個體珠之間安全通過,和提供合適的間隙表面積用于使多糖吸附劑結(jié)合血液中的細(xì)胞因子或病原體。在用300微米、大致球形珠緊密填充的床中,合適的間隙孔徑的直徑是約68微米。有用的珠具有范圍從約100至大于500微米直徑的大小。珠的平均大小可從150-450微米。例如,來自Polymer Technology Group(Berkeley,USA)的具有0.3mm平均直徑的聚乙烯珠是合適的。間隙孔是珠大小的函數(shù)。
為了使用,將合適的珠封裝在容器,例如柱中。
下面描述基質(zhì)的其他合適形式。
網(wǎng)狀泡沫體具有開放的小室并可由例如聚氨酯和聚乙烯制造。可通過控制制造方法實(shí)現(xiàn)孔大小的控制。一般來說,網(wǎng)狀泡沫體可為3-100孔/英寸并可展示≥66cm2/cm3的表面積。
可通過化學(xué)或物理方法將珠燒結(jié)為整體式多孔結(jié)構(gòu)。可通過在筒中在其熔解溫度以上加熱珠并施加壓力燒結(jié)聚乙烯珠。得到的間隙孔徑比相同大小的非燒結(jié)珠的填充床的間隙孔徑略有減少。可實(shí)驗測定此減少并用于產(chǎn)生期望的最終間隙孔徑。
柱或其他外殼形狀可填充編織或非編織的肝素化織物,或在外殼已填滿基質(zhì)介質(zhì)以后可連接肝素,硫酸乙酰肝素或任選的非肝素吸附位點(diǎn),例如通過共價鍵、離子鍵或其他化學(xué)或物理鍵。通過在編織或針織期間或在制造非編織的網(wǎng)期間控制織物的纖維纖度(denier)和密度,可控制間隙孔徑。有用的非編織織物可為氈合(fel ts)、熔噴或靜電結(jié)成的網(wǎng)的形式,具有通過纖維的纏結(jié)和/或交叉纖維的粘附或凝聚維系在一起的隨機(jī)取向。可用的編織織物具有更確定且非隨機(jī)的結(jié)構(gòu)。
柱可填充纖維或由纖維制造的紗線。聚乙烯和其他纖維可被拉成細(xì)的中空纖維或?qū)嵭膯谓z纖維或復(fù)絲紗線,用把中空纖維膜安裝在常規(guī)血液透析筒或血液氧合器中的相同方式可將其填充在筒中。在本發(fā)明中,在將肝素或其他吸附劑結(jié)合在外和/或內(nèi)表面之前、之中或之后使原本多孔的中空纖維變得致密或無孔。來自Royal DSM的Dyneema 是由UHMWPE制造的高強(qiáng)度實(shí)心纖維。Dyneema可為肝素化的并填充在筒中以提供高表面積支持物,用于去除細(xì)胞因子和病原體。
螺旋纏繞筒包含與任選的間隔材料緊密纏繞在一起以避免相鄰表面接觸的薄膜或膜。膜可由聚合物例如聚氨酯,聚乙烯,聚丙烯,聚砜,聚碳酸酯,PET,PBT等制造。
2.2.吸附性多糖的連接
可通過多種方法,包括共價連接或離子連接將本發(fā)明的吸附性多糖結(jié)合到固體基質(zhì)的表面。
本發(fā)明的吸附介質(zhì)可包含與固體基質(zhì)表面共價連接的肝素。可使用多種本來已知的方法將肝素連接至期望的基質(zhì),例如在Wendel和Ziemer的綜述文章中描述的(H.P Wendel和G.Ziemer,European Journal of Cardio-thoracic Surgery 16(1999)342-350)。在一個實(shí)施方案中,肝素通過共價末端連接與固體基質(zhì)連接。此方法通過減少或消除可能進(jìn)入血流的肝素從基質(zhì)表面的釋放提高設(shè)備的安全性。要避免肝素被血液“濾出”和進(jìn)入血液,因為這可增加出血和肝素引起的血小板減少的風(fēng)險。
多糖,例如肝素與固體基質(zhì)的共價連接相比非共價連接提供了對參數(shù)(如固定化分子的表面密度和方向)的更好的控制。發(fā)明人已證明這些參數(shù)對提供細(xì)胞因子或病原體與固化的碳水化合物分子的最佳結(jié)合是重要的。肝素在固體基質(zhì)上的表面濃度可在1-10μg/cm2的范圍中。共價末端連接的意思是,多糖,例如肝素通過肝素分子的末端殘基與固體基質(zhì)共價連接。也可在多個點(diǎn)上結(jié)合肝素。優(yōu)選末端連接。
如果使用珠,在與多糖例如肝素,或其他化合物連接以前可對珠進(jìn)行親水化(hydrophilized)。制備珠的可能方法包括酸蝕、等離子體處理和暴露于強(qiáng)氧化劑例如高錳酸鉀。
2.3.每克基質(zhì)的多糖量
每克基質(zhì)的多糖吸附劑的量可變化。在一個具體的實(shí)施方案中,如果使用珠,每克珠的多糖,例如肝素的量由使用的層數(shù)和珠的大小決定。珠越大,每克珠獲得的多糖,例如肝素越少。優(yōu)選的量是每次MBTH法2.0±0.5mg肝素/g珠。
在要求保護(hù)的方法中使用的多糖的分子量可變化。例如,天然肝素具有22kDa的平均分子量。硝酸分解的肝素具有8kDa的分子量。
3.具有不同表面功能的珠的混合物
肝素是可結(jié)合細(xì)胞因子,病原體和其他蛋白質(zhì)的生物活性碳水化合物。但肝素最著名和最廣泛的用途是作為避免血液凝結(jié)的抗凝劑。其作為可注射的、全身性抗凝劑已在臨床上被安全使用了50年。另外,其作為醫(yī)療設(shè)備的涂料或表面處理已被制造商使用多年,用于改善醫(yī)療設(shè)備在血液接觸應(yīng)用中的安全性的唯一目的。在為了大量運(yùn)輸必須暴露大表面積于血液的設(shè)備中這特別重要。實(shí)例包括透析器和血液氧合器。在本發(fā)明中使用的吸附介質(zhì)的表面為了2個目的包含肝素:1)肝素能夠結(jié)合病原體,細(xì)胞因子和促成疾病的其他血源性物質(zhì),和2)肝素能夠在接觸外來的、例如人工制成的表面后避免血液凝固和相關(guān)反應(yīng)。因此肝素是本發(fā)明的吸附介質(zhì)的關(guān)鍵成分,因為其在從血液和其他生物液中去除有害物質(zhì)的期間提供了有效性和安全性。
除了肝素和硫酸乙酰肝素以外,還有其他生物活性的化學(xué)部分(包括其他碳水化合物)可從血液和其他生物液中去除僅用固化的肝素不能有效去除的有害物質(zhì)。例如,殼聚糖,一種高度陽離子型的正電荷碳水化合物會結(jié)合內(nèi)毒素。其他正電荷分子,例如聚乙烯亞胺(PEI),也可結(jié)合內(nèi)毒素。然而,陽離子型表面相比肝素化表面與血液較不相容,并可導(dǎo)致增加的促凝性,此為在血液接觸設(shè)備中的一種危險情況。(見Sagnella S.,和Mai-Ngam K.2005,Colloids and Surfaces B:Biointerfaces,Vol.42,pp.147-155,Chitosan based surfactant polymers designed to improve blood compatibility on biomaterials和Keuren J.F.W.,Wielders S.J.H.,Willems G.M.,Morra M.,Cahalan L.,Cahalan P.,和Lindhout T.2003,Biomaterials,Vol.24,pp.1917-1924.Thrombogenecity of polysaccharide-coated surfaces)。盡管可以使用包含PEI,殼聚糖或其他固有形成血栓的(throbogenic)表面作為生物活性吸附劑的吸附藥筒從血液中去除LPS或內(nèi)毒素,由于嚴(yán)重的凝血風(fēng)險,患者將需要高劑量的全身性抗凝劑。在全身性肝素的情況下,這可能導(dǎo)致出血風(fēng)險和可能的血小板減少。
本發(fā)明的方法用肝素化介質(zhì)和固有形成血栓的介質(zhì)的混合物制備吸附床。通過用具有肝素化表面和,例如,陽離子型表面(或其他固有形成血栓的表面)組裝的吸附藥筒,細(xì)胞因子,病原體和內(nèi)毒素均可從血液或生物液中安全地去除。
另一種有生物活性,但形成血栓的碳水化合物是唾液酸。已知唾液酸結(jié)合病毒凝集素,包括流感。(C,Mandal.1990,Experientia,Vol.46,pp.433-439,Sialic acid binding Lectins.)肝素化珠和唾液酸包被珠的混合筒可用于治療患者,例如在流感流行期間。
腹部感染性休克通常由大腸桿菌(E.Coli)引起,這是一種革蘭氏陰性菌。革蘭氏陰性菌一般不結(jié)合肝素,因此使用除了細(xì)胞因子和/或內(nèi)毒素以外還結(jié)合這些細(xì)菌的多功能吸附柱將是有用的。具有甘露糖序列的碳水化合物,例如已知甲基α-D--吡喃甘露糖苷結(jié)合大腸桿菌,肺炎克雷伯氏菌(K.Pneumonia),銅綠假單胞菌(P.Aeruginosa)和沙門氏菌(Salmonella)。(Ofek I.,和Beachey E.H.1,1978,Infection and Immunity,Vol.22,pp.247-254,Mannose Binding and Epithelial Cell Adherence of Escherichia coli和Sharon,N.2,1987,F(xiàn)EBS letters,Vol.217,pp.145-157Bacterial lectins,cell-cell recognition and infectious disease.)
此實(shí)施方案的使用是基于以下觀念,即抗血栓形成表面和血栓形成表面的緊密接觸或極為接近可避免臨床上大量血栓的形成(如果單獨(dú)使用固有形成血栓的表面則將發(fā)生)。在珠或顆粒形式的吸附介質(zhì)的情況下,本發(fā)明的優(yōu)選應(yīng)用是在將其填充進(jìn)筒或其他外殼以前,將不同的吸附介質(zhì)混合在一起。這提供了相鄰珠上的多種表面化學(xué)成分的緊密接觸,同時允許有效制造吸附藥筒或濾器。一種相關(guān)方法是把不同介質(zhì)以“凍糕型(parfait-type)”排列分層堆積在外殼內(nèi),使得血液相繼或以平行流接觸不同介質(zhì)。不同介質(zhì)在筒內(nèi)的一種排列是在筒的入口和/或出口處放置未混合的抗血栓形成介質(zhì),在入口和出口區(qū)之間插入包含更容易形成血栓的介質(zhì)的任選混合的區(qū)域。在纖維形式的介質(zhì)的情況下,可通過在紡織工業(yè)中熟知的從混合纖維形成織物的方法制備混合的編織、針織或非編織結(jié)構(gòu)。可選地,可從較細(xì)的復(fù)絲紗線或由具有不同表面化學(xué)成分的2種或多種纖維制成的單絲制備紗線,只要一種纖維類型包含有效阻止在接觸后血液凝結(jié)的表面。然后可使用混合纖維紗線制備用于血液接觸的織物。可混合中空纖維或?qū)嵭睦w維吸附介質(zhì)并用于制造類似中空纖維透析器或氧合器的筒。對用于螺旋纏繞吸附藥筒類型的膜或薄膜型吸附介質(zhì),可使用彼此極為靠近的2種或多種表面化學(xué)成分,使血液必須(幾乎)同時接觸2種表面化學(xué)成分。這可通過在膜、薄膜表面層內(nèi)的多種結(jié)合組分的有規(guī)律的或隨機(jī)的陣列,或通過在2片間隔很近的薄、薄膜(其中之一是抗血栓形成的)之間形成血流通道實(shí)現(xiàn)。
4.用于本發(fā)明的方法的設(shè)備
本發(fā)明的另一個方面提供了包含吸附劑修飾的固體基質(zhì)的設(shè)備用于從哺乳動物血液中體外去除細(xì)胞因子或病原體的用途,所述吸附劑對細(xì)胞因子或病原體具有結(jié)合親和力。
在根據(jù)本發(fā)明的用途和方法中提及的設(shè)備可包含用于體外處理(例如患有腎衰竭的)患者的血液和血清的常規(guī)設(shè)備。
已知在用于體外循環(huán)的血液接觸醫(yī)療設(shè)備中的局部血流模式通過剪切激活和在停滯區(qū)中的血小板聚集影響凝塊形成。因此,在本發(fā)明的多個方面中使用的設(shè)備應(yīng)被設(shè)計為不產(chǎn)生這些問題的形式。
在本發(fā)明的一些實(shí)施方案中使用的設(shè)備可例如具有以下性能:
在150-2000ml/min范圍內(nèi)的血流量,或如果用線性流速測量≥8cm/min。
低流阻。
具有固定在其上的碳水化合物的基質(zhì)的大表面積,例如約0.1-1m2。
穩(wěn)定的涂料(在與血液接觸后沒有臨床上顯著的碳水化合物泄漏到血液中)。
在設(shè)備中合適的血液動力學(xué)性能(無停滯區(qū))。
最佳生物相容性。
可用于根據(jù)本發(fā)明的用途或方法的這樣的設(shè)備的非限制性實(shí)例是兒科血流透析器,這是用于去除細(xì)胞因子分子的體外血液過濾設(shè)備,并且其兼容高流速。一種這樣的設(shè)備可從Exthera Medical獲得。也可使用其他型號或類型的用于體外處理血液或血清的設(shè)備,例如來自Gambro AB,Sweden的Prisma M10血液過濾器/透析器。
高流量條件可被定義為超過擴(kuò)散限度的血流量。
5.細(xì)胞因子
如本文使用的,術(shù)語“細(xì)胞因子”的意思是例如與微生物感染或免疫有關(guān)而釋放的蛋白質(zhì),其選自白介素,干擾素,趨化因子和腫瘤壞死因子。細(xì)胞因子的實(shí)例是血管細(xì)胞粘附分子(VCAM),抗凝血酶,激活調(diào)節(jié)的正常T細(xì)胞表達(dá)和分泌蛋白(RANTES),干擾素,腫瘤壞死因子α(TNF-α),腫瘤壞死因子β(TNF-β),白介素-1(IL-1),IL-8,GRO-α和白介素-6(IL-6)。
所述方法也提供了通過強(qiáng)吸附肝素結(jié)合分子,從血液中選擇性去除細(xì)胞因子。一些分子相比其他分子對肝素具有更高的結(jié)合親和力。例如,TNF-α對肝素具有高親和力。
6.病原體
本發(fā)明的另一個方面提供了通過從哺乳動物血液中去除細(xì)胞因子和/或病原體治療疾病的方法,所述方法通過使哺乳動物血液接觸在上面的方法中公開的固體基質(zhì)。可使用根據(jù)本發(fā)明的肝素化基質(zhì)從血液中去除的病原體的實(shí)例包括:
病毒-腺病毒,冠狀病毒,登革病毒,乙肝,丙肝,HIV,HPV巨細(xì)胞病毒,等等。
細(xì)菌-炭疽桿菌(Bacillus anthracis),肺炎衣原體(Chlamydia pneumoniaem),單核細(xì)胞增多性李斯特氏菌(Listeria monocytogenes),銅綠假單胞菌(Pseudomonas aeruginosa),金黃色葡萄球菌(Staphylococcus aureus),MRSA,化膿性鏈球菌(Streptococcus pyrogenes),小腸結(jié)腸炎耶爾森菌(Yersinia enterocolitica),等等。
寄生蟲-Giardia lambitia,瘧原蟲屬(plasmodium spp.)等等。
又見,Chen,Y.Gotte M.,Liu J.,和Park P.W.,Mol.Cells,26,415-426。
根據(jù)本發(fā)明可治療的疾病的一個實(shí)例是膿毒癥。膿毒癥一般被視為對感染的全身性應(yīng)答,其可導(dǎo)致器官衰竭并常導(dǎo)致死亡。此病癥可由細(xì)菌、病毒、寄生蟲或真菌感染引起。已知此病癥在醫(yī)院中特別危險,在醫(yī)院中患者可能已經(jīng)免疫受損。在膿毒癥期間,患者經(jīng)歷所謂的細(xì)胞因子風(fēng)暴(cytokine storm),且體內(nèi)免疫系統(tǒng)攻擊健康組織,導(dǎo)致在高度灌注的器官中的多器官衰竭。減少TNF-α和其他炎性分子將調(diào)節(jié)免疫應(yīng)答并可作為器官保護(hù)策略。另外,在血液中的任意肝素結(jié)合病原體可被去除,這將幫助減少其進(jìn)一步建群和可減少治療感染所需的抗生素的量。通過降低與抗生素治療相關(guān)的副作用風(fēng)險,這可改善患者的安全。
本發(fā)明的方法可在其他常規(guī)治療,例如施用抗生素以前或以后應(yīng)用。
7.將本發(fā)明和其他過濾/分離步驟組合
在根據(jù)本發(fā)明的治療方法的一個實(shí)施方案中,血液的取出和再引入可在連續(xù)的環(huán)路中進(jìn)行,所述環(huán)路包含受試者血流的一部分。
在另一個方面,上述方法可與其他方法組合過濾或處理哺乳動物血液。例如,基于對流動力學(xué)的筒可與常規(guī)體外循環(huán),例如CPB、血液透析和氧合串聯(lián)使用。
8.實(shí)施例
在以下實(shí)施例中進(jìn)一步描述本發(fā)明的多個方面。這些實(shí)施例不旨在限制。例如,在本實(shí)施例中使用肝素。然而,可單獨(dú)使用其他碳水化合物和多糖吸附劑,或除了下面舉例的肝素包被的基質(zhì)以外還使用其他碳水化合物和多糖吸附劑。
8.1.實(shí)施例1
肝素柱的制備
具有0.3mm平均直徑的聚乙烯(PE)珠(批號180153)由Polymer Technology Group(Berkeley,USA)提供,柱(Mobicol,1mL)從MoBiTec (Germany)獲得。肝素和聚乙烯亞胺(PEI)分別購自Scient ific Protein Laboratories(Waunakee,Wisconsin,USA)和BASF(Ludwigshafen,Germany)。使用的所有化學(xué)品為分析級或更高。
如Larm等人(Larm O,Larsson R,Olsson P.A new non-thrombogenic surface prepared by select ive covalent binding of heparin via a modified reducing terminal residue.Biomater Med Devices Artif Organs 1983;11:161-173)描述的進(jìn)行肝素在珠上的固定。
使用下述一般程序肝素化聚合物表面。
用氧化劑(高錳酸鉀、過硫酸銨)蝕刻聚合物表面,以引入親水特性和一些反應(yīng)官能團(tuán)(-SO3H,-OH,-C=O,-C=C-)。也可用等離子體或電暈蝕刻表面。例如,用氧化劑(在硫酸中的高錳酸鉀)蝕刻PE-珠。這些親水化珠特別包含OH-基和雙鍵,在以后用作對照。
用聚胺,聚乙烯亞胺(PEI)或殼聚糖處理引入反應(yīng)性氨基官能團(tuán)。為了某些目的,可通過用雙功能試劑,例如巴豆醛或戊二醛交聯(lián)在表面上穩(wěn)定聚胺。
通過用硫化多糖(硫酸葡聚糖或肝素)離子交聯(lián)進(jìn)一步穩(wěn)定涂料。如果必要,重復(fù)這些步驟并建立夾心結(jié)構(gòu)。在每一步之間應(yīng)進(jìn)行小心的漂洗(水,合適的緩沖液)。在最后加入PEI或殼聚糖之后,利用天然肝素還原性末端殘基中的醛官能團(tuán),通過還原胺化進(jìn)行與天然肝素胺化表面的末端連接(EPA)。
通過肝素的部分亞硝酸降解(nitrous degradation)可獲得在還原性末端殘基中的反應(yīng)性更強(qiáng)的醛官能團(tuán)。這會縮短反應(yīng)時間,但固化的肝素將具有較低的分子量。連接通過還原胺化(氰基硼氫鹽,CNBH3-)在水溶液中進(jìn)行。
在此可選方法中,在醋酸緩沖液(800ml,0.1M,pH 4.0)中懸浮胺化介質(zhì)并加入4.0g亞硝酸分解的肝素(來自Pharmacia,Sweden的肝素)。在搖晃0.5h后,加入NaBH3CN(0.4g)。搖晃反應(yīng)混合物24h,然后如上處理,得到肝素化介質(zhì)。
1-10μg/cm2肝素可連接至所有親水表面,如玻璃,纖維素,幾丁質(zhì)等,和幾乎所有疏水聚合物,如聚氯乙烯,聚乙烯,聚碳酸酯,聚苯乙烯,PTFE等。
得到的具有共價末端連接的肝素的PE-珠用氧化乙烯(ethylenoxide,ETO)滅菌并用0.9%氯化鈉和超純水漂洗。使用MBTH法測的肝素的量為2.0mg肝素/g珠。(Larm O,Larsson R,Olsson P.A new non-thrombogenic surface prepared by selective covalent binding of heparin via a modified reducing terminal residue.Biomater Med Devices Artif Organs 1983;11:161-173和Riesenfeld J,Roden L.Quantitative analysis of N-sulfated,N-acetylated,and unsubst ituted glucosamine amino groups in heparin and related polysaccharides.Anal Biochem 1990;188:383-389).
使用的聚乙烯珠具有0.3mm的平均直徑,并使用保證肝素分子共價末端連接至表面的技術(shù)進(jìn)行肝素化,因此使對肝素/硫酸乙酰肝素具有親和力的蛋白質(zhì)更易接近碳水化合物鏈。固化的肝素的平均分子量為約8kDa,且每克珠連接2mg(等于約360IU)。通過如預(yù)期地去除流經(jīng)肝素化,而不是非肝素化珠的血液中75%的抗凝血酶(AT)濃度驗證了此表面的完整性。
這些數(shù)據(jù)與Bindslev等人公開的在膿毒癥患者中使用表面肝素化的氧合器的體外肺輔助的之前的觀察結(jié)果良好吻合。(Bindslev L,Eklund J,Norlander O,Swedenborg J,等人Treatment of acute respiratory failure by extracorporeal carbon dioxide elimination performed with a surface heparinized artificial lung.Anesthesiology 1987;67:117-120.)
8.2.實(shí)施例2
患者
研究方案經(jīng)卡羅林醫(yī)學(xué)大學(xué)醫(yī)院(Karolinska University Hospital)的當(dāng)?shù)貍惱砦瘑T會批準(zhǔn),并從每位患者處得到簽署的知情同意。從3位膿毒癥(發(fā)熱>38℃,發(fā)冷,白細(xì)胞>12x 109細(xì)胞/L)患者(2M/1F,年齡為43,56和68歲;表1)的血液透析器中抽取動脈血。
表1.獻(xiàn)血患者的臨床表征
以前對患者施用了廣譜抗生素(頭孢他啶或頭孢呋辛,同時使用氨基糖苷類;每種1個劑量)和肝素(200IU/kg透析開始時的體重)。在EDTA真空管中收集血液并立即轉(zhuǎn)移至相鄰的房間中,對以前制備好的柱應(yīng)用1mL血液并以1,5和10mL/min之一的流速通過柱,使用滾輪泵(roller pump)。在另一端立即收集通過柱的血液并冷凍離心(4500G)。隨后收集上清并冷凍在-80℃用于以后的分析。
8.3.實(shí)施例3
細(xì)胞因子的定量分析
使用讀板儀(Multiskan Ascent)用光致發(fā)光測量細(xì)胞因子的量。每個樣品在3個孔中測量,使用幾何平均數(shù)用于分析。所有試劑盒的測定內(nèi)變異系數(shù)低于8%。我們使用了Coamatic抗凝血酶試劑盒(Haemochrom,貨號8211991),Quantikine人IL-6(R&D Systems,貨號D6050),Quantikine 人IL-10(R&D Systems,貨號D1000B),蛋白質(zhì)C抗原檢測96(HL Scandinavia AB,產(chǎn)品號H5285),人CCL5/RANTES Quant ikine(R&D Systems,貨號DRN00B),Quantikine人sVCAM-1(CD106)(R&D Systems,貨號DVC00),Quantikine人IFN-γ(R&D Systems,貨號DIF50),Quantikine HS TNF-α/TNFSF1A(R&D Systems,貨號HSTA00D)和BD OptEIA人C5a ELISA試劑盒II(BD Biosciences,貨號557965)。
統(tǒng)計學(xué)評估
使用成對Kruskal-Wallis檢驗比較每種細(xì)胞因子在過柱前和后的血液濃度,雙側(cè)p-值小于0.05指示顯著。結(jié)果總結(jié)在表2中。
表2.在血液通過不同柱之前和之后測量的細(xì)胞因子濃度
細(xì)胞因子結(jié)合
分析的細(xì)胞因子在過柱前和后的濃度顯示在表2和圖1中。簡單地說,相比非肝素化珠,通過肝素化珠導(dǎo)致血液VCAM和TNF的顯著更大的減少。
珠體積的影響
使用1:1和1:10的血液:珠的體積得到的數(shù)據(jù)沒有顯著變化(表2)。
流速的影響
將血液流速從1變至最大10mL/min沒有顯著影響去除的各個細(xì)胞因子的量,表明觀察到的與固化肝素分子的結(jié)合是非常快的事件,明顯不依賴于擴(kuò)散動力學(xué)。
8.4.實(shí)施例4
在此實(shí)施例中用臨床尺寸的筒檢測了5升加入重組TNF-α的血小板貧乏血漿。如在實(shí)施例1中描述的,用肝素化PE珠填充300ml筒。使用ETO滅菌,使用16小時周期和50度的溫度滅菌設(shè)備。在研究開始前,允許設(shè)備“排氣(gas out)”額外12個小時。
從Innovative Research處購買5.1L冷凍的、未過濾的豬肝素化血小板貧乏血漿,并貯存在-20度冰箱中直至使用日。從Invitrogen處獲得粉末形式的1mg重組人腫瘤壞死因子-α。
進(jìn)行程序當(dāng)天上午從-20℃冰箱中取出血漿并置于溫水浴中解凍。將1ml無菌水與1mg粉末狀TNF-α混合以重構(gòu)1mg/ml的濃度。
在Fresenius 2008K透析機(jī)上以封閉的系統(tǒng)設(shè)置安裝“Combiset”血液透析管道(在Fresenius機(jī)器上使用的標(biāo)準(zhǔn)管道),用seraph濾血器代替Fresenius Kidney。將5L血漿轉(zhuǎn)移進(jìn)5L儲存袋中,儲存袋與動脈和靜脈患者線連接。用鹽水預(yù)處理透析機(jī)和管道以保證正常功能和沒有空氣通過封閉的循環(huán)。
將5L血漿袋置于周圍包裹Bair Hugger保溫毯的板式搖床(plate rocker)上,包裹保溫毯以在程序進(jìn)行期間維持溫度。此時收集輸注前(pre-infusion)的對照樣品并置于液氮中速凍。然后將樣本轉(zhuǎn)移至樣品儲存盒并置于干冰上。在確認(rèn)了所有連接后,將0.415ml TNF-α注入儲存袋的端口。在收集輸注后對照樣品之前,允許具有TNF-α的血漿在搖床上混合10分鐘。收集輸注后樣品,在液氮中速凍,然后移至干冰上的樣品儲存盒中。用鹽水清洗透析系統(tǒng),當(dāng)血漿通過封閉系統(tǒng)時開啟系統(tǒng)時鐘。在5分鐘時從濾器上游收集首個樣品。
在試運(yùn)行的第1個小時中,從濾血器的緊接上游和緊接下游的端口每隔5分鐘收集樣品。在液氮中速凍樣品,并置于干冰上的樣品儲存盒中。
在試運(yùn)行的第2和第3個小時中,從濾血器的緊接上游和緊接下游的端口每隔10分鐘收集樣品。在液氮中速凍樣品,并置于干冰上的樣品儲存盒中。
在試運(yùn)行的第4和第5個小時中,從上游和下游的端口每隔20分鐘收集樣品。也在液氮中速凍這些樣品,并置于干冰上的樣品儲存盒中。
在每個時間點(diǎn)的上游和下游兩處的每次樣品收集時,使用新的針和新的注射器以避免殘留的TNF-α。
進(jìn)行ELISA監(jiān)控血漿中的TNF-α的量。為了包被96孔板,在10μL包被緩沖液A中稀釋10μL捕獲抗體,每孔加入100μL。用封口膜覆蓋板,4℃儲存過夜或整個周末。從-80℃冰箱中取出樣品,記錄并解凍。從4℃冰箱中取出板,吸去孔中的液體,用400μL/孔測定緩沖液洗一遍,然后顛倒并在吸水紙巾上吸干。每孔加入300μL測定緩沖液,將板孵育60分鐘。在這期間,通過在測定緩沖液中稀釋,從CytoSet包含的TNF-α標(biāo)準(zhǔn)物制備標(biāo)準(zhǔn)物。在測定緩沖液中稀釋解凍的樣品。一旦樣品被稀釋,它們在冷藏盒中的合適位置中被替換并放回-80℃冰箱,如記錄所指示。用400μL/孔測定緩沖液再次洗滌平板,顛倒和吸干。根據(jù)ELISA模板表將100μL置于孔中。一式兩份測定樣品和標(biāo)準(zhǔn)品,在每塊板上包含標(biāo)準(zhǔn)曲線。在5.49mL測定緩沖液中稀釋8.8μL檢測抗體,在加完所有樣品和標(biāo)準(zhǔn)品后對每孔加入50μL。在定軌振動器上在室溫孵育板2小時。如上述洗滌和吸干板5次。在10mL測定緩沖液中稀釋鏈霉抗生物素綴合物(16μL),每孔加入100mL。在定軌振動器上在室溫孵育板30分鐘,然后如上述用測定緩沖液洗5次。每孔加入100μLTMB溶液,在定軌振動器上再孵育板30分鐘。每孔加入100μL終止溶液,在加入終止溶液后30分鐘內(nèi)在Vmax讀板儀上在450nm處讀板。
檢測結(jié)果標(biāo)繪在圖1中。在富含TNF血清的40分鐘的連續(xù)循環(huán)內(nèi),觀察到80%的TNF減少,沒有后續(xù)釋放。在理想地混合后,血漿中的所有TNF將在33分鐘內(nèi)通過吸附柱。在此時期中捕獲了大多數(shù)TNF證明了基于對流動力學(xué)通過吸附去除了TNF-α。
8.5.實(shí)施例5
進(jìn)行了石英晶體微天平(QCM)實(shí)驗,以嘗試標(biāo)準(zhǔn)化TNF-α與肝素化表面的非競爭性結(jié)合能力。QCM是一種可檢測在特別制備的晶體上的吸附劑重量的技術(shù)。最小檢測極限是0.5ng/cm2。QCM檢測晶體的共振頻率。因為晶體的質(zhì)量隨吸附而增加,共振頻率的變化與質(zhì)量的增加成比例。以下方程描述了質(zhì)量變化(Δm)
n-泛音(overtone)
其中Δf是頻率的變化。
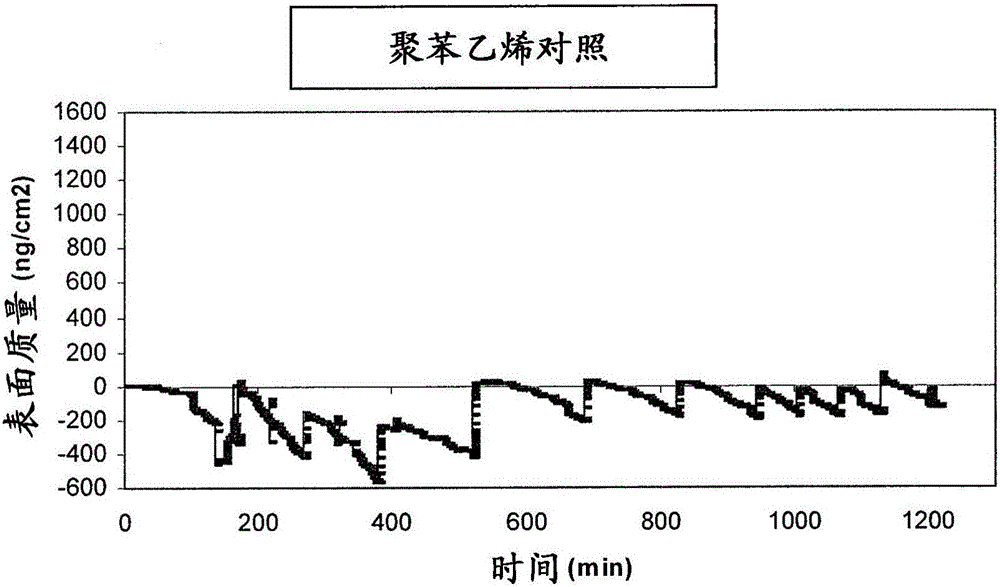
根據(jù)實(shí)施例1中描述的方法肝素化聚苯乙烯包被的QCM晶體。制備了120ml溶液,其中將重組TNF-α加入PBS以得到83μg/L的終濃度。然后溶液以50μl/min的速度通過含有4個QCM晶體的小室。2個晶體是肝素化的,2個晶體是對照晶體(未處理的聚苯乙烯)。實(shí)驗總時間是20小時。在肝素化晶體和對照晶體上吸附的TNF-α的量的結(jié)果顯示在圖2中。在肝素化晶體上最多吸附了1234ng/cm2的TNF-α,在對照表面上的吸附可以忽略不計。
8.6.實(shí)施例6
進(jìn)行了下述研究,檢測使用肝素化珠從采集自感染炭疽桿菌的獼猴的血漿中去除細(xì)胞因子。在若干動物死亡時收集血漿并合并。1ml過濾注射器填充0.5克根據(jù)實(shí)施例1中概述的程序肝素化的PE珠、或用作對照的未處理的PE珠。共使用3個樣品注射器和3個對照注射器。在珠頂部放置頂部多孔板以避免在對過濾注射器加入鹽水或血漿時使珠漂浮。使用2ml Tris緩沖的鹽水(TBS)預(yù)處理過濾注射器。使用5ml注射器使2ml鹽水通過濾器。然后縮回5ml注射器的活塞并填滿4ml空氣。然后使空氣通過過濾注射器以將殘留的鹽水推出珠外。然后將0.5ml血漿吸入5ml注射器并隨即推過過濾注射器。使另外4ml空氣通過過濾注射器以去除任何殘留血漿。在將血漿從注射器排空以后,取樣等分試樣并速凍,用于細(xì)胞因子濃度分析。使用Multiplex測定檢測GRO-α,IL-8,MIP-1β,Rantes,和TNF-β。結(jié)果總結(jié)在表3中。
表3.
8.7.實(shí)施例7
使用分層組裝的結(jié)合細(xì)胞因子和內(nèi)毒素的藥筒
使用2種不同的吸附介質(zhì)制造藥筒(cartridge)。使用肝素化珠捕獲細(xì)胞因子和使用PEI珠捕獲內(nèi)毒素。通過控制肝素化珠與PEI珠的比例,可維持血液相容性。根據(jù)實(shí)施例1中的頭2個步驟制造PEI珠。
在此實(shí)施例中,使用肝素化珠和聚乙烯亞胺(PEI)包被珠制造筒。在直立的支架(stand)上固定300ml吸附柱。然后加入50ml平均300微米的肝素化珠至筒中并允許其沉降。然后加入50:50的PEI珠和肝素化珠的混合物組成下一個200ml。然后用最后的50ml肝素化珠填充筒。然后密封筒,珠的緊密填充維持吸附介質(zhì)的分層結(jié)構(gòu)。在此筒中,2/3的珠是肝素化的,而1/3是胺化的,因此是固有形成血栓的。
8.8.實(shí)施例8
使用珠的一致混合物的結(jié)合細(xì)胞因子和內(nèi)毒素的藥筒
使用2種不同的吸附介質(zhì)制造筒。使用肝素化珠捕獲細(xì)胞因子,使用PEI珠捕獲內(nèi)毒素。通過控制肝素化珠與PEI珠的比例,可維持設(shè)備的總體血液相容性。
在此實(shí)施例中,使用肝素化珠和PEI包被珠制造筒。在直立的支架(stand)上固定300ml吸附柱。將100ml PEI包被珠加入200ml肝素化珠并充分混合。然后將300ml珠加至筒中并密封。珠的緊密填充維持珠的隨機(jī)混合。在此筒中,2/3的珠是肝素化的,而1/3是胺化的。
8.9.實(shí)施例9
分層組裝的結(jié)合細(xì)胞因子、革蘭氏陰性菌和內(nèi)毒素的藥筒
使用3種不同的吸附介質(zhì)制造筒。使用肝素化珠捕獲細(xì)胞因子,使用甘露糖功能化珠捕獲革蘭氏陰性菌,使用PEI珠捕獲內(nèi)毒素。通過控制肝素化珠、甘露糖功能化珠與PEI包被珠的比例,可維持血液相容性。
在直立的支架(stand)上固定300ml吸附柱。然后加入50ml平均300微米的肝素化珠至筒中并允許其沉降。然后加入具有等量肝素化珠、PEI珠和甘露糖功能化珠的200ml珠至筒中。然后用最后的50ml肝素化珠將筒填滿至頂部。然后密封筒,珠的緊密填充維持吸附介質(zhì)的分層結(jié)構(gòu)。在此筒中,55.6%的珠是肝素化的,22.2%是PEI珠,和22.2%是甘露糖功能化的。
在以下的權(quán)利要求書中進(jìn)一步描述本發(fā)明的實(shí)施方案。
- 還沒有人留言評論。精彩留言會獲得點(diǎn)贊!