腸道吻合環的制作方法
本發明屬于醫療器械技術領域,具體涉及一種腸道吻合環。
背景技術:
腹部外科手術進行腸道吻合是常見的術式,一臺手術甚至要做好幾個腸道吻合,吻合器械需求量大。且隨著人們對健康的要求增高,對醫療器械的要求進一步增加。
目前國際上所使用的腸吻合技術主要分為以下四種:手工絲線縫合、吻合器、直線切割閉合器和無線吻合技術。手工絲線吻合的缺點很多,不僅操作復雜、費事,而且吻合質量難以達到吻合器的水平,故吻合口瘺、出血、狹窄、吻合口炎等并發癥的發生機率居高不下。吻合器雖然操作簡單,可縮短吻合時間,且并發癥的發生機率較低,但是在做兩段端腸吻合時,若選擇端端吻合,則需要在吻合口下方另做一切口方能進行吻合,這一切口增加了手術的創傷和時間,同時增加了感染的機率;若選擇端側吻合,還需要更換釘倉來閉合其段端,而且吻合釘永遠留在體內,有引起相關并發癥可能。直線切割閉合器在行腸吻合時要求要游離較長的腸管,故使用有局限性,在游離較困難的十二指腸、直腸等位置不宜使用,而且吻合的過程中有盲端形成,增加了腸瘺及吻合口出血的風險。
現在最常使用的無線吻合技術系Hardy等人于1985年首次推出的一種生物可吸收吻合環(BAR),該吻合環的商品名是ValtracTM,由可吸收降解的聚甘醇碳酸和硫酸鋇所組成。生物可吸收腸吻合環(BAR)相比以上幾種吻合技術具有較大的優勢,主要體現在以下幾個方面:(1)最快捷吻合方式。步驟少,效率高,學習掌握快,大約只需要10例左右的經驗積累,平均完成一個吻合口時間為17±6(min),明顯快于手工絲線吻合的時間(34±6min),大大減少了手術和麻醉時間,利于術后患者的恢復,它是一種可以標準化的腸道吻合技術。(2)最理想的吻合。閉合后使漿膜之間的組織緊密黏連,從而達到吻合口愈合的目的。無縫線吻合技術減少了縫線、吻合釘所帶來的消化道壁的損傷,同時無異物反應,吻合口的肉芽組織較少,只有輕微的組織壞死,所形成的疤痕相應減少。無縫線,無針眼,抗滲漏能力強,胃腸道吻合口創傷愈合所需的2-3周內保證吻合口密閉,比傳統手工縫合和使用吻合器吻合有更高強度抗消化道“暴裂”的能力。有報道稱,吻合的部位能夠承受70mmHg的壓力而不發生吻合口破裂。能夠擴張消化道,手工、吻合器吻合均無此功能,作為消化道內支架是最好的消化道擴張器,擴張較其它器械安全、持續、充分,也可以有效的防止吻合口的狹窄。(3)最靈活的運用,可進行端端、端側及側側吻合。線性吻合器吻合多為端側吻合,有盲端形成,可導致盲袢綜合征,而BAR為端端吻合,符合腸道的正常生理,同時解決了小腸和結腸端端吻合時由于管徑不同而產生的吻合困難的問題。(4)可吸收。術后14-30d裂解碎片隨糞便自行排出,體內無遺物,無吻合釘,避免對將來行CT和MRI的影響,以及避免術后腸道狹窄,降低感染幾率。(5)比行腸道端側吻合所需要的吻合器加閉合器更經濟實惠,減輕患者及其家庭的醫療負擔,創造良好的社會效益。(6)通過X線顯影,確認吻合環的形狀和位置,可以隨時了解吻合環的位置以及降解情況。吻合環在國內外所有醫院、醫療機構的使用報道中,術后切口感染率、吻合口出血、吻合口瘺和梗阻的發生率與傳統手工縫合及使用吻合器吻合相比,無統計學差異,是一門安全可行的吻合技術,其作用已經得到全世界胃腸外科醫生的廣泛認可。但是,現有的腸道吻合環仍然存在操作比較復雜、連接可靠性有待進一步提高、用料較多、支撐能力強不夠、抗爆裂性能不夠好等缺陷,還有必要進一步提高腸道吻合環的上述各項性能。
鎂合金是近年來比較受到關注的生物可降解材料,部分學者對它在骨科、心血管科、整形外科、牙科等方面的應用做了不少的研究,取得了一系列進展。目前已經有鎂合金血管內支架應用于臨床。2006年,德國的Biotronik公司在全球首先開發了鎂合金生物可吸收血管內支架,在比利時ST-Blasius醫院首次用于人體。該支架在植入的2-3個月內發生了降解,同時減少了血管再狹窄等并發癥的發生。2007年Erbel發表了使用該公司所開發的可吸收鎂合金血管支架對63個患者進行心臟冠狀動脈支架植入手術的臨床實驗報告,證明了鎂合金支架臨床應用的可行性。鎂合金較高分子材料具有更好的生物相容性、可調控的降解性、更好的力學性能、更低廉的價格、制備載藥涂層能力、具有抗菌性能等優勢。然而,現有的鎂合金材料作為腸道吻合環其耐腐蝕性能和力學性能還有待進一步提高。
技術實現要素:
本發明所要解決的技術問題是,克服以上背景技術中提到的不足和缺陷,提供一種操作簡便、連接穩定可靠、用料少的腸道吻合環。
為解決上述技術問題,本發明提出的技術方案為:
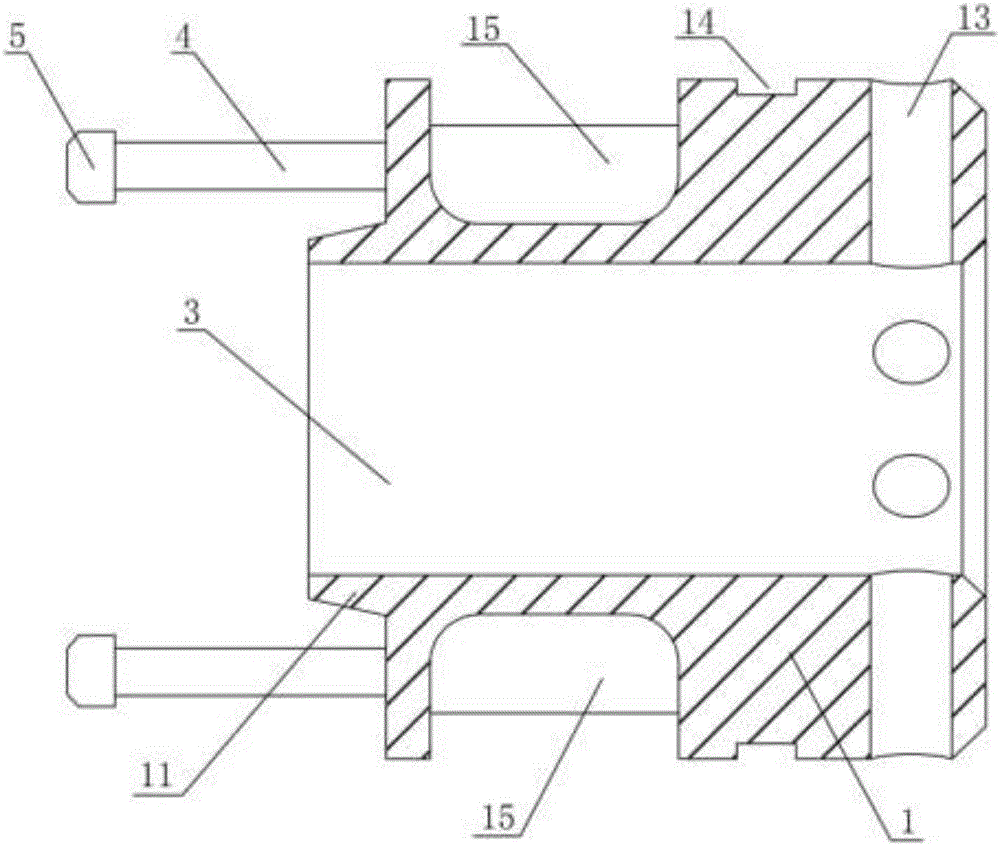
一種腸道吻合環,包括相互吻合的第一半環和第二半環,所述第一半環和第二半環的內圈為腸道通道,所述第一半環的一端設有彈性導套,所述彈性導套的端部設有厚度大于彈性導套主體部分的倒鎖頭,所述第二半環的一端開有與所述彈性導套相匹配的軸向吻合環槽,所述軸向吻合環槽的底部設有與所述倒鎖頭相匹配的倒鎖槽,第一半環和第二半環通過所述倒鎖頭和倒鎖槽相互卡接組成所述腸道吻合環。
作為對上述技術方案的進一步改進:
優選的,所述軸向吻合環槽為帶有坡度的環槽,軸向吻合環槽的外周直徑由軸向吻合環槽的開口端向內逐漸減小,軸向吻合環槽的縱向截面呈楔形。
優選的,所述彈性導套上開有十字槽口,所述十字槽口將彈性導套分為四瓣,所述軸向吻合環槽的內側設有與所述十字槽口相匹配的十字導向筋板。
優選的,所述第二半環上于所述軸向吻合環槽和腸道通道之間形成吻合筒,所述第一半環上于所述彈性導套的內側設有沿所述腸道通道向所述倒鎖頭一端延伸的錐套,所述吻合筒的端部開有與所述錐套相匹配的錐度內孔。
優選的,所述第一半環上于遠離所述彈性導套的一端開有多個第一減重通孔,多個所述第一減重通孔沿第一半環的周向均布設置;所述第一半環上于所述第一減重通孔和所述彈性導套之間開有第一環形凹槽。
優選的,所述第一半環上于所述第一環形凹槽和所述彈性導套之間開有多個減重槽,多個所述減重槽沿第一半環的周向均布設置。
優選的,所述第二半環上于遠離所述軸向吻合環槽的一端開有多個第二減重通孔,多個所述第二減重通孔沿第二半環的周向均布設置;所述第二半環上于所述第二減重通孔和所述軸向吻合環槽之間開有第二環形凹槽。
優選的,所述腸道吻合環的材質為可生物降解的Mg-Zn-Sr合金;所述Mg-Zn-Sr合金中Zn的質量分數為4%,Sr的質量分數為0.1%-0.5%,余量為Mg。
本發明采用Mg-Zn-Sr合金材料來代替傳統的高分子材料(聚甘醇碳酸)制作出性能更加優良的腸道吻合環。它在具備了ValtracTM的全部優點的同時具有以下幾點優勢:(1)取材廣泛,價格更加低廉,鎂合金(鑄態)<100元/kg,而聚乳酸(原材料)50,000元/kg。(2)鎂鋅鍶作為體內的必需的微量元素,對人體完全無害,作為生物材料較聚甘醇碳酸和硫酸鋇所制成的吻合環具有更好的生物相容性。(3)Mg-Zn-Sr合金做成的吻合環具有更好的力學性能,在早期能起到更好的支撐作用和防爆裂能力。Sr元素的加入能夠顯著細化鑄態Mg-Zn-Sr合金的晶粒,并有Mg17Sr2中間相沿晶界析出。微量Sr元素的添加可降低鎂合金的縮孔數量,改善鎂合金的力學性能。Sr元素的加入能夠通過細晶效應、固溶強化和消除顯微縮孔等作用顯著提高鎂合金的力學性能。Sr元素的加入可細化晶粒,增強保護膜的穩定性,進而增強鎂合金的耐腐蝕性能。(4)Mg-Zn-Sr合金可通過調整表面改性、合金成分和比例來調控降解速度,可制作出不同降解速度的吻合環。例如大腸的愈合一般慢于小腸,可通過對合金比例的調控制作出適合不同降解時間需要的吻合環,達到“貼身設計”的效果,且更加安全。(5)鎂金屬對大腸桿菌、金黃色葡萄球菌、綠膿桿菌等細菌的具有一定抑菌作用,鋅金屬也具有抑菌的效果,氧化鋅被認為是安全的消毒劑。Mg-Zn-Sr合金具有良好的抗菌性能。細菌感染是腸瘺發生和發展的主要原因之一,尤其是大腸,術前腸道準備包括機械性腸道清潔和抗生素準備兩部分,它是保證手術后吻合口一期愈合的關鍵,在腸道準備不充分的情況下手術行腸吻合往往可導致腸瘺的發生,Mg-Zn-Sr合金的抑菌作用對于腸道吻合口的愈合而言無疑是一大得天獨厚的有利因素。(6)制作藥物涂層的可行性也是該Mg-Zn-Sr合金作為腸道吻合環材料的優勢之一。本實施例的腸道吻合環在Mg-Zn-Sr合金表面可以制備攜帶依維莫司的PLGA涂層,并且其為面降解,保證了藥物的持續釋放。
本發明所用的Mg-Zn-Sr合金中Zn的質量分數為4%,Sr的質量分數為0.1%-0.5%,余量為Mg,Mg-Zn-Sr合金中Sr元素若加入過多,則Mg17Sr2中間相也會增加,會產生越來越多的微電偶腐蝕,進而降低Mg-Zn-Sr合金的耐腐蝕性能。本發明所用的Mg-Zn-Sr合金中Zn的質量分數為4%,Sr的質量分數為0.1%-0.5%,余量為Mg,Sr元素采用上述添加量可以最大限度地增強鎂合金的耐腐蝕性能。
優選的,所述Mg-Zn-Sr合金由純度≥99.9%的鎂錠、純度≥99.9%的鋅錠和Mg-25wt%Sr中間合金在CO2和SF6保護氣氛中,于750℃-800℃條件下熔煉得到。
優選的,所述腸道吻合環由所述Mg-Zn-Sr合金經鍛壓成型得到。
與現有技術相比,本發明的優點在于:
(1)該腸道吻合環采用可生物降解的Mg-Zn-Sr合金為材料,通過鍛壓成型工藝制備得到,該Mg-Zn-Sr合金中Zn的質量分數為4%,Sr的質量分數為0.1%-0.5%,余量為Mg。采用該新型Mg-Zn-Sr合金材料不僅成本低,生物相容性好,力學性能好,耐腐蝕性能優良,具有一定的抑菌效果,而且可在該Mg-Zn-Sr合金的表面上制作藥物涂層(如攜帶依維莫司的PLGA涂層)。
(2)本發明的腸道吻合環采用機械鎖扣原理,利用彈性導套與軸向吻合環槽的配合以及倒鎖頭與倒鎖槽的配合,起到軸向鎖緊作用,操作簡便、連接穩定可靠。
(3)將軸向吻合環槽設置為帶有坡度的環槽,在對接時,該坡度使得彈性導套向內發生彈性變形,當彈性導套運動到倒鎖槽的位置時,將倒鎖頭卡住,進行軸向鎖緊,更加方便進行對接。
(4)通過十字槽口將彈性導套分為四瓣,使得彈性導套更容易向內發生彈性變形,在軸向吻合環槽的內側設置與十字槽口相匹配的十字導向筋板,在第一半環和第二半環卡接時,該十字導向筋板與十字槽口相配合,起到周向固定作用,限制腸道吻合環的周向扭動,進一步提高了連接的穩定性。
(5)采用錐套和錐度內孔的錐形配合,進一步提高了第一半環和第二半環對接的牢固性,使得其連接更為可靠,接口之間配合更加緊密,并且使得第一半環和第二半環的腸道通道緊密對接,提高了對接的密封性,降低了腸液從兩段腸道通道的對接處漏出的可能性。
(6)通過在第一半環上設置第一減重通孔、第一環形凹槽和減重槽,有效降低了第一半環的重量,并且節省了材料;在第二半環上設置第二減重通孔和第二環形凹槽,降低了第二半環的重量,節省了材料。
附圖說明
為了更清楚地說明本發明實施例或現有技術中的技術方案,下面將對實施例或現有技術描述中所需要使用的附圖作簡單地介紹,顯而易見地,下面描述中的附圖是本發明的一些實施例,對于本領域普通技術人員來講,在不付出創造性勞動的前提下,還可以根據這些附圖獲得其他的附圖。
圖1為本發明腸道吻合環的剖視示意圖。
圖2為本發明腸道吻合環中第一半環的剖視示意圖。
圖3為本發明腸道吻合環中第一半環倒鎖頭一端的結構示意圖。
圖4為本發明腸道吻合環中第二半環的剖視示意圖。
圖5為本發明腸道吻合環中第二半環軸向吻合環槽一端的結構示意圖。
圖例說明:
1、第一半環;2、第二半環;3、腸道通道;4、彈性導套;5、倒鎖頭;6、軸向吻合環槽;7、倒鎖槽;8、十字槽口;9、十字導向筋板;10、吻合筒;11、錐套;12、錐度內孔;13、第一減重通孔;14、第一環形凹槽;15、減重槽;16、第二減重通孔;17、第二環形凹槽。
具體實施方式
為了便于理解本發明,下文將結合說明書附圖和較佳的實施例對本發明作更全面、細致地描述,但本發明的保護范圍并不限于以下具體的實施例。
需要特別說明的是,當某一元件被描述為“固定于、固接于、連接于或連通于”另一元件上時,它可以是直接固定、固接、連接或連通在另一元件上,也可以是通過其他中間連接件間接固定、固接、連接或連通在另一元件上。
除非另有定義,下文中所使用的所有專業術語與本領域技術人員通常理解的含義相同。本文中所使用的專業術語只是為了描述具體實施例的目的,并不是旨在限制本發明的保護范圍。
除非另有特別說明,本發明中用到的各種原材料、試劑、儀器和設備等均可通過市場購買得到或者可通過現有方法制備得到。
實施例1:
本發明腸道吻合環的一種實施例,該腸道吻合環的材質為可生物降解的Mg-Zn-Sr合金;該Mg-Zn-Sr合金中Zn的質量分數為4%,Sr的質量分數為0.1%,余量為Mg。該Mg-Zn-Sr合金由純度≥99.9%的鎂錠、純度≥99.9%的鋅錠和Mg-25wt%Sr中間合金在CO2和SF6保護氣氛中(鎂在高溫下容易被氧化且易燃,需在保護氣氛下熔煉),于750℃-800℃條件下熔煉得到。該腸道吻合環由上述Mg-Zn-Sr合金經鍛壓成型得到。
體外耐腐蝕性能測試:
采用人工模擬體液(SBF)浸泡試樣進行體外腐蝕試驗,先配制人工模擬體液,在交換蒸餾水中依次加入NaCl、NaHCO3、KCl、K2HPO4.3H2O、MgCl2.6H2O、CaCl2、Na2SO4、三羥基甲基胺烷、HCl,配備出無色、透明的SBF溶液,確保無沉淀,且達到以下標準:
表1人工模擬體液中各離子濃度(mmol/L)
制備后備用,用于體外腐蝕實驗。
體外耐腐蝕性能測試的具體方法采用浸泡失重法和電化學腐蝕試驗。
其中,浸泡失重法的具體步驟如下:
(1)樣品的預處理:用鐵砂紙按順序從240#,600#,1000#上依次將樣品與SBF接觸面打磨光滑,然后浸入丙酮溶液中超聲波清洗10分鐘,再把試樣放在蒸餾水中超聲清洗3分鐘,最后真空干燥箱中干燥。
(2)用游標卡尺測量試樣的長、寬、高,計算其表面積A(cm2)。
(3)用精確度為0.1毫克的電子天平稱量試樣的質量,記為原始質量m0。取三個試樣,分標為A、B、C三組,一個瓶中放一個試樣。按照樣品表面積(cm2):模擬體液體積(mL)=1:20的比例,將合金試樣浸入SBF中,燒杯密閉以防止蒸發,溶液溫度采用水浴箱控制在37±0.5℃,每24小時更換一次SBF。
(4)試樣浸泡5天后取出,然后在沸騰的20%鉻酸和1%硝酸銀的混合溶液中浸泡清除表面的腐蝕產物,再次丙酮和無水乙醇中超生清洗10分鐘,干燥后再用電子天平稱量試樣的重量,記為浸泡后質量m1,用下面公式計算出失重速率CR(mg/cm2/d):
CR=(m0-m1)/(A*t)
式中m0和m1分別是浸泡前后的質量,單位為mg,t為浸泡時間,單位為天(d),A為試樣浸泡前的原始面積,單位為cm2。合金的腐蝕速率實驗結果為三個試樣的平均值。腐蝕速率代表了金屬的耐腐蝕性能,即腐蝕速率越小金屬的耐腐蝕性能越強。具體測試結果見表2。
電化學腐蝕試驗采用CHI660C電化學工作站,采用了三電極體系,鉑電極為對極,飽和甘汞電極為參比電極,將合金樣品暴露出一個圓形工作面(1cm2)作為工作電極,接觸SBF中,其余各面用樹脂密閉,并引出一根銅導線構成工作電極。SBF的溫度保持在37±0.5℃。采用線性極化掃描,在開路電位±200mV區間,以2mV/s進行線性掃描獲得Tafel曲線。根據曲線得到各合金的腐蝕電流和腐蝕速率,來比較各種合金的耐腐蝕性能。具體測試結果見表3。
實施例2:
本發明腸道吻合環的一種實施例,該腸道吻合環的材質為可生物降解的Mg-Zn-Sr合金;該Mg-Zn-Sr合金中Zn的質量分數為4%,Sr的質量分數為0.4%,余量為Mg。該Mg-Zn-Sr合金由純度≥99.9%的鎂錠、純度≥99.9%的鋅錠和Mg-25wt%Sr中間合金在CO2和SF6保護氣氛中,于750℃-800℃條件下熔煉得到。該腸道吻合環由上述Mg-Zn-Sr合金經鍛壓成型得到。體外耐腐蝕性能測試采用與實施例1同樣的方法進行。浸泡失重法的具體測試結果見表2,電化學腐蝕試驗的具體測試結果見表3。
對比例1:
本發明腸道吻合環的一種實施例,該腸道吻合環的材質為可生物降解的Mg-Zn-Sr合金;該Mg-Zn-Sr合金中Zn的質量分數為4%,Sr的質量分數為1%,余量為Mg。該Mg-Zn-Sr合金由純度≥99.9%的鎂錠、純度≥99.9%的鋅錠和Mg-25wt%Sr中間合金在CO2和SF6保護氣氛中,于750℃-800℃條件下熔煉得到。該腸道吻合環由上述Mg-Zn-Sr合金經鍛壓成型得到。體外耐腐蝕性能測試采用與實施例1同樣的方法進行。浸泡失重法的具體測試結果見表2,電化學腐蝕試驗的具體測試結果見表3。
對比例2:
本發明腸道吻合環的一種實施例,該腸道吻合環的材質為可生物降解的Mg-Zn合金;該Mg-Zn合金中Zn的質量分數為4%,余量為Mg。該Mg-Zn合金由純度≥99.9%的鎂錠和純度≥99.9%的鋅錠在CO2和SF6保護氣氛中,于750℃-800℃條件下熔煉得到。該腸道吻合環由上述Mg-Zn合金經鍛壓成型得到。體外耐腐蝕性能測試采用與實施例1同樣的方法進行。浸泡失重法的具體測試結果見表2,電化學腐蝕試驗的具體測試結果見表3。
表2各實施例和對比例鎂合金的平均失重速率
由表2可見,Sr元素的添加明顯提高了鎂合金的耐腐蝕性能,其中實施例1所得Mg-Zn-Sr合金的腐蝕速率最小,耐腐蝕性能最好。而隨著Sr元素的添加量加大(實施例2和對比例1),Mg-Zn-Sr合金的腐蝕速率增大,Mg-Zn-Sr合金的腐蝕速率較Mg-Zn合金(對比例2)的腐蝕速率小。說明在Mg-Zn-Sr合金中Zn的質量分數為4%,Sr的質量分數為1%,余量為Mg的組分配比時合金的耐腐蝕性能最好。
表3各實施例和對比例的電化學腐蝕試驗數據
擊破電位是極化曲線上出現突然上升的一個轉折點,意味著局部腐蝕的開始。所以擊破電位越正意味著局部腐蝕越不易發生,形成的表面氧化膜越穩定,耐腐蝕性就越強。由表3可見,由實施例1、實施例2、對比例1到對比例2,擊破電位越來越負,表明實施例1的Mg-Zn-Sr合金陽極曲線中的鈍化平臺最寬廣,說明該Mg-Zn-Sr合金表面形成保護膜最為穩定,局部腐蝕開始的時間最晚,最不易被腐蝕。
實施例3:
如圖1至圖5所示,本發明腸道吻合環的一種實施例,該腸道吻合環的材質使用上述實施例1或實施例2中的Mg-Zn-Sr合金,該腸道吻合環主要包括相互吻合的第一半環1和第二半環2。使用時將兩段待吻合的腸道分別套接在該第一半環1和第二半環2,然后將第一半環1和第二半環2套接吻合即可將兩段腸道進行對接,使兩段腸道的組織緊密黏連。該第一半環1和第二半環2的內圈為腸道通道3,將第一半環1和第二半環2吻合對接后通過該腸道通道3可保持腸道內物質通暢。第一半環1的一端設有彈性導套4,該彈性導套4的端部設有厚度大于彈性導套4主體部分的倒鎖頭5,利用該倒鎖頭5將第一半環1和第二半環2卡接。第二半環2的一端開有與彈性導套4相匹配的軸向吻合環槽6,該軸向吻合環槽6的底部設有與倒鎖頭5相匹配的倒鎖槽7,第一半環1和第二半環2通過倒鎖頭5和倒鎖槽7相互卡接組成腸道吻合環。倒鎖頭5上帶有倒角,使得倒鎖頭5更容易進入軸向吻合環槽6,通過彈性導套4與軸向吻合環槽6的配合以及倒鎖頭5與倒鎖槽7的配合,起到軸向鎖緊作用,操作簡便,連接穩定可靠。
本實施例中,軸向吻合環槽6為帶有坡度的環槽,軸向吻合環槽6的外周直徑由軸向吻合環槽6的開口端向內逐漸減小,軸向吻合環槽6的縱向截面呈楔形。將軸向吻合環槽6設置為帶有坡度的環槽,對接時,倒鎖頭5沿著帶有坡度的軸向吻合環槽6前行,坡度使彈性導套4向內發生彈性變形,運動到倒鎖槽7位置時,將倒鎖頭5卡住,軸向鎖緊,更加方便進行對接。
本實施例中,在彈性導套4上開有十字槽口8,該十字槽口8將彈性導套4分為四瓣,使得彈性導套4更容易向內發生彈性變形。軸向吻合環槽6的內側設有與該十字槽口8相匹配的十字導向筋板9。在第一半環1和第二半環2卡接時,該十字導向筋板9與十字槽口8相配合,起到周向固定作用,限制腸道吻合環的周向扭動。
本實施例中,第二半環2上于軸向吻合環槽6和腸道通道3之間形成吻合筒10,第一半環1上于彈性導套4的內側設有沿腸道通道3向倒鎖頭5一端延伸的錐套11,吻合筒10的端部開有與該錐套11相匹配的錐度內孔12。采用錐套11和錐度內孔12的錐形配合,進一步提高了第一半環1和第二半環2對接的牢固性,使得其連接更為可靠,接口之間配合更加緊密,并且使得第一半環1和第二半環2的腸道通道3緊密對接,提高了對接的密封性,降低了腸液從兩段腸道通道3的對接處漏出的可能性。
本實施例中,第一半環1上于遠離彈性導套4的一端開有多個第一減重通孔13,多個第一減重通孔13沿第一半環1的周向均布設置,第一減重通孔13的數量優選為6個。如此,可減少材料使用量,并減輕腸道吻合環的重量。第一半環1上于第一減重通孔13和彈性導套4之間開有第一環形凹槽14,進一步減輕了第一半環1的重量,節省了材料,并且設置該第一環形凹槽14可方便將腸道鎖緊固定在第一半環1上。第一半環1上于第一環形凹槽14和所述彈性導套4之間開有多個減重槽15,多個減重槽15沿第一半環1的周向均布設置,更進一步地減輕了第一半環1的重量。
本實施例中,第二半環2上于遠離軸向吻合環槽6的一端開有多個第二減重通孔16,多個第二減重通孔16沿第二半環2的周向均布設置,第二減重通孔16的數量優選為6個,可減少材料用量,并減輕第二半環2的重量。第二半環2上于第二減重通孔16和軸向吻合環槽6之間開有第二環形凹槽17,進一步降低了第二半環2的重量。
以下以豬大腸對該腸道吻合環的具體使用方法進行說明:
(1)將一截豬的大腸剪成兩截,準備進行腸吻合;
(2)剔除兩段端1cm距離內的脂肪垂和系膜以便于吻合,在大腸的段端做手工荷包縫合,需做連續縫合,針間距3-4毫米,距離腸斷端2-3毫米縫合;
(3)將第一半環1和第二半環2的一端分別塞入兩段已經做好荷包縫合的腸管;
(4)將荷包線收緊打結,將兩截豬大腸分別固定在腸道吻合環的第一環形凹槽14和第二環形凹槽17上;
(5)將做好荷包縫合的第一半環1和第二半環2卡接對合,將兩段大腸連接;
(6)關閉吻合環,環體閉合時,指尖要用力均勻,聽到“吧嗒”一聲時證明完成吻合,之后對漿膜進行縫合加固。術后封閉腸道一端,另一端注水及打氣達到一定的壓力后吻合口依舊牢靠,證明了該吻合環的防爆裂能力較好。
以上所述僅為本發明的優選實施例而已,并不用于限制本發明,對于本領域的技術人員來說,本發明可以有各種更改和變化。凡在本發明的精神和原則之內,所作的任何修改、等同替換、改進等,均應包含在本發明的保護范圍之內。
- 還沒有人留言評論。精彩留言會獲得點贊!