一種PEGMa修飾MoOx與溫敏PNIPAM微凝膠的組裝體系及其制備方法與流程
本發明涉及一種微凝膠的組裝體系及其制備方法。
背景技術:
根據世界癌癥報道,癌癥始終是主要致死疾病之一,平均每年約有1000萬新增病例,而經過常規的手術切除,放療和化療等手段治療后,平均生存期也僅為6-24個月。且常規治療有很多的弊端,如殺死正常組織細胞,增加腫瘤細胞的代謝率和破壞機體免疫功能等。近些年,越來越多的人開始注意使用微創性的光熱療法來治療腫瘤,即用一定波長的近紅外光照射光熱劑將光能轉換為熱能局部加溫殺死腫瘤細胞。光熱治療可以避免常規療法的不足,還會使治療過程簡便易操作,治療后并發癥較少,住院時間縮短。
光熱治療技術的實際應用中主要是借助對人體沒有傷害的近紅外光輻照光熱劑從而將光能轉化為熱能殺死癌細胞。因此,光熱治療技術的關鍵在于光熱劑,也就是光熱轉換材料。目前人們已經開發出一系列在近紅外光范圍有強吸收的納米材料,如含貴重金屬的納米粒子(Au、Ag)、有機聚合物納米材料、半導體光熱材料以及碳基納米材料。為了進一步提高光熱治療效果,人們采用光熱化學聯合治療技術開發出多種用于聯合治療試劑包括聚苯胺/聚異丙基丙烯酰;金納米粒/聚異丙基丙烯酰胺-丙烯酸;石墨烯/二氧化硅/聚異丙基丙烯酰胺-丙烯酸等;然而這些聯合治療試劑對載入的藥物難以實現精確可控的靶向釋放,且會在人體內積累形成潛在毒性。
技術實現要素:
本發明目的是為了解決了現有光熱轉換材料對載入的藥物難以實現精確可控的靶向釋放,且存在毒副作用的問題,而提供一種PEGMa(甲基丙烯酸酯)修飾MoOx(氧化鉬)與溫敏PNIPAM(聚異丙基丙烯酰胺)微凝膠的組裝體系及其制備方法。
一種PEGMa修飾MoOx與溫敏PNIPAM微凝膠的組裝體系,其化學式為PEGMa-MoOx/P(NIPAM-co-MAA)。
上述PEGMa修飾MoOx與溫敏PNIPAM微凝膠的組裝體系的制備方法,按照以下步驟進行的:
一、將0.08~0.09g的鉬酸銨在攪拌的條件下溶解在15~25ml的去離子水中;
二、將0.4~0.6g甲基丙烯酸酯溶解于10~15ml無水乙醇溶液;
三、將步驟一和步驟二中所得溶液混勻,然后用水熱法在160℃恒溫條件下反應10~14h,對沉淀物進行離心分離,經洗滌、干燥后得到改性氧化鉬PEGMa-MoOx;
四、將上述PEGMa-MoOx溶解在盛有100ml去離子水的燒杯中,攪拌30min后轉移到250ml圓底燒瓶中,然后加入1.5~2.0g的N-異丙基丙烯酰胺(NIPAM)、82~328μL甲基丙烯酸(MAA)、0.05~0.07g N,N-亞甲基雙丙烯酰胺(MBA)和0.05~0.06g十二烷基硫酸鈉(SDS)并混勻,在通氮氣的條件下以1~5℃/min的升溫速度加熱到70℃,然后加入0.2~0.3g過硫酸銨(APS),使反應在70℃下聚合6h,于8000r/min條件下離心10min,經洗滌、透析、干燥后獲得PEGMa-MoOx/P(NIPAM-co-MAA),即完成PEGMa修飾MoOx與溫敏PNIPAM微凝膠的組裝體系的制備。
本發明的優點是:
1、本發明制備方法具有簡單可行,成本低廉,反應條件溫和,易操作,光熱轉換納米粒子粒徑可控且分布均勻等特點。通過該方法制備得到PEGMa-MoOx/P(NIPAM-co-MAA),它是具有光熱化學聯合治療效果的近紅外光刺激可控響應性光熱轉換微凝膠組裝體系,在808nm激光器照射下,微凝膠中改性氧化鉬納米粒子可將光能轉換為熱能,負載抗癌藥物后在病灶處燒蝕細胞的同時還可以使具有靶向作用的微凝膠發生可控受熱收縮,可將內部包覆的藥物可控釋放于病灶處,殺死腫瘤細胞,達到光熱化學聯合治療的效果。
2、本發明采用甲基丙烯酸酯修飾改性氧化鉬,使氧化鉬被部分還原能以多種價態存在,從而實現光熱轉換的性能。同時使改性后的氧化鉬帶有雙鍵可以與溫敏單體進行復合。通過水熱法制備得到的改性氧化鉬粒徑分布較均勻且光熱轉換效果較佳。
3、本發明采用鉬酸銨和甲基丙烯酸酯為主要反應物制備改性氧化鉬,使氧化鉬得以應用于生物醫藥領域的同時,可進一步與具有雙鍵的功能性聚合物反應,實現各種兼具光熱治療效果的其他多功能治療的作用。
4、本發明將改性后的氧化鉬與溫敏單體(NIPAM),親水性單體(MAA)復合的制備方案,可使復合微凝膠實現靶向定位的作用。由于腫瘤細胞的微環境偏酸溫度也相對較高,因此通過復合MAA后可以使復合凝膠穩定存在于腫瘤細胞中,同時,在808nm激光器照射后復合微凝膠除了燒蝕細胞外還能體積收縮,實現靶向釋藥。通過調節激光強度和照射時間能精確控制藥物的釋放量及釋放速率。優于單一的光熱治療或化療的效果,無副作用。
5、本發明中改性氧化鉬能在PH為7-8的人體正常生理環境中自動降解,而在PH為5-6的偏酸性條件下穩定存在,因此在實現光熱化學治療的效果后,改性氧化鉬能在24h內自動降解,排除體外,避免納米粒子在體內積累,產生毒副作用。
6、本發明所選用的溫敏單體及親水性單體制備的微凝膠生物相容性良好,且復合改性氧化鉬后復合微凝膠的光熱轉換效率也較高,制備方法簡單,成本低廉,毒副作用小,具有極高的實用性。
附圖說明
圖1為實施例中PEGMa-MoOx的SEM圖;
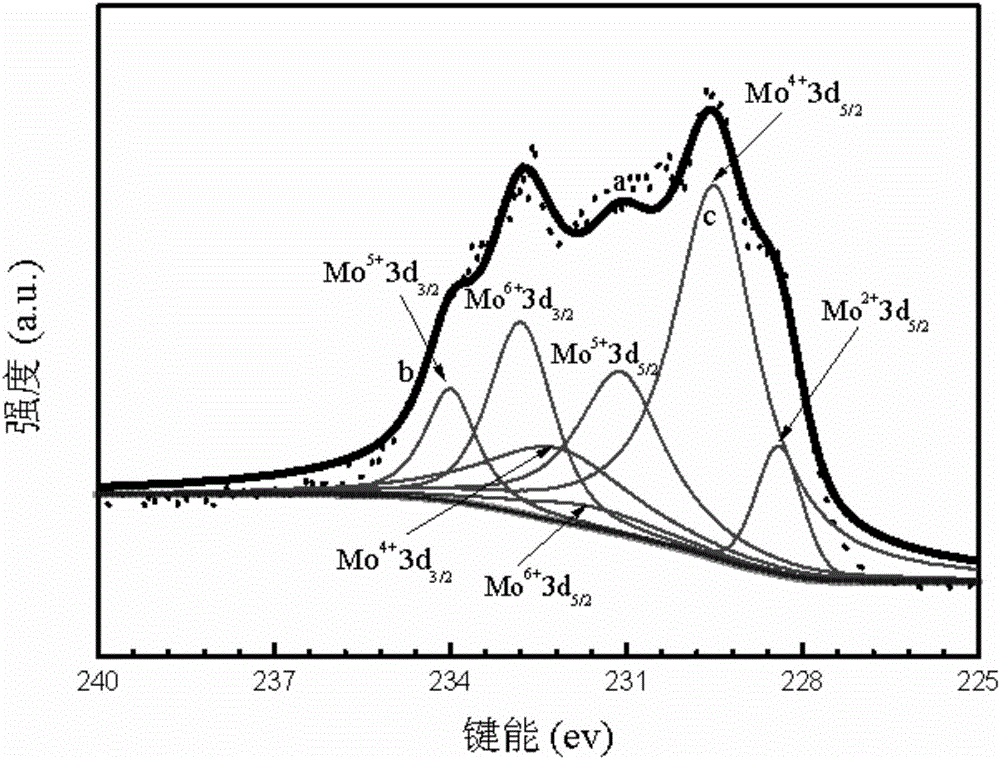
圖2為實施例中PEGMa-MoOx的XPS圖,其中a曲線表示原始數據,b曲線表示擬合曲線,c曲線表示背景線;
圖3為實施例中PEGMa-MoOx的溫度-輻照時間曲線圖,其中■表示PEGMa-MoOx,●表示水;
圖4為實施例中MAA的用量為82μL時,PEGMa-MoOx/P(NIPAM-co-MAA)的SEM圖;
圖5為實施例中實施例中MAA的用量為164μL時,PEGMa-MoOx/P(NIPAM-co-MAA)的SEM圖;
圖6為實施例中實施例中MAA的用量為328μL時,PEGMa-MoOx/P(NIPAM-co-MAA)的SEM圖;
圖7為實施例中PEGMa-MoOx/P(NIPAM-co-MAA)的紅外譜圖,其中a曲線表示MAA的用量為82μL,b曲線表示MAA的用量為164μL,c曲線表示MAA的用量為328μL;
圖8為實施例中PEGMa-MoOx/P(NIPAM-co-MAA)的溫度-輻照時間曲線圖▲表示MAA的用量為82μL,●表示MAA的用量為164μL,■表示MAA的用量為328μL。
具體實施方式
本發明技術方案不局限于以下所列舉的具體實施方式,還包括各具體實施方式之間的任意組合。
具體實施方式一:本實施方式一種PEGMa修飾MoOx與溫敏PNIPAM微凝膠的組裝體系,其化學式為PEGMa-MoOx/P(NIPAM-co-MAA)。
具體實施方式二:本實施方式一種PEGMa修飾MoOx與溫敏PNIPAM微凝膠的組裝體系的制備方法,按照以下步驟進行的:
一、將0.08~0.09g的鉬酸銨在攪拌的條件下溶解在15~25ml的去離子水中;
二、將0.4~0.6g甲基丙烯酸酯溶解于10~15ml無水乙醇溶液;
三、將步驟一和步驟二中所得溶液混勻,然后用水熱法在160℃恒溫條件下反應10~14h,對沉淀物進行離心分離,經洗滌、干燥后得到改性氧化鉬PEGMa-MoOx;
四、將上述PEGMa-MoOx溶解在盛有100ml去離子水的燒杯中,攪拌30min后轉移到250ml圓底燒瓶中,然后加入1.5~2.0g的N-異丙基丙烯酰胺、82~328μL甲基丙烯酸、0.05~0.07g N,N-亞甲基雙丙烯酰胺和0.05~0.06g十二烷基硫酸鈉并混勻,在通氮氣的條件下以1~5℃/min的升溫速度加熱到70℃,然后加入0.2~0.3g過硫酸銨,使反應在70℃下聚合6h,于8000r/min條件下離心10min,經洗滌、透析、干燥后獲得PEGMa-MoOx/P(NIPAM-co-MAA),即完成PEGMa修飾MoOx與溫敏PNIPAM微凝膠的組裝體系的制備。
本實施方式步驟三中在160℃恒溫條件下反應12h,沉淀物為黑藍色沉淀。
本實施方式步驟四中氮氣的目的是除去游離的氧氣。
本實施方式步驟四中N,N-亞甲基雙丙烯酰胺作為交聯劑使用;十二烷基硫酸鈉作為表面活性劑使用;過硫酸銨作為引發劑使用。
具體實施方式三:本實施方式與具體實施方式二不同的是:步驟一中將0.0865g的鉬酸銨在攪拌的條件下溶解在20ml的去離子水中。其它步驟及參數與具體實施方式二相同。
具體實施方式四:本實施方式與具體實施方式二或三不同的是:步驟二中將0.5g甲基丙烯酸酯溶解于10ml無水乙醇溶液。其它步驟及參數與具體實施方式二或三相同。
具體實施方式五:本實施方式與具體實施方式二至四之一不同的是:步驟三在160℃恒溫條件下反應12h。其它步驟及參數與具體實施方式二至四之一相同。
具體實施方式六:本實施方式與具體實施方式二至五之一不同的是:步驟三中洗滌是采用去離子水洗滌。其它步驟及參數與具體實施方式二至五之一相同。
具體實施方式七:本實施方式與具體實施方式二至六之一不同的是:步驟三干燥的溫度為50℃。其它步驟及參數與具體實施方式二至六之一相同。
具體實施方式八:本實施方式與具體實施方式二至七之一不同的是:步驟四中加入1.8729g的N-異丙基丙烯酰胺、164μL甲基丙烯酸、0.0618g N,N-亞甲基雙丙烯酰胺和0.055g十二烷基硫酸鈉并混勻。其它步驟及參數與具體實施方式二至七之一相同。
具體實施方式九:本實施方式與具體實施方式二至八之一不同的是:步驟四中在通氮氣的條件下以2℃/min的升溫速度加熱到70℃,然后加入0.288g過硫酸銨。其它步驟及參數與具體實施方式二至八之一相同。
具體實施方式十:本實施方式與具體實施方式二至九之一不同的是:步驟四中洗滌是采用去離子水洗滌。其它步驟及參數與具體實施方式二至九之一相同。
具體實施方式十一:本實施方式與具體實施方式二至十之一不同的是:步驟四中透析是采用截留分子量為8000-14000Da的透析袋透析4天,每天換四次水。其它步驟及參數與具體實施方式二至十之一相同。
具體實施方式十二:本實施方式與具體實施方式二至十一之一不同的是:步驟四中干燥的溫度為50℃。其它步驟及參數與具體實施方式二至十一之一相同。
采用以下實施例驗證本發明的有益效果:
實施例:
一種PEGMa修飾MoOx與溫敏PNIPAM微凝膠的組裝體系的制備方法,按照以下步驟進行的:
一、將0.0865g的鉬酸銨在攪拌的條件下溶解在15~25ml的去離子水中;
二、將0.5g甲基丙烯酸酯溶解于10ml無水乙醇溶液;
三、將步驟一和步驟二中所得溶液混勻,然后用水熱法在160℃恒溫條件下反應12h,對沉淀物進行離心分離,經洗滌、干燥后得到改性氧化鉬PEGMa-MoOx;
四、將上述PEGMa-MoOx溶解在盛有100ml去離子水的燒杯中,攪拌30min后轉移到250ml圓底燒瓶中,然后加入1.8729g的N-異丙基丙烯酰胺(NIPAM)、82μL或者164μl或者328μl甲基丙烯酸(MAA)、0.0618g N,N-亞甲基雙丙烯酰胺(MBA)和0.055g十二烷基硫酸鈉(SDS)并混勻,在通氮氣的條件下以2℃/min的升溫速度加熱到70℃,然后加入0.288g過硫酸銨(APS),使反應在70℃下聚合6h,于8000r/min條件下離心10min,經洗滌、透析、干燥后獲得PEGMa-MoOx/P(NIPAM-co-MAA),即完成PEGMa修飾MoOx與溫敏PNIPAM微凝膠的組裝體系的制備。
本實施例步驟三中在160℃恒溫條件下反應12h,沉淀物為黑藍色沉淀。
本實施例步驟四中氮氣的目的是除去游離的氧氣。
本實施例步驟四中甲基丙烯酸(MAA)的用量82μL或者164μl或者328μl,對應著的MAA摩爾比為變量分別為5,10,20。
本實施例步驟三中改性氧化鉬PEGMa-MoOx從圖1可見,PEGMa改性后的氧化鉬納米粒子分布較均勻,粒徑在140-160nm,且表面粗糙。說明該改性氧化鉬納米粒子具有負載生物大分子的潛能,由于PEGMa的改性,大大提高了其生物相容性,增加了其在生物醫藥方面應用的功能。從圖2可見,232.8,235.5ev所在的峰為Mo6+3d3/2,Mo6+3d3/2;231.1,234.0ev所在的峰為Mo5+3d3/2,Mo5+3d3/2;229.5,232.2ev所在的峰為Mo4+3d3/2,Mo4+3d5/2;228.4,231.6ev所在的峰為Mo2+3d3/2,Mo2+3d3/2;確認各個峰后,發現通過PEGMa改性氧化鉬后,鉬以多中價態存在,對3d峰進行分峰處理的時候就發現加入了+2價態的鍵能位置的數據后擬合較好,峰形基本符合。說明改性氧化鉬中鉬元素以+6,+5,+4價態存在,同時可能有少量的+2價態的鉬存在。正是鉬元素多種價態的存在,使改性氧化鉬能夠吸收近紅外光,將光能轉換為熱能。同時由于多種價態的存在,氧化鉬也具有被還原或是氧化的可能,使其能夠在生物體內降解,并排出體外。
本實施例步驟三中改性氧化鉬PEGMa-MoOx在808nm激光器(1W/cm2)照射下溫度隨時間的變化曲線,見圖3。a曲線表示0.55mg/ml的改性氧化鉬在7min內溫度從31℃升高到50℃左右。溫度升高了21度左右,b曲線表示水在同樣的條件下溫度只升高了4度。說明PEGMa改性氧化鉬較成功,改性氧化鉬能夠將近紅外光的光能轉換為熱能。從溫度升高情況來看,將改性氧化鉬注射到生物體內通過近紅外光照射可以將腫瘤細胞加熱到50℃,從而將癌細胞殺死,實現無副作用的光熱治療腫瘤的效果。
本實施例步驟三中改性氧化鉬PEGMa-MoOx能在PH為7-8的人體正常生理環境中自動降解,而在PH為5-6的偏酸性條件下穩定存在,因此在實現光熱化學治療的效果后,改性氧化鉬能在24h內自動降解,排除體外,避免納米粒子在體內積累,產生毒副作用。
本實施例步驟四中所得PEGMa-MoOx/P(NIPAM-co-MAA),在掃描電子顯微鏡下觀察得到的形貌圖見圖4、圖5和圖6,分別為組裝體系中MAA投入量的摩爾比分別為5,10,20時的形貌圖,圖中復合凝膠的粒徑為300-400nm,近似球形。由于MAA的加入可以使組裝體系更加穩定,而從形貌觀察也發現該復合體系仍然是微凝膠。說明該組裝體系組裝較成功,為后續載藥和光熱化學治療提供了必要條件,同時MAA的加入可以防止該組裝體系在靶向到達腫瘤細胞之前被降解或者失去光熱活性,保證了光熱治療的最佳效果。
本實施例步驟四中所得PEGMa-MoOx/P(NIPAM-co-MAA),其紅外譜圖見圖7,曲線a,b,c分別為組裝體系中MAA投入量的摩爾比分別為5,10,20時的紅外譜圖。圖中3270-1處為-OH鍵的吸收峰,740cm-1處是Mo-O-Mo鍵的伸縮振動峰,970cm-1為C-O-C鍵的伸縮振動峰,1642,1404cm-1處為碳氧雙鍵和碳碳雙鍵的振動峰,1204cm-1為N-H鍵的伸縮振動吸收峰。從紅外譜圖的分析來看,改性氧化鉬與溫敏PNIPAM微凝膠的組裝已經實現,該組裝體系具有更高的生物相容性,并且能夠負載藥物,隨著溫度的變化可以靶向到達腫瘤細胞的位置,經近紅外光照射后殺死腫瘤細胞。
本實施例步驟四中所得PEGMa-MoOx/P(NIPAM-co-MAA),在808nm激光器(1W/cm2)照射下溫度隨時間的變化曲線,見圖8,曲線a,b,c表示組裝體系中MAA投入量的摩爾比分別為5,10,20時的變化曲線。從圖中可以發現三條曲線在7min內溫度都從18℃升高到了34℃左右,溫度升高了16℃左右,但是由于該復合為凝膠的濃度只有0.005mg/ml,比現有其他光熱材料在0.5mg/ml時溫度升高20度左右要高很多,說明該復合體系能夠實現光熱化學聯合治療腫瘤的目標。由于改性氧化鉬能夠在正常的生物體環境中降解排出體外,因此該復合體系在達到光熱治療癌細胞的效果的同時還能避免正常細胞受損。最后還能以較少含量的微凝膠達到較好的光熱治療的目的。
本實施例步驟四中所得PEGMa-MoOx/P(NIPAM-co-MAA),記作NCm。將24mg NCm分散于10mL超純水中,得到的復合微凝膠水溶液放入透析袋(截留分子量為8000-14000)中,并將透析袋置于50.0mL含有抗癌藥物DOX的水溶液(1.0mg/mL)中,于室溫下靜置24h,得到MoOx/P(NIPAM-co-MAA)-DOX載藥微凝膠,它為可控響應性光熱轉換微凝膠組裝體系,可應用于近紅外光熱治,藥物靶向可控釋放,腫瘤的熱化療;MoOx/P(NIPAM-co-MAA)-DOX載藥微凝膠在808nm激光器(1W/cm2)照射下溫度可從18℃升高到34℃,微凝膠中改性氧化鉬納米粒子可將光能轉換為熱能,在病灶處燒蝕細胞的同時還可以使具有靶向作用的微凝膠發生可控受熱收縮,可將內部包覆的藥物可控釋放于病灶處,殺死腫瘤細胞,達到光熱化學聯合治療的效果。
- 還沒有人留言評論。精彩留言會獲得點贊!