一種喜樹堿化合物作為拓撲異構酶抑制劑在治療慢性肝臟疾病藥物中的應用的制作方法
本發明涉及藥物領域,具體涉及一種喜樹堿化合物作為拓撲異構酶抑制劑在治療慢性肝臟疾病藥物中的應用。
背景技術:
肝纖維化是肝臟遭受各種病因引起的慢性損傷后的修復反應,是肝硬化早期的可逆階段;目前唯有通過肝移植對肝硬化進行治療,因此,對肝纖維化的防治極其重要;肝星狀細胞(hepatic stellate cell,HSC)是位于肝臟血竇中一類富含維生素A的間充質細胞;在正常肝臟中肝星狀細胞HSC處于不分裂靜息狀態;當肝臟受損時,肝星狀細胞HSC為各類刺激因素激活、轉變成旺盛增殖和過度合成細胞外基質蛋白的肌成纖維母(myofibroblastic,MF)表型細胞;活化態肝星狀細胞HSC的大量擴增在肝纖維化發生過程中占有非常重要的地位;因此通過抑制炎癥反應、對抗氧化應激、調節相關刺激細胞因子的活性和信號傳導等途徑抑制肝星狀細胞HSC的增殖、活化和誘導其凋亡已經成為治療肝纖維化的重要手段;目前有人嘗試使用紫杉醇、姜黃素、10-羥基喜樹堿(HCPT)和一氧化氮(NO)類等藥物來抑制活化態肝星狀細胞HSC的增殖和細胞外基質ECM的沉積;還有采用RNAi技術沉默I型膠原蛋白基因的報道。
技術實現要素:
本發明的目的在于提供一種喜樹堿化合物作為拓撲異構酶抑制劑在的應用,所述抑制劑能夠抑制活化態肝星狀細胞HSC的糖酵解代謝活動、從而有效逆轉HSC為靜息態表型。
本發明采用的技術方案是:一種喜樹堿化合物作為拓撲異構酶抑制劑在治療慢性肝臟疾病藥物中的應用,該化合物化學式為C20H16N2O4,相對分子量為348.34,CAS號:7689-03-4,該化合物為成都蘭貝植化有限公司產品;該化合物是由珙桐科旱蓮屬植物喜樹的根、皮、果實提取制得的生物堿,由喜樹根或果粉以有機溶劑提取而得,呈淡黃色針狀結晶;其結構式如下所示:
該抑制劑由上述化合物溶于二甲基亞砜組成。
進一步的,所述抑制劑對活化態肝星狀細胞缺氧因子HIF-1-α有抑制作用。
進一步的,所述抑制劑對活化態肝星狀細胞中糖酵解限速酶基因表達有抑制作用。
進一步的,所述抑制劑對肝星狀細胞中糖酵解代謝活動有抑制作用。
進一步的,所述抑制劑對肝星狀細胞從活化態向靜息態表型逆轉有促進作用。
所述抑制劑由以下方法制備,將2mg喜樹堿CPT溶于10ml DMSO溶液中充分溶解制備成原始濃度為200μg/ml的細胞母液;將上述配置好的抑制劑母液用DMSO進行梯度稀釋,使抑制劑的最終濃度分別為:0.25μg/ml、0.125μg/ml 0.062μg/ml、0.031μg/ml、0.016μg/ml、0.008μg/ml、0.004μg/ml、0.002μg/ml。
本發明通過細胞計數試劑盒分析喜樹堿CPT抑制劑的細胞毒性;取和不同濃度的CPT溶液共孵育48小時的大鼠活化態肝星狀細胞株HSC-T6、人乳腺癌細胞株Hela細胞制備總蛋白;然后以蛋白質印跡法Western Blot檢測細胞中α-SMA、PKM2、HIF-1-α蛋白含量;取和CPT共孵育48小時的大鼠活化態肝星狀細胞株HSC-T6和原代活化態HSC細胞,制備細胞總RNA,以QRT-PCR檢測細胞中Pkm、α-Sma、Collagen1a1基因的RNA表達水平;以DMSO和10-羥基喜樹堿HCPT作為藥物處理對照組。
實驗結果表明:低劑量的喜樹堿可以通過削弱活化態肝星狀細胞中缺氧因子HIF-1-α的蛋白水平而抑制其對下游一系列糖酵解相關基因(如Pkm)的轉錄調控活性,進而減退細胞的糖酵解代謝活動,最終抑制細胞中典型肌成纖維母細胞MF表型標記分子基因(如α-Sma)的表達;喜樹堿的這一抑制作用表現出對活化態肝星狀細胞細胞的選擇性;而已報道的抗肝纖維化藥物10-羥基喜樹堿雖然對活化態肝星狀細胞有相當的細胞毒性,但在不高于半抑制濃度(IC50藥物濃度)時并不抑制細胞中缺氧因子HIF-1-α活性和糖酵解限速酶PKM2及MF表型代表標記分子ɑ-SMA的蛋白水平。
本發明的有益效果是:
(1)本發明涉及的抑制劑特異性好,針對性強,能夠通過抑制活化態肝形狀細胞HSC的糖酵解代謝活動有效逆轉HSC為靜息態表型;
(2)本發明涉及的抑制劑作為治療肝纖維化的藥物能夠在引起更低的炎癥反應及毒副作用的情況下達到治療效果;
(3)本發明結構相對簡單,制備方便。
附圖說明
圖1為CPT和HCPT對大鼠肝星狀細胞系HSC-T6細胞生存率的影響。
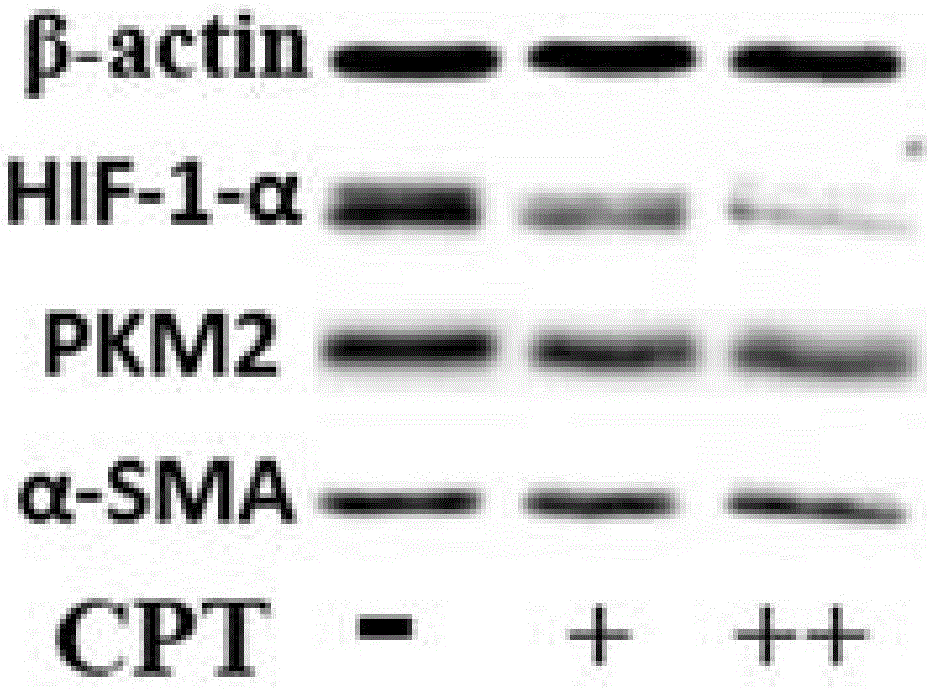
圖2為CPT半抑制濃度和1/2半抑制濃度對大鼠肝星狀細胞系HSC-T6細胞處理48小時后蛋白水平變化。
圖3為CPT半抑制濃度和1/2半抑制濃度對大鼠肝星狀細胞系HSC-T6細胞處理48小時后基因水平變化。
圖4為CPT半抑制濃度和1/2半抑制濃度對大鼠原代肝星狀細胞HSC細胞處理48小時后基因水平變化。
圖5為HCPT半抑制濃度和1/2半抑制濃度對大鼠肝星狀細胞系HSC-T6細胞處理48小時后蛋白水平變化。
圖6為CPT和HCPT半抑制濃度和1/2半抑制濃度對人乳腺癌細胞系Hela細胞處理48小時后蛋白水平變化。
具體實施方式
下面結合附圖和具體實施例對本發明做進一步說明。
本實施例實驗中用到的藥品與試劑如下:
α-SMA單克隆抗體為Abcam公司產品;PKM2單克隆抗體為Cell signaling technology公司產品;HIF-1-α單克隆抗體為Affinity公司產品;β-actin為Genescript公司產品;CCK8(WST)細胞計數試劑盒為北京莊盟國際生物基因科技有限公司產品;喜樹堿CPT、10-羥基喜樹堿HCPT為成都蘭貝植化有限公司產品。
實施例中,所有數據均采用統計軟件SPSS進行統計分析,以t檢驗分析組間差異,計量數據以平均數±標準差表示。
實施例1
喜樹堿抑制劑細胞毒性檢測
取對數生長期大鼠肝星狀細胞株HSC-T6以0.25%胰酶消化,配置成單細胞懸液;再以5×103/孔的細胞密度接種于96孔板置于37℃,5%二氧化碳(CO2)的孵化箱進行培養;一天后采用含有10%血清及1%雙抗的DMEM高糖培養基將200μg/ml喜樹堿溶液稀釋至0.25μg/ml、0.125μg/ml 0.062μg/ml、0.031μg/ml、0.016μg/ml、0.008μg/ml、0.004μg/ml、0.002μg/ml終濃度;羥基喜樹堿溶液稀釋至:0.5μg/ml、0.25μg/ml、0.125μg/ml、0.063μg/ml、0.01μg/ml、0.016μg/ml、0.008μg/ml、0.004μg/ml;吸棄孔板內舊培養基,每孔分別換上100μL以上濃度的喜樹堿和羥基喜樹堿培養基溶液,孵箱中繼續培養48h;以CCK-8法檢測孔內存活的大鼠活化態肝星狀細胞株HSC-T6相對細胞數量并計算細胞的存活率;以未加空白膠束的細胞組為陰性對照,以無細胞的培養基為空白對照;細胞的存活率計算公式如下:
細胞存活率%=(ODsample-ODblank/ODcontrol-ODblank)×100%
在公式中,ODsample為樣品組吸光度值,ODblank為空白對照吸光度值,ODcontrol為陰性對照吸光度值;根據細胞存活情形計算CPT的IC50。
實驗如圖1所示,與不含藥物的陰性對照組相比,CPT和HCPT均對大鼠活化態肝星狀細胞株HSC-T6細胞的生長有顯著抑制作用,隨著藥物濃度的升高細胞生存率下降;根據SPSS軟件擬合得到CPT和HCPT的IC50值分別為0.025μg/ml和0.04μg/ml;CPT較HCPT對大鼠活化態肝星狀細胞株HSC-T6細胞表現出更強的細胞毒性。
實施例2
HSC中缺氧因子HIF-1-ɑ蛋白/糖酵解酶基因/肌成纖維母細胞MF表型分子標記基因的表達
大鼠活化態肝星狀細胞株HSC-T6和體外培養14天的原代HSC,CPT或者HCPT共孵育48小時備用;根據CPT和HCPT細胞毒性檢測結果擬合得到藥物濃度與細胞生存率曲線;計算半抑制濃度IC50值,并設置IC50濃度為高劑量、1/2IC50為低劑量進行RNA分析;
將含有10%血清及1%雙抗的DMEM高糖培養基將200μg/ml濃度溶液稀釋至CPT IC50濃度(高劑量:0.025μg/ml)和1/2CPT IC50濃度并與孔板內大鼠活化態肝星狀細胞株HSC-T6細胞共孵育48h。
采用RT-QPCR實驗方法進行分析,實驗方法如下:
以Trizol試劑(總RNA抽提試劑)裂解細胞、提取總RNA并定量;隨后對RNA樣品進行脫氧核糖核酸酶I(DNase I酶)消化以去除DNA污染,采用隨機引物和反轉錄酶合成互補脫氧核糖核酸(cDNA)第一鏈;最后取稀釋的cDNA樣品模板和各基因特異擴增引物,采用SYBR green綠色熒光試劑盒分別進行QPCR反應;以S9基因為內對照,采用ΔCt計算方法對各基因mRNA進行定量。
如圖2所示,較無CPT處理組,CPT處理組細胞中缺氧因子HIF-1-ɑ的蛋白水平隨濃度增加而下降;與之相應的是糖酵解限速酶PKM2和MF表型典型標記分子ɑ-SMA的蛋白水平也呈現相似的下降趨勢;MF表型代表標記分子ɑ-Sma基因和I型膠原蛋白分子基因的mRNA水平也隨著CPT處理而顯著下降(圖3),表明HSC-T6的MF表型被抑制;進一步采用兩種同樣濃度的CPT分別處理體外激活的原代HSC細胞48小時,結果發現細胞中Pkm、α-Sma和Collagen 1a1基因的mRNA水平也均隨著CPT處理而下降,且表現出劑量依賴性的抑制效果(圖4),說明原代活化態肝星狀細胞MF表型被CPT抑制。
實施例3
蛋白表達水平
實驗采用大鼠肝星狀細胞株HSC-T6和人乳腺細胞株Hela,與CPT或HCPT共孵育48小時;根據喜樹堿和羥基喜樹堿細胞毒性檢測結果擬合得到藥物濃度與細胞生存率曲線,計算IC50值,并設置CPT IC50濃度(高劑量)和1/2IC50濃度(低劑量)進行蛋白分析;處理方法為含有10%血清及1%雙抗的DMEM高糖培養基將200μg/ml藥物溶液稀釋至指定劑量并與孔板內細胞共孵育48小時。
實驗方法如下:
以RIPA裂解液裂解細胞制備總蛋白,采用BCA蛋白濃度檢測法測定蛋白濃度;然后以聚丙烯酰胺凝膠電泳(SDS-PAGE電泳)對蛋白進行分離、并通過電轉進行蛋白印跡至聚偏氟乙烯(PDVF)膜;然后進行封閉、一抗和二抗依次孵育,最后以增強化學發光法(ECL顯色法)進行顯色、并于Image Lab成像儀中成像。
如圖5所示,無論是采用IC50還是1/2IC50濃度,10-羥基喜樹堿都未能減少T6細胞中的缺氧因子HIF-1-ɑ蛋白;細胞中糖酵解限速酶PKM2和MF表型典型標記分子ɑ-SMA的蛋白水平也并未受到影響;如圖6所示,在不高于IC50藥物濃度下,CPT和HCPT也均未能明顯改變Hela細胞中的HIF-1-α、PKM2和α-SMA的蛋白水平。
低劑量的喜樹堿可以通過削弱活化態肝星狀細胞中缺氧因子HIF-1-α的蛋白水平而抑制其對下游一系列糖酵解相關基因(如Pkm)的轉錄調控活性,進而減退細胞的糖酵解代謝活動,最終抑制細胞中典型肌成纖維母細胞MF表型標記分子基因(如α-Sma)的表達;喜樹堿的這一抑制作用表現出對活化態肝星狀細胞細胞的選擇性;除此之外,已經報道的抗肝纖維化藥物10-羥基喜樹堿雖然對活化態肝星狀細胞有相當的細胞毒性,但在不高于半抑制濃度(IC50藥物濃度)時并不抑制細胞中缺氧因子HIF-1-α活性和糖酵解限速酶PKM2及MF表型代表標記分子ɑ-SMA的蛋白水平;因此,通過使用喜樹堿可以抑制活化態肝星狀細胞細胞中的HIF-1-α和相應的糖代謝活動,從而逆轉其肌成纖維母細胞(myofibroblastic,MF)表型、最后達到治療肝纖維化的目的。
本發明與抑制肌成纖維母細胞表型的活化態肝星狀細胞(MF-HSC細胞)的增殖和促進其凋亡的治療手段相比,誘導其MF表型向靜息態逆轉能夠在不引起炎癥反應及更低毒副作用的情況下達到治療肝纖維化的目的;研究發現,通過抑制活化態肝星狀細胞HSC的糖酵解代謝活動可以有效逆轉HSC為靜息態表型;選用了我國特有喜樹堿(CPT)處理活化態HSC,通過減少缺氧誘導因子HIF-1-α蛋白來削弱細胞的糖酵解活動、進而逆轉細胞活化態表型。
- 還沒有人留言評論。精彩留言會獲得點贊!