一種預防或治療糖尿病性神經損傷及其相關病癥的方法與流程
本發明涉及纖溶酶原或纖溶酶修復神經組織損傷、預防和/或治療糖尿病性神經損傷相關病癥的作用。
發明背景
糖尿病(diabetes mellitus)是一種體內胰島素相對或絕對不足或靶細胞對胰島素敏感性降低,或胰島素本身存在結構上的缺陷而引起的碳水化合物、脂肪和蛋白質代謝紊亂的一種慢性疾病[1]。美國每年用于糖尿病治療的花費為有1760億美元(176billion),因糖尿病間接造成的損失也高達690(69billion)億美元[2]。糖尿病神經病變是一種以糖尿病高血糖為特征的機體代謝障礙而累及神經系統的疾病,同時也是糖尿病最常見的慢性并發癥之一[3]。其中有60-75%的糖尿病患者最終會發展成糖尿病神經病變[4]。糖尿病神經病變是非創傷性下肢截肢的最主要因素。糖尿病神經病變主要包括糖尿病中樞神經病變和周圍神經病變(Diabetic Peripheral Neuropathy,DNP),尤以后者多見。糖尿病中樞神經病變是指在糖尿病背景下,大腦、小腦、腦干神經元和神經纖維及脊髓的神經元受損傷而造成的病變。糖尿病周圍神經病變是指在排除其他原因的情況下,糖尿病患者出現周圍神經功能障礙相關的癥狀和/或體征,主要由周圍感覺神經的損傷或感染引起。
疼痛是糖尿病神經病變的主要癥狀之一,主要由糖尿病神經損傷引起。如上文所述,糖尿病神經疼痛相應地分為糖尿病中樞神經性疼痛和糖尿病周圍神經性疼痛,以后者更為常見,且嚴重影響患者的生活質量,特別是損害睡眠和降低生活享受程度,長期慢性疼痛癥狀改變患者精神和情緒等方面,同時令其生活和社交能力下降。
對于糖尿病神經病變,在不同階段中疼痛產生的具體發病機制尚未完全明確。目前臨床上用于治療糖尿病神經疼痛的藥物主要包括如下幾類:(1)抗癲癇藥物,例如加巴噴丁、普瑞巴林等;(2)阿片類鎮痛藥物,例如曲馬多、嗎啡類、羥考酮等;(3)局部麻醉藥物,例如利多卡因;(4)抗抑郁劑,例如阿米替林、帕羅西汀、文拉法辛等;(5)非甾體抗炎藥(NSAID),如萘普生、萘普酮等。然而傳統的藥物依然存在多種缺陷,如加巴噴丁等抗癲癇藥物副作用和不良反應幾率較高且成本昂貴,而阿片類和非甾體抗炎藥對周圍和中樞神經性疼痛的效力有限或不足,而帕羅西汀和文拉法辛等抗抑郁藥則容易出現中樞五羥色胺綜合征,用藥禁忌較多等。因此,盡管近年來在緩解糖尿病神經疼痛的藥物開發方面已經取得了一定進步,仍然亟需一種有效的修復糖尿病神經損傷、防止糖尿病糖尿病神經損傷相關病癥的藥物。
纖溶酶是纖溶酶原激活系統(PA系統)的關鍵組分。它是一種廣譜的蛋白酶,能夠水解細胞外基質(ECM)的幾個組分,包括纖維蛋白、明膠、纖連蛋白、層粘連蛋白和蛋白聚糖[5],此外,纖溶酶能將一些金屬蛋白酶前體(pro-MMP)激活形成具有活性的金屬蛋白酶(MMP)。因此纖溶酶被認為是胞外蛋白水解作用的一個重要的上游調節物[6,7]。纖溶酶是由纖溶酶原通過兩種生理性的PA:組織型纖溶酶原激活劑(tPA)或尿激酶型纖溶酶原激活劑(uPA)蛋白水解形成的。由于纖溶酶原在血漿和其他體液中相對水平較高,傳統上認為PA系統的調節主要通過PA的合成和活性水平實現。PA系統組分的合成受不同因素嚴格調節,如激素、生長因子和細胞因子。此外,還存在纖溶酶和PA的特定生理抑制劑。纖溶酶的主要抑制劑是α2-抗纖溶酶(α2-antiplasmin)。某些細胞表面具有直接水解活性的uPA特異性細胞表面受體(uPAR)[8,9]。
纖溶酶原(plasminogen,plg)是一個單鏈糖蛋白,由791個氨基酸組成,分子量約為92kDa[10,11]。纖溶酶原主要在肝臟合成,大量存在于胞外液中。血漿中纖溶酶原含量約為2μM。因此纖溶酶原是組織和體液中蛋白質水解活性的一個巨大的潛在來源[12,13]。纖溶酶原存在兩種分子形式:谷氨酸-纖溶酶原(Glu-plasminogen)和賴氨酸-纖溶酶原(Lys-plasminogen)。天然分泌和未裂解形式的纖溶酶原具有一個氨基末端(N-末端)谷氨酸,因此被稱為谷氨酸-纖溶酶原。然而,在纖溶酶存在時,谷氨酸-纖溶酶原在Lys76-Lys77處水解成為賴氨酸-纖溶酶原。與谷氨酸-纖溶酶原相比,賴氨酸-纖溶酶原與纖維蛋白具有更高的親和力,并可以更高的速率被PA激活。這兩種形式的纖溶酶原的Arg560-Val561肽鍵可被uPA或tPA切割,導致二硫鍵連接的雙鏈蛋白酶纖溶酶的形成[14]。纖溶酶原的氨基末端部分包含五個同源三環,即所謂的kringle,羧基末端部分包含蛋白酶結構域。一些kringle含有介導纖溶酶原與纖維蛋白及其抑制劑α2-AP特異性相互作用的賴氨酸結合位點。最新發現一個為38kDa的纖維蛋白溶酶原片段,其中包括kringle1-4,是血管生成的有效抑制劑。這個片段被命名為血管抑素,可通過幾個蛋白酶水解纖溶酶原產生。
纖溶酶的主要底物是纖維蛋白,纖維蛋白的溶解是預防病理性血栓形成的關鍵[15]。纖溶酶還具有對ECM幾個組分的底物特異性,包括層粘連蛋白、纖連蛋白、蛋白聚糖和明膠,表明纖溶酶在ECM重建中也起著重要作用[12,16,17]。間接地,纖溶酶還可以通過將某些蛋白酶前體轉化為活性蛋白酶來降解ECM的其他組分,包括MMP-1、MMP-2、MMP-3和MMP-9。因此,有人提出,纖溶酶可能是細胞外蛋白水解的一個重要的上游調節器[18]。此外,纖溶酶具有激活某些潛在形式的生長因子的能力[19-21]。在體外,纖溶酶還能水解補體系統的組分并釋放趨化補體片段。
db/db小鼠是最為廣泛應用的糖尿病實驗動物模型之一,其在糖尿病神經痛的發病過程,發病機理等方面高度與人的糖尿病神經痛發病情況類似。因此,使用db/db小鼠進行相關研究,其結果具有代表性。db/db鼠在4-6周時發展成糖尿病鼠,8-12周時痛覺超敏,12周以后則痛覺減退。[22-26]
通過研究,本發明令人驚訝地發現,纖溶酶原具有顯著的神經修復作用和治療糖尿病神經損傷及其相關病癥的作用,且安全性好。因此,纖溶酶原可能是一種新的修復糖尿病神經組織損傷、以及治療和/或預防其相關病癥的策略。
發明概述
一方面,本發明涉及一種預防和/或修復糖尿病性神經損傷的方法,包括給藥受試者治療有效量的纖溶酶原或纖溶酶。一方面本發明涉及纖溶酶原或纖溶酶用于預防和/或修復糖尿病性神經損傷的用途,包括給藥受試者治療有效量的纖溶酶原或纖溶酶。
在一個實施方案中,所述糖尿病性神經損傷包括神經組織損傷,神經的炎癥。本發明還涉及一種治療和/或預防糖尿病性神經損傷相關病癥的方法,包括給藥受試者治療有效量的纖溶酶原或纖溶酶。在一個實施方案中,所述糖尿病性神經損傷相關病癥包括肢體疼痛、感覺減退、麻木、灼熱、冰涼,以及糖尿病神經性疼痛,包括但不限于糖尿病并發癥引發的自發性疼痛、痛覺減退(hypoalgesia)、痛覺超敏(hyperalgesia)等。在一個實施方案中,所述纖維蛋白溶酶原與序列2、6、8、10或12具有至少80%、85%、90%、95%、96%、97%、98%或99%的序列同一性,并且仍然具有纖維蛋白溶酶原活性。在一個實施方案中,所述纖維蛋白溶酶原是包含纖溶酶原活性片段、并且仍然具有纖維蛋白溶酶原活性的蛋白質。在一個實施方案中,所述纖溶酶原選自Glu-纖維蛋白溶酶原、Lys-纖維蛋白溶酶原、小纖維蛋白溶酶原、微纖維蛋白溶酶原、δ-纖溶酶原或其任意組合。在一個實施方案中,所述纖維蛋白溶酶原全身或局部施用,例如,通過表面、靜脈內、肌內、皮下、吸入、椎管內、局部注射、關節內注射或直腸施用。在一個實施方案中,所述纖維蛋白溶酶原可與其它藥物或療法聯合施用。在一個實施方案中,所述其它藥物或療法包括神經營養藥物、鎮痛類藥物、糖尿病治療藥物、抗感染藥物、抗高血壓藥物、抗高血脂藥物、物理療法,例如,電磁療法、紅外線療法。
在一個實施方案中,所述所述受試者為哺乳動物,優選為人。
在一個實施方案中,所述受試者纖維蛋白溶酶或者纖維蛋白溶酶原低下。具體地,所述低下是先天的、繼發的和/或局部的。
在一個實施方案中,纖維蛋白溶酶原與序列2、6、8、10或12具有至少80%、85%、90%、95%、96%、97%、98%或99%的序列同一性,并且仍然具有纖維蛋白溶酶原活性。在一個實施方案中,纖維蛋白溶酶原是在序列2、6、8、10或12的基礎上,添加、刪除和/或取代1-100、1-90、1-80、1-70、1-60、1-50、1-45、1-40、1-35、1-30、1-25、1-20、1-15、1-10、1-5、1-4、1-3、1-2、1個氨基酸,并且仍然具有纖維蛋白溶酶原活性的蛋白質。在一個實施方案中,纖溶酶原是包含纖溶酶原活性片段、并且仍然具有纖維蛋白溶酶原活性的蛋白質。在一個實施方案中,纖溶酶原選自Glu-纖維蛋白溶酶原、Lys-纖維蛋白溶酶原、小纖維蛋白溶酶原、微纖維蛋白溶酶原、δ-纖溶酶原或其任意組合。在一個實施方案中,纖溶酶原是選自如下的保守取代變體:Glu-纖維蛋白溶酶原、Lys-纖維蛋白溶酶原、小纖維蛋白溶酶原、δ-纖溶酶原或微纖維蛋白溶酶原。在一個實施方案中,纖維蛋白溶酶原為人天然纖維蛋白溶酶原,例如序列2所示的纖溶酶原的直向同系物,例如,來自靈長類動物或嚙齒類動物的纖維蛋白溶酶原直向同系物,例如來自大猩猩、恒河猴、鼠、牛、馬、狗的纖維蛋白溶酶原直向同系物。最優選,本發明的纖維蛋白溶酶原的氨基酸序列如序列2、6、8、10或12所示。
在一個實施方案中,所述纖溶酶原與適當的多肽載體或穩定劑組合施用。在一個實施方案中,所述纖溶酶原以每天0.0001-2000mg/kg、0.001-800mg/kg、0.01-600mg/kg、0.1-400mg/kg、1-200mg/kg、1-100mg/kg、10-100mg/kg(以每公斤體重計算)或0.0001-2000mg/cm2、0.001-800mg/cm2、0.01-600mg/cm2、0.1-400mg/cm2、1-200mg/cm2、1-100mg/cm2、10-100mg/cm2(以每平方厘米體表面積計算)的劑量施用,優選至少重復一次,優選至少每天施用。在局部施用的情況下,上述劑量還可以根據情況進一步調整。
另一方面,本發明涉及纖溶酶原或纖溶酶在制備預防和/或修復糖尿病性神經損傷的藥物中的用途。一方面,本發明涉及一種制藥方法,包括將纖溶酶原或纖溶酶和藥學可接受的載體一起制備成預防和/或修復糖尿病性神經損傷的藥物。
在一個實施方案中,所述糖尿病性神經損傷包括神經組織損傷,神經的炎癥。本發明還涉及纖溶酶原或纖溶酶在制備治療和/或預防糖尿病性神經損傷相關病癥的藥物中的用途。在一個實施方案中,所述糖尿病性神經損傷相關病癥包括肢體疼痛、感覺減退、麻木、灼熱、冰涼,以及糖尿病神經性疼痛,包括但不限于糖尿病并發癥引發的自發性疼痛、痛覺減退、痛覺超敏。在一個實施方案中,所述纖維蛋白溶酶原與序列2、6、8、10或12具有至少80%、85%、90%、95%、96%、97%、98%或99%的序列同一性,并且仍然具有纖維蛋白溶酶原活性。在一個實施方案中,所述纖維蛋白溶酶原是包含纖溶酶原活性片段、并且仍然具有纖維蛋白溶酶原活性的蛋白質。在一個實施方案中,所述纖溶酶原選自Glu-纖維蛋白溶酶原、Lys-纖維蛋白溶酶原、小纖維蛋白溶酶原、微纖維蛋白溶酶原、δ-纖溶酶原或其任意組合。在一個實施方案中,所述纖維蛋白溶酶原全身或局部施用,例如,通過表面、靜脈內、肌內、皮下、吸入、椎管內、局部注射、關節內注射或直腸施用。在一個實施方案中,所述纖維蛋白溶酶原可與其它藥物或療法聯合施用。在一個實施方案中,所述其它藥物或療法包括神經營養藥物,鎮痛類藥物,糖尿病治療藥物,抗感染藥物,抗高血壓藥物、抗高血脂藥物、物理療法,例如,電磁療法、紅外線療法。
在一個實施方案中,所述所述受試者為哺乳動物,優選為人。
在一個實施方案中,所述受試者纖維蛋白溶酶或者纖維蛋白溶酶原低下。具體地,所述低下是先天的、繼發的和/或局部的。
在一個實施方案中,纖維蛋白溶酶原與序列2、6、8、10或12具有至少80%、85%、90%、95%、96%、97%、98%或99%的序列同一性,并且仍然具有纖維蛋白溶酶原活性。在一個實施方案中,纖維蛋白溶酶原是在序列2、6、8、10或12的基礎上,添加、刪除和/或取代1-100、1-90、1-80、1-70、1-60、1-50、1-45、1-40、1-35、1-30、1-25、1-20、1-15、1-10、1-5、1-4、1-3、1-2、1個氨基酸,并且仍然具有纖維蛋白溶酶原活性的蛋白質。在一個實施方案中,纖溶酶原是包含纖溶酶原活性片段、并且仍然具有纖維蛋白溶酶原活性的蛋白質。在一個實施方案中,纖溶酶原選自Glu-纖維蛋白溶酶原、Lys-纖維蛋白溶酶原、小纖維蛋白溶酶原、微纖維蛋白溶酶原、δ-纖溶酶原或其任意組合。在一個實施方案中,纖溶酶原是選自如下的保守取代變體:Glu-纖維蛋白溶酶原、Lys-纖維蛋白溶酶原、小纖維蛋白溶酶原、δ-纖溶酶原或微纖維蛋白溶酶原。在一個實施方案中,纖維蛋白溶酶原為人天然纖維蛋白溶酶原,例如序列2所示的纖溶酶原的直向同系物,例如,來自靈長類動物或嚙齒類動物的纖維蛋白溶酶原直向同系物,例如來自大猩猩,恒河猴、鼠、牛、馬,狗的纖維蛋白溶酶原直向同系物。最優選,本發明的纖維蛋白溶酶原的氨基酸序列如序列2、6、8、10或12所示。
在一個實施方案中,所述纖溶酶原與適當的多肽載體或穩定劑組合施用。在一個實施方案中,所述纖溶酶原以每天0.0001-2000mg/kg、0.001-800mg/kg、0.01-600mg/kg、0.1-400mg/kg、1-200mg/kg、1-100mg/kg、10-100mg/kg(以每公斤體重計算)或0.0001-2000mg/cm2、0.001-800mg/cm2、0.01-600mg/cm2、0.1-400mg/cm2、1-200mg/cm2、1-100mg/cm2、10-100mg/cm2(以每平方厘米體表面積計算)的劑量施用,優選至少重復一次,優選至少每天施用。在局部施用的情況下,上述劑量還可以根據情況進一步調整。
另一方面,本發明涉及用于預防和/或修復受試者糖尿病性神經損傷的纖溶酶原,以及用于預防和/或修復受試者糖尿病性神經損傷的、包含纖溶酶原或纖溶酶的藥物組合物。在一個實施方案中,所述糖尿病性神經損傷包括神經組織損傷,神經的炎癥。本發明還涉及用于治療和/或預防受試者糖尿病性神經損傷相關病癥的纖溶酶原,以及用于治療和/或預防受試者糖尿病性神經損傷相關病癥的、包含纖溶酶原的藥物組合物。在一個實施方案中,所述糖尿病性神經損傷相關病癥包括肢體疼痛、感覺減退、麻木、灼熱、冰涼,以及糖尿病神經性疼痛,包括但不限于糖尿病并發癥引發的自發性疼痛、痛覺減退、痛覺超敏。在一個實施方案中,所述纖維蛋白溶酶原與序列2、6、8、10或12具有至少80%、85%、90%、95%、96%、97%、98%或99%的序列同一性,并且仍然具有纖維蛋白溶酶原活性。在一個實施方案中,所述纖維蛋白溶酶原是包含纖溶酶原活性片段、并且仍然具有纖維蛋白溶酶原活性的蛋白質。在一個實施方案中,所述纖溶酶原選自Glu-纖維蛋白溶酶原、Lys-纖維蛋白溶酶原、小纖維蛋白溶酶原、微纖維蛋白溶酶原、δ-纖溶酶原或其任意組合。在一個實施方案中,所述纖維蛋白溶酶原全身或局部施用,例如,通過表面、靜脈內、肌內、皮下、吸入、椎管內、局部注射、關節內注射或直腸施用。在一個實施方案中,所述纖維蛋白溶酶原可與其它藥物或療法聯合施用。在一個實施方案中,所述其它藥物或療法包括神經營養藥物,鎮痛類藥物,糖尿病治療藥物,抗感染藥物,抗高血壓藥物、抗高血脂藥物、物理療法,例如,電磁療法、紅外線療法。
在一個實施方案中,所述所述受試者為哺乳動物,優選為人。
在一個實施方案中,所述受試者纖維蛋白溶酶或者纖維蛋白溶酶原低下。具體地,所述低下是先天的、繼發的和/或局部的。
在一個實施方案中,纖維蛋白溶酶原與序列2、6、8、10或12具有至少80%、85%、90%、95%、96%、97%、98%或99%的序列同一性,并且仍然具有纖維蛋白溶酶原活性。在一個實施方案中,纖維蛋白溶酶原是在序列2、6、8、10或12的基礎上,添加、刪除和/或取代1-100、1-90、1-80、1-70、1-60、1-50、1-45、1-40、1-35、1-30、1-25、1-20、1-15、1-10、1-5、1-4、1-3、1-2、1個氨基酸,并且仍然具有纖維蛋白溶酶原活性的蛋白質。在一個實施方案中,纖溶酶原是包含纖溶酶原活性片段、并且仍然具有纖維蛋白溶酶原活性的蛋白質。在一個實施方案中,纖溶酶原選自Glu-纖維蛋白溶酶原、Lys-纖維蛋白溶酶原、小纖維蛋白溶酶原、微纖維蛋白溶酶原、δ-纖溶酶原或其任意組合。在一個實施方案中,纖溶酶原是選自如下的保守取代變體:Glu-纖維蛋白溶酶原、Lys-纖維蛋白溶酶原、小纖維蛋白溶酶原、δ-纖溶酶原或微纖維蛋白溶酶原。在一個實施方案中,纖維蛋白溶酶原為人天然纖維蛋白溶酶原,例如序列2所示的纖溶酶原的直向同系物,例如,來自靈長類動物或嚙齒類動物的纖維蛋白溶酶原直向同系物,例如來自大猩猩,恒河猴、鼠、牛、馬,狗的纖維蛋白溶酶原直向同系物。最優選,本發明的纖維蛋白溶酶原的氨基酸序列如序列2、6、8、10或12所示。
在一個實施方案中,所述纖溶酶原與適當的多肽載體或穩定劑組合施用。在一個實施方案中,所述纖溶酶原以每天0.0001-2000mg/kg、0.001-800mg/kg、0.01-600mg/kg、0.1-400mg/kg、1-200mg/kg、1-100mg/kg、10-100mg/kg(以每公斤體重計算)或0.0001-2000mg/cm2、0.001-800mg/cm2、0.01-600mg/cm2、0.1-400mg/cm2、1-200mg/cm2、1-100mg/cm2、10-100mg/cm2(以每平方厘米體表面積計算)的劑量施用,優選至少重復一次,優選至少每天施用。在局部施用的情況下,上述劑量還可以根據情況進一步調整。
另一個方面,本發明涉及用于預防和/或修復受試者糖尿病性神經損傷的、包含纖溶酶原或纖溶酶的藥物組合物的制品或藥盒。在一個實施方案中,所述糖尿病性神經損傷包括神經組織損傷,神經的炎癥。本發明還涉及用于治療和/或預防受試者糖尿病性神經損傷相關病癥的、包含纖溶酶原或纖溶酶的藥物組合物的制品或藥盒。在一個實施方案中,所述糖尿病性神經損傷相關病癥包括肢體疼痛、感覺減退、麻木、灼熱、冰涼,以及糖尿病神經性疼痛,包括但不限于糖尿病并發癥引發的自發性疼痛、痛覺減退、痛覺超敏。在一個實施方案中,所述纖維蛋白溶酶原與序列2、6、8、10或12具有至少80%、85%、90%、95%、96%、97%、98%或99%的序列同一性,并且仍然具有纖維蛋白溶酶原活性。在一個實施方案中,所述纖維蛋白溶酶原是包含纖溶酶原活性片段、并且仍然具有纖維蛋白溶酶原活性的蛋白質。在一個實施方案中,所述纖溶酶原選自Glu-纖維蛋白溶酶原、Lys-纖維蛋白溶酶原、小纖維蛋白溶酶原、微纖維蛋白溶酶原、δ-纖溶酶原或其任意組合。在一個實施方案中,所述纖維蛋白溶酶原全身或局部施用,例如,通過表面、靜脈內、肌內、皮下、吸入、椎管內、局部注射、關節內注射或直腸施用。在一個實施方案中,所述纖維蛋白溶酶原可與其它藥物或療法聯合施用。在一個實施方案中,所述其它藥物或療法包括神經營養藥物、鎮痛類藥物、糖尿病治療藥物、抗感染藥物、抗高血壓藥物、抗高血脂藥物、物理療法,例如,電磁療法、紅外線療法。
在一個實施方案中,所述所述受試者為哺乳動物,優選為人。
在一個實施方案中,所述受試者纖維蛋白溶酶或者纖維蛋白溶酶原低下。具體地,所述低下是先天的、繼發的和/或局部的。
在一個實施方案中,纖維蛋白溶酶原與序列2、6、8、10或12具有至少80%、85%、90%、95%、96%、97%、98%或99%的序列同一性,并且仍然具有纖維蛋白溶酶原活性。在一個實施方案中,纖維蛋白溶酶原是在序列2、6、8、10或12的基礎上,添加、刪除和/或取代1-100、1-90、1-80、1-70、1-60、1-50、1-45、1-40、1-35、1-30、1-25、1-20、1-15、1-10、1-5、1-4、1-3、1-2、1個氨基酸,并且仍然具有纖維蛋白溶酶原活性的蛋白質。在一個實施方案中,纖溶酶原是包含纖溶酶原活性片段、并且仍然具有纖維蛋白溶酶原活性的蛋白質。在一個實施方案中,纖溶酶原選自Glu-纖維蛋白溶酶原、Lys-纖維蛋白溶酶原、小纖維蛋白溶酶原、微纖維蛋白溶酶原、δ-纖溶酶原或其任意組合。在一個實施方案中,纖溶酶原是選自如下的保守取代變體:Glu-纖維蛋白溶酶原、Lys-纖維蛋白溶酶原、小纖維蛋白溶酶原、δ-纖溶酶原或微纖維蛋白溶酶原。在一個實施方案中,纖維蛋白溶酶原為人天然纖維蛋白溶酶原,例如序列2所示的纖溶酶原的直向同系物,例如,來自靈長類動物或嚙齒類動物的纖維蛋白溶酶原直向同系物,例如來自大猩猩,恒河猴、鼠、牛、馬,狗的纖維蛋白溶酶原直向同系物。最優選,本發明的纖維蛋白溶酶原的氨基酸序列如序列2、6、8、10或12所示。
在一個實施方案中,所述制品或藥盒包含含有有效劑量的纖溶酶原的容器。優選,該制品或藥盒進一步包含含有一種或多種其它藥物的容器。該藥盒還可包含使用說明書,說明所述纖溶酶原可以用于治療所述由糖尿病引起的神經損傷及其相關病癥,并且可以進一步說明,所述纖溶酶原可以在其它藥物或療法施用之前,同時,和/或之后施用。
一方面,本發明涉及纖溶酶原或纖溶酶在制備預防和/或治療受試者的糖尿病性血管病變導致的機體組織和內臟器官損傷(損害)的藥物、制品、藥盒中的用途。在一個實施方案中,所述組織和內臟器官損傷(損害)包括對大腦、心臟、肝臟、肺臟、腎臟、神經、視網膜、皮膚、胃腸道的損傷(損害)。一方面,本發明涉及纖溶酶原或纖溶酶在制備預防和/或治療受試者的糖尿病并發癥的藥物、制品、藥盒中的用途。在一個實施方案中,所述糖尿病并發癥為糖尿病引發的糖尿病性大腦病變、糖尿病性心臟病變、糖尿病性肝臟病變、糖尿病性腎臟病變、糖尿病性肺臟病變、糖尿病性神經病變,糖尿病性血管病變、糖尿病性視網膜病變、糖尿病性皮膚病變。
一方面,本發明涉及一種制藥方法,包括將纖溶酶原或纖溶酶與藥學可接受的載體制備成用于預防和/或治療受試者的糖尿病性血管病變導致的機體組織和內臟器官損傷(損害)的藥物、制品、藥盒。在一個實施方案中,所述組織和內臟器官損傷(損害)包括對大腦、心臟、肝臟、肺臟、腎臟、神經、視網膜、皮膚、胃腸道的損傷(損害)。一方面,本發明涉及一種制藥方法,包括將纖溶酶原或纖溶酶與藥學可接受載體制備成預防和/或治療受試者的糖尿病并發癥的藥物、制品或藥盒。在一個實施方案中,所述糖尿病并發癥為糖尿病引發的糖尿病性大腦病變、糖尿病性心臟病變、糖尿病性肝臟病變、糖尿病性腎臟病變、糖尿病性肺臟病變、糖尿病性神經病變,糖尿病性血管病變、糖尿病性視網膜病變、糖尿病性皮膚病變。
一方面,本發明涉及用于預防和/或治療受試者的糖尿病性血管病變導致的機體組織和內臟器官損傷(損害)的纖溶酶原或纖溶酶、包含纖溶酶原或纖溶酶的藥物組合物、制品、藥盒。在一個實施方案中,所述組織和內臟器官損傷(損害)包括對大腦、心臟、肝臟、腎臟、肺臟、神經、視網膜、胃腸道、皮膚的損傷(損害)。一方面,本發明涉及用于預防和/或治療受試者的糖尿病并發癥的纖溶酶原、包含纖溶酶原的藥物組合物、制品或藥盒。在一個實施方案中,所述糖尿病并發癥為糖尿病引發的糖尿病性大腦病變、糖尿病性心臟病變、糖尿病性肝臟病變、糖尿病性肺臟病變糖尿病性腎臟病變、糖尿病性神經病變,糖尿病性血管病變、糖尿病性視網膜病變、糖尿病性皮膚病變。
一方面,本發明涉及一種預防和/或治療受試者的糖尿病性血管病變導致的機體組織和內臟器官損傷(損害)的方法,包括給藥受試者纖溶酶原或纖溶酶、包含纖溶酶原或纖溶酶的藥物組合物、制品、藥盒。本發明還涉及纖溶酶原或纖溶酶、包含纖溶酶原或纖溶酶的藥物組合物、制品、藥盒用于預防和/或治療受試者的糖尿病性血管病變導致的機體組織和內臟器官損傷(損害)的用途。在一個實施方案中,所述組織和內臟器官損傷(損害)包括對大腦、心臟、肝臟、肺臟、腎臟、神經、視網膜、胃腸道、皮膚的損傷(損害)。一方面,本發明涉及一種預防和/或治療受試者的糖尿病并發癥的方法,包括給藥受試者纖溶酶原或纖溶酶、包含纖溶酶原或纖溶酶的藥物組合物、制品或藥盒。本發明還包括纖溶酶原或纖溶酶、包含纖溶酶原或纖溶酶的藥物組合物、制品或藥盒用于預防和/或治療受試者的糖尿病并發癥的用途。在一個實施方案中,所述糖尿病并發癥為糖尿病引發的糖尿病性大腦病變、糖尿病性心臟病變、糖尿病性肝臟病變、糖尿病性肺臟病變、糖尿病性腎臟病變、糖尿病性神經病變,糖尿病性血管病變、糖尿病性視網膜病變、糖尿病性皮膚病變。
在一個實施方案中,所述纖維蛋白溶酶原與序列2、6、8、10或12具有至少80%、85%、90%、95%、96%、97%、98%或99%的序列同一性,并且仍然具有纖維蛋白溶酶原活性。在一個實施方案中,纖維蛋白溶酶原是在序列2、6、8、10或12的基礎上,添加、刪除和/或取代1-100、1-90、1-80、1-70、1-60、1-50、1-45、1-40、1-35、1-30、1-25、1-20、1-15、1-10、1-5、1-4、1-3、1-2、1個氨基酸,并且仍然具有纖維蛋白溶酶原活性的蛋白質。在一個實施方案中,纖溶酶原是包含纖溶酶原活性片段、并且仍然具有纖維蛋白溶酶原活性的蛋白質。在一個實施方案中,纖溶酶原選自Glu-纖維蛋白溶酶原、Lys-纖維蛋白溶酶原、小纖維蛋白溶酶原、微纖維蛋白溶酶原、δ-纖溶酶原或其任意組合。在一個實施方案中,纖溶酶原是選自如下的保守取代變體:Glu-纖維蛋白溶酶原、Lys-纖維蛋白溶酶原、小纖維蛋白溶酶原、δ-纖溶酶原或微纖維蛋白溶酶原。在一個實施方案中,纖維蛋白溶酶原為人天然纖維蛋白溶酶原,例如序列2所示的纖溶酶原的直向同系物,例如,來自靈長類動物或嚙齒類動物的纖維蛋白溶酶原直向同系物,例如來自大猩猩,恒河猴、鼠、牛、馬,狗的纖維蛋白溶酶原直向同系物。最優選,本發明的纖維蛋白溶酶原的氨基酸序列如序列2、6、8、10或12所示。
在一個實施方案中,所述受試者纖維蛋白溶酶或者纖維蛋白溶酶原低下。具體地,所述低下是先天的、繼發的和/或局部的。
本發明明確涵蓋了屬于本發明實施方案之間的技術特征的所有組合,并且這些組合后的技術方案在本申請中已經明確公開,就像上述技術方案已經單獨且明確公開一樣。另外,本發明還明確涵蓋各個實施方案及其要素的所有亞組合,并且在本文中公開,就像每一個此類亞組合單獨且明確在本文中公開一樣。
發明詳述
1.定義
“糖尿病”是由遺傳因素、免疫功能紊亂、微生物感染及其毒素、自由基毒素、精神因素等等各種致病因子作用于機體導致胰島功能減退、胰島素抵抗等而引發的糖、蛋白質、脂肪、水和電解質等一系列代謝紊亂綜合征,臨床上以高血糖為主要特點。
“糖尿病并發癥”是由糖尿病過程中血糖控制不良導致的身體其他器官或組織的損害或功能障礙,其中包括肝臟、腎臟、心臟、視網膜、神經系統的損害或功能障礙等。據世界衛生組織統計,糖尿病并發癥高達100多種,是目前已知并發癥最多的一種疾病。
“糖尿病性微血管病變”指糖尿病患者機體各器官或組織微循環不同程度的異常導致的微血管病變。微血管病變形成的過程大致為:微循環功能性改變,內皮損傷,基膜增厚,血粘度增高,紅細胞聚集,血小板粘附和聚集,最后導致微血栓形成和/或微血管閉塞。
上述“糖尿病性微血管病變”導致組織或器官局部血管損傷、血流不暢、細胞缺氧、形成血凝塊、血栓和炎癥,并進一步影響周邊的組織及器官功能,進而導致“糖尿病并發癥”。因此,本發明權利要求技術方案中提到“糖尿病性血管病變”和“糖尿病并發癥”術語時,都涵蓋了糖尿病引發的血栓。
“糖尿病性神經病變”或稱為“糖尿病性神經病”是一種以糖尿病高血糖為特征的機體代謝障礙而累及神經系統的疾病,其由糖尿病引起的神經系統損傷造成。
“糖尿病性神經損傷”包括感覺神經受損、運動神經受損和自主神經受損。其中感覺神經受損通常較為嚴重,常見癥狀為疼痛,包括灼燒樣疼痛、電極樣疼痛、針扎樣疼痛及各種不同的患者體驗等。
“糖尿病性神經損傷相關病癥”是一種以糖尿病高血糖為特征的機體代謝障礙而累及神經系統所引起的一系列病癥,由糖尿病引起的神經系統損傷造成,包括但不限于:肢體疼痛、感覺減退、麻木、灼熱、冰涼,以及糖尿病神經性疼痛,包括但不限于糖尿病并發癥引發的自發性疼痛、痛覺減退(hypoalgesia)、痛覺超敏(hyperalgesia)等等。
“糖尿病性神經疼痛”是糖尿病神經病變的最常見形式,通常由糖尿病感覺神經受損所致。主要的疼痛通常伴有溫度和觸覺喪失,疼痛發生以下肢感覺居多,同時也發生在上肢和軀干。一般可分為周圍和中樞神經疼痛。周圍神經疼痛通過周圍神經的損傷引起,而中樞神經疼痛通過中樞神經系統和/或脊髓損傷引起。
“纖溶酶”是存在于血液中的一種非常重要的酶,能將纖維蛋白凝塊水解為纖維蛋白降解產物和D-二聚體。
“纖溶酶原”是纖溶酶的酶原形式,根據swiss prot中的序列,按含有信號肽的天然人源纖溶酶原氨基酸序列(序列4)計算由810個氨基酸組成,分子量約為90kD,主要在肝臟中合成并能夠在血液中循環的糖蛋白,編碼該氨基酸序列的cDNA序列如序列3所示。全長的纖溶酶原包含七個結構域:位于C末端的絲氨酸蛋白酶結構域、N末端的Pan Apple(PAp)結構域以及5個Kringle結構域(Kringle1-5)。參照swiss prot中的序列,其信號肽包括殘基Met1-Gly19,PAp包括殘基Glu20-Val98,Kringle1包括殘基Cys103-Cys181,Kringle2包括殘基Glu184-Cys262,Kringle3包括殘基Cys275-Cys352,Kringle4包括殘基Cys377-Cys454,Kringle5包括殘基Cys481-Cys560。根據NCBI數據,絲氨酸蛋白酶域包括殘基Val581-Arg804。
Glu-纖溶酶原是天然全長的纖溶酶原,由791個氨基酸組成(不含有19個氨基酸的信號肽),編碼該序列的cDNA序列如序列1所示,其氨基酸序列如序列2所示。在體內,還存在一種是從Glu-纖溶酶原的第76-77位氨基酸處水解從而形成的Lys-纖溶酶原,如序列6所示,編碼該氨基酸序列的cDNA序列如序列5所示。δ-纖溶酶原(δ-plasminogen)是全長纖溶酶原缺失了Kringle2-Kringle5結構的片段,僅含有Kringle1和絲氨酸蛋白酶域[27,30],有文獻報道了δ-纖溶酶原的氨基酸序列(序列8)[30],編碼該氨基酸序列的cDNA序列如序列7。小纖溶酶原(Mini-plasminogen)由Kringle5和絲氨酸蛋白酶域組成,有文獻報道其包括殘基Val443-Asn791(以不含有信號肽的Glu-纖溶酶原序列的Glu殘基為起始氨基酸)[28],其氨基酸序列如序列10所示,編碼該氨基酸序列的cDNA序列如序列9所示。而微纖溶酶原(Micro-plasminogen)僅含有絲氨酸蛋白酶結構域,有文獻報道其氨基酸序列包括殘基Ala543-Asn791(以不含有信號肽的Glu-纖溶酶原序列的Glu殘基為起始氨基酸)[29],也有專利文獻CN102154253A報道其序列包括殘基Lys531-Asn791(以不含有信號肽的Glu-纖溶酶原序列的Glu殘基為起始氨基酸),本專利序列參考專利文獻CN102154253A,其氨基酸序列如序列12所示,編碼該氨基酸序列的cDNA序列如序列11所示。
本發明的“纖溶酶”與“纖維蛋白溶酶”、“纖維蛋白溶解酶”可互換使用,含義相同;“纖溶酶原”與“纖維蛋白溶酶原”、“纖維蛋白溶解酶原”可互換使用,含義相同。
在循環過程中,纖溶酶原采用封閉的非活性構象,但當結合至血栓或細胞表面時,在纖溶酶原激活劑(plasminogen activator,PA)的介導下,其轉變為呈開放性構象的活性纖溶酶。具有活性的纖溶酶可進一步將纖維蛋白凝塊水解為纖維蛋白降解產物和D-二聚體,進而溶解血栓。其中纖溶酶原的PAp結構域包含維持纖溶酶原處于非活性封閉構象的重要決定簇,而KR結構域則能夠與存在于受體和底物上的賴氨酸殘基結合。已知多種能夠作為纖溶酶原激活劑的酶,包括:組織纖溶酶原激活劑(tPA)、尿激酶纖溶酶原激活劑(uPA)、激肽釋放酶和凝血因子XII(哈格曼因子)等。
“纖溶酶原活性片段”是指在纖溶酶原蛋白中,能夠與底物中的靶序列結合并發揮蛋白水解功能的活性片段。本發明涉及纖溶酶原的技術方案涵蓋了用纖溶酶原活性片段代替纖溶酶原的技術方案。本發明所述的纖溶酶原活性片段為包含纖溶酶原的絲氨酸蛋白酶域的蛋白質,優選,本發明所述的纖溶酶原活性片段包含序列14、與序列14具有至少80%、90%、95%、96%、97%、98%、99%同源性的氨基酸序列的蛋白質。因此,本發明所述的纖溶酶原包括含有該纖溶酶原活性片段、并且仍然保持該纖溶酶原活性的蛋白。
目前,對于血液中纖維蛋白溶酶原及其活性測定方法包括:對組織纖維蛋白溶酶原激活劑活性的檢測(t-PAA)、血漿組織纖維蛋白溶酶原激活劑抗原的檢測(t-PAAg)、對血漿組織纖溶酶原活性的檢測(plgA)、血漿組織纖溶酶原抗原的檢測(plgAg)、血漿組織纖維蛋白溶酶原激活劑抑制物活性的檢測、血漿組織纖維蛋白溶酶原激活劑抑制物抗原的檢測、血漿纖維蛋白溶酶-抗纖維蛋白溶酶復合物檢測(PAP)。其中最常用的檢測方法為發色底物法:向受檢血漿中加鏈激酶(SK)和發色底物,受檢血漿中的纖溶酶原在SK的作用下,轉變成PLM,后者作用于發色底物,隨后用分光光度計測定,吸光度增加與纖維蛋白溶酶原活性成正比。此外也可采用免疫化學法、凝膠電泳、免疫比濁法、放射免疫擴散法等對血液中的纖維蛋白溶酶原活性進行測定。
“直系同源物或直系同系物(ortholog)”指不同物種之間的同源物,既包括蛋白同源物也包括DNA同源物,也稱為直向同源物、垂直同源物。其具體指不同物種中由同一祖先基因進化而來的蛋白或基因。本發明的纖溶酶原包括人的天然纖溶酶原,還包括來源于不同物種的、具有纖溶酶原活性的纖溶酶原直系同源物或直系同系物。
“保守取代變體”是指其中一個給定的氨基酸殘基改變但不改變蛋白質或酶的整體構象和功能,這包括但不限于以相似特性(如酸性,堿性,疏水性,等)的氨基酸取代親本蛋白質中氨基酸序列中的氨基酸。具有類似性質的氨基酸是眾所周知的。例如,精氨酸、組氨酸和賴氨酸是親水性的堿性氨基酸并可以互換。同樣,異亮氨酸是疏水氨基酸,則可被亮氨酸,蛋氨酸或纈氨酸替換。因此,相似功能的兩個蛋白或氨基酸序列的相似性可能會不同。例如,基于MEGALIGN算法的70%至99%的相似度(同一性)。“保守取代變體”還包括通過BLAST或FASTA算法確定具有60%以上的氨基酸同一性的多肽或酶,若能達75%以上更好,最好能達85%以上,甚至達90%以上為最佳,并且與天然或親本蛋白質或酶相比具有相同或基本相似的性質或功能。
“分離的”纖溶酶原是指從其天然環境分離和/或回收的纖溶酶原蛋白。在一些實施方案中,所述纖溶酶原會純化(1)至大于90%、大于95%、或大于98%的純度(按重量計),如通過Lowry法所確定的,例如超過99%(按重量計),(2)至足以通過使用旋轉杯序列分析儀獲得N端或內部氨基酸序列的至少15個殘基的程度,或(3)至同質性,該同質性是通過使用考馬斯藍或銀染在還原性或非還原性條件下的十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(SDS-PAGE)確定的。分離的纖溶酶原也包括通過生物工程技術從重組細胞制備,并通過至少一個純化步驟分離的纖溶酶原。
術語“多肽”、“肽”和“蛋白質”在本文中可互換使用,指任何長度的氨基酸的聚合形式,其可以包括遺傳編碼的和非遺傳編碼的氨基酸,化學或生物化學修飾的或衍生化的氨基酸,和具有經修飾的肽主鏈的多肽。該術語包括融合蛋白,包括但不限于具有異源氨基酸序列的融合蛋白,具有異源和同源前導序列(具有或沒有N端甲硫氨酸殘基)的融合物;等等。
關于參照多肽序列的“氨基酸序列同一性百分數(%)”定義為在必要時引入缺口以實現最大百分比序列同一性后,且不將任何保守替代視為序列同一性的一部分時,候選序列中與參照多肽序列中的氨基酸殘基相同的氨基酸殘基的百分率。為測定百分比氨基酸序列同一性目的的對比可以以本領域技術范圍內的多種方式實現,例如使用公眾可得到的計算機軟件,諸如BLAST、BLAST-2、ALIGN或Megalign(DNASTAR)軟件。本領域技術人員能決定用于比對序列的適宜參數,包括對所比較序列全長實現最大對比需要的任何算法。然而,為了本發明的目的,氨基酸序列同一性百分數值是使用序列比較計算機程序ALIGN-2產生的。
在采用ALIGN-2來比較氨基酸序列的情況中,給定氨基酸序列A相對于給定氨基酸序列B的%氨基酸序列同一性(或者可表述為具有或包含相對于、與、或針對給定氨基酸序列B的某一%氨基酸序列同一性的給定氨基酸序列A)如下計算:
分數X/Y乘100
其中X是由序列比對程序ALIGN-2在該程序的A和B比對中評分為相同匹配的氨基酸殘基的數目,且其中Y是B中的氨基酸殘基的總數。應當領會,在氨基酸序列A的長度與氨基酸序列B的長度不相等的情況下,A相對于B的%氨基酸序列同一性會不等于B相對于A的%氨基酸序列同一性。除非另有明確說明,本文中使用的所有%氨基酸序列同一性值都是依照上一段所述,使用ALIGN-2計算機程序獲得的。
如本文中使用的,術語“治療”和“處理”指獲得期望的藥理和/或生理效果。所述效果可以是完全或部分預防疾病或其癥狀,和/或部分或完全治愈疾病和/或其癥狀,并且包括:(a)預防疾病在受試者體內發生,所述受試者可以具有疾病的素因,但是尚未診斷為具有疾病;(b)抑制疾病,即阻滯其形成;和(c)減輕疾病和/或其癥狀,即引起疾病和/或其癥狀消退。
術語“個體”、“受試者”和“患者”在本文中可互換使用,指哺乳動物,包括但不限于鼠(大鼠,小鼠)、非人靈長類、人、犬、貓、有蹄動物(例如馬、牛、綿羊、豬、山羊)等。
“治療有效量”或“有效量”指在對哺乳動物或其它受試者施用以治療疾病時足以實現對疾病的所述預防和/或治療的纖溶酶原的量。“治療有效量”會根據所使用的纖溶酶原、要治療的受試者的疾病和/或其癥狀的嚴重程度以及年齡、體重等而變化。
2.本發明纖溶酶原的制備
纖溶酶原可以從自然界分離并純化用于進一步的治療用途,也可以通過標準的化學肽合成技術來合成。當通過化學合成多肽時,可以經液相或固相進行合成。固相多肽合成(SPPS)(其中將序列的C末端氨基酸附接于不溶性支持物,接著序貫添加序列中剩余的氨基酸)是適合纖溶酶原化學合成的方法。各種形式的SPPS,諸如Fmoc和Boc可用于合成纖溶酶原。用于固相合成的技術描述于Barany和Solid-Phase Peptide Synthesis;第3-284頁于The Peptides:Analysis,Synthesis,Biology.第2卷:Special Methods in Peptide Synthesis,Part A.,Merrifield,等J.Am.Chem.Soc.,85:2149-2156(1963);Stewart等,Solid Phase Peptide Synthesis,2nd ed.Pierce Chem.Co.,Rockford,Ill.(1984);和Ganesan A.2006Mini Rev.Med Chem.6:3-10和Camarero JA等2005Protein Pept Lett.12:723-8中。簡言之,用其上構建有肽鏈的功能性單元處理小的不溶性多孔珠。在偶聯/去保護的重復循環后,將附接的固相游離N末端胺與單個受N保護的氨基酸單元偶聯。然后,將此單元去保護,露出可以與別的氨基酸附接的新的N末端胺。肽保持固定在固相上,之后將其切掉。
可以使用標準重組方法來生產本發明的纖溶酶原。例如,將編碼纖溶酶原的核酸插入表達載體中,使其與表達載體中的調控序列可操作連接。表達調控序列包括但不限于啟動子(例如天然關聯的或異源的啟動子)、信號序列、增強子元件、和轉錄終止序列。表達調控可以是載體中的真核啟動子系統,所述載體能夠轉化或轉染真核宿主細胞(例如COS或CHO細胞)。一旦將載體摻入合適的宿主中,在適合于核苷酸序列的高水平表達及纖溶酶原的收集和純化的條件下維持宿主。
合適的表達載體通常在宿主生物體中作為附加體或作為宿主染色體DNA的整合部分復制。通常,表達載體含有選擇標志物(例如氨芐青霉素抗性、潮霉素抗性、四環素抗性、卡那霉素抗性或新霉素抗性)以有助于對外源用期望的DNA序列轉化的那些細胞進行檢測。
大腸桿菌(Escherichia coli)是可以用于克隆主題抗體編碼多核苷酸的原核宿主細胞的例子。適合于使用的其它微生物宿主包括桿菌,諸如枯草芽孢桿菌(Bacillus subtilis)和其他腸桿菌科(enterobacteriaceae),諸如沙門氏菌屬(Salmonella)、沙雷氏菌屬(Serratia)、和各種假單胞菌屬(Pseudomonas)物種。在這些原核宿主中,也可以生成表達載體,其通常會含有與宿主細胞相容的表達控制序列(例如復制起點)。另外,會存在許多公知的啟動子,諸如乳糖啟動子系統,色氨酸(trp)啟動子系統,β-內酰胺酶啟動子系統,或來自噬菌體λ的啟動子系統。啟動子通常會控制表達,任選在操縱基因序列的情況中,并且具有核糖體結合位點序列等,以啟動并完成轉錄和翻譯。
其他微生物,諸如酵母也可用于表達。酵母(例如釀酒酵母(S.cerevisiae))和畢赤酵母(Pichia)是合適的酵母宿主細胞的例子,其中合適的載體根據需要具有表達控制序列(例如啟動子)、復制起點、終止序列等。典型的啟動子包含3-磷酸甘油酸激酶和其它糖分解酶。誘導型酵母啟動于特別包括來自醇脫氫酶、異細胞色素C、和負責麥芽糖和半乳糖利用的酶的啟動子。
在微生物外,哺乳動物細胞(例如在體外細胞培養物中培養的哺乳動物細胞)也可以用于表達并生成本發明的纖溶酶原(例如編碼主題抗-Tau抗體的多核苷酸)。參見Winnacker,From Genes to Clones,VCH Publishers,N.Y.,N.Y.(1987)。合適的哺乳動物宿主細胞包括CHO細胞系、各種Cos細胞系、HeLa細胞、骨髓瘤細胞系、和經轉化的B細胞或雜交瘤。用于這些細胞的表達載體可以包含表達控制序列,如復制起點,啟動子和增強子(Queen等,Immunol.Rev.89:49(1986)),以及必需的加工信息位點,諸如核糖體結合位點、RNA剪接位點、多聚腺苷酸化位點,和轉錄終止子序列。合適的表達控制序列的例子是白免疫球蛋白基因、SV40、腺病毒、牛乳頭瘤病毒、巨細胞病毒等衍生的啟動子。參見Co等,J.Immunol.148:1149(1992)。
一旦合成(化學或重組方式),可以依照本領域的標準規程,包括硫酸銨沉淀、親和柱、柱層析、高效液相層析(HPLC)、凝膠電泳等來純化本發明所述的纖溶酶原。該纖溶酶原是基本上純的,例如至少約80%至85%純的,至少約85%至90%純的,至少約90%至95%純的,或98%至99%純的或更純的,例如不含污染物,所述污染物如細胞碎片,除主題抗體以外的大分子,等等。
3.藥物配制劑
可以通過將具有所需純度的纖溶酶原與可選的藥用載體、賦形劑,或穩定劑(Remington's Pharmaceutical Sciences,16版,Osol,A.ed.(1980))混合形成凍干制劑或水溶液制備治療配制劑。可接受的載體、賦形劑、穩定劑在所用劑量及濃度下對受者無毒性,并包括緩沖劑例如磷酸鹽、檸檬酸鹽及其它有機酸;抗氧化劑包括抗壞血酸和蛋氨酸;防腐劑(例如十八烷基二甲基芐基氯化銨;氯化己烷雙胺;氯化芐烷銨(benzalkonium chloride),苯索氯銨;酚、丁醇或苯甲醇;烷基對羥基苯甲酸酯如甲基或丙基對羥基苯甲酸酯;鄰苯二酚;間苯二酚;環己醇;3-戊醇;間甲酚);低分子量多肽(少于約10個殘基);蛋白質如血清白蛋白、明膠或免疫球蛋白;親水聚合物如聚乙烯吡咯烷酮;氨基酸如甘氨酸、谷氨酰胺、天冬酰胺、組氨酸、精氨酸或賴氨酸;單糖、二糖及其它碳水化合物包括葡萄糖、甘露糖,或糊精;螯合劑如EDTA;糖類如蔗糖、甘露醇、巖藻糖或山梨醇;成鹽反離子如鈉;金屬復合物(例如鋅-蛋白復合物);和/或非離子表面活性劑,例如TWEENTM,PLURONICSTM或聚乙二醇(PEG)。優選凍干的抗-VEGF抗體配制劑在WO 97/04801中描述,其包含在本文中作為參考。
本發明的配制劑也可含有需治療的具體病癥所需的一種以上的活性化合物,優選活性互補并且相互之間沒有副作用的那些。例如,抗高血壓的藥物、抗心律失常的藥物、治療糖尿病的藥物等。
本發明的纖溶酶原可包裹在通過諸如凝聚技術或界面聚合而制備的微膠囊中,例如,可置入在膠質藥物傳送系統(例如,脂質體,白蛋白微球,微乳劑,納米顆粒和納米膠囊)中或置入粗滴乳狀液中的羥甲基纖維素或凝膠-微膠囊和聚-(甲基丙烯酸甲酯)微膠囊中。這些技術公開于Remington's Pharmaceutical Sciences 16th edition,Osol,A.Ed.(1980)。
用于體內給藥的本發明的纖溶酶原必需是無菌的。這可以通過在冷凍干燥和重新配制之前或之后通過除菌濾膜過濾而輕易實現。
本發明的纖溶酶原可制備緩釋制劑。緩釋制劑的適當實例包括具有一定形狀且含有糖蛋白的固體疏水聚合物半通透基質,例如膜或微膠囊。緩釋基質實例包括聚酯、水凝膠(如聚(2-羥基乙基-異丁烯酸酯)(Langer等,J.Biomed.Mater.Res.,15:167-277(1981);Langer,Chem.Tech.,12:98-105(1982))或聚(乙烯醇)、聚交酯(美國專利3773919,EP 58,481)、L-谷氨酸與乙基-L-谷氨酸的共聚物(Sidman,等,Biopolymers 22:547(1983))、不可降解的乙烯-乙烯乙酸酯(ethylene-vinyl acetate)(Langer,等,出處同上)、或可降解的乳酸-羥基乙酸共聚物如Lupron DepotTM(由乳酸-羥基乙酸共聚物和亮氨酰脯氨酸(leuprolide)乙酸酯組成的可注射的微球體),以及聚D-(-)-3-羥丁酸。聚合物如乙烯-乙酸乙烯酯和乳酸-羥基乙酸能持續釋放分子100天以上,而一些水凝膠釋放蛋白的時間卻較短。可以根據相關機理來設計使蛋白穩定的合理策略。例如,如果發現凝聚的機理是通過硫代二硫鍵互換而形成分子間S-S鍵,則可通過修飾巰基殘基、從酸性溶液中凍干、控制濕度、采用合適的添加劑、和開發特定的聚合物基質組合物來實現穩定。
4.給藥和劑量
可以通過不同方式,例如通過靜脈內、腹膜內、皮下、顱內、鞘內、動脈內(例如經由頸動脈)、肌內、鼻內、表面或皮內施用或脊髓或腦投遞來實現本發明藥物組合物的施用。氣溶膠制劑如鼻噴霧制劑包含活性劑的純化的水性或其它溶液及防腐劑和等滲劑。將此類制劑調節至與鼻粘膜相容的pH和等滲狀態。
在一些情況中,可以以下方式修飾或配制本發明的纖溶酶原藥物組合物,從而提供其穿過血腦屏障的能力。可以通過各種腸內和胃腸外施用路徑,包括口服,靜脈內等對患有血栓和/或血栓相關疾病的個體施用此類纖溶酶原的組合物。
用于胃腸外施用的制備物包括無菌水性或非水性溶液、懸浮液和乳劑。非水性溶劑的例子是丙二醇、聚乙二醇、植物油如橄欖油,和可注射有機酯,如油酸乙酯。水性載體包括水、醇性/水性溶液、乳劑或懸浮液,包括鹽水和緩沖介質。胃腸外媒介物包含氯化鈉溶液、林格氏右旋糖、右旋糖和氯化鈉、或固定油。靜脈內媒介物包含液體和營養補充物、電解質補充物,等等。也可以存在防腐劑和其他添加劑,諸如例如,抗微生物劑、抗氧化劑、螯合劑、和惰性氣體,等等。
在一些實施方案中,本發明的纖溶酶原與促進穿過血腦屏障的藥劑配制在一起。在一些情況中,本發明的纖溶酶原直接或經接頭與促進穿過血腦屏障的載體分子、肽或蛋白質融合。在一些實施方案中,本發明的纖溶酶原與結合內源血腦屏障(BBB)受體的多肽融合。連接纖溶酶原與結合內源BBB受體的多肽,促進穿過BBB。結合內源BBB受體的合適的多肽包括抗體,例如單克隆抗體,或其抗原結合片段,其特異性結合內源BBB受體。合適的內源BBB受體包括但不限于胰島素受在一些情況中,抗體是囊封于脂質體中的。參見例如美國專利公開文本No.2009/0156498。
醫務人員會基于各種臨床因素確定劑量方案。如醫學領域中公知的,任一患者的劑量取決于多種因素,包括患者的體型、體表面積、年齡、要施用的具體化合物、性別、施用次數和路徑、總體健康、和同時施用的其它藥物。本發明包含纖溶酶原的藥物組合物的劑量范圍可以例如為每天約0.0001至2000mg/kg,或約0.001至500mg/kg(例如0.02mg/kg,0.25mg/kg,0.5mg/kg,0.75mg/kg,10mg/kg,50mg/kg等等)受試者體重。例如,劑量可以是1mg/kg體重或50mg/kg體重或在1-50mg/kg的范圍,或至少1mg/kg。高于或低于此例示性范圍的劑量也涵蓋在內,特別是考慮到上述的因素。上述范圍中的中間劑量也包含在本發明的范圍內。受試者可以每天、隔天、每周或根據通過經驗分析確定的任何其它日程表施用此類劑量。例示性的劑量日程表包括連續幾天1-10mg/kg。在本發明的藥物施用過程中需要實時評估、定期評估血栓和血栓相關疾病的治療效果和安全性。
5.治療效力和治療安全性
本發明的一個實施方案涉及使用纖溶酶原治療受試者后,對治療效力和治療安全性的判斷。
治療效力評估:從治療開始周(基線周)到預設的治療階段之間對受試者進行日常平均疼痛評價,所述評價可以例如使用11點VAS量表疼痛評分、LANSS量表、神經病理性疼痛量表(NPS)或Likert量表(按照0-10分進行等級評分)等來進行。例如VAS量表,0表示無疼痛,11代表疼痛無法忍受。其中:
0分:無疼痛;
3分以下:有輕微的疼痛,能忍受;
4-6分:受試者疼痛并影響睡眠,尚能忍受;
7-10分:受試者有漸強烈的疼痛,疼痛難忍,影響食欲與睡眠。
也可以采用更精細的VAS量表進行評分,例如以100-毫米刻度評價疼痛。
還可將疼痛指數作為主要評價指標,同時設置次要評價指標,如關節活動度、功能狀態、生活質量等。
安全性評估:此外,本發明還涉及使用纖溶酶原及其變體對受試者進行治療過程中和治療后,對所述治療方案安全性的判斷,包括但不限于不良事件監測、臨床實驗室評價、心電圖(ECG)、生命體征測量,以及物理和神經檢查等,并對受試者中藥物的血清半衰期、治療半衰期、半數中毒量(TD50)、半數致死量(LD50)進行統計。不良事件定義為被給予藥物的患者或臨床試驗受試者中任何不利的醫學事件,所述事件不必與該治療具有因果關系。其中不良事件通常包括但不限于頭痛、頭暈、上呼吸道感染、惡心等。
6.制品或藥盒
本發明的一個實施方案涉及一種制品或藥盒,其包含本發明的纖溶酶原/纖溶酶。所述制品優選包括一個容器,標簽或包裝插頁。適當的容器有瓶子、小瓶、注射器等。容器可由各種材料如玻璃或塑料制成。所述容器含有組合物,所述組合物可有效治療本發明的疾病或病癥并具有無菌入口(例如所述容器可為靜脈內溶液包或小瓶,其含有可被皮下注射針穿透的塞子的)。所述組合物中至少一種活性劑為纖溶酶原/纖溶酶。所述容器上或所附的標簽說明所述組合物用于治療本發明所述糖尿病性神經病變。所述制品可進一步包含含有可藥用緩沖液的第二容器,諸如磷酸鹽緩沖的鹽水,林格氏溶液以及葡萄糖溶液。其可進一步包含從商業和使用者角度來看所需的其它物質,包括其它緩沖液、稀釋劑、過濾物、針和注射器。此外,所述制品包含帶有使用說明的包裝插頁,包括例如指示所述組合物的使用者將纖溶酶原組合物以及治療伴隨的疾病的其它藥物給藥患者。
附圖說明:
圖1顯示14-15周齡的糖尿病小鼠給予纖溶酶原后體重的變化。
圖2顯示14-15周齡的糖尿病小鼠給予纖溶酶原后機械觸誘發痛感應能力的變化。
圖3顯示14-15周齡的糖尿病小鼠在給藥纖溶酶原后第0、3、6、12天檢測冷刺激感應能力的結果。
圖4顯示14-15周齡的糖尿病小鼠在給藥纖溶酶原后第0、3、6、12天檢測機械痛敏感應能力的結果。
圖5顯示24-25周齡的糖尿病小鼠在給藥纖溶酶原后體重的變化。
圖6顯示24-25周齡的糖尿病小鼠在給藥纖溶酶原后第0、4、7、11、16天檢測機械觸誘發痛感應能力的結果。
圖7顯示24-25周齡的糖尿病小鼠在給藥纖溶酶原后第0、4、7、11、16天檢測冷刺激感應能力的結果。
圖8顯示24-25周齡的糖尿病小鼠在給纖溶酶原后第0、4、7、11、16天檢測機械痛敏感應能力的結果。
圖9顯示24-25周齡的糖尿病小鼠在連續15天給藥纖溶酶原后坐骨神經HE染色觀察結果。
圖10顯示24-25周齡的糖尿病小鼠在連續15天給藥纖溶酶原后坐骨神經纖維蛋白免疫染色觀察結果。
圖11顯示24-25周齡的糖尿病小鼠在連續31天給藥纖溶酶原后肝臟纖維蛋白免疫染色觀察結果。
圖12顯示24-25周齡的糖尿病小鼠在連續31天給藥纖溶酶原后肝臟F4/80免疫染色觀察結果。
圖13顯示24-25周齡的糖尿病小鼠在連續31天給藥纖溶酶原后腎臟纖維蛋白免疫染色觀察結果。
圖14顯示24-25周齡的糖尿病小鼠在連續31天給藥纖溶酶原后腎臟Bcl-2免疫染色觀察結果。
圖15顯示24-25周齡的糖尿病小鼠在連續31天給藥纖溶酶原后視網膜PAS染色觀察結果。
圖16顯示24-25周齡的糖尿病小鼠在連續15天給藥纖溶酶原后血清中D-二聚體的含量檢測結果。
圖17顯示24-25周齡的糖尿病小鼠在給藥纖溶酶原31天后血清心肌肌鈣蛋白I濃度檢測結果。
圖18顯示24-25周糖尿病小鼠給予纖溶酶原31天腎臟IgM免疫染色觀察結果。
圖19顯示24-25周糖尿病小鼠給予纖溶酶原31天后血清谷丙轉氨酶(ALT)檢測結果。
圖20顯示8周齡糖尿病小鼠給予纖溶酶原9天機械觸誘發痛感應能力的變化。
實施例
實施例1纖溶酶原對實驗動物體重的影響
14-15周齡db/db雄鼠10只,隨機分為兩組,給溶媒PBS對照組和給纖溶酶原組各5只。實驗開始當天記為第0天稱重分組,實驗第二天開始給纖溶酶原或PBS,并記為第1天。給纖溶酶原組小鼠按1mg/0.1mL/只/天尾靜脈注射纖溶酶原,給溶媒PBS對照組給予相同體積的PBS。在第0、3、6、12天分別稱體重。結果顯示給纖溶酶原組和給溶媒PBS對照組在第0、3、6、12天體重無顯著差異(圖1),說明纖溶酶原對動物體重影響不大。
實施例2纖溶酶原促進糖尿病小鼠對痛覺感應能力的修復
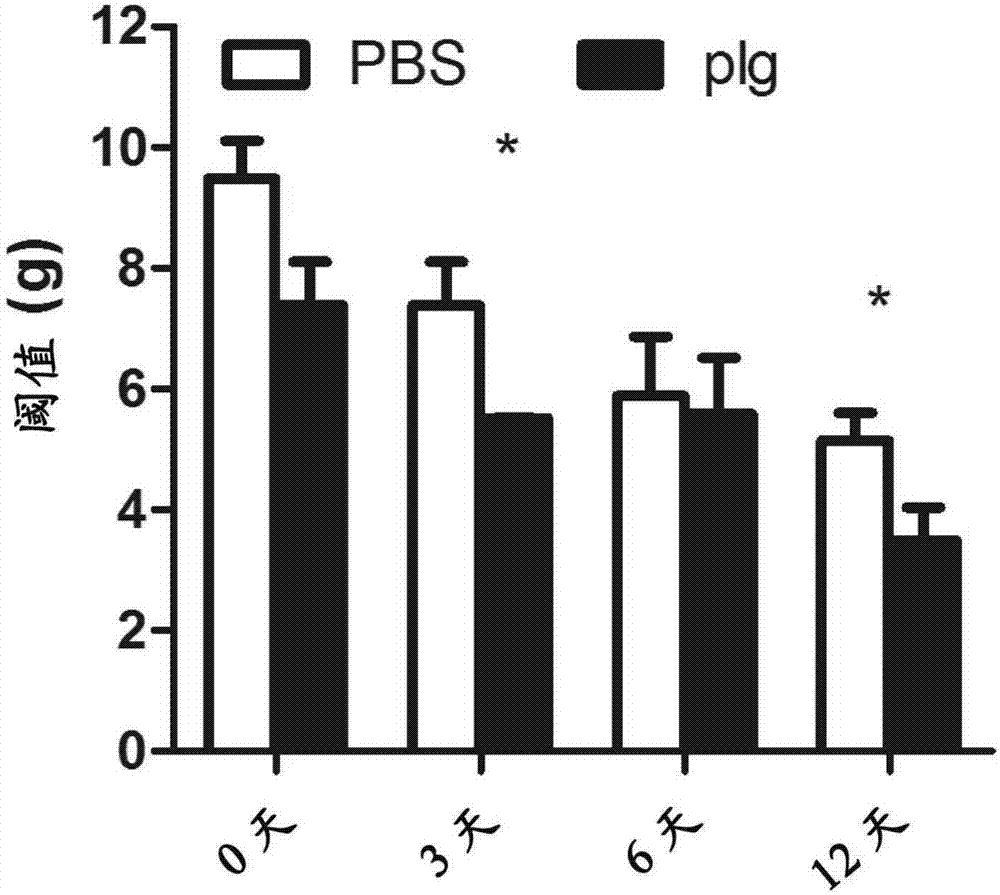
14-15周齡db/db雄鼠10只,隨機分為兩組,溶媒PBS對照組和給纖溶酶原組,每組各5只。實驗開始當天記為第0天稱重分組,實驗第二天開始給纖溶酶原或PBS并記為第1天。給纖溶酶原組小鼠按1mg/0.1mL/只/天尾靜脈注射纖溶酶原,給溶媒PBS對照組給予相同體積的PBS。在給纖溶酶原后第0,3,6,12天用Von-Frey纖維絲(Stoelting,USA)檢測動物對機械性損傷的敏感程度。以2.0g力為起始力,先檢測其左腳。若5次刺激有4次有縮爪反應即為陽性,記為該動物對機械損傷的閾值。若2.0g力刺激反應為陰性則以大一級的力刺激其右腳,若為陽性則計為其閾值,若為陰性則繼續以大一級的力刺激其左腳,如此交替刺激糖尿病鼠左右腳直到出現陽性反應[31]。Von Frey纖維絲實驗統計結果顯示,給藥3天和給藥11天后均觀察到其50%痛覺閾值顯著低于給溶媒PBS對照組(圖2),說明纖溶酶原修復了糖尿病小鼠對機械觸誘發痛(mechanical allodynia)的感應能力。
實施例3纖溶酶原恢復糖尿病小鼠對冷刺激的神經感應
14-15周齡db/db雄鼠10只,隨機分為兩組,給溶媒PBS對照組和給纖溶酶原組,每組各5只。實驗開始當天記為第0天稱重分組,實驗第二天開始給纖溶酶原或PBS并記為第1天。給纖溶酶原組小鼠按1mg/0.1mL/只/天尾靜脈注射纖溶酶原,給溶媒PBS對照組給予相同體積的PBS。在給纖溶酶原后第0,3,6,12天用去針頭注射器擠出一滴丙酮液珠并輕觸糖尿病鼠足底,使其覆蓋整個足底。從左腳開始,每隔3分鐘輪流刺激其左右腳,共刺激10次,并統計縮爪反應次數。反應百分比=縮爪次數/刺激次數×100%。
實驗結果顯示,在第0和第3天時,給纖溶酶原組和對照組對丙酮刺激無顯著差異,而第6天開始觀察到顯著差異,在第12天則觀察到極顯著差異(圖3)。這些結果表明,給纖溶酶原6天后顯示出了對冷覺顯著敏感,而在12天時出現極顯著的反應差異,說明纖溶酶原極顯著地修復了糖尿病小鼠對冷刺激的神經感應損傷。
實施例4纖溶酶原對糖尿病小鼠機械性痛敏感應的修復
14-15周齡db/db雄鼠10只,隨機分為兩組,給溶媒PBS對照組和給纖溶酶原組,每組各5只。實驗開始當天記為第0天稱重分組,實驗第二天開始給纖溶酶原或PBS并記為第1天。給纖溶酶原組小鼠按1mg/0.1mL/只/天尾靜脈注射纖溶酶原,給溶媒PBS對照組給予相同體積的PBS。在給纖溶酶原后第0,3,6,12天用美標27號針頭(27gauge-needle)以輕觸小鼠足底但不能刺穿其真皮層的力度刺激db/db鼠足底,從左腳開始,每隔3分鐘輪流刺激其左右腳,共刺激10次,并統計縮爪反應次數。反應百分比=縮爪次數/刺激次數×100%。給纖溶酶原組和給溶媒PBS對照組對針刺反應差異極顯著,P值小于0.0001(圖4),說明纖溶酶原極顯著地修復了糖尿病導致的神經機械性痛敏感應的損傷。
實施例5纖溶酶原對糖尿病后期神經損傷小鼠體重的影響
24-25周齡db/db雄鼠10只,隨機分為兩組,給溶媒PBS對照組和給纖溶酶原組,每組各5只。實驗開始當天記為第0天稱重分組,實驗第二天開始給纖溶酶原或PBS并記為第1天,連續給藥15天。給纖溶酶原組小鼠按2mg/0.2mL/只/天尾靜脈注射纖溶酶原,給溶媒PBS對照組給予相同體積的PBS。在給纖溶酶原第0、4、7、11、16天分別稱體重。結果顯示給纖溶酶原組和給溶媒PBS對照組在第0、4、7、11、16天體重(圖5)無顯著差異,說明纖溶酶原對動物體重影響不大。
實施例6纖溶酶原促進糖尿病后期神經損傷小鼠對機械觸誘發痛感應能力的修復
24-25周齡db/db雄鼠10只,隨機分為兩組,給溶媒PBS對照組和給纖溶酶原組,每組各5只。實驗開始當天記為第0天稱重分組,實驗第二天開始給纖溶酶原或PBS并記為第1天,連續給藥15天。給纖溶酶原組小鼠按2mg/0.2mL/只/天尾靜脈注射纖溶酶原,給溶媒PBS對照組給予相同體積的PBS。在給纖溶酶原后第0、4、7、11、16天用Von-Frey纖維絲(Stoelting,USA)檢測動物對機械性損傷的敏感程度。以2.0g力為起始力,先檢測其左腳。若5次刺激有2次有縮爪反應即為陽性,若為陽性即用小一級的力再對其右腳進行刺激;若為陰性,則用大一級的力對其右腳進行刺激,如此左右腳交替刺激,刺激間隔為5分鐘,總共刺激6次,然后根據S.R.Chaplan et.al.(1994)[32]介紹的方法計算其50%縮爪的閾值。
研究發現,與給溶媒PBS對照組相比,給纖溶酶原組的糖尿病小鼠機械觸誘發痛反應均一性增加,且在第16天檢測時發現與給溶媒PBS對照組相比出現了極顯著差異(圖6),說明纖溶酶原修復了神經損傷晚期的糖尿病小鼠對機械觸誘發痛(mechanical allodynia)的感應能力。
實施例7纖溶酶原對糖尿病后期神經損傷小鼠冷刺激感應的修復
24-25周齡db/db雄鼠10只,隨機分為兩組,給溶媒PBS對照組和給纖溶酶原組,每組各5只。實驗開始當天記為第0天稱重分組,實驗第二天開始給纖溶酶原或PBS并記為第1天,連續給藥15天。給纖溶酶原組小鼠按2mg/0.2mL/只/天尾靜脈注射纖溶酶原,給溶媒PBS對照組給予相同體積的PBS。在給藥后第0、4、7、11、16天用去針頭注射器擠出一滴丙酮液珠并輕觸db/db鼠足底,使其覆蓋整個足底。從左腳開始,每隔3分鐘輪流刺激其左右腳,共刺激10次,并統計縮爪反應次數。反應百分比=縮爪次數/刺激次數×100%。
實驗結果顯示,在第0和第4天時,給纖溶酶原組和給溶媒PBS對照組對丙酮刺激并無顯著差異,而第7天開始觀察到顯著差異,在第16天則觀察到極顯著差異,P值<0.0001(圖7),說明給藥15天后,糖尿病小鼠幾乎完全恢復了對冷刺激的反應,表明纖溶酶原極顯著地修復了晚期糖尿病的神經冷刺激損傷。
實施例8纖溶酶原對糖尿病后期神經損傷小鼠機械痛敏感應的修復
24-25周齡db/db雄鼠10只,隨機分為兩組,給溶媒PBS對照組和給纖溶酶原,每組各5只。實驗開始當天記為第0天稱重分組,實驗第二天開始給纖溶酶原或PBS并記為第1天,連續給藥15天。給纖溶酶原組小鼠按2mg/0.2mL/只/天尾靜脈注射纖溶酶原,給溶媒PBS對照組給予相同體積的PBS。在給纖溶酶原后第0、4、7、11、16天用27號針頭(27-gauge needle)以輕觸小鼠足底但不能刺穿其真皮層的力度刺激db/db鼠足底,從左腳開始,每隔3分鐘輪流刺激其左右腳,共刺激10次,并統計縮爪反應次數。反應百分比=縮爪次數/刺激次數×100%。
實驗結果顯示,在給纖溶酶原第7天或更早便可觀察到糖尿病后期神經損傷小鼠對針刺刺激感應的不同程度的恢復,在第11和16天觀察到給纖溶酶原組和給溶媒PBS對照組小鼠對針刺刺激反應有極顯著差異和顯著差異(圖8),說明纖溶酶原極顯著地修復了糖尿病后期小鼠的機械痛敏感應。
實施例9纖溶酶原對糖尿病后期神經損傷小鼠神經組織損傷的保護作用
24-25周齡db/db雄鼠10只,隨機分為兩組,給溶媒PBS對照組和給纖溶酶原組,每組各5只。實驗開始當天記為第0天稱重分組,實驗第二天開始給纖溶酶原或PBS并記為第1天,連續給藥15天。給纖溶酶原組小鼠按2mg/0.2mL/只/天尾靜脈注射纖溶酶原,給溶媒PBS對照組給予相同體積的PBS。在第16天處死小鼠并取坐骨神經在10%中性福爾馬林固定液中固定24小時。固定后的坐骨神經經酒精梯度脫水和二甲苯透明后進行石蠟包埋。組織切片厚度為5μm,切片脫蠟復水并用蘇木素和伊紅染色(HE染色),1%鹽酸酒精分化,氨水返藍,并酒精梯度脫水封片,切片在顯微鏡下400倍下觀察。
實驗結果顯示,給溶媒PBS對照組坐骨神經纖維間隙增寬,較大數量的髓鞘軸索腫脹(↑),少數軸索崩解(▲)(圖9A)。而纖溶酶原組神經纖維排列緊密,僅可見少量髓鞘軸索腫脹,崩解(圖9B)。說明纖溶酶原對糖尿病后期小鼠的神經組織損傷具有一定的修復作用。
實施例10纖溶酶原減少糖尿病后期神經損傷小鼠神經組織纖維蛋白水平
24-25周齡db/db雄鼠10只,隨機分為兩組,給溶媒PBS對照組和給纖溶酶原組,每組各5只。實驗開始當天記為第0天稱重分組,實驗第二天開始給纖溶酶原或PBS并記為第1天,連續給藥15天。給纖溶酶原組小鼠按2mg/0.2mL/只/天尾靜脈注射纖溶酶原,給溶媒PBS對照組給予相同體積的PBS。在第16天處死小鼠并取坐骨神經在10%中性福爾馬林固定液中固定24小時。固定后的坐骨神經經酒精梯度脫水和二甲苯透明后進行石蠟包埋。組織切片厚度為5μm,切片脫蠟復水后水洗1次,然后用PAP筆圈出組織。以3%TBS稀釋的雙氧水孵育15分鐘,水洗3次。10%正常羊血清(Vector laboratories,Inc.,USA)封閉1小時,吸走多余血清。兔抗小鼠纖維蛋白(原)抗體(Abcam)室溫孵育1小時或4℃孵育過夜,TBS洗3次。山羊抗兔IgG(HRP)抗體(Abcam)二抗室溫孵育1小時,TBS洗3次。按DAB試劑盒(Vector laboratories,Inc.,USA)顯色,水洗3次后蘇木素復染30秒,流水沖洗5分鐘。梯度脫水透明并封片,切片在顯微鏡下400倍下觀察。
纖維蛋白原是纖維蛋白的前體,在組織存在損傷的情況下,作為機體對損傷的一種應激反應,纖維蛋白原水解成纖維蛋白[33-35]。因此可將纖維蛋白原水平作為損傷程度的一個標志。
研究發現,與給溶媒PBS對照組(圖10A)相比,給纖溶酶原組(圖10B)的小鼠其坐骨神經纖維蛋白的水平降低,說明纖溶酶原使神經組織的損傷得到了一定程度的修復。
實施例11纖溶酶原減少糖尿病晚期肝組織纖維蛋白水平
24-25周齡db/db雄鼠10只,隨機分為兩組,給溶媒PBS對照組和給纖溶酶原組,每組各5只。實驗開始當天記為第0天稱重分組,實驗第二天開始給纖溶酶原或PBS并記為第1天,連續給藥31天。給纖溶酶原組小鼠按2mg/0.2mL/只/天尾靜脈注射纖溶酶原,給溶媒PBS對照組給予相同體積的PBS。在第32天處死小鼠并取肝臟組織在10%中性福爾馬林固定液中固定24小時。固定后的肝臟組織經酒精梯度脫水和二甲苯透明后進行石蠟包埋。組織切片厚度為5μm,切片脫蠟復水后水洗1次。以3%雙氧水孵育15分鐘,水洗2次,每次5分鐘。10%的正常羊血清液(Vector laboratories,Inc.,USA)封閉1小時;時間到后,棄除羊血清液,用PAP筆圈出組織。兔抗小鼠纖維蛋白(原)抗體(Abcam)4℃孵育過夜,TBS洗2次,每次5分鐘。山羊抗兔IgG(HRP)抗體(Abcam)二抗室溫孵育1小時,TBS洗2次,每次5分鐘。按DAB試劑盒(Vector laboratories,Inc.,USA)顯色,水洗3次后蘇木素復染30秒,流水沖洗5分鐘。梯度脫水透明并封片,切片在顯微鏡下200倍下觀察。
纖維蛋白原是纖維蛋白的前體,在組織存在損傷的情況下,作為機體對損傷的一種應激反應,纖維蛋白原水解成纖維蛋白[33-35]。因此可將纖維蛋白水平作為損傷程度的一個標志。
研究發現,與給溶媒PBS對照組(圖11A)相比,給纖溶酶原組(圖11B)的小鼠其肝臟組織纖維蛋白陽性著色淺,說明注射纖溶酶原能使糖尿病小鼠肝臟組織沉積的纖維蛋白顯著降低,反映出纖溶酶原對糖尿病小鼠的肝臟組織損傷有顯著修復作用。
實施例12纖溶酶原減輕糖尿病晚期小鼠肝臟組織的炎癥
24-25周齡db/db雄鼠10只,隨機分為兩組,給溶媒PBS對照組和給纖溶酶原組,每組各5只。實驗開始當天記為第0天稱重分組,實驗第二天開始給纖溶酶原或PBS并記為第1天,連續給藥31天。給纖溶酶原組小鼠按2mg/0.2mL/只/天尾靜脈注射纖溶酶原,給溶媒PBS對照組給予相同體積的PBS。給纖溶酶原31天后處死小鼠并取肝臟組織在10%中性福爾馬林固定液中固定24小時。固定后的肝臟組織經酒精梯度脫水和二甲苯透明后進行石蠟包埋。組織切片厚度為5μm,切片脫蠟復水后水洗1次。以3%雙氧水孵育15分鐘,水洗2次,每次5分鐘。10%正常羊血清(Vector laboratories,Inc.,USA)封閉1小時,時間到后甩去血清,用PAP筆圈出組織。針對F4/80的兔多克隆抗體(Abcam)4℃孵育過夜,TBS洗2次,每次5分鐘。山羊抗兔IgG(HRP)抗體(Abcam)二抗室溫孵育1小時,TBS洗2次。按DAB試劑盒(Vector laboratories,Inc.,USA)顯色,水洗3次后蘇木素復染30秒,流水沖洗5分鐘。梯度脫水透明并封片,切片在顯微鏡下400倍下觀察。
F4/80為巨噬細胞標志物,可以表示炎癥反應的程度和階段。結果顯示,給纖溶酶原組(圖12B)與給溶媒PBS對照組(圖12A)相比,給纖溶酶原組小鼠的F4/80陽性表達明顯降低,說明給纖溶酶原后肝臟組織炎癥減少。圖12C為F4/80免疫組化陽性表達數定量分析結果,給纖溶酶原組F4/80表達量顯著減少,且具有統計學差異,說明注射纖溶酶原能夠顯著減輕糖尿病小鼠肝臟的炎癥。
實施例13纖溶酶原促進糖尿病晚期小鼠腎臟纖維蛋白水解
24-25周齡db/db雄鼠20只,隨機分為兩組,給溶媒PBS對照組和給纖溶酶原組,每組各10只。實驗開始當天記為第0天稱重分組,實驗第二天開始給纖溶酶原或PBS并記為第1天,連續給藥31天。給纖溶酶原組小鼠按2mg/0.2mL/只/天尾靜脈注射纖溶酶原,給溶媒PBS對照組給予相同體積的PBS。在第32天處死小鼠并取腎臟在10%中性福爾馬林固定液中固定24小時。固定后的腎臟組織經酒精梯度脫水和二甲苯透明后進行石蠟包埋。組織切片厚度為5μm,切片脫蠟復水后水洗1次。以3%雙氧水孵育15分鐘,水洗2次,每次5分鐘。10%的正常羊血清液(Vector laboratories,Inc.,USA)封閉1小時;時間到后,棄除羊血清液,用PAP筆圈出組織。兔抗小鼠纖維蛋白(原)抗體(Abcam)4℃孵育過夜,TBS洗2次,每次5分鐘。山羊抗兔IgG(HRP)抗體(Abcam)二抗室溫孵育1小時,TBS洗2次,每次5分鐘。按DAB試劑盒(Vector laboratories,Inc.,USA)顯色,水洗3次后蘇木素復染30秒,流水沖洗5分鐘。梯度脫水透明并封片,切片在顯微鏡下200倍下觀察。
纖維蛋白原是纖維蛋白的前體,在組織存在損傷的情況下,作為機體對損傷的一種應激反應,纖維蛋白原水解成纖維蛋白沉積在損傷部位[33-35]。因此,可將纖維蛋白水平作為損傷程度的一個標志。
結果顯示,給纖溶酶原組(圖13B)比給溶媒PBS對照組(圖13A)纖維蛋白原陽性著色淺,說明注射纖溶酶原能夠顯著降低糖尿病小鼠腎臟沉積的纖維蛋白,反映出纖溶酶原對糖尿病小鼠的機體損傷有顯著修復作用。
實施例14纖溶酶原促進糖尿病晚期小鼠腎臟細胞凋亡抑制蛋白Bcl-2的表達
24-25周齡db/db雄鼠20只,隨機分為兩組,給溶媒PBS對照組和給纖溶酶原組,每組各10只。實驗開始當天記為第0天稱重分組,實驗第二天開始給纖溶酶原或PBS并記為第1天,連續給藥31天。給纖溶酶原組小鼠按2mg/0.2mL/只/天尾靜脈注射纖溶酶原,給溶媒PBS對照組給予相同體積的PBS。在第32天處死小鼠并取腎臟在10%中性福爾馬林固定液中固定24小時。固定后的腎臟組織經酒精梯度脫水和二甲苯透明后進行石蠟包埋。組織切片厚度為5μm,切片脫蠟復水后水洗1次。以3%雙氧水孵育15分鐘,水洗2次,每次5分鐘。10%的正常羊血清液(Vector laboratories,Inc.,USA)封閉1小時;時間到后,棄除羊血清液,用PAP筆圈出組織。兔抗小鼠Bcl-2抗體(Abcam)4℃孵育過夜,TBS洗2次,每次5分鐘。山羊抗兔IgG(HRP)抗體(Abcam)二抗室溫孵育1小時,TBS洗2次,每次5分鐘。按DAB試劑盒(Vector laboratories,Inc.,USA)顯色,水洗3次后蘇木素復染30秒,流水沖洗5分鐘。梯度脫水透明并封片,切片在顯微鏡下200倍下觀察。
Bcl-2為細胞凋亡抑制蛋白,在凋亡刺激因子作用下會下調表達[36,37]。Bcl-2免疫組化結果顯示,給纖溶酶原組(圖14B)腎小管上皮細胞陽性表達著色要明顯深于給溶媒PBS對照組(圖14A),且前者的著色范圍更廣。定量分析結果與觀察結果一致,且具有顯著差異(如圖14C)。這表明纖溶酶原能夠促進糖尿病小鼠腎臟細胞凋亡抑制分子Bcl-2的表達,從而能夠抑制糖尿病小鼠腎臟組織細胞的凋亡。
實施例15纖溶酶原改善糖尿病晚期小鼠視網膜的損傷
24-25周齡db/db雄鼠20只,隨機分為兩組,給溶媒PBS對照組和給纖溶酶原組,每組各10只。實驗開始當天記為第0天稱重分組,實驗第二天開始給纖溶酶原或PBS并記為第1天,連續給藥31天。給纖溶酶原組小鼠按2mg/0.2mL/只/天尾靜脈注射纖溶酶原,給溶媒PBS對照組給予相同體積的PBS。在第32天處死小鼠并取左側眼球在多聚甲醛固定液中固定24小時。固定后的眼球剝離出視網膜后,置于1mL 3%胰酶(Solarbio)的EP管中,在搖床中37℃震蕩消化2-3h。待視網膜出現軟化、脫落的現象后小心的將視網膜移入裝有蒸餾水的EP管中,于搖床中37℃震蕩2-3h,使視網膜上多余的組織脫落。輕柔的吹打視網膜,使其只剩血管層后在玻片上鋪片,自然風干。視網膜于Schiff氏液染色(PAS染色),1%鹽酸酒精分化,氨水返藍,并酒精梯度脫水二甲苯透明后封片,在顯微鏡下400倍下觀察。
從實驗結果可以看出,與纖溶酶原組(圖15B)相比,給溶媒PBS對照組(圖15A)db/db鼠視網膜毛細血管管徑粗細不一,血管管壁增厚深染,血管內皮細胞(Δ)增生,周細胞(↓)明顯減少,而給纖溶酶原組病理改變明顯減輕;定量分析發現給纖溶酶原組與給溶媒PBS對照組相比無細胞血管長度(圖15C)顯著減少,并且統計學分析結果顯示顯著差異。說明纖溶酶原能夠顯著促進糖尿病后期小鼠視網膜損傷的修復。
實施例16纖溶酶原促進糖尿病造成的微血栓的溶解
24-25周齡db/db雄鼠10只,隨機分為兩組,給溶媒PBS對照組和給纖溶酶原組,每組各5只。實驗開始當天記為第0天稱重分組,實驗第二天開始給纖溶酶原或PBS并記為第1天,連續給藥15天。給纖溶酶原組小鼠按2mg/0.2mL/只/天尾靜脈注射纖溶酶原,給溶媒PBS對照組給予相同體積的PBS。在第16天摘眼球取血,全血靜置后血清用于檢測血液中D-二聚體含量。
結果顯示,給藥15天后,給纖溶酶原組血清中D-二聚體含量顯著上升(圖16),說明給纖溶酶原后,由于糖尿病造成的微血栓顯著溶解。
實施例17纖溶酶原促進糖尿病晚期心肌損傷的修復
24-25周齡db/db雄鼠28只,隨機分為兩組,給溶媒PBS對照組12只,給纖溶酶原組16只。實驗開始當天記為第0天稱重分組,實驗第二天開始給纖溶酶原或PBS并記為第1天,連續給藥31天。給纖溶酶原組小鼠按2mg/0.2mL/只/天尾靜脈注射纖溶酶原,給溶媒PBS對照組給予相同體積的PBS。第32天摘除眼球取血,以3500r/min離心15-20分鐘,并取心取上清進行心肌肌鈣蛋白I的濃度測定。
心肌肌鈣蛋白I(cardiac troponin,CTNI)是心肌損傷的重要標志物,其血清濃度能夠反映心肌損傷的程度[38]。結果顯示,給纖溶酶原組心肌肌鈣蛋白I的濃度要明顯的低于給溶媒PBS對照組,且具有極顯著的統計學差異(圖17)。說明纖溶酶原能夠極顯著促進糖尿病后期小鼠心肌損傷的修復。
實施例18纖溶酶原降低糖尿病晚期小鼠腎臟的損傷
24-25周齡db/db雄鼠8只,隨機分為兩組,給溶媒PBS對照組和給纖溶酶原組,每組各4只。實驗開始當天記為第0天稱重分組,實驗第二天開始給纖溶酶原或PBS并記為第1天,連續給藥31天。給纖溶酶原組小鼠按2mg/0.2mL/只/天尾靜脈注射纖溶酶原,給溶媒PBS對照組給予相同體積的PBS。在第32天檢測生理指標結束,處死小鼠并取腎臟在10%中性福爾馬林固定液中固定24小時。固定后的腎臟組織經酒精梯度脫水和二甲苯透明后進行石蠟包埋。組織切片厚度為5μm,切片脫蠟復水后水洗1次。以3%雙氧水孵育15分鐘,水洗2次,每次5分鐘。山羊抗鼠IgM(HRP)抗體(Abcam)室溫孵育1小時,TBS洗2次,每次5分鐘。按DAB試劑盒(Vector laboratories,Inc.,USA)顯色,水洗3次后蘇木素復染30秒,流水沖洗5分鐘。梯度脫水透明并封片,切片在顯微鏡下400倍下觀察。
IgM抗體在清除凋亡和壞死細胞過程中發揮著重要作用[39-41]。因此,其表達能夠反映組織器官的損傷情況。
結果顯示,給纖溶酶原組(圖18B)小鼠腎小球IgM的陽性著色淺于給溶媒PBS對照組(圖18A),并且范圍也較小,統計分析結果與觀察結果一致(圖18C),這表明注射纖溶酶原后腎小球的損傷明顯的改善,反映出纖溶酶原對糖尿病小鼠的機體損傷有顯著修復功能。
實施例19纖溶酶原促進糖尿病小鼠肝臟損的修復
25-28周齡db/db雄鼠9只,隨機分為兩組,給溶媒PBS對照組3只,給纖溶酶原組6只。實驗開始當天記為第0天稱重分組,實驗第二天開始給纖溶酶原或PBS并記為第1天,連續給藥31天。給纖溶酶原組小鼠按2mg/0.2mL/只/天尾靜脈注射纖溶酶原,給溶媒PBS對照組給予相同體積的PBS。給纖溶酶原31天后摘眼球采全血,待血清析出后4℃3500r/min離心10分鐘,取上清液進行檢測。本實驗使用谷丙轉氨酶檢測試劑盒(南京建成生物工程研究所,貨號C009-2),運用賴氏比色法(Reitman-Frankel)檢測血清中谷丙轉氨酶(ALT)的含量。
谷丙轉氨酶是肝臟健康狀態的一個重要指標[42,43],谷丙轉氨酶的正常參考值區間為9~50U/L。檢測結果顯示,給溶媒PBS對照組血清中ALT的含量顯著高于正常生理指標,而給纖溶酶原組已經恢復到體內的正常水平,并且給纖溶酶原組要顯著低于給溶媒PBS對照組,且具有統計學差異(圖19)。說明在糖尿病晚期模型小鼠中,注射纖溶酶原能有效地修復肝損傷。
實施例20纖溶酶原促進糖尿病小鼠對痛覺感應能力的修復
8周齡db/db雄鼠8只,隨機分為兩組,給溶媒PBS對照組和給纖溶酶原組,每組4只。實驗開始當天記為第0天稱重分組,實驗第二天開始給纖溶酶原或PBS并記為第1天,連續給藥8天。給纖溶酶原組小鼠按2mg/0.2mL/只/天尾靜脈注射纖溶酶原,給溶媒PBS對照組給予相同體積的PBS。在給纖溶酶原后第0,3,6、9天用Von-Frey纖維絲(Stoelting,USA)檢測動物對機械性損傷的敏感程度。以2.0g力為起始力,先檢測其左腳。若5次刺激有2次有縮爪反應即為陽性,若為陽性即用小一級的力再對其右腳進行刺激;若為陰性,則用大一級的力對其右腳進行刺激,如此左右腳交替刺激,刺激間隔為5分鐘,總共刺激6次,然后根據S.R.Chaplan et.al.(1994)[32]介紹的方法計算其50%縮爪的閾值。
db/db鼠在4周左右時發展成糖尿病鼠,8-12周時痛覺超敏,12周以后則痛覺脫敏[45,46]。因此,我們選擇8周齡超敏期的db/db鼠來進行實驗。
結果顯示,與給溶酶PBS對照組相比,給纖溶酶原組小鼠的痛覺閾值顯著升高(圖20)。說明纖溶酶原能夠顯著減輕糖尿病早期神經損傷所致的痛覺超敏(過度敏感)。
參考文獻:
[1]Md.Shahidul Islam,2013.Animal Models of Diabetic Neuropathy:Progress Since 1960s.Journal of Diabetes Research.
[2]Eizirik DL,Miani M,Cardozo AK.2013.Signalling danger:Endoplasmic reticulum stress and the unfolded protein response in pancreatic islet inflammation.Diabetologia 56:234–241.
[3]Said G.Diabetic neuropathy.Nat Clin Pract Neurol 2007;3:331-40.
[4]Vincent AM,Callaghan BC,Smith AL,Feldman EL.2011.Diabetic neuropathy:Cellular mechanisms as therapeutic targets.Nat Rev Neurol 7:573–583.
[5]Alexander CM and Werb,Z.(1991).Extracellular matrix degradation.In Cell Biology of Extracellular Matrix,Hay ED,ed.(New York:Plenum Press),pp.255-302.
[6]Werb,Z.,Mainardi,C.L.,Vater,C.A.,and Harris,E.D.,Jr.(1977).Endogenous activiation of latent collagenase by rheumatoid synovial cells.Evidence for a role of plasminogen activator.N.Engl.J.Med.296,1017-1023.
[7]He,C.S.,Wilhelm,S.M.,Pentland,A.P.,Marmer,B.L.,Grant,G.A.,Eisen,A.Z.,and Goldberg,G.I.(1989).Tissue cooperation in a proteolytic cascade activating human interstitial collagenase.Proc.Natl.Acad.Sci.U.S.A 86,2632-2636.
[8]Stoppelli,M.P.,Corti,A.,Soffientini,A.,Cassani,G.,Blasi,F.,and Assoian,R.K.(1985).Differentiation-enhanced binding of the amino-terminal fragment of human urokinase plasminogen activator to a specific receptor on U937monocytes.Proc.Natl.Acad.Sci.U.S.A 82,4939-4943.
[9]Vassalli,J.D.,Baccino,D.,and Belin,D.(1985).A cellular binding site for the Mr 55,000 form of the human plasminogen activator,urokinase.J.Cell Biol.100,86-92.
[10]Wiman,B.and Wallen,P.(1975).Structural relationship between"glutamic acid"and "lysine"forms of human plasminogen and their interaction with the NH2-terminal activation peptide as studied by affinity chromatography.Eur.J.Biochem.50,489-494.
[11]Saksela,O.and Rifkin,D.B.(1988).Cell-associated plasminogen activation:regulation and physiological functions.Annu.Rev.Cell Biol.4,93-126.
[12]Raum,D.,Marcus,D.,Alper,C.A.,Levey,R.,Taylor,P.D.,and Starzl,T.E.(1980).Synthesis of human plasminogen by the liver.Science 208,1036-1037
[13]Wallén P(1980).Biochemistry of plasminogen.In Fibrinolysis,Kline DL and Reddy KKN,eds.(Florida:CRC
[14]Sottrup-Jensen,L.,Zajdel,M.,Claeys,H.,Petersen,T.E.,and Magnusson,S.(1975).Amino-acid sequence of activation cleavage site in plasminogen:homology with"pro"part of prothrombin.Proc.Natl.Acad.Sci.U.S.A 72,2577-2581.
[15]Collen,D.and Lijnen,H.R.(1991).Basic and clinical aspects of fibrinolysis and thrombolysis.Blood 78,3114-3124.
[16]Alexander,C.M.and Werb,Z.(1989).Proteinases and extracellular matrix remodeling.Curr.Opin.Cell Biol.1,974-982.
[17]Mignatti,P.and Rifkin,D.B.(1993).Biology and biochemistry of proteinases in tumor invasion.Physiol Rev.73,161-195.
[18]Collen,D.(2001).Ham-Wasserman lecture:role of the plasminogen system in fibrin-homeostasis and tissue remodeling.Hematology.(Am.Soc.Hematol.Educ.Program.)1-9.
[19]Rifkin,D.B.,Moscatelli,D.,Bizik,J.,Quarto,N.,Blei,F.,Dennis,P.,Flaumenhaft,R.,and Mignatti,P.(1990).Growth factor control of extracellular proteolysis.Cell Differ.Dev.32,313-318.
[20]Andreasen,P.A.,Kjoller,L.,Christensen,L.,and Duffy,M.J.(1997).The urokinase-type plasminogen activator system in cancer metastasis:a review.Int.J.Cancer 72,1-22.
[21]Rifkin,D.B.,Mazzieri,R.,Munger,J.S.,Noguera,I.,and Sung,J.(1999).Proteolytic control of growth factor availability.APMIS 107,80-85.
[22]Cheng HT,Dauch JR,Hayes JM,Hong Y,Feldman EL.2009.Nerve growth factor mediates mechanical allodynia in a mouse model of type 2 diabetes.J Neuropathol Exp Neurol 68:1229–1243.
[23]Ii M,Nishimura H,Kusano KF,Qin G,Yoon YS,Wecker A,Asahara T,Losordo DW.2005.Neuronal nitric oxide synthase mediates statin-induced restoration of vasa nervorum and reversal of diabetic neuropathy.Circulation 112:93–102.
[24]Kan M,Guo G,Singh B,Singh V,Zochodne DW.2012.Glucagon-like peptide 1,insulin,sensory neurons,and diabetic neuropathy.J Neuropathol Exp Neurol 71:494–510.
[25]Sullivan KA,Hayes JM,Wiggin TD,Backus C,Su Oh S,Lentz SI,Brosius F 3rd,Feldman EL.2007.Mouse models of diabetic neuropathy.Neurobiol Dis 28:276–285.
[26]Wang L,Chopp M,Szalad A,Liu Z,Bolz M,Alvarez FM,Lu M,Zhang L,Cui Y,Zhang RL,Zhang ZG.2011.Phosphodiesterase-5 is a therapeutic target for peripheral neuropathy in diabetic mice.Neuroscience 193:399–410.
[27]Marder V J,Novokhatny V.Direct fibrinolytic agents:biochemical attributes,preclinical foundation and clinical potential[J].Journal of Thrombosis and Haemostasis,2010,8(3):433-444.
[28]Sottrup-Jensen L,Claeys H,Zajdel M,et al.The primary structure of human plasminogen:Isolation of two lysine-binding fragments and one“mini”-plasminogen(MW,38,000)by elastase-catalyzed-specific limited proteolysis[J].Progress in chemical fibrinolysis and thrombolysis,1978,3:191-209.
[29]Nagai N,Demarsin E,Van Hoef B,et al.Recombinant human microplasmin:production and potential therapeutic properties[J].Journal of Thrombosis and Haemostasis,2003,1(2):307-313.
[30]Hunt J A,Petteway Jr S R,Scuderi P,et al.Simplified recombinant plasmin:production and fu-nctional comparison of a novel thrombolytic molecule with plasma-derived plasmin[J].Thromb Haemost,2008,100(3):413-419.
[31]Yoon Choi a,Young Wook Yoon a,Heung Sik Na,Sun Ho Kim,Jin MO Chung.Behavioral signs of ongoing pain and cold allodynia in a rat model of neuropathic pain,Pain,59(1994)369-376.
[32]S.R.Chaplan,et al.,Quantitative assessment of tactile allodynia in the rat paw,Journal of Neuroscience Methods 53(1994)55-63.
[33]Jae Kyu Ryu,Mark A.Petersen,Sara G.Murray et al.Blood coagulation protein fibrinogen promotes autoimmunity and demyelination via chemokine release and antigen presentation.NATURE COMMUNICATIONS,2015,6:8164.
[34]Dimitrios Davalos,Katerina Akassoglou.Fibrinogen as a key regulator of inflammation in disease.Seminars in Immunopathology,2012.34(1):43-62.
[35]Valvi D,Mannino DM,Mullerova H,et al.Fibrinogen,chronic obstructive pulmonary disease(COPD)and outcomes in two United States cohorts.Int J Chron Obstruct Pulmon Dis 2012;7:173–82.
[36]Moungj aroen J,Nimmannit U,Callery PS,Wang L,Azad N,Lipipun V,Chanvorachote P,Rojanasakul Y(2006).Reactive oxygen species mediate caspase activation and apoptosis induced by lipoic acid in human lung epithelial cancer cells through Bcl-2 downregulation.J Pharmacol Exp Ther 319,1062–1069.
[37]Wang L,Chanvorachote P,Toledo D,Stehlik C,Mercer RR,Castranova V,Rojanasakul Y (2008).Peroxide is a key mediator of Bcl-2 down-regulation and apoptosis induction by cisplatinin human lung cancer cells.Mol Pharmacol 73,119–127.
[38]R.Langhorn and J.L.Willesen.Cardiac Troponins in Dogs and Cats.J Vet Intern Med 2016;30:36–50.
[39]Zwart B,Ciurana C,Rensink I,Manoe R,Hack CE,et al.(2004)Complement activation by apoptotic cells occurs predominantly via IgM and is limited to late apoptotic(secondary necrotic)cells.Autoimmunity 37:95–102.
[40]Zhang M,Takahashi K,Alicot EM,Vorup-Jensen T,Kessler B,et al.(2006)Activation of the lectin pathway by natural IgM in a model of ischemia/reperfusion injury.J Immunol 177:4727–4734.
[41]Kim SJ,Gershov D,Ma X,Brot N,Elkon KB(2002)I-PLA2 Activation during Apoptosis Promotes the Exposure of Membrane Lysophosphatidylcholine Leading to Binding by Natural Immunoglobulin M Antibodies and Complement Activation.The Journal of Experimental Medicine 196:655–665.
[42]Karmen A,Wroblewski F,Ladue JS(Jan 1955).Transaminase activity in human blood.The Journal of Clinical Investigation.34(1):126–31
[43]Wang CS,Chang TT,Yao WJ,Wang ST,Chou P(Apr 2012).Impact of increasing alanine aminotransferase levels within normal range on incident diabetes.Journal of the Formosan Medical Association=Taiwan Yi Zhi.111(4):201–8.
[44]Roy S,Sato T,Paryani G,Kao R:Downregulation of fibronectin overexpression reduces basement membrane thickening and vascular lesions in retinas of galactose-fed rats.Diabetes 2003,52:1229–1234.
[45]Cheng HT,Dauch JR,Hayes JM,Hong Y,Feldman EL.2009.Nerve growthfactor mediates mechanical allodynia in a mouse model of type 2 diabetes.J Neuropathol Exp Neurol 68:1229–1243.
[46]Ii M,Nishimura H,Kusano KF,Qin G,Yoon YS,Wecker A,Asahara T,Losordo DW.2005.Neuronal nitric oxide synthase mediatesstatin-induced restoration of vasa nervorum and reversal of diabetic neuropathy.Circulation 112:93–102。
序列表
<110> 深圳瑞健生命科學研究院有限公司
<120> 一種預防或治療糖尿病性神經損傷及其相關病癥的方法
<130> PCK02771
<160> 14
<170> PatentIn version 3.5
<210> 1
<211> 2376
<212> DNA
<213> 不含有信號肽的天然纖溶酶原(Glu-PLG,Glu-纖維蛋白溶酶原)核酸序列
<400> 1
gagcctctgg atgactatgt gaatacccag ggggcttcac tgttcagtgt cactaagaag 60
cagctgggag caggaagtat agaagaatgt gcagcaaaat gtgaggagga cgaagaattc 120
acctgcaggg cattccaata tcacagtaaa gagcaacaat gtgtgataat ggctgaaaac 180
aggaagtcct ccataatcat taggatgaga gatgtagttt tatttgaaaa gaaagtgtat 240
ctctcagagt gcaagactgg gaatggaaag aactacagag ggacgatgtc caaaacaaaa 300
aatggcatca cctgtcaaaa atggagttcc acttctcccc acagacctag attctcacct 360
gctacacacc cctcagaggg actggaggag aactactgca ggaatccaga caacgatccg 420
caggggccct ggtgctatac tactgatcca gaaaagagat atgactactg cgacattctt 480
gagtgtgaag aggaatgtat gcattgcagt ggagaaaact atgacggcaa aatttccaag 540
accatgtctg gactggaatg ccaggcctgg gactctcaga gcccacacgc tcatggatac 600
attccttcca aatttccaaa caagaacctg aagaagaatt actgtcgtaa ccccgatagg 660
gagctgcggc cttggtgttt caccaccgac cccaacaagc gctgggaact ttgtgacatc 720
ccccgctgca caacacctcc accatcttct ggtcccacct accagtgtct gaagggaaca 780
ggtgaaaact atcgcgggaa tgtggctgtt accgtgtccg ggcacacctg tcagcactgg 840
agtgcacaga cccctcacac acataacagg acaccagaaa acttcccctg caaaaatttg 900
gatgaaaact actgccgcaa tcctgacgga aaaagggccc catggtgcca tacaaccaac 960
agccaagtgc ggtgggagta ctgtaagata ccgtcctgtg actcctcccc agtatccacg 1020
gaacaattgg ctcccacagc accacctgag ctaacccctg tggtccagga ctgctaccat 1080
ggtgatggac agagctaccg aggcacatcc tccaccacca ccacaggaaa gaagtgtcag 1140
tcttggtcat ctatgacacc acaccggcac cagaagaccc cagaaaacta cccaaatgct 1200
ggcctgacaa tgaactactg caggaatcca gatgccgata aaggcccctg gtgttttacc 1260
acagacccca gcgtcaggtg ggagtactgc aacctgaaaa aatgctcagg aacagaagcg 1320
agtgttgtag cacctccgcc tgttgtcctg cttccagatg tagagactcc ttccgaagaa 1380
gactgtatgt ttgggaatgg gaaaggatac cgaggcaaga gggcgaccac tgttactggg 1440
acgccatgcc aggactgggc tgcccaggag ccccatagac acagcatttt cactccagag 1500
acaaatccac gggcgggtct ggaaaaaaat tactgccgta accctgatgg tgatgtaggt 1560
ggtccctggt gctacacgac aaatccaaga aaactttacg actactgtga tgtccctcag 1620
tgtgcggccc cttcatttga ttgtgggaag cctcaagtgg agccgaagaa atgtcctgga 1680
agggttgtag gggggtgtgt ggcccaccca cattcctggc cctggcaagt cagtcttaga 1740
acaaggtttg gaatgcactt ctgtggaggc accttgatat ccccagagtg ggtgttgact 1800
gctgcccact gcttggagaa gtccccaagg ccttcatcct acaaggtcat cctgggtgca 1860
caccaagaag tgaatctcga accgcatgtt caggaaatag aagtgtctag gctgttcttg 1920
gagcccacac gaaaagatat tgccttgcta aagctaagca gtcctgccgt catcactgac 1980
aaagtaatcc cagcttgtct gccatcccca aattatgtgg tcgctgaccg gaccgaatgt 2040
ttcatcactg gctggggaga aacccaaggt acttttggag ctggccttct caaggaagcc 2100
cagctccctg tgattgagaa taaagtgtgc aatcgctatg agtttctgaa tggaagagtc 2160
caatccaccg aactctgtgc tgggcatttg gccggaggca ctgacagttg ccagggtgac 2220
agtggaggtc ctctggtttg cttcgagaag gacaaataca ttttacaagg agtcacttct 2280
tggggtcttg gctgtgcacg ccccaataag cctggtgtct atgttcgtgt ttcaaggttt 2340
gttacttgga ttgagggagt gatgagaaat aattaa 2376
<210> 2
<211> 791
<212> PRT
<213> 不含有信號肽的天然纖溶酶原(Glu-PLG,Glu-纖維蛋白溶酶原)氨基酸序列
<400> 2
Glu Pro Leu Asp Asp Tyr Val Asn Thr Gln Gly Ala Ser Leu Phe Ser
1 5 10 15
Val Thr Lys Lys Gln Leu Gly Ala Gly Ser Ile Glu Glu Cys Ala Ala
20 25 30
Lys Cys Glu Glu Asp Glu Glu Phe Thr Cys Arg Ala Phe Gln Tyr His
35 40 45
Ser Lys Glu Gln Gln Cys Val Ile Met Ala Glu Asn Arg Lys Ser Ser
50 55 60
Ile Ile Ile Arg Met Arg Asp Val Val Leu Phe Glu Lys Lys Val Tyr
65 70 75 80
Leu Ser Glu Cys Lys Thr Gly Asn Gly Lys Asn Tyr Arg Gly Thr Met
85 90 95
Ser Lys Thr Lys Asn Gly Ile Thr Cys Gln Lys Trp Ser Ser Thr Ser
100 105 110
Pro His Arg Pro Arg Phe Ser Pro Ala Thr His Pro Ser Glu Gly Leu
115 120 125
Glu Glu Asn Tyr Cys Arg Asn Pro Asp Asn Asp Pro Gln Gly Pro Trp
130 135 140
Cys Tyr Thr Thr Asp Pro Glu Lys Arg Tyr Asp Tyr Cys Asp Ile Leu
145 150 155 160
Glu Cys Glu Glu Glu Cys Met His Cys Ser Gly Glu Asn Tyr Asp Gly
165 170 175
Lys Ile Ser Lys Thr Met Ser Gly Leu Glu Cys Gln Ala Trp Asp Ser
180 185 190
Gln Ser Pro His Ala His Gly Tyr Ile Pro Ser Lys Phe Pro Asn Lys
195 200 205
Asn Leu Lys Lys Asn Tyr Cys Arg Asn Pro Asp Arg Glu Leu Arg Pro
210 215 220
Trp Cys Phe Thr Thr Asp Pro Asn Lys Arg Trp Glu Leu Cys Asp Ile
225 230 235 240
Pro Arg Cys Thr Thr Pro Pro Pro Ser Ser Gly Pro Thr Tyr Gln Cys
245 250 255
Leu Lys Gly Thr Gly Glu Asn Tyr Arg Gly Asn Val Ala Val Thr Val
260 265 270
Ser Gly His Thr Cys Gln His Trp Ser Ala Gln Thr Pro His Thr His
275 280 285
Asn Arg Thr Pro Glu Asn Phe Pro Cys Lys Asn Leu Asp Glu Asn Tyr
290 295 300
Cys Arg Asn Pro Asp Gly Lys Arg Ala Pro Trp Cys His Thr Thr Asn
305 310 315 320
Ser Gln Val Arg Trp Glu Tyr Cys Lys Ile Pro Ser Cys Asp Ser Ser
325 330 335
Pro Val Ser Thr Glu Gln Leu Ala Pro Thr Ala Pro Pro Glu Leu Thr
340 345 350
Pro Val Val Gln Asp Cys Tyr His Gly Asp Gly Gln Ser Tyr Arg Gly
355 360 365
Thr Ser Ser Thr Thr Thr Thr Gly Lys Lys Cys Gln Ser Trp Ser Ser
370 375 380
Met Thr Pro His Arg His Gln Lys Thr Pro Glu Asn Tyr Pro Asn Ala
385 390 395 400
Gly Leu Thr Met Asn Tyr Cys Arg Asn Pro Asp Ala Asp Lys Gly Pro
405 410 415
Trp Cys Phe Thr Thr Asp Pro Ser Val Arg Trp Glu Tyr Cys Asn Leu
420 425 430
Lys Lys Cys Ser Gly Thr Glu Ala Ser Val Val Ala Pro Pro Pro Val
435 440 445
Val Leu Leu Pro Asp Val Glu Thr Pro Ser Glu Glu Asp Cys Met Phe
450 455 460
Gly Asn Gly Lys Gly Tyr Arg Gly Lys Arg Ala Thr Thr Val Thr Gly
465 470 475 480
Thr Pro Cys Gln Asp Trp Ala Ala Gln Glu Pro His Arg His Ser Ile
485 490 495
Phe Thr Pro Glu Thr Asn Pro Arg Ala Gly Leu Glu Lys Asn Tyr Cys
500 505 510
Arg Asn Pro Asp Gly Asp Val Gly Gly Pro Trp Cys Tyr Thr Thr Asn
515 520 525
Pro Arg Lys Leu Tyr Asp Tyr Cys Asp Val Pro Gln Cys Ala Ala Pro
530 535 540
Ser Phe Asp Cys Gly Lys Pro Gln Val Glu Pro Lys Lys Cys Pro Gly
545 550 555 560
Arg Val Val Gly Gly Cys Val Ala His Pro His Ser Trp Pro Trp Gln
565 570 575
Val Ser Leu Arg Thr Arg Phe Gly Met His Phe Cys Gly Gly Thr Leu
580 585 590
Ile Ser Pro Glu Trp Val Leu Thr Ala Ala His Cys Leu Glu Lys Ser
595 600 605
Pro Arg Pro Ser Ser Tyr Lys Val Ile Leu Gly Ala His Gln Glu Val
610 615 620
Asn Leu Glu Pro His Val Gln Glu Ile Glu Val Ser Arg Leu Phe Leu
625 630 635 640
Glu Pro Thr Arg Lys Asp Ile Ala Leu Leu Lys Leu Ser Ser Pro Ala
645 650 655
Val Ile Thr Asp Lys Val Ile Pro Ala Cys Leu Pro Ser Pro Asn Tyr
660 665 670
Val Val Ala Asp Arg Thr Glu Cys Phe Ile Thr Gly Trp Gly Glu Thr
675 680 685
Gln Gly Thr Phe Gly Ala Gly Leu Leu Lys Glu Ala Gln Leu Pro Val
690 695 700
Ile Glu Asn Lys Val Cys Asn Arg Tyr Glu Phe Leu Asn Gly Arg Val
705 710 715 720
Gln Ser Thr Glu Leu Cys Ala Gly His Leu Ala Gly Gly Thr Asp Ser
725 730 735
Cys Gln Gly Asp Ser Gly Gly Pro Leu Val Cys Phe Glu Lys Asp Lys
740 745 750
Tyr Ile Leu Gln Gly Val Thr Ser Trp Gly Leu Gly Cys Ala Arg Pro
755 760 765
Asn Lys Pro Gly Val Tyr Val Arg Val Ser Arg Phe Val Thr Trp Ile
770 775 780
Glu Gly Val Met Arg Asn Asn
785 790
<210> 3
<211> 2433
<212> DNA
<213> 含有信號肽的天然纖溶酶原(來源于swiss prot)的核酸序列
<400> 3
atggaacata aggaagtggt tcttctactt cttttatttc tgaaatcagg tcaaggagag 60
cctctggatg actatgtgaa tacccagggg gcttcactgt tcagtgtcac taagaagcag 120
ctgggagcag gaagtataga agaatgtgca gcaaaatgtg aggaggacga agaattcacc 180
tgcagggcat tccaatatca cagtaaagag caacaatgtg tgataatggc tgaaaacagg 240
aagtcctcca taatcattag gatgagagat gtagttttat ttgaaaagaa agtgtatctc 300
tcagagtgca agactgggaa tggaaagaac tacagaggga cgatgtccaa aacaaaaaat 360
ggcatcacct gtcaaaaatg gagttccact tctccccaca gacctagatt ctcacctgct 420
acacacccct cagagggact ggaggagaac tactgcagga atccagacaa cgatccgcag 480
gggccctggt gctatactac tgatccagaa aagagatatg actactgcga cattcttgag 540
tgtgaagagg aatgtatgca ttgcagtgga gaaaactatg acggcaaaat ttccaagacc 600
atgtctggac tggaatgcca ggcctgggac tctcagagcc cacacgctca tggatacatt 660
ccttccaaat ttccaaacaa gaacctgaag aagaattact gtcgtaaccc cgatagggag 720
ctgcggcctt ggtgtttcac caccgacccc aacaagcgct gggaactttg tgacatcccc 780
cgctgcacaa cacctccacc atcttctggt cccacctacc agtgtctgaa gggaacaggt 840
gaaaactatc gcgggaatgt ggctgttacc gtgtccgggc acacctgtca gcactggagt 900
gcacagaccc ctcacacaca taacaggaca ccagaaaact tcccctgcaa aaatttggat 960
gaaaactact gccgcaatcc tgacggaaaa agggccccat ggtgccatac aaccaacagc 1020
caagtgcggt gggagtactg taagataccg tcctgtgact cctccccagt atccacggaa 1080
caattggctc ccacagcacc acctgagcta acccctgtgg tccaggactg ctaccatggt 1140
gatggacaga gctaccgagg cacatcctcc accaccacca caggaaagaa gtgtcagtct 1200
tggtcatcta tgacaccaca ccggcaccag aagaccccag aaaactaccc aaatgctggc 1260
ctgacaatga actactgcag gaatccagat gccgataaag gcccctggtg ttttaccaca 1320
gaccccagcg tcaggtggga gtactgcaac ctgaaaaaat gctcaggaac agaagcgagt 1380
gttgtagcac ctccgcctgt tgtcctgctt ccagatgtag agactccttc cgaagaagac 1440
tgtatgtttg ggaatgggaa aggataccga ggcaagaggg cgaccactgt tactgggacg 1500
ccatgccagg actgggctgc ccaggagccc catagacaca gcattttcac tccagagaca 1560
aatccacggg cgggtctgga aaaaaattac tgccgtaacc ctgatggtga tgtaggtggt 1620
ccctggtgct acacgacaaa tccaagaaaa ctttacgact actgtgatgt ccctcagtgt 1680
gcggcccctt catttgattg tgggaagcct caagtggagc cgaagaaatg tcctggaagg 1740
gttgtagggg ggtgtgtggc ccacccacat tcctggccct ggcaagtcag tcttagaaca 1800
aggtttggaa tgcacttctg tggaggcacc ttgatatccc cagagtgggt gttgactgct 1860
gcccactgct tggagaagtc cccaaggcct tcatcctaca aggtcatcct gggtgcacac 1920
caagaagtga atctcgaacc gcatgttcag gaaatagaag tgtctaggct gttcttggag 1980
cccacacgaa aagatattgc cttgctaaag ctaagcagtc ctgccgtcat cactgacaaa 2040
gtaatcccag cttgtctgcc atccccaaat tatgtggtcg ctgaccggac cgaatgtttc 2100
atcactggct ggggagaaac ccaaggtact tttggagctg gccttctcaa ggaagcccag 2160
ctccctgtga ttgagaataa agtgtgcaat cgctatgagt ttctgaatgg aagagtccaa 2220
tccaccgaac tctgtgctgg gcatttggcc ggaggcactg acagttgcca gggtgacagt 2280
ggaggtcctc tggtttgctt cgagaaggac aaatacattt tacaaggagt cacttcttgg 2340
ggtcttggct gtgcacgccc caataagcct ggtgtctatg ttcgtgtttc aaggtttgtt 2400
acttggattg agggagtgat gagaaataat taa 2433
<210> 4
<211> 810
<212> PRT
<213> 含有信號肽的天然纖溶酶原(來源于swiss prot)的氨基酸序列
<400> 4
Met Glu His Lys Glu Val Val Leu Leu Leu Leu Leu Phe Leu Lys Ser
1 5 10 15
Gly Gln Gly Glu Pro Leu Asp Asp Tyr Val Asn Thr Gln Gly Ala Ser
20 25 30
Leu Phe Ser Val Thr Lys Lys Gln Leu Gly Ala Gly Ser Ile Glu Glu
35 40 45
Cys Ala Ala Lys Cys Glu Glu Asp Glu Glu Phe Thr Cys Arg Ala Phe
50 55 60
Gln Tyr His Ser Lys Glu Gln Gln Cys Val Ile Met Ala Glu Asn Arg
65 70 75 80
Lys Ser Ser Ile Ile Ile Arg Met Arg Asp Val Val Leu Phe Glu Lys
85 90 95
Lys Val Tyr Leu Ser Glu Cys Lys Thr Gly Asn Gly Lys Asn Tyr Arg
100 105 110
Gly Thr Met Ser Lys Thr Lys Asn Gly Ile Thr Cys Gln Lys Trp Ser
115 120 125
Ser Thr Ser Pro His Arg Pro Arg Phe Ser Pro Ala Thr His Pro Ser
130 135 140
Glu Gly Leu Glu Glu Asn Tyr Cys Arg Asn Pro Asp Asn Asp Pro Gln
145 150 155 160
Gly Pro Trp Cys Tyr Thr Thr Asp Pro Glu Lys Arg Tyr Asp Tyr Cys
165 170 175
Asp Ile Leu Glu Cys Glu Glu Glu Cys Met His Cys Ser Gly Glu Asn
180 185 190
Tyr Asp Gly Lys Ile Ser Lys Thr Met Ser Gly Leu Glu Cys Gln Ala
195 200 205
Trp Asp Ser Gln Ser Pro His Ala His Gly Tyr Ile Pro Ser Lys Phe
210 215 220
Pro Asn Lys Asn Leu Lys Lys Asn Tyr Cys Arg Asn Pro Asp Arg Glu
225 230 235 240
Leu Arg Pro Trp Cys Phe Thr Thr Asp Pro Asn Lys Arg Trp Glu Leu
245 250 255
Cys Asp Ile Pro Arg Cys Thr Thr Pro Pro Pro Ser Ser Gly Pro Thr
260 265 270
Tyr Gln Cys Leu Lys Gly Thr Gly Glu Asn Tyr Arg Gly Asn Val Ala
275 280 285
Val Thr Val Ser Gly His Thr Cys Gln His Trp Ser Ala Gln Thr Pro
290 295 300
His Thr His Asn Arg Thr Pro Glu Asn Phe Pro Cys Lys Asn Leu Asp
305 310 315 320
Glu Asn Tyr Cys Arg Asn Pro Asp Gly Lys Arg Ala Pro Trp Cys His
325 330 335
Thr Thr Asn Ser Gln Val Arg Trp Glu Tyr Cys Lys Ile Pro Ser Cys
340 345 350
Asp Ser Ser Pro Val Ser Thr Glu Gln Leu Ala Pro Thr Ala Pro Pro
355 360 365
Glu Leu Thr Pro Val Val Gln Asp Cys Tyr His Gly Asp Gly Gln Ser
370 375 380
Tyr Arg Gly Thr Ser Ser Thr Thr Thr Thr Gly Lys Lys Cys Gln Ser
385 390 395 400
Trp Ser Ser Met Thr Pro His Arg His Gln Lys Thr Pro Glu Asn Tyr
405 410 415
Pro Asn Ala Gly Leu Thr Met Asn Tyr Cys Arg Asn Pro Asp Ala Asp
420 425 430
Lys Gly Pro Trp Cys Phe Thr Thr Asp Pro Ser Val Arg Trp Glu Tyr
435 440 445
Cys Asn Leu Lys Lys Cys Ser Gly Thr Glu Ala Ser Val Val Ala Pro
450 455 460
Pro Pro Val Val Leu Leu Pro Asp Val Glu Thr Pro Ser Glu Glu Asp
465 470 475 480
Cys Met Phe Gly Asn Gly Lys Gly Tyr Arg Gly Lys Arg Ala Thr Thr
485 490 495
Val Thr Gly Thr Pro Cys Gln Asp Trp Ala Ala Gln Glu Pro His Arg
500 505 510
His Ser Ile Phe Thr Pro Glu Thr Asn Pro Arg Ala Gly Leu Glu Lys
515 520 525
Asn Tyr Cys Arg Asn Pro Asp Gly Asp Val Gly Gly Pro Trp Cys Tyr
530 535 540
Thr Thr Asn Pro Arg Lys Leu Tyr Asp Tyr Cys Asp Val Pro Gln Cys
545 550 555 560
Ala Ala Pro Ser Phe Asp Cys Gly Lys Pro Gln Val Glu Pro Lys Lys
565 570 575
Cys Pro Gly Arg Val Val Gly Gly Cys Val Ala His Pro His Ser Trp
580 585 590
Pro Trp Gln Val Ser Leu Arg Thr Arg Phe Gly Met His Phe Cys Gly
595 600 605
Gly Thr Leu Ile Ser Pro Glu Trp Val Leu Thr Ala Ala His Cys Leu
610 615 620
Glu Lys Ser Pro Arg Pro Ser Ser Tyr Lys Val Ile Leu Gly Ala His
625 630 635 640
Gln Glu Val Asn Leu Glu Pro His Val Gln Glu Ile Glu Val Ser Arg
645 650 655
Leu Phe Leu Glu Pro Thr Arg Lys Asp Ile Ala Leu Leu Lys Leu Ser
660 665 670
Ser Pro Ala Val Ile Thr Asp Lys Val Ile Pro Ala Cys Leu Pro Ser
675 680 685
Pro Asn Tyr Val Val Ala Asp Arg Thr Glu Cys Phe Ile Thr Gly Trp
690 695 700
Gly Glu Thr Gln Gly Thr Phe Gly Ala Gly Leu Leu Lys Glu Ala Gln
705 710 715 720
Leu Pro Val Ile Glu Asn Lys Val Cys Asn Arg Tyr Glu Phe Leu Asn
725 730 735
Gly Arg Val Gln Ser Thr Glu Leu Cys Ala Gly His Leu Ala Gly Gly
740 745 750
Thr Asp Ser Cys Gln Gly Asp Ser Gly Gly Pro Leu Val Cys Phe Glu
755 760 765
Lys Asp Lys Tyr Ile Leu Gln Gly Val Thr Ser Trp Gly Leu Gly Cys
770 775 780
Ala Arg Pro Asn Lys Pro Gly Val Tyr Val Arg Val Ser Arg Phe Val
785 790 795 800
Thr Trp Ile Glu Gly Val Met Arg Asn Asn
805 810
<210> 5
<211> 2145
<212> DNA
<213> LYS77-PLG(Lys-纖溶酶原)核酸序列
<400> 5
aaagtgtatc tctcagagtg caagactggg aatggaaaga actacagagg gacgatgtcc 60
aaaacaaaaa atggcatcac ctgtcaaaaa tggagttcca cttctcccca cagacctaga 120
ttctcacctg ctacacaccc ctcagaggga ctggaggaga actactgcag gaatccagac 180
aacgatccgc aggggccctg gtgctatact actgatccag aaaagagata tgactactgc 240
gacattcttg agtgtgaaga ggaatgtatg cattgcagtg gagaaaacta tgacggcaaa 300
atttccaaga ccatgtctgg actggaatgc caggcctggg actctcagag cccacacgct 360
catggataca ttccttccaa atttccaaac aagaacctga agaagaatta ctgtcgtaac 420
cccgataggg agctgcggcc ttggtgtttc accaccgacc ccaacaagcg ctgggaactt 480
tgtgacatcc cccgctgcac aacacctcca ccatcttctg gtcccaccta ccagtgtctg 540
aagggaacag gtgaaaacta tcgcgggaat gtggctgtta ccgtgtccgg gcacacctgt 600
cagcactgga gtgcacagac ccctcacaca cataacagga caccagaaaa cttcccctgc 660
aaaaatttgg atgaaaacta ctgccgcaat cctgacggaa aaagggcccc atggtgccat 720
acaaccaaca gccaagtgcg gtgggagtac tgtaagatac cgtcctgtga ctcctcccca 780
gtatccacgg aacaattggc tcccacagca ccacctgagc taacccctgt ggtccaggac 840
tgctaccatg gtgatggaca gagctaccga ggcacatcct ccaccaccac cacaggaaag 900
aagtgtcagt cttggtcatc tatgacacca caccggcacc agaagacccc agaaaactac 960
ccaaatgctg gcctgacaat gaactactgc aggaatccag atgccgataa aggcccctgg 1020
tgttttacca cagaccccag cgtcaggtgg gagtactgca acctgaaaaa atgctcagga 1080
acagaagcga gtgttgtagc acctccgcct gttgtcctgc ttccagatgt agagactcct 1140
tccgaagaag actgtatgtt tgggaatggg aaaggatacc gaggcaagag ggcgaccact 1200
gttactggga cgccatgcca ggactgggct gcccaggagc cccatagaca cagcattttc 1260
actccagaga caaatccacg ggcgggtctg gaaaaaaatt actgccgtaa ccctgatggt 1320
gatgtaggtg gtccctggtg ctacacgaca aatccaagaa aactttacga ctactgtgat 1380
gtccctcagt gtgcggcccc ttcatttgat tgtgggaagc ctcaagtgga gccgaagaaa 1440
tgtcctggaa gggttgtagg ggggtgtgtg gcccacccac attcctggcc ctggcaagtc 1500
agtcttagaa caaggtttgg aatgcacttc tgtggaggca ccttgatatc cccagagtgg 1560
gtgttgactg ctgcccactg cttggagaag tccccaaggc cttcatccta caaggtcatc 1620
ctgggtgcac accaagaagt gaatctcgaa ccgcatgttc aggaaataga agtgtctagg 1680
ctgttcttgg agcccacacg aaaagatatt gccttgctaa agctaagcag tcctgccgtc 1740
atcactgaca aagtaatccc agcttgtctg ccatccccaa attatgtggt cgctgaccgg 1800
accgaatgtt tcatcactgg ctggggagaa acccaaggta cttttggagc tggccttctc 1860
aaggaagccc agctccctgt gattgagaat aaagtgtgca atcgctatga gtttctgaat 1920
ggaagagtcc aatccaccga actctgtgct gggcatttgg ccggaggcac tgacagttgc 1980
cagggtgaca gtggaggtcc tctggtttgc ttcgagaagg acaaatacat tttacaagga 2040
gtcacttctt ggggtcttgg ctgtgcacgc cccaataagc ctggtgtcta tgttcgtgtt 2100
tcaaggtttg ttacttggat tgagggagtg atgagaaata attaa 2145
<210> 6
<211> 714
<212> PRT
<213> LYS77-PLG(Lys-纖溶酶原)氨基酸序列
<400> 6
Lys Val Tyr Leu Ser Glu Cys Lys Thr Gly Asn Gly Lys Asn Tyr Arg
1 5 10 15
Gly Thr Met Ser Lys Thr Lys Asn Gly Ile Thr Cys Gln Lys Trp Ser
20 25 30
Ser Thr Ser Pro His Arg Pro Arg Phe Ser Pro Ala Thr His Pro Ser
35 40 45
Glu Gly Leu Glu Glu Asn Tyr Cys Arg Asn Pro Asp Asn Asp Pro Gln
50 55 60
Gly Pro Trp Cys Tyr Thr Thr Asp Pro Glu Lys Arg Tyr Asp Tyr Cys
65 70 75 80
Asp Ile Leu Glu Cys Glu Glu Glu Cys Met His Cys Ser Gly Glu Asn
85 90 95
Tyr Asp Gly Lys Ile Ser Lys Thr Met Ser Gly Leu Glu Cys Gln Ala
100 105 110
Trp Asp Ser Gln Ser Pro His Ala His Gly Tyr Ile Pro Ser Lys Phe
115 120 125
Pro Asn Lys Asn Leu Lys Lys Asn Tyr Cys Arg Asn Pro Asp Arg Glu
130 135 140
Leu Arg Pro Trp Cys Phe Thr Thr Asp Pro Asn Lys Arg Trp Glu Leu
145 150 155 160
Cys Asp Ile Pro Arg Cys Thr Thr Pro Pro Pro Ser Ser Gly Pro Thr
165 170 175
Tyr Gln Cys Leu Lys Gly Thr Gly Glu Asn Tyr Arg Gly Asn Val Ala
180 185 190
Val Thr Val Ser Gly His Thr Cys Gln His Trp Ser Ala Gln Thr Pro
195 200 205
His Thr His Asn Arg Thr Pro Glu Asn Phe Pro Cys Lys Asn Leu Asp
210 215 220
Glu Asn Tyr Cys Arg Asn Pro Asp Gly Lys Arg Ala Pro Trp Cys His
225 230 235 240
Thr Thr Asn Ser Gln Val Arg Trp Glu Tyr Cys Lys Ile Pro Ser Cys
245 250 255
Asp Ser Ser Pro Val Ser Thr Glu Gln Leu Ala Pro Thr Ala Pro Pro
260 265 270
Glu Leu Thr Pro Val Val Gln Asp Cys Tyr His Gly Asp Gly Gln Ser
275 280 285
Tyr Arg Gly Thr Ser Ser Thr Thr Thr Thr Gly Lys Lys Cys Gln Ser
290 295 300
Trp Ser Ser Met Thr Pro His Arg His Gln Lys Thr Pro Glu Asn Tyr
305 310 315 320
Pro Asn Ala Gly Leu Thr Met Asn Tyr Cys Arg Asn Pro Asp Ala Asp
325 330 335
Lys Gly Pro Trp Cys Phe Thr Thr Asp Pro Ser Val Arg Trp Glu Tyr
340 345 350
Cys Asn Leu Lys Lys Cys Ser Gly Thr Glu Ala Ser Val Val Ala Pro
355 360 365
Pro Pro Val Val Leu Leu Pro Asp Val Glu Thr Pro Ser Glu Glu Asp
370 375 380
Cys Met Phe Gly Asn Gly Lys Gly Tyr Arg Gly Lys Arg Ala Thr Thr
385 390 395 400
Val Thr Gly Thr Pro Cys Gln Asp Trp Ala Ala Gln Glu Pro His Arg
405 410 415
His Ser Ile Phe Thr Pro Glu Thr Asn Pro Arg Ala Gly Leu Glu Lys
420 425 430
Asn Tyr Cys Arg Asn Pro Asp Gly Asp Val Gly Gly Pro Trp Cys Tyr
435 440 445
Thr Thr Asn Pro Arg Lys Leu Tyr Asp Tyr Cys Asp Val Pro Gln Cys
450 455 460
Ala Ala Pro Ser Phe Asp Cys Gly Lys Pro Gln Val Glu Pro Lys Lys
465 470 475 480
Cys Pro Gly Arg Val Val Gly Gly Cys Val Ala His Pro His Ser Trp
485 490 495
Pro Trp Gln Val Ser Leu Arg Thr Arg Phe Gly Met His Phe Cys Gly
500 505 510
Gly Thr Leu Ile Ser Pro Glu Trp Val Leu Thr Ala Ala His Cys Leu
515 520 525
Glu Lys Ser Pro Arg Pro Ser Ser Tyr Lys Val Ile Leu Gly Ala His
530 535 540
Gln Glu Val Asn Leu Glu Pro His Val Gln Glu Ile Glu Val Ser Arg
545 550 555 560
Leu Phe Leu Glu Pro Thr Arg Lys Asp Ile Ala Leu Leu Lys Leu Ser
565 570 575
Ser Pro Ala Val Ile Thr Asp Lys Val Ile Pro Ala Cys Leu Pro Ser
580 585 590
Pro Asn Tyr Val Val Ala Asp Arg Thr Glu Cys Phe Ile Thr Gly Trp
595 600 605
Gly Glu Thr Gln Gly Thr Phe Gly Ala Gly Leu Leu Lys Glu Ala Gln
610 615 620
Leu Pro Val Ile Glu Asn Lys Val Cys Asn Arg Tyr Glu Phe Leu Asn
625 630 635 640
Gly Arg Val Gln Ser Thr Glu Leu Cys Ala Gly His Leu Ala Gly Gly
645 650 655
Thr Asp Ser Cys Gln Gly Asp Ser Gly Gly Pro Leu Val Cys Phe Glu
660 665 670
Lys Asp Lys Tyr Ile Leu Gln Gly Val Thr Ser Trp Gly Leu Gly Cys
675 680 685
Ala Arg Pro Asn Lys Pro Gly Val Tyr Val Arg Val Ser Arg Phe Val
690 695 700
Thr Trp Ile Glu Gly Val Met Arg Asn Asn
705 710
<210> 7
<211> 1245
<212> DNA
<213> delta-plg(delta-纖溶酶原)核酸序列
<400> 7
gagcctctgg atgactatgt gaatacccag ggggcttcac tgttcagtgt cactaagaag 60
cagctgggag caggaagtat agaagaatgt gcagcaaaat gtgaggagga cgaagaattc 120
acctgcaggg cattccaata tcacagtaaa gagcaacaat gtgtgataat ggctgaaaac 180
aggaagtcct ccataatcat taggatgaga gatgtagttt tatttgaaaa gaaagtgtat 240
ctctcagagt gcaagactgg gaatggaaag aactacagag ggacgatgtc caaaacaaaa 300
aatggcatca cctgtcaaaa atggagttcc acttctcccc acagacctag attctcacct 360
gctacacacc cctcagaggg actggaggag aactactgca ggaatccaga caacgatccg 420
caggggccct ggtgctatac tactgatcca gaaaagagat atgactactg cgacattctt 480
gagtgtgaag aggcggcccc ttcatttgat tgtgggaagc ctcaagtgga gccgaagaaa 540
tgtcctggaa gggttgtagg ggggtgtgtg gcccacccac attcctggcc ctggcaagtc 600
agtcttagaa caaggtttgg aatgcacttc tgtggaggca ccttgatatc cccagagtgg 660
gtgttgactg ctgcccactg cttggagaag tccccaaggc cttcatccta caaggtcatc 720
ctgggtgcac accaagaagt gaatctcgaa ccgcatgttc aggaaataga agtgtctagg 780
ctgttcttgg agcccacacg aaaagatatt gccttgctaa agctaagcag tcctgccgtc 840
atcactgaca aagtaatccc agcttgtctg ccatccccaa attatgtggt cgctgaccgg 900
accgaatgtt tcatcactgg ctggggagaa acccaaggta cttttggagc tggccttctc 960
aaggaagccc agctccctgt gattgagaat aaagtgtgca atcgctatga gtttctgaat 1020
ggaagagtcc aatccaccga actctgtgct gggcatttgg ccggaggcac tgacagttgc 1080
cagggtgaca gtggaggtcc tctggtttgc ttcgagaagg acaaatacat tttacaagga 1140
gtcacttctt ggggtcttgg ctgtgcacgc cccaataagc ctggtgtcta tgttcgtgtt 1200
tcaaggtttg ttacttggat tgagggagtg atgagaaata attaa 1245
<210> 8
<211> 414
<212> PRT
<213> delta-plg(delta-纖溶酶原)氨基酸序列
<400> 8
Glu Pro Leu Asp Asp Tyr Val Asn Thr Gln Gly Ala Ser Leu Phe Ser
1 5 10 15
Val Thr Lys Lys Gln Leu Gly Ala Gly Ser Ile Glu Glu Cys Ala Ala
20 25 30
Lys Cys Glu Glu Asp Glu Glu Phe Thr Cys Arg Ala Phe Gln Tyr His
35 40 45
Ser Lys Glu Gln Gln Cys Val Ile Met Ala Glu Asn Arg Lys Ser Ser
50 55 60
Ile Ile Ile Arg Met Arg Asp Val Val Leu Phe Glu Lys Lys Val Tyr
65 70 75 80
Leu Ser Glu Cys Lys Thr Gly Asn Gly Lys Asn Tyr Arg Gly Thr Met
85 90 95
Ser Lys Thr Lys Asn Gly Ile Thr Cys Gln Lys Trp Ser Ser Thr Ser
100 105 110
Pro His Arg Pro Arg Phe Ser Pro Ala Thr His Pro Ser Glu Gly Leu
115 120 125
Glu Glu Asn Tyr Cys Arg Asn Pro Asp Asn Asp Pro Gln Gly Pro Trp
130 135 140
Cys Tyr Thr Thr Asp Pro Glu Lys Arg Tyr Asp Tyr Cys Asp Ile Leu
145 150 155 160
Glu Cys Glu Glu Ala Ala Pro Ser Phe Asp Cys Gly Lys Pro Gln Val
165 170 175
Glu Pro Lys Lys Cys Pro Gly Arg Val Val Gly Gly Cys Val Ala His
180 185 190
Pro His Ser Trp Pro Trp Gln Val Ser Leu Arg Thr Arg Phe Gly Met
195 200 205
His Phe Cys Gly Gly Thr Leu Ile Ser Pro Glu Trp Val Leu Thr Ala
210 215 220
Ala His Cys Leu Glu Lys Ser Pro Arg Pro Ser Ser Tyr Lys Val Ile
225 230 235 240
Leu Gly Ala His Gln Glu Val Asn Leu Glu Pro His Val Gln Glu Ile
245 250 255
Glu Val Ser Arg Leu Phe Leu Glu Pro Thr Arg Lys Asp Ile Ala Leu
260 265 270
Leu Lys Leu Ser Ser Pro Ala Val Ile Thr Asp Lys Val Ile Pro Ala
275 280 285
Cys Leu Pro Ser Pro Asn Tyr Val Val Ala Asp Arg Thr Glu Cys Phe
290 295 300
Ile Thr Gly Trp Gly Glu Thr Gln Gly Thr Phe Gly Ala Gly Leu Leu
305 310 315 320
Lys Glu Ala Gln Leu Pro Val Ile Glu Asn Lys Val Cys Asn Arg Tyr
325 330 335
Glu Phe Leu Asn Gly Arg Val Gln Ser Thr Glu Leu Cys Ala Gly His
340 345 350
Leu Ala Gly Gly Thr Asp Ser Cys Gln Gly Asp Ser Gly Gly Pro Leu
355 360 365
Val Cys Phe Glu Lys Asp Lys Tyr Ile Leu Gln Gly Val Thr Ser Trp
370 375 380
Gly Leu Gly Cys Ala Arg Pro Asn Lys Pro Gly Val Tyr Val Arg Val
385 390 395 400
Ser Arg Phe Val Thr Trp Ile Glu Gly Val Met Arg Asn Asn
405 410
<210> 9
<211> 1104
<212> DNA
<213> Mini-plg(小纖維蛋白溶酶原)核酸序列
<400> 9
gtcaggtggg agtactgcaa cctgaaaaaa tgctcaggaa cagaagcgag tgttgtagca 60
cctccgcctg ttgtcctgct tccagatgta gagactcctt ccgaagaaga ctgtatgttt 120
gggaatggga aaggataccg aggcaagagg gcgaccactg ttactgggac gccatgccag 180
gactgggctg cccaggagcc ccatagacac agcattttca ctccagagac aaatccacgg 240
gcgggtctgg aaaaaaatta ctgccgtaac cctgatggtg atgtaggtgg tccctggtgc 300
tacacgacaa atccaagaaa actttacgac tactgtgatg tccctcagtg tgcggcccct 360
tcatttgatt gtgggaagcc tcaagtggag ccgaagaaat gtcctggaag ggttgtaggg 420
gggtgtgtgg cccacccaca ttcctggccc tggcaagtca gtcttagaac aaggtttgga 480
atgcacttct gtggaggcac cttgatatcc ccagagtggg tgttgactgc tgcccactgc 540
ttggagaagt ccccaaggcc ttcatcctac aaggtcatcc tgggtgcaca ccaagaagtg 600
aatctcgaac cgcatgttca ggaaatagaa gtgtctaggc tgttcttgga gcccacacga 660
aaagatattg ccttgctaaa gctaagcagt cctgccgtca tcactgacaa agtaatccca 720
gcttgtctgc catccccaaa ttatgtggtc gctgaccgga ccgaatgttt catcactggc 780
tggggagaaa cccaaggtac ttttggagct ggccttctca aggaagccca gctccctgtg 840
attgagaata aagtgtgcaa tcgctatgag tttctgaatg gaagagtcca atccaccgaa 900
ctctgtgctg ggcatttggc cggaggcact gacagttgcc agggtgacag tggaggtcct 960
ctggtttgct tcgagaagga caaatacatt ttacaaggag tcacttcttg gggtcttggc 1020
tgtgcacgcc ccaataagcc tggtgtctat gttcgtgttt caaggtttgt tacttggatt 1080
gagggagtga tgagaaataa ttaa 1104
<210> 10
<211> 367
<212> PRT
<213> Mini-plg(小纖維蛋白溶酶原)氨基酸序列
<400> 10
Val Arg Trp Glu Tyr Cys Asn Leu Lys Lys Cys Ser Gly Thr Glu Ala
1 5 10 15
Ser Val Val Ala Pro Pro Pro Val Val Leu Leu Pro Asp Val Glu Thr
20 25 30
Pro Ser Glu Glu Asp Cys Met Phe Gly Asn Gly Lys Gly Tyr Arg Gly
35 40 45
Lys Arg Ala Thr Thr Val Thr Gly Thr Pro Cys Gln Asp Trp Ala Ala
50 55 60
Gln Glu Pro His Arg His Ser Ile Phe Thr Pro Glu Thr Asn Pro Arg
65 70 75 80
Ala Gly Leu Glu Lys Asn Tyr Cys Arg Asn Pro Asp Gly Asp Val Gly
85 90 95
Gly Pro Trp Cys Tyr Thr Thr Asn Pro Arg Lys Leu Tyr Asp Tyr Cys
100 105 110
Asp Val Pro Gln Cys Ala Ala Pro Ser Phe Asp Cys Gly Lys Pro Gln
115 120 125
Val Glu Pro Lys Lys Cys Pro Gly Arg Val Val Gly Gly Cys Val Ala
130 135 140
His Pro His Ser Trp Pro Trp Gln Val Ser Leu Arg Thr Arg Phe Gly
145 150 155 160
Met His Phe Cys Gly Gly Thr Leu Ile Ser Pro Glu Trp Val Leu Thr
165 170 175
Ala Ala His Cys Leu Glu Lys Ser Pro Arg Pro Ser Ser Tyr Lys Val
180 185 190
Ile Leu Gly Ala His Gln Glu Val Asn Leu Glu Pro His Val Gln Glu
195 200 205
Ile Glu Val Ser Arg Leu Phe Leu Glu Pro Thr Arg Lys Asp Ile Ala
210 215 220
Leu Leu Lys Leu Ser Ser Pro Ala Val Ile Thr Asp Lys Val Ile Pro
225 230 235 240
Ala Cys Leu Pro Ser Pro Asn Tyr Val Val Ala Asp Arg Thr Glu Cys
245 250 255
Phe Ile Thr Gly Trp Gly Glu Thr Gln Gly Thr Phe Gly Ala Gly Leu
260 265 270
Leu Lys Glu Ala Gln Leu Pro Val Ile Glu Asn Lys Val Cys Asn Arg
275 280 285
Tyr Glu Phe Leu Asn Gly Arg Val Gln Ser Thr Glu Leu Cys Ala Gly
290 295 300
His Leu Ala Gly Gly Thr Asp Ser Cys Gln Gly Asp Ser Gly Gly Pro
305 310 315 320
Leu Val Cys Phe Glu Lys Asp Lys Tyr Ile Leu Gln Gly Val Thr Ser
325 330 335
Trp Gly Leu Gly Cys Ala Arg Pro Asn Lys Pro Gly Val Tyr Val Arg
340 345 350
Val Ser Arg Phe Val Thr Trp Ile Glu Gly Val Met Arg Asn Asn
355 360 365
<210> 11
<211> 750
<212> DNA
<213> Micro-plg(微纖維蛋白溶酶原)核酸序列
<400> 11
gccccttcat ttgattgtgg gaagcctcaa gtggagccga agaaatgtcc tggaagggtt 60
gtaggggggt gtgtggccca cccacattcc tggccctggc aagtcagtct tagaacaagg 120
tttggaatgc acttctgtgg aggcaccttg atatccccag agtgggtgtt gactgctgcc 180
cactgcttgg agaagtcccc aaggccttca tcctacaagg tcatcctggg tgcacaccaa 240
gaagtgaatc tcgaaccgca tgttcaggaa atagaagtgt ctaggctgtt cttggagccc 300
acacgaaaag atattgcctt gctaaagcta agcagtcctg ccgtcatcac tgacaaagta 360
atcccagctt gtctgccatc cccaaattat gtggtcgctg accggaccga atgtttcatc 420
actggctggg gagaaaccca aggtactttt ggagctggcc ttctcaagga agcccagctc 480
cctgtgattg agaataaagt gtgcaatcgc tatgagtttc tgaatggaag agtccaatcc 540
accgaactct gtgctgggca tttggccgga ggcactgaca gttgccaggg tgacagtgga 600
ggtcctctgg tttgcttcga gaaggacaaa tacattttac aaggagtcac ttcttggggt 660
cttggctgtg cacgccccaa taagcctggt gtctatgttc gtgtttcaag gtttgttact 720
tggattgagg gagtgatgag aaataattaa 750
<210> 12
<211> 249
<212> PRT
<213> Micro-plg(微纖維蛋白溶酶原)氨基酸序列
<400> 12
Ala Pro Ser Phe Asp Cys Gly Lys Pro Gln Val Glu Pro Lys Lys Cys
1 5 10 15
Pro Gly Arg Val Val Gly Gly Cys Val Ala His Pro His Ser Trp Pro
20 25 30
Trp Gln Val Ser Leu Arg Thr Arg Phe Gly Met His Phe Cys Gly Gly
35 40 45
Thr Leu Ile Ser Pro Glu Trp Val Leu Thr Ala Ala His Cys Leu Glu
50 55 60
Lys Ser Pro Arg Pro Ser Ser Tyr Lys Val Ile Leu Gly Ala His Gln
65 70 75 80
Glu Val Asn Leu Glu Pro His Val Gln Glu Ile Glu Val Ser Arg Leu
85 90 95
Phe Leu Glu Pro Thr Arg Lys Asp Ile Ala Leu Leu Lys Leu Ser Ser
100 105 110
Pro Ala Val Ile Thr Asp Lys Val Ile Pro Ala Cys Leu Pro Ser Pro
115 120 125
Asn Tyr Val Val Ala Asp Arg Thr Glu Cys Phe Ile Thr Gly Trp Gly
130 135 140
Glu Thr Gln Gly Thr Phe Gly Ala Gly Leu Leu Lys Glu Ala Gln Leu
145 150 155 160
Pro Val Ile Glu Asn Lys Val Cys Asn Arg Tyr Glu Phe Leu Asn Gly
165 170 175
Arg Val Gln Ser Thr Glu Leu Cys Ala Gly His Leu Ala Gly Gly Thr
180 185 190
Asp Ser Cys Gln Gly Asp Ser Gly Gly Pro Leu Val Cys Phe Glu Lys
195 200 205
Asp Lys Tyr Ile Leu Gln Gly Val Thr Ser Trp Gly Leu Gly Cys Ala
210 215 220
Arg Pro Asn Lys Pro Gly Val Tyr Val Arg Val Ser Arg Phe Val Thr
225 230 235 240
Trp Ile Glu Gly Val Met Arg Asn Asn
245
<210> 13
<211> 684
<212> DNA
<213> 絲氨酸蛋白酶(結構)域的核酸序列
<400> 13
gttgtagggg ggtgtgtggc ccacccacat tcctggccct ggcaagtcag tcttagaaca 60
aggtttggaa tgcacttctg tggaggcacc ttgatatccc cagagtgggt gttgactgct 120
gcccactgct tggagaagtc cccaaggcct tcatcctaca aggtcatcct gggtgcacac 180
caagaagtga atctcgaacc gcatgttcag gaaatagaag tgtctaggct gttcttggag 240
cccacacgaa aagatattgc cttgctaaag ctaagcagtc ctgccgtcat cactgacaaa 300
gtaatcccag cttgtctgcc atccccaaat tatgtggtcg ctgaccggac cgaatgtttc 360
atcactggct ggggagaaac ccaaggtact tttggagctg gccttctcaa ggaagcccag 420
ctccctgtga ttgagaataa agtgtgcaat cgctatgagt ttctgaatgg aagagtccaa 480
tccaccgaac tctgtgctgg gcatttggcc ggaggcactg acagttgcca gggtgacagt 540
ggaggtcctc tggtttgctt cgagaaggac aaatacattt tacaaggagt cacttcttgg 600
ggtcttggct gtgcacgccc caataagcct ggtgtctatg ttcgtgtttc aaggtttgtt 660
acttggattg agggagtgat gaga 684
<210> 14
<211> 228
<212> PRT
<213> 絲氨酸蛋白酶(結構)域的氨基酸序列
<400> 14
Val Val Gly Gly Cys Val Ala His Pro His Ser Trp Pro Trp Gln Val
1 5 10 15
Ser Leu Arg Thr Arg Phe Gly Met His Phe Cys Gly Gly Thr Leu Ile
20 25 30
Ser Pro Glu Trp Val Leu Thr Ala Ala His Cys Leu Glu Lys Ser Pro
35 40 45
Arg Pro Ser Ser Tyr Lys Val Ile Leu Gly Ala His Gln Glu Val Asn
50 55 60
Leu Glu Pro His Val Gln Glu Ile Glu Val Ser Arg Leu Phe Leu Glu
65 70 75 80
Pro Thr Arg Lys Asp Ile Ala Leu Leu Lys Leu Ser Ser Pro Ala Val
85 90 95
Ile Thr Asp Lys Val Ile Pro Ala Cys Leu Pro Ser Pro Asn Tyr Val
100 105 110
Val Ala Asp Arg Thr Glu Cys Phe Ile Thr Gly Trp Gly Glu Thr Gln
115 120 125
Gly Thr Phe Gly Ala Gly Leu Leu Lys Glu Ala Gln Leu Pro Val Ile
130 135 140
Glu Asn Lys Val Cys Asn Arg Tyr Glu Phe Leu Asn Gly Arg Val Gln
145 150 155 160
Ser Thr Glu Leu Cys Ala Gly His Leu Ala Gly Gly Thr Asp Ser Cys
165 170 175
Gln Gly Asp Ser Gly Gly Pro Leu Val Cys Phe Glu Lys Asp Lys Tyr
180 185 190
Ile Leu Gln Gly Val Thr Ser Trp Gly Leu Gly Cys Ala Arg Pro Asn
195 200 205
Lys Pro Gly Val Tyr Val Arg Val Ser Arg Phe Val Thr Trp Ile Glu
210 215 220
Gly Val Met Arg
225
- 還沒有人留言評論。精彩留言會獲得點贊!