適于治療或預防結核的脂質體制劑的制作方法
本申請是申請日為2012年1月4日的中國專利申請201280011787.0(pct/ep2012/050080)的分案申請。引言和
背景技術:
:本發明提供了包含來自結核分枝桿菌(mycobacteriumtuberculosis)復合菌株的脂質體制劑,以及包含這些制劑的懸液和藥物組合物及其在治療方法(特別是治療或預防結核)中的相應用途。本發明的制劑含有蔗糖和/或平均顆粒尺寸低于結核治療的基于脂質體的常規藥劑,導致更高的生物利用度和效力。
背景技術:
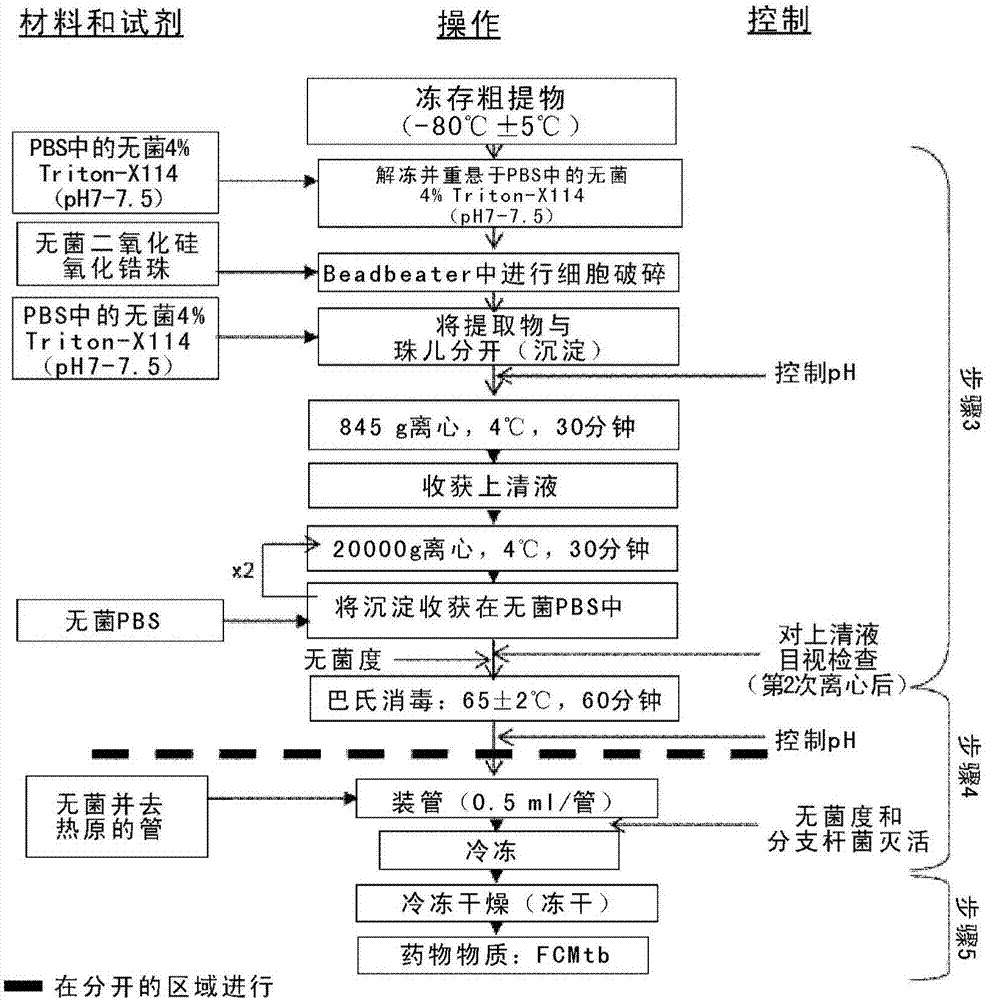
結核是由結核分枝桿菌復合群(mycobacteriumtuberculosis-complex,mtb-c,其包括分枝桿菌m.tuberculosis、m.bovis、m.microti和m.africanum)桿菌導致的慢性感染性疾病。分枝桿菌細胞包膜的主要獨特特征是厚且為蠟質的細胞壁。細胞壁屏障的特性還促進該生物的胞內存活,這是通過作為宿主與mtb-c桿菌之間免疫反應的直接調節劑來實現的。包膜由兩個不同部分組成:質膜,及其周圍的壁。細胞壁是由共價連接的肽聚糖結構形成的骨架,具有通過磷酸二酯鍵附著的支鏈多糖——阿拉伯半乳聚糖。阿拉伯半乳聚糖的遠端被高分子量脂肪酸(分枝菌酸,具有分枝菌的獨特大小和結構)酯化。據世界衛生組織稱,全世界每年有9,000,000例人感染該疾病的新病例記錄在案,約2,000,000人死亡。全世界的感染人數被認為超過2,700,000,000,每年又產生九百萬至一千萬的新感染。本領域中已經描述了多種基于有毒力或無毒力分枝桿菌菌株細胞壁片段的針對結核的疫苗。目前用于對結核進行預防性處理的疫苗是基于稱為bcg(卡介苗,m.bovis的一種減毒變體)菌株的細菌。還已知,疫苗組合物中使用的佐劑能極大地影響其有效性。海藻糖分枝菌酸酯(特別是海藻糖二分枝菌酸酯)是結核分枝桿菌提取物中最具生物活性的脂質,其誘導影響肉芽腫形成的促炎性級聯。應該指出,關于結核分枝桿菌細胞壁中這些化合物的存在量,并沒有生物學數據。來自該物種的任何樣品都具有高度生物復雜性。因此,為了實施定量分析,將需要激進的、復雜的并且漫長的純化步驟,導致用于進行進一步結構分析的純化化合物的量過低。這正是沒有關于結核分枝桿菌細胞壁中每種化合物確切百分比的已公開數據的原因。一些糖脂是mtb-c細胞的典型組分,例如脂阿拉伯甘露聚糖。脂阿拉伯甘露聚糖與mtb-c毒力有關。e.ribietal.,nature1963,198,1214-1215頁描述了用包含無毒力卡介苗(bcg)菌株細胞壁片段和礦物油的組合物進行的免疫測定。所述片段通過在礦物油中對所述菌株的培養物進行勻漿而獲得。該組合物比常規疫苗(bcg)更有效。盡管如此,同一文章中還描述了所述細胞壁片段當在水中勻漿并且不存在礦物油時不誘導免疫應答。d.p.paletal.,indianj.med.res.1977,65,340-345頁描述了用有毒力的h37rv菌株的細胞壁片段和礦物油制備的疫苗。在這種情況下,細胞壁片段通過在水相中對死細胞進行勻漿而獲得,然后向組合物中加入礦物油。還描述了,在水相中勻漿的細胞壁片段無免疫原性,必須存在礦物油才能使疫苗有效。g.k.khulleretal.,foliamicrobiol.,1992,37,407-412頁描述了結核分枝桿菌的無毒力h37ra菌株的細胞壁的不同級分的保護性效力,所述級分與弗氏不完全佐劑(也包括礦物油)配制在一起。e.m.aggeretal.,scand.j.immunol.,2002,56,443-447頁描述了包含有毒力的h37rv菌株的細胞壁片段的疫苗,其在包含陽離子型表面活性劑二甲基雙十八烷基溴化銨作為佐劑的情況下有效。還描述了,用不包含所述佐劑的勻漿結核分枝桿菌進行的測定在小鼠模型中不產生針對結核的抗性水平。i.m.ormevaccine,2006,24,2-19頁是一篇結核疫苗的綜述文章,其描述了,基于常規卡介苗(bcg)的疫苗在為成年人提供針對結核的保護中基本無效。可能受益于涉及結核的治療或預防的個體可分為以下亞組:(i)未接觸該疾病的個體。預防性疫苗接種可防止這些個體發生感染。(ii)已接觸該疾病但尚未感染的個體。皮膚結核菌素測試(tst)為陰性。初級預防(primaryprophylaxis)能防止這些個體發生感染。(iii)具有潛伏期結核的未發病的個體。可通過施用化學治療來降低疾病爆發的風險。化學治療還提供了使這些個體基本停止作為高風險感染源的優點。(iv)患病個體,即患有該疾病,通常是該疾病的原發形式,但沒有或基本沒有傳染性。化學治療避免這些個體變成傳染性。感染開始后,本領域描述了多種用于在感染個體(即具有潛伏期結核的個體)中防止發生活動性結核的治療。例如,在專利申請ep2196473a1中描述了,為了治療感染個體中的結核可以在長至數月的時間中向尚未發病以及已經發病的個體施用多種藥物,包括異煙肼。在專利申請es2231037a1中描述了免疫治療劑,其包含結核分枝桿菌復合群(mtb-c)的有毒力菌株的細胞片段,用于制備與其他藥物(如異煙肼或利福霉素)聯合用于治療感染個體中的結核的藥物。該專利申請還描述了用于制備包含mtb-c菌株之細胞壁片段的免疫治療劑的方法。如wo2010/031883a1所指出,潛伏期結核感染的傳播主要通過吸入被結核分枝桿菌感染的氣溶膠而發生。因此,與患肺結核并因此能夠散播感染氣溶膠的患者直接接觸的人(例如與他們住在一起或者有任何類型的充分或頻繁接觸的人)被認為是風險群體。因此,通常向i組個體(見上文)施用的感染初級預防是基于每天施用5mg/kg劑量的異煙肼(不超過300mg/天)的初級化學預防。該處理適用于與感染個體住在一起和/或任何類型密切接觸的任何年齡的所有tst陰性個體。在這種情況下,化學預防需要在停止接觸感染源后或感染源不具感染性后維持三個月。然而,化學預防在一些情況下可導致繼發性的不良效果,如martínezetal.,arch.bronchoneumol.,2005,41(1),27-33所述。包含有毒力結核分枝桿菌復合群(mtb-c)片段的藥物已經描述于例如ep1690549b1、ep2090318a1和pct/es2009/000436。ep2090318a1和pct/es2009/000436描述了包含有毒力結核分枝桿菌復合群(mtb-c)片段的藥物組合物,其作為適于預防性防止結核(任選地與其他藥物組合)的藥物。另一方面,ep1690549b1描述了適于治療結核的藥物組合物,其包含任選地與其他藥物組合的mtb-c片段。專利申請ep2090318a1中報道,施用包含基于有毒力mtb-c菌株細胞壁片段之藥劑的藥物能夠誘導針對結核分枝桿菌特異性抗原的產生干擾素-γ的th1型應答。所述抗原包括ag85b和ag85a,它們是復合體ag85的部分,后者由一系列低分子量蛋白組成,這些蛋白在細胞壁的生物合成中發揮決定作用,并且在細菌培養處于指數生長(log)期時以可觀的量產生。ep2090318a1還報道了,基于常規卡介苗(bcg)的疫苗不產生針對復合體ag85的免疫保護應答。特定淋巴細胞產生的干擾素-γ發揮關鍵作用:它使得感染的巨噬細胞能夠終止桿菌的生長(north&young,ann.rev.immunol.,2004,22:599-623)。世界衛生組織認識到,與無hiv感染的人相比,患有hiv的人發生結核(tb)的風險估計要高20-37倍。“guidelinesforintensifiedtuberculosiscase-findingandisoniazidpreventivetherapyforpeoplelivingwithhivinresource-constrainedsettings”whoguidelines2011,isbn:9789241500708)中給出了概況。然而,異煙肼預防性治療不是會為hiv陽性個體提供持久保護的疫苗接種。相反,異煙肼必須定期施用,并且異煙肼抗性也降低了該療法。因此,仍然需要提供用于hiv陽性人受試者的強有力的預防和治療性處理。發明目的本發明的目的是提供改進的藥劑,其在hiv陽性和hiv陰性人受試者中都適于預防或治療結核,例如預防潛伏期結核、初級預防和/或治療潛伏期或活動性結核。另一個目的是提供適于制備所述藥劑的mtb-c菌株。制備該藥劑的方法是本發明的另一個目的。定義“fcmtb”代表來自結核分枝桿菌復合群(mtb-c)菌株的片段。如果沒有另外指明,則“顆粒尺寸”(亦稱“粒度”)指顆粒的直徑。當顆粒尺寸無法準確測定時,則指近似顆粒尺寸。“z-平均”是如“材料和方法”章節中所述測定的平均顆粒尺寸。縮寫aids獲得性免疫缺陷綜合征bcg卡介苗cfu集落形成單位dp藥物產品ds藥物物質elisa酶聯免疫吸附測定elispot酶聯免疫點測定emea歐洲藥品管理局fcmtb結核分枝桿菌細胞的片段fim首次在人中hiv人免疫缺陷病毒ifn-γ干擾素γigtipgermanstriasipujol的衛生科學研究所imp研究性藥物產品ipc過程控制(inprocesscontrols)lcs脂質體濃縮物懸液ltbi潛伏期結核感染lps脂多糖mtb結核分枝桿菌(mycobacteriumtuberculosis)mtb結核分枝桿菌復合群(mycobacteriumtuberculosis-complex)nzb新西蘭黑nzw新西蘭白ppd蛋白純化衍生物q.s.適量tb結核tst結核皮膚測試who世界衛生組織w/v重量/體積w/w重量/重量技術實現要素:本發明提供了脂質體制劑,其包含來自結核分枝桿菌復合群(mtb-c)菌株的片段(fcmtb)和脂質體形成劑。在一個具體實施方案中,顆粒的z-平均尺寸(通過動態光散射測定)為120nm或更小,優選110nm或更小,更優選95nm或更小,最優選80nm或更小。在一個備選實施方案中,所述脂質體制劑包含1-20%(w/v)的蔗糖,優選2-12%(w/v)的蔗糖,更優選3-8%(w/v)的蔗糖,最優選4-6%(w/v)的蔗糖。重要的是要注意,盡管這兩個實施方案的每一個都可以獨立實現,但這些實施方案不視為互斥的,而是完全可以組合。在一個具體實施方案中,上述脂質體制劑的z-平均顆粒尺寸為40-120nm,優選50-110nm,更優選55-95nm,最優選55-80nm。在另一個具體實施方案中,上述脂質體制劑的平均顆粒尺寸可以更小,使得該脂質體制劑為乳劑,即,該具體實施方案中顆粒的z-平均尺寸優選小于40nm。在上述實施方案中任何一種或更多種的優選實施方案中,所述脂質體制劑是顆粒多分散性指數為0.4或更小(優選0.3或更小)的脂質體制劑。在任何上述實施方案的一個更優選實施方案中,所述結核分枝桿菌復合群(mtb-c)菌株是有毒力的結核分枝桿菌復合群(mtb-c)菌株。在任何上述實施方案中,還優選(a)所述來自結核分枝桿菌復合群(mtb-c)菌株的片段與(b)所述脂質體形成劑之間的比例為0.01∶1至1∶1,優選0.06∶1至0.1∶1。在任何上述實施方案的一個更優選實施方案中,所述脂質體制劑還包含:(d)表面活性物質(tensioactiveagent)。在一個甚至更優選的實施方案中,包含(d)表面活性物質的脂質體制劑是這樣的脂質體制劑,其中(a)與(d)的比值為0.1∶1至10∶1(w/w),優選0.5∶1至2∶1(w/w),最優選0.6∶1至0.8∶1(w/w)。在上述實施方案的一個具體實施方案中,所述脂質體制劑中的脂質體形成劑是磷脂,優選卵磷脂,更優選選自蛋卵磷脂或大豆卵磷脂,最優選大豆卵磷脂,其中每一種都可以是氫化的,部分氫化的或非氫化的。在含有表面活性劑的脂質體制劑的一個優選實施方案中,所述表面活性物質選自膽酸鹽、脫氧膽酸鹽、膽固醇和膽固醇琥珀酸單酯(cholesterolhemisuccinate)。在一個更優選的實施方案中,上述脂質體制劑是這樣的脂質體制劑,其中mtb-c細胞的片段是細胞壁片段或者包含細胞壁片段。在另一個更優選的實施方案中,上述脂質體制劑包含mtb-c菌株nctc13536的片段,該菌株的保藏編號為nctc13536,保藏單位代碼為nctc-國家典型培養物保藏中心,保藏日期為2010年12月3日,保藏單位地址為英國倫敦科林代爾大街健康保護機構,分類命名為mycobacteriumtuberculosisstrainruti。該菌株也稱為511,因此nctc13536和511這兩種名稱可互換使用。在一個甚至更優選的實施方案中,上述脂質體制劑包含以下的至少兩項,優選三項,更優選四項,最優選全部:(i)第一多肽,其分子量為約70kda,與結核分枝桿菌hsp70蛋白(rv0350)的質量指紋圖譜相似,(ii)第二多肽,其分子量為約38kda,與結核分枝桿菌38kda蛋白(rv0934)的質量指紋圖譜相似,(iii)第三多肽,其分子量為約30kda,與結核分枝桿菌ag85b蛋白(rv1866c)的質量指紋圖譜相似,和(iv)第四多肽,其分子量為約10kda,與結核分枝桿菌cfp10蛋白(rv3874)的質量指紋圖譜相似,和(v)第五多肽,其分子量為約6kda,與結核分枝桿菌esat-6蛋白(rv3875)的質量指紋圖譜相似。在另一個更優選的實施方案中,所述脂質體制劑包含分子量約19kda的脂多肽,其與與結核分枝桿菌19kda脂蛋白抗原前體lpqh(rv3763)的質量指紋圖譜相似。甚至更優選地,上述脂質體的特征還在于存在以下結核分枝桿菌抗原的至少一種或其片段:hsp70、38kda蛋白和ag85b。這里的“片段”是指任何這些多肽的任何部分,例如降解產物。在一個更優選的實施方案中,上述脂質體制劑包含通常可見于結核分枝桿菌中的脂質或其衍生物,例如綴合產物如糖綴合脂質。還優選的是,包含一種或更多種分枝菌酸,優選i、iii或iv型中的任何一種或更多種。作為替代或補充,該制劑中可包含糖綴合的分枝菌酸酯,優選海藻糖二分枝菌酸酯。作為替代或補充,還優選的是,本發明的脂質體制劑中存在至少一種mtb-c衍生糖脂,一種優選的糖脂是脂阿拉伯甘露聚糖。上述脂質體制劑還可包含一種或更多種表面活性劑,其優選來自非離子型表面活性劑組。在另一個優選的實施方案中,前述任一權利要求的脂質體制劑還包含一種或更多種鹽或其溶液,其中優選的鹽是氯化鈉。在任何上述實施方案的一個甚至更優選的實施方案中,本發明的脂質體制劑是凍干的。本發明還提供懸液,其中任一前述權利要求的脂質體制劑重構于溶劑中。在一個優選的實施方案中,該懸液的的溶劑是含水溶劑,優選是生理血清或者包含生理血清。本發明還提供藥物組合物,其包含上述任何一個或更多個實施方案所述的脂質體制劑或者上述任何一個或更多個實施方案所述的懸液,以及可藥用載體或稀釋劑或賦形劑,其中可以施用任何適于作為載體、稀釋劑或賦形劑的物質。在其一個優選實施方案中,該藥物組合物還包含可藥用佐劑。本發明還提供用于治療人或動物體的方法中的產品。即,提供上述任何一個或更多個實施方案的脂質體制劑、上述任何一個或更多個實施方案的懸液或上述任何一個或更多個實施方案的藥物組合物,其用于治療人或動物體的方法中。在一個具體實施方案中,本發明提供用于注射的該脂質體制劑、懸液或藥物組合物。在另一具體實施方案中,本發明提供用于結核治療或預防方法中的該脂質體制劑、懸液或藥物組合物。這些具體實施方案可以單獨或組合實現。在一個更具體的實施方案中,本發明提供上文就其在人體治療方法中的用途描述的脂質體制劑、懸液或藥物組合物,其特征還在于,其用于以包含1至1000、優選3至250、更優選4至80、最優選約5、約25或約50μg/劑fcmtb的劑量施用于人體。在又三個具體實施方案中(a)至(c)中,上文就其在人體治療方法中的用途描述的脂質體制劑、懸液或藥物組合物是(a)用于在具有潛伏期結核感染的個體中預防活動性結核的方法中,(b)用于結核初級預防方法中,以防止已接觸疾病單尚未感染的個體發生感染,或(c)用于治療或預防潛伏期結核的方法中。上述脂質體制劑、懸液或藥物組合物用于人或動物體治療方法的一個優選實施方案是其用于聯合治療或輔助治療(adiunctivetherapy)中。輔助治療是與首要治療(primarytreatment)結合的額外治療或第二治療,其提高治療疾病的有效性。聯合治療的一個具體實施方案是這樣的,其中所述聯合治療包含抗生素,優選異煙肼和利福霉素中的一種或更多種,其中安沙霉素是最優選的利福霉素。在本發明的一個具體實施方案中,輔助治療適用于hiv陽性人受試者,優選25μgfcmtb的單劑量。本發明還提供用于制備任何所述藥劑(所述脂質體制劑、懸液或藥物組合物)的方法。本發明還提供2010年保藏于倫敦nctc的mtb-c菌株nctc13536。發明詳述本發明提供脂質體制劑,其包含來自結核分枝桿菌復合群(mtb-c)菌株的片段(fcmtb)和脂質體形成劑。除非另外指明,否則本申請上下位中使用的術語“包含”均表示除了以“包含”引入的成員列表之外還可任選地包含其他成員。但是,作為本發明的一個具體實施方案,術語“包含”也包括不存在其他成員的可能性,即對于該實施方案而言,“包含”應理解成具有“由……組成”的含義。本發明詳述公開了本發明各個特征的具體和/或優選變化方案。作為特別優選的實施方案,本發明還考慮通過將針對本發明兩個或更多特征描述的兩個或更多個具體和/或優選變化方案組合而產生的那些實施方案。公認的是,脂質體形成(liposoformation)過程產生脂質環境,提高溶解度并產生物質(如fcmtb)的懸液。本發明意義上的脂質體可以是單層的、多層的或其組合。fcmtb可以是來自mtb-c菌株的任何類型的物質,其中來自蛋白質和/或脂質的片段是優選的。本申請意義上的fcmtb通常是來自mtb-c細胞的不同蛋白質抗原和脂質的混合物。細胞片段可通過本領域技術人員已知的任何適于破碎微生物或細菌細胞(例如特別是mtb-c細胞)的方法(如勻漿)來獲得。勻漿可通過超聲處理來進行,或通過將直徑約0.1mm的小珠(例如二氧化硅或氧化鋯/二氧化硅珠)與機械勻漿機一起使用來進行。可以使用的機械勻漿機例如biospec型。通過這種勻漿過程破碎mtb-c細胞,從而獲得小的細胞片段,通常包括小細胞壁片段。細胞片段制造中的特別重要的特征是通過脫脂作用對細胞壁片段進行“脫毒”,脫脂作用是本領域技術人員熟知的允許除去內毒素樣分子的方法。因此,優選對fcmtb進行脫毒和巴氏消毒,其后所得的脂質體制劑是無菌并無內毒素的。細胞片段在緩沖液中的分散體可以任選地凍干,以利于其保存。為此,將分散體分配到瓶中并在約-15℃至-120℃的溫度(例如-45℃)下以真空(例如0.1至0.5mbar)凍干。本發明的脂質體的尺寸分布通常為至少99.9%(以數量計)小于1μm。在一個具體實施方案中,顆粒的z-平均尺寸(通過動態光散射測定的)為120nm或更小,優選110nm,更優選110nm或更小,更優選95nm或更小,最優選80nm或更小。在動態光散射中,z-平均參數被認為是可通過該技術獲得的穩定且重要的數字,以及優選用于質量控制目的的尺寸數字。優選地,本發明制劑中的脂質體是單峰(monomodal)的,即,它們在動態光散射測定中僅顯示一個峰。更優選地,本發明制劑中的脂質體是球狀的,這可通過對該脂質體制劑的冷凍破碎制備物進行電子顯微術來測試,如實施例9所示。由此,球狀是指對于至少90%的脂質體顆粒(以數目計)而言,各個顆粒的所有表面點距離脂質體的中心都具有相似或相同的距離,即,這種顆粒的最小半徑與同一顆粒的最大半徑相比關系為0.6或更高,0.7或更高,0.8或更高或0.9或更高。本發明的脂質體制劑可包含多層或單層脂質體或其混合物。與本領域技術人員的標準知識一致,動態光散射測量應在合適的緩沖液(即本身不導致脂質體破碎、崩解或融合以任何方式使它們顯著不穩定的緩沖液)中進行。根據經驗,任何緩沖液都可以是合適的,只要離子強度和ph值都與形成所述脂質體的緩沖液相當。優選地,使用與形成所述脂質體的緩沖液在組成上相似或相同的緩沖液。在另一實施方案中,脂質體制劑還包含1-20%(w/v)的蔗糖,優選2-12%(w/v)的蔗糖,更優選3-8%(w/v)的蔗糖,最優選4-6%(w/v)的蔗糖。約5%的蔗糖是特別優選的。重要的是要注意,盡管這些實施方案(一個涉及具體的顆粒尺寸,另一個涉及蔗糖的存在情況)的每一個都可以獨立實現,但這些實施方案不視為互斥的,而是完全可以組合。在一個具體實施方案中,上述脂質體制劑的z-平均顆粒尺寸為40-120nm,優選50-110nm,更優選55-95nm,最優選55-80nm。z-平均顆粒尺寸優選通過動態光散射測定,如上文的一般描述和下文“材料和方法”章節中的詳細描述。在另一個具體實施方案中,上述脂質體制劑的z-平均顆粒尺寸可以更小,使得該脂質體制劑為乳劑,即,該具體實施方案中顆粒的z-平均尺寸優選小于40nm。在上述實施方案中任何一種或更多種的優選實施方案中,本發明制劑中的脂質體還是單分散的,這意味著觀察不到顯著的尺寸分布寬度。這在技術上通過以動態光散射測定的低多分散性指數(pdi)來測試,如0.4或更小,優選0.3或更小。因此,所述脂質體制劑是這樣的脂質體制劑,其中通過動態光散射測定的顆粒多分散性指數為0.4或更小,優選0.3或更小,最優選0.25或更小。來自結核分枝桿菌復合群(mtb-c)菌株的片段可通過包含上游方法和下游方法的方法獲得。出于舉例目的,本文簡要描述了五個主要步驟,實施該方法的具體模式在下文實施例2和3給出。上游方法(實施例2):步驟1:培養結核分枝桿菌,步驟2:收獲結核分枝桿菌并冷凍粗提取物。下游方法(實施例3):步驟3:細胞破碎和脫脂,步驟4:巴氏消毒,步驟5:凍干(任選的)。在任何上述實施方案的一個更優選實施方案中,所述結核分枝桿菌復合群(mtb-c)菌株是有毒力的結核分枝桿菌復合群(mtb-c)菌株。毒力是指致病性和/或桿菌侵入宿主組織的能力。所述有毒力菌株可以是屬于mtb-c物種的任何有毒力菌株,但屬于結核分枝桿菌的菌株是優選的。本發明的mtb-c菌株可通過接種在本領域技術人員熟知的培養基(如middlebrook7h10或7h11瓊脂、sauton′s培養基或proskauer-beck培養基)中來進行培養。所述有毒力菌株的培養優選在長時間中進行,例如等于或大于3周的時間,優選3周至4周。培養溫度優選維持在34℃至38℃。培養結束后,使用本領域技術人員熟知的技術(如專利申請es2231037-a1中描述的那些)收獲和分離細胞。脂質體制劑中的脂質體劑優選是氫化的、部分氫化的或非氫化的磷脂。所用磷脂可以是(或包含)例如磷脂酰膽堿、磷脂酰絲氨酸和磷脂酰肌醇。最典型的是磷脂酰膽堿,它可以是合成的或分離自多種天然來源。優選地,所述脂質體形成劑是(或包含)卵磷脂(lecithin),其選自蛋卵磷脂(egglecithin)和大豆卵磷脂(soylecithin)。大豆卵磷脂是磷脂(尤其是包括磷脂酰膽堿)的混合物,并且是特別優選的。還可包含在所述制劑中(作為脂質體形成劑本身或者作為其他組分)的典型脂質是磷酸二鯨蠟酯(dcp)、二肉豆蔻酰磷脂酰膽堿(dmpc)、二肉豆蔻酰磷脂酰甘油(dmpg)、二油酰磷脂酰膽堿(dopc)、二油酰磷脂酰乙醇胺(dope)、二油酰磷脂酰絲氨酸(dops)、二棕櫚酰磷脂酰膽堿(dppc)、二棕櫚酰磷脂酰甘油(dppg)、磷脂酰膽堿(pc)和/或磷脂酰絲氨酸(ps),其中每種脂質可以是氫化的,部分氫化的或者非氫化的。所述脂質體可使用本領域技術人員熟知的輔助脂質(auxiliarylipids)和技術(如專利申請es2231037-a1中所述)形成。還優選的是,在任何上述實施方案中,(a)結核分枝桿菌復合群(mtb-c)菌株的片段與(b)脂質體形成劑的比值為0.01∶1至1∶1,優選0.06∶1至0.1∶1。在任何上述實施方案的一個更優選實施方案中,所述脂質體制劑還包含:(d)表面活性物質。通常,所有類型的能夠改變表面張力值的試劑都可用作本發明意義上的表面活性物質,但要排除的是落入上文給出的脂質體形成劑定義之中的化合物。有多種類型的表面活性物質為本領域技術人員所知,并可用于本發明的脂質體制劑中。如本領域技術人員所知,表面活性物質通常是具有極性-非極性結構的化合物。不希望受限于任何特定理論,表面活性物質通常具有定位于顆粒表面的傾向,由此在界面上產生降低表面張力值的單分子層。在含有表面活性劑的脂質體制劑的一個優選實施方案,表面活性物質選自固醇及其衍生物,例如膽固醇,和或膽汁鹽(bilesalt),例如膽酸鹽(cholate)。特別優選的實施方案是其中表面活性物質選自膽酸鹽、脫氧膽酸鹽、膽固醇和膽固醇琥珀酸單酯。實施本發明的一個優良(但非限制性)的模式是其中制劑的脂質體同時包含大豆衍生的卵磷脂和膽酸鈉。在一個甚至更優選的實施方案中,包含(d)表面活性物質的脂質體制劑是這樣的脂質體制劑,其中(a)與(d)之間的比值為0.05∶1至3∶5(w/w)。如本領域技術人員所熟知,可以使用多種類型的脂質體形成劑。脂質體可任選地含有提高其穩定性的添加劑,例如維生素e,其據信發揮脂質體抗氧化劑作用。在一個更優選的實施方案中,上述脂質體制劑是這樣的脂質體制劑,其中mtb-c細胞的片段是(或包括)細胞壁片段。可以使用任何屬于mtbc的菌株,優選任何屬于結核分枝桿菌(mycobacteriumtuberculosis)的菌株。在另一個更優選的實施方案中,上述脂質體制劑包含2010年保藏于倫敦nctc的mtb-c菌株nctc13536的片段(實施例1)。另一個可以使用(因此在脂質體制劑中包含其片段)的菌株稱為h37rv,其可得自例如英國倫敦國家典型培養物中心(nctc)(保藏號nc007416),并且經常為本領域研究者使用。還可以使用多于一種菌株,即,脂質體制劑包含多種(例如兩種、三種或多于三種)菌株的片段。考慮到結核分枝桿菌包含約4000種推定抗原,針對全部這些蛋白來分析藥物物質是不可能的。盡管如此,某些mtb-c蛋白已經顯示出與期望的免疫應答相關。它們是近似大小為6、10、30、38和70kda的五個蛋白質條帶(renshaw,etal.,2005,embojournal24,2491-2498;singh,etal.,2005,clin.diagn.lab.immunol.12(2),354-358)。因此,在一個甚至更優選的實施方案中,上述脂質體制劑包含以下的至少兩項,優選三項,更優選四項,最優選全部:(i)第一多肽,其在十二烷基硫酸鈉(sds)聚丙烯酰胺凝膠電泳后測量的分子量為約70kda,其中所述第一多肽的質量指紋圖譜(massfingerprint)與結核分枝桿菌hsp70蛋白(rv0350)的質量指紋圖譜相似,(ii)第二多肽,其在十二烷基硫酸鈉(sds)聚丙烯酰胺凝膠電泳后測量的分子量為約38kda,其中所述第二多肽的質量指紋圖譜與結核分枝桿菌38kda蛋白(rv0934)的質量指紋圖譜相似,(iii)第三多肽,其在十二烷基硫酸鈉(sds)聚丙烯酰胺凝膠電泳后測量的分子量為約30kda,其中所述第三多肽的質量指紋圖譜與結核分枝桿菌ag85b蛋白(rv1866c)的質量指紋圖譜相似,和(iv)第四多肽,其在十二烷基硫酸鈉(sds)聚丙烯酰胺凝膠電泳后測量的分子量為約10kda,其中所述第四多肽的質量指紋圖譜與結核分枝桿菌cfp10蛋白(rv3874)的質量指紋圖譜相似,和(v)第五多肽,其在十二烷基硫酸鈉(sds)聚丙烯酰胺凝膠電泳后測量的分子量為約6kda,其中所述第五多肽的質量指紋圖譜與結核分枝桿菌esat-6蛋白(rv3875)的質量指紋圖譜相似。在另一個更優選的實施方案中,所述脂質體制劑還包含分子量(在十二烷基硫酸鈉(sds)聚丙烯酰胺凝膠電泳后測量)約19kda的脂多肽,其中所述脂多肽與結核分枝桿菌19kda脂蛋白抗原前體lpqh(rv3763)的質量指紋圖譜相似。相應條帶可通過本領域已知方法(如銀染)來顯現。本發明的研究者意想不到地發現,該多肽誘導高全igg體液應答,其可以是制劑的全部抗原中最高的體液應答。如何鑒定多肽或脂多肽的實例在實施例4中給出。甚至更優選地,上述脂質體制劑的特征還在于存在以下結核分枝桿菌抗原的至少一種或其片段:hsp70、38kda蛋白和ag85b,最優選hsp70、38kda和ag85b中至少之一。這里的“片段”是指任何這些多肽的任何部分,例如降解產物。可以使用多種方法獲得這些片段,例如化學或酶水解,由此,破碎是否有意發生、在脂質體形成之前或之后發生并不重要。優選的是,相應片段可以歸因于其相應來源,例如由于氨基酸序列顯著重疊,例如至少5、至少10、至少20個連續氨基酸。本發明的片段優選得自在饑餓、低氧和低ph脅迫條件下培養的桿菌。低氧是由于在培養期(例如21天)中密封在氣密袋中的平板上細菌的生長,導致微氧環境。低ph的解釋如下:培養開始時ph值為7.0-6.8,結束時(通常在培養21天后),ph值為6.4-6.5。在這些條件下,細菌的代謝較慢,導致穩定生長。應該理解,這使得桿菌對脅迫的抗性更高。在這些條件下,培養的桿菌產生與ltbi(潛伏期結核感染)中體內潛伏期桿菌相似的特征。因此,預計fcmtb中存在的抗原會觸發針對潛伏期桿菌之抗原(所謂的“結構”抗原)以及脅迫應答相關的抗原的新免疫應答。分枝桿菌糖脂長期以來就被認為具有免疫調節活性,特別是誘導肉芽腫應答和發揮強佐劑樣效應。因此,在另一個優選的實施方案中,上述脂質體制劑包含通常可見于結核分枝桿菌中的脂質或其衍生物,例如綴合脂質如糖綴合脂質。已經在結核分枝桿菌樣品中鑒定出一些免疫原性脂質組分(brennan,tuberculosis(edinburgh),2003,83(1-3),91-97),并開發了用于其測定的分析方法(電泳、sds-page、薄層層析)。盡管每種脂質組分的分離將需要如此激進的處理以致于很難獲得mtb-c提取物或脂質體制劑中每種可檢測組分的定量數據或百分比,但定量表征將用于表征本發明的更優選實施方案。根據這一優選實施方案,包含一種或更多種分枝菌酸,優選屬于i、iii或iv型中的任何一種或更多種。作為替代或補充,制劑中可包含糖綴合分枝菌酸酯,優選海藻糖二分枝菌酸酯。作為替代或補充,制劑中可包含脂阿拉伯甘露聚糖(lam)這種糖脂。此外,相信所述片段的多抗原性性質(多抗原性蛋白質混合物加脂質,而不是僅有純化的抗原)是有利的,因此本領域技術人員能夠改動細胞破碎過程以允許獲得最佳細胞抗原混合物。mtb-c細胞的勻漿在一種或更多種表面活性劑(優選非離子型表面活性劑)存在下進行。因此,上述脂質體制劑還可包含一種或更多種這些表面活性劑。大量這種表面活性劑在本領域技術人員的標準知識中。優選地,所用的非離子型表面活性劑選自乙氧基化烷基酚和乙氧基化山梨糖醇酯。更優選地,所述非離子型表面活性劑選自乙氧基化辛基酚。甚至更優選地,使用具有包含7至8摩爾環氧乙烷含量的乙氧基辛基酚,該表面活性劑以triton這一名稱銷售。對含有細胞壁片段的勻漿物進行常規處理以分離并移除未破碎細胞和溶解組分。es2231037-a1描述了例如可以使用不同速度的離心和用緩沖液進行的洗滌。進行上述純化過程后獲得含有細胞壁片段的沉淀。將所述沉淀分散在磷酸鹽緩沖液(pbs)中并進行常規處理,以確保在破碎和純化過程后可能仍保留活力的mtb-c細胞完全失活。所述處理可以是化學處理,例如用甲醛處理,或者是物理處理,例如高壓滅菌或巴氏消毒處理。下文實施例5給出了脂質表征的實例。在另一優選實施方案中,上述脂質體制劑還包含一種或多種鹽或其溶液,其中優選的鹽是氯化鈉。在任何上述實施方案的一個甚至更優選的實施方案中,所述脂質體制劑是凍干的。可以對所述脂質體進行凍干以由此獲得凍干脂質體形式的免疫治療劑。為此,可將分散體分配到瓶中并在低溫(如約-15℃至-120℃的溫度,例如-45℃)下以真空(例如0.1至0.5mbar)凍干。凍干后得到的瓶中含有適于作為免疫治療劑的脂質體制劑,它們優選保存在極低的溫度下,例如-70℃。本發明還提供懸液,其中任一前述權利要求的脂質體制劑重構在溶劑中。在一個優選的實施方案中,該懸液的溶劑是含水溶劑,更優選并且最優選是(或包含)生理血清。將脂質體制劑懸浮在溶劑中的方法為本領域技術人員所熟知。本發明制劑的一個特別有利的特性是,其能夠比包含mtb-c片段的常規脂質體制劑更快地懸浮(見實施例9)。本發明的一個目的是提供用于制備藥物組合物的包含mtb-c菌株細胞壁片段的藥劑,其中所述藥劑是(或包含)上文任何所述實施方案中所述的脂質體制劑或其組合。藥物物質的藥物制劑/蓋倫制劑(galenicformulation)的主要范圍是獲得懸液,其有效性和穩定性足以被細胞充分識別,并具有在人或動物體中觸發相關細胞免疫應答的潛力。為此,本發明還提供藥物組合物,其包含上述任何一個或更多個實施方案中描述的脂質體制劑或懸液,以及可藥用載體、賦形劑或稀釋劑。多種這樣的載體、賦形劑和稀釋劑為本領域技術人員所知,它們絕不受限于本公開內容。相反,任何適于作為載體、賦形劑或稀釋劑的物質均可使用。在一個優選的實施方案中,該藥物組合物還包含可藥用佐劑。由此,佐劑應理解為本發明該實施方案中包含的一種物質,其中所述佐劑是能夠在適用于人或動物體時刺激免疫系統應答于靶抗原的物質,其中所述佐劑本身不賦予免疫力。不限于任何具體的佐劑物質,優選的實施方案是其中佐劑是鋁鹽例如氯化鋁,或者礦物油或含有礦物油的組合物例如弗氏不完全佐劑(ifa)或弗氏完全佐劑(cfa),或者鹵化銨如溴化烷基銨,例如溴化二甲基雙十八烷基銨。本發明還提供用于人或動物體治療方法的產品。即,提供用于人或動物體治療方法的任何上述一個或更多個實施方案的脂質體制劑、任何所述一個或更多個實施方案的懸液或任何上述一個或更多個實施方案的藥物組合物。所述藥物可在粘膜中施用,例如眼、鼻內、口、胃、腸、陰道或尿道的粘膜,或者腸胃外施用,例如皮下、皮內、肌內、靜脈內或腹膜內施用。優選腸胃外施用。在一個具體實施方案中,本發明提供用于注射的該脂質體制劑、懸液或藥物組合物。在另一具體實施方案中,本發明提供用于結核治療或預防方法中的該脂質體制劑、懸液或藥物組合物。這些具體實施方案可以單獨或組合實現。本研究的發明人發現,本發明的制劑導致提高的細胞免疫應答,還控制常見的再感染過程(否則這可在潛伏期結核感染中發生),這是通過加強針對生長中桿菌的免疫力和誘導針對非復制桿菌的免疫力來實現的。上文就其在人或動物體治療方法中的用途描述的脂質體制劑、懸液或藥物組合物的合適劑量取決于若干參數,包括施用方法和受治者。在一個優選實施方案中,其用于對人體施用。在其一個優選實施方案中,這以1至1000、優選3至250、更優選4至80、最優選約5、約25或約50μg/劑fcmtb的劑量實現。特別優選25μg的劑量。在又三個具體實施方案中(a)至(c)中,上文就其在人或動物體治療方法中的用途描述的脂質體制劑、懸液或藥物組合物是(a)用于在具有潛伏期結核感染的個體中預防活動性結核的方法中。在另一更優選的實施方案中,(b)用于結核初級預防方法中,以防止已接觸疾病單尚未感染的個體發生感染,或(c)用于治療或預防潛伏期結核的方法中。用于人或動物體治療方法中的脂質體制劑、懸液或藥物組合物可以單劑量形式施用,或者同以某時間間隔重復而以多劑量(如2、3、4、5或多于5)施用。優選地,以2至5周(優選3至4周)的間隔分開使用兩劑。實施例8、10和12是怎樣將本發明脂質體制劑施用于人或動物受試者的實例。上述物質的一個優選實施方案是用于聯合治療或輔助治療的脂質體制劑、懸液或藥物組合物。醫學從業者經常使用輔助治療以獲得更好的治愈率或針對首要治療更快的應答。聯合治療或輔助治療包括使用多于一種藥物來治療人或動物體。聯合治療的第一個具體實施方案是其中所述聯合治療包含抗生素,優選異煙肼和安沙霉素,其中所述安沙霉素最優選是利福霉素。其第二個具體實施方案是其中所述聯合治療包含其他針對結核的預防性疫苗,例如s.h.e.kaufmann,naturerev.immunol.,2006,6,699-704頁中提到的那些,例如卡介苗(bcg)疫苗、亞單位疫苗或重組bcg疫苗。第一個和第二個具體實施方案可以組合。在聯合治療或輔助治療中,這兩種(或更多種)物質的施用可以是同時的,或者可以以在時間上分開的兩次(或更多次)接種中完成。接種之間的時間甚至可以是若干年。在聯合治療的情況中,接種在時間上分開進行,首先優選施用針對結核的預防性疫苗,隨后施用包含有毒力mtb-c菌株之細胞壁片段的藥物,其作為先接種疫苗的再刺激劑(加強劑)。在一個實施方案中,僅對人受試者施用單劑量,該劑量優選為25μgfcmtb。或者,在輔助治療中同時使用若干不同治療策略或處置類型。在本發明的一個具體實施方案中,將輔助治療施用于免疫系統受損的人受試者(例如患hiv的個體),或者任何由于其他原因而易于感染結核和/或需要這種治療的個體。輔助治療中也可以施用異煙肼。此外,輔助治療可包括施用治療受損免疫系統(例如治療hiv感染)的任何藥物或藥物組合。治療hiv感染的典型藥物是抗病毒藥,其非限制性綜述可見于“antiretroviraltherapyforhivinfectioninadultsandadolescentsrecommendationsforapublichealthapproach:2010年版”,作者:worldhealthorganization,isbn:9789241599764。因此,本發明人為向hiv陽性人受試者提供有效結核保護(如疫苗接種)的需求提供了解決方案。可以通過允許檢測待測個體體液中人免疫缺陷病毒(hiv)--導致獲得性免疫缺陷綜合征(aids)的病毒-—存在情況的任何測試來測試個體是被認為hiv陽性或否(即hiv陰性),其中體液通常是選自血清、唾液或尿中的任何一種。這種測試可檢測抗體、抗原或rna。合適的篩查測試的概況在chouetal.,ann.intern.med.2005jul5;143(1):55-73中給出。本發明的發明人意想不到地發現,對hiv陽性人受試者施用的25μgfcmtb單劑量提供了強應答。25μgfcmtb單劑量在施用于hiv陰性人受試者時也是強有力的。本發明人顯示,這在患有潛伏期結核的受試者中特別有用(實施例12)。因此,本發明的一個優選實施方案是要向hiv陽性或hiv陰性個體施用的25μgfcmtb單劑量。本發明還提供制造方法,其特征在于,該方法適于獲得任何上述一個或更多個實施方案的脂質體制劑以及懸液和包含它們的藥物組合物。一個非限制性實例在下文實施例11中給出。本發明還提供2010年保藏于倫敦nctc的mtb-c菌株nctc13536。該菌株具有低遺傳多態性。因此,包含nctc13536之片段的制劑由于這種低遺傳多態性而具有可重復性極高的優點。實施本發明的優選模式優選的是,使用50μgfcmtb/劑或25μgfcmtb/劑或5μgfcmtb/劑的具體劑量。例如,劑量為50μgfcmtb時,在一瓶制劑中存在表1中給出的量/物質:1含有磷脂酰膽堿(94.0%(w/w))2作為nacl0.9%溶液加入。表1.對于25μg/劑或5μg/劑的施用,準備其他的瓶,其中表1中的所有數字(除了蔗糖以外)各自除以2或10。制劑(50μg、25μg和5μg)中的蔗糖含量總是20000μg單位/瓶。由高度富含磷脂酰膽堿(94.0%(w/w))的大豆卵磷脂(脂質體形成劑)和膽酸鈉(表面活性物質)制成的脂質體制劑已經證明足以保證藥物物質在制造過程中和在重構懸液中的更高溶解度。脂質體制劑中fcmtb溶解度的一個重要參數是構成脂質體的組分的比例。在測試不同的fcmtb/脂質比例之后,確認了非常好的比例是約0.03∶0.2∶0.7(fcmtb∶膽酸鈉∶大豆卵磷脂,w/w/w)。還觀察到,水相中鹽的存在增強了脂質體形成。因此,該具體制劑中包含氯化鈉。表2:藥物產品(fcmtb),在凍干脂質體組合物重構后測定在一個優選模式中,實施本發明以使得本發明的脂質體制劑具有表2的特性。為對活受試者進行施用,用0.4ml注射用水重構該瓶,得到含有166.7μg/mlfcmtb的懸液。表3顯示了以50μg/劑重構后每瓶中每一組分的濃度。對于25μg/劑或5μg/劑的應用,使用其他的瓶,使得像對表1描述的那樣,表3中的所有數值(除了蔗糖以外)都分別除以2或10。制劑(50μg、25μg和5μg)中的蔗糖含量總是50000ug/ml。表3用0.4ml注射用水重構后的組分濃度材料和方法參考材料a)單克隆抗體:使用特異性單克隆抗體(抗hsp70、抗38kda、抗ag85b,(來自lionexdiagnosticgmbh,braunschweig,germany))來鑒定fcmtb批次的蛋白質譜。b)白蛋白標準品:用于測定蛋白含量的該標準品由0.9%鹽水溶液(2mg/ml)中的牛白蛋白構成,保存于疊氮化鈉中(生產商:pierce)。c)來自結核分枝桿菌的海藻糖6,6’-二分枝菌酸酯(tdm)標準品:使用市售tdm(sigma)來鑒定fcmtb批次中的tdm。d)來自結核分枝桿菌的分枝菌酸標準品使用市售分枝菌酸(sigma)來鑒定fcmtb批次中的分枝菌酸。e)分子量標記:使用名為pluspre-stainedstandard”(invitrogen)的分子量標記。參數的測定a)ph根據ph.eur.2.2.3和usp<791>,通過電位測定法測定重構fcmtb懸液(20mg/ml)的ph。b)含水量使用電量測定karlfisher裝置進程進行測定凍干fcmtb殘留水的測試,遵循ph.eur.,method2.5.12和usp<921>waterdetermination的一般指導。c)測定總蛋白含量測定fcmtb總蛋白含量的測試使用市售試劑盒(bcakit,pierce)進行,遵循ph.eur.,method2.5.33,method4(bicinchoninicacidorbcaassay)和usp<1057>。d)通過十二烷基硫酸鈉聚丙烯酰胺凝膠電泳(sds-page)鑒定蛋白質譜該測試根據ph.eur.,method2.2.31和usp<726>進行,凝膠中蛋白質的檢測通過改進的考馬斯染色或銀染進行。測試樣品:以40或20mg/ml濃度在純凈水中重構的fcmtb。參照溶液:分子量標記,純化抗原,fcmtb參照標準品。純化抗原結核分枝桿菌hsp70蛋白(rv0350)結核分枝桿菌38kda蛋白(rv0934)結核分枝桿菌ag85b蛋白(rv1886c)結核分枝桿菌19kda蛋白(rv3763)結核分枝桿菌cfp10蛋白(rv3874)結核分枝桿菌esat6蛋白(rv3875)表4:參照抗原為進行考馬斯染色,根據生產商的說明使用gel-codebluestain試劑溶液(pierce)。為進行銀染,根據生產商的說明使用來自invitrogen的protsil1試劑盒。為進行westernblot分析,根據本領域已知的標準方法通過sdspage分離蛋白質,然后電泳轉移到pvdf膜上,用特異性單克隆抗體進行免疫檢測。抗原-抗體相互作用通過與觸發化學發光反應的抗抗體一起孵育來顯現。使用來自來自lionex(braunschweig,germany)的抗原(結核分枝桿菌hsp70蛋白(70kda)、結核分枝桿菌38kda蛋白、結核分枝桿菌ag85b蛋白(30kda))以及來自lionex的特異性單克隆抗體抗hsp70、抗38kda和抗ag85b。e)分枝菌酸的鑒定根據ph.eur.,method2.2.27,通過一維tlc檢查fcmtb中的分枝菌酸:凍干fcmtb,40mg。參照溶液:分枝菌酸標準品(sigma)。方法:a)提取過程:用氯仿∶甲醇(1∶1)提取樣品,然后孵育過夜。除去上清液級分。b)分枝菌酸的酯化:向每個管中加入2ml甲醇∶甲苯∶硫酸(30∶15∶1;vol/vol),然后酯化過夜。然后加入4ml正己烷。在氮氣流下干燥,重懸于500μl己烷。c)tlc:在與平板(silicagel60(20x20cm)(merck)邊緣平行的線上應用10μl每種樣品。以流動相(乙醚:正己烷(15∶85,vol/vol))的飽和水箱將層析分離進行3次。然后將平板晾干。d)通過向平板噴霧磷鉬酸在96°乙醇中的溶液并在120℃加熱10分鐘而使分枝菌酸顯現。通過與分枝菌酸市售標準品點進行比較來測定fcmtb樣品中的分枝菌酸。結果表達為定性數據(評估的分枝菌酸存在(陽性)/不存在(陰性))。f)鑒定海藻酸6,6’-二分枝菌酸酯(tdm):測試樣品:凍干的fcmtb,40mg。參照溶液:tdm標準品(sigma)。方法:(i)提取過程:用氯仿∶甲醇(1∶1)提取樣品,然后孵育過夜。將上清液級分在氮氣流中干燥并稱重。最后將干燥的樣品以40mg/ml終濃度重懸于氯仿中。(ii)tlc:在與平板(silicagel60(20x20cm)(merck)邊緣平行的線上應用10μl每種樣品。以流動相(氯仿∶甲醇∶水(60∶12∶1,vol/vol))的飽和水箱進行層析分離。然后將平板晾干。(iii)檢測:通過向平板噴霧硫酸中的1%蒽酮溶液并在120℃加熱5分鐘而使tdm顯現。(iv)鑒定:通過與用于產生標準品點的市售tdm進行比較來測定fcmtb樣品中的tdm。結果表達為定性數據(評估的tdm存在(陽性)/不存在(陰性))g)鑒定脂阿拉伯甘露聚糖(lam):對于lam的western印跡分析,根據標準方法通過sdspage分離化合物,然后電泳轉移到硝酸纖維素膜上,使用特異性抗體cs35進行免疫檢測。通過與觸發熒光反應的抗抗體(igggoatanti-mouseirdye800cw)孵育而使抗原-抗體相互作用顯現。h)無菌度根據本領域技術人員的知識,所有需要無菌的過程都在無菌條件下進行,這也適用于沒有針對需要無菌的任何給定步驟明確提到的情況。無菌度測定如ph.eur.2.6.1(usp<71>)的規定進行評估。i)分枝桿菌的滅活根據ph.eur.2.6.2評估分枝桿菌的滅活。j)細菌內毒素細菌內毒素的測試(lal測試,limulusamoebocytelysate)根據ph.eur.,method2.6.14的一般指導進行,遵循methodd(生色動態法)和usp<85>。桿菌的破碎桿菌破碎的選擇認為允許最優地呈遞細胞抗原,特別是細胞壁抗原。fcmtb的破碎通過動態光散射(如下文所述)和激光衍射法測定。激光衍射允許測定0.04μm至2000μm范圍內的破碎。該測定在servicioscientífico-técnicosdelauniversitatdebarcelona,spain進行。儀器:coulterls13320,裝有universalliquidemodule(ulm)。溶劑:純凈水/礦物油。結果:繪制成直方圖,表示顆粒直徑(0.04μm-2000μm)之前的顆粒數目相對頻率(%)。測定z-平均顆粒尺寸和多分散性指數本文件描述的平均顆粒尺寸通過動態光散射(dls)測定,是基于顆粒布朗運動的物理概念,以stokes-einstein方程定義:其中-d(h)=流體力學直徑d=平動擴散系數k=玻爾茲曼常數t=絕對溫度η=粘度不希望限于任何理論,stokes-einstein方程確立了,液體介質中懸浮動顆粒處于恒定和隨機動運動中,其速度取決于其尺寸:顆粒越大,布朗運動就越慢。在動態光散射測定中,用單色光源(優選激光)照亮含有待測顆粒的樣品,并在相關函數中分析散射光的強度如何隨時間波動。例如,如果測定大顆粒,由于它們運動得慢,則散射光強度的波動也慢,其相關性需要很長時間才衰減;另一方面,如果測定小顆粒,因為它們運動得快,因此散射光強度的波動也快,信號的相關性迅速衰減。根據本發明,優選用以下儀器測定顆粒:zetasizernanozs(malverninstruments),使用純凈水/礦物油作為溶劑。如果沒有相反說明,則儀器根據生產商的說明使用,調節和校準(如果有的話)也根據生產商的說明進行。使用多種算法由相關函數計算尺寸。在本情況下使用iso13321第8頁定義的“cumulantsanalysis”。相關性函數在單指數曲線中的擬合結果允許計算以下參數:-顆粒分布的平均尺寸或z-平均直徑。該平均尺寸為強度平均。-多分散性指數(pdi),即對應于顆粒尺寸分布的寬度。結果通常繪制成直方圖,表示為顆粒數目相對頻率(%)相對于顆粒直徑(可以是1nm至3μm范圍內包含的任何直徑)。效力測試無特定病原體的6-7周齡雌性c57bl/6小鼠由harlaniberica(spain)提供。測試樣品:表3的制劑和安慰劑(無活性組分的疫苗制劑)。a)用單劑量對體內感染結核分枝桿菌的小鼠模型進行疫苗接種:實驗設計包括:第0天:用mtb菌株h37rvpasteur(4x104cfus)在小鼠下腹部進行皮下感染。第14天:用單次口服劑量的利福噴汀(25mg/kg)和異煙肼(10mg/kg)對動物進行化學預防處理,從而導致1周的抗生素效應。第21天:用單劑量疫苗/安慰劑和/或水在頸部皮下進行疫苗接種。獲得所有樣品并對單個小鼠進行分析。每個實驗包括:感染小鼠加安慰劑的基礎組和感染小鼠加疫苗接種的實驗組。組由6-7只動物組成,實驗一式二份進行。第28天:用異氟烷麻醉小鼠。b)用雙劑量對體內感染結核分枝桿菌的小鼠模型進行疫苗接種:實驗設計包括:第0天:用mtb菌株h37rvpasteur(4x104cfus)在小鼠下腹部進行皮下感染。第14天:用單次口服劑量的利福噴汀(25mg/kg)和異煙肼(10mg/kg)對動物進行化學預防處理,從而導致1周的抗生素效應。第21天:用第一劑疫苗/安慰劑和/或水在頸部皮下進行疫苗接種。第36天:用第二劑疫苗/安慰劑和/或水在頸部皮下進行疫苗接種。獲得所有樣品并對單個小鼠進行分析。每個實驗包括:感染小鼠加安慰劑的基礎組和感染小鼠加疫苗接種的實驗組。組由6-7只動物組成,實驗一式二份進行。第42天:用異氟烷麻醉小鼠。對于上文a)和b),在處死后,使用脾細胞懸液通過elispot對干擾素-γ點形成單位(sfu)參數進行離體分析,以用于細胞免疫應答。測定在結核分枝桿菌健康小鼠模型中的免疫原能力。無特定病原體的6-7周齡雌性c57bl/6小鼠由harlaniberica(spain)提供。用雙劑量對體內結核分枝桿菌健康小鼠模型進行疫苗接種。實驗設計包括:第0天根據實施本發明的優選模式用第一劑疫苗或安慰劑和/或水在頸部皮下進行疫苗接種。第21天用第二劑疫苗或安慰劑和/或水在頸部皮下進行疫苗接種。獲得所有樣品并對單個小鼠進行分析。每個實驗包括:感染小鼠加安慰劑的基礎組和感染小鼠加疫苗接種的實驗組。第28天用異氟烷麻醉小鼠。處死后,使用小鼠血清通過elisa對igg抗體進行分析,以用于體液免疫應答。結核的診斷結核的診斷方法為本領域技術人員所熟知。quantiferon測試和tst已知能夠給出可靠的結果,并可單獨或組合使用,用于將受試者就其對本發明產品治療的適用性進行分類。quantiferon也稱為qft,是針對結核感染或潛伏期結核的市售測試,由cellestislimited,chadstone,melbourne,victoria,australia生產。qft是用于結核診斷的干擾素-γ釋放測定(igra)。其根據生產商的說明使用。mantoux測試(也稱為mantoux篩選測試、結核菌素敏感性測試、(tst測試)、劃痕測試,或用于純化蛋白衍生物的ppd測試)是一種結核診斷工具。這兩種測試的概況可見于frankenetal.,clinvaccineimmunol.2007,april;14(4):477-480。實施例:給出以下實施例以為本領域技術人員提供可工作的模式以及關于本發明一些具體實施方案的解釋。這些實施例為說明性目的,而不旨在以任何方式對本發明的范圍構成限制。實施例1:分離mycobacteriumtuberculosisnctc13536菌株用于生產fcmtb的起始材料是菌株nctc13536(也稱為511或mycobacteriumtuberculosisnctc13536,是從西班牙巴塞羅那的一名有免疫力的肺結核患者中分離的結核分枝桿菌菌株)的接種物。其在2010年保藏于倫敦nctc(符合布達佩斯條約的官方保藏組織)。該菌株還保藏于西班牙巴塞羅那serviceofmicrobiologyofthehospitaldesantpau的菌株中心。在1995年和1996年分別對原始菌株進行了兩次傳代。mslpb#1對應于原始菌株結核分枝桿菌nctc13536的第二代,其在1996年10月進行,獲得了100管(3ml無菌玻璃管),保存于-70±5℃。如本領域標準方法所測定的,該菌株具有低遺傳多態性。實施例2:生產mtb-c細胞的上游方法本方法的流程圖在圖1中給出。用于生產fcmtb的起始材料是菌株nctc13536(實施例1)的接種物。為確保該起始材料的持續供應,優選使用種子批系統(seedlotsystem)。因此,用來自主種子批(msl,masterseedlot)的工作種子批(wsl,workingseedlot)產生fcmtb。將mycobacteriumtuberculosisnctc13536(實施例1)在培養基中培養3至5周。然后將細菌生長物傳代到37±2℃的proskauerbeck培養基中并以100±5rpm攪拌。一旦達到最高細菌濃度(目測)后,在proskauerbeck培養基中傳代培養并孵育。實現相似的細菌濃度后,取小的等分試樣。通過在37±2℃接種3-4周后在middlebrook瓊脂培養基中獲得的集落形成單位(cfu)來測定活性細菌數。細菌數必須為2-5x107cfus/ml。(1)培養結核分枝桿菌fcmtb的生產開始于自在7h11瓊脂平板中接種0.2mlwsl并在37±1℃孵育15±2天。然后將集落轉移至含有少量玻璃珠的管中。混合后,加入約5ml注射用水(wfi)以獲得細菌懸液。此時,進行活性平板計數和無菌度測試。使用浸有細菌懸液的拭子用結核分枝桿菌接種約100middlebrook7h11瓊脂平板,以獲得會合培養物。平板在37±1℃下孵育21±2天。如下進行無菌度測試作為過程控制:無菌度測試的目的是確保不存在真菌和除mycobacteria之外的細菌。測試通過根據無菌度測試的ph.eur2.6.1直接接種來進行。測試樣品必須是無菌的。使用7h11培養基代替7h10(ph.eur.2.6.2中提到的)。7h11以7h10培養基為基礎,加入1g酪胰蛋白酶消化物以增強結核分枝桿菌菌株的生長。(2)收獲結核分枝桿菌并冷凍粗提物孵育期之后,通過對瓊脂平板進行目測和進行無菌度測試來控制細菌培養物的純度。然后,從瓊脂平板上收集細菌生長物并轉移至無菌管中。將獲得的粗提物稱重(20-22g)。將混合物保持在-80℃±5℃。實施例3:用于產生得自粗提物的脂質體的下游方法本方法的流程圖在圖2中給出。(3)細胞破碎和脫脂將粗提物(實施例2)在37±1℃解凍,然后在4℃下加入含有4%(w/w)triton-x114的無菌pbs緩沖液(ph7.0-7.5)。混合后,隨后將其轉移至含有無菌二氧化硅/氧化鋯珠的無菌聚碳酸酯容器中。然后,在beadbeater中通過應用以下破碎方法來實施細胞破碎:3個循環,每個循環由5個開/關周期加10分鐘休息組成。方法完成后,通過隨后在含有4%triton-x114的無菌pbs緩沖液(ph7.0-7.5)中洗滌(反復搖動和沉淀)而將細胞破碎級分與珠子分開。然后收集經洗滌的細胞破碎級分懸液的等分試樣以進行ph控制,然后在4℃下以845g最終離心30分鐘。為了除去胞質級分并獲得富含細胞片段的懸液,在4℃下以20000g進行兩次約60分鐘的高速離心。第一次離心后,將淡黃色的上清液(富含可溶性蛋白和脂質)棄去,將沉淀重懸于pbs中,在上述相同條件下再次離心。其后,棄去的上清液的外觀必須是澄清無色的。最后,將所得沉淀重懸于50-60mlpbs的最終體積中(fcmtb懸液)。(4)巴氏消毒接著將fcmtb懸液在65±2℃巴氏消毒60分鐘。巴氏消毒結束后,通過石蕊濾紙測定經巴氏消毒的fcmtb的ph。ph6.5-7.5范圍內認為是可以接受的。將0.5ml產物懸液裝入無菌并去熱原的管中,進行針對無菌度和mycobacteria失活的ipc。將裝好的管冷凍在-80±5℃。材料在進行巴氏消毒后將與未處理材料物理分離,即,巴氏消毒之前利用的空間與其后填充過程使用的空間完全分開。(5)凍干接著在約-45℃至30℃的溫度和0.310mbar的壓力下對所有含有冷凍產物的管凍干約18小時(每管約0.5ml體積)。使用無菌操作并在氮氣氛下將管加塞并標注。然后將包裝好的藥物物質在-20°±5℃保存多至12個月。實施例4:蛋白表征圖3給出了就蛋白質譜而言的表征策略的概況基于文獻(andersenp.,1997,scandj.immunol.;45(2):115-31;geiseletal.,2005,j.immunol.;174(8):5007-15;stewartetal.2005,infect.immun.,73(10):6831-7.,wangetal.,2007,j.mol.biol.,366(2):375-81)選擇了6個蛋白質條帶作為蛋白質譜評估的代表:hsp70蛋白(rv0350)、38kda蛋白(rv0934)、(rv1866c)、19kda蛋白(rv3763)、cfp10蛋白(rv3874)和esat-6蛋白(rv3875)。a.測定總蛋白含量:通過二辛可寧酸(bca)法對fcmtb的總蛋白水平進行定量。總蛋白占fcmtb內容物的約10%(w/w)。參照標準品fcmtb-0429-16和fcmtb-52.1分別含有167μg蛋白/mgfcmtb和115μg蛋白/mgfcmtb。b.通過十二烷基硫酸鈉聚丙烯酰胺凝膠電泳(sds-page)鑒定蛋白質譜:通過與對應于以下結核分枝桿菌參照抗原進行比較來測定藥物物質fcmtb的蛋白質譜:esat6(6kda)(7);cfp10(10kda)(6);ag85b(30kda)(1);38kda(2);hsp70(70kda)(4)以及分子量標記mw(5),如所示(見圖4)。通過考馬斯染色進行藥物物質fcmtb的蛋白質譜測定和條帶(約70kda,38kda,30kda,10kda和6kda)鑒定。通過銀染進行19kda條帶(脂多肽)的鑒定。c.用特異性單克隆抗體通過western印跡鑒定蛋白質譜:使用以下單克隆抗體(mab)獲得的圖譜確定藥物物質fcmtb的蛋白質譜:抗hsp70(70kda,fig.5c)、抗38kda(fig.5d)、抗ag85b(30kda,fig.5e)。fcmtb-52.1是根據本發明實施的優選模式的fcmtb的優選批次。實施例6:脂質表征fcmtb脂質譜的表征由基于氯仿∶甲醇(1∶1)提取的分級分離法組成。本研究中實施的分級分離方案發基于delmaseta1.,1997,glycobiology7(6),811-7描述的方法。用于分析fcmtb中脂質和糖脂含量的方法是薄層層析(tlc)。具體地,通過薄層層析(tlc)在參照菌株h37rv和nctc13536以及不同fcmtb批次中都鑒定出了多酰基海藻糖(polyaciltrehalose(pt))、海藻糖二分枝菌酸酯(tdm)、二酰基海藻糖(dat)、磷脂酰肌醇甘露糖苷(pim)和其他糖脂以及結核菌醇二分枝菌酸酯(phthioceroldimycocerosates(pdim))和分枝菌酸。見圖7a。通過tlc分析上清液中海藻糖6,6’-二分枝菌酸酯(tdm)的含量。根據tlc法對沉淀中的分枝菌酸進行測定。盡管對于mtb-c脂質譜沒有已知的定量數據,但本研究中建立的定性脂質譜與目前的科學知識一致,并允許對目前已知的免疫原性脂質進行標準表征。將fcmtb與結核分枝桿菌菌株nctc13536和h37rv的全細胞脂質級分和tdm商品標準品進行了比較(見圖7a和7b)。總體而言,本發明包含fcmtb的脂質體的不同批次中的脂質含量是一致的。圖7d顯示了lam的表征。實施例6:破碎的細胞材料的表征使用兩種方法獲得的初步結果都顯示,fcmtb的片段大小主要是小于1μm(99%<1μm),fcmtb電子顯微術確證了這一點:片段的尺寸主要為100至300nm。通過260nm的吸光度研究了酚/氯仿混合物提取后的殘余dna水平(檢出限:0.2μgdna/mgfcmtb)。目前獲得的典型結果低于15μgdna/mgfcmtb。在不同fcmtb批次之間可重復的脂質和蛋白質譜顯示了該藥物物質生產過程的一致性。實施例7:免疫小鼠并使生物活性可見fcmtb蛋白質條帶與小鼠免疫血清的相互作用:利用western印跡法,可以使與血清中存在的igg抗體相互作用的fcmtb蛋白質條帶可見,所述血清得自用本發明基于脂質體制劑的疫苗接種兩次的感染小鼠。這被認為是生物活性的指示(圖6)。實施例8:包含fcmtb的脂質體制劑的體內活性如下在體內模型中研究該疫苗的生物活性:評估無脂質體的fcmtb(用注射用水wfi重構)和本發明最佳實施模式的脂質體制劑(5%蔗糖,見上文)中的fcmtb的免疫原能力(圖8)。這些結果顯示了含有蔗糖的脂質體制劑的優勢。脂質體的聚集或融合狀態是已證明對疫苗生物活性有顯著影響的參數。因此,本發明的研究者對疫苗的生產過程中和批次釋放時的顆粒尺寸和多分散性指標進行了充分的控制。實施例9:蔗糖的效果在最初的測試中,在包含mtb-c菌株nctc13536片段的脂質體制劑中任選地加入以下賦形劑之一:(a)1.5%甘油和(b)5%蔗糖。隨后,對兩種制劑的相關理化特性和生物活性進行比較評估。凍干脂質體組合物重構后和根據目前的批次釋放規格參數測試后的測定結果在表5中給出。(a)多分散性指數(1)存在脂質體聚集物nd=未測定表5:凍干脂質體組合物重構后測定的三種不同制劑的規格結果本研究者意想不到地發現,5%蔗糖制劑提供了更好的生理化學結果(例如含水量或重構時間)。但是,最關鍵的事實是含蔗糖制劑與其他兩種制劑相比,顯示出脂質體聚集(顆粒尺寸,z平均)的重要降低。動態光散射分析顯示,含蔗糖脂質體的z-平均為75±20nm(多分散性指數≤0.350)。含蔗糖制劑凍干制備物的電子顯微術顯示出尺寸為40至100nm的多層和單層脂質體的混合(圖9)。鑒于5%蔗糖制劑的這種改進的參數以及觀察到的更低的含水量(≤2%),預計該制劑有改進的穩定性結果。事實正是如此。本研究者關于室溫保存3個月的以1.5%甘油配制的實驗批次的數據顯示出ppd(免疫原效力)生物活性的大幅損失。相反,在室溫保存3個月后對含5%蔗糖的制劑進行研究時,ppd活性基本不變。因此,蔗糖還提供了更好地保持生物活性的優點。實施例10:含蔗糖制劑的生物特性將表3的制劑用于生物學研究。可以通過elispot來測量結核分枝桿菌感染小鼠模型中由接種本發明最佳實施模式的疫苗(單次接種)所觸發的細胞免疫應答,結果在表6中給出。nd:未測定表6:小鼠中接種后的免疫應答在使用elispot測定應答水平時,基于脂質體制劑的疫苗的接種導致體內細胞免疫應答與感染動物的基礎值相比顯著提高。相對于基礎應答的比值為4-8倍(ppd)和8-14倍(ag85b)。基于脂質體制劑的疫苗還能夠誘導多抗原體液應答,這特別是在存在高感染傳播的情況下有保護作用(guiradoetal.,2006,microbesinfect.8,1252-1259)。特別地在無蔗糖制劑和含有蔗糖作為主要賦形劑的制劑的免疫原效力數據之間進行了比較。所得結果明確指出,在單次疫苗接種模型中,50μgfcmtb劑量的含蔗糖制劑所引發的細胞免疫應答是相同劑量無蔗糖制劑所得應答的約1.5倍。在以下兩個效力測試中都獲得了這種更高的細胞免疫應答水平:為批次釋放規格而進行的測試(單次疫苗接種模型),以及可比性研究中包括的額外測試(兩次疫苗接種的模型)。此外,在兩個效力測試中,50μgfcmtb劑量含蔗糖制劑引發的細胞免疫應答都顯示出與200μgfcmtb無蔗糖制劑相似的水平。凍干脂質體組合物重構后測量的結果在圖10a和10b中給出。含蔗糖制劑顯示出脂質體聚集顯著降低。這被認為是免疫原效力增大的原因。用50μg劑量的這種新制劑獲得的細胞免疫應答與200μg劑量無蔗糖制劑幾乎相當。本領域已知,所述細胞應答被認為是有關系的應答(northrj,jungyj(2004).annu.rev.immunol.22:599-623)。實施例11:凍干脂質體制劑的生產方法包含本發明脂質體制劑的藥物組合物的生產方法的一個實施方案示于圖11。簡言之,其包括以下步驟1至5。(1)lcs本體組分(bulkcomponent)的制備將lcs的本體大豆卵磷脂溶于乙醇(1∶1;w/w),并將膽酸鈉溶于水(1∶5;w/w)。通過過濾對溶液進行除菌。將卵磷脂鈉溶液與膽酸鈉溶液混合后,在攪拌下加入凍干的fcmtb(實施例1)。組分比為0.03∶0.2∶0.7(fcmtb∶膽酸鈉∶大豆卵磷脂;w/w/w)。(2)lcs本體的制備將水相轉移至無菌不銹鋼混合器中。以0.7∶0.3(水相∶脂質相,w/w)的比例加入(1)的包含大豆卵磷脂、膽酸鈉和fcmtb的脂質相。將各相以2200rads/s混合3分鐘以進行勻漿和脂質體形成。勻漿后,將本體lcs轉移至另一容器并使其靜置至少5分鐘。對該lcs本體的顆粒尺寸進行ipc。(3)lcs本體的稀釋,脂質體懸液的最終制備制備10%(w/w)蔗糖溶液并滅菌。以適當的比例將該蔗糖溶液與水和lcs本體混合,以獲得5%蔗糖溶液中21mglcs/ml重構的最終脂質體懸液(ls)本體。對ph、無菌度和顆粒尺寸進行測試,作為過程控制。(4)填裝在管中裝入0.4mlls(在持續攪動下)并部分密封以進行冷凍和凍干。(5)凍干、包裝和標記將管在-80℃±5℃下冷凍直至凍干開始。凍干在-45℃至25℃的溫度和0.150mbar下進行。該過程持續24小時。凍干結束時,在氮氣氛中將管完全塞住,包裹、標記并保存在5℃±3℃。實施例12:針對ltbi的輔助治療僅需要單次注射25μgofcmtb設置ii期雙盲隨機臨床試驗,以在具有潛伏期結核感染(ltbi)(tst+并且quantiferon+)的96名hiv陽性(hiv+)和hiv陰性(hiv-)受試者中對3種fcmtb劑量(5、25、50μg各自根據本發明最佳實施方式制備)和安慰劑進行評價,所述受試者在接受1個月的異煙肼治療后隨機分入n=12的組。在剛進行異煙肼化學治療后以及相隔4周后,用fcmtb(5、25、50μg各自根據本發明最佳實施方式制備)對受試者接種兩次。免疫譜:fcmtb(5、25、50μg各自根據本發明最佳實施方式制備)引發了在所有劑量下激發的鐘形的針對分泌抗原(esat-6,ag85b)和結構抗原(16kda,38kda)的多抗原應答(圖12和13)。fcmtb(5、25、50μg各自根據本發明最佳實施方式制備)還在較高劑量下引發了與預防效果相容的長期記憶應答(who測試)。意想不到的是,盡管總體免疫應答在hiv-中強于hiv+,但25μgfcmtb(5、25、50μg各自根據本發明最佳實施方式制備)單次接種在兩個人群中都引發最佳的免疫應答(圖12和13)。結論:25μg單次疫苗接種是hiv陰性和hiv陽性受試者中針對ltbi的輔助治療的最佳選擇。附圖簡述圖1:流程圖,其顯示藥物物質fcmtb的上游方法,包括該方法中涉及的材料和試劑以及合適的流程控制。圖2:流程圖,其顯示藥物物質fcmtb的下游方法,包括該方法中涉及的材料和試劑以及合適的流程控制。圖3:蛋白表征的流程。圖4:通過sds-page和考馬斯藍染色法鑒定抗原。顯示了參照抗原esat6(6kda)(7);cfp10(10kda)(6);ag85b(30kda)(1);38kda(2);hsp70(70kda)(4)和分子量標記mw(5)。圖5:蛋白表征。圖5a:蛋白質譜:15.6μgfcmtb/ml(1,2)、6.25μgfcmtb/ml(3,4)和1.56μgfcmtb/ml(5,6)終濃度的參照標準品fcmtb-52.1(1-6)的蛋白質譜,sdspage隨后是考馬斯染色。mw以kda計。圖5b:19kda條帶的鑒定,sdspage隨后是銀染。圖5c:蛋白質譜:與來自lionex的esat-6標準品并行地,通過sds-page和銀染法鑒定所示fcmtb批次中的條帶(10kda和6kda)。不同的fcmtb批次(1、2、3、9、10、11,(第9道為fcmtb-52.1批次)),不同濃度的來自lionex的esat-6標準品(4至8);圖5d:與結核分枝桿菌hsp70并行地,使用特異性抗體通過western印跡在fcmtb批次中進行結核分枝桿菌hsp70(rv0350)抗原的westernblot鑒定。不同的fcmtb批次(1、2、3、4、7、8、9),esat-6標準品(5、6);圖5e:與來自lionex的結核分枝桿菌38kda并行地,使用特異性抗體通過western印跡法在fcmtb批次中進行結核分枝桿菌38kda(rv0934)抗原的鑒定。使用odyssey系統進行熒光檢測。不同的fcmtb批次(1、2、3、6、7),38kda標準品(4、5)。圖5f:與來自lionex的結核分枝桿菌ag85b并行地,使用特異性抗體通過western印跡法在fcmtb批次中進行結核分枝桿菌ag85b(rv1886c)抗原的鑒定。使用odyssey系統進行熒光檢測。不同的fcmtb批次(1、2、3、5、6、7),ag85b標準品(4)。圖6:使用western印跡法測定的不同fcmtb批次(50μg/條帶)的所示蛋白條帶與1/8000稀釋的血清之間的相互作用,所述血清得自用本發明基于脂質體制劑之藥物疫苗組合物接種兩次的感染小鼠。圖7:脂質分析。圖7a:通過tlc法鑒定了參照菌株(h37rv(2)和nctc13536(1)和不同fcmtb批次(3-9)中的多酰基海藻糖(polyacyltrehalose(pt))、海藻糖6,6’-二分枝菌酸酯(tdm)、二酰基海藻糖(dat)以及tdm標準品(10)。圖7b:通過tlc法鑒定fcmtb批次中的海藻糖6,6’-二分枝菌酸酯(tdm)。圖(a)和(b)代表兩個獨立測定。(a)tdm標準品(11)和(12),其他道為不同的fcmtb批次。b:(1)tdm標準品(1),其他道為不同的fcmtb批次。圖7c:通過tlc法測定的fcmtb批次中的分枝菌酸i、iii和iv的圖譜。圖(a)、(b)和(c)代表3個獨立測定。(a)fcmtb批次(1-6(fcmtb-51.2標準品6))。(b)用于說明/參考,(c)批次fcmtb-47b(1)與分枝菌酸標準品(2)相比。圖7d:lam的鑒定(參照在左道,其余道為產生自本發明脂質體的樣品)。圖8:相同劑量(50μg/劑)下,重懸于注射用水(wfi)的fcmtb與用脂質體制備的fcmtb(標記為ruti疫苗,批次10a)的細胞免疫效力的比較。圖9:脂質體濃縮物(lcs)本體的冷凍破碎(電子顯微術)。圖10:a:在效力測試中用兩種制劑(一次疫苗接種)測試的每批次的細胞免疫應答。b,同a一樣,但為兩次疫苗接種。“制劑ii”:包含5%(w/w)蔗糖,根據本文件的表1。“制劑i”,同制劑ii一樣,只是不存在蔗糖。μg指μgfcmtb/劑。85b:ag85b。圖11:本發明最佳實施方式的方法的流程圖。圖12:實施例12描述的1次接種ruti25μg的免疫譜。圖13:實施例12描述的免疫原性(hiv-和hiv+)。實施方式具體而言,本發明涉及以下實施方式:實施方式1.脂質體制劑,其包含:(a)來自結核分枝桿菌復合群(mtb-c)菌株的片段,(b)脂質體形成劑,(c)1至20%(w/v)的蔗糖,優選2至12%(w/v)的蔗糖,更優選3至8%(w/v)的蔗糖,最優選4至6%(w/v)的蔗糖,其中顆粒的z-平均尺寸為120nm或更小。實施方式2.實施方式1的脂質體制劑,其中所述顆粒的z-平均尺寸為40至110nm,更優選55至95nm。實施方式3.實施方式1或2中任一種的脂質體制劑,其中所述脂質體制劑為乳劑,并且其中顆粒的z-平均尺寸優選小于40nm。實施方式4.前述實施方式中任一種的脂質體制劑,其中顆粒的多分散性指數為0.4或更小,優選0.3。實施方式5.前述實施方式中任一種的脂質體制劑,其中所述結核分枝桿菌復合群(mtb-c)菌株是有毒力的結核分枝桿菌復合群(mtb-c)菌株,優選為2010年保藏于倫敦nctc的mtb-c菌株nctc13536。實施方式6.前述實施方式中任一種的脂質體制劑,其還包含(d)表面活性物質,和/或(e)一種或更多種非離子型表面活性劑。實施方式7.前述實施方式中任一種的脂質體制劑,其中所述mtb-c細胞的片段是細胞壁片段或者包含細胞壁片段。實施方式8.實施方式6的脂質體制劑,其中(a)與(d)的比值為0.05∶1至1∶5(w/w)。實施方式9.前述實施方式中任一種的脂質體制劑,其中所述脂質體形成劑是氫化的、部分氫化的或非氫化的磷脂,優選卵磷脂,最優選大豆卵磷脂。實施方式10.實施方式6至8中任一種的脂質體制劑,其中所述表面活性物質選自膽酸鹽、脫氧膽酸鹽、膽固醇和膽固醇琥珀酸單酯。實施方式11.前述實施方式中任一種的脂質體制劑,其中所述mtb-c細胞的片段是細胞壁片段或者包含細胞壁片段。實施方式12.前述實施方式中任一種的脂質體制劑,其包含2010年保藏于倫敦nctc的mtb-c菌株nctc13536的片段。實施方式13.前述實施方式中任一種的脂質體制劑,其包含以下的至少兩項,優選三項,更優選四項,最優選全部:(i)第一多肽,其在十二烷基硫酸鈉(sds)聚丙烯酰胺凝膠電泳后測量的分子量為約70kda,其中所述第一多肽的質量指紋圖譜與結核分枝桿菌hsp70蛋白(rv0350)的質量指紋圖譜相似,(ii)第二多肽,其在十二烷基硫酸鈉(sds)聚丙烯酰胺凝膠電泳后測量的分子量為約38kda,其中所述第二多肽的質量指紋圖譜與結核分枝桿菌38kda蛋白(rv0934)的質量指紋圖譜相似,(iii)第三多肽,其在十二烷基硫酸鈉(sds)聚丙烯酰胺凝膠電泳后測量的分子量為約30kda,其中所述第三多肽的質量指紋圖譜與結核分枝桿菌ag85b蛋白(rv1866c)的質量指紋圖譜相似,和(iv)第四多肽,其在十二烷基硫酸鈉(sds)聚丙烯酰胺凝膠電泳后測量的分子量為約10kda,其中所述第四多肽的質量指紋圖譜與結核分枝桿菌cfp10蛋白(rv3874)的質量指紋圖譜相似,和(i)第五多肽,其在十二烷基硫酸鈉(sds)聚丙烯酰胺凝膠電泳后測量的分子量為約6kda,其中所述第五多肽的質量指紋圖譜與結核分枝桿菌esat-6蛋白(rv3875)的質量指紋圖譜相似。實施方式14.前述實施方式中任一種的脂質體制劑,其中存在以下結核分枝桿菌抗原的至少一種或其片段:hsp70、38kda蛋白和ag85b。實施方式15.前述實施方式中任一種的脂質體制劑,其包含一種或更多種分枝菌酸和/或糖綴合分枝菌酸酯優選海藻糖二分枝菌酸酯,和/或糖脂優選脂阿拉伯甘露聚糖。實施方式16.前述實施方式中任一種的脂質體制劑,其還包含一種或更多種非離子型表面活性劑。實施方式17.前述實施方式中任一種的脂質體制劑,其還包含一種或更多種鹽或其溶液,其中所述鹽優選為氯化鈉。實施方式18.前述實施方式中任一種的脂質體制劑,其中所述脂質體制劑是凍干的。實施方式19.懸液,其中前述實施方式中任一種的脂質體制劑重構于溶劑中,其中所述溶劑優選為含水溶劑,更優選為生理血清或包含生理血清。實施方式20.藥物組合物,其包含實施方式1至18中任一種的制劑或實施方式19的懸液,以及可藥用載體或稀釋劑,和/或可藥用佐劑。實施方式21.實施方式1至18中任一種的脂質體制劑、實施方式19的懸液或實施方式20的藥物組合物,其用于治療人或動物體的方法中。實施方式22.實施方式21的脂質體制劑、懸液或藥物組合物,其用于治療或預防結核的方法中。實施方式23.實施方式22的脂質體制劑、懸液或藥物組合物,其選自以下:a)用于在具有潛伏期結核感染的個體中預防活動性結核的方法中;b)用于結核的初級預防方法中,以防止接觸過該疾病但尚未感染的個體發生感染,或c)用于治療或預防潛伏期結核的方法中。實施方式24.實施方式21至23中任一種的脂質體制劑、懸液或藥物組合物,其用于以包含1至1000、優選3至250、更優選4至80、最優選約5、約25或約50μg/劑fcmtb的劑量施用于人體。實施方式25.實施方式21至23中任一種的脂質體制劑、懸液或藥物組合物,其用于以25pgfcmtb的單次接種劑量施用于人體。實施方式26.實施方式21至25中任一種的脂質體制劑、懸液或藥物組合物,其用于聯合治療中,所述聯合治療優選包含抗生素,更優選異煙肼和安沙霉素中的一種或更多種,其中所述安沙霉素最優選是利福霉素。實施方式27.實施方式125的脂質體制劑、懸液或藥物組合物,其用于輔助治療中。實施方式28.實施方式27的脂質體制劑、懸液或藥物組合物,其用于在輔助治療中施用于hiv陽性人受試者。實施方式29.實施方式25的脂質體制劑、懸液或藥物組合物,其用于施用于hiv陰性人受試者。當前第1頁12
相關技術
網友詢問留言
已有0條留言
- 還沒有人留言評論。精彩留言會獲得點贊!
1