一種低溫等離子體誘導熱聲成像方法與流程
本發明涉及一種低溫等離子體誘導熱聲成像方法,特別涉及一種適用于生物醫學應用的脈沖低溫等離子體誘導的高分辨率功能性成像方法。
背景技術:
醫學影像技術,尤其是功能性醫學影像技術,在健康工程和疾病的早期診斷中占有重要的地位和作用。目前臨床用于疾病診斷的成像方法如X光、CT、超聲、MRI,只能發現一定尺寸的腫塊,導致多數病人錯過了腫瘤早期發現、早期治療的最佳時機,因此研究開發早期篩查和早期診斷的方法、技術一直是國內外關注并重點研究的領域。
生物組織的“電磁(光)熱聲成像”對生物組織介電譜敏感,具有電磁(或光學)成像的高對比度和超聲成像的高分辨率的特點,成為研究熱點。其中的熱聲成像技術具備無損和功能成像的技術特點,是繼形態、結構成像之后的新一代醫學成像方法。該技術在1981年首次由T.Bowen提出并完成了生物組織熱聲成像的可行性實驗,根據熱源激勵方法不同可分為微波熱聲、光聲以及最近幾年發展起來的磁熱聲成像。
微波熱聲由于受脈寬的限制,分辨率一直處于mm量級。2010年德國慕尼黑理工大學亥姆霍茲中心Ntziachristos研究小組利用10ns脈寬,100MHz的傳輸線系統實現170μm分辨率的微波熱聲成像;2012年華南師范大學邢達教授利用超短脈寬微波源實現100μm分辨率的熱聲成像,進一步推動了熱聲成像技術向臨床的應用發展。
為提高光聲成像分辨率,研究者從激光激勵聚焦和超聲檢測聚焦兩個方面考慮,提出了聲學分辨率的光聲顯微成像(ARPAM)和光學分辨率的光聲顯微成像(ORPAM)。2012年美國佛羅里達大學Xi利用ARPAM實現了老鼠耳朵血管成像,成像分辨率4.8μm,隨后利用ORPAM實現了0.22μm的分辨率,可完成組織細胞核、黑色素體的成像。
磁熱聲成像是由新加坡南洋理工大學在2013年首次提出的。該技術與微波熱聲成像相比,激勵頻率低、探測深度深、非接觸輻射低,是一種具有廣泛應用前景的功能性成像技術。新方法一經提出就受到國內外學者的廣泛關注,法國的里昂大學、天津生物醫學工程研究所、南京師范大學、中國科學院電工研究所、中國石油大學、青島大學等從不同角度對磁熱聲成像進行研究,2016年中科院電工研究所利用注入式磁聲方式獲得離體豬肉組織的電磁熱吸收圖像。
另一方面,隨著科學技術的不斷發展,低溫等離子體作為一種生物醫學技術,自從1968年第一次報道用氬離子體殺菌后,低溫等離子體在醫療器械殺菌、凝血、齲齒治療、治療腫瘤等多個領域得到應用。
在脈沖低溫等離子體射流中,局部電離的惰性氣體離子在單脈沖的作用下形成“單發等離子體子彈”,在空間上產生局部電荷分離、激發空間電場。空間電場在射流中向前傳播,通過等離子體能夠耦合到被測組織表面的一個微小區域中,實現電磁聚焦。
結合熱聲成像的特點和低溫等離子體射流的優勢,本發明提出一種基于納秒脈沖低溫等離子體誘導超聲的功能性微成像技術。該技術利用納秒脈沖低溫等離子體微射流技術與高頻聚焦超聲陣列相結合,通過電磁聚焦和超聲聚焦有望實現微米量級的高分辨率生物組織成像,新的成像方法具有高對比度、高穿透性、高分辨率的優勢,在國際上首次提出將脈沖低溫等離子射流作為一種與組織直接接觸的等離子態激勵方式,能夠使脈沖電磁能量有效地耦合到微小的局部組織中,避免了常規固態電極振動噪聲的干擾,是一種創新性的熱聲信號激勵方式。由于生物電阻抗的變化通常出現在組織細胞癌變初期,先于密度和彈性的變化,因此基于電阻抗的熱聲成像方法具備癌癥早期診斷的獨特優勢;同時該方法將電阻抗功能性成像與超聲高分辨率成像的優勢相結合,大大提高了電阻抗成像的精確度,是當前生物醫學成像研究的熱點。低溫等離子體作用于生物組織時能量高,斑束小,劑量可控,操作方便,不會產生熱損傷和輻射損傷;由其誘導的熱聲成像方法還能在常規低溫等離子體射流應用(如:抑制腫瘤細胞、殺菌消毒、止血等)的基礎上實現高分辨率的電阻抗微成像,對常規等離子體治療效果進行實時評估,具備輔助治療和動態監測的獨特優勢,所形成的儀器設備將在癌癥、心臟疾病等重大疾病的早期診斷研究上有突破性的應用,為我國人口與健康領域提供全新而可靠的研究和臨床診斷手段。
技術實現要素:
本發明專利將納秒脈沖激勵的“低溫等離子體射流”作用于生物組織,使生物組織吸收等離子體射流能量產生熱效應,引起瞬態的熱膨脹,激發熱彈性的高頻超聲信號。根據正常組織與病變組織的電阻抗和對等離子體射流光譜吸收系數不同,進而對等離子體射流能量的吸收也不同,使該熱聲信號攜帶了組織內部的電阻抗和對射流光譜吸收強度的信息;利用聲源重建算法,能在微米尺度上獲得與電阻抗和光譜吸收系數相關的熱聲源圖像,為疾病的早期診斷提供高分辨率和高對比度的生物組織醫學影像。
低溫等離子體誘導熱聲成像方法,其特征在于利用高壓脈沖激勵低溫等離子體射流,并作用于待測物質表面,在射流作用點附近引起瞬態的熱效應,激發熱彈性的超聲信號。
由低溫等離子體射流誘導的超聲信號是與下述兩個物理量有關:被測對象對射流發射光譜的吸收強度和生物組織的電阻抗。因此,激發的超聲信號攜帶了生物組織對射流光譜的吸收系數和電阻抗信息,適用于針對光吸收系數與電阻抗特性的多參數融合成像。
通過環繞在待測物體周圍的超聲換能器陣列測量超聲信號,采用時間反轉法或濾波反投影算法處理陣列超聲數據,可實現分布熱聲源的圖像重建;該分布熱聲源圖像在低溫等離子體射流激勵模式下,能夠獲得電阻抗和射流光譜吸收系數相結合的多種參數融合圖像。
為了產生生物安全的低溫等離子體射流,降低作用于生物組織時的熱損傷和電磁輻射,低溫等離子體射流裝置采用雙石英管(電介質)阻擋放電形式,以氦氣或氬氣為工作氣體,并采用納秒級高壓脈沖,以較低的重復頻率循環激勵;在超聲信號測量中,測量過程需要在低溫等離子體射流激勵脈沖的同步下進行,每次脈沖激勵過后,延遲一定的超聲傳輸時間,等超聲信號到達超聲探頭時記錄數據,然后再開啟下一次脈沖激勵和檢測過程,以此循環測量。
為了獲取組織成像區域的所有超聲信號,采用激勵和檢測的雙聚焦掃描模式:脈沖激勵的低溫等離子體射流在生物組織表面形成一個直徑為微米量級的接觸斑束,實現熱激勵的點集中模式;超聲檢測方面,通過超聲相控陣實現分布超聲源的聚焦檢測;通過掃描移動射流斑束的位置改變激勵點,通過改變陣列超聲探頭的聚焦點,跟蹤射流激勵點,獲取所有掃描點附近激發的超聲信號。
附圖說明
圖1納秒脈沖激勵低溫等離子體誘導熱聲成像原理示意圖。
圖中:1高壓納秒脈沖發生器,2相控陣超聲成像設備,3同步脈沖傳輸光纖,4內部高壓脈沖電極,5外部接地電極,6內、外石英玻璃管,7氦氣(氬氣)源,8低溫等離子體射流發生裝置,9氣體和氣路,10介質阻擋放電腔,11低溫等離子體射流,12射流激勵點,13成像目標體,14超聲換能器,15超聲聚焦點,16探頭與成像設備連接線,17病變區域。
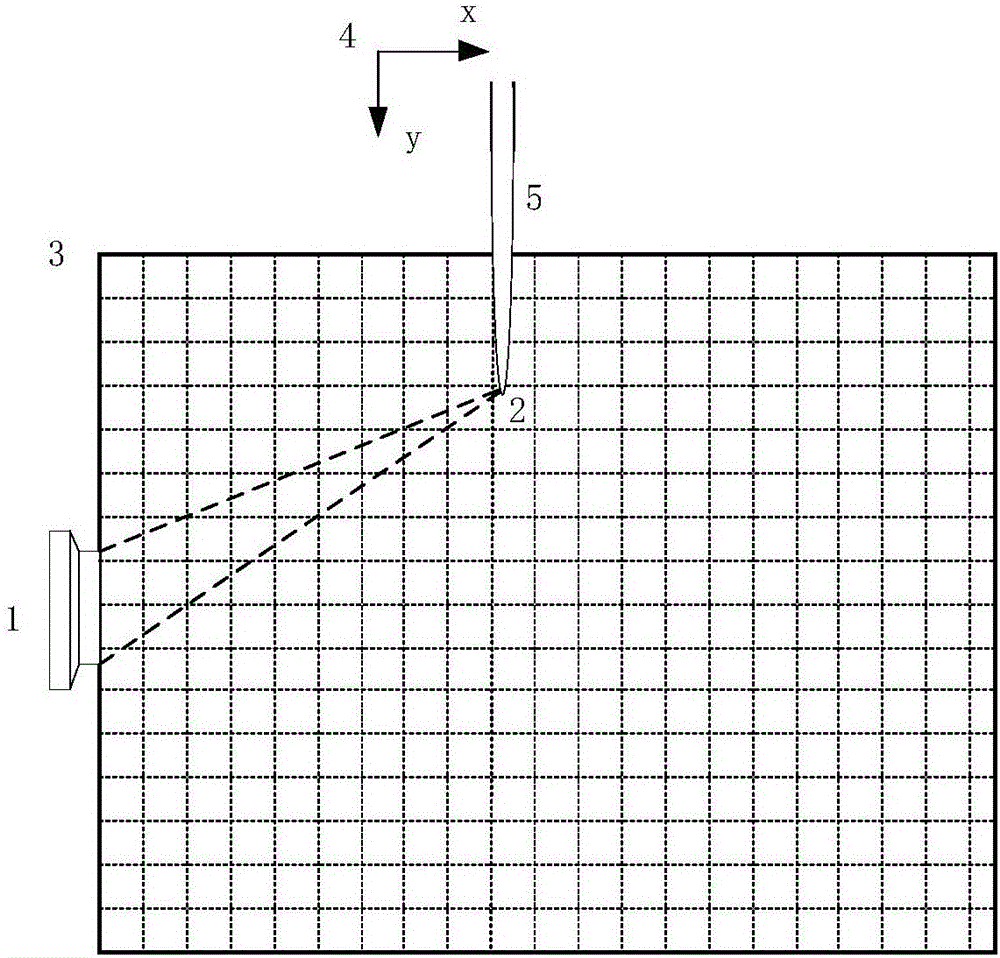
圖2低溫等離子體激勵掃描與相控陣聚焦原理示意圖。
圖中:1超聲陣列探頭,2等離子體掃描點和相控陣聚焦點,3成像區域,4運動掃描坐標,5低溫等離子體射流。
圖3激勵和檢測同步時序圖。
圖中:1納秒高壓脈沖同步信號,2 1#陣元采集脈沖序列,2 2#陣元采集脈沖序列,128#陣元采集脈沖序列,5超聲渡越時間,6有效采集數據區,7第一個掃描點時序,8超聲數據采集脈沖,9數據預處理、濾波、存儲時間,10第j個掃描點時序。
具體實施方式
下面結合附圖和具體實施方式對本發明做進一步說明。
在脈沖低溫等離子體射流中,局部電離的惰性氣體離子在單脈沖的作用下形成“單發等離子體子彈”,在空間上產生局部電荷分離、激發空間電場。空間電場在射流中向前傳播,通過等離子體通道耦合到被測介質表面的一個微小區域中,將電磁能量誘導至目標體內部,引發電-熱-聲效應。
另一方面,由于低溫等離子體射流的氣體擊穿過程主要以光電離為主,射流內部產生較強的光子,光波頻率由工作氣體和環境氣體決定,主要處于紫外波段。這部分光子射入目標體內部,同樣引發光聲效應。
不論是光聲效應還是電-熱-聲效應都可在目標體內部產生瞬態的熱激勵,引發瞬態熱膨脹,激發超聲信號。其中涉及了多種物理場的耦合過程:電磁場與熱力學場的耦合、光波與熱力學場的耦合、熱力學場與超聲波的耦合等。由于等離子射流本身的聲阻抗(類似于氣體聲阻抗)與被測目標體的聲阻抗相差很大,所以等離子體射流內部的聲場很難傳入目標體中,聲阻抗的差異對等離子體中的噪聲起到了屏蔽作用。
根據上述原理,本發明在“脈沖低溫等離子體射流”激勵作用下,利用目標體的電特性與瞬態熱膨脹、光吸收與瞬態熱膨脹之間的雙重耦合效應激發超聲信號,是本發明的核心內容之一。利用超聲相控陣探頭探測這個超聲信號,可以實現對目標體電阻抗與光吸收系數的混合探測與成像。
如附圖1所示,該方法涉及的成像裝置由1高壓納秒脈沖發生器、2相控陣超聲成像設備和8低溫等離子體射流發生裝置三部分組成。
高壓納秒脈沖發生裝置能夠產生脈寬在200納秒,電壓在30KV以內可調,重復頻率在10KHz以內可調的高壓脈沖,并通過高壓傳輸線加載到放電機構的兩個電極上。
低溫等離子體射流發生裝置由放電機構和7氦氣(或氬氣)源兩部分組成。整個放電機構由直徑不等的內、外兩個6石英玻璃管嵌套而成,內石英玻璃管直徑小、最下端封口,內部放置一個4高壓電極。10外部石英玻璃管直徑大,包裹在內石英玻璃管外,上、下兩端均開口,在上端開口處的內、外兩個石英玻璃管中間通入9工作氣體,通過下端小直徑開口的噴嘴產生11低溫等離子體射流。在外石英玻璃管的噴嘴附近安放5外部接地電極,內外電極之間形成兩層石英玻璃管和工作氣體構成的三層電解質。其中工作氣體處于兩個石英玻璃管中間,在加入高壓脈沖后產生介質阻擋放電。由于兩個玻璃管的阻擋作用,在高壓放電的基礎上又限制了放電電流,通過調節合理的尺寸參數和電源參數,可產生能與人體安全接觸的低溫等離子體射流,其溫度和電流密度均不會對人體造成傷害。
高壓納秒脈沖激勵低溫等離子體射流,作用于13成像目標體產生超聲信號。這個超聲信號也需要在同一個3同步脈沖的同步下進行采集。為了獲得不同射流激勵點處產生的超聲信號,本發明采用14陣列超聲探頭,根據掃描點的位置編程配置相控陣的聚焦點,實現12等離子體激勵點和15相控陣聚焦點的位置與時序的嚴格同步。
激勵掃描與相控陣聚焦原理示意圖如附圖2所示,1相控陣超聲陣列探頭與5低溫等離子體射流聚焦于同一個2聚焦點。這個聚焦點在成像區域內沿著4掃描運動坐標同步移動掃描,對每個掃描點2都獲取一組陣列超聲數據,得到2點的聲源強度。最終從相控陣超聲成像設備獲得的測量數據中提取聚焦點處的聲場強度,采用被動式相控陣聲源重建算法構建聲源強度的分布圖像,也就是熱聲源圖像。這個熱聲源圖像融合了目標體中每一點對低溫等離子體吸收強度信息和電阻抗信息,能夠區分生物組織的早期病變區域,并且具有微米量級分辨率。
激勵和檢測同步時序圖如附圖3所示。在納秒高壓脈沖同步信號的同步下,經歷固定的超聲渡越時間,啟動陣列探頭的數據采集。多路陣列探頭同步采集超聲信號,當距離激勵點最遠的超聲探頭陣元數據采集完成后,結束第一個激勵點的數據采集,進行簡單的數據預處理后,存儲待用。以同樣的步驟掃描采集成像區域內每個點的超聲數據,獲取所有掃描點的陣列超聲信號。
本發明中采用的被動式相控陣成像算法,就是對于每個掃描點j的陣列超聲數據,首先計算出單個超聲探頭陣元i距離掃描點的距離,利用目標體中的聲速,獲得每個振源到激勵點之間的超聲傳輸時間ti,j。將各個超聲探頭陣元采集的數據中與這個超聲傳輸時間相對應的檢測值疊加,獲得該激勵點的聲源強度。
- 還沒有人留言評論。精彩留言會獲得點贊!