生產純鎂金屬和各種副產物的濕法冶金方法與流程
本公開涉及從含鎂礦石生產鎂金屬和各種副產物。
背景技術:
鎂是地殼中含量第八豐富的元素。該輕質金屬被用于許多應用,和汽車工業的排放標準的最近變化產生了需求的恢復。
超過75%的鎂的初級產物實際上通過熱過程制造并且存在主要的環境問題和高能消耗。還使用產品的電解法(electrolytic route),并且通常通過電解來自海水或死海的鹽來制造。來自死海的鹽通常包含少于3.5%的鎂。
與鹽的使用相關的一個困難是將氯化鎂與剩余的進料分離以便產生例如引入電解池的純的鎂鹽。
在過去的幾十年中,開采蛇紋石石棉纖維的重要沉積物產生了大量的尾礦。該礦石由多于90%的蛇紋石(也稱為羥基硅酸鎂鐵)組成,主要為利蛇紋石Mg3Si2O5(OH)4,與少量的葉蛇紋石(Mg,Fe)3Si2O5(OH)4、水鎂石Mg(OH)2、磁鐵礦Fe3O4、鐵鎳礦(awarite)Ni8Fe3,痕量的鉻鐵礦Fe(Cr,Fe)2O4和富鉻尖晶石(Cr,Fe,Al,Mg)3O4。
石棉尾礦包含23-27%之間的鎂并且可以被提取以生產純鎂。它們還包含大約38%SiO2,1-6%Fe,0.2-0.3%Al和0.1-0.2%Ni。還存在痕量的其他元素。
已經針對含鎂礦石開發了幾種濕法冶金和電解方法,但是由于困難的操作條件,此時那些方法中沒有一種在生產中。一般而言,所得氯化鎂仍包含大量的雜質,其在被認為鎂電解生產的進給材料之前必須被去除。那些雜質可導致差的電池性能并且產生低的電流效率。而且,那些方法僅具有生產氯化鎂或金屬鎂的目的,損害二次產品的商業價值。
過去,已經提出了從硅質鎂礦物生產氯化鎂溶液的方法(美國專利5,091,161)。該方法涉及在高于50℃的溫度下用鹽酸溶液瀝濾材料。PH維持在低于1.5以防止二氧化硅凝膠的形成。瀝濾可以以以連續的方式進行。利用氧化鎂將瀝濾溶液的PH增加至4.0-4.5以使大量的雜質沉淀,然后固/液分離以獲得純凈的氯化鎂溶液(liquor),。在pH 6.0-7.0下用苛性鈉和氯氣純化的第二步驟使剩余的鐵和錳氧化和沉淀。通過離子交換柱進行純化的最后步驟以去除痕量的雜質比如鎳和硼。
以相同的方式,WO2000/017408提出了從包含鎂的材料生產氯化鎂溶液的方法,但是具有雜質分離的單個步驟。
這些方法表示超出先前已知的那些的有效步驟,但是仍具有一些缺點。例如,用于鐵雜質去除的苛性氧化鎂的使用是昂貴的并且施加重的經濟負擔。而且,這些方法不允許回收二氧化硅用于未來銷售,因為它被鐵和包括鎳在內的其他雜質污染。盡管這些方法包含純化階段,但是它們不允許消除一些雜質,比如硫酸鹽。已知電解池中的硫酸鹽引入通過增加電壓導致電流效率的下降。
為了從氯化鎂鹽水中去除鐵雜質,提出了水解方法,比如在WO 2014/029031和WO2009/153321中所描述的。簡言之,鹽水首先被濃縮和氧化,在此氯化亞鐵轉變為鐵和氧化物形式。隨后氯化鐵被水解,產生赤鐵礦和氯化氫。下述反應描述了氧化和水解步驟。
6FeCl2+3/2O2→4FeCl3+Fe2O3
FeCl3+3/2H2O→3HCl+1/2Fe2O3
盡管使用這些方法可以實現鹽酸和赤鐵礦的回收,但是其應用傾向被限于僅包含氯化亞鐵/氯化鐵的溶液。當其他氯化物,例如氯化鎂大量的存在于溶液中時,氯化物離子和質子的活性傾向于太高而不能實現正常運行。這種方法將在實驗室中以批量模式而非連續模式運作,因為氯化鎂濃度相對于鐵的濃度增加,接著溶液冷凍并且變為固體。而且,水解方法在壓力和升高的溫度,大約200℃下進行。它需要昂貴的裝置并且還消耗大量的能量。而且,包含一些鎂的鹽水的水解導致鐵的差的純化效率。觀察到約6%至11%的鎂損失,同時僅去除62至70%的鐵。因此,水解不是選擇性方法并且需要進一步的純化步驟。所以,該方法對于大體積不能是經濟上可行的。
為了濃縮氯化鎂鹽水以獲得水合鹽,當前使用蒸發。但是,該方法需要大量的能量和從而導致重大成本。由于該原因,蒸發的使用必須被限制。
以相同的方式,通過MgCl2的分解電壓,通過電解方法鎂的工廠電力消耗成為主要的電解步驟。因此,該消耗對生產成本和利潤率具有重大影響。
通過熔融鹽中鎂的常規電解方法,通過與排出的Cl2反應碳陽極傾向于分解以形成有機氯化合物,其具有負面環境影響。陽極的使用壽命也下降。
相應地,因此仍存在提供具有從含鎂礦石比如石棉尾礦生產鎂金屬的改進的全球方法和通過產生有價值的副產物改善總體經濟的需要,其限制化學堿的購買、降低能量消耗和制約有機氯排放。
技術實現要素:
現在根據本發明提供了從含鎂礦石生產鎂金屬的方法,包括以下步驟:(a)用HCl瀝濾含鎂礦石,獲得包括氯化鎂的漿料;(b)過濾漿料以獲得氯化鎂溶液和二氧化硅副產物;(c)通過添加中和劑和氧化劑使pH增加純化氯化鎂溶液,產生氯化鎂溶液;(d)從氯化鎂溶液分離鐵殘渣;(e)通過添加堿使pH二次增加來包含在氯化鎂溶液中的鎳復原,并且通過過濾回收富鎳部分;(f)添加氧化劑,并且通過添加堿使氯化鎂溶液的pH第三次增加,并沉淀剩余的金屬雜質;(g)添加中性鹽至所述氯化鎂溶液,從所述氯化鎂溶液沉淀硫酸鹽離子,并且從所述氯化鎂溶液分離金屬雜質和硫酸鹽,產生純鎂鹽水;(h)從鎂鹽水蒸發水和通過結晶使用干燥氣態氯化氫回收MgCl2·6H2O;(i)使MgCl2·6H2O脫水以獲得無水氯化鎂;和(j)在包含陽極和陰極的電解池的進料中電解無水氯化鎂,其中鎂金屬被回收。
在實施方式中,含鎂礦石是蛇紋石。
在補充的實施方式中,蛇紋石是磁性蛇紋石。
在另一種實施方式中,磁性蛇紋石是非活化和/或活化硅酸鎂。
在進一步的實施方式中,中和劑是活化和非活化蛇紋石的至少一種。
在另一種實施方式中,活化硅酸鎂通過將蛇紋石研磨至250μm或更小,使研磨的蛇紋石通過磁性分離器和煅燒蛇紋石的非磁性部分獲得。
在進一步的實施方式中,該方法進一步包括在瀝濾步驟(a)之前研磨含鎂礦石的初始步驟。
在另外實施方式中,過濾漿料的步驟(b)是固/液分離。
在另一種實施方式中,固/液分離在壓濾機或壓濾機中進行。
在進一步的實施方式中,在步驟(c)中pH在3和4之間增加。
在另一種實施方式中,非磁性蛇紋石通過煅燒被活化。
在另一種實施方式中,氧化劑是氯氣、氯酸鈉、氯酸鉀、亞氯酸鈉、過氧化氫、高錳酸鉀、雙氧、空氣或其混合物。
在進一步的實施方式中,方法進一步包括傾析氯化鎂溶液以去除鐵殘渣的步驟。
在實施方式中,通過傾析和離心的至少一種將鐵殘渣從氯化鎂溶液去除。
在另一種實施方式中,堿是氧化鎂、氫氧化鈉、氫氧化鉀或其混合物。
在另一種實施方式中,富鎳部分通過沉淀被回收。
在另一種實施方式中,其中富鎳部分在螯合樹脂體系上被捕獲。
在實施方式中,螯合樹脂體系是DOWEXTM M4195螯合樹脂。
在實施方式中,中性鹽是氯化鋇。
在進一步的實施方式中,在步驟(f)和(g)之后金屬雜質和硫酸鹽通過固/液分離與所述鎂鹽水分離。
在另一種實施方式中,脫水步驟(i)首先在流化床干燥器中進行。
在另一種實施方式中,通過噴霧加熱至高達約450℃的干燥氯化氫氣體,含水氯化鎂(MgCl2·2H2O)在流化床干燥器中被進一步二次脫水。
在另一種實施方式中,電解池包括熔融鹽電解質。
在進一步的實施方式中,在步驟(j)中和/或之后氯化氫被進一步回收。
在另一種實施方式中,回收的氯化氫被重新分配至步驟(a)、(h)或(i)。
在另一種實施方式中,電解池是單極或多極電池。
在另一種實施方式中,陽極是多孔陽極。
在另一種實施方式中,氫氣沿著非多孔管或導管被進給至多孔陽極。
在另一種實施方式中,電解池被進給氫氣。
在進一步的實施方式中,在步驟j)之后氯化氫被進一步回收。
在另一種實施方式中,脫水裝置使從步驟(j)復原的氣態HCl脫水,產生被循環回至中步驟(a)、(h)或(i)的干燥氣態氯化氫。
附圖說明
現參考附圖。
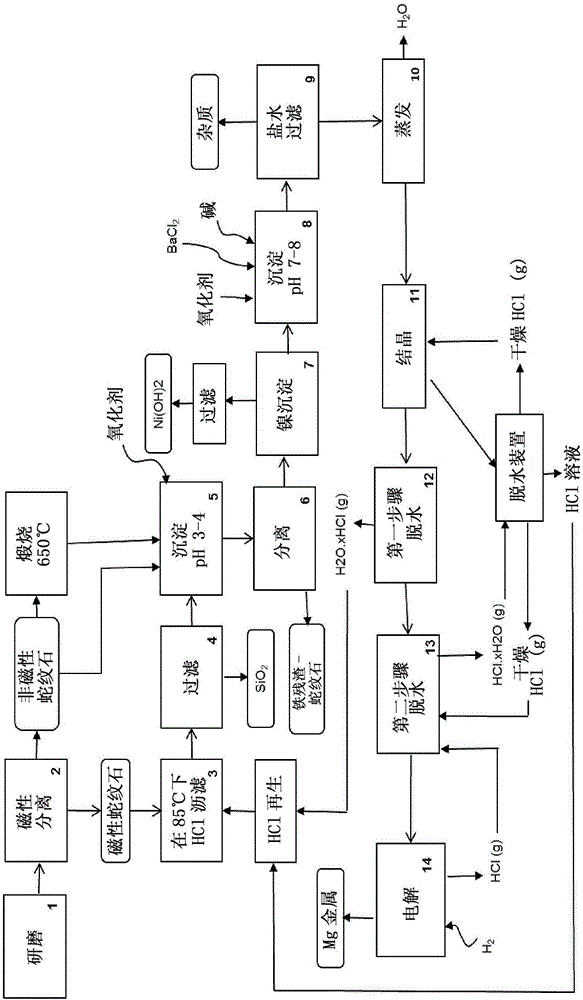
圖1圖解了根據一種實施方式的用于生產鎂金屬的方法的方框圖。
圖2圖解了蛇紋石的添加對溶液pH的影響。
圖3圖解了MgCl2溶解為HCl濃度的函數。
具體實施方式
提供了從含鎂礦石生產鎂金屬的方法。
在實施方式中,含鎂礦石是蛇紋石。
本文所述的方法包括礦物制備和分類,隨后用稀鹽酸瀝濾。過濾未瀝濾部分,并且用非活化和活化蛇紋石通過化學沉淀純化剩余的溶液以去除鐵和其他雜質。去除未溶解部分,比如漿料中的鐵-蛇紋石。鎳也通過沉淀被回收。通過沉淀,氯化鎂溶液的最終中和和純化步驟使得消除任何痕量的剩余雜質。溶液中的氯化鎂在酸性介質中結晶。MgCl2.6H2O被脫水,并且無水氯化鎂的后續電解產生純的鎂金屬和鹽酸。
本公開內容的方法對于處理各種硅酸鎂礦石可以是有效的,比如例如,并且不限于可用作起始材料的利蛇紋石、橄欖石、滑石、海泡石和蛇紋石或其混合物。
本文所述的方法使得從在加工含鎂礦石之后獲得的尾礦——比如石棉礦尾礦——提取和生產鎂金屬和各種副產物。
由圖1可見,并且根據一種實施方式,該方法包括調整起始材料的第一步驟。
制備(步驟1)和磁性分離(步驟2)
與工廠相鄰,一堆蛇紋石被裝載至卡車和傳送至碎石機,用于機械調整。
尾礦并且尤其是石棉尾礦可以被壓碎(研磨,步驟1)以便在下述步驟期間有所幫助。開采的尾礦被減小以通過250μm的篩。在低強度并且可能在高強度下通過磁性分離回收壓碎蛇紋石的磁性部分(步驟2),用于鎳回收的更好產率。在1 200和17000高斯通量密度下初始材料上兩個相繼分離的磁性重量部分的百分數大約為40%。該階段允許濃縮鎳,同時保持該部分中大(strong)的鎂百分數。
蛇紋石尾礦是堿性硅酸鎂材料并且包含可變量的水鎂石。由于這些原因,它被認為是中和劑。鎂在鹽酸溶液比如瀝出液中的溶解在小于1的pH下是相對有效的,但是在高pH值下較低。在該情況下,需要相當可觀的量的材料以增加pH。
用于沉淀的蛇紋石也通過酸性溶解經歷瀝濾,但是隨著pH逐漸增加,該溶解是不太有效的。本文提供的部分的初次磁性分離優化了從整個礦石的鎳提取并且對整體過程具有積極地經濟影響。
在補充的實施方式中,蛇紋石是磁性蛇紋石。
在另一種實施方式中,磁性蛇紋石是非活化和活化硅酸鎂。
蛇紋石的煅燒影響鎂的溶解行為并且基于使用的材料允許獲得較好的產率。在煅燒期間,水被釋放,產生無序材料。在575和700℃之間,蛇紋石在活性氧化鎂和二氧化硅中破碎。根據煅燒時間和材料的顆粒尺寸,活化度不同。蛇紋石作為中和劑的使用使得鹽水中富集鎂和增加鎂金屬的產品收率。
從磁性分離方法,剩余的非磁性部分被用于煅燒和更優選地為通過106μm的篩的細粒。活化蛇紋石作為中和劑被引入步驟5中,如本文以下解釋。下表是蛇紋石尾礦的典型分析。
表1
蛇紋石的基本組分,非磁性和磁性部分
ND:未測定
來源:SGS報告
瀝濾(步驟3)
在給定的時間段期間磁性部分在鹽酸溶液中被瀝濾,其使得鎂和其他元素比如鐵和鎳溶解。在瀝濾之后,二氧化硅仍保持完全未溶解。
瀝濾在60至125℃之間的溫度下,例如在80℃下進行。由于反應混合物中的高鹽含量,這些條件是可能的,防止水性溶液沸騰。瀝濾反應將大部分鎂、鐵、鋁、鉀、鈣、鎳和錳轉變至水溶性氯化物化合物。材料的重要部分對于HCl消化是惰性的,并且在反應混合物中仍是固體。
過濾和純化(步驟4和5)
然后漿料通過適當的過濾裝置,比如帶式過濾機或壓濾機經歷固/液分離(步驟4)以復原特征在于非常大的表面積的無定形的二氧化硅(SiO2)。顯示該二氧化硅具有良好的純度并且潛在地具有經濟意義。
隨后,氯化鎂溶液然后通過中和經歷純化步驟(步驟5)以去除溶解的鐵和在目標pH值下可得到沉淀的其他氯化物雜質。為了沉淀大量的雜質,通過添加非磁性蛇紋石(非活化和活化蛇紋石)或能夠中和的其他硅酸鎂礦物,pH增加直至3-4。堿含量使鹽水的酸度中和,并且將污染物轉化為不溶解的形式。由于它在位點上是可用的,蛇紋石尾礦比如非磁性部分的使用構成優于先前提出的方法的經濟優勢,并且提供化學添加和運輸的節省。而且,用于中和的非活化和活化蛇紋石的組合允許限制待煅燒的材料的數量。與水解相比,通過沉淀純化在簡單的操作條件下是有成本效益的方法。因此,中和劑比如活化和/或活化非活化蛇紋石。
待添加的蛇紋石的重量取決于瀝出液中游離鹽酸的量和在目標pH下可沉淀的雜質的量。在中和步驟期間,溫度維持在大約80℃以利于蛇紋石的溶解。因此鹽水中的鎂濃度增加,并且鐵含量首先溶解和然后沉淀。
添加氧化劑——比如氯氣、氯酸鈉或氯酸鉀、亞氯酸鈉、過氧化氫、高錳酸鉀、雙氧、空氣、或其混合物——以將二價鐵轉化至三價鐵。該轉化允許在低pH下消除所有的鐵,并且避免污染在與Fe2+相同的pH范圍內沉淀的鎳。
分離(步驟6)
然后通過傾析或離心將沉淀的鐵和其他雜質(鐵-蛇紋石剩余物)以及未溶解的蛇紋石部分與第二漿料分離。
鎳回收(步驟7)
在純化和分離步驟之后,通過用堿——比如氧化鎂、氫氧化鈉、氫氧化鉀或其混合物——使pH增加直至pH 6-7,氯化物溶液中的鎳也可以沉淀為氫氧化物。在80℃下進行鎳沉淀步驟。然后通過過濾回收金屬。
可選地,氯化鎂溶液可通過一組包括螯合樹脂體系的離子交換樹脂床以專門捕獲鎳。例如,DOWEXTM M4195樹脂可用于從酸性鹽水溶液回收鎳。在美國專利號5,571,308中,描述了使用選擇性樹脂從瀝濾液去除鎳。此外,當洗脫鎳時通過將其與無機酸接觸,吸收的元素從離子交換樹脂回收。
氧化鎳(NiO)或鎳(Ni)通過鎳溶液的高溫水解或電解沉積可以獲得。
在中性pH下的純化(步驟8)
通過添加堿,比如例如氫氧化鈉使鎂溶液的PH增加直到7-8,以通過沉淀剩余的金屬雜質消除。溶液的溫度維持在大約80℃。而且,添加氧化劑以將二價錳轉化為四價錳(比如高錳酸鉀作為例子)。在該pH下,獲得Mn2+的最佳氧化動力學。對于Mn2+種類,該步驟允許在中性pH而不是較高pH——比如pH 11——下消除錳。
鎂鹽水包含硫酸鹽離子,并且消除它們是優選的以增加氯化鎂電解的性能。
氯化鋇被用作中性鹽,其在水性溶液中具有良好的溶解度。它與硫酸鹽反應以形成白色沉淀。
BaCl2(aq)+SO42-(aq)→BaSO4(s)+2Cl-(aq)
過濾(步驟9)
通過固/液分離,比如過濾從溶液消除沉淀的金屬雜質和硫酸鋇以獲得相對純的鎂鹽水。CaCl2、KCl和NaCl不被認為是雜質,因為它們是在電解池中使用的電解質的成分。
蒸發和結晶(步驟10和11)
蒸發來自過濾步驟的溶液直到氯化鎂濃度達到飽和。已知在100℃下水中MgCl2的溶解度為727g/L。介質中少量的其他鹽,比如Ca、K和Na的存在不會顯著地影響溶解度。該濃縮溶液在結晶器(cristallizer)中被轉移以進一步添加干燥的氣態氯化氫,在該結晶器中氯化鎂被沉淀。
在濃縮的HCl溶液中,溶解度通過常見的離子效應鹽減小。
結晶在本領域已知的結晶器中進行,并且HCl通過冷卻的液體噴霧或起泡(也稱為氣沖洗的步驟)以利于其吸收。為了氯化鎂回收的最大產率,將HCl引入溶液直到濃度達到34-37%。作為常規的方法,通過避免蒸發所有的水,該技術允許節省能量。通過連續過濾將鹽水中六水合物形式的鹽分離。
具有低鎂含量的飽和酸性溶液被進一步被用于使來自MgCl2.2H2O的脫水步驟的氣態HCl脫水,如下一部分所解釋。在包括冷凝器的脫水裝置中,含水HCl通過與低溫溶液接觸被干燥,該低溫溶液充當脫水劑。氫氣在幾乎飽和的溶液中的溶解度較低,從而氣體傾向于揮發和溶液富集在水中。一部分干燥HCl返回至結晶器,并且其他使新到來的MgCl2.2H2O脫水。剩余的HCl溶液與來自氯化鎂的第一脫水步驟的酸性水蒸氣結合,并且該混合物被引導至瀝濾步驟。
脫水(步驟12和13)
水合物氯化鎂然后經歷脫水過程以產生部分脫水產品(MgCl2.2H2O)。
MgCl2*6H2O→MgCl2*4H2O+2H2O(g) T=117℃
MgCl2*4H2O→MgCl2*2H2O+2H2O(g) T=185℃
通過使用間接的氣體加熱器進行該步驟,其也用來使干燥器中的床流體化。在兩個或三個階段中進行氯化鎂風干,并且選擇溫度以使干燥優化和氧化最小化。
為了去除最后的水分子(步驟13),鹽被二次送入流體床中,在該流化床中約450℃的干燥氯化氫氣體被噴霧。可選地,在HCl氣氛下通過使用回轉窯或噴霧干燥器可以干燥氯化鎂水合物。
利用加熱的氣態HCl進行該階段以防止水解和獲得干燥的含有大約0.1%量的氧化鎂的氯化鎂。在高溫下有空氣存在的情況下,氧化鎂部分轉化為非期望的產品,比如MgOHCl。氣態HCl的使用將根本上降低水解反應,從而降低產品中氧化鎂的濃度。另外,利用HCl進行水解的對峙反應,其也降低氧化鎂的濃度。
MgO+HCl(g)→MgOHCl(s)
MgOHCl+HCl(g)→MgCl2(s)+H2O(g)
這樣做的原因是避免消極結果。如果氧化鎂存在于MgCl2中,它將稍后在電解池中被濃縮為淤渣并且將與石墨陽極反應,并且消極地影響該過程的能量效率。而且,其在鎂金屬中不轉化,在該過程期間將失去進給材料的比例。
釋放的水合HCl氣體然后通過與步驟11中產生的飽和鹽酸溶液接觸脫水,該鹽酸溶液還包含低百分數的MgCl2。該鹽的存在增加了HCl的揮發性。在飽和溶液中,氫氣的溶解度差。氣體傾向于揮發和溶液富集在水中。
電解(14)
然后通過氯化鎂的進一步電解獲得鎂金屬(步驟14)。
本文包含的是在具有陽極和陰極的電解池中由氯化鎂電解生產鎂的方法,如在WO 2014/124539中所描述,其內容通過引用并入本文。氯化鎂被進給至電解池。
因此,通過包括以下步驟的電解生產可以獲得純的鎂金屬:在具有陰極和陽極的電解池中的熔融鹽電解質中電解由上文描述的步驟獲得的氯化鎂,在陰極形成鎂金屬,進給氫氣至陽極并且使氯化物離子在陽極與氫氣反應以形成氯化氫,從電池回收鎂金屬,并且從電池回收氯化氫。
本文還包含已知的電解池的使用,其中不進給氫氣。此外,本文還包含其中僅鎂金屬被回收的電解步驟,并且如果期望氯化氫可以作為單獨的步驟被產生,或甚至不產生。
電解池具有單級或多級類型。電解質組合物使得產生的鎂金屬形成漂浮在電解槽頂部的輕相。陽極可以是高表面積陽極,比如例如多孔陽極,在該情況中比如通過擴散氫氣滲透陽極的孔,或包含氯化鎂的熔融電解質滲透陽極的孔,以提供氫氣和氯化物離子之間的接觸。電解陽極的新設計允許氫注射至槽中。氫氣可以沿著非多孔管或導管被進給至多孔陽極。如果該管或導管與槽接觸,它不應該具有起電解陽極作用的材料。
可選地,可以采用具有允許遞送氫至陽極處的電解槽的結構的任何陽極,比如例如但不限于具有用于與氫氣來源連通的鉆孔通道的陽極。適當的陽極可以是石墨、碳化硅或氮化硅。
然后氫氣將與電極表面——氫氣在此產生——上的天然氯原子反應。該機制將在電極表面直接產生干燥的鹽酸氣體直接并且增加電池效率。已知氫擴散陽極在氫燃料電池、金屬/空氣電池組等中被用于氫的電化學氧化和/或氧的電化學還原。通過在界面處提供還原H2氣體,氫擴散陽極的使用提供了保護碳免于被氯氧化的方式。
在常規的鎂電解期間,根據方程1,MgCl2在陰極處分解為液態鎂和在陽極處分解為氣態氯。在該情況下,反應的理論電壓是2.50V。
MgCl2→Mg+Cl2 (方程2)
對于使用氫氣擴散陽極的方法,整個反應變為:
MgCl2+H2→Mg+2HCl (方程3)
對于這種反應,分解電壓降低至1.46V,允許理論電壓約1V的降低,總的電池電壓可達到0.86V的降低。這表示能量消耗25%的降低。
此外,如圖1所見,HCl復原為該過程的副產物。因為MgCl2鹽的純化過程消耗用于脫水步驟例如或瀝濾步驟的氣態HCl,這對于現場生產該方法需要的HCl是有極大興趣的。這產生經濟益處和該方法的簡單化,因為通過電解產生的干燥HCl可以直接用于該脫水過程。在鎂電解期間可產生的HCl的理論量可以由方程4估計:
其中i是電流(A),n(e-)是交換的電子數(在當前情況下n(e-)=1每摩爾HCl),F是法拉第常數和t是電解時間。因此,可以從電解過程提取和供應至MgCl2脫水設備的HCl的最大量理論上可以達到37.3 10-3mol h-1A-1。所以,對于在300kA下運行的一個電化學電池,每小時可以產生約410kg的氣態HCl。
另外,在陽極處HCl,而不是Cl2的形成可以使非期望的有機氯化合物的形成急劇地降低,產生更加生態的方法和最佳配合關于溫室氣體排放的增加的制約。作為另外的益處,通過減少氯與陽極碳的反應,其壽命將增加,導致陽極替代頻率的降低和從而更低的Mg生產成本。
通過參考下述實施例將更容易地理解本公開內容,給出下述實施例以闡釋實施方式而不是限制其范圍。
實施例I
瀝濾
為了確認鎂和鎳的提取,在以下提供的條件下,瀝濾表1提供的蛇紋石尾礦的磁性部分。在該步驟結束時,過濾漿料并且分析瀝出液以知道提取的幾種元素的產率。在回流和攪拌下在裝置中實現實驗。鎂提取超過90%并且鎳大約100%。
表2
可溶性元素提取產率
下表顯示了氧化物基(oxide base)的化學組成,和來自瀝濾2的未溶解部分的特定表面積。與非晶特征結合的高SiO2含量表明在各個工業部門很大的應用潛能。
表3
來自瀝濾2的二氧化硅部分的化學組成
實施例II
通過蛇紋石添加的中和
主要由利蛇紋石組成的蛇紋石的煅燒通過失去結合水使其解離以形成氧化鎂和二氧化硅。用于測試的蛇紋石之前在100℃下被干燥。在預定的溫度和時間下——比如650℃,60分鐘——在馬弗爐中的坩堝內煅燒材料。
表4
通過煅燒損失的重量
為了驗證非活化和活化蛇紋石中和的效率,制備了pH 0.74的HCl溶液。對于125ml的體積,分五次添加10g材料。在每次添加之后測量pH 15分鐘。在80℃下按照提出的方法進行測試。
表5
通過蛇紋石添加增加的pH
結果表明,非活化蛇紋石具有與活化蛇紋石相同的效率以使pH升高大約1(見圖2)。但是,高于該值,對于添加的相同的量其效率較低。因此煅燒增加了材料中和鹽酸溶液能力并且對于細粒度部分能力更強。至于鎂溶解,實驗顯示基于起始材料中的鎂含量,所有中和作用的百分數是相似的。
實施例III
鎳回收
為了通過沉淀回收鎳,在80℃下加熱741ml的包含鎳和雜質的pH 3.8的富鎂溶液,并且添加16ml的NaOH 3M以使pH增加至6.3。通過過濾獲得富鎳部分,其被認為是高價值產品。表6顯示了89%的鎳連同剩余的鋁、鐵和鈷雜質在該pH下沉淀,留下純化的鎂溶液。
表6
在pH 6.3下的沉淀元素
實施例IV
硫酸鹽沉淀
為了表明氯化鋇沉淀硫酸鹽的效率,制備包含157g/L的MgCl2和0,37g/L的SO42-的pH 7的溶液。在80℃下加熱其并且添加0,96g的BaCl2.2H2O,具有9%的化學計量過量。過濾和分析溶液。去除的硫酸鹽的產率為97%。
實施例V
在中性pH下的沉淀
添加431ml包含83mg的錳、30%的H2O2和1M NaOH的富鎂鹽水以氧化錳并且維持pH在大約7.5–8.0。在80℃下按照提出的用于第三階段的純化方法進行實驗。通過過濾從溶液去除氧化物形式的沉淀。下表顯示99%的錳——其是溶液中的主要最后雜質——沉淀,產生純的鎂鹽水。
表7
在中性pH下的錳沉淀
實施例VI
HCl介質中MgCl2的溶解度
為了表明氯化氫濃度對MgCl2溶解度的影響,將47g六水合鹽分別添加至25、30和37%的38ml的HCl。在回流下在35℃下攪拌該混合物15分鐘。在24℃下通過過濾去除固體。結果顯示,隨著HCl濃度的增加,鹽的溶解度降低(見圖3)。
實施例VII
通過水解方法的鐵去除
為了評估從濃縮的氯化鎂溶液去除鐵的水解方法的效率,在預定的條件下進行實驗。在水解期間,水中的鹽濃度保持在大約40-50%和溫度在200-230℃之間。反應時間在大約7小時。表10顯示僅62和70%的鐵分別被水解。這些結果確認,該方法不足以有效的去除鐵,并且第二種方法應該用于完成純化,因此增加生產成本。而且,鎂和鎳的顯著百分數被水解表示損失。
表10
來自濃縮的氯化物溶液的元素的水解
雖然結合其具體實施方式描述了本發明,但是應當理解它能夠進一步改進,并且該應用旨在涵蓋本發明的任何變型、用途或改進,包括與本公開內容的這種背離,如落在本發明所涉及的領域內的已知或通常的實踐內,如可以應用至本文先前闡釋的基本特征,和所附的權利要求的范圍內。
- 還沒有人留言評論。精彩留言會獲得點贊!