用于純化免疫球蛋白的方法與流程
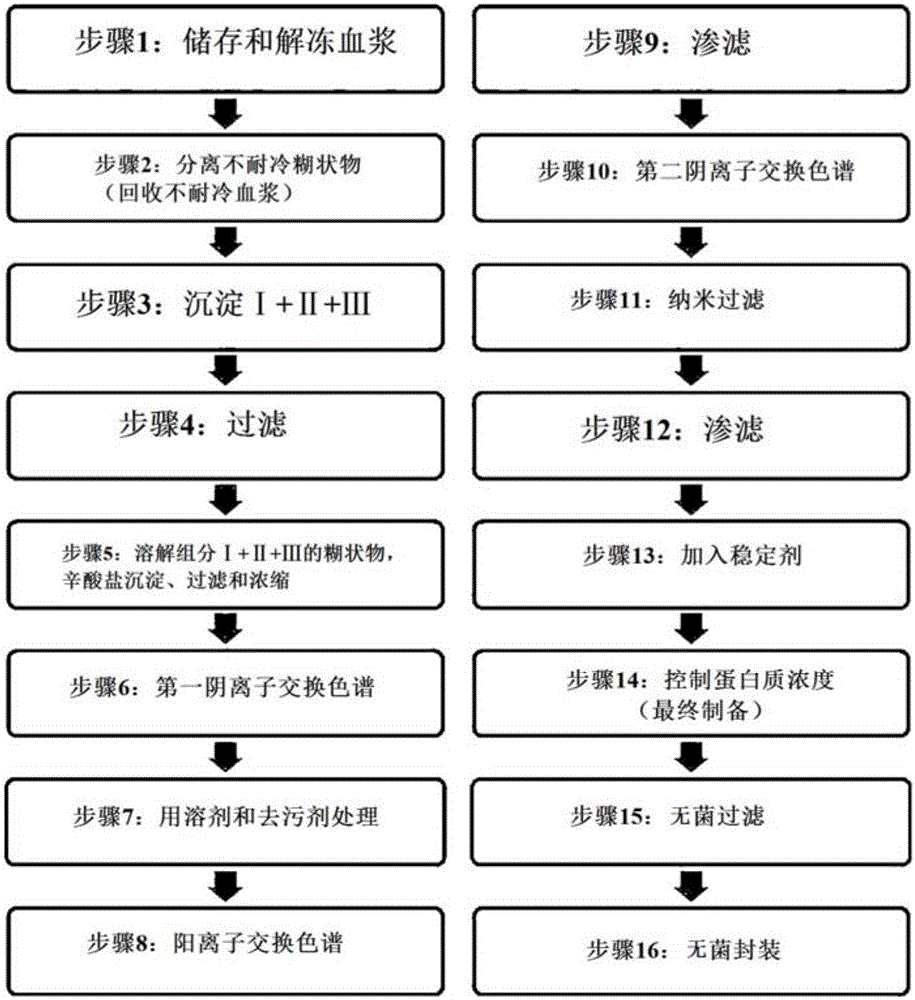
本發明涉及用于純化免疫球蛋白的方法,更具體地,涉及的用于純化免疫球蛋白的方法包括:溶解含免疫球蛋白的血漿蛋白質組分(fraction)I+II+III或組分II+III,然后通過加入辛酸鹽而實施沉淀反應,實施透析和濃縮,然后經過陰離子交換樹脂和陶瓷陽離子交換樹脂純化過程而有效地除去加入的用于滅活病毒的溶劑和去污劑,并保持鹽濃度在恒定水平,以保持免疫球蛋白的聚合物含量在低的水平。
背景技術:
免疫球蛋白是包含抗各種病毒和細菌抗體的血漿蛋白質,通過給藥給天然缺少抗體的受試者或由于病毒性疾病或細菌性疾病而需要人工補充抗體的患者而被用作預防或治療疾病的藥物。
為了使這樣的免疫球蛋白用作為藥物,已經根據Cohn和Oncley開發的冷乙醇分餾法(Cohn E.等,J.Am.Chem.Soc.,68:459,1946)或者Kistler和Nitschmann開發的改進的冷乙醇分餾法(Kistler P,Nitschmann HS,Vox Sang,7:414.1952)制備了用于皮下或肌肉注射的免疫球蛋白。
然而,用于肌肉注射的免疫球蛋白具有下述問題:1)這樣的免疫球蛋白的劑量受限,使得不可能大量施用免疫球蛋白;2)免疫球蛋白在注射免疫球蛋白的位點引起疼痛;3)免疫球蛋白中具有抗體活性的天然免疫球蛋白G(IgG)的含量低;4)注射位點的蛋白酶降低了免疫球蛋白的抗體活性;以及5)達到峰值血漿濃度的時間為24小時或更久。
為了解決肌肉注射的問題,嘗試通過靜脈注射給藥免疫球蛋白。然而,當靜脈注射給藥免疫球蛋白制劑時,由于其與抗補體活性結合(aggregate)引起的嚴重的副作用(過敏反應),出現了各種直接的副作用,包括呼吸困難和循環系統休克。這樣的癥狀主要在免疫球蛋白缺陷的患者中出現。特別地,在出現抗IgA抗體的患者中觀察到嚴重超敏性的副作用。
因此,由于上述問題,不可能靜脈注射免疫球蛋白,所以需要開發用于靜脈注射的免疫球蛋白制劑,以及開發在制備過程中能夠除去上述聚集體和/或防止聚集體形成的方法。由于用諸如胃蛋白酶、木瓜蛋白酶或血纖維蛋白溶酶(Plasmin)的蛋白酶或者諸如β-丙內酯的化學物質處理免疫球蛋白以改變它們的結構,從而抑制免疫球蛋白聚集體的形成或破壞免疫球蛋白聚集體,進而降低免疫球蛋白的抗補體活性,使得靜脈注射免疫球蛋白變得可能。
通過用胃蛋白酶處理原料(Cohn組分II)以除去免疫球蛋白聚集體而制備第一代靜脈注射免疫球蛋白(IVIG)產品。制備過程不包括柱色譜步驟,并凍干制得的產物,以便在適當的時間段內保持穩定,并在使用前立即溶解。然而,發現一些制造商制造的IVIG產品會引起病毒性感染,例如C型病毒性肝炎。由于這個原因,在制備過程中增加滅活和/或除去已知病毒的一個或多個步驟。之后,在上世紀八十年代中期公開了具有低抗補體活性和更高穩定性的第二代IVIG產品,并通過數個色譜步驟純化IVIG產品。
靜脈注射這樣的制劑,從而克服肌肉注射免疫球蛋白的缺點,包括受限的劑量、注射位點的疼痛以及蛋白酶降低免疫球蛋白的抗體活性,并且還將達到峰值血漿濃度需要的時間縮短至幾個小時或更短。
然而,由于其結構變化,上述靜脈注射免疫球蛋白產品具有很少的有抗體活性的天然IgG,或者不具有抗體活性的天然IgG,所以補體結合活性減小,或者不具有補體結合活性,并且具有短至約4~12天的血液半衰期,因此,表明它們對預防和治療疾病呈現不令人滿意的作用。此外,以凍干粉形態制得的第一代和第二代IVIG產品需要溶解它們的額外過程,并且具有低的溶解速度。由于這個原因,開發了液體IVIG產品,并且需要改善的工藝,以獲得更穩定且更純的IVIG產品。
與此相關地,德國專利申請No.2,604,759和美國專利申請No.4,124,576公開了通過使用諸如聚乙二醇的非離子型表面活性劑獲得具有抗體活性的純IgG(第三代IVIG)的方法,它們與上述用于靜脈注射的γ免疫球蛋白不同。這樣的IgG制劑具有補體結合活性,以及提高的血液半衰期,因此顯示出對預防和治療疾病的良好效果。然而,這些用聚乙二醇處理而生產的制劑仍然會引起副作用,因為難以從這些制劑中完全除去具有抗補體活性的聚集體(顯示約0.02U/mg的抗補體活性)。
此外,韓國公開No.1983-0007083公開了一種通過使用聚乙二醇處理從人血漿分離的Cohn組分II或組分II+III而制備靜脈注射免疫球蛋白的方法。然而,該方法存在的有問題為其較復雜且產量較低。
因此,本發明人為解決現有技術中出現的上述問題做出了巨大的努力,結果發現當通過辛酸鈉沉淀、陰離子交換色譜和陽離子交換色譜從作為原料的含免疫球蛋白的血漿蛋白組分Ⅰ+Ⅱ+Ⅲ或組分Ⅱ+Ⅲ中純化免疫球蛋白時,可解決包括在利用聚乙二醇處理的常規制備方法中出現的復雜步驟和產率較低的問題,并可省略用于制備組分II的沉淀Ⅰ+Ⅲ步驟和沉淀Ⅱ步驟,因此非常易于實施生產靜脈注射免疫球蛋白制劑的過程,從而完成本發明。
技術實現要素:
技術問題
本發明的目的為提供一種用于純化免疫球蛋白的方法,該方法可有效地除去雜質和血栓性物質,以生產穩定且高純度的免疫球蛋白。技術方案
為實現上述目的,本發明提供了一種用于純化免疫球蛋白的方法,包括如下步驟:
(a)溶解含免疫球蛋白的血漿蛋白組分I+II+III或組分II+III,然后通過加入沉淀劑而實施沉淀反應;
(b)除去(a)中產生的沉淀,然后過濾包含免疫球蛋白的上清液,濃縮濾液,使濃縮物經過陰離子交換色譜,并回收未吸附到陰離子交換色譜柱上的組分;
(c)用溶劑/去污劑處理所述回收的組分,以滅活病毒,然后使所述組分經過陽離子交換色譜,以除去所述溶劑/去污劑;
(d)透析和/或濃縮從所述陽離子交換色譜獲得的洗脫液,使所述洗脫液經過陰離子交換色譜,并回收未吸附到所述陰離子交換色譜柱上的組分;以及
(e)通過病毒濾器過濾回收的組分,并透析和/或濃縮濾液,從而獲得純化的免疫球蛋白。
附圖說明
圖1為顯示根據本發明制備靜脈注射免疫球蛋白的過程的示意圖。
圖2顯示了每個制備步驟中免疫球蛋白純度(凝血酶/IgG)的測量結果。
圖3顯示了通過SDS—PAGE測量的每個制備步驟中濾液或者沉淀物含有的FXI(人凝血因子XI)濃度的結果。
最佳實施方式
除非另有定義,否則本文所用的所有技術術語和科學術語都具有與本領域普通技術人員通常理解相同的含義。通常,本領域中已知并且普遍地使用下文將描述的文中使用的術語及實驗方法。
如文中使用,表述“含免疫球蛋白的血漿蛋白”意思是包括通過從人血漿或人胎盤血漿除去諸如因子IX和抗凝血酶的各種血漿蛋白而獲得的無冷凝蛋白血漿(cryoprecipitate-free plasma)、各種Cohn組分、以及通過硫酸銨或PEG獲得的組分(Polson等,Biochem Biophys Acta,82:463,1964);Polson and Ruiz-Bravo,Vox Sang,23:107.1972)。優選地,在本發明中使用的血漿蛋白組分可為Cohn組分Ⅱ、Cohn組分Ⅰ+Ⅱ+Ⅲ或Cohn組分Ⅱ+Ⅲ。
在本發明中,使用根據常規Cohn血漿組分方法從人血漿獲得組分Ⅰ+Ⅱ+Ⅲ或組分Ⅱ+Ⅲ。然后實施從Ⅰ+Ⅱ+Ⅲ或組分Ⅱ+Ⅲ中除去各種因子脂蛋白、纖維蛋白原、α球蛋白質、β球蛋白質和各種凝血因子的純化過程。
在本發明中,人血漿使用FDA批準且經生物檢測的美國血漿,生物檢測包括對人免疫缺陷病毒(HIV)、C型肝炎病毒(HCV)、B型肝炎病毒(HBV)和微小病毒B19進行的核酸擴增檢測以及血清學檢測。通過在夾套式容器中于1~6℃培養12~72小時而解凍在﹣20℃或更低溫度下儲存的血漿。
在上述條件下解凍血漿時,產生包括纖維蛋白原和凝血因子的冷凝蛋白。通過離心除去產生的冷凝蛋白,并回收剩余的不耐冷(cryo-poor)血漿。然后,重復沉淀和過濾過程,從而獲得組分Ⅰ+Ⅱ+Ⅲ。
在分離含免疫球蛋白血漿的過濾過程中,加入助濾劑,并與不耐冷血漿混合,然后通過壓濾機的方式分離成上清液和沉淀物。作為助濾劑,可使用Celpure 300或Celpure 1000。
本發明的方法中,通過將蒸餾水加到上述組分中使得組分Ⅰ+Ⅱ+Ⅲ或組分Ⅱ+Ⅲ與蒸餾水的比為1∶6至1∶10,從而實施步驟(a)中組分Ⅰ+Ⅱ+Ⅲ或組分Ⅱ+Ⅲ的溶解,并且所述蒸餾水可為注射用蒸餾水。
優選地,在基本不變性的溫度和pH下將所述血漿蛋白質組分懸浮(溶解)于水和/或緩沖液中。術語“基本不變性”是指該術語涉及的條件基本上不會造成IgG分子功能活性不可逆的喪失,例如抗原結合活性的喪失和/或生物Fc功能的喪失。
有利地,用至少一種非變性緩沖液酸化的水以6~10倍、優選7~8倍血漿蛋白組分體積的體積溶解所述血漿蛋白組分。優選地,保持含免疫球蛋白的懸浮液的pH在小于6,例如在4.0~6.0的范圍內,優選為4.1~4.3,以確保免疫球蛋白的最佳溶解度。可使用本領域中已知的任何酸性緩沖液,但是優選可使用磷酸鈉、乙酸鈉、乙酸、鹽酸或水(蒸餾水)作為酸性緩沖液。本發明中,使用蒸餾水或注射用蒸餾水。
在本發明中,步驟(a)為通過沉淀從其它物質中分離含免疫球蛋白上清液的步驟。
在本發明中所用的沉淀劑可為選自各種分子量形態的聚乙二醇(PEG)、辛酸和硫酸銨中的至少一種。非變性的水溶性蛋白沉淀劑可用作沉淀的替代方式。優選地,可使用辛酸。
通過以5~26mM,優選為19~21mM的濃度加入沉淀劑,然后調節溶液的pH至4.0~6.0,優選至4.5~5.5而實施步驟(a)中沉淀物的形成。可通過加入乙酸或氫氧化鈉而實施pH的調節,但并不限于此。對本領域技術人員顯而易見的是:在本發明中可使用通常可用于調節pH的其它物質。
通過加入沉淀劑實施沉淀約1小時,優選為50分鐘至1小時10分鐘,直到達到固相和液相之間的平衡。在整個沉淀期間,保持懸浮液在低溫,優選在2~6℃,并且最適溫度取決于蛋白質沉淀劑的特性。
通過沉淀形成的沉淀物含有大量聚集的蛋白質材料,并且上清液含有免疫球蛋白,因此可僅收集上清液,以純化免疫球蛋白。另外,可過濾含免疫球蛋白的上清液,以除去例如大的聚集體、助濾劑和殘余的不溶解相。優選通過深濾器的方式進行過濾,例如C150AF、AF 2000或AF 1000(Schenk)、30LA(Cuno)或相似的濾器。在一些情況下,還可通過離心進行聚集體、助濾劑和殘余的不溶解蛋白質材料的除去。
在本發明中,為了從組分Ⅰ+Ⅱ+Ⅲ的糊狀物中提取免疫球蛋白,加入蒸餾水或WFI(注射用蒸餾水),使得組分Ⅰ+Ⅱ+Ⅲ的糊狀物與蒸餾水的比為1∶6至10,并且提取的蛋白質的濃度為15mg/ml。使用1M的乙酸調節溶液的pH至 4.2±0.1,然后提取組分Ⅰ+Ⅱ+Ⅲ的糊狀物。
將1M辛酸鈉溶液加到提取物中,使得辛酸鹽的濃度為20±1.0mM,然后使用1M乙酸或0.5M氫氧化鈉(NaOH)調節提取物溶液的pH至5.1±0.1,并在4℃經沉淀1小時±10分鐘。回收上清液,并通過深濾器過濾,以獲得免疫球蛋白溶液。
在本發明中,步驟(b)是濃縮免疫球蛋白并除去雜質的步驟。在這個步驟中,控制免疫球蛋白的濃度至10~50mg/ml,優選至20~30mg/ml,并在5.0~6.0的pH以95~145cm/hr的流速實施陰離子交換色譜。用1.6~2.0倍的上樣體積(loading volume,LV)回收未吸附到用于實施陰離子交換的色譜柱上的組分。優選地,調節pH至5.4~5.8,更優選至5.5~5.7。
濃縮的含免疫球蛋白溶液在一個或多個步驟中經陰離子交換色譜或陽離子交換色譜,以除去沉淀劑以及其它的血漿蛋白,包括免疫球蛋白A(IgA)、白蛋白和聚集體。在本發明中,實施陰離子交換色譜,以從濃縮的含免疫球蛋白溶液中除去辛酸鹽和其它血漿蛋白。
用在陰離子交換色譜步驟中的陰離子交換樹脂可為被二乙氨乙基(DEAE)或季銨基取代的陰離子交換樹脂,但并不限于此。優選地,陰離子交換樹脂可為選自具有強堿性季銨基或弱堿性二乙氨乙基(DEAE)的陰離子交換樹脂中的任意一種。
例如,對于強堿性陰離子交換樹脂,可使用Q Sepharose Fast Flow、Q Sepharose High Performance、Resource Q、Source 15Q、Source 30Q、Mono Q、Mini Q、Capto Q、Capto Q ImpRes、Q HyperCel、Q Cermic HyperD F、Nuvia Q、UNOsphere Q、Macro-Prep High Q、Macro-Prep 25 Q、Fractogel EMD TMAE(S)、Fractogel EMD TMAE Hicap(M)、Fractogel EMD TMAE(M)、Eshmono Q、Toyopearl QAE-550C、Toyopearl SuperQ-650C、Toyopearl GigaCap Q-650M、Toyopearl Q-600C AR、Toyopearl SuperQ-650M、Toyopearl SuperQ-650S、TSKgel SuperQ-5PW(30)、TSKgel SuperQ-5PW(20)、TSKgel SuperQ-5PW等等,但并不限于此,并且可使用本領域中已知的任何陰離子交換樹脂。
柱子的尺寸(即柱子的直徑和樹脂的高度)反映了用于陰離子交換色譜的樹脂的合適體積,并可根據例如所使用的溶液中的免疫球蛋白的量以及所使用樹脂的結合性能而變化。在實施陰離子交換色譜前,優選用緩沖液平衡陰離子交換樹脂,該緩沖液使得樹脂結合其反離子。
本發明中,所用的陰離子交換樹脂為Q Sepharose Fast Flow,并且所用的柱緩沖液可為本領域中已知的平衡緩沖液(例如磷酸鈉緩沖液、檸檬酸鹽緩沖液、乙酸鹽緩沖液等),洗滌緩沖液以及洗脫緩沖液。
用25±0.5mM的乙酸鈉(NaOAc)緩沖液裝載陰離子交換色譜柱,使得其pH為5.6±0.1,并調節流動相的流速至120±25cm/hr。以90.0±20mg/mL的量裝載濃縮的免疫球蛋白溶液到柱子中。
本發明中,步驟(c)為滅活病毒的步驟,該病毒例如為含免疫球蛋白溶液中潛在的脂包膜病毒(lipid enveloped viruse),然后除去用于滅活的物質。在這個步驟中,可使用病毒滅活劑,優選為溶劑和/或去污劑。最優選地,可使用溶劑&去污劑處理所用的溶劑—去污劑的混合物。
通過步驟(c),可滅活脂包膜病毒(例如HIV1和HIV2,C型肝炎以及非A-B-C型肝炎、HTLV 1和HTLV 2,皰疹病毒家族,包括CMV和人類皰疹病毒4型),從而提高最終產品的安全性。
步驟(c)中,只要它們具有滅活病毒的性質,可無限制地使用任何溶劑和去污劑,尤其是滅活脂包膜病毒。去污劑可選自由非離子型去污劑和離子型去污劑組成的組中,并且優選為基本不變性的去污劑。特別地,在易于除去方面優先選擇非離子型去污劑。溶劑最優選為美國專利申請No.4,764,369中公開的磷酸三正丁酯(TNBP),但是不限于此。
在本發明中所用的病毒滅活劑優選為TNBP與選自聚山梨醇酯80(Tween 80)、Triton X-100和Triton X-45中的至少一種的混合物,但是不限于此。
加入優選的溶劑/去污劑混合物,使得TNBP在含免疫球蛋白的溶液中的濃度為0.2~0.6wt%,優選為0.24~0.36wt%,并使得Tween 80的濃度為0.8~1.5wt%,優選為0.8~1.2wt%。
在滅活包膜病毒的條件下實施病毒的滅活步驟,產生基本抗病毒(virus-safe)的含免疫球蛋白的溶液。這樣的條件包括4~30℃、優選19~28℃、最優選24~26℃的溫度,以及1~24小時、優選4~12小時,最優選約8小時的培養時間,以確保充分滅活病毒。
本發明中,可在4.5~5.5的pH下以110~130cm/hr的流速實施步驟(c)中的陽離子交換色譜。優選地,調節pH至4.9~5.1。裝載到陽離子交換樹脂上的免疫球蛋白的量為90~130mg/每毫升陽離子交換樹脂,優選為95~105mg/每毫升樹脂。在吸附免疫球蛋白后,用平衡緩沖液實施洗滌。用于洗滌的平衡緩沖液的用量可為至少3倍柱體積,優選至少5倍柱體積。在洗滌后,用至少8倍柱體積的洗脫緩沖液洗脫免疫球蛋白。
本發明中所用的陽離子交換色譜可為Sephardex、Sepharose、HyperCell或Source,但是不限于此,還可使用本領域中已知的其它陽離子交換樹脂。本發明中,優選使用陶瓷基陽離子交換樹脂。在本發明的實施例中,可將陶瓷基樹脂CM Hyper D凝膠用作陽離子交換樹脂,并將本領域中已知的平衡緩沖液(例如磷酸鈉緩沖液、檸檬酸鹽緩沖液或乙酸鹽緩沖液)、洗滌緩沖液以及洗脫緩沖液用作柱緩沖液。
用具有足以有效洗脫IgG的pH和離子強度的基本非變性的緩沖液來實施從陽離子交換樹脂上洗脫免疫球蛋白,從而回收含免疫球蛋白的洗脫液。文中,“有效洗脫”意思是從陽離子交換樹脂上洗脫至少75%,例如至少80%,例如至少85%的裝載到陽離子交換樹脂上的免疫球蛋白溶液。
本發明中,可在足以從陽離子交換樹脂上移除免疫球蛋白的洗脫緩沖液的高鹽濃度下實施步驟(c)中的陽離子交換色譜。可在400~600mM,優選在500mM的鹽濃度下實施。
在本發明中,步驟(d)為進一步除去雜質的步驟。
為了在透析和/或濃縮中保持聚合物的含量,優選在保持從陽離子交換色譜柱獲得的洗脫液的鹽濃度為50~150mM狀況下實施步驟(d)。當在蛋白洗脫步驟中使用能保持低鹽濃度的洗脫方法時,可減小免疫球蛋白的聚合物含量,因而可純化具有改善質量的免疫球蛋白。在本發明中,保持從陽離子交換樹脂獲得的洗脫液的鹽濃度為100mM或更低,以保持聚合物的含量。
在本發明中,可使用超濾/滲濾(UF/DF)系統實施步驟(d)中的透析和/或濃縮。在10mOsmol/kg或更低的滲透壓下實施,然后調節pH值至5.5~6.5。即透析和濃縮來自陽離子交換色譜柱的洗脫液,并且在一個步驟中分別通過滲濾和超濾實施透析和濃縮。有利地,用于滲濾/超濾的膜具有50,000Da范圍內的理論截留分子量(nominal weight cutoff)。
本發明中,實施滲濾以從陽離子交換色譜洗脫液中除去低分子量的離子,并保持UF/DF系統中的滲透壓為10mOsmol/kg或更小。發現通過折射計(T/S meter)測量,透析和/或濃縮的免疫球蛋白被濃縮至1.5±0.1。
本發明中,在5.5~6.5的pH下以90~150cm/hr的流速實施步驟(d)中的陰離子交換色譜,并用0.8~1.2倍的上樣體積(LV)回收未吸附到用于實施陰離子交換色譜的柱子上的組分。優選地,可調節pH至5.78~6.30,優選至6.0~6.2,并且優選用0.96~1.04倍的上樣體積(LV)回收未吸附到陰離子交換色譜柱上的組分。
此外,在步驟(d)中,可通過加入酸,優選1M硫酸、鹽酸或乙酸調節未吸附到陰離子交換色譜柱上的組分的pH至4.0~5.5,優選至4.3~4.7。
在本發明中,EMD TMAE(Fractogel EMD TMAE)用作陰離子交換樹脂。將其裝入柱子中,然后用20±1.0mM的乙酸鈉(NaOAc)緩沖液平衡,使得pH為6.1±0.05。調節移動相的流速至120±30cm/hr。以110.0±10mg/mLr的量裝載透析和/或濃縮的免疫球蛋白溶液到柱子中,并以1.0±0.04倍的上樣體積的量回收未吸附到陰離子交換色譜柱上的組分,然后通過加入1M乙酸調節pH值至4.5±0.2。
在本發明中,可使用納米過濾或超濾/滲濾系統實施步驟(e)中的過濾。可在2.0~3.0巴的壓力下實施納米過濾,并且可在10mOsmol/kg或更低的滲透壓下實施超濾/滲濾,然后可調節pH至4.5~5.5。
納米過濾是重要的除去病毒的步驟。在這個步驟中,通過Pall DVD預濾器和DV20病毒濾器在2.5±0.5巴(優選2.5±0.2巴)的壓力下過濾未吸附到第二陰離子交換色譜柱上的組分,以從免疫球蛋白溶液中除去病毒。然后,在10mOsmol/kg或更低的壓力下使用超濾/滲濾(UF/DF)系統實施滲濾,以除去低分子量的離子。
本發明的方法可進一步包括在步驟(e)之后加入穩定劑的步驟,以制備用于靜脈注射的免疫球蛋白。
本發明中,加入的穩定劑可為選自糖醇、麥芽糖、山梨糖醇、甘露糖、葡萄糖、海藻糖、白蛋白、賴氨酸、甘氨酸、PEG和Tween 80中的至少一種。優選地,甘氨酸用作穩定劑。
可以200~300mM的濃度加入穩定劑。在加入穩定劑后,可調節免疫球蛋白溶液的pH至4.5~5.5。優選地,可通過加入酸,優選為硫酸或鹽酸,調節pH至4.7~4.9。
本發明中,為了穩定免疫球蛋白,加入甘氨酸到透析和/或濃縮的免疫球蛋白溶液至250±50mM的終濃度,并充分混合,然后通過加入0.5N的鹽酸調節溶液的pH至4.8±0.1,然后使用0.2μm濾器滅菌并儲存。
可稀釋或濃縮用于靜脈注射的滅菌的免疫球蛋白制劑,使得蛋白質(已純化的免疫球蛋白)的濃度為1~30wt%。本發明中,用WFI稀釋或者通過超濾濃縮滅菌免疫球蛋白制劑,使得蛋白質濃度為40~60g/l,優選為45~55g/l,更優選為49.5~50.5g/l。然后,將甘氨酸加到免疫球蛋白溶液中至250±50mM的終濃度,并充分混合,然后將鹽酸加到免疫球蛋白溶液中,以調節pH至4.8±0.1,從而制備靜脈注射免疫球蛋白制劑。
另一方面,本發明涉及根據本發明的制備方法制備的靜脈注射免疫球蛋白。
在本發明的實施例中,測定每個制備步驟中免疫球蛋白溶液的純度(凝血酶/IgG)以及每個制備步驟中濾液或沉淀物中FXI(人凝血因子XI)的濃度。因此,可看到純化了具有99%或更高純度的免疫球蛋白溶液(圖2),并且除去了大部分的凝血因子FXI(表2和圖3)。
實施例
下文,將參考實施例進一步詳細地描述本發明。對本領域普通技術人員顯而易見的是:這些實施例僅為描述的目的,而不能解釋為對本發明范圍的限制。因此,本發明的實質范圍將由所附權利要求書及其等價方式所限定。
實施例1:制備靜脈注射免疫球蛋白
1-1:制備血漿
對于血漿,使用經過生物檢測的FDA批準的血漿,該生物檢測包括對人免疫缺陷病毒(HIV)、C型肝炎病毒(HCV)、B型肝炎病毒(HBV)和微小病毒B19進行的核酸擴增檢測以及血清學檢測。
本發明中,使用源自美國的血漿(批號600B0491)。血漿儲存在﹣20℃或更低的溫度下直至使用。用瓶子切割機打開裝有血漿的瓶子,并通過在夾套式容器中1~6℃培養12~72小時而解凍血漿。
在上述條件下解凍血漿時,生產包含纖維蛋白原和凝血因子的冷凝蛋白。通過離心除去產生的冷凝蛋白,并回收剩余的不耐冷血漿。
1-2:沉淀Ⅰ
將96%乙醇加到實施例1-1中回收的不耐冷血漿,使得在﹣3±1℃下的乙醇終濃度為8±0.8%,然后使用乙酸鹽緩沖液調節溶液的pH至7.2±0.2。根據工藝產物的消耗而決定是否實施沉淀Ⅰ的回收。在本發明中,進行沉淀Ⅰ過程,但是不進行通過離心除去沉淀。
1-3:沉淀Ⅱ+Ⅲ和過濾
在沉淀Ⅰ過程后,為進一步沉淀不耐冷血漿中含有的免疫球蛋白,實施沉淀Ⅱ+Ⅲ步驟。
另外將96%乙醇加到經沉淀Ⅰ步驟處理的不耐冷血漿中,使得在﹣5±1.0℃下的乙醇終濃度為20±2%。然后,使用乙酸鹽緩沖液調節溶液的pH至6.9±0.1。
然后,以每千克血漿0.0284千克的量將助濾劑(Celpure 300或Celpure 1000)加到溶液中,并混合30±10分鐘。混合物在保持2~8℃溫度的冷藏室中的壓濾機(裝置信息)上分離為上清液和沉淀物。
命名上清液為“上清液Ⅰ+Ⅱ+Ⅲ(或Ⅱ+Ⅲ)”,并命名沉淀物為“組分Ⅰ+Ⅱ+Ⅲw(或Ⅱ+Ⅲw)”(w;洗滌)。立即使用組分Ⅰ+Ⅱ+Ⅲw(或Ⅱ+Ⅲw),或在-20℃或更低的溫度下儲存。
1-4:提取組分Ⅰ+Ⅱ+Ⅲ的糊狀物,辛酸鹽沉淀,過濾及濃縮
為了從實施例1-3中獲得的組分Ⅰ+Ⅱ+Ⅲ的糊狀物中提取免疫球蛋白,加蒸餾水或WFI(注射用蒸餾水)到組分I+II+III的糊狀物,使得組分I+II+III的糊狀物與蒸餾水的比為1∶6至10,且提取的蛋白質濃度為15mg/ml。然后,通過加入1M乙酸調節溶液的pH至4.2±0.1,然后在2~8℃的溫度下提取組分I+II+III的糊狀物11±0.5小時。
將1M辛酸鈉溶液加到提取物中,使得辛酸鹽的濃度為20±1.0mM。然后通過加入1M乙酸或0.5M氫氧化鈉(NaOH)而調節提取溶液的pH至5.1±0.1,并在4℃下經沉淀1小時±10分鐘。然后,回收上清液,并用深濾器(Ahlstrom-924濾器、Ahlstrom-950濾器)從上清液中回收免疫球蛋白溶液。濃縮回收的免疫球蛋白溶液至28±2mg/ml。
1-5:第一陰離子交換色譜
為了從實施例1-4中獲得的濃縮的免疫球蛋白溶液中除去辛酸鹽及其它血漿蛋白,進行陰離子交換色譜。
將陰離子交換樹脂Q Sepharose FF(GE Healthcare,目錄號17-0510)裝入柱子中,然后用平衡緩沖液(25±0.5mM乙酸鈉(NaOAc),pH為5.6)平衡,使得pH為5.6±0.1。然后,在25℃或更高的溫度下以120±25cm/hr的流速裝載90.0±20mg/mLr量的實施例1-4中獲得的濃縮的免疫球蛋白溶液到柱子上。然后,用1.6~2.0倍的上樣體積(LV)回收未吸附到陰離子交換色譜柱上的組分。
1-6:溶劑/去污劑處理
為滅活含免疫球蛋白溶液中潛在的脂質包膜病毒,實施用溶劑和去污劑處理含免疫球蛋白溶液的步驟。
首先,調節所述組分的pH至5.0±0.1,將乙酸加到實施例1-5中未吸附到陰離子交換色譜柱并回收的組分中。然后,加入磷酸三正丁酯(TNBP)和聚山梨醇酯80(Tween 80)到所述組分分別至0.3±0.06%和1±0.2%的濃度,然后在200±50RPM下攪拌20~30分鐘。為了確定TNBP和Tween 80在溶液中是否均勻混合,取樣并分析一部分溶液。然后,在25±1.0℃、200±50RPM下連續攪拌溶液8小時。
1-7:陽離子交換色譜
為了從經溶劑/去污劑處理的免疫球蛋白溶液中除去TNBP、Tween 80和其它血栓性物質,例如凝血因子,實施陽離子交換色譜。
陽離子交換樹脂CM Hyper D凝膠(Pall Corporation;目錄號20050)為陶瓷材料,將其裝入柱中,然后用平衡緩沖液(25±0.5mM乙酸鈉(NaOAc))平衡,使得pH為5.0±0.1。然后,在20±2℃的溫度下以120±10cm/hr的流速裝載100.0±5mg/mLr量的實施例1-6中用溶劑/去污劑處理的免疫球蛋白溶液到柱子中。此外,用至少5個柱子體積的洗滌緩沖液洗滌后,用至少8個柱子體積的洗脫緩沖液洗脫免疫球蛋白(洗脫緩沖液的組成:20mM NaOAc pH 4.5w/0.5M NaCl)。
1-8:滲濾
為了從陽離子交換色譜洗脫液中除去低分子量的離子,實施滲濾。
在10mOsmol/kg或更低的滲透壓下使用超濾/滲濾系統(Millipore Pellicon2(50K))滲濾實施例1-7中獲得的洗脫液。為了保持免疫球蛋白的聚合物含量,將陽離子交換色譜洗脫液加至計算的透析濃縮物中,并在保持100mM或更低的氯化鈉濃度的同時連續實施超濾/滲濾(UF/DF)。
1-9:第二陰離子交換色譜
為了從實施例1-8中獲得的透析和/或濃縮的免疫球蛋白溶液中除去聚合物及其它血漿蛋白,實施第二陰離子交換色譜。
將陰離子交換樹脂Fractogel EMD TMAE(Merck-Millipore,目錄號116887)裝入柱子中,然后用平衡緩沖液(20±0.5mM乙酸鈉(NaOAc),pH為6.1)平衡,使得pH為6.1±0.1。然后,在20±2℃的溫度下以120±30cm/hr的流速裝載110.0±10mg/mLr量的實施例1-8中獲得的濃縮的免疫球蛋白溶液到柱子中。然后,用1.0±0.04倍的上樣體積(LV)回收未吸附到陰離子交換色譜柱上的組分,然后通過加入鹽酸調節pH至4.5±0.1。
1-10:納米過濾以及滲濾
納米過濾是重要的除菌步驟。在2.0±0.5巴或更低的壓力下,通過FlorodyneⅡ預濾器(AB1DJL7PH4)過濾實施例1-9中獲得的透析/濃縮的免疫球蛋白溶液,并通過病毒濾器(DV20,AB3DV207PH4)在2.0±0.5巴的壓力下過濾,從而除去免疫球蛋白溶液中的病毒。
然后,為了除去低分子量的離子,在10mOsmol/kg或更低的滲透壓下利用超濾/滲濾(UF/DF)系統滲濾免疫球蛋白溶液。
1-11:加入穩定劑以及制備最終制劑
為了穩定免疫球蛋白,將甘氨酸加到透析和/或濃縮的免疫球蛋白溶液中至250±50mM的終濃度,并充分混合,然后測量穩定的免疫球蛋白溶液的pH,通過加入0.5N鹽酸調節免疫球蛋白溶液的pH至4.8±0.1。然后使用0.2μm的濾器滅菌濾液,并儲存在不銹鋼儲存罐中。
用WFI稀釋或通過超濾濃縮生成的用于靜脈注射的免疫球蛋白制劑,使得蛋白質濃度為50±0.5g/l。然后,向其中加入甘氨酸至250±50mM的終濃度,并充分混合。然后測量穩定的免疫球蛋白制劑的pH,并通過加入鹽酸調節pH至4.8±0.1。
在調節pH后,滅菌免疫球蛋白制劑,并轉移至包裝間,以制備產品,然后在2~8℃的溫度下儲存所述產品。
實施例2:測量每個制備步驟中免疫球蛋白溶液中產生的凝血酶/IgG(血栓栓塞風險)
測量實施例1的每個制備步驟中取樣的免疫球蛋白制劑的純度(凝血酶/IgG)。
2-1:實驗方法
本發明中,根據FDA的六個附屬分析機構之一的CBER(生物制品評價和研究中心)提供的Thrombin Generation方案(CBER Thrombin Generation protocol 01Experiment(100916)a)實施實施例1的每個步驟中免疫球蛋白溶液的血栓栓塞風險的測量。
2-2:實驗結果
根據本發明的免疫球蛋白純化工藝包括Cohn血漿分級方法和離子交換色譜純化技術。如下面的圖2和表1所示,可看到辛酸鹽沉淀過程以及色譜純化工藝中的陽離子交換色譜和第二陰離子交換色譜過程中,有效地減少了產生的凝血酶(即血栓性物質)的量。
表1:每個制備過程中產物的分析
上面表1中的結果顯示了可減小靜脈注射免疫球蛋白引起的血栓形成,因此可有效地防止血栓形成引起的血栓栓塞,從而提高免疫球蛋白的安全性。
實施例3:在每個制備步驟中測量濾液或沉淀物中FXI(人凝血因子XI)的濃度
為了檢測除去凝結劑的程度,通過ELISA(AssayMax Human Factor XI(FXI)ELISA Kit;ssaypro,目錄號EF1011-1)和SDS—PAGE測量實施例1的每個制備步驟中取樣的濾液和沉淀物中的FXI(人凝血因子XI)的濃度。
表2:純化過程產品的FXI含量
可通過ELISA和SDS—PAGE測量根據本發明的純化過程產物的FXI含量。因此,如上面的表2和圖3所示,在鋅酸鹽沉淀、陽離子交換色譜和陰離子交換色譜中幾乎除去了FXI。
工業實用性
如上述,根據本發明用于制備靜脈注射免疫球蛋白的方法,可省略從作為原材料的組分I+II+III或組分II+III制備組分II的沉淀步驟,并且通過使用第一辛酸鈉沉淀、陰離子交換色譜和陽離子交換色譜而解決包括在實施聚乙二醇處理過程(聚乙二醇處理)的常規制備方法中出現的復雜的步驟和低產率的問題。此外,當使用根據本發明的純化免疫球蛋白的方法時,可提高除去雜質和血栓性物質的效率,并可保持免疫球蛋白的聚合物含量,所以可生產具有提高質量的穩定的免疫球蛋白。
盡管已經參考具體的特征詳細描述了本發明,但是對本領域技術人員顯而易見的是:該描述僅用于優選的實施方式,而非限制本發明的范圍。因此,本發明的實質范圍將由所附權利要求及其等價方式所限定。
- 還沒有人留言評論。精彩留言會獲得點贊!