甘草葉的活性成分及其結構和用途的制作方法
本發明屬于化學技術領域,涉及甘草葉中酚性成分的結構、制備及生物活性,特別是新化合物α, α′-二氫-3,5,3′,4′-四羥基-2,5′-二異戊烯基茋(α, α′-dihydro-3,5,3′,4′-tetrahydroxy-2,5′-diisopentenylstilben)的制備、結構及生物活性。
背景技術:
甘草(中國藥典,2010版,第一卷,80-81頁)被稱為“中藥國老”,是中藥方劑中最常用的藥材,有“十方九草”之稱。甘草還是食品工業中廣泛應用的天然甜味劑,此外,在煙草及化妝品工業中也有應用(張繼, 姚健, 丁蘭. 甘草的利用研究進展. 草原與草坪2000, 89(2): 12-17)。目前,醫藥和工業上主要使用甘草的根和根莖,而其地上部分大多被廢棄或作為牲畜飼料。為了充分開發利用甘草地上部分,提高甘草資源的利用率,發明人對甘草葉的有效成分進行了研究,從中分離純化到7種聯有異戊烯基的酚類成分,包括1個新化合物(1, 見說明書圖1)。碳水化合物在人體內經過小腸α-葡萄糖苷酶等作用水解為葡萄糖吸收入血,α-葡萄糖苷酶抑制劑可以降低II型糖尿病患者餐后血糖水平,使未完全消化的二糖從腸道排出,因此,α-葡萄糖苷酶抑制劑對II型糖尿病和肥胖癥患者有益。另外,α-葡萄糖苷酶參與許多病毒外殼關鍵糖蛋白的加工成熟,其抑制劑可能成為抗病毒藥物(Manns MP, Foster GR, Rockstroh JK, Zeuzem S, Zoulim F,Houghton M. The way forward in HCV treatment?finding the right path. Nat Rev Drug Discov, 2007, 6: 991?1000)。本發明公開甘草抗氧化、抗α-葡萄糖苷酶及抗小腸二糖酶活性組分的制備方法,其主要成分特別是新的二氫茋衍生物(α, α′-二氫-3,5,3′,4′-四羥基-2,5′-二異戊烯基茋, α, α′-dihydro-3,5,3′,4′-tetrahydroxy-2,5′-diisopentenylstilben, 1)的結構、制備方法及抗氧化、抑制α-葡萄糖苷酶和小腸二糖酶活性。
技術實現要素:
本發明的目的在于開發利用甘草地上部分,提高甘草資源的利用率,并提供對肥胖癥和II型糖尿病有益的新型α-葡萄糖苷酶和小腸二糖酶抑制劑,內容包括:將甘草葉用乙醇提取, 提取液過濾濃縮后上DIAION HP20大孔樹脂用水-乙醇梯度洗脫,得到甘草葉活性組分;將該活性組分經多種色譜分離純化的甘草葉成分1-7(圖1);
本發明還提供化學結構如圖1所示的甘草葉成分1-7:
本發明的另一個方面,提供化合物1的組合物;
本發明還提供含有化合物1的藥物制劑;
本發明的又一個方面,提供化合物1用作為抗氧化劑;
本發明的再一個方面,提供化合物1在制備抗氧化劑方面的應用;
另一個方面,本發明提供化合物1及其組合物用作藥物;
本發明還提供化合物1或其組合物在抗氧化應激和/或自由基的藥物方面的應用;
本發明還提供化合物1或其組合物在預防和/或治療氧化應激和/或自由基介導的疾病的藥物方面的應用;
本發明的再一方面,提供甘草葉活性組分及化合物1或其組合物的制備方法,包括步驟如下:將甘草葉用溶劑(優選95%乙醇)提取,提取液濃縮后上DIAION HP20大孔樹脂用水-乙醇梯度洗脫,得到對小腸二糖酶抑制活性的活性組分(優選60%乙醇洗脫部位),該活性組分經分離純化得甘草葉活性成分;
該甘草葉活性組分及從中分離到的成分有很強的抗氧化活性和較強的抑制α-葡萄糖苷酶和小腸二糖酶活性。該甘草葉活性組分可直接使用,也可將其中分離純化的活性成分用于抗氧化和/或清除自由基及治療和/或預防II型糖尿病。
因此,本發明還涉及含有上述甘草葉活性組分或化合物1的組合物,還包含藥物、食品或化妝品可接受的載體。所述本發明組合物,可按常規方法,通過將所述甘草葉活性組分或純成分與藥物、食品或化妝品可接受的載體混合來制備。
在本發明甘草葉的活性成分及其結構和用途的一個優選方案中,甘草葉的活性組分及成分的制備方法和結構確定,包括以下步驟:
1)將甘草葉用95%乙醇浸泡后超聲提取,提取液濃縮懸浮于水中用DIAION HP20大孔樹脂分離,60%乙醇洗脫部分為活性組分;
2)上述活性組分經反相硅膠C18、硅膠、Sephadex-LH20、MCI及制備液相分離純化得到甘草葉純成分1-7(圖1);
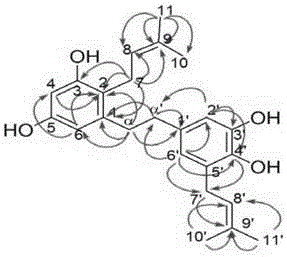
3)化合物2-7通過解析光譜數據及與文獻值(Hayashi H, Zhang S-L, Nakaizumi T, Shimura K, Yamagauchi M, Inoue K, Sarsenbaev K, Ito M, Honda G. Field survey of Glycyrrhiza plants in central Asia (2).1) Characterization of phenolics and their variation in the leaves of Glycyrrhizaplants collected in Kazakhstan. Chem Pharm Bull, 2003, 51: 1147?1152)對照確定其結構分別為6-異戊烯基槲皮素-3-甲醚(6-prenylquercetin-3-methyl ether, 2),5′-異戊烯基槲皮素(5′-prenylquercetin, 3),槲皮素-3-甲醚(quercetin-3-methyl ether, 4),6-異戊烯基圣草酚(6-prenyleriodictyol, 5),5′-異戊烯基圣草酚(5′-prenyleriodictyol, 6),8-[(順)-3-羥甲基-2-丁烯基]-圣草酚{8-[(Z)-3-hydroxymethyl-2-butenyl]-eriodictyol, 7};化合物1的結構經過仔細解析其包括二維核磁共振光譜在內的多種光譜,確定為α, α′-二氫-3,5,3′,4′-四羥基-2,5′-二異戊烯基茋(α, α′-dihydro-3,5,3′,4′-tetrahydroxy-2,5′-diisopentenylstilben)。
本發明的創造性和新發現為:發現了新結構的二氫茋衍生物 α, α′-二氫-3,5,3′,4′-四羥基-2,5′-二異戊烯基茋。得到有望對肥胖及糖尿病患者有益的甘草葉的活性組分,發現其所含的異戊烯基黃酮和異戊烯基茋均有很好的清除DPPH自由基活性,大多數成分還有較好的抑制α-葡萄糖苷酶和小腸二糖酶活性。由于結構中的異戊烯基存在,這些活性成分的極性比相應的非異戊烯基取代黃酮大為減低,可作為低極性食品、化妝品等的抗氧化劑,或作為保健食品或藥品用于肥胖或糖尿病。目前,甘草主要使用的是其根和根莖,本發明所述甘草葉的有效成分和部位為充分開發利用甘草資源提供了依據和方法。
具體實施方式
具體實施方式對本發明所涉及甘草葉成分的制備和活性測定法作進一步詳細說明。這些實施例僅用來例證本發明,不應將其視為對本發明保護范圍的限制。
實施例1:甘草葉的提取及活性組分的制備
將2公斤甘草葉(2013年9月采于內蒙古鄂爾多斯)用95%乙醇(10升)浸泡24小時后超聲提取30分鐘,過濾,殘渣再用95%乙醇6升浸泡12小時后超聲提取30分鐘。兩次提取液合并濃縮得434 g提取物。提取物懸浮于水中上樣至DIAION HP20大孔樹脂柱(6 ′ 23 cm色譜柱8個),用不同比例的乙醇-水梯度洗脫,60%乙醇洗脫物(118 g)顯示最強的抑制小腸二糖酶活性,1 mg/ml時的抑制率為64.2%。
實施例2:甘草葉活性組分中有效成分的分離純化及結構測定
上述活性部位(大孔樹脂60%乙醇洗脫部位)經反相硅膠C18色譜分離,水-甲醇梯度洗脫,50%甲醇洗脫部分經硅膠(石油醚-乙酸乙酯6:4),Sephadex-LH20(55%甲醇)和MCI(75%甲醇)分離純化得到化合物2(16mg)。反相硅膠C18色譜的40%甲醇洗脫部分上硅膠柱色譜分離,石油醚-乙酸乙酯6:4洗脫部分經Sephadex-LH20及MCI色譜分離得到化合物4(15mg)和7(119mg),石油醚-乙酸乙酯7:3洗脫部分用Sephadex-LH20分離,50-70%甲醇洗脫部分經MCI及制備液相色譜分離純化得化合物3(34mg)、5(26mg)、6(45mg)及 1(27mg)。通過解析光譜數據及與文獻值(Hayashi H,Zhang S-L,Nakaizumi T,Shimura K,Yamagauchi M,Inoue K,Sarsenbaev K,Ito M,Honda G.Field survey of Glycyrrhiza plants in central Asia(2).1)Characterization of phenolics and their variation in the leaves of Glycyrrhiza plants collected in Kazakhstan.Chem Pharm Bull,2003,51:1147-1152)對照確定了化合物2-7的結構分別為6-異戊烯基槲皮素-3-甲醚(2),5′-異戊烯基槲皮素(3),槲皮素-3-甲醚(4),6-異戊烯基圣草酚(5),5′-異戊烯基圣草酚(6),8-[(順)-3-羥甲基-2-丁烯基]-圣草酚(7)。化合物1為新化合物,通過解析多種光譜數據確定了其結構;
化合物1:類白色粉末,高分辨ESI-MS負離子模式測得準分子離子峰m/z 381.2065,為分子式C24H30O4的[M-H]-1峰(計算值:m/z 381.2066)。1H NMR(圖2)δ:1.656(3H,s)and1.698(3H,s)and 1.718(3H,s)and 1.724(3H,s)(H-10,10′,11,11′),2.596(2H,m,H-α′),2.651(2H,m,H-α),3.201(2H,d,J=7.0Hz,H-7),3.245(2H,d,J=7.0Hz,H-7′),5.047(1H,t,J=7.0Hz,H-8),5.280(1H,t,J=7.0Hz,H-8′),6.120(1H,d,J=2.5Hz,H-6),6.146(1H,d,J=2.5Hz,H-4),6.351(1H,d,J=2.5Hz,H-6′),6.480(1H,d,J=2.5Hz,H-2′);13C NMR(圖3)δ:17.90and 18.21(C-10,10′)、25.31(C-7)、25.98and 26.04(C-11,11′)、29.20(C-7′)、36.99(C-α)、38.57(C-α′)、101.33(C-4)、108.63(C-6)、113.85(C-2′)、119.06(C-2)、121.27(C-6′)、124.35(C-8′)、126.08(C-8)、129.47(C-5′)、130.51(C-9)、132.58(C-9′)、134.54(C-1′)、142.02(C-4′)、143.59(C-1)、145.85(C-3′)、156.59(C-5)、157.10(C-3);1H NMR圖譜中δ1.656到1.724的兩對甲基單峰分別與兩對雙鍵碳有HMBC相關,另有1對亞甲基的質子信號也與這兩對雙鍵碳相關,說明結構中有兩個異戊烯基。13C NMR數據提示有2個苯環存在,1H NMR光譜中出現兩對間位耦合的芳香質子信號,氫譜和碳譜還顯示有另外兩個亞甲基(CH2-α,α′)的信號,兩者均與同樣兩個芳香碳原子(C-1,1′)有HMBC(圖4)相關,另外,還分別與另外兩個芳香碳原子有HMBC相關,提示存在1,2-二苯乙烷基本骨架。該骨架與兩個異戊烯基和羥基的連接位置通過圖5所示的HMBC相關的確定,因此該化合物的結構為α,α′-二氫-3,5,3′,4′-四羥基-2,5′-二異戊烯基茋;
附圖說明
圖1.甘草葉活性成分1-7的化學結構
圖2.化合物1的1HNMR圖譜
圖3.化合物1的13CNMR圖譜
圖4.化合物1的HMBC圖譜
圖5.化合物1的HMBC主要相關。
實施例3:甘草葉提取物及大孔樹脂所得組分中化合物1-7的含量
用超高效液相-串聯四極桿電噴霧質譜(UPLC-QQQESIMS)測定成分的含量。UPLC- QQQESIMS在安捷倫Agilent 1290 infinity UPLC及 Agilent 6430 triple Quad MS上分析。優化的色譜條件為:ZORBAX Eclipse XDB-C18(2.1×50 mm,1.8 μm)色譜柱, 柱溫控制在30oC,流速設為0.4 mL/min,進樣量為1 μL;色譜流動相的A 相為含0.1%甲酸的純凈水, B相為甲醇; 流動相程序:0–4 min, 10-39% B; 4-4.1 min, 39-41% B; 4.1-8 min, 41-45% B; 8-8.1 min, 45-67% B; 8.1-12 min, 61-69% B; 12-12.1 min, 69-100% B; 12.1-14 min, 100% B。用質譜多反應監控(MRM)模式定量,優化后的質譜檢測條件列于表1;
用上述優化的定量條件對甘草葉提取物及大孔樹脂各流份分析結果列于表2。大孔樹脂60%洗脫物中這7種成份的含量最高;
實施例4:1,1-二苯基苦基苯肼(DPPH)自由基清除實驗
DPPH清除實驗參考Ma等的方法 (Ma JN. Wang SL. Zhang K. Wu ZG, Hattori M, Chen G L. Chemical components and antioxidant activity of the peels of commercial apple-shaped pear (fruit of pyrus pyrifolia cv. pingguoli). J Food Sci, 2012, 10: 1097?1102)在96孔板上測定。樣品孔含10 μl待測樣品溶液和190 μl DPPH溶液(0.1 mM),對照孔含10 μl二甲亞砜和190 μl DPPH溶液,顏色對照孔含10 μl樣品和190 μl 甲醇。避光室溫反應20 min后用酶標儀測定520 nm的吸光度(A),樣品對自由基的清除百分率用如下公式計算:
對自由基清除率%=100×[A對照- (A樣品–A顏色對照)] /A對照
A對照為對照孔的吸光度, A樣品為樣品孔的吸光度, A顏色對照為顏色對照孔的吸光度;
結果(表3)顯示,化合物1-7均有較強的清除DPPH自由基活性,除化合物2的清除DPPH半數有效濃度為13.9 μg/ml外,另外6個化合物清除DPPH自由基的半數有效濃度均小于6 μg/ml。
表3 甘草葉7種成分對DPPH的清除及對α-葡萄糖苷酶和麥芽糖酶的抑制活性
實施例5:甘草葉成分對α-葡萄糖苷酶和小腸二糖酶抑制活性
參考文獻方法(Ma CM, Sato N, Li XY, Nakamura N, Hattori M. Flavan-3-ol contents, anti-oxidative and α-glucosidase inhibitory activities of Cynomorium songaricum. Food Chem, 2010, 118: 116?119) 在96孔板上測定對α-葡萄糖苷酶抑制活性。底物溶液為2 mM的對硝基苯酚α-D-葡萄糖苷的磷酸鉀緩沖液溶液(100 mM,pH 7.0)。樣品孔含10 μl樣品和80 μl底物溶液,對照孔用10 μl DMSO代替樣品溶液。酶溶液為0.4 U/ml Bacillus Stearothermophilusα-葡萄糖苷酶。每孔加入10 μl酶溶液后在37 oC下培養20 min。培養前后均用酶標儀測定405 nm的吸光度,通過比較樣品孔的吸光度增值(ΔA樣品)與對照孔的吸光度增值(ΔA對照)用下述公式計算樣品對酶的百分抑制率:
抑制率%=100×[ (ΔA對照-ΔA樣品) ?ΔA對照]
對小腸二糖酶-麥芽糖酶的抑制活性參考Meng等的方法(Meng HC, Ma CM. Flavan-3-ol-cysteine and acetylcysteine conjugates from edible reagents and the stems of Cynomorium songaricum as potent antioxidants. Food Chem, 2013, 141: 2691?2696.)提取小腸二糖酶,用PH 7的磷酸鹽緩沖液將酶提取液稀釋10倍后在96孔板上測定活性。每孔加入3 μl樣品溶液,20 μl麥芽糖溶液(2 mg/ml)和7 μl二糖酶液。對照孔用3 μl二甲亞砜代替樣品溶液,其余同上。混勻37 oC振搖反應20 min后加入10 μl 二甲亞砜,生成的葡萄糖用南京建成的葡萄糖檢測試劑盒測定。對二糖酶的抑制百分率根據520 nm處的吸光度(A)按如下公式計算:
抑制率%=100×[ (A對照- A樣品) ? A對照]
每個樣品測量4個濃度,每個濃度測定3次,從百分抑制率-濃度曲線中求出抑制50%酶活性時的濃度(IC50);
結果(表3)顯示,除化合物7以外的6個成分均有較強的抑制α-葡萄糖苷酶活性,以化合物3和1的活性最高。化合物1, 3和7顯示了較強的抑制麥芽糖酶活性;
由于上述實例1所述甘草葉活性組分的大多數成分均有清除自由基活性和抑制α-葡萄糖苷酶活性。因此,實例1中大孔樹脂柱得到的該活性組分及實例2所得純成分預期對肥胖和糖尿病患者有益;
本實驗得到甘草活性組分的方法簡單,制備條件溫和,只使用無毒的常規試劑反應得到,適用于大批量生產。
上述僅為本發明較佳的具體實施方法,本發明保護范圍不應受此限制,熟悉本領域的技術人員在本發明的技術范圍內,以簡單變化或替換所得的技術方案均落入本發明的保護范圍。
- 還沒有人留言評論。精彩留言會獲得點贊!