含有減毒睡眠嗜組織菌的免疫組合物的制作方法
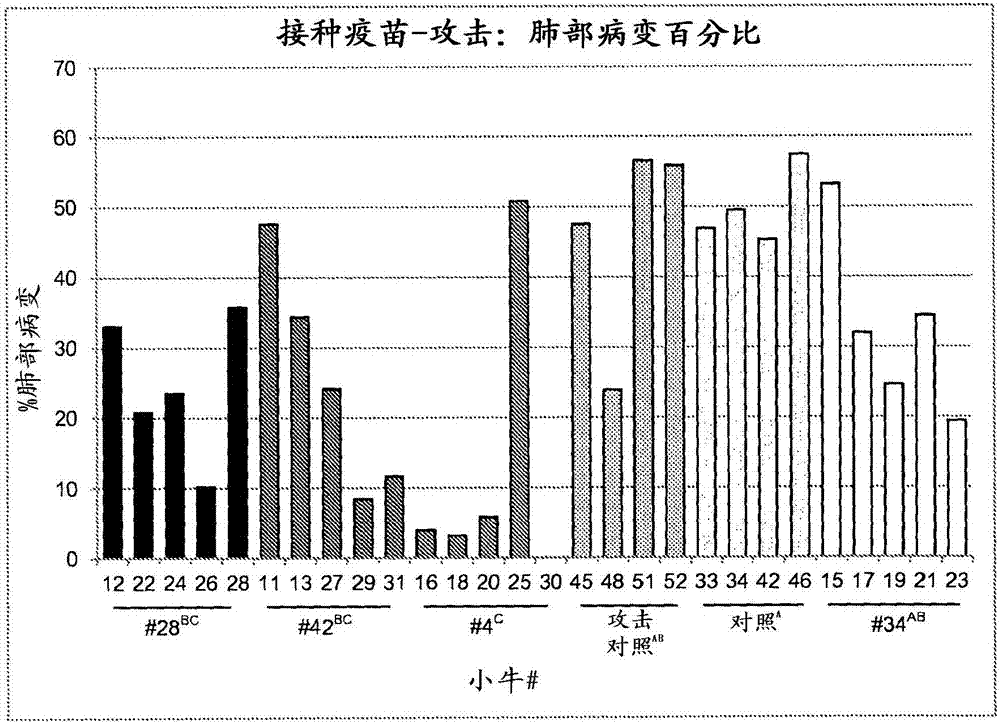
通過引用并入本申請要求2014年3月25日提交的美國臨時申請ussn61/970,195的優先權,并且所述臨時申請通過引用整體并入本文。本文中引用的所有其它參考文獻也通過引用整體并入本文。關于序列表的申明以文本格式替代紙質拷貝提供與本申請相關的序列表,并且將所述序列表在此通過引用并入本說明書。含有序列表的文本文件的名稱為mer_13_225p_st25。該文本文件為17,356kb;其創建于2014年2月20日;并在提交本說明書的同時將其通過efs-web電子提交。發明領域本發明總的來說涉及經遺傳工程化的減毒細菌疫苗,特別地為牛類提供免受由睡眠嗜組織菌(histophilussomni)(以前稱為睡眠嗜血桿菌(haemophilussomnus))引起的感染/疾病的廣泛、安全和有效的保護的那些疫苗。本發明還涉及產生該減毒細菌的方法,以及與該減毒細菌的減弱的致病性相關的核酸變異的鑒定。本發明因而涉及包含本發明的細菌(例如活的減毒細菌)的免疫原性或疫苗組合物。也可在組合物中滅活細菌;但可有利的是,所述細菌是活的減毒睡眠嗜組織菌。本發明因此還涉及用于制備和/或配制此類組合物的方法;例如,在合適的培養基上或中培養或生長或繁殖所述細菌,收獲所述細菌,任選滅活所述細菌,以及任選將其與合適的獸醫學上或藥學上可接受的載體、賦形劑、稀釋劑或媒介物和/或佐劑和/或穩定劑混合。因此,本發明還涉及細菌在配制此類組合物中的用途。發明背景牛呼吸道疾病綜合征(brdc)由多種微生物病原體組成,并對養牛業造成重大經濟損失。據估計治療成本(包括預防接種疫苗和暴發后藥物治療)將近每年40億美元(griffin,1997)。造成經濟影響的還有在診斷為brdc的動物中所觀察到的性能相關損失;平均日增重、收獲時的體重以及牛肉質量等級的可測量的損失(babcock,2010)。關于與性能降低相關的具體貨幣損失的報道不一;可能是由于對brdc的不同情況下的定義,但據估計在每只動物$40(fulton,2002)與幾乎$300(duff和gaylean2011)之間。還已顯示性能損失隨動物需要brdc治療的次數增加而顯著增加(fulton,2002)。睡眠嗜組織菌(以前稱為睡眠嗜血桿菌)已被鑒定為brdc的關鍵影響因素(duff和gaylean2011)。屬于巴氏桿菌(pasterellacea)科的該革蘭陰性多形球桿菌(pleomorphiccoccobacillus)(korczak,2004)構成牛、羊和其它反芻動物中的上呼吸道和泌尿生殖道的正常菌群的一部分(ward,2006)。它與其它牛病原體包括多殺性巴氏桿菌(pasteurellamultocida)和溶血曼氏桿菌(mannheimiahaemolytica)(這兩者也與brdc相關聯),以及人病原體杜克雷嗜血桿菌(haemophilusducreyi)和流感嗜血桿菌(haemophilusinfluenzae)密切相關(challacombe,2007)。從健康小牛的上呼吸道睡眠嗜組織菌的分離率估計高達無疾病臨床表現的50%;然而診斷為brdc的動物對于所述細菌具有甚至更高的分離率(griffin,2010)。在應激條件或免疫抑制狀態下,睡眠嗜組織菌可定殖在下呼吸道、心內膜或中樞神經系統,并且已被鑒定為多種疾病,諸如肺炎、心內膜炎、關節炎、流產、敗血癥和血栓栓塞性腦膜腦炎(teme)的病原體(ward,2006)。在屠宰時,少于15%的接受針對brdc的適當治療(預防接種疫苗和在爆發期間的適當抗生素)的動物顯示肺部病變的體征,并且這些病變牽涉不到總肺的5%(griffin,2010)。相反,50%的未接受適當護理的動物在屠宰時顯示肺部病變,并且這些病變可牽涉總肺的15%或更多(griffin,2010)。在超過10,000只動物的一個現場研究中,459頭小牛(4.6%)死于一種或另一種形式的疾病。在該研究的死亡中,279頭(60.8%)經顯示與呼吸系統疾病相關,并且在那些患有呼吸道感染的動物中,226頭(81.0%)與睡眠嗜組織菌相關肺炎、胸膜炎或膿腫相關(ribble,1988)。雖然抗生素治療可成功地響應于睡眠嗜組織菌感染,但日益增加的抗生素抗性現場分離株的流行令人關注(duff和gaylean,2011)。通過接種疫苗進行的預防護理將是優選的,因為其是積極主動的而非被動的,并且更具成本效益。目前可從不同動物保健公司獲得許多睡眠嗜組織菌疫苗;然而,這些疫苗主要由死菌苗組成,而且是在超過三十年前獲得許可的,目的在于預防teme。這些菌苗疫苗的使用已經有效對抗teme,然而已顯示其對育肥牛(feedlotcattle)的呼吸道疾病具有中性或甚至消極作用。消極副作用包括當對感染了牛呼吸道合胞病毒(brsv)的小牛接種疫苗時ige誘導的過敏性休克和相互作用(griffin,2010)。teme的流行性的減少以及始于80年代末的睡眠嗜組織菌相關肺炎(在美國)和心肌炎(在加拿大)的出現,已經導致對用于疫苗生產的有效抗原的進一步研究的需要(o'toole,2009)。睡眠嗜組織菌相關肺炎對于牛肉和乳制品行業是經濟上重大的病況。在目前可用的疫苗中很少存在現場藥效的證據,因此對于得到下一代疫苗產品的研究的需要是完全正當合理的。發明概述本發明的目的是提供用于治療和預防由睡眠嗜組織菌引起的感染的減毒細菌以及方法。在實施方案中,疫苗包含減毒睡眠嗜組織菌,其相較于更具毒力的株致病性較弱。全面的比較序列分析顯示相對于毒力更強的株,在減毒睡眠嗜組織菌株中不存在重要的毒力因子。因此,本發明的目的是提供減毒睡眠嗜組織菌,其缺乏由毒力更強的睡眠嗜組織菌株所具有的毒力因子。如本文所定義的,術語“基因”將在廣泛的意義上使用,并應包括編碼和非編碼序列(即上游和下游調控序列、啟動子、5'/3'utr、內含子和外顯子)。當旨在只提及基因的編碼序列時,術語“基因的編碼序列”或“cds”在本發明的整個說明書中可互換使用。當論述特定的核酸時,本領域技術人員將即刻擁有該序列的所有可衍生的形式(mrna、vrna、crna、dna、蛋白質等)。本發明還提供用于誘導抗睡眠嗜組織菌的免疫(或免疫原性)或保護性應答的方法,以及用于預防或治療睡眠嗜組織菌,或由睡眠嗜組織菌引起的疾病狀態的方法,包括向有此需要的動物施用所述減毒睡眠嗜組織菌,或包含該減毒睡眠嗜組織菌的組合物。此外,還提供了包含至少減毒睡眠嗜組織菌株和使用說明書的試劑盒。這些和其它實施方案已被公開的,或根據以下詳述是顯而易見的,并且被以下詳述所涵蓋。附圖簡述本發明的完整且可行的公開內容,包括本領域普通技術人員知曉的其最佳模式,更具體地示于本說明書的其余部分,包括參考附圖,其中:圖1顯示在攻擊模型中測試的每一株分離株和劑量的平均肺部病變百分比。根據對反正弦變換數據進行的學生氏t檢驗,具有不同字母的組是顯著不同的;圖2顯示其中鼻內施用疫苗的接種攻擊研究中對于每一小牛觀察到的肺部病變百分比。相同顏色的條塊代表利用同一分離株接種的動物的結果。接種分離株列于條塊下方,利用同一攻擊分離株攻擊所有動物。根據對反正弦變換數據進行的學生氏t檢驗,后跟相同字母的組是無顯著差異的。發明詳述本發明提供了參與微生物諸如細菌,例如,睡眠嗜組織菌的減毒的核苷酸序列和基因、由所述核苷酸序列編碼的產物(例如,蛋白質、抗原、免疫原、表位),用于產生此類核苷酸序列、產物、微生物的方法,及其用途,諸如用于制備疫苗或免疫原性組合物或用于引發免疫或免疫應答或作為載體,例如,作為表達載體(例如,體外或體內表達載體)。在核苷酸序列和微生物的基因中鑒定的突變產生新型且非顯而易見的減毒突變體。這些突變體用于生產具有高度免疫原性的活的減毒免疫原性組合物或活的減毒疫苗。突變的鑒定提供了新型且非顯而易見的核苷酸序列和基因,以及由該核苷酸序列和基因編碼的新型且非顯而易見的基因產物。在實施方案中,本發明提供了能夠在牛中提供抗睡眠嗜組織菌或由睡眠嗜組織菌引起的疾病的安全有效的免疫應答的減毒睡眠嗜組織菌株。在一個方面,本發明提供了在核苷酸序列或基因中含有減毒突變的細菌,其中所述突變改變由基因編碼的多肽或蛋白質的生物活性,導致減毒的細菌毒力。具體地,本發明包括在動物中引發免疫原性應答的減毒睡眠嗜組織菌株和包含其的疫苗,特別是在牛中引發、誘導或刺激應答的減毒睡眠嗜組織菌株。特定的目標睡眠嗜組織菌減毒株相對于強毒株在基因中具有突變。應當認識到,除了具有所公開的突變的株以外,具有任意數量的在公開的毒力基因中的突變的減毒株也可用于本發明的實施。在另一個方面,將該新型減毒睡眠嗜組織菌株配制成抗睡眠嗜組織菌和由睡眠嗜組織菌引起的感染/疾病的安全有效的疫苗。在實施方案中,所述減毒睡眠嗜組織菌株能夠在牛中提供抗睡眠嗜組織菌或由睡眠嗜組織菌引起的疾病的安全有效的免疫應答。在具體的實施方案中,減毒株相對于另外的遺傳上相似的強毒株缺少一個或若干個毒力基因。在實施方案中,減毒株缺乏和/或不表達糖苷水解酶家族蛋白(hsm_1160)和脂蛋白(hsm_1714)。其缺失也可促成菌株的減毒表型的基因包括:多銅氧化酶3型(hsm_1726)和tetr家族轉錄調節劑(hsm_1734)。在甚至更具體的實施方案中,所述減毒株與在名稱pta-121029下保藏在atcc中的菌株相同。在實施方案中,可鼻內或皮下施用所述菌株。在另一個方面,本發明包括包含所公開的減毒睡眠嗜組織菌株的免疫組合物。所述組合物還可包含藥學上或獸醫學上可接受的媒介物、稀釋劑或賦形劑。在實施方案中,所述組合物可在牛中提供抗隨后的強毒睡眠嗜組織菌攻擊的安全和保護性免疫應答。在另一個實施方案中,所述組合物可包含遺傳工程化的非天然存在的減毒睡眠嗜組織菌株,該菌株適合用于安全有效的疫苗制劑,并且具有至少以下突變的基因,包括所述基因被完全缺失,以消除所述基因表達其同源基因產物的能力:hsm_0270、hsm_0338、hsm_0377、hsm_0598、hsm_0708、hsm_0749、hsm_0953、hsm_1160、hsm_1191、hsm_1257、hsm_1426、hsm_1616、hsm_1624、hsm_1728、hsm_1730、hsm_1734、hsm_1736、hsm_1737、hsm_1741、hsm_1793和hsm_1889。在具體的實施方案中,工程化的睡眠嗜組織菌株相較于tk#4具有相同的減毒表型。在相關實施方案中,所述組合物可包含遺傳工程化的非天然存在的減毒睡眠嗜組織菌株,該菌株適合用于安全有效的疫苗制劑,并且具有足夠數量的以下突變的基因,包括所述基因被完全缺失,以消除所述基因表達其同源基因產物的能力:hsm_0270、hsm_0338、hsm_0377、hsm_0598、hsm_0708、hsm_0749、hsm_0953、hsm_1160、hsm_1191、hsm_1257、hsm_1426、hsm_1616、hsm_1624、hsm_1728、hsm_1730、hsm_1734、hsm_1736、hsm_1737、hsm_1741、hsm_1793和hsm_1889。在具體的實施方案中,工程化的睡眠嗜組織菌株相較于tk#4具有相同的減毒表型。在另一個實施方案中,所述組合物可包含遺傳工程化的非天然存在的減毒睡眠嗜組織菌株,該菌株適合用于安全有效的疫苗制劑,并且具有至少以下突變的基因,包括所述基因被完全缺失,以消除所述基因表達其同源基因產物的能力:hsm_0077、hsm_0270、hsm_0708、hsm_0975、hsm_1191、hsm_1257、hsm_1448、hsm_1542、hsm_1571、hsm_1624、hsm_1714、hsm_1726、hsm_1728、hsm_1730、hsm_1734、hsm_1736、hsm_1737、hsm_1741和hsm_1793。在具體的實施方案中,工程化的睡眠嗜組織菌株相較于tk#42具有相同的減毒表型。在相關實施方案中,所述組合物可包含遺傳工程化的非天然存在的減毒睡眠嗜組織菌株,該菌株適合用于安全有效的疫苗制劑,并且具有足夠數量的以下突變的基因,包括所述基因被完全缺失,以消除所述基因表達其同源基因產物的能力:hsm_0077、hsm_0270、hsm_0708、hsm_0975、hsm_1191、hsm_1257、hsm_1448、hsm_1542、hsm_1571、hsm_1624、hsm_1714、hsm_1726、hsm_1728、hsm_1730、hsm_1734、hsm_1736、hsm_1737、hsm_1741和hsm_1793。在具體的實施方案中,工程化的睡眠嗜組織菌株相較于tk#42具有相同的減毒表型。在另一個實施方案中,所述組合物可包含遺傳工程化的非天然存在的減毒睡眠嗜組織菌株,該菌株適合用于安全有效的疫苗制劑,并且具有至少以下突變的基因,包括所述基因被完全缺失,以消除所述基因表達其同源基因產物的能力:hsm_0268、hsm_0270、hsm_0274、hsm_0598、hsm_0708、hsm_0749、hsm_0938、hsm_1022、hsm_1160、hsm_1191、hsm_1212、hsm_1257、hsm_1542、hsm_1571、hsm_1667、hsm_1728、hsm_1730、hsm_1736、hsm_1737、hsm_1741、hsm_1793和hsm_1889。在具體的實施方案中,工程化的睡眠嗜組織菌株相較于tk#34具有相同的減毒表型。在相關實施方案中,所述組合物可包含遺傳工程化的非天然存在的減毒睡眠嗜組織菌株,該菌株適合用于安全有效的疫苗制劑,并且具有足夠數量的以下突變的基因,包括所述基因被完全缺失,以消除所述基因表達其同源基因產物的能力:hsm_0268、hsm_0270、hsm_0274、hsm_0598、hsm_0708、hsm_0749、hsm_0938、hsm_1022、hsm_1160、hsm_1191、hsm_1212、hsm_1257、hsm_1542、hsm_1571、hsm_1667、hsm_1728、hsm_1730、hsm_1736、hsm_1737、hsm_1741、hsm_1793和hsm_1889。在具體的實施方案中,工程化的睡眠嗜組織菌株相較于tk#34具有相同的減毒表型。現在,本申請人已公開這些充足組的減毒基因缺失,本領域技術人員將理解,只有非常規工作才仍然需確定這些基因缺失的哪個亞組合是產生可比較的或等效的減毒睡眠嗜組織菌疫苗株所必需的。在另一個實施方案中,所述組合物還可包含至少一種與除睡眠嗜組織菌外的牛病原體相關的或來源于其的另外的抗原。在實施方案中,至少一種或多種另外的抗原能夠在牛中引發抗睡眠嗜組織菌、牛呼吸道疾病綜合征(brdc)、牛呼吸道合胞病毒(brsv)、牛病毒性腹瀉(bvd)、牛副流感3(pi3)、牛傳染性鼻氣管炎(ibr)、牛皰疹病毒-1(bhv-1)、藍舌病病毒(btv)或能夠在牛中感染和引起疾病或對疾病的易感性的任何其它病原體的免疫應答。在另一個方面,本發明提供了對動物接種疫苗的方法,其包括施用公開的包含減毒睡眠嗜組織菌株的免疫組合物的至少一種。在實施方案中,所述睡眠嗜組織菌疫苗還包含佐劑。在具體的實施方案中,所述佐劑包含全細菌和/或細菌,包括梭菌屬(clostridium)、睡眠嗜組織菌、曼氏桿菌屬(mannheimia)、巴氏桿菌屬(pasteurella),嗜組織菌(histophilus)、沙門氏菌(salmonella)、大腸桿菌(escherichiacoli)或其組合和/或變異。在幾個實施方案中,所述佐劑增加動物的igm、igg、iga和/或其組合的產生。在另一個實施方案中,本發明提供了減毒睡眠嗜組織菌(h.somni)株,其能夠在牛類動物中提供抗睡眠嗜組織菌,或由睡眠嗜組織菌引起的疾病的安全有效的免疫應答;其中所述減毒株相對于參照毒睡眠嗜組織菌株在其基因組序列中缺乏最少數量的毒力因子編碼基因,以使減毒株不能在牛類動物中引發感染。在實施方案中,參照強毒株包含基因組dna序列,其編碼至少約99%的與如seqidno:2中所示的序列所編碼的基因相同的基因。在其它實施方案中,所述減毒株編碼編碼至少約99%的與如seqidno:1、3、4或5中所示的序列所編碼的基因相同的基因。在具體的實施方案中,所述減毒株以約等于或低于(包括不可檢測的水平)由在其基因組中具有如seqidno:1、3、4或5中所示的序列的減毒株表達的對應毒力基因的水平的水平,表達任何毒力因子基因。在具體的實施方案中,所述減毒株相對于睡眠嗜組織菌株2336,缺乏至少約99%的與睡眠嗜組織菌株#4相同的基因。在該實施方案中,菌株2336包含基因組序列,其編碼至少約99%的與如seqidno:6中所示的序列所編碼的基因相同的基因;以及菌株#4包含基因組序列,其編碼至少約99%的與如seqidno:1中所示的序列所編碼的基因相同的基因。在具體的實施方案中,減毒株是#4分離株(即,tk#4),其在名稱pta-121029下被保藏在atcc中。在另一個實施方案中,減毒株是#42分離株(即,tk#42),其在名稱pta-121030下被保藏在atcc中。在另一個方面,本發明提供了包含本文所述的減毒株中的任一種的免疫組合物。在實施方案中,所述組合物包含減毒株,其編碼至少約99%的與如seqidno:1、3、4或5中所示的序列所編碼的基因相同的基因。在一個具體的實施方案中,所述減毒株編碼至少約99%的與如seqidno:1中所示的序列所編碼的基因相同的基因。在相關實施方案中,所述減毒株編碼所有與如seqidno:1中所示的序列所編碼的基因相同的基因。在一個實施方案中,所述減毒株編碼至少約99%的與如seqidno:4中所示的序列所編碼的基因相同的基因。在相關實施方案中,所述減毒株編碼所有與如seqidno:4中所示的序列所編碼的基因相同的基因。在另一個實施方案中,所述減毒株編碼至少約99%的與如seqidno:3中所示的序列所編碼的基因相同的基因。在相關實施方案中,所述減毒株編碼所有與如seqidno:3中所示的序列所編碼的基因相同的基因。在另一個實施方案中,所述減毒株編碼至少約99%的與如seqidno:5中所示的序列所編碼的基因相同的基因。在相關實施方案中,所述減毒株編碼所有與如seqidno:5中所示的序列所編碼的基因相同的基因。在實施方案中,所述免疫組合物還包含藥學和獸醫學上可接受的媒介物、稀釋劑或賦形劑。在具體的實施方案中,免疫組合物能夠在牛類動物中引發保護性免疫應答,這可保護牛免受隨后對強毒睡眠嗜組織菌株的暴露的侵害。在另一個實施方案中,所述免疫組合物還包含至少一種或多種另外的抗原,其能夠在牛類動物中引發病原體特異性免疫應答。在具體的實施方案中,所述至少一種或多種另外的抗原在牛中引發足以保護動物免受隨后對所述抗原所源自的病原體的暴露的侵害的免疫應答。因此,如果牛pi3抗原被包含作為免疫組合物的組分,則所述組合物應引發保護性免疫應答。在另一個實施方案中,所述另外的抗原能夠在牛類動物中引發免疫應答,這將增強動物的抗隨后對牛呼吸道疾病綜合征、brsv、bvd、pi3或能夠在牛類動物中感染和引起疾病或對疾病的易感性的任何其它病原體的暴露的免疫應答。例如,brsv抗原將提供抗隨后對強毒brsv的暴露的保護。在另一個方面,本發明提供了對牛類動物接種疫苗的方法,其包括對所述牛類動物施用至少一個劑量的如本文所述的免疫學組合物的步驟。“抗原”或“免疫原”是指誘導宿主動物的特異性免疫應答的物質。抗原可包括整個生物體(被殺死的、減毒的或活的);生物體的亞單位或部分;含有具有免疫原性性質的插入物的重組載體;能夠在呈遞至宿主動物后誘導免疫應答的dna的碎片或片段;多肽、表位、半抗原或其任意組合。或者,所述免疫原或抗原可包括毒素或抗毒素。術語“蛋白質”、“肽”、“多肽”和“多肽片段”在本文中可互換使用,是指具有任何長度的氨基酸殘基的聚合物。所述聚合物可以是直鏈或支鏈的,其可包含經修飾的氨基酸或氨基酸類似物,并且其可被除氨基酸外的化學部分中斷。該術語還包括已被天然修飾或通過人工干預修飾的氨基酸聚合物;例如二硫鍵形成、糖基化、脂質化、乙酰化、磷酸化或任何其它操作或修飾,諸如與標記組分或生物活性組分的綴合。如本文中所用,術語“免疫原性或抗原性多肽”包括在一旦向宿主施用,其就能夠激發針對該蛋白質的體液和/或細胞類型的免疫應答的意義上具有免疫活性的多肽。優選地,所述蛋白質片段是這樣的蛋白質片段,其具有與總蛋白質基本相同的免疫活性。因此,根據本發明的蛋白質片段包含至少一個表位或抗原決定簇或基本上由其組成或由其組成。如本文中所使用,“免疫原性”蛋白質或多肽,包括該蛋白質的全長序列,其類似物,或其免疫原性片段。“免疫原性片段”意指包括一個或多個表位,從而引起上述免疫應答的蛋白質的片段。此類片段可使用許多本領域中眾所周知的表位作圖技術來鑒定。見,例如,epitopemappingprotocolsinmethodsinmolecularbiology,第66卷(glenne.morris,編輯,1996)。例如,線性表位可通過例如以下過程來確定:在固相載體上同時合成大量肽,所述肽對應于蛋白質分子的部分,將所述肽與抗體反應,同時所述肽仍然附接于所述載體。此類技術在本領域中已知的,并描述于,例如,美國專利號4,708,871;geysen等,1984;geysen等,1986。類似地,構象表位可通過測定氨基酸的空間構象(諸如通過,例如x-射線晶體學和二維核磁共振)來容易地鑒定。見,例如,epitopemappingprotocols,同上。在pct/us2004/022605(通過引用整體并入本文)中全面地描述了特別適用于t.parva的蛋白質的方法。如本文中所討論的,本發明涵蓋抗原性多肽的活性片段和變體。因此,術語“免疫原性或抗原性多肽”還設想了針對序列的缺失、添加和取代,只要所述多肽有效發揮產生如本文所定義的免疫應答的功能。術語“保守變異”意指另一種生物學類似的殘基對氨基酸殘基的替代,或使得編碼的氨基酸殘基不改變或為另一個生物學類似的殘基的核酸序列中的核苷酸的替代。在這方面,特別優選的取代在性質上通常是保守的,即在氨基酸的家族內發生的那些取代。例如,氨基酸一般分為四個家族:(1)酸性--天冬氨酸和谷氨酸;(2)堿性--賴氨酸、精氨酸、組氨酸;(3)非極性--丙氨酸、纈氨酸、亮氨酸、異亮氨酸、脯氨酸、苯丙氨酸、甲硫氨酸、色氨酸;和(4)不帶電的極性--甘氨酸、天冬酰胺、谷氨酰胺、胱氨酸、絲氨酸、蘇氨酸、酪氨酸。苯丙氨酸、色氨酸和酪氨酸有時被分類為芳香族氨基酸。保守變異的實例包括一個疏水殘基諸如異亮氨酸、纈氨酸、亮氨酸或甲硫氨酸取代另一個疏水殘基,或者一個極性殘基取代另一個極性殘基,諸如精氨酸取代賴氨酸、谷氨酸取代天冬氨酸或谷氨酰胺取代天冬酰胺等;或對生物活性不會具有重大影響的結構上相關的氨基酸對氨基酸的類似保守替代。基本上不影響蛋白質的免疫原性,具有與參照分子基本上相同的氨基酸序列,但具有最小氨基酸取代的蛋白質因而在參照多肽的定義之內。所有由通過這些修飾所產生的多肽均包括在本文中。術語“保守變異”還包括使用取代的氨基酸替代未取代的親代氨基酸,只要針對所述取代的多肽產生的抗體也與所述未取代的多肽免疫反應。術語“表位”是指特異性b細胞和/或t細胞對其作出響應的抗原或半抗原上的部位。該術語也可與“抗原決定簇”或“抗原決定位點”互換地用。可以在顯示一種抗體阻斷另一種抗體對靶抗原的結合的能力的簡單免疫測定中鑒定識別相同表位的抗體。針對組合物或疫苗的“免疫應答”針對目標組合物或疫苗的細胞和/或抗體介導的免疫應答在宿主中的產生。通常,“免疫應答”包括但不限于以下效應的一種或多種:特異性地針對目標組合物或疫苗中包含的抗原的抗體、b細胞、輔助t細胞和/或細胞毒性t細胞的產生。優選地,宿主將表現出治療性或保護性免疫學應答,以使得針對新感染的抗性將得以增強和/或疾病的臨床嚴重度被減輕。此類保護將通過通常由受感染的宿主所表現出的癥狀和/或臨床疾病體征的減輕或不存在、更快的恢復時間和/或受感染的宿主中降低的病毒滴度來有證明。“動物”是指哺乳動物、鳥類等。如本文中所用的動物或宿主包括哺乳動物和人。動物可以選自馬科動物(例如,馬)、犬科動物(例如,狗、狼、狐貍、叢林狼、豺),貓科動物(例如,獅子、老虎、家貓、野貓,其它大型貓科動物,和其它貓科動物,包括獵豹和山貓)、羊(ovine)(例如,綿羊)、牛類動物(例如,牛、小牛、公牛(steers)、公牛(bulls))、豬(procine)(例如、豬(pig))、禽類(例如,雞、鴨、鵝、火雞、鵪鶉、雉、鸚鵡、雀、鷹、烏鴉、鴕鳥、鴯鹋和食火雞)、靈長類動物(例如,狐猴、眼鏡猴、猴、長臂猿、猿)、雪貂、海豹和魚。術語“動物”還包括在各個發育階段(包括新生兒、胚胎和胎兒階段)的個體動物。除非另有解釋,否則本文使用的所有技術和科學術語具有與由本領域的普通技術人員通常理解的含義相同的含義。除非上下文另外明確指出,否則單數術語“一個/種(a)”、“一個/種(an)”和“該(the)”包括復數指代物。類似地,除非上下文另外明確指出,否則單詞“或”旨在包括“和”。應指出的是,在本公開中,特別是在權利要求和/或段落中,術語諸如“包含(comprises)”、“包括(comprised)”,“含有(comprising)”等可具有在美國專利法中歸于其的含義;例如,它們可以意指“包括(includes)”,“含有(included)”,“包含(including)”等;并且術語諸如“基本上由...組成(consistingessentiallyof)”和“基本上由...組成(consistsessentiallyof)”具有在美國專利法中規定它們的含義,例如,它們允許未明確列舉的元素,但排除在現有技術中發現的元素或影響本發明的基本或新型特性的元素。組合物本發明涉及睡眠嗜組織菌疫苗或組合物,其可包含減毒睡眠嗜組織菌株和藥學上或獸醫學上可接受的載體、賦形劑或媒介物,其引發、誘導或刺激動物的應答。術語“核酸”和“多核苷酸”是指rna或dna,其是直鏈或支鏈的,單鏈或雙鏈的,或其雜交體。該術語還包括rna/dna雜交體。以下是多核苷酸的非限定性實例:基因或基因片段、外顯子、內含子、mrna、trna、rrna、核酶、cdna,重組多核苷酸、支鏈多核苷酸、質粒、載體、具有任何序列的分離的dna、具有任何序列的分離的rna、核酸探針和引物。多核苷酸可包含經修飾的核苷酸,諸如甲基化核苷酸和核苷酸類似物、尿嘧啶、其它糖和連接基團諸如氟代核糖(fluororibose)和硫醇鹽,以及核苷酸支鏈。核苷酸的序列可以在聚合后諸如通過綴合用標記組分進一步修飾。包括在此定義內的其它類型的修飾是加帽、類似物對一個或多個天然存在的核苷酸的取代,以及用于將多核苷酸附接于蛋白質的裝置的引入、金屬離子、標記組分、其它多核苷酸或固相載體。所述多核苷酸可以通過化學合成獲得或源自微生物。術語“基因”被廣泛地用于指與生物學功能相關的多核苷酸的任何區段。因此,基因包括內含子和外顯子(如在基因組序列中),或者僅僅編碼序列(如在cdna中)和/或它們的表達所需的調控序列。例如,基因也指表達mrna或功能性rna,或編碼特定蛋白質,以及包括調控序列的核酸片段。“分離的”生物組分(諸如核酸或蛋白質或細胞器)是指已被基本上與所述組分天然存在于其中的生物體的細胞中的其它生物組分(例如其它染色體和染色體外dna和rna、蛋白質和細胞器)分離或純化出來的組分。已被“分離”的核酸和蛋白質包括通過標準純化方法純化的核酸和蛋白。該術語還包括通過重組技術以及化學合成制備的核酸和蛋白質。術語“保守變異”意指另一個生物學上類似的殘基對氨基酸殘基的替代,或核酸序列中的核苷酸的替代,使得所編碼的氨基酸殘基不改變或為另一個生物學上類似的殘基。在這方面,特別優選的取代通常在性質上是保守的,如上文中所述的。術語“重組”意指非天然存在的或以在自然界中未被發現的排列連接于另一個多核苷酸的半合成或合成來源的多核苷酸。“異源的”意指來源于與將與其比較的實體的其余部分遺傳上不同的實體。例如,多核苷酸可通過基因工程技術被置于來源于不同來源的質粒或載體中,從而為異源多核苷酸。從其天然編碼序列中取出并可操作地連接于除所述天然序列外的編碼序列的啟動子是異源啟動子。本發明的多核苷酸可以包括另外的序列,諸如同一轉錄單位內的另外的編碼序列、控制元件諸如啟動子、核糖體結合位點、5'utr、3'utr、轉錄終止子、多腺苷酸化位點、在同一或不同啟動子控制之下的另外的轉錄單位、允許克隆、表達、同源重組和宿主細胞的轉化的序列,以及可期望提供本發明的實施方案的任何此類構建體。使用方法和制品本發明包括以下方法實施方案。在實施方案中,公開了對動物接種疫苗的方法,其包括向動物施用包含減毒睡眠嗜組織菌株和藥學上或獸醫學上可接受的載體、賦形劑或媒介物的組合物。在該實施方案的一個方面,所述動物是牛。在本發明的一個實施方案中,可使用初免-加強方案,其由至少一次初始施用和至少一次使用至少一種共同的多肽、抗原、表位或免疫原的加強施用組成。通常,初始施用中使用的免疫學組合物或疫苗在性質上與用作加強劑的那些組合物或疫苗不同。然而,要指出的是,可將相同的組合物用作初始施用和加強施用。該施用操作方案被稱為“初免-加強”。初免-加強方案包括至少一個初始施用和至少一次使用至少一種共同的多肽和/或其變體或片段的加強施用。初始施用中使用的疫苗在性質上可與用作較后的加強疫苗的那些疫苗不同。初始施用可包括一次或多次施用。類似地,加強施用可包括一次或多次施用。基于細菌抗原的用于為哺乳動物的目標物種的組合物的劑量體積,例如,牛(cattle)或牛類(bovine)組合物的劑量體積,通常為約0.1至約2.0ml、約0.1至約1.0ml和約0.5ml至約1.0ml。可在最后一次免疫后約3-5周,通過用睡眠嗜組織菌的異源強毒株攻擊動物諸如牛來測試疫苗的功效。可鼻內、氣管內和/或經氣管攻擊動物。可在攻擊前和攻擊后收集來自鼻腔、氣管、肺、腦和/或口的樣品,并可分析所述樣品中睡眠嗜組織菌特異性抗體的存在。用于初免-加強操作方案的包含本發明的減毒病毒株的組合物包含在藥學上或獸醫學上可接受的媒介物、稀釋劑或賦形劑中。本發明的操作方案保護動物免受睡眠嗜組織菌的侵害和/或阻止受感染的動物的疾病進展。各種施用優選為一次注射劑量(one-shotdosage),但可間隔1至6周進行多個劑量。優選的時間間隔是2至3周,并且還設想了每年一次的加強。在實施方案中,向約5至約6周齡的小牛施用組合物。在另一個實施例中,小牛可以是約3至4周齡。本領域技術人員應理解的是,本文中的公開內容通過舉例的方式提供,并且本發明不限于此。根據本文中的公開內容和本領域的知識,本領域技術人員能夠確定施用次數、施用途徑,和待用于每個注射操作方案的劑量,而無需任何過度實驗。本發明的另一個實施方案是用于在動物中引發或誘導針對睡眠嗜組織菌的免疫或保護性應答的方法的試劑盒,其包含減毒睡眠嗜組織菌株的組合物或疫苗,以及用于以在動物中引發免疫應答的有效量進行遞送的方法的說明書。本發明的另一個實施方案是用于在動物中誘導針對睡眠嗜組織菌的免疫或保護性應答的方法的試劑盒,其包括包含本發明的減毒睡眠嗜組織菌株的組合物或疫苗,以及用于以在動物中引發免疫應答的有效量進行遞送的方法的說明書。藥學上或獸醫學上可接受的載體或媒介物或賦形劑對于本領域技術人員來說是眾所周知的。例如,藥學或獸醫學上可接受的載體或媒介物或賦形劑可以是0.9%nacl(例如,鹽水)溶液或磷酸鹽緩沖液。可用于本發明的方法的其它藥學或獸醫學上可接受的載體或媒介物或賦形劑包括、但不限于聚(l-谷氨酸)或聚乙烯吡咯烷酮。藥學上或獸醫學上可接受的載體或媒介物或賦形劑可以是有利于施用減毒細菌的任何化合物或化合物的組合。劑量和劑量體積在本文中在一般性描述中進行了論述,并且還由本領域技術人員結合本領域的知識根據本公開內容的閱讀來決定,而無需任何過度實驗。雖然在不使用佐劑的情況下獲得所公開的結果,但免疫組合物和疫苗還可包含適當的佐劑或基本上由其組成。用于本發明的實施的合適的佐劑是(1)丙烯酸或甲基丙烯酸、馬來酸酐的聚合物和烯基衍生物聚合物,(2)免疫刺激序列(iss),諸如具有一個或多個非甲基化的cpg單位的寡脫氧核糖核苷酸序列(klinman等,1996;wo98/16247),(3)水包油乳液,諸如在由m.powell,m.newman,plenumpress1995出版的“vaccinedesign,thesubunitandadjuvantapproach”的第147頁中描述的spt乳液,和同一著作的第183頁中描述的乳液mf59,(4)含季銨鹽的陽離子脂質,例如dda,(5)細胞因子,(6)氫氧化鋁或磷酸鋁,(7)皂苷或(8)任何引用的以及通過引用并入本申請的文件中論述的其它佐劑,或(9)其任意組合或混合物。在實施方案中,佐劑包括促進通過粘膜襯里的提高的吸收的那些佐劑。一些實例包括mpl、ltk63、毒素、plg微粒和若干其它佐劑(vajdy,m.immunologyandcellbiology(2004)82,617–627)。在實施方案中,佐劑可以是殼聚糖(vanderlubben等2001;patel等2005;majithiya等2008;美國專利系列號5,980.912)。參考文獻alekshun,m.n.andlevy,s.b.2007.molecularmechanismsofantibacterialmultidrugresistance.cell.128(6):1037-1050.asgarali,a.stubbs,k.a.,oliver,a.,vocaldo,d.j.,andmark,b.l.2009.inactivationoftheglycosidehydrolasenagzattenuatesantipseudomonalβ-lactamresistanceinpseudomonasaeruginosa.antimicrobialagentsandchemotherapy.53(6):2274-2282.aubry,cetal.2011.oata,apeptidoglycano-acetyltransferaseinvolvedinlisteriamonocytogenesimmuneescape,iscriticalforvirulence.j.infect.dis.204(5):731-740.babcock,a.h.2010.epidemiologyofbovinerespiratorydiseaseandmortalityincommercialfeedlots.kansasstateuniversity(doctoraldissertation).berghaus,l.j.,corbeil,l.b.,berghaus,r.d.,kalina,w.v.,kimball,r.a.,andgershwin,l.j.2006.effectsofdualvaccinationforbovinerespiratorysyncytialvirusandhaemophilussomnusonimmuneresponses.vaccine.24:6018-6027.brown,n.l.,stoyanov,j.v.,kidd,s.p.,andhobmanj.l.2003.themerrfamilyoftranscriptionalregulators.femsmicrobiologyreviews.27:145-163.challacombeetal.2007.completegenomesequenceofhaemophilussomnus(histophilussomni)strain129ptandcomparisontohaemophilusducreyi35000hpandhaemophilusinfluenzaerd.journalofbacteriology189(5);p1890-1898.corbeil,l.b.et.al.1985.serumsusceptibilityofhaemophilussomnusfrombovineclinicalcasesandcarriers.journalofclinicalmicrobiology.22(2):192-198.cox,a.d.,howard,m.d.,brisson,j.-r.,vanderzwanm.,thibault,p.,perry,m.b.,andinzana,t.j.1998.structuralanalysisofthephase-variablelipooligosaccharidefromhaemophilussomnusstrain738.europeanjournalofbiochemistry.97:253(2):507-516.dainesd.a.,jarischj.,andsmitha.l.2004.identificationandcharacterizationofanontypeablehaemophilusinfluenzaeputativetoxin-antitoxinlocus.bmcmicrobiol.jul26;4:30.duffandgaylean2011.recentadvancesinmanagementofhighlystressed,newlyreceivedfeedlotcattle.journalofanimalscience.85;p823-840.garbe,j.andcollin,m.2012.bacterialhydrolysisofhostglycoproteins–powerfulproteinmodificationandefficientnutrientacquisition.journalofinnateimmunity.4:121-131.fulton,r.w.etal.2002.evaluationofhealthstatusofcalvesandtheimpactonfeedlotperformances:assessmentofaretainedownershipprogramforpostweaningcalves.can.j.vet.res.66,173-180.geertsema,r.s.,worby,c.,kruger,r.p.,tagawa,y.,russo,r.,herdman,d.s.,lo,k.kimball,r.a.,dixon,j.,andcorbeil,l.b.2008.protectionofmiceagainsth.somnisepticemiabyvaccinationwithrecombinantimmunoglobulinbindingproteinsubunits.vaccine.26:4506-4512.gershwin,l.j.,berghaus,l.j.arnold,k.,anderson,m.l.,andcorbeil,l.b.2005.immunemechanismsofpathogenicsynergyinconcurrentbovinepulmonaryinfectionwithhaemophilussomnusandbovinerespiratorysyncytialvirus.2005.veterinaryimmunologyandimmunopathology.107:119-130.griffin,d.2010,bovinepasteurellosisandotherbacterialinfectionsoftherespiratorytract.vet.clin.northam.foodanim.pract.26(1);p57-71.griffin,d.1997.economicimpactassociatedwithrespiratorydiseaseinbeefcattle.vet.clin.northam.foodanim.pract.13;p367-377.guzmán-brambila,cetal.2012.twooutermembranelipoproteinsfromh.somniareimmunogenicinrabbitsandsheepandinduceprotectionagainstbacterialchallengeinmice.clinicalandvaccineimmunology.19(11):1826-1832.huston,w.m.,jennings,m.p.,mcewan,a.g.2002.themulticopperoxidaseofpseudomonasaeruginosaisaferroxidasewithacentralroleinironacquisition.molecularmicrobiology.45(6):1741-1750.kahler,c.et.al.1996.igtfandrfakconstitutethelipooligosaccharideice(innercoreextension)biosynthesisoperonofn.meningitidis.j.bacteriology.dec.6677-6684.kjos,m.,snipen,l.,salehian,z.,nes,i.f.,anddiep,d.b.2010.theabiproteinsandtheirinvolvementinbacteriocinself-immunity.journalofbacteriology.192(8):2068-2076.korczaket.al.2004.phylogenyofthefamilypasteurellaceaebasedonrpobsequences.internationaljournalofsystemicandevolutionarymicrobiology.54;p1393-1399.liu,t.et.al.2008.immunologicalresponsesagainsts.entericaserovartyphimuriumbraunlipoproteinandlipidamutantstrainsinswiss-webstermice:potentialuseaslive-attenuatedvaccines.microbialpathogenesis.44(3):224-237.perera,i.c.andgrove,a.2010.molecularmechanismsofligand-mediatedattenuationofdnabindingbymarrfamilytranscriptionalregulators.jmcb.2(5):243-254.o'tooleetal.2009.diagnosticexercise:myocarditisduetohistophilussomniinfeedlotandbackgroundedcattle.veterinarypathology.46;p1015-1017.ramos,j.l.,martinez-bueno,m.,molina-henares,a.j.,terán,w.,watanabe,k.,zhang,x.,trinidadgallegos,m.,brennan,r.,andtobes,r.2005.thetetrfamilyoftranscriptionalrepressors.mmbr.69:326-356.ribbleetal.1988.efficacyofimmunizationoffeedlotcattlewithacommercialhaemophilussomnusbacterin.canadianjournalofveterinaryresearch.52;p191-198.aetal.1994.cloningandcharacterizationofadnaregionencodingastress-sensitiverestrictionsystemfromcorynebacteriumglutamicumatcc13032andanalysisofitsroleinintergenicconjugationwithe.coli.j.bacteriology.176(23):7309-7319.wardetal.2006.haemophilussomnus(histophilussomni)inbighornsheep.canadianjournalofveterinaryresearch.70;p.34-42.現通過以下非限定性實施例進一步描述本發明。實施例文獻已報道了許多睡眠嗜組織菌毒力因子。單一毒力因子似乎不能主導病原體的作用,而是若干因子表現出協同作用以產生給定的分離株毒力。已鑒定了7個毒力因子:dr2(在涉及對血清的抗性的ibpa結構域內含有保守的細胞毒性fic基序的同向重復)、hsst-i(cmp-neu5ac-β-gal-α-(2-3)-唾液酰基轉移酶,其中脂寡糖(los)的唾液酸化已被證明能夠抑制抗體結合)、lob2b(編碼參與los合成的糖基轉移酶)、nan裂合酶(n-乙酰神經氨酸裂合酶,涉及唾液酸代謝)、nan差向異構酶(n-乙酰甘露糖胺-6-磷酸-2-差向異構酶,涉及碳水化合物的運輸和代謝)、luxs(涉及ai-2群體感應)和uspe(在生物膜形成中細胞運動和聚集所必需的通用應激蛋白)。引物被設計來擴增這些基因中的每一個基因,并且優化pcr反應參數。選擇50個分離株用于篩選。分離株選擇的標準是它們必須在本研究開始的大約一年內被分離,并且必須來自多樣化的地理位置或來自具有高度可能的基因型多樣性的特別有意義的病例。這樣做的目的是為了尋找指示現場中睡眠嗜組織菌的最新菌株,并且還嘗試和篩選盡可能多的多樣性。除了進行針對每一個目標毒力因子確定的pcr反應以外,還基于它們的生長和菌落外觀評價菌株。在1%瓊脂糖凝膠使pcr反應可視化。在基于生長、菌落外觀和pcr結果選擇分離株后,鑒定動物模型并將其用于評價目標分離株。實施例1-睡眠嗜組織菌小鼠攻擊模型的開發基于生長、地理多樣性和序列信息,選擇21個分離株用于在小鼠中進行評價(表1)。表1.針對天然存在的睡眠嗜組織菌疫苗候選物進行評價的分離株將于-80℃下保存的分離株劃線鋪板于columbia+5%綿羊血瓊脂板(csba)(bectondickinson,franklinlakes,nj)上。將板于37℃在5%co2下進行溫育。在18小時的生長后,將板用2mldpbs洗滌,并用另外的dpbs稀釋所得的溶液,并將培養物與fbs(預溫熱至rt)以1:1混合以獲得5x108與1x109cfu/劑量之間的終濃度。在添加fbs后,將培養物在rt下溫育5分鐘來上調睡眠嗜組織菌毒力因子,然后將其置于冰上利用其指定的分離株以0.5cc經腹膜內(ip)途徑注射每組10只18-20gnsa:cf-1小鼠(harlanspraguedawley)/分離株。給予10只小鼠的對照組dpbs+fbs。將過濾器頂部(filter-top)置于各小鼠籠的頂部,一個籠等于10只小鼠/分離株。將所述分離物稀釋并鋪板,將板于37℃在5%co2下溫育兩天。對板進行計數并測定每一個分離株的實際cfu/劑量。另外,利用分離株2336或tk#33sq注射5只小鼠,以確定該施用藥途徑是否是對ip途徑的可行選擇(用于評估毒力)。在攻擊后,每天觀察小鼠的死亡率。大多數菌株產生中等至偏上的8logscfu/劑量。sq法被證明是不成功的用于攻擊小鼠的方法。分離株tk#4、tk#24、tk#14、對照和2336導致最小百分比的死亡率,而分離株tk#1、tk#2、tk#21、tk#28和tk#30導致最大百分比的死亡率(表2)。表2.當用板上生長(plate-grown)的分離株攻擊18-20g小鼠時的死亡率百分比分離株編號途徑cfu/劑量死亡%tk#33sq3.7x1080對照ip002336ip1.7x10902336sq1.7x1090tk#4ip7.6x10810tk#14ip8.7x10810tk#24ip5.5x10810tk#34ip7.2x10820tk#42ip5.9x10820tk#5ip6.2x10830tk#15ip7.5x10830tk#33ip3.7x10830tk#37ip7.3x10830tk#41ip9.9x10830tk#3ip8.6x10840tk#22ip8.0x10840tk#40ip9.9x10840tk#44ip9.0x10840tk#47ip7.0x10840tk#1ip8.0x10850tk#2ip8.7x10850tk#28ip7.1x10850tk#30ip4.8x10850tk#21ip5.1x10880攻擊模型。進行兩項研究來確定用于小鼠的理想cfu/劑量和攻擊培養物制劑,所述小鼠在接種-攻擊研究中比在先前的研究中更大(即,考慮到接種疫苗與攻擊之間3周的生長)。對于第一項研究,使用40只25-30gnsa:cf-1小鼠(harlanspraguedawley)。將睡眠嗜組織菌分離株tk#21劃線鋪板于csba上。于37℃在5%co2下生長約24小時后,將所述分離株鋪在另外的csba上并在相同的條件下生長18-20小時。各板用2mldpbs洗滌,并收集液體。產生來自原始板洗滌物的稀釋液以建立在cfu/劑量上不同的兩份另外的溶液。將各稀釋液與fbs以1:1混合,以獲得在低8logs/劑量至低9logs/劑量的范圍內的攻擊液體的最終濃度。利用1:1的dpbs和fbs生成對照液體。將所有添加的fbs培養物在室溫下溫育5分鐘,隨后置于冰上。利用0.5ccip攻擊小鼠,并在攻擊后監測其死亡率。將攻擊培養物稀釋并鋪板,以確定最大死亡率所需的理想cfu/劑量。當將攻擊培養物tk#21在平板上生長并且小鼠更大(25-30克)(以解釋接種后3周它們的預期尺寸)時,在5.7x108cfu/劑量上獲得了最大的死亡率百分比(表3)。表3.當用板上生長的分離株攻擊25-30g小鼠時的死亡率百分比組分離株cfu/劑量死亡%1tk#211.6x1099.12tk#215.7x10827.33tk#214.2x108204對照00利用30只25-30gnsa:cf-1小鼠(harlanspraguedawley)進行最終的攻擊研究,以比較在平板上(如在文獻中通常進行的)或在肉湯中生長攻擊培養物之間的差異。如上類似地,從冷凍貯藏中取出分離物tk#21,將其鋪在另外的板上。對于肉湯培養,用2mlcolumbia肉湯洗滌板,并將50μl添加至25ml預溫熱的columbia肉湯中。在添加培養洗劑后劇烈振蕩培養物,然后置于設定為37℃和250rpm的搖床上。監測生長,并且當我們估計最終的攻擊培養物對于所有添加的液體將包含中等8logs/劑量時停止培養。同樣,通過如上進行板洗滌來制備攻擊培養物,利用dpbs稀釋培養物至約與肉湯培養物相同的濃度。將肉湯和板培養物均以1:1與fbs混合,并在室溫下溫育5分鐘,隨后置于冰上。利用0.5ccip的板洗滌物或肉湯攻擊11只小鼠/方法,將10只小鼠用作對照,所述對照被給予混合物,所述混合物為等比例的columbia肉湯與dpbs的混合物并且隨后該混合物以1:1與fbs混合得到的混合物。監測小鼠的攻擊后死亡率,完成稀釋和鋪板以測定cfu/劑量。當用在肉湯中生長的分離株#21攻擊小鼠時,相較于在平板上生長的相同分離株,25-30g的小鼠發生更大的死亡率(表4)。該結果是預料不到的,特別是考慮到文獻反向指導本領域技術人員在肉湯中生長睡眠嗜組織菌以用于毒力攻擊研究(berghaus等,2006;geertsema等,2008;gershwin等,2005)。表4.當用平板/肉湯生長的分離株攻擊25-30g小鼠時的死亡率百分比生長方法分離株cfu/劑量死亡%平板tk#215.3x10836.4肉湯tk#214.8x10854.5----對照----0130只18-20g的nsa:cf-1小鼠購自harlanspraguedawley。從先前的研究選擇5個睡眠嗜組織菌分離株(tk#42、tk#14、tk#4、tk#24和tk#34)作為疫苗候選物。從貯藏取出這些分離株,將其劃線至csba上,將它們在所述csba上于37℃和5%co2下培養約24小時。將所述分離株轉移至新的csba,并鋪在平板表面上,使它們在所述平板表面上生長~18小時。將板用2mlcolumbia肉湯洗滌。基于涉及這些分離株的生長的先前的研究,對于分離株tk#42和tk#34,將100μl板洗滌物添加至25mlcolumbia肉湯,對于分離株tk#4、tk#14和tk#24,將50μl板洗滌物添加至25mlcolumbia肉湯。將培養物在37℃和200rpm下進行培養。監測分離株的生長,從培養中取出培養物,并用columbia肉湯稀釋至含有約1x108cfu/劑量,以及對于每一個分離株,制備該培養物的1:10稀釋物以產生以1×107cfu/劑量進行評估的另一疫苗。用無菌columbia肉湯接種對照組,并用商購可得的(zoetis,用氫氧化鋁作為佐劑的滅活的嗜組織菌疫苗,kalamazoo,mi)接種另一對照組。在每一種疫苗被制備后,將其保持在冰上,每一個組包括10只小鼠,包括6只小鼠的columbia對照組例外。將疫苗以0.5cc進行sq遞送。接種疫苗后,將疫苗稀釋并鋪板,以測定實際cfu/劑量,并且每日監測小鼠的不良反應和/或死亡。利用limulusamebocytelysate試劑盒(lonza,allendale,nj)測定每一種疫苗中包含的內毒素。接種疫苗后19天,用睡眠嗜組織菌分離株tk#21攻擊小鼠。如上類似地制備野生型以用于在肉湯中生長,不同的是將150μl板洗滌物用于接種2個各自裝有75ml預溫熱的columbia肉湯的培養瓶中的每一個培養瓶。將所述培養瓶在37℃和250rpm下進行培養。從培養中取出培養物,稀釋,并以1:1與室溫fbs混合以含有中等8logs/劑量。將培養物在室溫下與fbs一起溫育5分鐘并置于冰上。攻擊產物是在攻擊前和攻擊后被涂板以確定cfu/劑量稀釋物是否符合我們的估計。向小鼠施用0.5ccip的攻擊培養物,并每日監測其死亡。利用(zoetis,用氫氧化鋁佐劑化的滅活的嗜組織菌疫苗)以及8logs的分離株tk#34和tk#22接種的小鼠,產生紅色注射部位反應。除tk#22外,所有分離株相較于對照組均在攻擊前為小鼠提供一定的保護。分離株tk#4在兩個疫苗劑量上都是有效的,然而,分離株tk#34在8logs上最好,分離株tk#24和tk#42在7logs上最好。在兩種劑量上,分離株tk#14提供了一定保護,但低于其他分離株(表5)。8logs的分離株tk#24和tk#42在接種疫苗后,在攻擊之前已使10只小鼠中的1只死亡。表5.利用低毒力分離株接種并用高毒力分離株攻擊的小鼠中的死亡率百分比*eu/劑量=內毒素單位/劑量;僅對8log疫苗測量eu/劑量。實施例2-睡眠嗜組織菌小牛攻擊在測試疫苗候選物之前,必須開發小牛攻擊模型。為進行該研究,使用20頭holstein小公牛。使用分離株tk#21或153-3(獲自具有確診的因睡眠嗜組織菌而導致的臨床疾病的小牛)攻擊54日齡的小牛。與上述類似地在肉湯中制備攻擊培養物。為了評估攻擊培養物的cfu/劑量,將先前建立的標準曲線(y=-5x10-8x+92.017(x=cfu/ml和y=%t(540nm))用于確定對于每一個分離株獲得~2.5x108和2.5x109cfu/劑量的最終攻擊濃度所需的稀釋度。用ebss稀釋培養物,隨后添加1:1比率的fbs,之后將培養物在室溫溫育5分鐘。將攻擊培養物置于冰上并追加另外的ebss以得到攻擊劑量。對于每分離株和劑量的4頭小牛中的每一頭,經氣管施用20cc的攻擊物,并追加(chase)60cc的ebss至肺內。4個動物保留為非攻擊對照,其被給予1:1的ebss和fbs。稀釋攻擊培養物,并將其在攻擊前和攻擊后鋪板以測定實際施用的cfu。由同一人對對臨床體征進行評級和記錄如下:表6.小牛攻擊臨床體征評級標準通過合計針對每一個分類測定的評級來計算每一個動物的總臨床評分。如果發現動物死亡,或滿足無痛處死的標準,則進行尸檢,并取出肺。主治獸醫就表面積病變百分比對肺進行評級,將組織進行分析。4天之后,將剩余的動物無痛處死,并如上進行尸檢。對肺部病變進行反正弦變換,使用“jmpfitybyx”函數進行分析,并用學生氏t檢驗分離平均值。將24頭holstein小公牛分入5個圍欄(每個圍欄包含5只動物各自用于接種疫苗,并且4只動物用作非接種對照)。另外,如果安排了小牛接種疫苗-攻擊研究,則使來自攻擊模型的非攻擊組的4只動物保持存活以在下周被攻擊。將它們保持在分開的圍欄中。這些動物(被稱為來自攻擊模型的對照)是另外的實驗對照,其用來觀察當這些動物被攻擊時,處于相同牲口棚中但不在與被攻擊的動物相同的圍欄中是否可影響結果。如針對小鼠那樣,使用分離株tk#28、tk#42、tk#4和tk#34制備疫苗。與上述攻擊培養物類似地制備疫苗培養物,但不添加fbs。所述疫苗據估計含有5x108cfu/劑量,劑量為2cc,每一個小牛鼻孔中施用1cc。稀釋所述疫苗,在接種疫苗前和接種疫苗后將其鋪板以測定實際cfu/劑量。接種疫苗后監測動物的健康。在第-17天(在到達后1天)、第0天(接種疫苗的日期,小牛年齡=35日齡)、第14天、第21天和第33天(攻擊的日期)收集鼻拭子和血液樣品。將鼻試子呈送至newportlaboratoriesdiagnosticlab以進行細菌培養,保留血液樣品以用于可能的血清學。以估計的5x109cfu/劑量,如上文中一樣攻擊所有動物外加來自攻擊模型研究的4只對照動物。如上利用總的臨床評分進行臨床體征、尸檢、肺部病變、細菌培養、支原體(mycoplasma)pcr和統計,也用jmpfitybyx分析肺部病變。為了進行攻擊研究,實際鋪板的cfu/劑量十分接近預測的估計的2.5x109或2.5x108cfu/劑量。對于9log組,用分離株tk#21攻擊的動物給予3.9x109cfu/劑量,對于8log組,給予2.9x108cfu/劑量。對于9log組,用分離株153-3攻擊的動物給予1.8x109cfu/劑量,以及對于8log組,給予1.7x108cfu/劑量。對于用分離株tk#21以9logs攻擊的動物觀察到比任何其它攻擊組更多的疾病的臨床體征(表7)。另外,對于用分離株tk#21攻擊的動物觀察到比任何其它攻擊組更嚴重的肺部病變(圖1)。大部分具有肺部病變的小牛具有從肺組織回收的睡眠嗜組織菌。在整個研究過程中,從鼻拭子和肺組織回收多殺性巴氏桿菌(p.multocida),但其似乎不是疾病癥狀的促成原因,因為動物在直至攻擊后都未顯示肺炎的臨床癥狀。同樣地,許多動物在肺組織中被確認為對牛分枝桿菌(m.bovis)呈陽性,或懷疑在肺組織中具有牛分枝桿菌。正如所預期的,未檢測到m.bovoculi。表7.在攻擊模型研究期間評級的臨床體征的平均總和分離株平均臨床評分*153-3(9logs)0.75153-3(8logs)0.25對照0.00tk#21(9logs)7.00tk#21(8logs)1.75*來自對動物死亡前所采取的最后一次評級用于接種的細菌的實際濃度接近估計的5x108cfu/劑量。僅在利用活細菌接種后在接種后第14天、第21天和第33天的鼻拭子采集日期的每一個日期從2至3只動物回收睡眠嗜組織菌。鼻拭子顯示睡眠嗜組織菌可在鼻道中保持存活21-33天(如果不是更多的話)(表8)。表8.向利用分離株tk#28、tk#42、tk#4和tk#34鼻內接種的小牛施用的細菌濃度和內毒素,和在整個研究過程中從接種的動物回收的睡眠嗜組織菌分離株的數量。在攻擊時給予每一頭小牛的分離株tk#21的濃度為7.39x109cfu/劑量。所述攻擊在測定疫苗的功效和測定最有效的疫苗候選物中是有效的。肺部病變的臨床體征和百分比表明分離株tk#4是最有效的疫苗,分離株tk#34是有效性最低的,而分離株tk#28和tk#42落在之間(表9;圖2)。除均用分離株tk#4接種的3頭小牛外,在研究中從所有小牛的肺回收了睡眠嗜組織菌,這表明具有肺部病變的動物的死亡和/或疾病的原因歸因于攻擊分離株。在研究過程中,從一些小牛的鼻道回收了多殺性巴氏桿菌,其隨著研究進展而不斷增加。攻擊后,從28頭小牛中的9頭的肺組織回收了多殺性巴氏桿菌,并在來自其中3只動物的肺中檢測到牛分枝桿菌。接種疫苗似乎與多殺性巴氏桿菌或牛分枝桿菌的存在或不存在無關。另外,當與來自本研究的對照動物相比較時,來自攻擊模型的對照,不如對照對攻擊易感。由于將攻擊模型對照關在與受攻擊的動物相同的牲口棚中,因此它們可能已從先前的暴露獲得一定的免疫(表9)。表9.來自鼻內接種并用睡眠嗜組織菌野生型攻擊的動物的臨床評分*為來自對動物死亡前所采取的最后一次評級的平均臨床評分。根據學生氏t檢驗,具有不同字母的臨床評分是顯著不同的。討論因為小鼠模型中的數據與在小牛中獲得的結果良好相關,因此本發明人已提供了用于選擇牛疫苗/攻擊候選物的新型有用的工具。分離株tk#21因其毒力和結果的再現性而為優異的攻擊分離株。當經氣管施用時,在牛中理想的攻擊劑量似乎為約中等至高9logs/劑量。當用作鼻內疫苗時,分離株tk#4對于隨后的睡眠嗜組織菌攻擊具有顯著的保護性(5頭小牛中的4頭)。臨床體征和肺部病變與非接種疫苗者顯著不同。分離株tk#28和tk#42在接種疫苗的小牛中誘導一定的保護,但功效較低(5頭小牛中的2頭)。實施例3–強毒和無毒睡眠嗜組織菌分離株的比較基因組分析如上所論述的,不同的睡眠嗜組織菌分離株在小鼠和牛中具有不同水平的毒力。一株(特別是菌株tk#4)顯示了作為鼻內牛疫苗候選物的前景(實施例2)。另外,tk#21被證明是牛和小鼠的強毒攻擊分離株,其具有文獻中使用的攻擊分離株(2336和hs91)的典型表型。為了更好地理解影響該毒力的因素以及也為了確定最近獲得的分離株是否仍然與較早的分離株相似,將8株睡眠嗜組織菌分離株送去進行全基因組測序。發現4個基因(糖苷水解酶家族蛋白、脂蛋白、多銅氧化酶3型和tetr家族轉錄調節劑)在tk#4中丟失,但存在于tk#21中。同樣,最近分離的睡眠嗜組織菌缺少211個至316個存在于2336(于1985年中分離的野生型)中的基因。當與2336相比較時,hs91(來自1991年的分離株)僅缺少15個基因。這些數據表明,tk#4的基因型促成其無毒性表型,并且隨時間流逝在睡眠嗜組織菌群體內存在遺傳漂變。這些結果證實了tk#4的減毒的遺傳學解釋以及對響應于天然遺傳漂變保持功效的現有疫苗和攻擊分離株的需要。為了理解差異毒力的遺傳和分子基礎,針對genbank分離株2336在tk#4、tk#21、tk#34、tk#28、tk#42、hs91、2336(高度強毒株,至少根據文獻)、129pt(genbank中的已知的無毒株)和153-3(中等毒株)之間進行9向比較基因組分析(9-waycomparativegenomeanalysis)。該分析還將促進我們對可能遺傳漂變的理解,以及描繪參與毒力/無毒力機制的基因。材料和方法用于測序的樣品制備將8株睡眠嗜組織菌分離株鑒定為可在全基因組測序中有價值的一組不同的分離株(表10)。這些分離株來自許多地方,具有寬范圍的毒力,并且是不同年份從動物分離而來。在columbia肉湯(bdref#294420;lot#0292713,franklinlakes,nj)中生長所有這些分離株,并在生長后,添加10%甘油以在newportlaboratoriesresearchanddevelopment設施(worthington,mn)中在-80℃冰箱中于低溫小瓶(fisherscientificcat.#10-500-26,waltham,ma)中冷凍培養物。從冰箱取出分離株,將其劃線鋪板至columbia綿羊血瓊脂板(csba)(bdref#22165/221263;lot#222713220121113,franklinlakes,nj)上。將板于37℃在5%co2下培養過夜。24-26小時后,從培養箱取出板,將其用于鋪在另外的csba上以在37℃和5%co2下生長過夜。在培養16-18小時后,將板用2ml預溫熱的columbia肉湯洗滌,對于每一個培養物,每一個接種量物量使用一個培養瓶,將其以100μl或150μl用于起始25mlcolumbia肉湯的肉湯培養。以200rpm振蕩肉湯培養物,監測透光度百分比(%t)(540nm)直至培養物達到15-20%t。從培養箱取出肉湯培養物,將其通過以15,000rpm旋轉(每次2分鐘)1.5ml的培養物來在同一微量離心管中沉淀3次,按照制造商的推薦(進行少許改進)使用bacterialgenomicdnapurification試劑盒(edgebiosystems,gaithersburg,md)分離基因組dna。以一式三份從每一個培養物的一式三份旋轉沉淀提取dna。對推薦的dna提取方法的改進是將dna重懸浮于100μlte中,將其在37℃溫育15分鐘,以促進溶解dna沉淀而不剪切dna。隨后混合3個提取物,在1%瓊脂糖上進行比較,定量,在納米微滴(nanodrop)上檢查純度。計算dna的量以提供用于在universityofidaho核心設施(moscow,id)進行測序所需的總dna。表10.用于比較基因組分析的睡眠嗜組織菌分離株的列表過濾高質量讀取(read)和序列覆蓋度(coverage)為了將來自ncbi數據庫的129pt(登錄號cp000436)針對2336(登錄號cp000947)進行比較,需要對現場分離株使用類似方法。因此,利用art讀取仿真軟件(http://www.niehs.nih.gov/research/resources/software/biostatistics/art/)從129pt生成假讀取。利用以下命令行運行art:art_illumina-ihs129pt.fasta-p-l250-f60-m500-s10-na-ohs129pt_sim,其等同于-p=配對的,-l=250bp,-f=60x覆蓋度,-m=dna片段的平均大小,-s=10dna片段大小的標準差。隨后,使用seqyclean,利用illuminatruseq接頭就質量過濾所有分離株讀取,所述seqyclean是在universityofidaho開發的讀取清除程序(可在其網站上獲得)。該程序除去測序接頭和含有5個或更多個q-值<20的堿基的低質量讀取,從而消除堿基讀取期間的錯誤和增加準確度。讀取作圖使用bowtie2缺省參數將基因組dna結果相對在ncbi數據庫中的2336(登錄號cp000947)進行作圖。將使用針對mapq<10的定制腳本的過濾用于除去多個作圖的讀取。預期相同的分離株具有>95%的比對率。基因覆蓋度samtools被用來計算每一個位置相對2336參照的作圖覆蓋度。這被用來計算具有對于每一個基因的覆蓋度的堿基百分比。含有少于80%的堿基的基因被稱為對于該各自的分離物是不存在的。相對2336對丟失的基因進行兩種分析。第一種分析比較hs91(在與2336相似的年代)、tk#21、tk#4、153-3和129pt。第二種分析比較tk#34、tk#42、2336(以確認我們的2336匹配數據庫)、tk#28和129pt。致病島(pi)以及整合與接合元件(integrativeandconjugativeelements)(ice)將hs91、tk#21、tk#4、153-3和129pt的全基因組測序的結果與2336比較。基于旁側特征序列(flankingsignaturesequence)如重組酶、整合酶、轉座酶、解旋酶和噬菌體重復序列的存在搜索致病島(pi)和整合與接合元件(ice)。含有一簇這些推定的特征序列的基因組區域被鑒定為潛在的pi或ice。結果被清除的序列對于所有分離株具有近100x的覆蓋度。覆蓋的程度在所謂的堿基的質量上給予我們信心(表11)。表11.每一個測序的分離株的原始讀取和估計的堿基覆蓋度的質量比對揭示了分離株與參照株之間的差異。genbank2336分離株與由newportlabs測序的2336基因組具有99.67%的同一性,表明我們的基于基因組間的比較的作圖的有效性和準確度。由此,將其它分離株與2336的相似性與對hs91的第二高的相似性完成比較。同樣,將ncbi數據庫中的共生129pt(登錄號cp000436)與數據庫的2336比對以作為參照比較(表12)。表12.與genbank2336登錄號cp000947比對的測序數據百分比。將分離株從最高至最低百分比的比對率列出。分離株比對率(%)hs9199.71233699.67153-396.11tk#3492.11tk#491.30tk#2188.35129pt*87.92tk#4283.84tk#2883.33*登錄號cp000436。在分離株當中,129pt相較于2336野生型缺少許多毒力基因和毒力相關基因。當與2336野生型比較時,更加靠近現在所獲得的分離株比更早的分離株缺少更多的總的基因(表13)。表13.估計的相較于ncbi數據庫中的2336(登錄號cp00947)對于每一個測序的分離株是存在的或不存在的基因的數量*登錄號cp000436。當比較在第一種和第二種分析中相對于2336不存在的基因時,129pt(共生)比任何其它被比較的分離株缺少更多的與致病性和/或毒力相關的那些基因。129pt總共缺少從hs91、tk#21、tk#4、153-3和129pt匯編的總共47個丟失的基因中的44個基因(表14)。它也缺少從tk#34、tk#42、2336、tk#28和129pt匯編的總共47個丟失的基因中的44個基因(表15)。已發現分離株2336僅缺少一個存在于ncbi數據庫中的已鑒定的致病性相關基因。該基因是含yada結構域的蛋白(表15)。疫苗候選物tk#4總共缺少來自經分析的分離株的可能的47個不存在的基因中的23個基因。該候選物缺少血凝素/溶血素的附著和粘附基因,含yada結構域的蛋白(總共丟失5個重復)和含血凝素結構域的蛋白質。tk#4還缺少轉鐵蛋白結合蛋白(用于鐵攝取)和多銅氧化酶3型的兩個同種型(提供攝取儲存在宿主中的金屬的能力)。負責宿主定殖的基因諸如糖苷水解酶家族蛋白(nasopharnyx定殖)和肽酶s8/s53枯草桿菌蛋白酶kexinsedolisin也從tk#4丟失。同樣,負責藥物抗性或對應激物的應答的基因也發生丟失,所述基因包括tetr家族轉錄調節劑的兩個同種型、酰基轉移酶3、marr家族轉錄調節劑的兩個同種型、小的多藥抗性蛋白、marr家族轉錄調節劑和應激-敏感性限制系統蛋白。最后,tk#4缺少一些影響病原體逃避宿主防御的能力的基因諸如脂寡糖唾液酰基轉移酶、脂蛋白和abi家族蛋白(其參與來自細菌素類的自身免疫)(表14)。相較于2336,高度致病性tk#21也缺少在tk#4中被發現丟失的類似毒力基因(23個丟失的tk#4基因中的19個基因),除糖苷水解酶家族蛋白、脂蛋白、多銅氧化酶3型的一個同種型和tetr家族轉錄調節劑的一個同種型外。tk#21缺少但tk#4具有的唯一基因是一個重復的含yada結構域的蛋白(表14)。根據公開的文獻,hs91與2336高度相似并且毒力相當。在hs91中未發現丟失在發病機制中可潛在地起作用的毒力或毒力相關基因(表14)。分離株153-3缺少在tk#4中被發現丟失的許多潛在的毒力基因(在tk#4中丟失的23個基因中的14個基因),但丟失一些存在于tk#4中的另外的基因(所有分離株中鑒定的總共47個基因中有23個基因丟失)。除了tk#4以外,153-3也缺少絲狀血凝素外膜蛋白、粘附素、10個重復的含yada結構域的蛋白(相較于對于tk#4的5個重復)、糖基轉移酶家族蛋白和乙酰轉移酶。tk#4缺少但存在于153-3中的基因是應激-敏感性限制系統蛋白、含血凝素結構域的蛋白、糖苷水解酶家族蛋白、脂寡糖唾液酰基轉移酶、abi家族蛋白、脂蛋白、多銅氧化酶3型的一個同種型、tetr家族轉錄調節劑的一個同種型,和肽酶s8/s53酶枯草桿菌蛋白酶kexinsedolisin(表14)。來自第二種分析的3個最近的分離株比更早的分離株具有更多丟失基因。tk#34缺少最近的分離株的大多數基因,47個基因中的22個基因。這些基因包括絲狀血凝素外膜蛋白、血凝素/溶血素樣蛋白、粘附素、應激-敏感性限制系統、6個重復的含yada結構域的蛋白、轉鐵蛋白結合蛋白、含血凝素結構域的蛋白的兩個同種型、糖苷水解酶家族蛋白、tetr家族轉錄調節劑、lob1蛋白、merr家族轉錄調節劑的兩個同種型、多銅氧化酶3型、小的多藥抗性蛋白、marr家族轉錄調節劑以及肽s8/s53枯草桿菌蛋白酶kexinsedolisin。在tk#34中丟失的22個基因當中,發現tk#42缺少12個基因。這些基因包括:血凝素/溶血素樣蛋白、5個重復的含yada結構域的蛋白、tetr家族轉錄調節劑的一個同種型、merr家族轉錄調節劑的2個同種型、多銅氧化酶3型的一個同種型、小的多藥抗性蛋白和marr家庭轉錄調控因子。除了tk#34也不存在的12個基因以外,tk#42還缺少一個重復的含yada結構域的蛋白、糖基轉移酶家族蛋白、毒力相關蛋白d(vapd)、酰基轉移酶3、脂蛋白、多銅氧化酶3型的另一個同種型和tetr轉錄調控因子的另一個同種型。所有在tk#42中不存在的基因在tk#28中也不存在,沒有例外(表15)。表14.當與2336(登錄號cp00947)比較時,在hs91、tk#21、tk#4、153-3和129pt的被分析基因組的一個或多個中丟失的參與毒力的基因表15.當與2336(ncbi數據庫中的登錄號cp00947)比較時,tk#34、tk#42、2336、tk#28和129pt的被分析的基因組的一個或多個中丟失的參與毒力的基因從全基因組匯編(wholegenomecompilation)鑒定了7個推定的pi或ice。第一pi或ice位于hsm_r0009與大約hsm_0254之間(~28kb),但似乎沒有明顯的毒力基因、毒力相關基因或藥物抗性基因存在于這個位置中。hs91和2336含有所有存在的基因;然而,tk#21、tk#4、153-3、129pt和tk#34似乎缺少大部分位于該pi或ice中的基因。tk#42和tk#28具有該第一pi或ice的一部分。第二位置在hsm_0319至hsm_0348之間(~41kb),并且在該位置上存在兩個重復的含yada結構域的蛋白,其中一個是不存在于tk#21、tk#4、153-3和129pt中,另一個在153-3和129pt中丟失。第三個pi位于hsm_0638至hsm_0692之間(~45kb)。分離株153-3、129pt和tk#34缺少在該潛在pi或ice中的許多基因;然而,沒有一個被鑒定為推定的毒力基因、毒力相關基因或耐藥基因,因為pi中的很多基因僅被鑒定為假設的蛋白。第四pi位置在hsm_0847與hsm_0923之間在該范圍內再次未鑒定出毒力因子;然而tk#21、tk#4、153-3、129pt和tk#34缺少大部分在該區域中發現的基因。第五pi位置在hsm_1115與hsm_1167之間(~51kb)。tk#4缺少hsm_1129至hsm_1146和hsm_1149至hsm_1167,該不存在的區域包括糖苷水解酶家族蛋白。分離株129pt缺少hsm_1131至hsm_1167,tk#34缺少hsm_1129至hsm_1144和hsm_1149至hsm_1167,但其它分離株具有這些存在的基因中的大多數。在hsm_1124上還存在雙組分應答調節劑,其可參與幫助細菌感測多種環境并對其作出響應。所有測序的分離株均包含該雙組分應答調節劑。第六推定的pi或ice是從hsm_1615至hsm_1719(~101kb)。在該區域內,存在abi家族蛋白、酰基轉移酶3、fhab蛋白、絲狀血凝素外膜蛋白、lob1蛋白、乙酰轉移酶和脂蛋白。tk#21、tk#4、153-3、129pt、tk#28、tk#42和tk#34缺少這些基因中的一些基因(表14和15),從而潛在促成它們的不同水平的毒力。最后一個潛在的pi或ice位于hsm_1860至hsm_r0065(~38kb)。在該區域中從tk#21、tk#4、129pt和tk#34丟失的一個關鍵基因是肽酶s8/s53枯草桿菌蛋白酶kexinsedolisin,其對于初始宿主定殖是非常重要的。還有其它基因從tk#21、tk#4、129pt、tk#34、tk#42和tk#28丟失,其大部分被鑒定為假設的蛋白或轉座酶。hs91、153-3、tk#42、2336和tk#28似乎具有該整個區域的大部分或全部完整區域。討論tk#4似乎是被充分減毒,同時仍能夠引發足夠的免疫應答,使得該菌株成為強候選疫苗。tk#4缺少一些與在大約同年獲得的其它分離株相似的基因;然而,一些不存在的基因對于tk#4是唯一的,包括:糖苷水解酶家族蛋白(ghfp)、脂蛋白(lp)、多銅氧化酶3型和tetr家族轉錄調節劑。從tk#4和致病分離株均丟失的幾個基因,可促成減毒表型,然而,這些基因似乎不是無毒所必需的。在另一方面,從tk#4獨特地缺失然而存在于致病株中的兩個基因,糖苷水解酶家族蛋白和脂蛋白,似乎對于tk#4的減毒表型是必要和充分的。(tk#4中)這兩個基因的表達不存在與減毒的毒力之間的因果關系得到先前公開的工作支持,所述工作表明ghfp和lp蛋白在定殖和宿主防御的逃避中起著重要的作用(asgarali等2009;garbe和collin,2010;liu等2008;以及guzmán-brambila等2012)。此外,該數據表明,雖然tk#4的減毒程度不如129pt,但該菌株為牛和小鼠二者提供保護(免受隨后強毒攻擊)。與tk#4類似,tk#34也被高度減毒;然而,tk#4丟失更多數量的參與宿主逃避的基因。tk#4和tk#34二者均分別缺少含血凝素結構域的蛋白和含yada結構域的蛋白的各種同種型或重復。tk#34缺少tk#4所具有的絲狀血凝素外膜蛋白、粘附素、lob1蛋白。tk#4缺少存在于tk#34中的脂寡糖唾液酰基轉移酶、abi家族蛋白、酰基轉移酶3、脂蛋白、多銅氧化酶3型和tetr轉錄調節劑。結果表明,丟失的毒力因子的組合促成了在小鼠和牛中具有保護性的部分減毒的細菌(tk#4)或高度減毒但對于小鼠和牛無保護性的分離株(tk#34)。此處的數據單獨地表明,本領域技術人員無法提前預測應當缺失哪些基因,以獲得足夠的減毒,但仍具有充分防護性的睡眠嗜組織菌疫苗株。最后,水平基因轉移似乎沒有將一些抗性基因傳遞給該分離物,并且其它毒力因子的缺少似乎已使該分離株充分減毒以使其不能引發疾病。在另一方面,比共生菌株更多的毒力因子的存在使得tk#4成為強候選疫苗(即,該菌株能存活得足夠長以刺激宿主體液免疫應答并提供長期的保護)。已發現tk#21在小鼠和牛中是高強毒分離株。然而,在遺傳上,其與當前菌株tk#4和153-3更相似(相對于tk#21毒力較小),然而同時與其它已知的強毒株2336和hs91更加趨異。tk#21確實具有tk#4缺少的糖苷水解酶家族蛋白、脂蛋白、多銅氧化酶3型的一個同種型,和tetr家族轉錄調節劑的一個同種型。這4個基因均可促成tk#4的減毒。在tk#21中作為不同的同種型未被發現丟失的丟失的最獨特的基因是糖苷水解酶和脂蛋白。組合在一起的這些基因似乎是造成攻擊分離株(具有所述基因)與疫苗候選物(缺少所述基因)之間的充分差異所必需的。tk#21確實缺少tk#4所具有的含yada結構域的蛋白;然而,這似乎并不促成毒力的缺乏。與tk#21相關的毒力似乎不歸因于其與2336的趨異,而是歸因于其與tk#4的微妙差異。tk#21、tk#4、153-3、tk#34、tk#42和tk#28的更加靠近現在的分離株似乎是相似的,但它們與2336和hs91顯著不同(見表15)。這些數據表明,睡眠嗜組織菌群正隨時間流逝而進化,以及普遍接受攻擊分離株2336可能不再與小牛目前面臨的睡眠嗜組織菌的基因庫相關。這也提供了支持tk#4作為疫苗候選物的證據,因為其遺傳組成與小牛的牛呼吸道疾病綜合征中目前流行的菌株高度相關。比對率支持hs91和2336是十分密切相關的,以及tk#21、tk#4、153-3、tk#34、tk#42和tk#28是密切相關的。還表明的是,目前的分離株在遺傳上與二十世紀年代所分離的那些分離株不同。同樣,當觀察基因的不存在時,更加靠近現在的分離株比hs91缺少更多數量的2336基因,并且當前的分離株也往往缺少相似的基因。這意味著基因組在睡眠嗜組織菌中天然漂變。同樣,由于當前的分離株代表了美國國內的不同狀態,因此這意味著,此處看到的遺傳漂變代表美國的當前的睡眠嗜組織菌群。總體而言,該數據表明,許多基因的組合可能是使分離株成為有效疫苗或攻擊候選物所需的,并且只有少數基因的丟失可使候選物減毒至足以拯救動物的生命而非結束其生命。該數據還表明,所述睡眠嗜組織菌群隨時間流逝確實漂變,并且該產業需要進化以保持相關疫苗。這些數據強烈支持自體疫苗性以及定期重新評價商業疫苗功效的重要性。表16.針對利用“samtoolsmpileup”分析的每一個分離株鑒定的變體(對于2336,登錄號cp00947)除了許多鑒定的snp(表16)以外,還存在許多丟失的基因(表17-23)。對于所有毒相關基因,更加靠近現在的分離株(tk#21、tk#4、153-3、tk#34、tk#42和tk#28)和129pt具有最多snp,而hs91野生型、hs91突變體和2336具有少數snp乃至沒有snp。對于los生物合成或修飾基因,在兩種分析中的糖基轉移酶和乙酰轉移酶基因中,以及在組2分析的lob2b中發現最高百分比的snp。分離株129pt缺少最多los生物合成或修飾基因。對于粘附、定殖和生物膜形成基因,在含yada結構域的蛋白和含血凝素結構域的蛋白中發生最多snp。所述粘附、定殖和生物膜形成基因中的許多基因在最近的分離株中丟失。組1中的糖苷水解酶以及兩個組中的一些tonb依賴性受體對于宿主侵襲或金屬攝取具有最多snp。許多應激反應、抗生素抗性基因和藥物外排基因從大多數更加新的分離株中丟失。在存在的分離株當中,除tetr家族轉錄調節劑外,組1中的snp的百分比相當低。對于參與los生物合成或修飾的基因,除129pt外的所有分離株在omp轉運蛋白p1中具有1個插入缺失。對于lob2b,tk#21和tk#34分別具有1個和2個插入缺失。所有最近的分離株對于pgmb具有1個插入缺失,但hs91和2336的較早分離株沒有。tk#42和tk#28在糖基轉移酶家族蛋白中具有1個插入缺失,并且它們在lob2a中具有1個插入缺失。分離株129pt在neuahs中具有插入缺失。在參與粘附、定殖和與生物膜形成的毒力相關基因的非同義插入缺失的組1分析中,tk#21和tk#4具有最多插入缺失。這些插入缺失發生在含yada結構域的蛋白(對于tk#21總共26個插入缺失,對于tk#4總共32個插入缺失)、絲狀血凝素外膜蛋白(對于tk#21總共6個插入缺失和對于tk#4總共5個插入缺失)以及對于tk#21在粘附素中1個插入缺失。分離株153-3也在組1中具有一些插入缺失,但缺少大部分被分析的基因,有點類似于129pt。存在的具有非同義插入缺失的這些基因有含yada結構域的蛋白(總共6個插入缺失)、絲狀血凝素外膜蛋白(3個插入缺失)和含血凝素結構域的蛋白(1個插入缺失;表19)。對于關于粘附、定殖和生物膜形成的組2的分析,分離株tk#34、tk#42和tk#28具有最多插入缺失。這些插入缺失存在于含yada結構域的蛋白(對于tk#34總共24個插入缺失,對于tk#42總共31個插入缺失,以及對于tk#28總共31個插入缺失)、絲狀血凝素外膜蛋白(對于tk#34總共2個插入缺失,對于tk#42總共4個插入缺失,以及對于tk#28總共4個插入缺失)以及對于tk#34在含血凝素結構域的蛋白中存在1個插入缺失。而且,129pt對于含yada結構域的蛋白具有7插入缺失并且在含血凝素結構域的蛋白中具有1個插入缺失,雖然其缺乏許多被分析的基因。最后,hs91δaroc和hs91δnanpu分別總共具有3個和2個插入缺失,以及對于絲狀血凝素外膜蛋白和對于含yada結構域的蛋白各自具有1個插入缺失(表20)。表17.存在于來自參與脂寡糖(los)生物合成或修飾的毒力相關基因的組1分析的分離株中的插入缺失的數量*表示此時對于該特定分離株發現基因丟失。表18.存在于來自參與脂寡糖(los)生物合成或修飾的毒力相關基因的組2分析的分離株中的插入缺失的數量*表示此時對于該特定分離株發現基因丟失。表19(5).存在于來自參與粘附、定殖或生物膜形成的毒力相關基因的組1分析的分離株中的插入缺失的數量*表示此時對于該特定分離株發現基因丟失。表20(6).存在于來自參與粘附、定殖或生物膜形成的毒力相關基因的組2分析的分離株中的插入缺失的數量*表示此時對于該特定分離株發現基因丟失。表21.存在于來自參與宿主侵襲或金屬攝取的毒力相關基因的組1分析的分離株中的插入缺失的數量*表示此時對于該特定分離株發現基因丟失。表22.存在于來自參與宿主侵襲或金屬攝取的毒力相關基因的組2分析的分離株中的插入缺失的數量*表示此時對于該特定分離株發現基因丟失。表23.存在于來自參與應激反應、抗生素抗性和藥物外排的毒力相關基因的組1分析的分離株中的插入缺失的數量*表示此時對于該特定分離株發現基因丟失。表24.存在于來自參與應激反應、抗生素抗性和藥物外排的毒力相關基因的組2分析的分離株中的插入缺失的數量*表示基因從該特定分離株丟失。對于參與宿主侵襲和金屬攝取的毒力相關基因在最近的分離株和129pt當中丟失的插入缺失存在許多相似性。這些基因包括tonb依賴性受體(對于tk#4和tk#34的每一個存在2個插入缺失,對于tk#42、tk#28和129pt存在1個插入缺失)、tbpb(對于hs91、tk#42、2336、tk#28和129pt各自存在1個插入缺失)、tbpa(對于tk#21、tk#4、153-3、tk#34和tk#42存在2個插入缺失,對于129pt存在3個或4個插入缺失(對于該分離株,兩次分析的結果導致不同的插入缺失估計),以及對于tk#28存在1個插入缺失)、tbpa2(對于153-3存在1個插入缺失)、溶血激活/分泌蛋白樣蛋白(對于tk#42和tk#28各自存在1個插入缺失)、tonb依賴性血紅蛋白/轉鐵蛋白/乳鐵蛋白家族受體(對于129pt存在1個插入缺失)和外膜血紅素受體蛋白(對于tk#21和tk#4存在1個插入缺失,對于tk#34和129pt存在2個插入缺失)。在應激反應、抗生素抗性和藥物外排基因當中具有任何插入缺失的唯一基因是酰基轉移酶3。在hs91和2336中存在1個非同義插入缺失,而在tk#34、hs91δaroc和hs91δnanpu中存在2個插入缺失。********在已這樣詳細地描述本發明的優選實施方案后,應當理解的是,由上述段落定義的本發明不限于上述描述中所示的具體細節,因為其許多顯而易見的變化是可能的,而不脫離本發明的精神或范圍。當前第1頁12
相關技術
網友詢問留言
已有0條留言
- 還沒有人留言評論。精彩留言會獲得點贊!
1