一種來源于虎眼萬年青的尿苷-5’-二磷酸木糖合成酶,其核苷酸序列及應用的制作方法
本發明涉及一種來源于虎眼萬年青的尿苷-5’-二磷酸木糖合成酶,其編碼基因及其在催化底物尿苷-5’-二磷酸葡萄糖醛酸為尿苷-5’-二磷酸木糖反應中的應用,屬于基因工程領域。
背景技術:
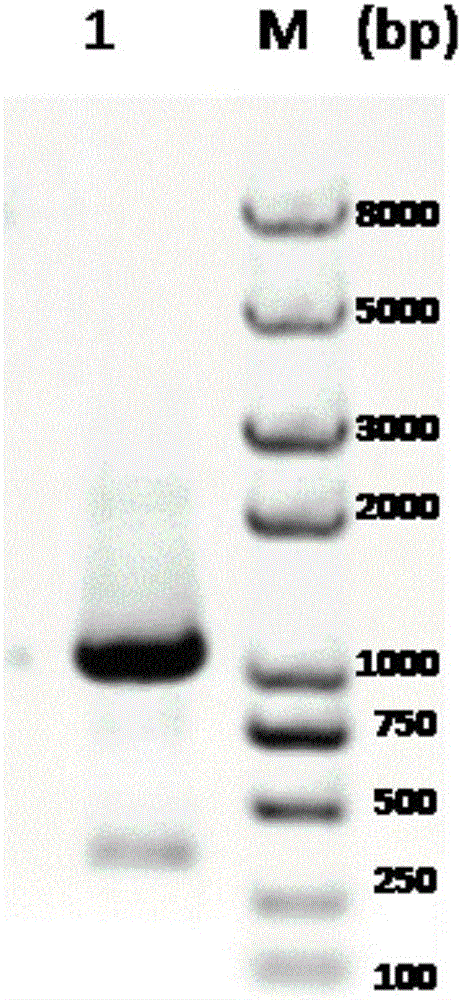
:尿苷-5’-二磷酸木糖合成酶(UXS)是生物體內生成尿苷-5’-二磷酸木糖(UDP-木糖)的關鍵酶。UXS能將尿苷-5’-二磷酸葡萄糖醛酸(UDP-葡萄糖醛酸)脫去羧基而形成UDP-木糖(圖1)。UDP-木糖是一個在糖蛋白、多糖和各種經過糖基修飾的次生代謝產物,如黃酮苷、三萜皂苷、甾體皂苷等生物合成中重要的糖基供體,它廣泛存在于動物、植物、真菌、細菌中。許多糖基化的化合物與其苷元相比具有更好的水溶性,可以使化合物的成藥性增加。但UDP-木糖含量低,合成困難,導致價格昂貴,不利于木糖苷的合成,給創新藥物的研制帶來了很大的困難。通過UXS對UDP-葡萄糖醛酸的催化,一步反應就能將UDP-葡萄糖醛酸轉化為UDP-木糖,從而可以給天然產物的糖苷化提供穩定而廉價的糖基供體,這可以帶來很大的經濟利益。因此,克隆UXS基因并對其進行功能鑒定對于酶催化合成UDP-木糖這一化合物或者通過合成生物學技術規模化制備木糖苷天然產物,減少由于化學合成以及植物提取木糖苷類天然產物等傳統方法對環境和物種造成的壓力,從而促進社會可持續發展具有很重要的意義。迄今為止,已在植物如十字花科植物擬南芥(Arabidopsisthaliana),禾本科植物大麥(Hordeumvulgare),細菌如草木樨中華根瘤菌(Sinorhizobiummeliloti)中發現并克隆得到UDP-木糖合成酶基因,而尚沒有從天門冬科植物虎眼萬年青(Ornithogalumcaudatum)中分離得到該蛋白的報道。本發明通過對虎眼萬年青進行轉錄組測序,獲得了虎眼萬年青UDP-木糖合成酶OsaUXS1序列信息。通過提取虎眼萬年青RNA,利用RT-PCR,從虎眼萬年青無菌鱗莖中克隆得到OsaUXS1基因,并對其進行了功能鑒定,這是首次從虎眼萬年青植物中克隆得到這個基因。技術實現要素:本發明解決的技術問題是提供一種來源于虎眼萬年青的尿苷-5’-二磷酸木糖合成酶、編碼該酶的核苷酸序列、含有該核苷酸序列的表達載體、含有該核苷酸序列或表達載體的宿主細胞,以及其在催化底物尿苷-5’-二磷酸葡萄糖醛酸反應中的應用。為解決本發明的技術問題,采用如下技術方案:本發明技術方案的第一方面提供了一種來源于虎眼萬年青的尿苷-5’-二磷酸木糖合成酶,其特征在于:a)SEQIDNO.1所示的氨基酸序列;b)SEQIDNO.1所示的氨基酸序列經替換,缺失或添加1-35個氨基酸形成的具有同等功能的氨基酸序列。以上所述的尿苷-5’-二磷酸木糖合成酶,其特征在于,在尿苷-5’-二磷酸木糖合成酶上可進行常規修飾;或者在尿苷-5’-二磷酸木糖合成酶上還連接有用于檢測或純化的標簽。其中,所述的常規修飾包括乙酰化、酰胺化、環化、糖基化、磷酸化、烷基化、生物素化、熒光基團修飾、聚乙二醇PEG修飾、固定化修飾;所述的標簽包括His6、GST、EGFP、MBP、Nus、HA、IgG、FLAG、c-Myc、ProfinityeXact。本發明技術方案的第二方面提供了一種編碼第一方面所述尿苷-5’-二磷酸木糖合成酶的核酸分子,其核苷酸序列如SEQIDNO.3所示。本發明技術方案的第三方面提供了一種含有第二方面所述核酸分子的表達載體。本發明技術方案的第四方面提供了一種含有第三方面所述表達載體的宿主細胞,其中所述宿主細胞優選大腸桿菌,釀酒酵母,畢赤酵母,鏈霉菌和植物細胞,更優選的宿主細胞選自大腸桿菌。本發明技術方案的第五方面提供了第一方面所述的尿苷-5’-二磷酸木糖合成酶或第二方面所述核酸分子或第三方面所述表達載體或第四方面所述宿主細胞在催化底物尿苷-5’-二磷酸葡萄糖醛酸反應中的應用,其中的催化底物為尿苷-5’-二磷酸葡萄糖醛酸,產物為尿苷-5’-二磷酸木糖。有益技術效果:UDP-木糖在生物體中含量低,合成困難,導致價格昂貴,不利于木糖苷的合成,給創新藥物的研制帶來了很大的困難。通過UXS1對UDP-葡萄糖醛酸的催化,一步反應就能將UDP-葡萄糖醛酸轉化為UDP-木糖,從而可以給天然產物的糖苷化提供穩定而廉價的糖基供體,還可以帶來很大的經濟利益。附圖說明圖1:尿苷-5’-二磷酸木糖合成酶所參與的催化反應。圖2:OsaUXS1基因的PCR分析結果,其中M是DNA分子量標準;1是OsaUXS1基因PCR結果。圖3:重組質粒pETDuet-OsaUXS1示意圖。圖4:OsaUXS1重組蛋白SDS-PAGE分析銀染結果,其中M為蛋白分子標準;1為OsaUXS1;2為空載體對照。圖5:OsaUXS1重組蛋白免疫印跡結果,其中CK為對照;1為OsaUXS1。圖6:咪唑洗脫純化后OsaUXS1蛋白SDS-PAGE分析銀染結果,其中1-4為目的蛋白;M為 蛋白分子標準。圖7:OsaUXS1重組酶催化UDP-葡萄糖醛酸HPLC-UV檢測結果,其中1為實驗組;2為對照組(滅活的酶);3為不加NAD+的實驗組;4為不加NAD+的對照組。圖8:OsaUXS1催化UDP-葡萄糖醛酸產物HPLC-MS結果。圖9:OsaUXS1催化UDP-葡萄糖醛酸產物1HNMR圖。圖10:溫度對OsaUXS1催化UDP-葡萄糖醛酸活性的影響。圖11:pH對OsaUXS1催化UDP-葡萄糖醛酸活性的影響。圖12:OsaUXS1催化UDP-葡萄糖醛酸酶活曲線圖。圖13:OsaUXS1催化UDP-葡萄糖醛酸Lineweaver-Burk雙倒數圖。具體實施方式本發明通過如下實施例進行進一步的說明,這些實施例僅用于說明性的,而不是以任何方式限制本發明權利要求的范圍。實施例1虎眼萬年青轉錄組測序及序列分析提取虎眼萬年青無菌鱗莖總RNA后,以mRNA為模板,用六堿基隨機引物(randomhexamers)合成第一條cDNA鏈,然后加入緩沖液、dNTPs、RNaseH和DNApolymeraseI合成第二條cDNA鏈,在經過QiaQuickPCR試劑盒純化并加EB緩沖液洗脫之后做末端修復、加poly(A)并連接測序接頭,然后用瓊脂糖凝膠電泳進行片段大小選擇,最后進行PCR擴增,建好的測序文庫用IlluminaHiSeqTM2000進行測序。測序得到的原始圖像數據經basecalling轉化為序列數據,即rawdata或rawreads。對rawreads進行數據過濾,去掉帶接頭的,重復的,測序質量很低的reads,得到cleanreads。使用短reads組裝軟件Trinity將具有一定長度overlap的cleanreads連成更長的片段,即Contig。然后,將cleanreads比對回Contig,通過paired-endreads能確定來自同一轉錄本的不同Contig以及這些Contig之間的距離,Trinity將這些Contig連在一起,得到兩端不能再延長的序列,這些序列稱之為Unigene。通過blastx將Unigene序列比對到蛋白數據庫nr、Swiss-Prot、KEGG和COG(Evalue<0.00001),并通過blastn將Unigene比對到核酸數據庫nt(Evalue<0.00001),得到跟給定Unigene具有最高序列相似性的蛋白,從而得到該Unigene的蛋白功能注釋信息。通過功能注釋,從虎眼萬年青轉錄組序列中發現一個長為1543bp的,具有UDP-木糖合成酶基因保守序列的Contig,即CL1039(SEQIDNO.2)。實施例2OsaUXS1基因克隆取100mg虎眼萬年青無菌鱗莖于液氮中速凍,研缽研成細粉狀,Trizol提取法,提取虎眼萬年青無菌鱗莖總RNA。使用RT-PCRKit(ReverTra-Plus-,TOYOBO公司)將虎眼萬年青無菌鱗莖總RNA反轉錄成cDNA。反轉錄體系和程序如下:在20μL體系中加入總RNA1 μg,RNaseFreeH2O4μL,Oligo(dT)201μL,65℃保溫5min后,立刻置于冰上冷卻,然后在上述管中再依次加入5×RTbuffer4μL,RNaseInhibitor(10U/μL)1μL,dNTPMixture(10mM)和ReverTraAce1μL,30℃保溫10min,42℃溫育60min,85℃變性5min,冰上5min,完成cDNA的合成。cDNA置于-20℃備用。以虎眼萬年青無菌鱗莖cDNA為模板,設計兩對OsaUXS1特異引物,通過巢式PCR的方法擴增OsaUXS1基因。第一輪PCR,50μL體系中含10×PCRbuffer5μL,2mMdNTPs5μL,25mMMgSO43μL,10μM的引物FCL1039-1(5’-CAAATTACGAAGAGATCGGATC-3’,SEQIDNO.4)和RCL1039-1(5’-TTAAGCGTGCAGACAATGATC-3’,SEQIDNO.5)各1.5μL,KOD-Plus-Neo1μL,cDNA2μL,ddH2O補足。PCR程序:94℃預變性5min;98℃變性30s,53℃復性45s,每一個循環遞減1℃,68℃延伸120s,共15循環;98℃變性30s,38℃復性45s,68℃延伸120s,共15循環;68℃延伸7min,4℃保溫。第二輪PCR,50μL體系中含10×PCRbuffer5μL,2mMdNTPs5μL,25mMMgSO43μL,10μM的引物FCL1039-2(5’-ATGGCGAAGGAGAGCTCCA-3’,SEQIDNO.6)和RCL1039-2(5’-TTAACTGCTCTGTTTGCTGG-3’,SEQIDNO.7)各1.5μL,KOD-Plus-Neo1μL,第一輪PCR產物2μL,ddH2O補足。PCR程序:94℃預變性5min;98℃變性30s,45℃復性45s,68℃延伸120s,共30個循環;68℃延伸7min,4℃保溫。0.8%瓊脂糖凝膠電泳分析PCR產物,結果表明,擴增得到了一條長約為1kb的條帶(圖2)。PCR產物與pEASYTM-T1Simple(Transgen公司)載體連接,轉化到Trans1-T1(Transgen公司)菌株,在含有100μg/mL羧芐青霉素的LB平板上培養,挑取單克隆進行菌落PCR,篩選陽性克隆送樣測序。結果表明,擴增得到的PCR產物與轉錄組測序結果完全一樣,長為1047bp(即SEQIDNO.3),含有該基因的載體命名為pEASY-OsaUXS1。實施例3OsaUXS1表達載體的構建根據In-Fusion(Clontech公司)同源重組的原理,以測序正確的質粒pEASY-OsaUXS1為模板,FETduetUXS1(5’-gccaggatccgaattcgatggcgaaggagagctcc-3’,SEQIDNO.8)和RETduetUXS1(5’-atgcggccgcaagcttttaactgctctgtttgctgg-3’,SEQIDNO.9)為引物,通過如下程序和體系進行PCR,50μL體系中含10×PCRbuffer5μL,2mMdNTPs5μL,25mMMgSO43μL,10μM的引物FETduetUXS1和RETduetUXS1各1.5μL,KOD-Plus-Neo1μL,質粒1μL,ddH2O補足。PCR程序:94℃預變性5min;98℃變性30s,63℃復性45s,68℃延伸120s,共30個循環;68℃延伸7min,4℃保溫。擴增得到長為1kb的OsaUXS1基因。將該基因通過In-Fusion的方法連接到EcoRⅠ和HindⅢ雙酶切處理的pET-Duet1中,重組產物轉化到Trans1-T1菌株,在含有50μg/mL的氨芐青霉素LB平板上培養,挑取單克隆進行菌落PCR,篩選陽性克隆進行測序。結果表明載體構建正確,命名為pETDuet-OsaUXS1(圖3)。實施例4重組OsaUXS1蛋白的誘導表達和檢測將構建好的質粒pETDuet-OsaUXS1用熱激法轉化表達宿主菌Transetta(DE3),轉化產物涂布于含氨芐青霉素(50μg/mL)及氯霉素(35μg/mL)的LB固體培養基(10g胰蛋白胨,5g酵母粉,10g氯化鈉溶于1L蒸餾水中,加入15g瓊脂粉,而后調節pH為7.0)上,37℃倒置培養過夜,直至長出單克隆。挑取單克隆轉接于20mL含氨芐青霉素(50μg/mL)及氯霉素(35μg/mL)的LB液體培養基(10g胰蛋白胨,5g酵母粉,10g氯化鈉溶于1L蒸餾水中,而后調節pH為7.0),37℃,200rpm培養至OD600為1.0左右,按1:50比例轉接入50mL含氨芐青霉素(50μg/mL)及氯霉素(35μg/mL)的LB培養基(10g胰蛋白胨,5g酵母粉,10g氯化鈉溶于1L蒸餾水中,而后調節pH為7.0),至OD600為0.6時,加入IPTG(終濃度為0.5mM),在25℃,160rpm條件下,誘導培養12小時。取1mL菌液,12000rpm,離心2min收集菌體。加入1mL預冷裂解緩沖液(25mM,pH為8.0的磷酸鈉緩沖液),重懸菌體,菌體采用超聲破碎法破碎(超聲5s,停10s,總共超聲破碎6min)。破碎液通過12000rpm,離心20min,吸取上清。取10μL上清進行SDS-PAGE分析。結果如圖4所示,從圖中可以看出,和對照相比,實驗菌的誘導產物中出現了一條長約為38kDa的特異性條帶。與OsaUXS1的理論大小一致,表明OsaUXS1在大腸桿菌中成功表達。為進一步確證OsaUXS1基因的表達,進行了免疫印跡分析。離心收集E.coli[pETDuet-OsaUXS1]的菌體,用超聲破碎液進行SDS-PAGE電泳,采用Westernblot進行檢測。所用一抗為抗His-Tag的小鼠單克隆抗體,二抗為山羊抗小鼠IgG(1:5000)。結果表明,與對照相比,E.coli[pETDuet-OsaUXS1]經免疫印跡后,在相應的位置上出現了一條相應的雜交帶(圖5)。因此,確認重組的OsaUXS1蛋白具有特異的免疫活性,表明OsaUXS1基因在E.coli中得到了表達。實施例5重組OsaUXS1蛋白的純化和定量E.coli[pETDuet-OsaUXS1]在25℃,160rpm條件下,經0.5mMIPTG誘導培養12小時后,12000rpm,離心2min收集菌體,大量菌體采用細胞破碎儀(800MPa)破碎,12000rpm,離心2min,收集破碎液上清,上清經0.22μm濾膜過濾后,通過鎳膠親和層析進行純化。用涮洗緩沖液(pH8.0,25mM磷酸鈉,300mM氯化鈉,20mM咪唑)沖洗雜蛋白,直到A280小于0.010。緊接著用40mL洗脫緩沖液(pH8.0,含25mM磷酸鈉,300mM氯化鈉,100mM咪唑)將結合在鎳膠上的重組OsaUXS1洗脫下來,收集洗脫等分,進行SDS-PAGE分析。結果如圖6所示,從結果可以看出,OsaUXS1純化效果較好,幾乎看不到雜帶。采用2L含25mM磷酸鈉(pH8.0)緩沖液透析純化的重組OsaUXS1蛋白,換液4次,而后將透析液加入甘油10mL,蛋白保存于-20℃環境中。使用Bio-radproteinassay試劑盒對純化的OsaUXS1蛋白進行定量,按其說明書有部分修改。首先按1:4的比例將染料和ddH2O稀釋混勻,而后通過0.22μM濾膜過濾備用。標準BSA蛋白及待測蛋白按一定梯度稀釋,渦旋混勻,而后蛋白按如下體系(100μL:dryreagentdilution buffer;10μL:protein)同染料作用,室溫中至少震蕩孵育5min。酶標儀測量各蛋白的A595值,對不同BSA標準蛋白濃度及對應的A595值線性回歸分析,獲得標準BSA蛋白的濃度方程,根據得到的方程測得催化UDP-葡萄糖醛酸實驗中所用的OsaUXS1蛋白濃度為0.409mg/mL。實施例6OsaUXS1蛋白功能鑒定本實驗以UDP-葡萄糖醛酸為底物,探討OsaUXS1對該底物的脫羧基作用,結果表明,OsaUXS1能催化UDP-葡萄糖醛酸形成UDP-木糖。OsaUXS1催化UDP-葡萄糖醛酸形成的產物鑒定以純化的OsaUXS1蛋白作為催化劑,建立200μL反應體系(200mM磷酸緩沖液50μL,加入20μL濃度為10mM的底物UDP-葡萄糖醛酸,20μL純化的蛋白,110μL滅菌水)。30℃反應30min后,用200μL氯仿終止反應。利用0.22μM尼龍膜過濾反應液,進樣20μL進行HPLC分析。色譜柱為Shodex公司的WA-pak陰離子交換柱。HPLC條件表1所示,其中A相為H2O;B相為700mM的醋酸銨-醋酸緩沖液,pH為5.2。檢測波長為261nm。表1時間A相%B相%流速mL/min0982120505013201001339821409821HPLC結果(圖6)表明,OsaUXS1能催化UDP-葡萄糖醛酸,實驗組底物峰消耗較多,同時在底物峰之前出現了一個新的產物峰,該產物的最大吸收波長為261nm,為尿嘧啶的特征吸收峰。收集產物的HPLC-MS分析(圖8)表明,在負離子檢測模式下,產物形成的[M-H]-離子的m/z為534.6219,與UDP-木糖的分子量相符。為進一步確證新產物的結構,通過液相制備樣品,樣品冷干后用氘代水溶解,用1HNMR(600M)進行結構解析(圖9)。歸屬各氫信號,結果如下:Xylosyl:H1”5.44(1H,dd)H2”3.40(1H,dt)H3”3.59(1H,t)H4”3.53(1H,dt)H5a”/H5b”3.64(2H,m)Rib:H1’5.88(1H,d)H2’4.27(2H,m)H4’4.18(1H,m)H5a’(1H,m)H5b’(1H,m)Uridine:H55.87(1H,d)H67.85(1H,d)綜合以上分析,可以確證OsaUXS1催化UDP-葡萄糖醛酸所形成的新產物為UDP-木糖。從而表明,OsaUXS1具有UDP-木糖合成酶的功能。同時實驗結果還表明,OsaUXS1在沒有外加NAD+的情況下依然有較高的活性,轉化率為加入NAD+的97.4%。實施例7OsaUXS1催化UDP-葡萄糖醛酸酶學性質測定OsaUXS1催化UDP-葡萄糖醛酸最適溫度確定取1.5mLEP管,加入200mM磷酸緩沖液50μL,20μL純化的酶,110μL滅菌水,置于不同溫度下孵育10min后,快速加入20μL濃度為10mM的UDP-葡萄糖醛酸。反應30min后加入200μL氯仿終止反應,利用0.22μM尼龍膜過濾反應液,進樣20μL進行HPLC分析。色譜柱為Shodex公司的WA-pak陰離子交換柱。HPLC條件表1所示,其中A相為H2O;B相為700mM的醋酸銨-醋酸緩沖液,pH為5.2。檢測波長為261nm。以產物峰面積最大者為100%,其余取對應的相對值。結果表明(圖10),OsaUXS1催化UDP-葡萄糖醛酸的最適溫度為30℃,在30—50℃范圍內均能達到大于50%的活性,溫度過低或過高均不利于反應進行,4℃活性為最高值的3.24%,在60℃下酶失活。OsaUXS1催化UDP-葡萄糖醛酸最適pH值確定配置pH4-6的100mM的醋酸鈉-醋酸緩沖液,pH6-9的10mM的磷酸鹽緩沖液,pH7.5-9.2的100mM的Tris-HCl緩沖液。取100μL不同pH的緩沖液,20μL濃度為0.409mg/mL的純化后的OsaUXS1蛋白60μL滅菌水,30℃孵育10min,加入20μL濃度為10mM的UDP-葡萄糖醛酸。30℃反應30min后,加入200μL氯仿終止反應,12000rpm離心5min,吸取水相用0.22μM尼龍膜過濾,取濾液20μL用HPLC分析,HPLC條件如表1,檢測波長261nm,各自進樣量相同。通過比較HPLC檢測產物峰面積并比較不同pH下催化效率,以產物峰面積最大者為100%,其余取相對值。通過HPLC分析結果(圖11)表明,催化UDP-葡萄糖醛酸的最適pH為5.0,隨著pH升高或降低,其活性下降。OsaUXS1催化UDP-葡萄糖醛酸動力學參數測定利用反應緩沖液配置(pH5.0,50mM磷酸鹽)不同濃度UDP-木糖標準品,并HPLC檢測,檢測波長261nm,得到峰面積。通過線性回歸得出峰面積同UDP-木糖濃度的關系,得到一擬合方程Y=111.9X+1.428(0.1≤X≤1),X為UDP-木糖濃度(mM),Y為峰面積變化值。建立100μL反應體系,pH為5.0,50mM磷酸鹽緩沖液,OsaUXS1終濃度為40.9μL/mL,改變底物UDP-葡萄糖醛酸濃度,在最適溫度30℃下反應10min,立即用氯仿終止各個反應,利用HPLC分析UDP-木糖的生成量,利用峰面積求得UDP-木糖的濃度,進而求出反應初速度(mM/min)。根據實驗結果做酶活曲線(圖12)。使用GraphPadPrism5中相關程序自動計算出Km和Vmax(圖13)。OsaUXS1酶學性質數據如表2表2當前第1頁1 2 3
相關技術
網友詢問留言
已有0條留言
- 還沒有人留言評論。精彩留言會獲得點贊!
1