一種兼性內切型重組褐藻膠裂解酶rAly?1及其編碼基因與應用的制作方法
本發明涉及一種兼性內切型重組褐藻膠裂解酶rAly-1及其編碼基因與應用,屬于基因工程技術領域。
背景技術:
褐藻膠是一種線性酸性多糖,其主鏈分子呈線性,由甘露糖醛酸(Mannuronate,M)及其C-5差像異構體古羅糖醛酸(Guluronate,G),通過糖苷鍵連續或交替鏈接而成。褐藻膠分子內存在均一的聚M段、聚G段,以及雜合的MG或GM段。褐藻膠主要產自海帶、馬尾藻等藥、食兩用的大型海洋真核藻類,是構成細胞壁和細胞間基質的主要成分。此外,條件致病菌銅綠假單胞菌和某些土壤微生物如棕色固氮菌也能分泌褐藻膠,區別在于微生物來源的褐藻膠具有乙酰化修飾。目前,日用化工、食品和醫藥領域應用的主體是海藻來源的褐藻膠。褐藻膠與瓊膠、卡拉膠一起,是產量最大、經濟價值最高、應用最為廣泛的三大海洋多糖。長期以來,褐藻膠的高值化研究一直是海洋生物技術領域的重點之一。近期,耿美玉等以聚M段褐藻膠寡糖為原料,成功開發了具有抗β-淀粉樣蛋白聚集活性的候選藥物971,即將完成抗阿爾茨海默癥(Alzheimer Disease,AD)的III期臨床,有望成為一類新藥。最新研究還表明,褐藻膠寡糖具有動態調節抗炎/促炎與抗氧化/促氧化、抑制α-葡萄糖苷酶活性等重要功能。因此,具有特定M/G比例和聚合度大小的褐藻膠寡糖具有重要應用價值和經濟價值,實現這類寡糖的高效制備具有重要意義。
褐藻膠裂解酶,通過β-消去機制催化褐藻膠分子內糖苷鍵的斷裂,并在寡糖產物的非還原性末端形成C4=C5不飽和雙鍵,與C5-位的C=O(羧羰基)形成共軛結構,從而產生含有不飽和末端(Δ)的寡糖產物。與化學或物理學降解方法相比,褐藻膠的酶法降解具有條件溫和、易控制、環境污染小等優勢特征,因而具有推廣應用的潛質。褐藻膠裂解酶主要來源于海螺的消化系統、海藻降解菌或病毒等。受限于天然褐藻膠裂解酶的產量低,轉基因褐藻膠裂解酶雖然產量高、但多數酶的水溶性和活性較差等綜合因素的影響,迄今,與β-瓊膠酶、纖維素酶等同類產品相比,少見廣泛應用的商品化褐藻膠裂解酶。
分析造成這種局面的原因時還發現,關于褐藻膠裂解酶的專利申請和科研文獻雖然數量較多,但主要集中于產酶菌株和酶的資源發掘等初步研究,關于酶的寡糖生成特征及其底物降解特性的闡釋相對較少,整體上不能提供充足的酶學特性信息,這導致工具酶匱乏,且無法精確應用。
由于褐藻膠是由M、G兩種糖單元組成的,因此根據酶對底物的選擇性,通常可將褐藻膠裂解酶分為M-專一性、G-專一性、以及M/G-兼性等三大類。此外,根據酶的底物降解模式,還可以分為內切酶、外切酶等兩種類型。內切酶可隨機、高效降解多糖,生成聚合度不同的系列不飽和寡糖;外切酶可有序降解底物,專一性生成基本糖單元,供生物體吸收利用。其中,要實現褐藻膠的徹底酶解或寡糖的高效制備,兼性內切酶是十分重要的工具之一。在已有的中國專利申請中,關于M/G兼性或雙功能褐藻膠裂解酶的申請較少,僅見如:
1、中國專利文獻CN105624137A(申請號201410660235.3)公開的一種褐藻膠裂解酶Algb的基因序列及其制備方法與應用。2、中國專利文獻CN105154458A(申請號201510672140.8)公開的一種重組褐藻膠裂解酶及其工程菌和水解制備褐藻寡糖的方法。
關于內切型褐藻膠裂解酶的申請相對更少,僅見如:
1、中國專利文獻CN105154458A(申請號201510672140.8)公開的一種重組褐藻膠裂解酶及其工程菌和水解制備褐藻寡糖的方法。2、中國專利文獻CN104293754A(申請號201410469861.4)公開的一種內切型褐藻膠裂解酶及其編碼基因與應用。
其中,又僅見中國專利文獻CN104293754A(申請號201410469861.4)提供了詳細的數據,證明了所主張的AlgL-5酶是內切型的降解模式。目前,未見關于以兼性內切型褐藻膠裂解酶的相關報道。
技術實現要素:
本發明針對現有技術的不足,提供一種兼性內切型重組褐藻膠裂解酶rAly-1及其編碼基因與應用。
本發明的技術方案如下:
一種兼性內切型重組褐藻膠裂解酶rAly-1,氨基酸序列如SEQ ID NO.2所示。
上述兼性內切型重組褐藻膠裂解酶rAly-1既能降解來自褐藻膠的古羅糖醛酸寡糖片段,也能降甘露糖醛酸寡糖片段,是兼性褐藻膠裂解酶。該酶降解褐藻膠后可最終產生以不飽和二糖、不飽和三糖為主產物的系列寡糖產物,其摩爾比約為1:1;且不飽和二糖中幾乎全部都是ΔG;不飽和三糖產物含有ΔG、ΔM等兩種非還原性末端,且二者摩爾比接近5:4。該酶的最小不飽和寡糖底物是四糖,而最小不飽和寡糖產物是二糖。該酶以內切方式降解不飽和五糖,并產生等摩爾量的不飽和二糖與不飽和三糖。該酶在降解飽和五糖底物時,飽和二糖產物產生于底物的非還原性末端,且不飽和三糖產物生成于底物的還原性末端。
上述兼性內切型重組褐藻膠裂解酶rAly-1的編碼基因,核苷酸序列如SEQ ID NO.1所示。
上述兼性內切型重組褐藻膠裂解酶rAly-1的編碼基因,全長共1335bp,所編碼蛋白質含有444個氨基酸,分子量約為50.7kD。
一種重組表達載體,在表達載體中插入了上述兼性內切型重組褐藻膠裂解酶rAly-1的編碼基因。
一種重組菌,在宿主細胞中轉入了上述兼性內切型重組褐藻膠裂解酶rAly-1的重組表達載體。
上述兼性內切型重組褐藻膠裂解酶rAly-1的編碼基因、重組表達載體、重組菌在制備兼性內切型重組褐藻膠裂解酶rAly-1中的應用。
上述兼性內切型重組褐藻膠裂解酶rAly-1在降解褐藻膠、降解褐藻膠寡糖或制備不飽和寡糖中的應用。
有益效果
1、本發明首次由火色桿菌屬細菌(Flammeovirga yaeyamensis)MY04的基因組中獲得兼性內切型重組褐藻膠裂解酶rAly-1,該酶既能降解來自褐藻膠的古羅糖醛酸片段,也能降甘露糖醛酸片段。該酶徹底降解褐藻膠后的產物是等摩爾量的不飽和二糖與不飽和三糖,其中不飽和二糖產物基本上都是ΔG,而不飽和三糖產物含有ΔG、ΔM等兩種非還原性末端,且二者摩爾比接近5:4。整體上,該酶可以用于徹底降解任意M/G比例褐藻膠多糖,以及高效制備較低聚合度的褐藻膠寡糖。
2、本發明所述的兼性內切型重組褐藻膠裂解酶rAly-1以褐藻膠為底物時,在50℃、pH6.0條件下具有最高酶活力,比活力達到1261±8.2U/mg,酶的溫度穩定性和pH穩定性好,具有廣闊的應用前景。
附圖說明
圖1、重組褐藻膠裂解酶rAly-1功能模塊構成的BLASTp分析結果;
圖2、重組褐藻膠裂解酶rAly-1表達及純化情況的聚丙烯酰胺凝膠電泳圖(SDS-PAGE);
其中:M、蛋白質分子量標準,條帶自上至下大小為116kD,66.2kD,45kD,35kD,25kD,18.4kD,14.4kD;泳道1、對照菌株破壁前菌體,上樣量10μL,泳道2、重組菌破壁前菌體,上樣量10μL,泳道3、重組菌破壁后上清,上樣量10μL,泳道4、經鎳柱純化的rAly-1,上樣量10μL;
圖3、溫度對重組褐藻膠裂解酶rAly-1活性的影響曲線;
圖4、pH值對重組褐藻膠裂解酶rAly-1活性的影響曲線;
圖5、溫度對重組褐藻膠裂解酶rAly-1穩定性的影響曲線;
圖6、pH值對重組褐藻膠裂解酶rAly-1穩定性的影響曲線;
圖7、金屬離子及化學試劑對重組褐藻膠裂解酶rAly-1活性的影響柱形圖;
圖8、重組褐藻膠裂解酶rAly-1降解褐藻膠過程中寡糖產物的分子凝膠色譜-HPLC分析圖;
圖中:(1)UDP2,不飽和二糖;(2)UDP3,不飽和三糖;(3)UDP4,不飽和四糖;(4)UDP5,不飽和五糖;
圖9、用重組褐藻膠裂解酶rAly-1徹底降解褐藻膠后所制備的不飽和寡糖片段UDP2、UDP3的HPLC分析圖;
圖10-1、用重組褐藻膠裂解酶rAly-1徹底降解褐藻膠所制備不飽和寡糖片段UDP2的MS分析圖;
圖10-2、用重組褐藻膠裂解酶rAly-1徹底降解褐藻膠所制備不飽和寡糖片段UDP3的MS分析圖;
圖11-1、用重組褐藻膠裂解酶rAly-1徹底降解褐藻膠所制備不飽和寡糖片段UDP2的1H-NMR圖;
圖11-2、用重組褐藻膠裂解酶rAly-1徹底降解褐藻膠所制備不飽和寡糖片段UDP3的1H-NMR圖;
圖12、自重組褐藻膠裂解酶rAlgL-5不完全降解褐藻膠的產物中分離所得UDP2-UDP6HPLC分析圖;
圖13、用重組褐藻膠裂解酶rAly-1徹底降解用rAlgL-5所制備寡糖UDP2-UDP6的HPLC分析圖;
圖14、用重組褐藻膠裂解酶rAly-1徹底降解飽和聚M五糖(M5)的HPLC分析圖(紫外);
圖15、用重組褐藻膠裂解酶rAly-1徹底降解飽和聚G五糖(G5)的HPLC分析圖(紫外);
圖16、用重組褐藻膠裂解酶rAly-1徹底降解還原性末端被2-AB標記的飽和聚M五糖(M5)的HPLC分析圖(熒光);
圖17、用重組褐藻膠裂解酶rAly-1徹底降解還原性末端被2-AB標記的飽和聚G五糖(G5)的HPLC分析圖(熒光)。
具體實施方式
以下實施例的闡述,是為了全面公開本發明如何實施的一些常用技術,而不是為了限制本發明的應用范圍。發明人已經盡最大努力確保實施例中個參數的準確性(例如量,溫度,等等),但是一些實驗誤差和偏差也應該予以考慮。除非另有說明,本發明中分子量是指重均分子量,溫度是攝氏度。
生物材料來源
火色桿菌(Flammeovirga yaeyamensis)MY04來源于中國微生物菌種保藏管理委員會普通微生物中心,地址:北京市朝陽區北辰西路1號院3號中國科學院微生物研究所,保藏日期2008年11月27日,保藏編號CGMCC NO.2777。
實施例1、火色桿菌(Flammeovirga yaeyamensis)MY04菌株基因組DNA的提取
將火色桿菌(Flammeovirga yaeyamensis)MY04接種至液體培養基YT04中,在28℃、200rpm的條件下,振蕩培養至600nm吸光值(OD600)為1.2;取培養菌液10mL,在12,000×g(g,地球引力常數)條件下離心15min,收集菌體沉淀;用10mL的溶菌酶緩沖液(10mM Tris-HCl,pH 8.0)懸浮菌體,在12,000rmp條件下離心15min,收集菌體沉淀。
上述液體培養基YT04,每升組分如下:
胰蛋白胨10g、酵母提取物5.0g、氯化鈉30g,用水溶解并定容至1L,pH 7.2。
向上述菌體沉淀中,每管加入溶菌酶緩沖液(購自上海生工生物工程有限公司)6.0mL,得到約7.0mL的菌液,分別加入濃度為20mg/mL的溶菌酶溶液各280μL,使溶菌酶終濃度為800μg/mL;置于冰水浴中1.0h,然后轉移至37℃水浴中,溫浴2h,至反應體系粘稠;加入濃度為100mg/mL的十六烷基磺酸鈉溶液0.41mL、100mg/mL的蛋白酶K溶液30μL,在52℃溫浴1.0h;加入Tris-平衡過的酚/氯仿/異戊醇(體積比25:24:1)溶液7.5mL,輕輕顛倒混勻;在10,000×g、4℃條件下離心10min,收集上清,并加入1.0mL的NaAc-HAc(pH 5.2,3.0M)緩沖液,以及8.5mL的無水乙醇,充分混勻;用槍頭挑出絲狀DNA,轉移至1.5mL的離心管中,以70%乙醇(貯于-20℃),洗滌2次,微離心后棄掉上清;在10,000×g、4℃條件下離心2min,徹底棄掉上清;將DNA沉淀于無菌工作臺中風吹干燥,然后用無菌去離子水在4℃過夜溶解DNA樣品,制得基因組DNA。
實施例2、火色桿菌(Flammeovirga yaeyamensis)MY04菌株基因組的掃描及其序列分析。
將實施例1制得的基因組DNA,采用焦磷酸測序技術進行基因組的掃描測序,由上海美吉生物公司完成。用NCBI(National Center for Biotechnology Information,http://www.ncbi.nlm.nih.gov/)網站的在線軟件對DNA測序結果進行分析。所用到的NCBI網站的分析軟件是Open Reading Frame Finder(ORF Finder,http://www.ncbi.nlm.nih.gov/gorf/gorf.html)和Basic Local Alignment Search Tool(BLAST,http://blast.ncbi.nlm.nih.gov/Blast.cgi)。
用上述生物學軟件分析的結果顯示,火色桿菌(Flammeovirga yaeyamensis)MY04菌株基因組DNA上攜帶一個褐藻膠裂解酶的編碼基因aly-1,基因aly-1的編碼區長1335bp,核苷酸序列如SEQ ID NO.1所示。基因aly-1所編碼的重組褐藻膠裂解酶rAly-1共含有444個氨基酸,其氨基酸序列如SEQ ID NO.2所示。
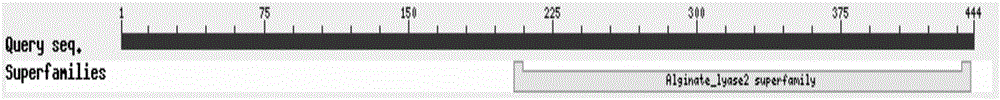
用BLASTp軟件在線分析,結果顯示,NCBI數據庫中與重組褐藻膠裂解酶rAly-1的氨基酸序列相似性大于30%的都是功能未經過鑒定的蛋白質。如圖1所示,BLASTp分析還推測Aly-1的蛋白質C-端含有在褐藻膠裂解酶超級家族2中保守的假定催化結構域。用生物學軟件BioEdit 7.0.5.3進行分析,顯示蛋白質Aly-1的理論分子量約為50.7kD。用信號肽在線預測軟件SignalP 4.1 Server(http://www.cbs.dtu.dk/services/SignalP/)在線分析,該蛋白質的N-端1-20位氨基酸為分泌型信號肽。
實施例3、基因aly-1在大腸桿菌BL21(DE3)菌株中的重組表達
以實施例1制得的基因組DNA為模板,進行PCR擴增。引物序列如下:
正向引物Aly1-F:5’-cgcGGATCCAACAATAAAGTAGAGGACGAG-3’(BamH I);
反向引物Aly1-R:5’-ccgCTCGAGTATAAGTTTCTTTTAATTCTATAG-3’(Xho I);
正向引物Aly1-F中下劃線標注的是限制性內切酶BamH I位點,反向引物Aly1-R下劃線標注的是限制性內切酶Xho I位點。所用高保真DNA聚合酶PrimeSTAR HS DNA Polymerase購自中國大連寶生物公司,所用PCR反應試劑按照該公司提供的產品說明進行操作。
PCR反應條件:95℃預變性4min;94℃變性40s,60℃退火30s,72℃延伸75s,35個循環;72℃延伸10min;4℃穩定10min。
將PCR產物用限制性內切酶BamH I和Xho I進行雙酶切,通過瓊脂糖凝膠電泳回收酶切后的PCR產物。將購于美國Invitrogen公司的產品pET-30a(+)質粒DNA,用BamH I和Xho I雙酶切,進行瓊脂糖凝膠電泳并回收酶切后的產物片段。限制性內切酶BamH I和Xho I均購于中國大連寶生物公司,酶切所用到的酶與底物反應的體系、溫度和時間,均按照該公司提供的產品說明操作。
將經過BamH I和Xho I雙酶切的PCR產物,與同樣經過雙酶切的pET-30a(+)質粒載體,在DNA連接酶的催化下進行接;連接產物轉化大腸桿菌DH5α菌株,涂布于含有50μg/mL卡那霉素的Luria-Bertani培養基固體平板上,37℃培養16h后,挑取單克隆;將單克隆接入含有50μg/mL卡那霉素的液體Luria-Bertani培養基中培養,提取質粒;將質粒用擴增引物進行PCR驗證,結果得到大小為1.3kb的擴增產物,初步證明構建的重組質粒正確;接著將該重組質粒進行測序,結果表明,在pET-30a(+)的BamH I和Xho I酶切位點之間插入SEQ ID NO.1所示的基因aly-1,且插入方向正確,所以進一步證明構建的重組質粒正確,將該重組質粒命名為pE30a-Aly1。
將重組質粒pE30a-Aly1轉化大腸桿菌菌株BL21(DE3)(購自美國Invitrogen公司),然后按照該公司提供的操作步驟,使用異丙基硫代半乳糖苷(IPTG)進行重組褐藻膠裂解酶rAly-1的誘導表達。在8,000×g、4℃條件下離心15min,收集菌體,并用緩沖液A重懸菌體,冰水浴環境中超聲破碎。在15,000×g、4℃條件下進一步離心30min,收集水溶性組分,并用Ni-瓊脂糖凝膠對組褐藻膠裂解酶rAly-1進行純化。用含有咪唑濃度為10、50、100、250、500mM的緩沖液A進行梯度洗脫,純化條件按照凝膠的產品手冊操作。用聚丙烯酰胺凝變性膠電泳檢測重組褐藻膠裂解酶rAly-1的純化情況。結果如圖2所示:經IPTG誘導表達后的BL21(DE3)菌體中,重組褐藻膠裂解酶rAly-1的產量不低于500mg/L菌體培養物;純化后的重組褐藻膠裂解酶rAly-1在電泳膠上呈單一條帶,且位置與預測的分子量相吻合;將純化后的重組褐藻膠裂解酶rAly-1樣品裝入最小分子截留量為10kD的透析袋,在4℃環境中對緩沖液A進行透析。所說緩沖液A的成分是50mM Tris、150mM NaCl,pH 7.9,制得重組褐藻膠裂解酶rAly-1酶液。
實施例4、重組褐藻膠裂解酶rAly-1最適溫度的測定
用去離子水配制質量體積濃度為0.1-1.2%的褐藻膠、聚甘露糖醛酸片段(polyM)和聚古洛糖醛酸片段(polyG)三種不同底物,加熱溶解后,置于0℃、10℃、20℃、25℃、30℃、35℃、40℃、45℃、50℃、55℃、60℃、70℃、80℃、90℃、100℃水浴環境中降溫1h。向每900μL底物溶液中添加實施例3制得的重組褐藻膠裂解酶rAly-1的稀釋液100μL,重組褐藻膠裂解酶rAly-1的稀釋液濃度為10μg/mL,混勻后繼續反應,隔時取樣。每個溫度條件下3個平行樣品,以沸水浴滅活的重組酶制劑為對照組。
用DNS-還原糖法測定各反應體系中新生成還原糖的濃度(OD540),并計算平均值,進行偏差分析。最大吸收值對應的反應溫度為重組酶的最適溫度,相對酶活(RA)定義為:各吸收值與最大吸收值的百分比。結果如圖3所示:以如上所述三種底物測定酶活時,重組褐藻膠裂解酶rAly-1都在50℃反應時達到最大活力,這表明重組褐藻膠裂解酶rAly-1的最適反應溫度是50℃。同時,以褐藻膠為底物時,重組褐藻膠裂解酶rAly-1在0℃展示了73%的相對酶活,這表明重組褐藻膠裂解酶rAly-1具有適冷的酶學性質;在80-100℃也展示了45%以上的相對酶活,這表明重組褐藻膠裂解酶rAly-1具有一定的適熱酶學性質。
另外,如圖4所示,重組褐藻膠裂解酶rAly-1對褐藻膠、聚古洛糖醛酸片段(polyG)和聚甘露糖醛酸片段(polyM)的降解均具有較好的降解活性,初步表明重組褐藻膠裂解酶rAly-1是一個兼性的褐藻膠裂解酶。
實施例5、重組褐藻膠裂解酶rAly-1最適pH的測定
分別用濃度為50mM的NaAc-HAC緩沖液、50mM的NaH2PO4-Na2HPO4緩沖液、50mM的Tris-HCl緩沖液,分別與褐藻膠配制質量體積濃度(g/mL)為0.1~1.2%的褐藻膠底物,所對應的pH值分別為5、6,6、7、8,7、8、9、10三個區段,各pH值均在最適溫度下調定。將底物溶解后,置于最適溫度中孵育1h,然后向每900μL底物中添加實施例3制得的重組褐藻膠裂解酶rAly-1的稀釋液100μL,混勻后開始反應,隔時取樣。每個pH條件下3個平行樣品,以沸水浴滅活的重組酶制劑為對照組。用DNS-還原糖法測定各反應體系中新生成的還原糖濃度(OD540),并計算平均值和偏差。相對酶(RA)活定義為:各組平均吸收值與最大吸收值的百分比。最大吸收值對應的pH為重組酶的最適pH。結果如圖4所示:重組褐藻膠裂解酶rAly-1的最適反應pH為6.0。在pH 5~10范圍內,重組褐藻膠裂解酶rAly-1相對酶活在78%以上,顯示該酶具有廣泛的pH反應活性。
實施例6、重組褐藻膠裂解酶rAly-1的溫度穩定性分析
將實施例3制得的重組褐藻膠裂解酶rAly-1酶液在不同溫度(0~70℃)下熱處理0.5h、1h、2h后,分別與用蒸餾水配置的質量體積濃度(g/mL)為0.1~1.2%的褐藻膠,按1:9(體積比)的比例混合,然后在最適溫度下測定殘余酶活,以不經過熱處理的酶液酶活定義為100%相對活力。結果如圖5所示:重組褐藻膠裂解酶rAly-1在低于50℃的溫度下預處理2h后,仍然具有>90%的殘余活性,表明該酶具有一定的熱穩定性。
實施例7、重組褐藻膠裂解酶rAly-1的pH穩定性分析
將實施例3制得的重組褐藻膠裂解酶rAly-1的酶液,在最適溫度(50℃)、不同的pH(pH5~10)環境中分別預孵育2h后,與質量體積濃度(g/mL)為0.1~1.2%的褐藻膠底物溶液按1:9(體積比)的比例混合,然后在最適溫度下測定殘余酶活,以不經過預處理的酶液酶活定義為100%相對活力。結果如圖6所示,在pH5~10的范圍內預處理2h,rAly-1酶活仍保持70%以上。這表明重組褐藻膠裂解酶rAly-1對pH值耐受范圍較廣。
實施例8、金屬離子對重組褐藻膠裂解酶rAly-1活性的影響
將用去離子水配置的質量濃度為0.1~1.2%褐藻膠底物、實施例3制得的重組褐藻膠裂解酶rAly-1酶液、以及水按5:1:4(體積比)的比例混合后,接著向反應體系中添加不同的金屬離子,添加的離子終濃度為1mM或10mM,然后在50℃反應4h,按前述的DNS-還原糖法測酶的活力。對照組為不加任何金屬離子時rAly-1的活性(設定為100%)。結果圖7所示,在1mM或10mM濃度下:(1)Na+、K+、Li+等三種一價金屬試劑在10mM時對rAly-1的活性表現為促進作用,但Ag+具有顯著抑制作用;(2)Co2+、Fe2+、Mg2+、Ni2+等二價金屬例子對酶活具有促進作用,而其余二價、三價金屬離子對酶活具有抑制作用;(3)甘油、β-巰基乙醇及DTT在10mM時對rAly-1的活性有明顯促進活性,可分別使酶活提高至125.8%、130.4%及116.4%。
實施例9、DNS-還原糖法測定重組褐藻膠裂解酶rAly-1的酶活
將用去離子水配置的質量濃度為0.1-1.2%的褐藻膠、濃度為10μg/mL的重組褐藻膠裂解酶rAly-1酶液、150mmol/L的HAc-NaAc(pH 6.0)緩沖液以及水按1:1:1(體積比)的比例混合后,50℃下反應4h。將反應產物在沸水浴中加熱10min,轉入冰水浴中5min,在12,000×g、4℃條件下離心15min,收集上清;將一定體積的上清與等體積的DNS(3,5-對硝基二甲苯)-反應液混勻,在沸水浴中加熱10min,降至室溫,在540nm測定吸收值。用分析純葡萄糖醛酸鈉內酯作標準品,同樣方法操作,繪制葡萄糖醛酸內酯的摩爾濃度與OD540之間的量效關系曲線。用購于上海生工生物工程有限公司的蛋白質定量試劑盒測定重組褐藻膠裂解酶rAly-1酶液中的蛋白質含量。按照國際標準定義計算酶的活力單位,即在標準條件下,每分鐘內產生1μmol產物所需的酶量為1個IU。結果表明:重組rAly-1能以褐藻膠為底物,酶解并產生還原糖產物,酶活為1261±8.2U/mg。
實施例10、重組褐藻膠裂解酶rAly-1降解褐藻膠的產物的高效液相(HPLC)分析
用去離子水配制質量體積濃度(g/mL)為0.1~1.2%的褐藻膠底物,加熱溶解后,置于50℃水浴環境中降溫1h。向每100μL底物中添加實施例3制得的重組酶rAly-1的稀釋液10-100μL,不足200μL體積時,用無菌去離子水補足;混勻后繼續反應,隔時取樣。將反應產物在沸水浴中加熱10min,轉入冰水浴中5min。在12,000×g、4℃條件下離心15min,收集上清。
用濃度為0.20mol/L的NH4HCO3溶液,平衡Superdex Peptide 10/300GL(GE公司)分子凝膠色譜柱,流速0.40mL/min,至少2柱床。將上述褐藻膠的不同酶解時間的樣品,以自動進樣器加載100μg/樣品,其它條件不變,232nm檢測。用HPLC操作軟件,分析各寡糖組分的積分面積,計算相對摩爾濃度。
如圖8所示,在上述條件下,褐藻膠底物被降解后,隨著酶解反應時間的增加,具有235nm特征吸收的寡糖產物的含量逐漸增加,且相對含量最終趨于穩定。這初步表明重組褐藻膠裂解酶rAly-1是褐藻膠裂解酶。酶解反應的最終主產物是HPLC分析中出峰時間為40.5'和43.2'的兩個寡糖產物,面積比穩定為1:1,表明二者摩爾比約為1:1。
實施例11、重組褐藻膠裂解酶rAly-1徹底降解褐藻膠的寡糖主產物的分子量鑒定
按照實施例10所述,將共200mg褐藻膠用重組褐藻膠裂解酶rAly-1徹底酶解,樣品分批上樣、過Superdex Peptide 10/300GL分子凝膠色譜柱(GE公司),并按照出峰時間分別收集出峰時間為40.5'和43.2'的兩個寡糖樣品。將多次收集到的兩個寡糖樣品分別集中后,反復冷凍干燥以脫鹽。用無菌去離子水溶解所得寡糖樣品,進行一級質譜(MS)分析,確定各寡糖的相對分子量。還用重水(D2O)溶解所得的寡糖樣品,反復冷凍干燥,以完成氫氘置換,并進行1H-NMR分析,最終確定各寡糖的化學結構及特征。
如圖9所示,用重組褐藻膠裂解酶rAly-1徹底降解褐藻膠后所制備的不飽和寡糖片度UDP2、UDP3進行HPLC分析,結果顯示產物在235nm具有特征吸收,出峰時間分別為40.5'和43.2,,純度均大于99%,符合進一步實驗要求。
在陰離子模式下進行的一級質譜分析的結果(圖10)表明,這兩個寡糖主產物的分子量分別是352、528。這表明,上述兩個寡糖主產物分別是重組褐藻膠裂解酶rAly-1徹底降解褐藻膠之后所產生的不飽和二糖(UDP2,圖10-1)及不飽和三糖(UDP3,圖10-2)。
綜合圖8、9、10的結果,不飽和二糖是重組褐藻膠裂解酶rAly-1降解褐藻膠之后聚合度最小的寡糖主產物。
進一步通過1H-NMR數據分析上述兩種寡糖的結構特征:(1)如圖11-1所示,5.75ppm處的特征性化學位移值表明,重組褐藻膠裂解酶rAly-1降解褐藻膠后的主產物不飽和二糖UDP2幾乎全部是ΔG。(2)如圖11-2所示5.70、5.60ppm兩處的化學位移值,表明主產物不飽和三糖UDP3的非還原性末端有兩種類型:ΔG和ΔM;而且兩處峰的面積積分之比為100:83,表明這兩類不飽和三糖的摩爾比約為5:4。
實施例12、重組褐藻膠裂解酶rAlgL-5不完全降解褐藻膠的產物UDP2-UDP6的制備
按照專利申請(申請號201410469861.4,一種內切型褐藻膠裂解酶及其編碼基因與應用)中實施例10所述,將共200mg褐藻膠用重組酶rAlgL-5進行不徹底酶解,產物分批上樣、過分子凝膠柱Superdex Peptide 10/300GL(GE公司),并按照出峰時間分別收集單個寡糖片段。將這些寡糖樣品多次收集、分別集中后,反復冷凍干燥以脫鹽。
如圖12所示,制備的寡糖片段UDP2-UDP6經HPLC檢測分析,結果顯示產物在235nm具有特征吸收,純度均大于99%,符合進一步實驗要求
實施例13、重組褐藻膠裂解酶rAly-1最小不飽和寡糖底物的分析
用去離子水和實施例12所制備的寡糖片段,包括:不飽和七糖(UDP7)、不飽和六糖(UDP6)、不飽和五糖(UDP5)、不飽和四糖(UDP4)、不飽和三糖(UDP3)及不飽和二糖(UDP2)。將這些寡糖樣品分別配置底物溶液,與濃度為10μg/mL的重組褐藻膠裂解酶rAly-1酶液、150mmol/L的HAc-NaAc(pH 6.0)緩沖液以及水按1:1:1(體積比)的比例混合后,50℃反應24h。按照實施例10所述色譜操作條件,進行HPLC分析。結果如圖13所示,本申請所述重組褐藻膠裂解酶rAly-1:
(1)降解不飽和六糖(UDP6)之后產生不飽和四糖、不飽和三糖和不飽和二糖;
(2)降解不飽和五糖(UDP5)之后產生等量的不飽和三糖和不飽和二糖;
(3)降解不飽和四糖(UDP4)之后產生兩倍的不飽和二糖;
(4)與不飽和三糖或不飽和二糖反應前后無顯著變化。
這充分表明,不飽和四糖片段是重組褐藻膠裂解酶rAly-1的最小不飽和寡糖底物,且重組褐藻膠裂解酶rAly-1以內切酶方式降解寡糖底物。
實施例14、重組褐藻膠裂解酶rAly-1酶切模式的高效液相色譜(HPLC)分析
取約含30μg飽和聚M五糖(M5)、聚G五糖(G5)的溶液,150mmol/L的HAc-NaAc(pH 6.0)緩沖液、實施例3制得的重組褐藻膠裂解酶rAly-1的稀釋液,按照體積比1:1:1混勻,置于50℃水浴中反應12h。將反應體系置沸水浴中10min,轉至冰水浴5min,在12,000×g、4℃條件下離心至少15min。收集上清,作為重組褐藻膠裂解酶rAly-1的寡糖降解產物。以預先在沸水浴中滅活的重組褐藻膠裂解酶rAly-1酶液,做陰性對照反應。
按照實施例10所述的色譜條件,將重組褐藻膠裂解酶rAly-1酶解飽和聚M五糖(M5)、聚G五糖(G5)的樣品,以自動進樣器加載20μg/樣品,其它條件不變,232nm檢測。用HPLC操作軟件,分析各寡糖組分的積分面積,計算相對摩爾濃度。參照分子量標準物,確定各寡糖的相對分子量。
如圖14,重組褐藻膠裂解酶rAly-1降解飽和聚M五糖(M5)之后產生不飽和三糖UM3。如圖15所示,重組褐藻膠裂解酶rAly-1降解飽和聚G五糖(G5)之后產生不飽和三糖UG3。這表明,重組褐藻膠裂解酶rAly-1是兼性內切型褐藻膠裂解酶,且在降解飽和型五糖底物時,其飽和型二糖產物生成自底物的非還原性末端,而不飽和三糖產物生成于底物的還原性末端。
實施例15、重組褐藻膠裂解酶rAly-1酶切模式的熒光-高效液相色譜(HPLC)分析
取約含10μg飽和聚M五糖(M5)、聚G五糖(G5)的溶液,旋轉蒸干。加入含過量鄰氨基苯甲酰胺(2-AB)、硼腈化鈉的二甲亞砜(DMSO)溶液,混勻后置60℃水浴中溫育2h。旋轉蒸干,加入500μL去離子水溶解樣品,將樣品與200μL氯仿共振蕩,離心,收集上清。繼續用氯仿反復抽提,不少于7次,得到還原性末端被熒光標記了的飽和聚M五糖(2AB-M5)、熒光標記的飽和聚G五糖(2AB-G5)。同樣方法標記飽和寡糖的分子量標準物。
取上述2AB-M5、2AB-G5樣品、150mmol/L的HAc-NaAc(pH 6.0)緩沖液、實施例3制得的重組褐藻膠裂解酶rAly-1的稀釋液,按照體積比1:1:1混勻,置于40℃水浴中反應12h。將反應體系置沸水浴中10min,轉至冰水浴5min,在12,000×g、4℃條件下離心至少15min。收集上清,作為重組褐藻膠裂解酶rAly-1的寡糖降解產物。以預先在沸水浴中加熱10min的重組褐藻膠裂解酶rAly-1酶液,做陰性對照反應。
按照實施例10所述的色譜條件,將2AB-M5、2AB-G5及其酶解產物的標記樣品,以自動進樣器加載50-200ng/樣品,其它條件不變,330nm激發,420nm檢測。用HPLC操作軟件,分析各寡糖組分的積分面積,計算相對摩爾濃度。參照分子量標準物,確定各寡糖的相對分子量。
如圖16、17所示,用過量的重組褐藻膠裂解酶rAly-1與2AB-M5反應后,僅少量被降解,且產生等摩爾量的2AB-M3。但是,該酶可完全降解2AB-G5,并生成等摩爾量的2AB-G3。這表明,重組褐藻膠裂解酶rAly-1是兼性內切型褐藻膠裂解酶,進行酶解反應時是從底物的非還原性末端釋放出最小產物,包括飽和型二糖或不飽和二糖。
進一步地,對比14與16,以及15與17,說明:(1)2-AB對飽和五糖末端標記,抑制了酶rAly-1對寡糖的降解活性;(2)rAly-1作為兼性內切型褐藻膠裂解酶,對polyG的偏好性略大于polyM。
- 還沒有人留言評論。精彩留言會獲得點贊!