環介導的級聯放大策略用于高靈敏檢測DNA甲基轉移酶活性的制作方法
本發明涉及酶活性檢測領域,具體涉及一種環介導的級聯放大策略用于高靈敏檢測dna甲基轉移酶活性的方法。
背景技術:
dna甲基轉移酶是一種表觀遺傳學修飾酶,在調節基因表達、發育和基因組印記方面起重要作用。其通過在腺嘌呤或胞嘧啶上共價添加甲基而催化dna甲基化。研究表明dna甲基轉移酶活性異常和疾病的產生和發展有關。顯然,dna甲基轉移酶活性被認為是一種潛在的癌癥生物標志物和癌癥治療中的藥物作用靶點。因此,靈敏檢測dna甲基轉移酶活性對于dna甲基轉移酶相關的癌癥治療和診斷至關重要。
用于dna甲基轉移酶活性檢測的傳統方法包括放射性標記法、凝膠電泳和高效液相色譜。為了提高檢測的靈敏度和特異性,許多新的方法包括電化學、化學發光、比色和熒光方法已用于dna甲基轉移酶活性檢測。在這些方法中,熒光方法作為有力的生物分析工具用于dna甲基轉移酶活性受到廣泛的關注。通常情況下,熒光方法通過使用雙鏈探針或含懸垂鏈的發夾探針用于目標物識別和信號轉導。其中,信號轉導鏈被部分地封閉在雙鏈探針或發夾探針莖部。經dna甲基轉移酶識別作用,雙鏈探針或發夾探針釋放信號轉導鏈,且該信號轉導鏈觸發隨后的信號輸出過程。這種部分封閉方式會導致由探針泄漏所引起的非特異性擴增,產生假陽性信號。而在dna甲基轉移酶不存在時,雙鏈探針或發夾探針與報告探針間會發生競爭性雜交,致使非特異性背景擴增,影響檢測的靈敏度和精確度。
技術實現要素:
為了解決以上問題,基于鏈置換放大和指數滾環擴增,我們發展了一種環介導的級聯放大策略用于高靈敏熒光檢測dna甲基轉移酶活性。我們設計了一種長莖環探針,其包括用于dna甲基轉移酶識別的甲基化位點、用于確保探針穩定的長莖部和用于引發后續放大的環部。長莖環探針中環部和小部分的莖部作為觸發鏈用于后續的信號輸出過程。該觸發鏈被長莖部完全封閉在探針的環部,避免探針泄漏所引起的非特異性放大。長莖環探針被dna甲基轉移酶甲基化,且隨后被甲基化敏感型限制性內切酶特異性地切割,產生觸發鏈。接下來,該觸發鏈引發鏈置換放大和指數滾環擴增,合成大量富含g的序列。最后,其與染料選擇性相互作用,獲得增強的熒光信號。
本發明采用的技術方案如下:
本發明的第一個目的是提供一種用于檢測dna甲基轉移酶活性的長莖環探針,該探針包括長莖部和環部,所述長莖部包括緊靠環部的緩沖區域、dna甲基轉移酶特異性識別位點序列和長莖部區域;其中所述緩沖區域的堿基對為1~7個。
常規莖環結構的設計是本領域技術人員熟知的技術內容,其包括莖部和環部,莖部通常是由若干個互補的堿基對構成的雜交雙鏈dna序列,環部通常是由寡聚核酸形成的單鏈序列。本領域的技術人員應當知曉構成莖環結構中的環部的常規序列,優選的,本發明中環部序列的堿基數為10~25個。在本發明中的某些實施中,環部的序列可以為表1中斜體序列所示:5′-atacgactcacta-3′,但并不僅僅限于以上序列,只要能夠滿足成環的條件即可。
本發明的長莖環探針中,dna甲基轉移酶特異性識別位點序列與環部之間的序列(即為所述的緩沖區域)是合理的長莖環探針設計的重要因素。合理的設計可以有效地降低背景信號且dna甲基轉移酶存在時顯著地增強熒光信號。本發明所述緩沖區域是由1~7個互補的堿基對構成的雜交雙鏈dna序列,當大于7個時,經過限制性內切酶切割后所產生的新發夾探針相對穩定,不易發生構象轉變為單鏈用于后續的擴增反應。優選的,所述緩沖區域的堿基對為2~5個;最優選的,所述緩沖區域的堿基對為3個。
本發明中所述的dna甲基轉移酶包括dam、m.sssi、alui、haeiii或hhai甲基轉移酶等。每個類型的dna甲基轉移酶有其各自的甲基轉移酶特異性識別位點序列,如dam甲基轉移酶的識別位點序列可為5′-gatc-3′,本領域的技術人員知曉和確定每個類型的dna甲基轉移酶的特異性識別位點序列。
本發明中所述的長莖部區域是由若干個互補的堿基對構成的長雙鏈dna序列。根據本發明的長莖環探針的作用,將其設計為18~30個堿基對。長莖環探針中的環部和小部分的莖部(小部分的莖部是指緩沖區域)作為觸發鏈用于后續的信號輸出過程。該觸發鏈被所述長莖部區域完全封閉在探針的環部以及部分莖部,避免探針泄漏所引起的非特異性放大。
優選的,所述長莖環探針序列為seqidno:1、seqidno:3、seqidno:5、seqidno:7或seqidno:9所示:
最優選的,所述探針為seqidno:5所示。
根據本發明中長莖環探針的序列介紹,其制備方法為本領域技術人員常規知曉的,可以通過序列合成公司進行合成。
本發明的第二個目的是提供上述長莖環探針在用于檢測dna甲基轉移酶活性或在制備用于篩選dna甲基轉移酶抑制劑/拮抗劑的試劑中的應用。
本發明的第三個目的是提供一種檢測dna甲基轉移酶活性的方法,當待測樣品中存在dna甲基轉移酶時,所述長莖環探針被dna甲基轉移酶甲基化,且隨后被甲基化敏感型限制性內切酶特異性地切割,產生觸發鏈;在聚合酶和切割酶的協同作用下,所產生的觸發鏈引發鏈置換放大反應,產生大量引物;所產生的引物引發指數滾環擴增,合成大量g-四倍體序列;其與染料相互作用而獲得增強的熒光信號。
進一步的,a、當待測樣品中存在dna甲基轉移酶時,所述dna甲基轉移酶特異性識別和催化所述長莖環探針發生甲基化,形成具有甲基化的長莖環;
b、甲基化敏感型限制性內切酶將甲基化的長莖環切割成兩部分,一部分為雙鏈dna,另一部分為新發夾探針,所述新發夾探針結構不穩定,發生構象轉變成單鏈dna形成觸發鏈;
c、所述觸發鏈與鏈置換模板發夾探針雜交,并在鏈置換擴增活性的聚合酶和切割酶的作用下引發聚合和切割反應,釋放出多個引物;
d、在dna連接酶的作用下所釋放的引物與掛鎖探針雜交得到環狀探針;
e、所釋放的引物在滾環擴增活性的聚合酶作用下觸發滾環擴增,合成含多個串聯的富含g序列的長dna產物;
f、切割酶切割所述長dna產物和掛鎖探針雜交所形成的雙鏈dna,產生富含g的序列和所述引物,所述引物繼續用于引發下級滾環擴增;
g、在金屬離子的作用下,富含g的序列折疊成g-四倍體結構,其選擇性與染料作用的得到增強的熒光信號,即可測得dna甲基轉移酶的活性。
所述方法為非疾病診斷與治療方法。
而當待測樣品中不存在dna甲基轉移酶時,長莖環探針保持原有的穩定結構,無法引發鏈置換放大和指數滾環擴增;則無法產生與染料相互作用的g-四倍體,致使低的背景信號。
步驟b中,所述甲基化敏感型限制性內切酶為各種類型dna甲基轉移酶所對應的限制性內切酶,如dam甲基轉移酶對應的甲基化敏感型限制性內切酶為dpni限制性內切酶。
步驟c中,所述鏈置換模板發夾探針為輔助探針,目的是引發鏈置換放大反應和釋放滾環擴增時的引物。所述發夾探針包括莖環序列和連接在其莖部序列上的懸垂單鏈;其中,所述莖環序列中包括釋放滾環擴增時的引物的互補序列和切割酶特異性識別序列,所述懸垂單鏈與觸發鏈互補,可以進行雜交。
所述鏈置換擴增活性的聚合酶為klenowfragment聚合酶,也可以為其它具有鏈置換擴增活性的聚合酶。
對切割酶的種類并沒有特殊限定,所述切割酶可為nt.bbvci酶或其它切割酶;當其為一種特定的切割酶時,那么在設計的發夾探針中的切割酶特異性識別序列與切割酶的類型相對應。
所釋放出的引物序列能夠特異性滾環擴增出所述掛鎖探針互補序列富含g的序列。
步驟d中,所述dna連接酶為t4連接酶。
所述掛鎖探針,也稱扣鎖探針或可成環探針或鎖式探針,一種人工合成的低聚核苷酸鏈分子大約有70-100個堿基,形成環型分子后的掛鎖探針可作為一種特定的信號源被滾環擴增法來快速放大與檢測。在滿足形成環型分子的基礎上,本發明的掛鎖探針的特點是包括若干個富含c序列,相鄰的富含c序列之間為切割酶的特性識別位點序列。在本發明的某些實施例中,其序列如seqidno:13所示。
步驟e中,所述滾環擴增活性的聚合酶為phi29dna聚合酶,也可以為其它滾環擴增活性的聚合酶。
步驟f中,對切割酶的種類并沒有特殊限定,所述切割酶可為nt.bbvci酶或其它切割酶。
步驟g中,所述金屬離子為k+,所述染料為n-甲基卟啉二丙酸ix(nmm)。一般g-四倍體結構的形成需要一定的離子強度和ph條件下,這種條件的摸索可以常規得到。
具體包括以下操作步驟:
(1)向待測樣品中加入長莖環探針和甲基化敏感型限制性內切酶進行孵育;
(2)向步驟(1)反應得到的體系中加入發夾探針、鏈置換擴增活性的聚合酶、切割酶和擴增原料dntps進行孵育,發生鏈置換反應,釋放用于后續擴增的引物;然后進行酶失活;
(3)向步驟(2)反應得到的體系加入dna連接酶和掛鎖探針進行孵育,所釋放的引物與掛鎖探針雜交得到環狀探針;
(4)向步驟(3)反應得到的體系中加入滾環擴增活性的聚合酶、切割酶和擴增原料dntps進行孵育,發生滾環擴增反應;
(5)向步驟(4)反應得到的體系中加入金屬離子和染料進行孵育,然后檢測熒光信號。
本發明的第四個目的是提供一種進行dna甲基化轉移酶抑制劑/拮抗劑篩選的方法,其特點是:加入候選抑制劑/拮抗劑和所述長莖環探針,進行孵育,然后加入dna甲基化轉移酶;后續步驟與所述檢測dna甲基轉移酶活性的方法相同。
本發明的第五個目的是提供一種檢測dna甲基轉移酶活性或篩選dna甲基化轉移酶抑制劑/拮抗劑的試劑盒,該試劑盒包括所述長莖環探針;
所述甲基化敏感型限制性內切酶;
鏈置換反應體系:包括鏈置換模板發夾探針、所述鏈置換擴增活性的聚合酶、切割酶和所述擴增原料dntps;
滾環擴增反應體系:包括用于滾環擴增的掛鎖探針、所述dna連接酶、所述滾環擴增活性的聚合酶、切割酶和擴增原料dntps。
上述技術方案中的一個技術方案具有如下有益效果:
(1)基于鏈置換放大和指數滾環擴增,本發明發展了一種環介導的級聯放大熒光策略用于高靈敏檢測dna甲基轉移酶活性。
(2)用于后續放大的觸發鏈被長莖環探針的長莖部區域完全封閉,有效地避免探針泄漏所引起的非特異性擴增。
(3)通過鏈置換放大和指數滾環擴增相結合,該方法可靈敏檢測dna甲基轉移酶,檢測限能達到8.1×10-5u/ml,低于大多數報道的dna甲基轉移酶活性檢測方法。
(4)此外,該方法能夠很好的區分dam甲基轉移酶與其他甲基轉移酶,具有良好的選擇性。
(5)此外,該方法成功的用于評估抑制劑對dna甲基轉移酶活性的抑制作用,尤其是成功的使用兩種抗菌藥物(慶大霉素和青霉素g)和一種抗癌藥物(5-氟尿嘧啶)用于評估dna甲基轉移酶的抑制作用。結果表明,通過有效的結合長莖環探針設計和環介導的級聯放大策略,該系統在早期癌癥診斷和治療中具有潛在的應用。
附圖說明
圖1:環介導的級聯放大策略用于高靈敏檢測dam甲基轉移酶活性的原理。
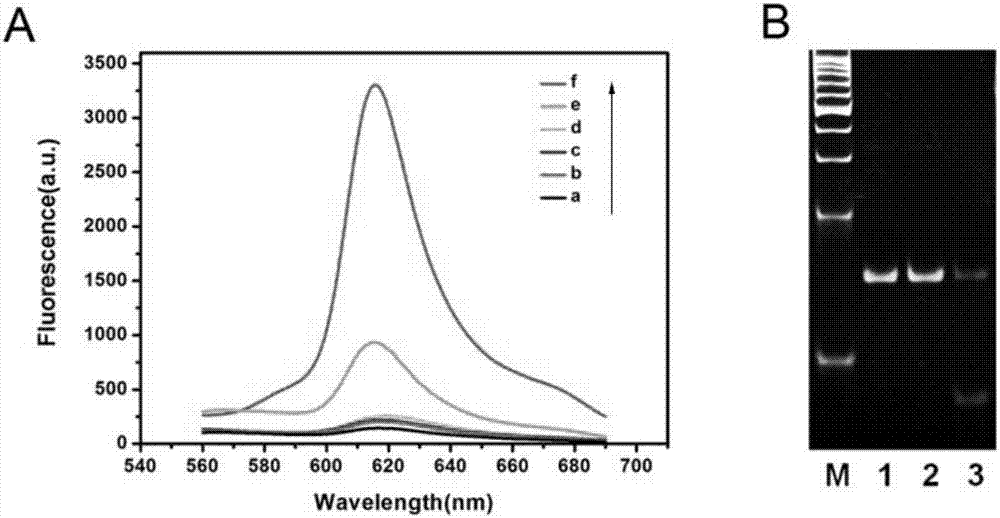
圖2:(a)不同條件下,dam甲基轉移酶檢測策略的熒光發射光譜。(b)聚丙烯酰胺凝膠電泳表征分析dam甲基轉移酶。1-3條帶分別是長莖環探針、dpni+長莖環探針和dam+dpni+長莖環探針。
圖3:緩沖區域長度對f/f0的影響。
圖4a和圖4b:dam甲基轉移酶與δf的線性關系。
圖5:不同甲基轉移酶對熒光強度的影響。
圖6:(a)1μm三種抑制劑對甲基轉移酶活性的抑制作用;(b)不同濃度的5-氟尿嘧啶對甲基轉移酶活性的抑制作用。
具體實施方式
下面結合實施例和附圖對本發明進一步說明。
本發明的試劑和儀器的說明如下:
dam、m.sssi、haeiii、hhai和alui甲基轉移酶、dpni限制性內切酶、klenowfragment(3′–5′exo-)聚合酶、nt.bbvci切割酶、s-腺苷甲硫氨酸和t4dna連接酶從neb購得。慶大霉素、青霉素g和5-氟尿嘧啶從上海生工生物技術有限公司購得。phi29dna聚合酶從fermentas獲得。實驗中所用化學品都為分析純,且使用過程中無需進一步的純化。所有的溶液均采用超純水制備(>18.25mω·cm)。該工作中的寡核苷酸由上海生工生物技術有限公司合成和純化,其序列在表格1中列出。
所有樣品的熒光光譜測量在日立f-7000熒光分光光度儀上進行。發射光譜范圍為560~690nm,激發波長為399nm。618nm處的熒光強度用于評估該傳感系統的性能。激發和發射的狹縫寬度均為5nm,激發電壓為700v。
表1.該工作中所使用的寡核苷酸序列
注釋:探針1-6中,標注下劃線的序列為長莖環探針的莖部,斜體的序列為長莖環探針的環部,探針1~6中序列(gatc)為dna甲基轉移酶的識別位點。探針和發夾中的加粗顯示為兩者的互補雜交序列。
實施例1
1、dam甲基轉移酶活性分析
向10μl甲基轉移酶緩沖液(50mmnacl,10mmtris-hcl,10mmmgcl2,1mmdithiothreitol,ph7.5)中加入160μmsam(sam為輔助因子)、20nm長莖環探針、2udpni和不同量的dam甲基轉移酶,37℃孵育2h。隨后,向上述混合液中加入40nm發夾探針、1uklenowfragment(3′–5′exo-)、2unt.bbvci和0.6mmdntps和1×cutsmart(50mmkac,20mmtris-hac,10mmmg(ac)2,100μg/mlbsa,ph7.9),37℃孵育30min。將反應系統于85℃加熱20min使酶失活,然后緩慢冷卻至30℃。之后,向反應混合液中加入120ut4dna連接酶、800nm掛鎖探針和1×t4ligasebuffer(50mmtris-hcl,10mmmgcl2,10mmdithiothreitol,1mmatp,ph7.5),37℃孵育1h。隨后加入1mmdntps、3uphi29dna聚合酶、4unt.bbvci和1×cutsmart,37℃孵育3h。將反應系統于75℃加熱20min使酶失活,然后緩慢冷卻至30℃。最后,加入200nmkcl和3μmnmm,37℃孵育30min。
2、凝膠電泳分析
凝膠電泳實驗用于驗證該傳感系統的可行性。制備好的樣品和1×loadingbuffer混合,然后使用15%非變性聚丙烯酰胺凝膠電泳將裂解產物從底物中分離出。使用1×tbe(89mmtris,89mmboricacid,2.0mmedta,ph8.3)作為電泳緩沖液,在恒定電流為30ma的條件下電泳2h。凝膠使用溴化乙錠染色5min,在蒸餾水中去染色5min。
3、藥物對dam甲基轉移酶活性的影響
為了進一步研究該方法的抑制劑篩選能力,該工作中使用三種抑制劑,慶大霉素、青霉素g和5-氟尿嘧啶,評估了其對dam甲基轉移酶活性的抑制作用。甲基化實驗在10μl甲基轉移酶緩沖液中進行,包含8u/mldam甲基轉移酶和不同濃度的抑制劑,37℃孵育2h。剩余的步驟和上述描述的相同。dam甲基轉移酶的相對活性使用下面的公式進行估算:相對活性=(f2–f0)/(f1–f0)。其中,f2和f1分別為存在或不存在抑制劑時,8u/mldam甲基轉移酶的熒光強度;f0為0u/mldam甲基轉移酶的熒光強度。
實施例2
1、原理分析
所提出的甲基轉移酶活性分析的原理如圖1所示。dam甲基轉移酶存在時,其特異性地識別和催化長莖環探針發生甲基化,形成甲基化的長莖環。隨后,dpni限制性內切酶特異性地將甲基化的長莖環切割成兩部分。一部分為雙鏈dna,一部分為新發夾探針。在實驗條件下,新發夾探針結構不穩定,發生構象轉變生成單鏈。在klenowfragment聚合酶和nt.bbvci作用下,該單鏈dna引發聚合和切割反應,釋放出多個引物。t4dna連接酶作用下,所釋放的引物與掛鎖探針雜交得到環狀探針。隨后,該引物在phi29dna聚合酶作用下觸發滾環擴增,合成含多個串聯序列的長dna產物。接下來,nt.bbvci切割長dna產物和掛鎖探針雜交所形成的雙鏈,產生大量富含g的序列和引物。該引物可用于引發下級滾環擴增。通過phi29dna聚合酶和切割酶的協同作用,最終可實現指數擴增,得到豐富的富含g的序列。通過加入k+,富含g的序列折疊成g-四倍體結構,其選擇性與nmm作用的得到增強的熒光信號。而dam甲基轉移酶不存在時,長莖環探針保持原有的穩定結構,無法引發鏈置換放大和指數滾環擴增。則無法產生于nmm相互作用的g-四倍體,致使低的背景信號。該方法的優勢有以下幾點:(1)長莖環探針中,觸發鏈被長莖部的完全封閉,有效地避免由探針泄漏所引起的背景信號;(2)用于鏈置換反應中的模板為含懸垂鏈的發夾探針,避免由線型模板折疊所引起的非特異性放大;(3)連接反應依賴于所產生的引物,有效地改善了特異性;(4)環狀探針包含三個切割酶的識別位點和兩個富含g序列的互補序列,有效地增加信號輸出;(5)鏈置換放大和指數滾環擴增的有效結合確保了dam甲基轉移酶活性分析的高靈敏度。
2、該傳感系統的可行性
我們通過觀察熒光發射光譜以驗證該策略的可行性,如圖2a所示。系統中只存在nmm時,熒光信號極弱(曲線a)。當發夾探針或dpni不存在時,熒光強度也很弱(曲線b和c),表明切割和放大反應需要dpni和發夾探針。與甲基轉移酶不存在時的低熒光信號相比(曲線d),甲基轉移酶加入引起增強的熒光信號(曲線e),表明甲基化和切割反應發生了,且所產生的單鏈dna引發后續的鏈置換放大和滾環擴增。與之相比,當甲基轉移酶和足夠的nt.bbvci加入時,熒光信號的顯著增加(曲線f)。這種結果表明甲基化和切割反應發生了,且所產生的單鏈dna引發后續的鏈置換放大和指數滾環擴增。此外,聚丙烯酰胺凝膠電泳用于進一步的驗證dam甲基轉移酶的甲基化過程。如圖2b所示,當dam甲基轉移酶和dpni限制性內切酶都不存在時,只有長莖環的一條亮帶(條帶1),表明無甲基化和切割事件發生。當只有dpni限制性內切酶存在時,可以觀察到一條相似的條帶(條帶2)。與之相比,當dam甲基轉移酶和dpni限制性內切酶都存在時,可以觀察到明亮的條帶變暗且低分子量的新條帶產生(條帶3),表明長莖環探針發生甲基化且甲基化的探針被dpni限制性內切酶切割。實驗結果和上述描述的熒光發射光譜實驗結果相一致。
3、長莖環探針設計的優化
長莖環探針中,dam甲基轉移酶識別位點和環部的序列長度(稱為緩沖區域)是合理的長莖環探針設計的重要因素。合理的設計可以有效地降低背景信號且dam甲基轉移酶存在時顯著地增強熒光信號。在此,我們設計了六種具有不同緩沖區域長度的長莖環探針。如圖3所示,隨著緩沖區域的長度從1增加到3個堿基(探針1、探針2和探針3),傳感系統的f/f0逐漸地增加,表明緩沖區域長度的增加利于dam甲基轉移酶識別堿基對的雜交,以促進高效的酶反應。然而,當緩沖區域的長度進一步的從4增加到7個堿基(探針4、探針5和探針6),f/f0降低,表明經dpni限制性內切酶切割后所產生的新發夾探針相對穩定,不易發生構象轉變為單鏈用于后續擴增反應。因此,我們選擇3個堿基長度的緩沖區域為最優的設計。
4、該傳感系統的分析性能
為了評估該方法的分析性能,我們在最優條件下測量了不同濃度的dam甲基轉移酶。如圖4a所示,隨著dam甲基轉移酶濃度的增加,熒光強度增加。這和事實相一致,更高濃度的dam甲基轉移酶可以產生更多的g-四倍體結構。所產生的g-四倍體結構與nmm作用,產生增強的熒光強度。當dam甲基轉移酶濃度高于1.0×10-2u/ml時,熒光強度增長速度變小。其原因為,dam甲基轉移酶濃度較高時,幾乎所有的探針都發生甲基化。如圖4b的內插圖所示,凈信號δf與dam甲基轉移酶濃度(4.0×10-4~1.0×10-2u/ml)的對數呈線性關系,檢測限為8.1×10-5u/ml,檢測限低于現有報道的大多數檢測限。表明該方法是一種有效的檢測dam甲基轉移酶活性的方法。該方法令人滿意的靈敏度可能歸因于以下兩個因素:(1)長莖環探針的低背景泄漏;(2)鏈置換放大和連接反應改善的特異性;(3)鏈置換反應和指數滾環擴增的高放大效率。
5、選擇性
為了考察該方法的選擇性,我們選擇四種不同的甲基轉移酶作為潛在的干擾酶,包括m.sssi、alui、haeiii和hhai甲基轉移酶,其識別序列分別為5′-ccgg-3′、5′-agct-3′、5′-ggcc-3′和5′-gcgc-3′。如圖5所示,8u/mldam甲基轉移酶可以誘導顯著的熒光強度增加。相反,其余的甲基轉移酶不能誘導顯著的熒光強度變化。該結果表明該方法對于dam甲基轉移酶具有良好的選擇性。
精密度和重現性是衡量分析方法實際應用的重要參數,我們通過計算日內和日間實驗的相對標準偏差(rsd)來評估方法的精密度和重現性(n=3)。選擇的高、中、低三個濃度分別為8.0×10-4u/ml、2.0×10-3u/ml和8.0×10-3u/ml。日內rsd分別為3.2%、2.8%和1.2%。相同濃度下,日間rsd分別為4.6%、2.8%和2.2%。這些結果表明該方法具有可接受的精密度和重現性。
6、復雜生物樣品的分析
為了評估該方法在復雜生物樣品中的實際應用,對10%稀釋的人血清樣品加標不同濃度的dam甲基轉移酶進行了考察。選擇的高、中、低三個濃度分別為8.0×10-4u/ml、2.0×10-3u/ml和8.0×10-3u/ml。其回收率分別為98.7%、95%和98.7%,且rsd分別為4.1%、3.0%和2.6%。這些結果表明,該方法在復雜生物樣品中準確定量dam甲基轉移酶方面具有很大的潛力。
7、dna甲基轉移酶活性的抑制評估
為了評估該方法潛在的抑制劑篩選能力,我們選擇慶大霉素、青霉素g和5-氟尿嘧啶為典型的甲基轉移酶抑制劑。如圖6a所示,1μm三種抑制劑中,5-氟尿嘧啶由于具有高毒性而對dam甲基轉移酶具有更好的抑制效率。且從圖6b可看出,隨5-氟尿嘧啶濃度增加,系統相對活性降低。5-氟尿嘧啶的ic50值(降低50%酶活性所需的抑制劑濃度)約為0.8μm。這些結果表明,該方法在研究抗癌藥物對dna甲基轉移酶活性的抑制影響和篩選dna甲基轉移酶抑制劑方面具有潛在的應用。
總結:
簡而言之,基于鏈置換放大和指數滾環擴增,我們發展了一種環介導的級聯放大熒光策略用于高靈敏檢測dam甲基轉移酶活性。用于后續放大的觸發鏈被長莖環探針的長莖部完全封閉,有效地避免探針泄漏所引起的非特異性擴增。通過鏈置換放大和指數滾環擴增相結合,該方法可靈敏檢測dam甲基轉移酶,檢測限為8.1×10-5u/ml,低于大多數報道的dna甲基轉移酶活性檢測方法。此外,該方法能夠很好的區分dam甲基轉移酶與其他甲基轉移酶,具有良好的選擇性。此外,該方法成果的用于評估抑制劑對dna甲基轉移酶活性的抑制作用。上述結果表明,該系統在早期癌癥診斷和治療中具有潛在的應用。
上述實施例為本發明較佳的實施方式,但本發明的實施方式并不受上述實施例的限制,其他的任何未背離本發明的精神實質與原理下所作的改變、修飾、替代、組合、簡化,均應為等效的置換方式,都包含在本發明的保護范圍之內。
- 還沒有人留言評論。精彩留言會獲得點贊!