一種接種液組合物及利用其構建惡性胸腔積液來源異種移植瘤動物模型的方法與流程
本發明屬于醫藥模型領域。更具體而言,本發明涉及惡性胸腔積液來源的異種移植瘤動物模型的構建。
背景技術:
在我國,肺癌已代替肝癌成為首位惡性腫瘤死亡原因,而且發病率和死亡率仍在繼續迅速上升。肺癌的高死亡率主要是因為60-70%的肺癌患者被發現時已是肺癌晚期,失去了手術機會無法根治。
腫瘤動物模型是進行腫瘤相關機制和藥物篩選研究的重要平臺。目前,臨床前腫瘤動物模型多采用腫瘤細胞系進行皮下接種的方法,其具有易建立和易重復等優點。但腫瘤細胞系因在體外建立,脫離了自然的腫瘤微環境,使其遺傳不穩定且不能概括患者腫瘤的異質性。因此該方法建立的腫瘤動物模型,不能完全反映癌癥病人復雜的臨床癥狀,具有很大局限性。為了克服這些問題,研究者們建立了癌癥病人來源的異體移植腫瘤動物模型,即將來源于患者的手術腫瘤組織移植入免疫缺陷小鼠體內。該模型非常好得維持了腫瘤移植物的組織學特性、基因表達譜、SNP位點和拷貝數變異等多個特征,因此可應用于病人的個性化藥物篩選、生物標志物鑒定、臨床前腫瘤藥物藥效評價和生物學機制研究等,為藥物臨床試驗結果的預測提供了更加準確的結果。
目前,肺癌患者來源腫瘤移植模型的建立方法主要是利用患者的手術組織移植入免疫缺陷小鼠皮下。雖然,在臨床上很多肺癌患者經常合并發生的惡性胸腔積液,其他惡性腫瘤晚期也會伴發惡性胸腔積液,例如乳腺癌、淋巴瘤等惡性腫瘤(參見,林江濤等,胸膜活檢聯合胸水脫落細胞學檢查在惡性胸腔積液診斷中的應用,《內科急危重癥雜志》,2001,7(1))。然而,由于惡性胸腔積液中腫瘤細胞不僅數量較少,而且腫瘤細胞中含有已死亡或接近死亡的腫瘤細胞,除此之外胸水還含有免疫細胞及其他細胞,免疫細胞產生的炎癥因子及其本身可能會殺傷腫瘤細胞。由于上述限制,一般認為,無法用惡性胸水來構建異種移植瘤動物模型。目前針對肺癌動物模型的研究方向主要是側重于如何將手術采集到的腫瘤組織原位移植到動物中來構建異種移植瘤動物模型(王力偉等,移植性肺癌動物模型研究進展,《介入放射學雜志》,2015,24(7))。
綜上所述,本領域迫切需要一種利用惡性胸腔積液構建異種移植瘤動物模型的方法。
技術實現要素:
根據本發明第一方面,提供了一種惡性胸腔積液來源異種移植瘤動物模型,所述動物模型由以下方法構建:
(a)采集臨床惡性胸腔積液樣本;
(b)富集所述惡性胸腔積液樣本中的腫瘤細胞;以及
(c)將如步驟(b)富集所得到的腫瘤細胞接種至實驗動物,飼養動物至腫瘤形成,從而獲得惡性胸腔積液來源的異種移植瘤動物模型。
一個優選實施方式中,所述步驟(b)中使用FX系統進行細胞富集。
一個優選實施方式中,將所述步驟(b)所獲得的腫瘤細胞進行H&E染色,CK免疫熒光染色,以檢測所富集的細胞是否為腫瘤細胞。
一個優選實施方式中,將所述步驟(b)所獲得的腫瘤細胞用無菌接種液處理,所述無菌接種液包含:45體積份的HBSS,5體積份的胎牛血清和50體積份的Matrigel膠,加入Thiazovivin,終濃度為10uM。
另一個優選實施方式中,所述實驗動物為重癥聯合免疫缺陷(SCID)小鼠。
另外一個優選實施方式中,所述惡性胸腔積液樣本選自含有以下的基因型:EGFR20號外顯子T790M突變、EGFR 21號外顯子L858R突變、和/或ALK融合基因。
根據本發明第二方面,提供一種無菌接種液組合物,包含以下組分:Hank′s平衡鹽緩沖液和/或磷酸緩沖液PBS,胎牛血清,基底膜基質膠,和ROCK蛋白抑制劑。
一個優選實施方式中,所述基底膜基質膠選自Matrigel膠或Cultrex BME膠;所述ROCK蛋白抑制劑選自Thiazovivin、Y-27632、吡那地爾(Pinacidil)、法舒地爾(Fasudil)、Ripasudil、RKI-1447、GSK429286A,或它們的任意組合。
另一個優選實施方式中,所述Hank′s平衡鹽緩沖液(購自Invitrogen,14170)為35-55體積份,胎牛血清為3-10體積份,基底膜基質膠為40-60體積份,并且ROCK蛋白抑制劑的終濃度為5-20uM。
根據本發明第三方面,提供一種構建惡性胸腔積液來源異種移植瘤動物模型的方法,包括以下步驟:
(a)采集臨床惡性胸腔積液樣本;
(b)富集所述惡性胸腔積液樣本中的腫瘤細胞;
(c)使用根據本發明的無菌接種液組合物懸浮步驟(b)中富集的腫瘤細胞;以及
(d)將如步驟(c)所述懸浮于無菌接種液組合物中的腫瘤細胞接種至實驗動物,飼養動物至腫瘤形成,從而獲得惡性胸腔積液來源的異種移植瘤動物模型。
一個優選實施方式中,所述步驟(b)中使用FX系統進行細胞富集。
另一個優選實施方式中,所述實驗動物為重癥聯合免疫缺陷(SCID)小鼠。
另外一個優選實施方式中,所述惡性胸腔積液樣本來自肺癌、乳腺癌、淋巴瘤、或卵巢癌。
根據本發明第四方面,提供一種根據本發明的方法構建的動物模型在臨床或科研研究中的應用。
一個優選實施方式中,所述應用選自藥物篩選研究、藥效學研究、藥理學研究、患者響應性研究、基因特異性研究、生物標志物研究、和/或生物學機制研究。
另外一個優選實施方式中,所述動物模型應用于選自以下的基因型:EGFR20號外顯子T790M突變、EGFR 21號外顯子L858R突變、和/或ALK融合基因。
本發明提供的技術方案能夠利用惡性胸腔積液建模,因惡性胸腔積液采集方便,同時對患者生活影響小等特點,因此可多次建模,提高成功率。本發明提供的惡性胸腔積液建模技術方案可以針對喪失手術機會的晚期肺癌患者惡性胸水進行建模,從而可在臨床和科研中的有很大的實際應用價值。
本發明建立異種移植瘤動物模型的方法最大程度地保留了腫瘤的細胞生物學活性,忠實地還原了患者腫瘤細胞的相關特征,整個模型建立過程簡單易行,成瘤率高達40%,因此可用于各種具有惡性胸腔積液的癌癥特別是肺癌的藥物篩選及機制研究。
下面通過參考附圖和具體實施方式進一步詳細闡述本發明,但這些闡述僅僅是為了使本領域技術人員更好地理解和實施本發明,并不對本發明做任何形式的限制。除非另有說明,否則本文所用的所有科學和技術術語具有本發明所屬和相關技術領域的一般技術人員通常理解的含義。
附圖說明
圖1顯示富集的腫瘤細胞的CK免疫熒光染色。
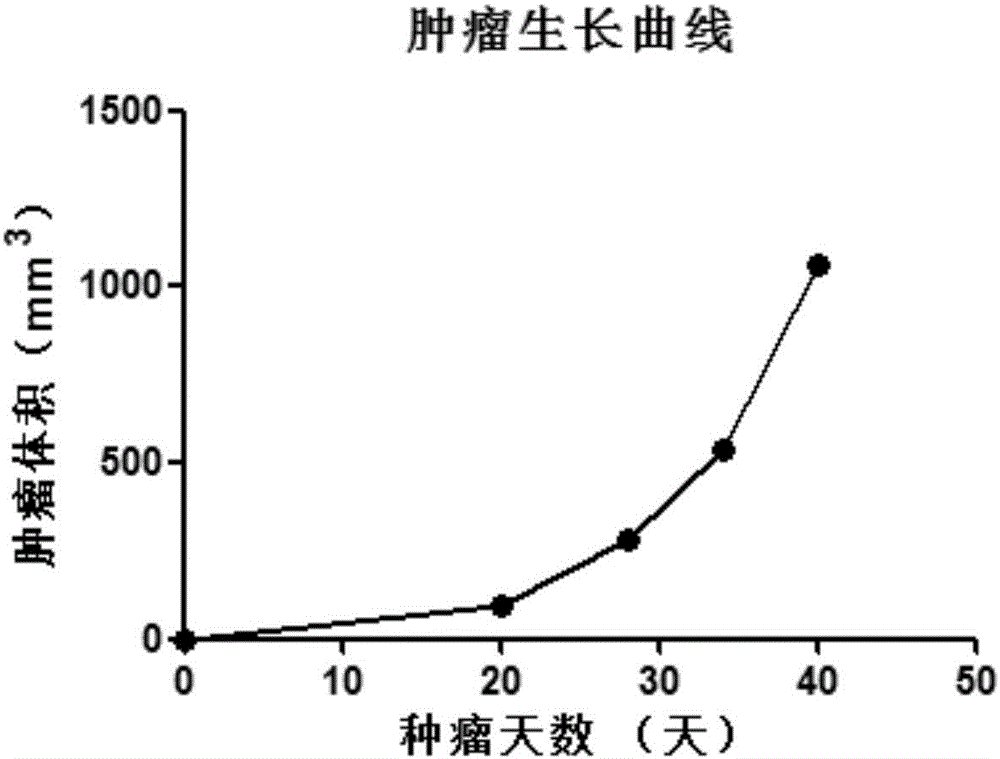
圖2顯示富集的腫瘤細胞移植入小鼠皮下之后的腫瘤生長曲線。
圖3顯示從惡性胸腔積液臨床樣本中富集的腫瘤細胞的蘇木精伊紅染色。
圖4顯示ALK融合基因模型CTC15012的克卓替尼(Crizotinib)藥效實驗。
圖5顯示EGFR 21號外顯子L858R突變模型CTC15008的吉非替尼(Gefitnib)藥效實驗。
圖6顯示EGFR 20號外顯子T790M突變模型CTC15015的埃羅替尼(Erlotinib)藥效實驗。
圖7顯示EGFR 20號外顯子T790M突變模型CTC15015的AZD9291藥效實驗。
具體實施方式
在本申請上下文中,術語“接種液組合物”、“接種液”、“無菌接種液”、“無菌接種液組合物”可互換使用。
本申請上下文中的術語“包括”和“包含”可以相互替換使用,并同時涵蓋了“由…組成”這一表述。
在本發明中,如果沒有特別說明,本文所提到的所有技術特征以及優選技術特征可以相互組合形成新的技術方案。
在本發明中,如果沒有特別說明,本文所提到的所有實施方式以及優選實施方式可以相互組合形成新的技術方案。
異種移植瘤動物模型是指將腫瘤組織或細胞移植到實驗動物例如小鼠、大鼠等的體內所形成的腫瘤動物模型。移植性模型由于具有實驗條件易于控制、實驗周期較短而且可以在同種或同品系動物中連續移植等優點而被廣泛用于癌癥研究。
胸腔是由壁層胸膜與臟層胸膜所組成的一個封閉性腔隙,其內為負壓,正常情況下兩層胸膜之間存在很少量的起潤滑作用的液體,以減少在呼吸活動過程中兩層胸膜之間的摩擦。當發生某種病理情況影響到胸膜,無論是壁層胸膜產生胸水或是臟層胸膜吸收胸水的速率有變化,都可使胸腔內液體增多,形成所謂的胸腔積液(參見,中國專利申請CN102676456A)。
本發明人通過將惡性胸腔積液中的腫瘤細胞有針對性地富集,從而獲得了惡性胸腔積液來源異種移植瘤動物模型。單純通過富集的方法,建模方法成瘤率通常很低,一般低于10%。
本發明人還意外地發現,使用本發明所述的接種液,能夠顯著提高用惡性胸腔積液來源的癌癥細胞構建異種移植瘤動物模型的成瘤率。
不受任何理論的約束,本發明人出乎意料地發現,使用本發明的方法,尤其是使用本發明所述的接種液,優選組合使用FX系統進行細胞富集,能夠非常顯著地提高用惡性胸腔積液來源的癌癥細胞構建異種移植瘤動物模型的成瘤率。
本發明第一方面提供了一種惡性胸腔積液來源異種移植瘤動物模型,所述動物模型由以下方法構建:
(a)采集臨床惡性胸腔積液樣本;
(b)富集所述惡性胸腔積液樣本中的腫瘤細胞;以及
(c)將如步驟(b)富集所得到的腫瘤細胞接種至實驗動物,飼養動物至腫瘤形成,從而獲得惡性胸腔積液來源的異種移植瘤動物模型。
一個優選實施方式中,所述步驟(b)中使用FX系統進行細胞富集。
一個優選實施方式中,將所述步驟(b)所獲得的腫瘤細胞進行H&E染色,CK免疫熒光染色,以檢測所富集的細胞是否為腫瘤細胞。
一個優選實施方式中,將所述步驟(b)所獲得的腫瘤細胞用無菌接種液處理,所述無菌接種液包含:45體積份的HBSS,5體積份的胎牛血清和50體積份的Matrigel膠,加入Thiazovivin,終濃度為10uM。
另一個優選實施方式中,所述實驗動物為重癥聯合免疫缺陷(SCID)小鼠。
另外一個優選實施方式中,所述惡性胸腔積液樣本來自肺癌、乳腺癌、淋巴瘤、或卵巢癌。
本發明第二方面提供一種接種液組合物,該組合物包含以下組分:Hank′s平衡鹽緩沖液,胎牛血清,基底膜基質膠,和ROCK蛋白抑制劑。
一種優選實施方式中,本發明提供一種接種液組合物,該接種液組合物由以下組分組成:Hank′s平衡鹽緩沖液,胎牛血清,基底膜基質膠,和ROCK蛋白抑制劑。
Hank′s平衡鹽緩沖液(Hank′s Balanced Salt Solution,HBSS)是用于細胞培養的常用緩沖液,可通過商業途徑購得,例如可購自Sigma-Aldrich、ThermoFisher Scientific等公司。同樣,本發明中使用的胎牛血清也可通過商業途徑購得,例如可購自Sigma-Aldrich等公司。
基底膜基質膠(Basement Membrane Matrix),也稱為基底膜細胞外基質、基底膜提取物、EHS基質等,是一種可溶性的基底膜制備物,提取自Engelbreth-Holm-Swarm(EHS)小鼠肉瘤,富含細胞外基質(ECM)蛋白諸如層粘連蛋白、膠原IV、巢蛋白和各種細胞因子(https://www.corning.com/worldwide/en/products/life-sciences/products/surfaces/matrigel-matrix.html)。由于含有細胞體外貼壁、生長和分化所需的多種化學物質,基底膜基質膠已被廣泛用于2D和3D細胞體外培養。目前,市場上提供基底膜基質膠的公司主要有Sigma-Aldrich公司(Matrigel,例如商品號E1270),Corning公司(商品名),Trevigen公司(商品名BME)。這些基底膜基質膠都可以合適地用于本發明,例如優選使用或BME。
ROCK蛋白(Rho相關蛋白激酶)是一種蛋白激酶,屬于絲氨酸-蘇氨酸激酶的AGC家族。ROCK蛋白主要通過作用于細胞骨架來調控細胞的形狀和移動。ROCK蛋白抑制劑是指靶向ROCK蛋白的一系列化合物,目前已知的ROCK蛋白抑制劑例如Thiazovivin、Y-27632、吡那地爾(Pinacidil)、法舒地爾(Fasudil)、Ripasudil、RKI-1447、GSK429286A等。本發明可使用任何合適的ROCK蛋白抑制劑,例如包括但不限于Thiazovivin、Y-27632、吡那地爾(Pinacidil)、法舒地爾(Fasudil)、Ripasudil、RKI-1447、GSK429286A,或它們的任意組合。不受任何理論的限制,但發明人相信,ROCK蛋白抑制劑可抑制細胞的凋亡,因此可能提高細胞的存活,增加建模的成功率。
一個優選實施方式中,所述Hank′s平衡鹽緩沖液為35-55體積份,胎牛血清為3-10體積份,基底膜基質膠為40-60體積份,并且ROCK蛋白抑制劑的終濃度為5-20uM。更優選的,Hank′s平衡鹽緩沖液為40-50體積份,胎牛血清為4-8體積份,基底膜基質膠為45-55體積份,并且ROCK蛋白抑制劑的終濃度為8-15uM。最優選的,Hank′s平衡鹽緩沖液為45體積份,胎牛血清為5體積份,基底膜基質膠為50體積份,并且ROCK蛋白抑制劑的終濃度為10uM。
因此,一個優選實施方式中,本發明的無菌接種液由以下組分組成:Hank′s平衡鹽緩沖液,胎牛血清,Matrigel膠,和Thiazovivin。例如,本發明的無菌接種液由以下組分組成:35-55體積份的Hank′s平衡鹽緩沖液;3-10體積份的胎牛血清;40-60體積份的Matrigel膠;以及終濃度為5-20uM的Thiazovivin。優選的,本發明的無菌接種液由以下組分組成:40-50體積份的Hank′s平衡鹽緩沖液;4-8體積份的胎牛血清;45-55體積份的Matrigel膠;以及終濃度為8-15uM的Thiazovivin。最優選的,本發明的無菌接種液由以下組分組成:45體積份的Hank′s平衡鹽緩沖液;5體積份的胎牛血清;50體積份的Matrigel膠;以及終濃度為10uM的Thiazovivin。
本發明還提供一種構建惡性胸腔積液來源異種移植瘤動物模型的方法,該方法包括以下步驟:
(a)采集臨床惡性胸腔積液樣本;
(b)富集所述惡性胸腔積液樣本中的腫瘤細胞;
(c)使用根據本發明的無菌接種液組合物懸浮步驟(b)中富集的腫瘤細胞;以及
(d)將如步驟(c)所述懸浮于無菌接種液組合物中的腫瘤細胞接種至實驗動物,飼養動物至腫瘤形成,從而獲得惡性胸腔積液來源的異種移植瘤動物模型。
優選地,步驟(b)中使用FX系統(Clearbridge BioMedics公司)進行細胞富集。FX系統使用微流控分選技術,其基于ClearCell CTChip FR1芯片驅動,無須標記細胞,即可達到腫瘤細胞的富集效果,是全球第一個采用全自動細胞檢索系統進行活的腫瘤細胞的富集技術。與目前市場上常用的循環腫瘤細胞富集系統相比,FR系統具有三大優勢:準確度、敏感度更高,且無需標記;富集到的循環腫瘤細胞純度更高;富集活的腫瘤細胞,保持了較高的腫瘤細胞生物活性。本發明優選使用FX系統進行細胞富集,但本發明中癌細胞的分離和富集也可使用傳統的離心沉淀等技術或者本領域知曉的從胸水中分離富集癌細胞的其他任何合適的方法(例如,參見中國專利申請CN102676456A)。
一個優選實施方式中,將所述步驟(b)所獲得的腫瘤細胞進行H&E染色,CK免疫熒光染色,以檢測所富集的細胞是否為腫瘤細胞。
另一個優選實施方式中,所述實驗動物為小鼠或大鼠,更優選小鼠,最優選為重癥聯合免疫缺陷(SCID)小鼠。
另外一個優選實施方式中,所述惡性胸腔積液樣本來自肺癌、乳腺癌、淋巴瘤、或卵巢癌。惡性胸水主要由胸腔臟器的惡性腫瘤引起,尤其常見于晚期肺癌(例如非小細胞肺癌),但也見于乳腺癌、淋巴瘤、卵巢癌等癌癥。
優選地,在步驟(b)之后還包括鑒定所富集的細胞是否為腫瘤細胞的步驟,例如通過H&E染色、細胞角蛋白(Cytokeratin,CK)免疫熒光染色檢測所富集的細胞是否為腫瘤細胞。另外一個實施方式中,在使用FX系統進行細胞富集之前,用PBS清洗細胞,加入紅細胞裂解液裂解,并用PBS重懸細胞。
本發明第四方面提供一種根據本發明的方法構建的動物模型在臨床或科研研究中的應用。根據本發明的方法構建的動物模型可應用于多種臨床或科研研究中,包括但不限于藥物篩選研究、藥效學研究、藥理學研究、患者響應性研究、基因特異性研究、生物標志物研究、和/或生物學機制研究。
另外,由于惡性胸腔積液多出現于晚期癌癥患者,很多患者的積液出現于治療耐藥后,因此由此類樣本所建立的模型多為較特殊的基因突變模型,例如EGFR20號外顯子T790M突變和ALK融合基因耐藥。因此,一個優選實施方式中,根據本發明的方法構建的動物模型應用于選自以下的基因型:EGFR20號外顯子T790M突變、EGFR 21號外顯子L858R突變、和/或ALK融合基因。
本發明可適用于晚期癌癥尤其是肺癌(例如非小細胞肺癌)伴發惡性胸腔積液的患者,收集該類患者的惡性胸腔積液進行異源移植小鼠模型的建立。因為通過惡性胸腔積液建模成功率非常低且不穩定,所以惡性胸腔積液腫瘤細胞首先采用微流控技術進行高純度富集,同時用本發明的無菌接種液懸浮富集的腫瘤細胞,最大程度保留了腫瘤細胞生物學活性,隨后接種至重癥聯合免疫缺陷小鼠皮下生長,忠實地還原了患者腫瘤細胞的相關特征,整個模型建立過程簡單易行,成瘤率高達40%,可用于肺癌藥物篩選及肺癌的機制研究。通過本發明建立的肺癌患者惡性胸腔積液來源異種移植瘤模型具有制作過程操作簡單方便,具可重復性,建模成功率高,易于推廣等優點,適用于藥物篩選及實驗研究,且收集胸液過程中所施行的胸腔閉式引流術或胸腔穿刺術對患者影響小。
下面將結合具體實施例進一步闡述本發明。在以下實施例中,如無特別說明,所用的實驗材料和試劑均可在常規生化試劑公司購得。所用的實驗方法,如無特殊說明,均為常規方法。另外,這些實施例僅用于說明本發明而不以任何方式限制本發明的范圍。本發明的范圍僅由所附的權利要求書限定。本領域技術人員在閱讀了本公開內容之后,可在不脫離本發明精神和范圍的情況下對本發明做出多種改動和變化,這些改動和變化都應認為是本發明實施方式的等同形式而落在本發明的范圍內。
實施例
實施例1肺癌惡性胸腔積液來源的異種移植瘤小鼠模型的構建
1.實驗動物
從供應商訂購4-5周齡的雌性重癥聯合免疫缺陷小鼠,飼養于SPF級別動物房,實驗開始前動物至少適應性飼養三天。
2.實驗過程
2.1肺癌臨床惡性胸腔積液樣本的采集
收取新鮮收集的非小細胞肺癌惡性胸腔積液樣本各200ml于含抗凝劑的試管中,冰上運輸,在24小時內運至實驗室。共收集15例惡性胸腔積液。
2.2惡性胸腔積液中腫瘤細胞的富集
在生物安全柜中用一倍體積的PBS緩沖液(HyClone公司,SH30256.01)稀釋惡性胸腔積液樣本,500g離心10分鐘,去上清,PBS重懸,重復離心清洗2次。
PBS重懸后,用70um濾網過濾,500g離心10分鐘。去上清,加入紅細胞裂解液,裂解3-5分鐘,加2-3倍體積的PBS中和,500g離心10分鐘。去上清,加入適量PBS重懸。細胞懸液上至腫瘤細胞富集儀ClearCell FX系統(Clearbridge BioMedics公司)中,進行腫瘤細胞的富集。
將富集的細胞取30000個細胞進行貼片,H&E染色,CK免疫熒光染色確定所富集的細胞為腫瘤細胞(結果見附圖1),并經專業病理科醫師確認。
2.3配制無菌接種液
混合45體積份的HBSS緩沖液,5體積份的胎牛血清和50體積份的Matrigel(SIGMA,E1270-10ml)膠,并加入ROCK蛋白抑制劑Thiazovivin(Selleck,S1459)至終濃度為10uM。將配制好的上述接種液滅菌。
2.4肺癌患者惡性胸腔積液來源腫瘤移植模型的建立
將富集的腫瘤細胞分為兩份,一份不加無菌接種液,一份懸浮于上述制備的無菌接種液中,用注射器分別皮下移植到重癥聯合免疫缺陷小鼠右側背部。細胞移植后,每天觀察小鼠健康狀況,定期檢測腫瘤生長情況,用電子游標卡尺每周測量一次腫瘤的長和寬,腫瘤體積計算公式:TV=(長*寬2)/2。腫瘤生長情況參見附圖2(該圖是CTC15012的生長曲線)。
2.5腫瘤組織的病理學分析
用蘇木精伊紅染色對形成的腫瘤組織進行常規病理學檢測(結果見附圖3)。
3.實驗結果
通過收集的15例惡性胸腔積液進行建模,不加無菌接種液組,僅成瘤2例,一例為ALK融合基因肺癌模型,另一例為EGFR 20號外顯子插入突變肺癌模型,成瘤率為13.3%。而加無菌接種液組,最終建成6例異源移植小鼠模型,其中包含兩例ALK融合基因(其中一例命名為CTC15012),一例EGFR 21號外顯子L858R突變(命名為CTC15008),一例EGFR 20號外顯子T790M突變(命名為CTC15015),一例EGFR 20號外顯子插入突變及一例EGFR野生型,成瘤率達到40%。
實施例2在非小細胞肺癌模型CTC15012上進行的藥效實驗
為了驗證本發明所建立的肺癌突變模型與臨床反應一致,在所建立的動物模型上進行與臨床病人所服用的藥物一致的相應的藥效實驗。
雌性NU/NU裸小鼠皮下接種人源的ALK融合基因模型CTC15012腫瘤塊。非小細胞肺癌模型CTC15012源自于一名55歲女性病人,該患者的病理診斷為支氣管肺腺癌。將腫瘤于HBSS中剪成剪碎成小塊接種到裸鼠的皮下,待腫瘤長至500-700mm3時,將腫瘤在HBSS培養液中剪成10-15mg的小塊用于20只實驗裸鼠皮下接種。具體接種方法為:碘伏對小鼠背部兩側皮膚消毒,用20號套管針將總量2×2×2mm3的腫瘤快組織于背部兩側刺入,針頭走行于皮膚與肌肉間,最終將組織送入前肢肩背部皮下,壓迫傷口至無出血。SPF級環境下常規飼養,待腫瘤體積長至平均約100-300mm3時,挑選12只腫瘤生長均一性較好的荷瘤小鼠,根據腫瘤大小和裸鼠體重隨機分組給藥,分組如下:
第一組:N=6,對照組,灌胃給藥,一天一次;
第二組:N=6,克卓替尼,25mg/kg,灌胃給藥,一天一次。
每組小鼠每天稱重給藥并觀察小鼠健康狀況,每周調查2次小鼠腫瘤體積。
結果如圖4所示,ALK融合基因模型CTC15012對ALK抑制劑克卓替尼(Selleck,S1068)敏感。
實施例3在非小細胞肺癌模型CTC15008上進行的藥效實驗
雌性NU/NU裸小鼠皮下接種人源的EGFR 21號外顯子L858R突變模型CTC15008腫瘤塊。非小細胞肺癌模型CTC15008源自于一名71歲女性病人,該患者的病理診斷為支氣管肺腺癌。將腫瘤于HBSS中剪成剪碎成小塊接種到裸鼠的皮下,待腫瘤長至500-700mm3時,將腫瘤在HBSS培養液中剪成10-15mg的小塊用于20只實驗裸鼠皮下接種。具體接種方法為:碘伏對小鼠背部兩側皮膚消毒,用20號套管針將總量2×2×2mm3的腫瘤快組織于背部兩側刺入,針頭走行于皮膚與肌肉間,最終將組織送入前肢肩背部皮下,壓迫傷口至無出血。SPF級環境下常規飼養,待腫瘤體積長至平均約100-300mm3時,挑選12只腫瘤生長均一性較好的荷瘤小鼠,根據腫瘤大小和裸鼠體重隨機分組給藥,分組如下:
第一組:N=6,對照組,灌胃給藥,一天一次;
第二組:N=6,吉非替尼,75mg/kg,灌胃給藥,一天一次。
每組小鼠每天稱重給藥并觀察小鼠健康狀況,每周調查2次小鼠腫瘤體積。
結果如圖5所示,EGFR 21號外顯子L858R突變模型CTC15008對EGFR抑制劑吉非替尼(Selleck,S1025)敏感。
實施例4在非小細胞肺癌模型CTC15015上進行的藥效實驗
雌性NU/NU裸小鼠皮下接種人源的EGFR 20號外顯子T790M突變模型CTC15015腫瘤塊。非小細胞肺癌模型CTC15015源自于一名51歲男性病人,該患者的病理診斷為支氣管肺腺癌,臨床對埃羅替尼耐藥。將腫瘤于HBSS中剪成剪碎成小塊接種到裸鼠的皮下,待腫瘤長至500-700mm3時,將腫瘤在HBSS培養液中剪成10-15mg的小塊用于30只實驗裸鼠皮下接種。具體接種方法為:碘伏對小鼠背部兩側皮膚消毒,用20號套管針將總量2×2×2mm3的腫瘤快組織于背部兩側刺入,針頭走行于皮膚與肌肉間,最終將組織送入前肢肩背部皮下,壓迫傷口至無出血。SPF級環境下常規飼養,待腫瘤體積長至平均約100-300mm3時,挑選18只腫瘤生長均一性較好的荷瘤小鼠,根據腫瘤大小和裸鼠體重隨機分組給藥,分組如下:
第一組:N=6,對照組,灌胃給藥,一天一次;
第二組:N=6,埃羅替尼,50mg/kg,灌胃給藥,一天一次。
第三組:N=6,AZD9291,5mg/kg,灌胃給藥,一天一次。
每組小鼠每天稱重給藥并觀察小鼠健康狀況,每周調查2次小鼠腫瘤體積。
結果如圖6所示,EGFR 20號外顯子T790M突變模型CTC15015對EGFR抑制劑埃羅替尼(Selleck,S1023)不敏感。結果如圖7所示,EGFR 20號外顯子T790M突變模型CTC15015對EGFR抑制劑AZD9291(Selleck,S7297)敏感。
- 還沒有人留言評論。精彩留言會獲得點贊!