一種人胚胎干細胞快速定向分化至視網膜色素上皮細胞的方法與流程
本發明涉及一種細胞培養方法,具體涉及一種人胚胎干細胞快速定向分化至視網膜色素上皮細胞的方法。
背景技術:
視網膜色素上皮細胞(Retinal pigment epithelial cell,簡稱RPE細胞)是一層緊貼于視網膜視覺神經之外的色素細胞。融合的RPE細胞在顯微鏡下呈現單層六邊形,細胞內含有密集的色素顆粒。RPE細胞具有多種細胞功能,例如,吸收光線,上皮性轉運,離子緩沖,視覺環路,細胞吞噬,分泌及免疫調節,對于維持視網膜上各種視覺神經元細胞的正常功能有重要作用1-2。其中比較重要的功能有:1)上皮性轉運:RPE細胞形成了血視網膜屏障(Blood retina barrier),它與雙側表面外的細胞緊密結合,并使視網膜內層獨立于外部系統的影響,這對眼部精密調控環境中的高選擇性物質轉運以及神經信號轉遞有重要意義,同時,RPE細胞為感光細胞提供營養,調控離子濃度,排除水及其他代謝產物;2)針對感光細胞外段(Photoreceptor outer segment)的細胞吞噬作用(Phagocytosis):感光細胞持續暴露于光氧化刺激,會受到一定損傷,RPE細胞通過細胞吞噬作用不斷將受損傷的外段吞噬并消化,以維持感光細胞的正常功能;3)分泌細胞因子:RPE細胞能分泌大量的各種因子和信號分子來與其周圍的組織實行交流,如,成纖維生長因子,轉化生長因子-β,類胰島素生長因子-1,血小板源性生長因子,血管內皮生長因子以及色素上皮源性因子等,這些信號分子都有重要的生理病理學意義。如果RPE細胞出現功能性病變,將直接影響與其相關的視網膜,通常會導致視力損害,甚至盲癥。最常見的視力疾病有老年黃斑變性和視網膜色素變性3。
老年黃斑變性(Age related macular degeneration,簡稱AMD)是一種與年齡相關的眼科疾病,其發病率高,常見于老年人群,是55歲以上的老年人視力低下致盲的最主要原因,嚴重影響老年人生活質量。在歐美地區55歲以上人群的患病率為1.63%,65歲以上的患病率約16%,75歲以上的患病率接近30%4-5。我國隨著人口老齡化以及高血壓和高血糖患者數量的增加,AMD患病人數也逐步上升。世界衛生組織曾發表報告,指出全世界至少有800萬人由于晚期老年性黃斑變性而遭受視力嚴重損傷帶來的痛苦。
AMD致病原因是人類視覺成像最敏銳的黃斑區產生衰退性病變。首先出現衰退的是視網膜下方的視網膜色素上皮細胞,隨后是與視網膜色素上皮細胞直接相鄰的視網膜感光細胞出現凋亡,導致視野正中的視力大幅度下降,甚至失明。AMD根據其臨床表現不同分為萎縮型(又稱干性)和滲出型(又稱濕性)兩型,干性主要為RPE細胞下堆積毒性沉淀等引起RPE細胞和感光細胞凋亡;濕性主要為脈絡膜新生血管形成,侵入視網膜下,導致黃斑區出血并形成盤狀脫離,最終形成盤狀傷痕,導致視野中心視力的嚴重喪失。AMD確切的致病原因仍然不清,一些研究表明主要致病因素有環境和遺傳方面的3,6。
與AMD的嚴重致盲性相對應的是缺乏有效治療方法。對濕性AMD現在可采用抗新生血管藥物進行治療。但是對于干性AMD,目前無任何有效的治療手段。一些臨床研究表明使用復合維生素可以延緩黃斑形成,但是最終失明仍然是不可避免的。
人類胚胎干細胞(Human embryonic stem cell,簡稱hESC)作為一種全能性干細胞(Pluripotent stem cell),具有兩種其他細胞沒有的特性:一是可以無限分裂生長的自我更新能力;二是可以分化為人體所有其他細胞系的潛能。在特定的體外培養條件下,可以將hESC分化至不同功能的體細胞,進而形成不同的組織甚至是器官。胚胎干細胞所具有的這些潛能對醫學界有著很強的應用前景。現代醫學仍然對很多人類疾病束手無策,這類疾病的致病機理大多是因為失去一種或幾種功能細胞,而人體又無法再生這些失去的細胞。如果將hESC 分化成這些失去的細胞并移植回病人,就有很大可能完全治愈這些原本沒有任何希望的疾病,這些疾病包括:I型糖尿病,老年性癡呆,肌萎縮性脊髓側索硬化癥,表皮溶解水皰癥,心臟衰竭,心肌梗塞,缺血性心肌炎以及鐮刀型貧血等等7。同時胚胎干細胞還可以結合基因治療,組織工程及藥物開發等進行醫療或研究應用,因此胚胎干細胞的醫療應用前景十分廣闊,有巨大的社會需求和市場潛力。
目前英國、美國、日本以及韓國的科學家在嘗試移植hESC分化的RPE細胞(hESC-RPE)到病人的視網膜取代衰退的RPE細胞,以治療AMD。韓國CHA University的科學家與美國制藥公司Ocata Therapeutics合作,于2013年對四名AMD病人進行了治療,其中三人顯示出治療效果,長期觀察后未發現任何副作用8。日本理化研究所的科學家與神戶市立中央市民醫院合作,于2014年使用誘導全能性干細胞(Induced pluripotent stem cell,簡稱iPSC)分化的RPE細胞對一名AMD病人實施治療14。英國科學家成立了以hESC-RPE治療AMD的London Project to Cure Blindness,參與的研究和商業機構有Moorfields Eye Hospital、UCL Institute of Ophthalmology、National Institute for Health Research以及輝瑞制藥公司,于2015年9月成功對一名AMD病人實施了移植手術,并計劃在18個月內對10名病人進行治療15。美國加州再生醫學研究所資助了以hESC-RPE治療AMD的California Project to Cure Blindness,參與的研究機構有University of Southern California、UC Santa Barbara、Caltech、City of Hope以及Cedar Sinai Hospital,與2016年開始準備臨床一期實驗。
在對AMD的干細胞治療中,RPE細胞的分化技術具有重要的地位。RPE細胞的分化效率的高低,不同批次RPE細胞的產量是否穩定,RPE細胞的各項性狀是否達到正常水平決定了隨后的治療效果的好壞。傳統使用的自發分化RPE細胞的方法需要較長的時間,近年來有使用定向分化的方法來加速RPE細胞分化,但是分化效率依然較低,另外分化后的RPE細胞的成熟過程仍然需要很長時間9-13,這些缺點都不利于RPE細胞的臨床醫學應用。
技術實現要素:
有鑒于此,本發明提供了一種人胚胎干細胞快速定向分化至視網膜色素上皮細胞的方法,該方法能夠在30天內將人胚胎干細胞誘導分化至成熟的視網膜色素上皮細胞,具有快速高效的優點。
本發明采取的技術方案如下:
1.一種人胚胎干細胞快速定向分化至視網膜色素上皮細胞的方法,包括如下步驟:
(1)首先進行人胚胎干細胞培養,當細胞生長至80%融合時棄去培養基,加入分化基礎培養基,同時加入終濃度50ng/mL的Noggin因子、終濃度10ng/mL的DKK-1因子和終濃度10mM的煙酰胺繼續培養;所述分化基礎培養基按500mL計,組分及各組分含量為:
1×DMEM/F12培養基480mL,Supplement 10mL,100×N-2Supplement 5mL,100×MEM非必需氨基酸溶液5mL;所述DMEM/F12培養基中DMEM與F12的體積比為1∶1;
(2)分化后第3天棄去舊培養基,更換新的分化基礎培養基,同時加入終濃度10ng/mL的Noggin因子、終濃度10ng/mL的DKK-1因子、終濃度10mM的煙酰胺和終濃度5ng/mL的bFGF繼續培養;
(3)分化后第5天棄去舊培養基,更換新的分化基礎培養基,同時加入終濃度10ng/mL的Noggin因子、終濃度10ng/mL的DKK-1因子、終濃度10mM的煙酰胺和終濃度5ng/mL的bFGF繼續培養;
(4)分化后第7~8天,當細胞培養物中出現5~15%的神經干細胞時,棄去舊培養基,更換新的分化基礎培養基,同時加入終濃度100ng/mL的激活素A和終濃度10μM的SU5402繼續培養至分化后第14天,期間每2天更換一次培養基;
(5)分化后第15天部分細胞已分化至視網膜色素上皮細胞,棄去舊培養 基,更換成熟培養基繼續培養至細胞培養物中出現大面積色素斑塊;
所述成熟培養基按500mL計,組分及各組分含量為:1×IMDM培養基494.5mL,Supplement 5mL,按1∶1000的體積比稀釋的化學成分確定的脂質濃縮物(Chemically defined lipid concentrate)0.5mL。
優選的,所述步驟(1)中人胚胎干細胞培養的器皿底部覆蓋有一層Matrigel。
優選的,所述步驟(1)中使用Essential 8培養基培養人胚胎干細胞至80%融合,棄去培養基,用DMEM/F12培養基洗滌細胞后加入分化基礎培養基。
優選的,所述步驟(1)中人胚胎干細胞生長至80%融合時,手工移除已分化的雜細胞。
優選的,所述步驟(4)中更換新的分化基礎培養基之前先用DMEM/F12培養基對細胞進行洗滌。
優選的,所述人胚胎干細胞為H9細胞系。
2.Noggin因子在促進人胚胎干細胞快速定向分化至視網膜色素上皮細胞中的應用。
3.煙酰胺在促進人胚胎干細胞快速定向分化至視網膜色素上皮細胞中的應用。
4.SU5402在促進人胚胎干細胞快速定向分化至視網膜色素上皮細胞中的應用。
在本發明中,Noggin因子使用濃度范圍可以為10~100ng/mL,DKK-1因子使用濃度范圍可以為5~20ng/mL,煙酰胺使用濃度范圍可以為5~15ng/mL,bFGF使用濃度范圍可以為5~10ng/mL,激活素A使用濃度范圍可以為80~120ng/mL,SU5402因子使用濃度范圍可以為10~20μM。
Noggin為一種由脊索分泌的多肽蛋白,是神經系統和骨骼發育所必需的重要調控因子,動物模型證實缺失Noggin基因會導致脊髓神經管畸形等神經系統的缺陷。Noggin蛋白主要作用途徑是通過結合并抑制生長因子TGF-β家族成 員,如BMP4等因子,來發揮各種調控作用。加入Noggin能有效提高胚胎干細胞分化到神經干細胞和視網膜干細胞的效率。
DKK-1是WNT信號通路的抑制分子,主要作用方式是抑制WNT通路上的信號受體LRP6,降低β-鏈蛋白的水平并提高OCT4的表達水平。DKK-1在頭部,心臟以及上肢的發育中有重要作用。動物研究表明,DKK-1表達缺失會導致一系列神經系統缺陷,如眼睛發育缺失,嗅覺異常,前腦和中腦發育缺陷等。
成纖維細胞生長因子(FGF)是具有廣泛生物活性和生理功能的多功能生長因子,對細胞生長和分化以及功能都有影響。尤其是在神經系統中,bFGF廣泛存在并對神經元有維持生存和促進生長及受損神經元的修復與再生作用。在體外細胞培養中,bFGF和表皮生長因子(EGF)是誘導和維持神經干細胞正常生長所必需的培養基成分。
煙酰胺(Nicotinamide)是煙酸(維生素B3)的酰胺。在細胞中,煙酸被用于合成煙酰胺腺嘌呤二核苷酸(NAD)與煙酰胺腺嘌呤二核苷酸磷酸(NADP),而煙酰胺的轉變途徑與煙酸的途徑非常相似,所以可作為NAD合成的前體。體外實驗證實煙酰胺對神經細胞有保護作用,可以提高神經細胞生存率。
激活素A(Activin A)屬于生長因子TGF-β家族的成員,主要由各種腺體,如生殖腺、腦垂體等分泌表達,皮膚組織受傷后愈合時也會高水平表達。其作用主要是促進各種非神經組織的形態發生。對RPE細胞所屬的上皮組織的形態形成,極性化和生理功能有促進作用。
SU5402(2-[(1,2-二氫-2-氧代-3H-吲哚-3-亞基)甲基]-4-甲基-1H-吡咯-3-丙酸)是一種化學小分子,對FGF受體,VEGF受體和PDGF受體有抑制作用。bFGF是誘導和維持神經干細胞正常生長所必需的培養基成分,加入SU5402能夠抑制視網膜神經元細胞的分化,從而提高RPE細胞分化效率。
如圖1所示,胚胎干細胞分化到RPE細胞的過程可大致分為三個階段,一是胚胎干細胞分化為外胚層的神經干細胞,二是由神經干細胞分化成視網膜干 細胞,最后由視網膜干細胞分化為兩種不同的組織---主要由各種神經元細胞組成的視網膜和單層極性化的RPE細胞。由于RPE細胞來源于視神經組織,但又不是神經元細胞,所以RPE細胞在分化的過程中受到的調控較為復雜,分化前期需要特定調控因子促進神經組織形成,分化后期則需要其它調控因子來抑制神經組織的形成。因此,在促進人胚胎干細胞分化至RPE細胞時需要定點定時精細調節定向分化中的各種信號分子和生長因子。
本發明在上述前兩個階段采用Noggin蛋白、DKK-1、bFGF和煙酰胺促進神經干細胞及視網膜干細胞的生成,隨后采用激活素A及SU5402促進視網膜干細胞快速分化成熟為RPE細胞,最后使用成熟培養基促使RPE細胞快速成熟,整個過程可以在30天內完成,既高效又快速。
附圖說明
為了更清楚地說明本發明具體實施方式或現有技術中的技術方案,下面將對具體實施方式或現有技術描述中所需要使用的附圖作簡單地介紹。
圖1本發明所用信號分子及生長因子在促使人胚胎干細胞分化至RPE細胞中的作用及機制示意圖;
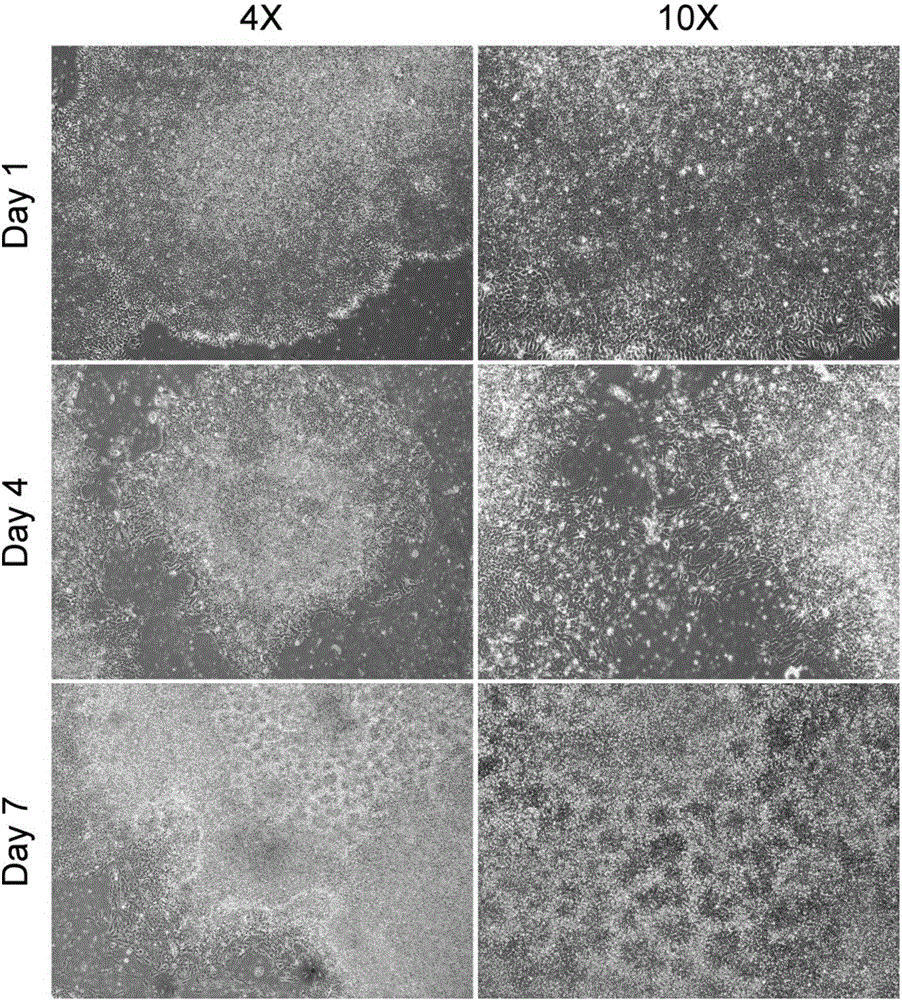
圖2為人胚胎干細胞H9定向分化的第一階段(1-7天)的細胞形態;第一天(Day 1),H9細胞在低倍鏡(4×)下呈現典型未分化的胚胎干細胞群落形態;高倍鏡(10×)下可見細胞群落為單層細胞;第四天(Day 4),細胞群落發生分化,低倍鏡下細胞群落形態明顯變化,群落邊緣變得不光滑,群落形狀不再是圓形,高倍鏡下可見細胞群落中心出現多層細胞堆積,群落邊緣的細胞形狀變為細長;第七天(Day 7),細胞群落形態進一步變化,低倍鏡下可見整個群落變為多層細胞堆積,高倍鏡下可見大量典型的神經干細胞形態特征:玫瑰花狀結構(neural rosette);
圖3為人胚胎干細胞H9定向分化的第二階段(第15天)的細胞形態;A,細胞培養物出現少量色素小斑塊;B,低倍鏡下的色素斑塊(已成熟的RPE細 胞);C,高倍鏡下的色素斑塊(已成熟的RPE細胞);D,低倍鏡下的無色素斑塊(未成熟的RPE細胞);E,高倍鏡下的無色素斑塊(未成熟的RPE細胞),這些未成熟的RPE細胞已經呈現六邊形的細胞輪廓,在相差顯微鏡下,細胞邊緣呈現為高亮度;
圖4人胚胎干細胞H9定向分化的第三階段(第30天)的細胞形態;A,細胞培養物出現大量色素斑塊;B,低倍鏡下的色素斑塊(已成熟的RPE細胞);C,高倍鏡下的色素斑塊(已成熟的RPE細胞);D,低倍鏡下的無色素斑塊(未成熟的RPE細胞);E,高倍鏡下的無色素斑塊(未成熟的RPE細胞);
圖5人胚胎干細胞H9定向分化的最后(第60天)的細胞形態;A,細胞培養物出現大量色素斑塊;B,低倍鏡下的色素斑塊(已成熟的RPE細胞);C,高倍鏡下的色素斑塊(已成熟的RPE細胞)。
具體實施方式
下面將結合附圖對本發明技術方案的實施例進行詳細的描述。
本發明所用人胚胎干細胞為H9細胞系;所述分化基礎培養基按500mL計,組分及各組分含量為:
1×DMEM/F12培養基480mL,Supplement(簡稱B27)10mL,100×N-2 Supplement(簡稱N2)5mL,100×MEM非必需氨基酸溶液(MEM Non-Essential Amino Acids Solution,NEAA)5mL;所述DMEM/F12培養基中DMEM與F12的體積比為1∶1;
所述成熟培養基按500mL計,組分及各組分含量為:1×IMDM培養基494.5mL,Supplement 5mL,按1∶1000的體積比稀釋的化學成分確定的脂質濃縮物(Chemically defined lipid concentrate,賽默飛,產品號11905031)0.5mL。
一種人胚胎干細胞快速定向分化至視網膜色素上皮細胞的方法,包括如下步驟:
(1)在Matrigel(Corning公司生產)覆蓋的細胞培養用六孔板上,使用Essential 8培養基進行人胚胎干細胞H9細胞系培養,當細胞生長至80%融合時,棄去培養基,用DMEM/F12培養基洗滌細胞培養物一次后,每孔加入分化基礎培養基2mL,同時加入終濃度50ng/mL的Noggin因子、終濃度10ng/mL的DKK-1因子和終濃度10mM的煙酰胺繼續培養;
需注意的是,人胚胎干細胞生長至80%融合時,需先手工移除已分化的雜細胞;正常情況下培養的人胚胎干細胞都會有少量已分化細胞混雜于占多數的未分化的細胞中,正常培養6-8天后,細胞融合度達到80%或以上時,細胞培養產物中混雜的已分化細胞的數量將會達到比較高的比例(約5-20%),如果直接使用該細胞培養物進行RPE細胞定向分化,通常不會獲得高的產率,這是因為已分化的細胞屬于隨機分化,有大量其它類型的體細胞,其中一些細胞類型,如成纖維細胞和內皮細胞具有很強的生長優勢,如果不在分化的初期排除這些生長快速的雜細胞,那么最終的分化細胞產物中RPE細胞的比例將會很低,所以在開始進行分化前,應該首先進行顯微鏡檢測,判斷已分化細胞的比例,如果已分化細胞比例超過5%,則需要在手術顯微鏡下進行手工移除已分化細胞;手工移除時,應在手術顯微鏡下使用P10移液器和P10槍頭,沿未分化細胞群落邊緣劃線,然后再使用槍頭將劃線區域內的已分化細胞鏟除;細胞移除操作完成后,應使用新鮮培養基洗滌培養孔;
(2)分化后第3天棄去舊培養基,每孔加入分化基礎培養基2mL,同時加入終濃度10ng/mL的Noggin因子、終濃度10ng/mL的DKK-1因子、終濃度10mM的煙酰胺和終濃度5ng/mL的bFGF繼續培養;
(3)分化后第5天棄去舊培養基,每孔加入分化基礎培養基2mL,同時加入終濃度10ng/mL的Noggin因子、終濃度10ng/mL的DKK-1因子、終濃度10mM的煙酰胺和終濃度5ng/mL的bFGF繼續培養;
(4)分化后第7天,細胞培養物中出現5~15%的神經干細胞,胚胎干細胞已被誘導分化至神經干細胞和視網膜干細胞(見圖2),移除舊培養基,用 DMEM/F12培養基洗滌一次細胞培養物后,更換新的分化基礎培養基,每孔加入2mL,同時加入終濃度100ng/mL的激活素A和終濃度10μM的SU5402繼續培養至分化后第14天,期間每2天更換一次培養基;
(5)分化后第15天部分細胞培養物出現淺棕色的色素小斑塊,表明已經有部分細胞分化至RPE細胞(見圖3);移除舊培養基后,使用RPE成熟培養基洗滌一次后,每孔加入RPE成熟培養基2mL繼續培養,并且每2天更換一次新鮮培養基,直至細胞培養物中出現大面積的色素斑塊(約在第45-60天,見圖4和圖5);
(6)待細胞培養物出現50%或更多深棕色色素斑塊,即可分離純化RPE細胞,可采用的分離純化方法有兩種:一、在手術顯微鏡下,使用手術剪刀將較大的色素斑塊剪下并收集;二、使用多輪酶消化,分別移除其它種類的細胞后,再收集RPE細胞;使用手工取樣或酶消化的方法分離純化視網膜色素上皮細胞后,離心沉淀,將沉淀的細胞接種于RPE成熟培養基中,置37℃、5%CO2飽和濕度培養箱中培養;
(7)取1-3代視網膜色素上皮細胞鑒定細胞形態并測定分子標記,證實培養的是具有正常特征的視網膜色素上皮細胞。
培養過程中,需要注意的是定向分化第一天和第三天添加的信號分子和生長因子濃度的差異,由于Noggin是神經系統和骨骼發育所必需的重要調控因子,所以在RPE細胞定向分化的前期必需加入Noggin以提高神經組織分化的效率,但是如果一直保持高濃度的Noggin則有可能提高骨骼細胞分化的比例,所以在定向分化的第一天和第二天,使用高濃度的Noggin以確立分化的方向,隨后使用低濃度的Noggin以降低骨骼細胞分化的比例。
成纖維細胞生長因子(FGF)是誘導和維持神經干細胞正常生長所必需的培養基成份,但是bFGF也是維持胚胎干細胞形態功能的必要調控因子,如果在定向分化第一天即加入bFGF則會顯著延長分化的時間,不利于大規模快速高效的工業化生產,所以在定向分化的第一天和第二天,不加入bFGF以促使胚 胎干細胞快速進入分化階段,待第三天,再加入bFGF誘導神經干細胞分化。
以上兩種因子的濃度變化對高效快速定向分化RPE細胞有至關重要的影響,如果不能正確按時按量添加,分化效率會受到極大影響。
在定向分化的第5-7天,細胞培養物出現少量玫瑰花狀結構(neural rosette,神經干細胞的典型形態特征)后,應及時換加Activin A和SU5402。
在定向分化前期(第1-6天)添加的因子群(Noggin,DKK-1,bFGF和Nicotinamide)具有強烈的促進神經組織分化的作用,但是由于所需的最終細胞產物RPE細胞不是神經細胞,所以需要在神經干細胞和視網膜干細胞出現后迅速轉換分化方向,以提高RPE細胞的分化效率。轉化分化方向(添加Activin A和SU5402)的時機尤為重要,根據實驗經驗,當整個細胞培養物出現少量(5-15%)玫瑰花狀結構時,即為添加Activin A和SU5402的最佳時機。如果玫瑰花狀結構比例高于25%時,細胞的分化方向則偏重于神經組織,大量最終細胞產物則是視網膜神經元細胞,甚至是腦神經元細胞。
最后應說明的是:以上各實施例僅用以說明本發明的技術方案,而非對其限制;盡管參照前述各實施例對本發明進行了詳細的說明,本領域的普通技術人員應當理解:其依然可以對前述各實施例所記載的技術方案進行修改,或者對其中部分或者全部技術特征進行等同替換;而這些修改或者替換,并不使相應技術方案的本質脫離本發明各實施例技術方案的范圍,其均應涵蓋在本發明的權利要求和說明書的范圍當中。
現有技術文獻
1.Strauss,O.The retinal pigment epithelium in visual function.Physiol Rev 85,845-881(2005).
2.Bok,D.The retinal pigment epithelium:a versatile partner in vision.J Cell Sci Suppl 17,189-195(1993).
3.Zarbin,M.A.Current concepts in the pathogenesis of age-related macular degeneration.Arch Ophthalmol 122,598-614(2004).
4.Jager,R.D.,Mieler,W.F.&Miller,J.W.Age-related macular degeneration.N Engl J Med 358,2606-2617(2008).
5.de Jong,P.T.Age-related macular degeneration.N Engl J Med 355,1474-1485(2006).
6.Zajac-Pytrus,H.M.,Pilecka,A.,Turno-Krecicka,A.,Adamiec-Mroczek,J.&Misiuk-Hojlo,M.The Dry Form of Age-Related Macular Degeneration(AMD):The Current Concepts of Pathogenesis and Prospects for Treatment.Adv Clin Exp Med 24,1099-1104(2015).
7.Strauer,B.E.&Kornowski,R.Stem cell therapy in perspective.Circulation 107,929-934(2003).
8.Song,W.K.,et al.Treatment of macular degeneration using embryonic stem cell-derived retinal pigment epithelium:preliminary results in Asian patients.Stem Cell Reports 4,860-872(2015).
9.Klimanskaya,I.,et al.Derivation and comparative assessment of retinal pigment epithelium from human embryonic stem cells using transcriptomics.Cloning Stem Cells 6,217-245(2004).
10.Buchholz,D.E.,et al.Derivation of functional retinal pigmented epithelium from induced pluripotent stem cells.Stem Cells 27,2427-2434(2009).
11.Hirami,Y.,et al.Generation of retinal cells from mouse and human induced pluripotent stem cells.Neurosci Lett 458,126-131(2009).
12.Buchholz,D.E.,et al.Rapid and efficient directed differentiation of human pluripotent stem cells into retinal pigmented epithelium.Stem Cells Transl Med 2,384-393(2013).
13.Leach,L.L.,Buchholz,D.E.,Nadar,V.P.,Lowenstein,S.E.&Clegg,D.O.Canonical/beta-catenin Wnt pathway activation improves retinal pigmented epithelium derivation from human embryonic stem cells.Invest Ophthalmol Vis Sci 56,1002-1013(2015).
14.http://www.nature.com/news/next-generation-stem-cells-cleared-for-human-trial-1.15897
15.http://www.moorfields.nhs.uk/news/new-trial-wet-amd。
- 還沒有人留言評論。精彩留言會獲得點贊!