干巴菌胞外多糖及其制備方法和應用與流程
本發明涉及干巴菌多糖技術領域,特別涉及一種干巴菌胞外多糖,還涉及所述干巴菌胞外多糖的制備方法及其應用。
背景技術:
干巴菌(Thelephora ganbajun Zang)是我國特有的革菌屬(Thelephora)珍稀野生食用菌,口感好營養價值高,僅僅分布在我國滇中800~2300 m高海拔地區的弱酸性紅壤地面上。干巴菌與松樹有外生菌根關系,人工栽培難以成功,因此導致干巴菌無序亂采現象嚴重,產量逐年下降,每年干巴菌上市時總是供不應求,價格逐年升高。由于其分布的局限性,國內外對干巴菌的研究極為有限,主要集中在干巴菌的分類、菌種分離、菌種鑒定和生態環境等方面。因此,干巴菌是一種具有極高經濟價值及營養價值的亟待研究開發的菌種資源。
目前應用于化妝品的多糖類保濕劑主要有透明質酸、甲殼素及其衍生物、植物多糖提取物、肝素等。近年來將具有生物活性的食用真菌多糖作為保濕劑應用于化妝品,滿足了人們對高品質化妝品的需求,成為保濕化妝品的發展趨勢。干巴菌胞外多糖(Exopolysaccharide, EPS)良好的保濕和抗氧化特性是化妝品市場最重要的功能性訴求。
自由基是機體細胞代謝過程中產生的活性物質,如果自由基在體內過多積累就會引起生物膜的不飽和脂類發生氧化反應,形成脂質過氧化物,從而引起細胞結構和功能的改變,造成對機體的損害,引起各種疾病,這就是引起機體衰老的主要原因。干巴菌胞外多糖可以清除體內的自由基,進而起到保護生物膜和延緩衰老的作用。
因此,干巴菌胞外多糖可以作為天然、營養、安全的化妝品保濕劑和抗衰老功能食品,從而為干巴菌資源開發提供有效的途徑。
陸文娟等在《響應面法優化提取干巴菌多糖的工藝研究》《南京師范大學學報(工程技術版)》,2015,15(3):84-92,以干巴菌子實體為原料,采用超聲細胞破碎法提取其多糖,在單因素實驗的基礎上,采用響應面法對提取工藝進行優化,通過Box-Behnken設計,建立并分析了各因素與多糖得率關系的數學模型,結果顯示,最佳工藝條件為:液料比為38:1,提取時間為3 h,提取溫度為88 ℃,超聲功率為603 W,重復2次,測定干巴菌多糖的得率為5.96%。但該項目并沒有涉及干巴菌的液體發酵培養、干巴菌多糖的分離純化以及具有清除自由基、抗氧化功效的多糖組分等研究內容。
技術實現要素:
為了解決以上現有技術中干巴菌胞外多糖EPS在提取和應用中存在的利用不充分的問題,本申請提供了由干巴菌菌株(Thelephoraganbajun Zang)TG-1發酵得到的菌絲體胞外多糖EPS。本課題組從云南地區分離純化得到了一株干巴菌菌株(TG-1),并且研究發現干巴菌在液體發酵培養時菌絲體生長旺盛,胞外多糖產量高,并且通過抗氧化實驗和保濕實驗證明干巴菌胞外多糖EPS具有良好的保濕和抗氧化特性。
本申請還提供了所述干巴菌胞外多糖EPS的制備方法。
本申請還提供了所述干巴菌胞外多糖EPS的應用。
本發明是通過以下步驟得到的:
一種干巴菌胞外多糖,其特征在于是通過以下步驟得到的:
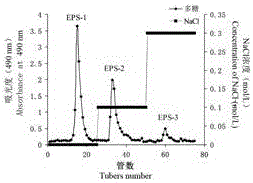
保藏編號為CGMCC No.12977的干巴菌菌株TG-1在液體培養基中發酵,從菌絲體分離后得到的發酵液中,提取干巴菌胞外多糖,然后經過陰離子交換柱層析分離,依次用去離子水和0.1、0.3 mol/L的NaCl溶液進行洗脫,分別得到干巴菌胞外多糖組分EPS-1,EPS-2,EPS-3。
所述的干巴菌胞外多糖EPS,其特征在于EPS、EPS-1、EPS-2、EPS-3中硫酸基的含量分別為15~21%,0.5~2%,25~40%,9~16%;糖醛酸的含量分別為5~10%,2~7%,30~50%,30~50%。
所述的干巴菌胞外多糖,液體培養基中含有馬鈴薯150~250 g/L,葡萄糖15~25 g/L,硫酸鎂0.5~2.5 g/L,磷酸二氫鉀0.5~2.5 g/L,蛋白胨1~3 g/L,pH為4.5~7,于15~30 ℃發酵培養。
所述的干巴菌胞外多糖,菌絲體分離,提取干巴菌胞外多糖操作如下:
洗滌菌絲體1~4次,至洗滌液澄清,將收集到的上清液或濾液合并,并濃縮至原體積3/4~1/2,加入1~4倍體積乙醇,靜置1~24 h至胞外多糖完全析出,過濾分離胞外多糖,40~60 ℃條件下烘干,溶于去離子水中,除蛋白至少2~3次,凍干后得到干巴菌胞外多糖。
所述的干巴菌胞外多糖,干巴菌胞外多糖經過陰離子交換柱層析分離操作如下:
將干巴菌胞外多糖溶于去離子水中,用0.45 μm的微孔濾膜過濾,得到上樣溶液,將上樣溶液用規格為1.6 × 30 cm的DEAE-52纖維素陰離子交換柱進行層析分離,依次用去離子水和0.1、0.3 mol/L的NaCl溶液進行洗脫,洗脫液的流速為1 mL/min,洗脫組分凍干后即為干巴菌胞外多糖組分EPS-1,EPS-2和EPS-3。
所述的干巴菌胞外多糖在制備抗衰老保健品和化妝品中的應用。
干巴菌胞外多糖為干巴菌胞外多糖EPS及其組分EPS-1,EPS-2和EPS-3。
所述的保健品是具有清除自由基、抗氧化作用的保健品。
所述的化妝品是具有清除自由基、抗氧化和保濕作用的化妝品。
有益效果:
1)利用液體發酵途徑,制備干巴菌胞外多糖,為干巴菌的資源化利用提供了一條有效途徑。
2)干巴菌菌株TG-1在液體發酵培養時具有旺盛的胞外多糖分泌能力,因此,干巴菌菌株TG-1對干巴菌的開發利用及干巴菌胞外多糖的規模化生產具有非常重要的意義。
3)抗氧化實驗表明,干巴菌胞外多糖EPS及其組分具有優良的抗氧化活性,EPS及3個組分抗氧化能力有差異,還原力的強弱順序為EPS-2 > EPS-1 > EPS > EPS-3,清除羥基自由基能力的強弱順序為EPS >EPS-2 > EPS-1 > EPS-3,清除超氧陰離子自由基能力的強弱順序為EPS-2 > EPS > EPS-1 > EPS-3,清除DPPH自由基能力的強弱順序為EPS-2 > EPS > EPS-1 > EPS-3,因此,EPS的三個組分中EPS-2的抗氧化能力最強,其次為EPS-1和EPS-3,為干巴菌胞外多糖構效關系的研究、多糖的改造、多糖的活性分析以及多糖抗衰老功能食品的開發奠定了理論基礎。
4)干巴菌胞外多糖具有優良的保濕能力。在120 h時,在相對濕度60%的條件下,EPS的保濕率為55~65%;在相對濕度43%的條件下,EPS的保濕率為85~92%;在相對濕度0%的條件下,EPS的保濕率為25~35%。并且在某些條件下,MPS的保濕能力要強于透明質酸(HA)和甘油(Gl),可以用于護膚保健。
菌種保藏信息
保藏時間:2016年 9月 23日,
保藏單位:中國微生物菌種保藏管理委員會普通微生物中心,
保藏編號:CGMCC No. 12977,
保藏單位地址:北京市朝陽區北辰西路1號院3號中國科學院微生物研究所,郵政編碼:100101分類命名:干巴菌 Thelephora ganbajun。
附圖說明
圖1干巴菌EPS的洗脫曲線,
圖2干巴菌EPS、EPS-1、EPS-2、EPS-3的體外抗氧化能力(A:還原力;B:羥基自由基清除能力;C:超氧陰離子自由基清除能力;D:DPPH自由基清除能力),
圖3保濕率隨時間的變化曲線(RH60%),
圖4保濕率隨時間的變化曲線(RH43%),
圖5保濕率隨時間的變化曲線(RH0%)。
具體實施方式
下面結合具體實施例對本發明進行進一步說明:
實施例1菌株的獲得
分別于云南省不同地區采集4個新鮮干巴菌子實體,用75%酒精進行表面消毒,再用無菌水沖洗數次后,用滅菌鑷子撕取干巴菌內部組織小塊接種到含氯霉素的馬鈴薯葡萄糖(PDA)培養基平板上,移入24 ℃培養箱中培養,待長出菌絲后,反復純化,直至獲得干巴菌純培養物。于4個干巴菌子實體中分別篩選獲得4株干巴菌菌種,并分別命名為TG-1、TG-2、TG-3、TG-4。
實施例2干巴菌胞外多糖(EPS)的提取
進行發酵罐培養實驗,① 菌種的活化。將干巴菌TG-1、TG-2、TG-3、TG-4分別接種于活化培養基平板上(馬鈴薯 200 g/L,葡萄糖 20 g/L,硫酸鎂 1 g/L,磷酸二氫鉀 1.5 g/L),24 ℃培養7 d。取0.5 cm2干巴菌活化菌種接入液體培養基中(馬鈴薯 200 g/L,葡萄糖 20 g/L,蛋白胨 2 g/L,硫酸鎂 1 g/L,磷酸二氫鉀 1.5 g/L),500 mL三角瓶裝液量為300 mL,然后于搖床24 ℃振蕩培養10 d。② 培養條件。裝量:7.5升;接種量:10 %;發酵溫度:24 ℃;攪拌速度:350 r/min;泡沫控制:接種后加兩滴消泡劑。③ 發酵過程中pH值及DO值的測定。利用pH電極及溶氧電極自動在線測定并記錄數據。④ 菌絲體的分離。將干巴菌培養物離心(10000 r/min,10 min),反復離心洗滌菌絲體3遍后,將收集到的上清液或濾液合并,并濃縮至原體積2/3~1/4。⑤ 加入3倍體積乙醇。靜置12 h至胞外多糖完全析出,過濾分離胞外多糖,55 ℃條件下烘干。⑥ 將上述多糖溶于去離子水中,除蛋白5次,凍干后得到EPS。
干巴菌TG-1、TG-2、TG-3、TG-4的EPS產量分別為0.78 g/L,0.42 g/L,0.49 g/L,0.56 g/L。因此,干巴菌TG-1菌株的EPS產量最高,是生產干巴菌EPS的理想菌株。
實施例3體外抗氧化實驗
(1)還原力的測定
采用普魯士蘭法進行還原力的測定。將干巴菌胞外多糖分別用去離子水進行梯度稀釋,配置一系列不同濃度的多糖水溶液。取1 mL多糖樣品于試管中,加入2.5 mL磷酸鹽緩沖液(pH 6.6,0.2 mol/L)和1 mL鐵氰化鉀溶液(10 g/L),混勻后置于50 ℃恒溫水浴鍋中20 min。水浴結束后,再加入2 mL三氯乙酸(100 g/L)和1.2 mL三氯化鐵溶液(1 g/L)。混勻后測定700 nm處吸光度,并用2,6-二叔丁-4-甲基苯酚(2, 6 - di - tert - butyl - 4 - methylphenol, BHT)作為陽性對照。
(2)羥基自由基清除能力的測定
采用Fenton法進行羥基自由基清除能力的測定。配置一系列不同濃度的干巴菌胞外多糖水溶液。將1 mL硫酸亞鐵溶液(9 mmol/L),1 mL水楊酸乙醇溶液(9 mmol/L),1 mL多糖樣品溶液和1 mL過氧化氫溶液(8.8 mmol/L)于試管中混合均勻,37 ℃水浴30 min。離心(5000 r/min,10 min)后取上清液于510 nm處測定吸光度,并用BHT作為陽性對照。按照以下公式計算羥基自由基清除率(Scavenging rate, SR),SR (%) = (A0–A)/A0×100。其中,A0為空白對照的吸光度,A為多糖樣品的吸光度。羥基自由基的清除能力以EC50值表示,EC50值代表羥基自由基清除50%時所需要的樣品濃度。EC50值越小則代表羥基自由基的清除能力越強。
(3)超氧陰離子自由基清除能力的測定
超氧陰離子自由基清除能力采用鄰苯三酚自氧化法進行測定。配置一系列不同濃度的干巴菌胞外多糖水溶液。將1 mL多糖樣品水溶液與2 mL Tris-HCl緩沖液(pH 8.2,50 mmol/L)混合均勻,置于25 ℃水浴中20 min,水浴結束后,加入0.4 mL 25 ℃水浴預熱過的鄰苯三酚溶液(5 mmol/L),迅速混合均勻,于325 nm每隔20 s測定一次吸光度,持續5 min,并用BHT作為陽性對照。按照以下公式計算超氧陰離子自由基清除率(SR),SR(%) = (S0–S)/S0×100。其中,S0為空白對照吸光度的斜率(斜率即為鄰苯三酚的自氧化速率),S為多糖樣品吸光度的斜率。較低的斜率代表較高的超氧陰離子自由基清除能力。超氧陰離子自由基的清除能力以EC50值表示,EC50值代表超氧陰離子自由基清除50%時的樣品濃度。
(4)DPPH自由基清除能力的測定
將干巴菌胞外多糖進行梯度稀釋,配置一系列不同濃度的多糖水溶液。取2 mL多糖樣品溶液于試管中,加入2 mL DPPH乙醇溶液(0.2 mmol/L),混合均勻后避光反應30 min,然后在517 nm處測定其吸光度,用BHT作為為陽性對照。根據吸光度計算DPPH自由基的清除能力,清除能力(SR)的計算公式為:SR (%) = [1–(A–A0)/A1]×100。其中,A為2 mL多糖樣品溶液與2 mL DPPH乙醇溶液混合液的吸光度,A0為2 mL乙醇與2 mL多糖樣品溶液混合液的吸光度,A1為2 mL去離子水與2 mL DPPH乙醇溶液混合液的吸光度。DPPH自由基的清除能力以EC50值表示,EC50值代表清除50% DPPH自由基的樣品濃度。DPPH自由基的清除能力用BHT作為為陽性對照。
由圖2A可見,EPS具有一定的還原力,并且,還原力的大小隨著濃度的增加而增強。當濃度為2500 mg/L時,EPS,EPS-1,EPS-2,EPS-3的還原力分別為1.22,1.29,1.42和1.131。因此,還原力的強弱順序為EPS-2 > EPS-1 > EPS > EPS-3。EPS-2的還原力最強。由圖2B可見,EPS及其組分EPS-1,EPS-2,EPS-3都具備羥基自由基的清除能力,并且隨著濃度的增加表現出明顯的量效關系。EPS,EPS-1,EPS-2,EPS-3清除羥基自由基的EC50值分別為264.74 mg/L,329.55 mg/L,269.05 mg/L和349.27 mg/L。因此,清除羥基自由基能力的強弱順序為EPS >EPS-2 > EPS-1 > EPS-3。由圖2C可見,EPS及其組分都具備超氧陰離子自由基的清除能力,并且,隨著濃度的增加都表現出了明顯的量效關系。EPS,EPS-1,EPS-2,EPS-3清除超氧陰離子自由基的EC50值分別為2196.79 mg/L,2268.94 mg/L,2162.36 mg/L和2312.16 mg/L。因此,清除超氧陰離子自由基能力的強弱順序為EPS-2 > EPS > EPS-1 > EPS-3。由圖2D可見,EPS及其組分都具備DPPH自由基的清除能力,并且,隨著濃度的增加都表現出了明顯的量效關系。EPS,EPS-1,EPS-2,EPS-3清除DPPH自由基的EC50值分別為1248.89 mg/L,1500 mg/L,1169.86 mg/L和1524.76 mg/L。因此,清除DPPH自由基能力的強弱順序為EPS-2 > EPS > EPS-1 > EPS-3。抗氧化實驗結果表明,EPS的三個組分中EPS-2的抗氧化能力最強,其次為EPS-1和EPS-3。
實施例4保濕實驗:
準確稱取干巴菌胞外多糖(EPS)、高分子量透明質酸(HA-H)、低分子量透明質酸(HA-L)和甘油(Gl)樣品0.2000g于稱量瓶(25×25)中,并配制成質量分數為10%的溶液,分別置于裝有飽和醋酸鉀(RH60%)、飽和碳酸鈉(RH43%)和變色硅膠(RH0%)的干燥器中,用甘油,低分子量及高分子量的透明質酸鈉作為對照。將兩個干燥器置于25 ℃的恒溫箱中,分別在4,8,16,24,32,40,48,60,72,84,96,108,120 h后稱重,計算保濕率。保濕率計算公式:保濕率%=(mn﹣m0)/mn×100%,式中:mn為放置之前樣品質量,m0為放置之后樣品質量。
由圖3可以看出,在相對濕度60%的條件下,在120 h時,EPS、HA-H、HA-L和Gl的保濕率分別為61.87%,53.87%,56.96%和50.18%。因此,在該相對濕度條件下,干巴菌胞外多糖(EPS)的保濕能力要高于透明質酸(HA)和甘油(Gl)。由圖4可以看出,在相對濕度43%的條件下,在120 h時,EPS、HA-H、HA-L和Gl的保濕率分別為88.47%,88.12%,86.63%和84.19%。因此,在該相對濕度條件下,干巴菌胞外多糖(EPS)的保濕能力要優于透明質酸(HA)和甘油(Gl)。由圖5可以看出,在120 h時,EPS、HA-H、HA-L和Gl的保濕率分別為29.87%,38.34%,34.72%和18.71%。因此,在該相對濕度的條件下,干巴菌胞外多糖(EPS)的保濕能力要低于透明質酸(HA)而高于甘油(Gl)。
上述實施例為本發明較佳的實施方式,但本發明的實施方式并不受實施例的限制,其它任何未背離本發明的精神實質與原理下所做的改變、修飾、組合、替代、簡化均應為等效替換方式,都包含在本發明的保護范圍之內。
- 還沒有人留言評論。精彩留言會獲得點贊!