與小麥旗葉長QTLQFll.sicau?2D緊密連鎖的分子標記及應用的制作方法
本發明涉及小麥分子育種領域,具體地說,涉及一種與小麥旗葉長QTL QFll.sicau-2D緊密連鎖的分子標記及應用。
背景技術:
小麥是世界重要糧食作物,我國是小麥生產與消費大國,小麥在保障國家糧食安全中占有重要地位,常年種植面積在2666.67萬公頃以上,約占糧食作物面積的27%;總產量為1億噸以上,約占糧食作物產量的22%。
旗葉是小麥生長后期光合效率最高的葉片,是小麥籽粒碳水化合物的重要來源。研究表明,旗葉對小麥籽粒產量的貢獻可達1/3,在籽粒和產量形成中起著重要的作用(左寶玉,段續川.冬小麥不同層次葉片中葉綠體超微結構及其功能的研究[J].Journal of Integrative Plant Biology,1978(3):29-34+93-95.)。旗葉主要是通過影響小麥的穗粒數、單穗粒重和千粒重,從而影響小麥產量。旗葉形態包括:旗葉長、旗葉寬、旗葉面積、旗葉周長、旗葉長寬比等,對旗葉形態性狀相關基因進行定位可為選育高產小麥品種提供理論依據。
旗葉相關性狀是數量性狀(Quantitative trait locus,QTL),受到多基因的控制,并且受環境作用影響很大。近年來,合理的旗葉長、旗葉寬等逐漸成為研究的熱點。在水稻、玉米、大麥中都有對旗葉QTL研究的相關報道,而小麥旗葉的卻是很少。Jia等在5A染色體的Xbarc303~Xwmc區段上定位到了控制旗葉寬的QTL:Qflw.nau-5A,可解釋25%的表型變異(Jia H,Wan H,Yang S,et al.Genetic dissection of yield-related traits in a recombinant inbred line population created using a key breeding parent in China’s wheat breeding[J].Theoretical and Applied Genetics,2013,126(8):2123-39.)。Xue等利用綿陽99-323和PH691構建的NIL對旗葉寬Qflw.nau-5A進行了精細定位,發現其位于5AL上與抗赤霉病基因Fhb5緊密連鎖(Xue S,Xu F,Li G,et al.Fine mapping TaFLW1,a major QTL controlling flag leaf width in bread wheat(Triticum aestivum L.).[J].Theoretical and Applied Genetics,2013,126(8):1941-9.)。
小麥材料H461相對于小麥品種川麥107(國審品種,簡稱CM107)具有長旗葉、寡分蘗、多穗粒數、多小穗數、高千粒重和高穗粒重等特性(侯永翠,鄭有良,蒲至恩,魏育明,李偉.穗數型小麥新品種川農16與大穗型寡分蘗品系H461遺傳差異研究初報.四川農業大學學報.2003,21:94-9)。同時,小麥品種川麥107的旗葉長數顯著低于H461。因此,利用H461和川麥107構建遺傳研究群體,進一步驗證小麥H461的旗葉長特性,定位控制旗葉長基因,尋找緊密連鎖的分子標記,促進旗葉長基因的圖位克隆,同時為小麥特異旗葉長材料的創制及株型育種提供新基因資源,進一步利用分子標記輔助選擇,將增強旗葉長測的準確性,提高育種效率,加速實現增加小麥單產的目標。
分子標記輔助選擇,不依賴于表現型選擇,即不受環境條件、基因間互作、基因型與環境互作等多種因素的影響,而是直接對基因型進行選擇,因而能大大提高育種效率。高分辨熔解曲線(High Resolution Melting,HRM)技術近年來國際上興起的一種SNP及突變研究工具。這種檢測方法具有操作簡便、特異性好、高通量、快速、檢測成本低、結果準確等優勢,并且實現了真正的閉管操作而受到普遍的關注。因此,篩選出與旗葉長QTL緊密連鎖的,且適用于熒光定量PCR平臺HRM技術的分子標記,不僅能對小麥旗葉基因進行選擇,有效調控小麥旗葉形態,塑造合理的旗葉形態群體,同時提高了選擇通量、速度和準確性,解決了大規模推廣應用的技術瓶頸,對規模化改良小麥育種群體質量和產量具有重要意義。
技術實現要素:
本發明的目的是提供一種與小麥旗葉長QTL QFll.sicau-2D緊密連鎖的分子標記。
本發明的另一目的是提供所述分子標記在小麥育種中的應用。
為了實現本發明目的,本發明提供的與小麥旗葉長QTL QFll.sicau-2D緊密連鎖的分子標記,其為分子標記HRM6,核苷酸序列如SEQ ID No:1所示。
分子標記HRM6與小麥旗葉長QTL QFll.sicau-2D之間的遺傳距離為0.01cM,二者共定位于小麥2D染色體上標記MK10324和MK2107之間0.71cM區段內(圖1),小麥旗葉長QTL QFll.sicau-2D能顯著增加小麥旗葉長,LOD值大于5.26,解釋約23%的表型變異。
本發明還提供用于熒光定量PCR擴增所述分子標記HRM6的引物對,包括上游引物和下游引物,序列分別如SEQ ID No:2-3所示。
本發明還提供所述分子標記HRM6在小麥育種中的應用。
本發明還提供所述分子標記HRM6在篩選或鑒定長旗葉小麥品種中的應用。
包括以下步驟:
1)提取待測小麥的基因組DNA;
2)以待測小麥的基因組DNA為模板,設計用于熒光定量PCR擴增所述分子標記的引物對(SEQ ID No:2-3),進行熒光定量PCR擴增;
3)分析PCR擴增產物,進行基因分型。
其中,步驟2)熒光定量PCR擴增反應體系:SsoFast EvaGreen超混合液5μL、上游引物和下游引物各300ng、模板DNA 100ng、Dnaes/RNase-free去離子水加至總量為10μL。
熒光定量PCR擴增程序:95℃預變性5min;94℃變性15s、55℃退火30s,共50個循環;熔解曲線范圍為65~95℃,每0.2℃讀一次數,時間為10s。
步驟3)利用高分辨熔解曲線進行基因分型,含有小麥旗葉長QTL QFll.sicau-2D的小麥品種均出現與小麥H461相同的熔解曲線,而不含有小麥旗葉長QTL QFll.sicau-2D的小麥品種均出現與小麥H461明顯不同的熔解曲線。
本發明還提供所述分子標記HRM6在鑒定小麥旗葉長QTL QFll.sicau-2D中的應用。
本發明還提供SEQ ID No:2-3所示引物對在小麥分子標記輔助育種中的應用。
在本發明中,小麥旗葉長QTLQFll.sicau-2D及分子標記HRM6是通過以下方法獲得的:
(1)利用長旗葉小麥H461作為母本,以川麥107為父本雜交,得到雜種F1,F1代單株自交獲得F2,采用單粒傳法獲得含有200個株系的F8代RIL群體,隨機選擇165個株系構成遺傳作圖群體。
(2)用CTAB法提取所述的遺傳作圖群體的各株系的DNA,用DArT芯片技術,以親本H461和川麥107的DNA為模板,進行基因分型,獲得所述RIL群體的基因型資料。親本H461的帶型記為A,親本川麥107的帶型記為B。F8群體株系帶型來源于H461的記為A,來源于川麥107的記為B,雜合型為H。
(3)小麥抽穗期田間鑒定所述F8群體植株的旗葉長。
(4)利用JoinMap4.0作圖軟件將獲得的所述RIL群體基因型資料構建小麥分子連鎖圖譜,尋找最優的標記數和標記順序,確定后續使用的連鎖群。利用軟件MapQTL 6.0的區間作圖模型(Interval Mapping)和多重QTL作圖模型(Multiple QTL Model),并結合F8群體旗葉表型數據將旗葉長QTL QFll.sicau-2D定位于2DL染色體上一個0.71cM的區段內。
(5)獲取該區段內的DArT探針序列,通過在IWGSC小麥中國春的基因組測序數據(ftp://ftpmips.helmholtz-muenchen.de/plants/wheat/IWGSC/),獲得目標區段更多的序列信息,電子延長DArT探針序列兩端對應的序列,并進行序列分析,初步篩選用于后續熒光定量PCR引物設計的目標區域。
(6)設計熒光定量PCR引物,用于后續篩選。利用Beacon Designer 7.0軟件設計熒光定量PCR引物10對(表1)。熒光定量PCR引物設計標準:引物長度18~25bp,擴增產物長度65~100bp,退火溫度60℃,GC含量在40%~60%之間,SNP差異位點產物退火溫度差異大于0.2℃。
表1 10對HRM引物序列及擴增片段長度
(7)高分辨熔解曲線(HRM)分析
a)親本之間多態性分子標記的篩選:選取上述設計的10對引物,以親本H461和CM107的DNA為模板,進行PCR擴增,共獲得1對效果良好的熒光定量PCR分子標記引物,命名為HRM6-F/R(核苷酸序列如SEQ ID No:2-3所示)。擴增產物為具有多態性的分子標記HRM6,核苷酸序列如SEQ ID No:1所示。
b)F8群體的HRM分析:用上述步驟獲得的具有多態性的分子標記HRM6的PCR引物,擴增親本H461、CM107和F8群體植株的DNA,進行基因型鑒定,獲得分子標記數據。親本H461的類型記為A,擴增片段大小長67bp,單堿基差異位點為“C”。親本CM107的類型記為B,擴增片段長67bp,單堿基差異位點為“A”。F8群體株系類型來源于H461的記為A,來源于CM107的記為B。
本發明具有以下優點:
本發明首次公開了來自小麥H461的旗葉長QTL QFll.sicau-2D,位于小麥2D染色體,顯著增加了小麥旗葉長。該QTL在小麥產量(調控旗葉長)育種中具有較高的利用價值。
本發明首次公開了基于熒光定量PCR平臺精確檢測小麥H461新旗葉長QTL QFll.sicau-2D的分子標記HRM6,且為共顯性標記,檢測準確高效、擴增方便穩定。
本發明公開的分子標記HRM6與旗葉長QTL QFll.sicau-2D極顯著相關,呈現共分離標記特征,用于分子標記輔助選擇的準確性高,提高適應不同環境的小麥特定分蘗品種的選擇鑒定效率,且成功率高。
附圖說明
圖1為本發明小麥H461旗葉長QTL QFll.sicau-2D在2D染色體上的位置及與分子標記HRM6之間的連鎖遺傳圖譜。
圖2為本發明實施例2中利用熒光定量PCR引物對H461、川麥107三葉期的葉片DNA做基因型分型的結果。
圖3為本發明實施例2中H461×川農16的F8RIL群體后代利用熒光定量PCR引物進行基因型分型的結果。
具體實施方式
以下實施例用于說明本發明,但不用來限制本發明的范圍。若未特別指明,實施例均按照常規實驗條件,如Sambrook等分子克隆實驗手冊(Sambrook J&Russell DW,Molecular Cloning:a Laboratory Manual,2001),或按照制造廠商說明書建議的條件。
實施例1 小麥旗葉長QTL QFll.sicau-2D的定位及分子標記HRM6的獲得
1、利用長旗葉小麥H461作為母本,以小麥川麥107為父本雜交,得到雜種F1,F1代單株自交獲得F2,采用單粒傳法獲得含有200個株系的F8代RIL群體,隨機選擇165個株系構成遺傳作圖群體。
2、用CTAB法提取所述的遺傳作圖群體的各株系的DNA,用DArT芯片技術,以親本H461和川麥107的DNA為模板,進行基因分型,獲得所述RIL群體的基因型資料。親本H461的帶型記為A,親本川麥107的帶型記為B。F8群體株系帶型來源于H461的記為A,來源于川麥107的記為B,雜合型為H。
3、小麥抽穗期田間鑒定所述F8群體植株的旗葉長。
4、利用JoinMap4.0作圖軟件將獲得的所述RIL群體基因型資料構建小麥分子連鎖圖譜,尋找最優的標記數和標記順序,確定后續使用的連鎖群。利用軟件MapQTL 6.0的區間作圖模型(Interval Mapping)和多重QTL作圖模型(Multiple QTL Model),并結合F8群體旗葉表型數據將旗葉長QTLQFll.sicau-2D定位于2DL染色體上一個0.71cM的區段內。
5、獲取該區段內的DArT探針序列,通過在IWGSC小麥中國春的基因組測序數據,獲得目標區段更多的序列信息,電子延長DArT探針序列兩端對應的序列,并進行序列分析,初步篩選用于后續熒光定量PCR引物設計的目標區域。
6、設計熒光定量PCR引物,用于后續篩選。利用Beacon Designer 7.0軟件設計熒光定量PCR引物10對(表1)。熒光定量PCR引物設計標準:引物長度18~25bp,擴增產物長度65~100bp,退火溫度60℃,GC含量在40%~60%之間,SNP差異位點產物退火溫度差異大于0.2℃。
7、高分辨熔解曲線(HRM)分析
(a)親本之間多態性分子標記的篩選:選取上述設計的10對引物,以親本H461和CM107的DNA為模板,進行PCR擴增,共獲得1對效果良好的熒光定量PCR分子標記。
(b)F8群體的HRM分析:以上述步驟獲得的具有多態性的分子標記HRM6,擴增親本H461、CM107和F8群體植株的DNA,進行基因型鑒定,獲得分子標記數據。親本H461的類型記為A,擴增片段大小長67bp,單堿基差異位點為“C”。親本CM107的類型記為B,擴增片段長67bp,單堿基差異位點為“A”。F8群體株系類型來源于H461的記為A,來源于CM107的記為B。分子標記HRM6的核苷酸序列如SEQ ID No:1所示。
(c)利用軟件MapQTL 6.0的區間作圖模型(Interval Mapping),并結合F8群體旗葉長表型數據,發現分子標記HRM6位于旗葉長QTL位點QFll.sicau-2D 0.71cM的區段內,結果如圖1所示,由圖1可知,旗葉長QTL QFll.sicau-2D定位在標記MK10324和MK2107之間的0.71cM的區段內,而分子標記HRM6距離DArT標記MK10324為0.317cM,QFll.sicau-2D與分子標記HRM6距離0.01cM,呈緊密連鎖。
實施例2 與小麥旗葉長QTL QFll.sicau-2D緊密連鎖的分子標記HRM6的應用
1.1 DNA的提取
試驗材料選取H461、川農16(CN16)及川麥107(CM107),其中川農16、川麥107為短旗葉長品種,H461為長旗葉長品種。采用CTAB法提取小麥樣品三葉期的葉片DNA。
1.2檢測小麥旗葉長QTLQFll.sicau-2D的引物的篩選
1.2.1引物設計
(1)獲取該區段內的DArT探針序列,通過在IWGSC小麥中國春的基因組測序數據,獲得目標區段更多的序列信息,電子延長DArT探針序列兩端對應的序列,并進行序列分析,初步篩選用于后續熒光定量PCR引物設計的目標區域。
(2)設計熒光定量PCR引物,用于后續篩選。設計熒光定量PCR引物。熒光定量PCR引物設計標準:引物長度18~25bp,擴增產物長度65~100bp,退火溫度60℃,GC含量在40%~60%之間,SNP差異位點產物退火溫度差異大于0.2℃。
1.2.2熒光定量PCR平臺測試引物及其親本間的差異性
(1)提取川農16、H461、川麥107三葉期的葉片DNA。
(2)以步驟(1)所得的DNA作為模板,HRM6-F(SEQ ID No:2)和HRM6-R(SEQ ID No:3)為引物進行熒光定量PCR擴增。
(3)熒光定量PCR擴增反應體系:SsoFast EvaGreen超混合液5μL、上下游引物各300ng、模板DNA 100ng、Dnaes/RNase-free去離子水加至總量為10μL。
(4)熒光定量PCR程序:95℃預變性5min;94℃變性15s、55℃退火30s,共50個循環;熔解曲線范圍為65~95℃,每0.2℃讀一次數,時間為10s。
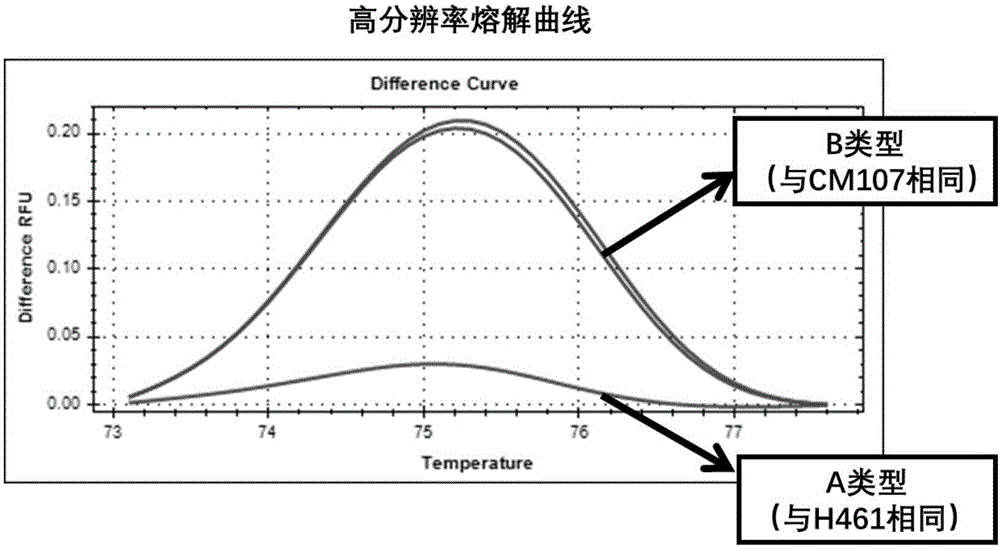
(5)將步驟(4)所得結果文件,導入BioRadPrecisionMelt軟件進行基因分型,結果如圖2所示。在繪制熔解曲線過程中,根據堿基對A=T,C≡G解鏈的溫度不同,BioRadPrecisionMelt將樣本分為兩種類型。H461為類型A,川農16/川麥107為類型B。
1.3群體檢測過程中引物序列HRM6-F/R的適用性
(1)以H461為母本,川農16為父本雜交得到F1,F1自交獲得F2,通過單粒傳法加代至F8代RIL驗證群體。提取群體中各株系三葉期的葉片DNA。
(2)以步驟(1)所得的DNA作為模板,利用本發明所提供的引物進行熒光定量PCR擴增,熒光染料為SsoFast EvaGreen。
(3)熒光定量PCR擴增反應體系:5μL SsoFast EvaGreen超混合液、上下游引物各300ng、100ng模板DNA、Dnaes/RNase-free去離子水加至總量為10μL。
(4)熒光定量PCR程序:95℃預變性5min;94℃變性15s、55℃退火30s,共50個循環;熔解曲線范圍為65~95℃,每0.2℃讀一次數,時間為10s。
(5)將步驟(4)所得結果文件,導入BioRadPrecisionMelt軟件進行基因分型,結果如圖3所示。隨機抽檢96株株系,56株能擴增出與H461相同類型的片段,為含有旗葉長QTL QFll.sicau-2D的植株,預測株系植株在抽穗后旗葉長較長。40株能擴增出與川農16、川麥107相同的B型片段,為不含有旗葉長QTL QFll.sicau-2D的植株,預測這些植株在抽穗后旗葉長較短。
(6)小麥抽穗期間田間鑒定該96個F8植株的旗葉長,結果見表2,旗葉長QTL QFll.sicau-2D的分子標記HRM6預測遺傳群體旗葉長的結果。與H461類型相同的植株平均旗葉長為24.28cm,顯著高于與川農16、川麥107類型的植株旗葉長(平均22.84cm)。實際結果與預期結果一致,說明本發明的旗葉長QTL QFll.sicau-2D確實具有顯著增加旗葉長的作用,且分子標記HRM6可以用于跟蹤鑒定旗葉長QTL QFll.sicau-2D。
表2
雖然,上文中已經用一般性說明及具體實施方案對本發明作了詳盡的描述,但在本發明基礎上,可以對之作一些修改或改進,這對本領域技術人員而言是顯而易見的。因此,在不偏離本發明精神的基礎上所做的這些修改或改進,均屬于本發明要求保護的范圍。
序列表
<110> 四川農業大學
<120> 與小麥旗葉長QTL QFll.sicau-2D緊密連鎖的分子標記及應用
<130> KHP171110011.3TQ
<160> 3
<170> PatentIn version 3.3
<210> 1
<211> 67
<212> DNA
<213> 小麥
<220>
<221> misc_feature
<222> (27)..(27)
<223> n為c或a
<400> 1
gcttcaacac tttgccgttt catcaangat gcagctcgaa acatataggg gtatgtaagc 60
gtcggat 67
<210> 2
<211> 19
<212> DNA
<213> 人工序列
<400> 2
gcttcaacac tttgccttt 19
<210> 3
<211> 18
<212> DNA
<213> 人工序列
<400> 3
atccgacgct tacatacc 18
- 還沒有人留言評論。精彩留言會獲得點贊!