iPS細胞分化成內胚層祖細胞的無血清誘導培養基及誘導方法與流程
本發明涉及組織工程領域,尤其是涉及一種iPS細胞分化成內胚層祖細胞的無血清誘導培養基及誘導方法。
背景技術:
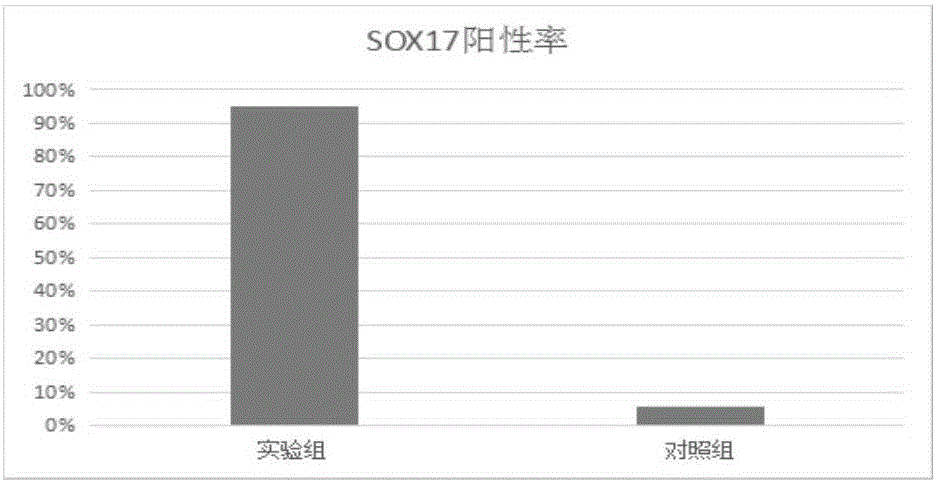
:組織工程是近幾年的研究熱點,但是種子細胞很難在體外進行大規模的培養擴增,種子細胞來源問題阻礙了組織工程的發展。自體的種子細胞來源有限,異體的種子細胞存在排斥反應,胚胎干細胞又存在倫理問題,因此從尿液中收集尿液細胞,將尿液細胞誘導成為iPS細胞(誘導性多能干細胞),iPS細胞再誘導成為各個成體細胞,可以解決組織工程的種子來源問題。從尿液中獲得細胞,方便快捷,不用通過創傷獲取,來源廣泛。目前iPS細胞誘導分化為成體細胞誘導方案主要有單純細胞因子誘導、共培養誘導、擬胚體培養基誘導等。然而單純細胞因子誘導效率低,共培養誘導存在免疫原性,擬胚體存在不定向三個胚層誘導的特點,定向分化率低。成體的各個細胞來源于胚層的不同胚層,因此,要高效獲得某種成體細胞,亟需高效定向獲得某一種胚層。技術實現要素:基于此,有必要提供一種iPS細胞分化成內胚層祖細胞的無血清誘導培養基及誘導方法。一種iPS細胞分化成內胚層祖細胞的無血清誘導培養基,包括第一階段培養基、第二階段培養基和第三階段培養基;其中,所述第一階段培養基為每500ml基礎培養基中添加有終濃度為80-160ng/ml的ActivinA以及終濃度為5-18ng/ml的HGF;所述第二階段培養基為每500ml基礎培養基中添加有終濃度為8-25ng/ml的BMP-4;所述第三階段培養基為每500ml基礎培養基中添加有終濃度為5-18ng/ml的HGF以及終濃度為15-28ng/ml的FGF-2;所述基礎培養基為每500mlDMEM/F12培養基中添加有終濃度為0.05-0.2mmol/l的β巰基乙醇、終濃度為75-180μg/ml的Wnt3a、終濃度為0.15-0.7μg/ml的氫化可的松、終濃度為25-100μg/ml的胰島素、終濃度為5-20ng/ml的亞硒酸鈉以及終濃度為85-180μg/ml的轉鐵蛋白。在其中一個實施例中,所述第一階段培養基為每500ml基礎培養基中添加有終濃度為80-120ng/ml的ActivinA以及終濃度為8-12ng/ml的HGF;所述第二階段培養基為每500ml基礎培養基中添加有終濃度為15-25ng/ml的BMP-4;所述第三階段培養基為每500ml基礎培養基中添加有終濃度為8-12ng/ml的HGF以及終濃度為15-25ng/ml的FGF-2;所述基礎培養基為每500mlDMEM/F12培養基中添加有終濃度為0.08-0.12mmol/l的β巰基乙醇、終濃度為80-120μg/ml的Wnt3a、終濃度為0.2-0.6μg/ml的氫化可的松、終濃度為50-80μg/ml的胰島素、終濃度為8-12ng/ml的亞硒酸鈉以及終濃度為85-120μg/ml的轉鐵蛋白。在其中一個實施例中,所述第一階段培養基為每500ml基礎培養基中添加有終濃度為100ng/ml的ActivinA以及終濃度為10ng/ml的HGF;所述第二階段培養基為每500ml基礎培養基中添加有終濃度為20ng/ml的BMP-4;所述第三階段培養基為每500ml基礎培養基中添加有終濃度為10ng/ml的HGF以及終濃度為20ng/ml的FGF-2;所述基礎培養基為每500mlDMEM/F12培養基中添加有終濃度為0.1mmol/l的β巰基乙醇、終濃度為100μg/ml的Wnt3a、終濃度為0.4μg/ml的氫化可的松、終濃度為60μg/ml的胰島素、終濃度為10ng/ml的亞硒酸鈉以及終濃度為100μg/ml的轉鐵蛋白。一種iPS細胞分化成內胚層祖細胞的誘導方法,依次上述第一階段培養基、第二階段培養基及第三階段培養基對iPS細胞分為三個階段進行誘導分化。在其中一個實施例中,所述三個階段分別為誘導分化的第1天至第3天、第4天至第7天以及第8天至第11天,在每個階段培養時,均隔天換培養基。在其中一個實施例中,所述iPS細胞分化成內胚層祖細胞的誘導方法還包括在誘導分化之前,將iPS細胞通過培養板和離心的方法形成單細胞團擬胚體的步驟。在其中一個實施例中,所述將iPS細胞通過培養板和離心的方法形成單細胞團擬胚體的步驟是按照每個培養板孔加入0.5-1×106個iPS細胞,添加EB形成培養基,再以400-700r/min低速離心4-10分鐘后,放入5%CO2、37℃環境中培養40-65小時,形成所述單細胞團擬胚體。在其中一個實施例中,所述培養板為AggreWellTM800培養板。在其中一個實施例中,所述iPS細胞分化成內胚層祖細胞的誘導方法還包括如下iPS細胞復蘇及單細胞形成的步驟:將P30的iPS細胞進行復蘇,用mTeSR1無基質細胞培養,在70-80%匯合度時,用Accutase消化液消化為單細胞,再將所述單細胞按照每個培養板孔0.5-1×106個iPS細胞加入所述培養板孔中以形成所述單細胞團擬胚體。通過使用上述特定成分和濃度的iPS細胞分化成內胚層祖細胞的無血清誘導培養基及誘導方法,該無血清誘導培養基中各成分協同配合可以將iPS細胞定向誘導分化為內胚層祖細胞,從而為iPS誘導分化為成體的各個細胞提供了技術支持。同時該無血清誘導培養基及誘導方法均沒有用到血清,從而有效地避免了動物源性病原體帶來的風險,提高了臨床應用的安全性。并且較之傳統的含胎牛血清的擬胚體培養基等,顯著提高了iPS細胞向內胚層祖細胞的誘導分化效率,可靠性高,適用范圍廣。并且通過進一步優化該無血清誘導培養的各成分濃度,可以取得更為顯著的誘導iPS細胞向內胚層祖細胞分化的效率和效果。附圖說明圖1為實驗組與對照組的內胚層祖細胞的免疫熒光染色SOX17表達的鑒定結果圖;圖2為實驗組與對照組的內胚層祖細胞中SOX17陽性率的比較結果。具體實施方式為了便于理解本發明,下面將參照相關附圖對本發明進行更全面的描述。附圖中給出了本發明的較佳實施例。但是,本發明可以以許多不同的形式來實現,并不限于本文所描述的實施例。相反地,提供這些實施例的目的是使對本發明的公開內容的理解更加透徹全面。除非另有定義,本文所使用的所有的技術和科學術語與屬于本發明的
技術領域:
的技術人員通常理解的含義相同。本文中在本發明的說明書中所使用的術語只是為了描述具體的實施例的目的,不是旨在于限制本發明。本文所使用的術語“和/或”包括一個或多個相關的所列項目的任意的和所有的組合。本實施例先將iPS細胞通過AggreWellTM800培養板和離心的方法形成單細胞團擬胚體,實驗組用無血清誘導培養基培養單細胞團擬胚體形成定型內胚層,對照組是繼續用擬胚體培養基進行培養,然后通過免疫熒光方法鑒定細胞,比較實驗組和對照組的內胚層SOX17的表達水平。具體過程如下。一、培養基1.實驗組2.對照組培養基名稱工作濃度EB培養基500ml可理解,在其他實施例中,實驗組培養基的成分不限于上表中,只要滿足第一階段培養基為每500ml基礎培養基中添加有終濃度為80-160ng/ml的ActivinA以及終濃度為5-18ng/ml的HGF;第二階段培養基為每500ml基礎培養基中添加有終濃度為8-25ng/ml的BMP-4;第三階段培養基為每500ml基礎培養基中添加有終濃度為5-18ng/ml的HGF以及終濃度為15-28ng/ml的FGF-2;基礎培養基為每500mlDMEM/F12培養基中添加有終濃度為0.05-0.2mmol/l的β巰基乙醇、終濃度為75-180μg/ml的Wnt3a、終濃度為0.15-0.7μg/ml的氫化可的松、終濃度為25-100μg/ml的胰島素、終濃度為5-20ng/ml的亞硒酸鈉以及終濃度為85-180μg/ml的轉鐵蛋白即可,或者進一步滿足第一階段培養基為每500ml基礎培養基中添加有終濃度為80-120ng/ml的ActivinA以及終濃度為8-12ng/ml的HGF;第二階段培養基為每500ml基礎培養基中添加有終濃度為15-25ng/ml的BMP-4;第三階段培養基為每500ml基礎培養基中添加有終濃度為8-12ng/ml的HGF以及終濃度為15-25ng/ml的FGF-2;基礎培養基為每500mlDMEM/F12培養基中添加有終濃度為0.08-0.12mmol/l的β巰基乙醇、終濃度為80-120μg/ml的Wnt3a、終濃度為0.2-0.6μg/ml的氫化可的松、終濃度為50-80μg/ml的胰島素、終濃度為8-12ng/ml的亞硒酸鈉以及終濃度為85-120μg/ml的轉鐵蛋白即可。二、步驟(1)基礎培養基的配制:按每500mlDMEM/F12培養基加入胰島素30mg、氫化可的松0.2mg、轉鐵蛋白50mg、亞硒酸鈉5μg、β巰基乙醇0.05mmol以及Wnt3a50μg配制。(2)第一階段培養基:將步驟1的基礎培養基500ml,加入ActivinA50μg,HGF5μg。(3)第二階段培養基:將步驟1的基礎培養基500ml,加入BMP-410μg。(4)第三階段培養基:將步驟1的基礎培養基500ml,加入HGF5μg,FGF-210μg。(5)對照組培養基:EB培養基(主要成分:擬胚體(EB)形成基礎培養基、擬胚體(EB)形成專用胎牛血清、谷氨酰胺、雙抗、非必需氨基酸(購買自:北京百奧萊博科技有限公司,產品編號:BL1266)、2-巰基乙醇,廠家:賽業生物科技有限公司,產品編號:MUXES-90051)(6)復蘇細胞:選擇P30的iPS細胞(來源中國科學院廣州生物醫藥與健康研究院)進行復蘇,用mTeSR1無基質細胞培養,80%匯合度時,用Accutase消化液消化為單細胞,計數。(7)單細胞團擬胚體的形成:按每個AggreWellTM800培養板孔中加入1×106個iPS細胞,加入EB形成培養基,按產品使用操作手冊,將AggreWellTM800培養板以700r/min低速離心5min后,放入5%CO2、37℃培養箱中培養,培養48h后形成單細胞團擬胚體。(8)誘導分化:將單細胞團擬胚體轉移至低吸附24孔板中,24孔板分為兩組,實驗組和對照組,每組12孔,隔天換液,培養到11天后,對外胚層祖細胞的基因表達水平和表面蛋白表達水平進行檢測。實驗組誘導方法:開始誘導的第一天記為第一天(Day1)。第一階段(Day1-3):用第一階段培養基培養iPS細胞。第二階段(Day4-7):用第二階段培養基進行培養。第三階段(Day8-11):用第三階段培養基進行培養。觀察發現:經過第二、第三階段的誘導,形態發生改變、細胞數量增加,定行內胚層細胞基本形成。對照組的誘導方法:全程都是用EB培養基進行誘導培養。三、內胚層祖細胞的鑒定免疫熒光染色:(1)吸棄孔板中的培養基,注意不要碰到細胞。(2)加入1×PBS清洗細胞一次,5min,吸棄PBS。(3)再加入4%的多聚甲醛(4%PFA),放入37℃、5%CO2培養箱中孵育20min。此步驟后可拿出超凈臺操作。(4)吸棄4%多聚甲醛,注意不要碰到細胞。用1×PBS清洗細胞3次,每次5min。(5)吸棄PBS。加入0.1%Triton打孔,作用10min。(6)吸棄0.1%Triton,用1×PBS清洗細胞3次,每次3min。(7)加入5%BSA,常溫封閉1h。(8)終止封閉前,按照1:100的比例,用PBS稀釋一抗。(9)吸棄封閉液,用PBS洗細胞一次。(10)加入稀釋過的一抗,4℃孵育過夜。(11)吸棄一抗。用1×PBS清洗細胞3次,每次3min。(12)按照1:500的比例稀釋熒光二抗(成分:FITC,廠家:艾美捷科技有限公司,產品編號:A22110),向孔板中加入二抗,室溫孵育1h。(13)吸棄二抗。用1×PBS清洗細胞3次,每次3min。(14)Hochest(純水1:10000稀釋)復染細胞核,室溫作用約2min。(15)吸棄Hochest染液,用1×PBS清洗細胞3次,每次5min。(16)倒置熒光顯微鏡照相,備注好細胞名稱、倍數、時間等。(17)用統計分析法,比較兩組的陽性率。四、結果如圖1和圖2所示,結果表明,實驗組的內胚層SOX17表達率顯著提高,說明了iPS細胞向內胚層祖細胞的定向分化,進一步說明利用本發明的無血清誘導培養基及誘導方法,可以高效誘導iPS細胞向內胚層祖細胞的分化。同時整個過程沒有用到血清,有效的避免了動物源性病原體帶來的風險,提高了臨床應用的安全性。以上所述實施例的各技術特征可以進行任意的組合,為使描述簡潔,未對上述實施例中的各個技術特征所有可能的組合都進行描述,然而,只要這些技術特征的組合不存在矛盾,都應當認為是本說明書記載的范圍。以上所述實施例僅表達了本發明的幾種實施方式,其描述較為具體和詳細,但并不能因此而理解為對發明專利范圍的限制。應當指出的是,對于本領域的普通技術人員來說,在不脫離本發明構思的前提下,還可以做出若干變形和改進,這些都屬于本發明的保護范圍。因此,本發明專利的保護范圍應以所附權利要求為準。當前第1頁1 2 3
相關技術
網友詢問留言
已有0條留言
- 還沒有人留言評論。精彩留言會獲得點贊!
1