關于精神神經疾病或惡性腫瘤的化合物及醫藥組合物的制作方法
本申請是申請公布號cn104520303a的原申請的分案申請,原申請的申請日為2013年7月30日,申請號為201380040385.8,發明名稱為“關于精神神經疾病或惡性腫瘤的化合物及醫藥組合物”。本發明涉及精神神經疾病或惡性腫瘤的化合物及醫藥組合物、其用途、使用其的精神神經疾病或惡性腫瘤的預防、改善、抑制惡化和/或治療方法。
背景技術:
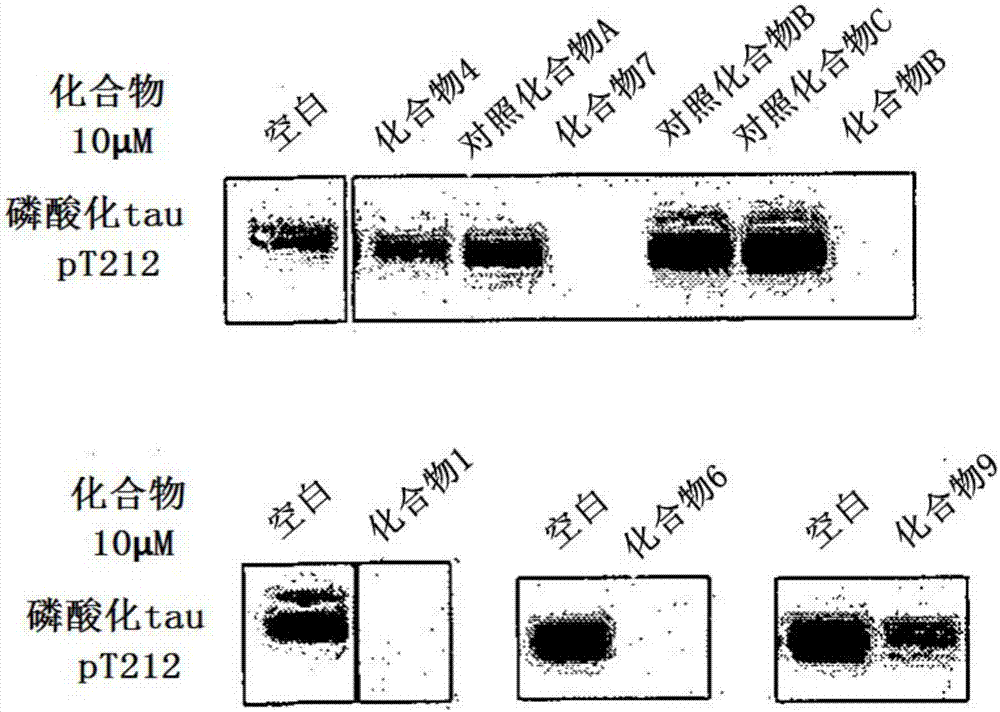
:蛋白質磷酸化酶(激酶)對于細胞內信息傳遞是必不可少的,已知這些物質表達異常或活性異常時會引起多種多樣的疾病。因此,作為藥物研發目標因子各種磷酸化酶被注目,在全世界正在進行對于目標的磷酸化酶的特異的抑制劑的探索。例如,公開了能阻礙作為磷酸化酶的clk1及clk4的磷酸化活性的苯并噻唑衍生物(專利文獻1),或能阻礙作為磷酸化酶的dyrk的磷酸化活性的苯并噻唑衍生物(專利文獻2)。在先技術文獻專利文獻專利文獻1:美國公開專利第2005/0171026號專利文獻2:國際公開第2010/010797號技術實現要素:本發明解決的課題本發明在一個方面,提供關于精神神經疾病或惡性腫瘤的化合物及醫藥組合物、其用途或使用其的精神神經疾病或惡性腫瘤的預防、改善、抑制惡化和/或治療方法。用于解決課題的方案本發明在一個方面,涉及用下述通式(i)表示的化合物或其前體藥物或其制藥上可接受的鹽。[化學式1][在通式(i)中,r1及r2各自獨立,為氫原子或c1-6烴鏈,r3為下述基團,[化學式2]z與以a及b標記的原子共同形成選自由1個苯環、1個雜芳環、1個以上的苯環縮合而成的芳香環、1個以上的雜芳環縮合而成的雜芳環、1個以上的苯環和1個以上的雜芳環縮合而成的混合縮合多環、以及環狀脂肪族組成的組中的環,所述環可以具有1個以上的作為氫原子、鹵原子或c1-6烷基的取代基,r4為氫原子、鹵原子或c1-6烷基。]。本發明在其他的方面還涉及一種如下式所示的化合物或其前體藥物或其制藥上可接受的鹽。[化學式3]本發明在其他的方面涉及一種下述通式(iii)所示的化合物或其前體藥物或其制藥上可接受的鹽。[化學式4][在式(iii)中,r7及r8各自獨立,為氫原子、鹵原子、碳數1-6的直鏈或支鏈或環狀的烷基。]本發明在其他的方面涉及一種如下式所示的化合物或其前體藥物或其制藥上可接受的鹽。[化學式5]本發明在其他的方面涉及一種通式(i)或(iii)所示的化合物或其前體藥物或其制藥上可接受的鹽、及含有它們的醫藥組合物。另外,本發明在其他的方面還涉及一種用于預防、改善、抑制惡化和/或治療精神神經疾病或惡性腫瘤的、通式(i)或(iii)所示的化合物或其前體藥物或其制藥上可接受的鹽、含有它們的醫藥組合物,它們的用途以及使用其的預防、改善、抑制惡化和/或治療的方法。本發明在其他的方面還涉及一種下述通式(ii)所示的化合物或其前體藥物或其制藥上可接受的鹽。[化學式6][通式(ii)中,x及y各自獨立,為s或nh,r5為下述基團:[化學式7]z與以a及b標記的原子共同形成選自由1個苯環、1個雜芳環、1個以上的苯環縮合而成的芳香環、1個以上的雜芳環縮合而成的雜芳環、1個以上的苯環和1個以上的雜芳環縮合而成的混合縮合多環、以及環狀脂肪族組成的組中的環,所述環可以具有1個以上的作為氫原子、鹵原子或c1-6烷基的取代基,r6為氫原子、鹵原子或c1-6烷基。]本發明在其他的方面涉及一種如下式所示的化合物或其前體藥物或其制藥上可接受的鹽。[化學式8]本發明在其他的方面還涉及通式(ii)所示的化合物或其前體藥物或其制藥上可接受的鹽、含有它們的醫藥組合物。另外,本發明在其他的方面還涉及用于精神神經疾病或惡性腫瘤的預防、改善、抑制惡化和/或治療的、通式(ii)所示的化合物或其前體藥物或其制藥上可接受的鹽、含有其的醫藥組合物、其用途,以及使用其的預防、改善、抑制惡化和/或治療的方法。附圖說明圖1是使用特異地識別tau蛋白的212位的蘇氨酸殘基的磷酸化的抗體(上層)及特異地識別tau蛋白的抗體(下層),對于評價體系培養細胞進行蛋白質印跡的結果的一個例子。圖2是在10μm的化合物存在下,使用特異地識別tau蛋白的212位的蘇氨酸殘基的磷酸化的抗體對于誘導表達tau蛋白及dyrk1a蛋白的兩者的評價體系培養細胞,進行蛋白質印跡的結果的一個例子。圖3是表示評價化合物1的口服吸收性的結果一個例子的圖。圖4是在0.3~10μm的化合物存在下,使用特異地識別tau蛋白的212位的蘇氨酸殘基的磷酸化的抗體對于誘導表達tau蛋白及dyrk1a蛋白的兩者的上述培養細胞,進行蛋白質印跡的結果的一個例子。圖5是在應激負荷前預先給藥化合物(100mg/kg),應激負荷后將腦組織摘出,通過western-blot比較·評價化合物1及2給藥組與非化合物給藥組之間的tau蛋白的212位的蘇氨酸殘基的磷酸化程度的結果的一個例子。圖6是測定口服給藥化合物1及2后的血漿中濃度及腦組織中濃度的結果的一個例子。圖7是在10μm的化合物存在下,使用特異地識別tau蛋白的212位的蘇氨酸殘基的磷酸化的抗體對于誘導表達tau蛋白及dyrk1a蛋白的兩者的評價體系培養細胞,進行蛋白質印跡的結果(化合物6、9、15)的一個例子。圖8是在10μm的化合物存在下,使用特異地識別tau蛋白的212位的蘇氨酸殘基的磷酸化的抗體對于誘導表達tau蛋白及dyrk1a蛋白的兩者的評價體系培養細胞,進行蛋白質印跡的結果(化合物3、11、12)的一個例子。圖9是在10μm的化合物存在下,使用特異地識別tau蛋白的212位的蘇氨酸殘基的磷酸化的抗體對于誘導表達tau蛋白及dyrk1a蛋白的兩者的評價體系培養細胞,進行蛋白質印跡的結果(化合物10、13、14)的一個例子。圖10是對于由唐氏綜合癥引起的急性巨核細胞白血病細胞cmk11-5,評價化合物的增殖抑制作用的結果的一個例子。使用阿爾瑪藍(alamarblue)通過檢出熒光強度計算出了細胞數。圖11表示對于由唐氏綜合癥引起的急性巨核細胞白血病細胞j425,評價化合物的增殖抑制作用的結果的一個例子。使用阿爾瑪藍(alamarblue)通過檢出熒光強度計算出了細胞數。圖12是對于由唐氏綜合癥引起的急性巨核細胞白血病細胞kpam1,評價化合物的增殖抑制作用的結果的一個例子。使用阿爾瑪藍(alamarblue)通過檢出熒光強度計算出了細胞數。圖13表示對于視網膜母細胞瘤(retinoblastoma)細胞株weri進行化合物的增殖抑制作用評價的結果的一個例子。使用阿爾瑪藍(alamarblue)通過檢出熒光強度計算出了細胞數。圖14是對于源自人肺腺癌的細胞株(pc-9),用顯微鏡觀察化合物2、3、11及12的增殖抑制作用的結果的一個例子。圖15是對于源自人肺腺癌的細胞株(pc-9-gr-step),用顯微鏡觀察化合物2、3、11及12的增殖抑制作用的結果的一個例子。圖16是對于源自人肺腺癌的細胞株(pc-9-gr-high),用顯微鏡觀察化合物2、3、11及12的增殖抑制作用的結果的一個例子。圖17表示細胞附著培養的情況和抑制細胞附著培養的情況下,評價化合物對于人乳腺癌細胞(triple-negative)的細胞株(mda-mb-453)的增殖抑制作用的結果的一個例子。使用阿爾瑪藍(alamarblue)通過檢出熒光強度計算出了細胞數。圖18表示細胞附著培養的情況和抑制附著培養的情況下,評價化合物對于人乳腺癌細胞(triple-negative)的細胞株(mda-mb-468)的增殖抑制作用的結果的一個例子。使用阿爾瑪藍(alamarblue)通過檢出熒光強度計算出了細胞數。圖19表示評價化合物2的記憶·學習障礙的糾正作用的結果。圖19a表示在實驗第8天(訓練測試1)到第12天(訓練測試5)之間實施的參考記憶的結果。圖19b表示實驗第13天的探索測試的結果。具體實施方式[通式(i)所示的化合物]本發明在一個或多個的實施方式中,涉及下述通式(i)所示的化合物或其前體藥物或其制藥上可接受的鹽。[化學式9][在式(i)中,r1及r2各自獨立,為氫原子或c1-6烴鏈,r3為下述基團:[化學式10]z與以a及b標記的原子共同形成選自由1個苯環、1個雜芳環、1個以上的苯環縮合而成的芳香環、1個以上的雜芳環縮合而成的雜芳環、1個以上的苯環和1個以上的雜芳環縮合而成的混合縮合多環、以及環狀脂肪族組成的組中的環,所述環可以具有1個以上的作為氫原子、鹵原子或c1-6烷基的取代基,r4為氫原子、鹵原子或c1-6烷基。]在本發明中的“前體藥物”在一個或多個的實施方式中,在生物體內易被加水分解,可舉出再生通式(i)所示的化合物的物質,例如,若為具有羧基的化合物,可舉出該羧基變為烷氧羰基的化合物、變為烷基硫代羰基的化合物、或變為烷基氨基羰基的化合物。另外,例如若為具有氨基的化合物,可舉出該氨基被烷酰基取代變為烷酰基氨基的化合物、被烷氧基羰基取代變為烷氧基羰基氨基的化合物、變為烷氧基甲基氨基的化合物、或變為羥胺的化合物。另外,例如若為具有羥基的化合物,可舉出該羥基被上述酰基取代變為酰氧基的化合物、變為磷酸酯的化合物、或者變為酰氧基甲氧基的化合物。作為用于這些前體藥物化的基團的烷基部分,可舉出后述的烷基,該烷基可被取代(例如由碳原子數1~6的烷氧基等)。在一個或多個的實施方式中,例如,以羧基變為烷氧基羰基的化合物作為例子,可舉出被甲氧基羰基、乙氧基羰基等的低級(例如碳數為1~6)烷氧基羰基,甲氧基甲氧基羰基、乙氧基甲氧基羰基、2-甲氧基乙氧基羰基、2-甲氧基乙氧基甲氧基羰基、新戊酰氧基甲氧基羰基等的被烷氧基取代而成的低級(例如碳數為1~6)烷氧基羰基。在本發明中的“c1-6烴鏈”是指從碳數1~6個的脂肪族烴中去除任意1個氫原子所產生的1價基團。在一個或多個的實施方式中,烴鏈可為直鏈結構、支鏈結構、環狀結構均可,可舉出烷基、烯基、苯基、或環烷基。在一個或多個的實施方式中,在本發明中的“c1-6烷基”可舉出甲基、乙基、1-丙基、2-丙基、2-甲基-1-丙基、2-甲基-2-丙基、1-丁基、2-丁基、1-戊基、2-戊基、3-戊基、2-甲基-1-丁基、3-甲基-1-丁基、2-甲基-2-丁基、3-甲基-2-丁基、2,2-二甲基-1-丙基、1-己基、2-己基、3-己基、2-甲基-1-戊基、3-甲基-1-戊基、4-甲基-1-戊基、2-甲基-2-戊基、3-甲基-2-戊基、4-甲基-2-戊基、2-甲基-3-戊基、3-甲基-3-戊基、2,3-二甲基-1-丁基、3,3-二甲基-1-丁基、2,2-二甲基-1-丁基、2-乙基-1-丁基、3,3-二甲基-2-丁基、2,3-二甲基-2-丁基等。本發明中的“雜環”是指在構成環的原子中含有1~2個的雜原子,在環中可以含有雙鍵的、非芳香族性的環或芳香族性的環。本發明的“雜芳環”是指芳香族性的雜環。本發明中的“雜原子”是指硫原子、氧原子或氮原子。本發明中的“環狀脂肪族”是指具有環狀結構的脂肪族。作為環狀脂肪族的基團,例如可舉出碳數3~10個的環狀脂肪族基團,也可為由多個的環構成的具有縮環結構的環狀脂肪族基團。具體而言,例如可舉出碳數3~10的環烷基、環狀醚基、十氫萘基及金剛烷基等。作為碳數3~10個的環狀脂肪族基的具體的例子,可舉出環丙基、環丁基、環戊基、環己基、環庚基等。在本發明中“制藥上可接受的鹽”是指含有藥理上和/或制藥上可接受的鹽,例如可舉出無機酸鹽、有機酸鹽、無機堿鹽、有機堿鹽、酸性或堿性氨基酸鹽等。作為上述無機酸鹽的優選的例子,例如可舉出鹽酸鹽、氫溴酸鹽、硫酸鹽、硝酸鹽、磷酸鹽等,作為有機酸鹽的優選的例子,例如可舉出醋酸鹽、琥珀酸鹽、富馬酸鹽、馬來酸鹽、酒石酸鹽、檸檬酸鹽、乳酸鹽、硬脂酸鹽、苯甲酸鹽、甲磺酸鹽、對甲苯磺酸鹽等。作為上述無機堿鹽的優選的例子,例如可舉出鈉鹽、鉀鹽等的堿金屬鹽;鈣鹽、鎂鹽等的堿土金屬鹽、鋁鹽、銨鹽等。作為上述有機堿鹽的優選的例子,例如可舉出二乙胺鹽、二乙醇胺鹽、葡甲胺鹽、n,n'-二芐基乙二胺鹽等。作為上述酸性氨基酸鹽的優選的例子,例如可舉出天門冬氨酸鹽、谷氨酸鹽等。作為上述堿性氨基酸鹽的優選的例子,例如可舉出精氨酸鹽、賴氨酸鹽、鳥氨酸鹽等。在本發明中,“化合物的鹽”可包括通過將化合物放置在大氣中,吸收水分而能形成的水合物。另外,在本發明中,“化合物的鹽”還可包括化合物吸收其他種類的溶劑而能形成的溶劑合物。在通式(i)中,在一個或多個的實施方式中,r1為c1-6烷基,在進一步的一個或多個的實施方式中,為甲基、乙基或丙基。在通式(i)中,在一個或多個的實施方式中,r2為c1-6烷基,在進一步的一個或多個的實施方式中,為甲基。在通式(i)中,在一個或多個的實施方式中,r3為下述基團:[化學式11]一個或多個的實施方式中,z與以a及b標記的原子共同形成1個苯環。在通式(i)中,在一個或多個的實施方式中,r4為氫原子。在一個或多個的實施方式中,上述通式(i)所示的化合物為如下所示的化合物。[化學式12]在一個或多個的實施方式中,上述通式(i)所示的化合物為下述通式(iii)所示的化合物。[化學式13][在通式(iii)中,r7及r8各自獨立,為氫原子、鹵原子、碳數1-6的直鏈或支鏈或環狀的烷基。]在一個或多個的實施方式中,作為r7及r8的碳數1-6的直鏈或支鏈的烷基,可舉出甲基、乙基、1-丙基、2-丙基、2-甲基-1-丙基、2-甲基-2-丙基、1-丁基、2-丁基、1-戊基、2-戊基、3-戊基、2-甲基-1-丁基、3-甲基-1-丁基、2-甲基-2-丁基、3-甲基-2-丁基、2,2-二甲基-1-丙基、1-己基、2-己基、3-己基、2-甲基-1-戊基、3-甲基-1-戊基、4-甲基-1-戊基、2-甲基-2戊基、3-甲基-2-戊基、4-甲基-2-戊基、2-甲基-3-戊基、3-甲基-3-戊基、2,3-二甲基-1-丁基、3,3-二甲基-1-丁基、2,2-二甲基-1-丁基、2-乙基-1-丁基、3,3-二甲基-2-丁基、2,3-二甲基-2-丁基等。另外,在一個或多個的實施方式中,作為r7及r8的碳數1-6的環狀烷基,可舉出環丙基、環丁基、環戊基、環己基。在一個或多個的實施方式中,上述通式(iii)所示的化合物為下述通式所示的化合物。需要說明的是,r7及r8各自獨立,如上述定義所述。[化學式14]在上述通式(iii)的一個或多個的實施方式中,r7及r8各自獨立,為氫原子、鹵原子、碳數為1-6的直鏈或支鏈的烷基。在一個或多個的實施方式中,上述通式(iii)所示的化合物為如下式所示的化合物。[化學式15][精神神經疾病或惡性腫瘤的預防、改善、抑制惡化和/或治療]通式(i)或(iii)所示的化合物或其前體藥物或其制藥上可接受的鹽,對于精神神經疾病或惡性腫瘤的預防、改善、抑制惡化和/或治療顯示出效果。該機理推斷如下。即,通式(i)或(iii)所示的化合物或其制藥上可接受的鹽,能夠抑制tau蛋白的異常磷酸化,進而通過抑制淀粉狀蛋白前體蛋白(app)的磷酸化,能夠抑制淀粉狀蛋白β(ab)肽的產生,由此推斷能預防、改善、抑制惡化和/或治療精神神經疾病。另外,推斷通過該磷酸化酶活性抑制作用,能預防、改善、抑制惡化和/或治療惡性腫瘤。但是,本發明可不限定于該推斷地進行解釋。另外,在一個或多個的實施方式中,通式(i)或(iii)所示的化合物或其前體藥物或其制藥上可接受的鹽發揮腦內轉移性及口服吸收性。從而能更加有效地預防、改善、抑制惡化和/或治療精神神經疾病或惡性腫瘤。本發明中的“精神神經疾病”,在不受限定的一個或多個的實施方式中,可舉出唐氏癥候群、阿爾茨海默病或在唐氏癥候群中可能發病的阿爾茨海默病。本發明中的“惡性腫瘤”,在不受限定的一個或多個的實施方式中,可舉出腦瘤、膠質母細胞瘤、胰管癌、橫紋肌肉瘤、肺癌、胰腺癌、大腸癌、皮膚癌、前列腺癌、乳腺癌或卵巢癌。另外,本發明中的“惡性腫瘤”,在不受限定的其他的一個或多個的實施方式中,為現有的藥物耐受性惡性腫瘤。對于本發明中的“惡性腫瘤”的更進一步的實施方式而言,為通過抑制或阻礙受體型酪氨酸激酶活性,從而能預防、改善、抑制惡化和/或治療已知的或未來可知的惡性腫瘤。另外,對于本發明中的“惡性腫瘤”的更進一步的實施方式而言,為通過抑制或阻礙表皮生長因子受體(egfr)酪氨酸激酶活性,從而能預防、改善、抑制惡化和/或治療已知的或未來可知的惡性腫瘤。另外,對于本發明中的“惡性腫瘤”的更進一步的實施方式而言,為利用阻礙受體型酪氨酸激酶或表皮生長因子受體(egfr)酪氨酸激酶的活性的藥劑,沒有觀察到預防、改善、抑制惡化和/或治療的顯著效果的已知或未來可知的惡性腫瘤。而且,對于本發明中的“惡性腫瘤”的更進一步的實施方式而言,為用吉非替尼沒有觀察到顯著的預防、改善、抑制惡化和/或治療效果的已知或未來可知的惡性腫瘤。在不受限定的一個或多個的實施方式中,本發明的通式(i)和/或(ii)和/或(iii)所示的化合物或其制藥上可接受的鹽,與受體型酪氨酸激酶或表皮生長因子受體(egfr)酪氨酸激酶的穩定性相關,被認為是使它們不穩定的物質,推斷通過該作用能預防、改善、抑制惡化和/或治療惡性腫瘤。然而,本發明可不限定于該推斷地進行解釋。在一個或多個的實施方式中,本發明涉及一種用于預防、改善、抑制惡化和/或治療精神神經疾病或惡性腫瘤的、上述通式(i)或(iii)所示的化合物或其前體藥物或其制藥上可接受的鹽。在一個或多個的實施方式中,本發明涉及一種含有上述通式(i)或(iii)所示的化合物或其前體藥物或其制藥上可接受的鹽作為有效成分的醫藥組合物。另外,在一個或多個的實施方式中,本發明涉及一種用于預防、改善、抑制惡化和/或治療精神神經疾病或惡性腫瘤的醫藥組合物,且所述醫藥組合物含有上述通式(i)或(iii)所示的化合物或其前體藥物或其制藥上可接受的鹽作為有效成分(以下也稱為“本發明的醫藥組合物i”。)。另外,在一個或多個的實施方式中,本發明涉及上述通式(i)或(iii)所示的化合物或其前體藥物或其制藥上可接受的鹽在制造用于預防、改善、抑制惡化和/或治療精神神經疾病或惡性腫瘤的醫藥組合物中的用途。在一個或多個的實施方式中,本發明中的“醫藥組合物”可適用公知的制劑技術,做成適合給藥形態的劑型。作為該給藥形態,雖不受限于這些,但例如可舉出通過片劑、膠囊劑、顆粒劑、散劑、丸劑、含片劑、糖漿劑、液劑等的劑型的口服給藥。或者,可舉出通過注射劑、液劑、煙霧劑、栓劑、膏劑、貼劑、洗劑、搽劑、軟膏劑、滴眼劑等的劑型的非口服給藥。這些制劑不僅限于這些,可使用賦形劑、潤滑劑、粘結劑、崩解劑、穩定劑、調味劑、稀釋劑等的添加劑并用公知的方法制造。作為上述賦形劑不僅限于這些,但可舉出淀粉、馬鈴薯淀粉、玉米淀粉等的淀粉、乳糖、結晶纖維素、磷酸氫鈣等。作為上述包衣劑,雖不限于這些,但可舉出乙基纖維素、羥丙基纖維素、羥丙基甲基纖維素、蟲膠、滑石、巴西棕櫚蠟、石蠟等。作為上述粘結劑,雖不限于這些,但可舉出聚乙烯吡咯烷酮、聚乙二醇及與上述賦形劑相同的化合物。作為上述崩解劑,雖不限于這些,但可舉出與上述賦形劑相同的化合物以及交聯羧甲基纖維素鈉、羧甲基淀粉鈉、如交聯聚乙烯吡咯烷酮那樣的化學修飾后的淀粉·纖維素類。作為上述穩定劑,雖不限于這些,但可舉出對羥基苯甲酸甲酯、對羥基苯甲酸丙酯那樣的對羥基苯甲酸酯類;氯丁醇、苯甲醇、苯乙醇之類的醇類;苯扎氯銨;苯酚、甲酚之類的酚類;噻汞撒;脫水醋酸;及山梨酸。作為上述調味劑,雖不限于這些,但可舉出通常使用的甜味料、酸味料、香料等。另外,在制造液劑時,作為溶劑,雖不限于這些,但可使用乙醇、酚、氯甲酚、純凈水、蒸餾水等,根據需要也可使用表面活性劑或乳化劑等。作為上述表面活性劑或乳化劑,雖不限于這些,但可舉出聚山梨醇酯80、聚氧乙烯40硬脂酸酯、聚桂醇等。本發明的醫藥組合物i的使用方法可根據癥狀、年齢、給藥方法等而不同。使用方法雖不限于這些,但可以作為有效成分的上述通式(i)或(iii)所示的化合物的體內濃度為100nm~1mm之間的任意濃度的方式,間歇地或持續地口服、經皮、向粘膜下、皮下、肌肉內、血管內、腦內或腹腔內給藥。作為非限定的實施方式,可舉出在口服給藥的情況下,對于對象(若人時為成人)每天,換算為上述通式(i)或(iii)所示的化合物,根據癥狀將下限0.01mg(優選為0.1mg),上限2000mg(優選為500mg,更優選為100mg)分成1次或數次給藥。作為非限定的實施方式,可舉出在靜脈內給藥的情況下,對于對象(若人時為成人)每天,根據癥狀將下限0.001mg(優選為0.01mg),上限500mg(優選為50mg)分成1次或數次給藥。在一個或多個的實施方式中,本發明涉及預防、改善、抑制惡化和/或治療精神神經疾病或惡性腫瘤的方法,所述方法包括將上述通式(i)或(iii)所示的化合物或其前體藥物或其制藥上可接受的鹽向對象給藥。在一個或多個的實施方式中,上述通式(i)或(iii)所示的化合物或其前體藥物或其制藥上可接受的鹽的給藥可依照上述的醫藥組合物i的使用方法。作為對象可舉出人、人以外的動物。即,本發明可涉及以下一個或多個的實施方式;[a1]一種下述通式(i)所示的化合物或其前體藥物或者其制藥上可接受的鹽;[化學式16][在通式(i)中,r1及r2各自獨立,為氫原子或c1-6烴鏈,r3為下述基團:[化學式17]z與以a及b標記的原子共同形成選自由1個苯環、1個雜芳環、1個以上的苯環縮合而成的芳香環、1個以上的雜芳環縮合而成的雜芳環、1個以上的苯環和1個以上的雜芳環縮合而成的混合縮合多環、以及環狀脂肪族組成的組中的環,所述環可以具有1個以上的作為氫原子、鹵原子或c1-6烷基的取代基,r4為氫原子、鹵原子或c1-6烷基。][a2]一種如下式所示的化合物或其前體藥物或其制藥上可接受的鹽;[化學式18][a3]一種下述通式(iii)所示的化合物或其前體藥物或其制藥上可接受的鹽;[化學式19][在通式(iii)中,r7及r8各自獨立,為氫原子、鹵原子、碳數1-6的直鏈或支鏈或環狀的烷基。][a4]一種如下式所示的化合物或其制藥上可接受的鹽;[化學式20][a5]一種醫藥組合物,其含有[a1]-[a4]中任一項所述的化合物或其前體藥物或其制藥上可接受的鹽作為有效成分;[a6]一種醫藥組合物,其是用于預防、改善、抑制惡化和/或治療精神神經疾病或惡性腫瘤的醫藥組合物,所述醫藥組合物含有[a1]-[a4]中任一項所述的化合物或其前體藥物或其制藥上可接受的鹽作為有效成分;[a7]一種[a1]-[a4]所述的化合物或其前體藥物或其制藥上可接受的鹽,其用于精神神經疾病或惡性腫瘤的預防、改善、抑制惡化和/或治療;[a8][a1]-[a4]所述的化合物或其前體藥物或其制藥上可接受的鹽在制造用于預防、改善、抑制惡化和/或治療精神神經疾病或惡性腫瘤的醫藥組合物中的用途;[a9]一種精神神經疾病或惡性腫瘤的預防、改善、抑制惡化和/或治療的方法,所述方法包括:將下述通式(i)所示的化合物或其前體藥物或其制藥上可接受的鹽向對象給藥;[化學式21][在通式(i)中,r1及r2各自獨立,為氫原子或c1-6烴鏈,r3為下述基團:[化學式22]z與以a及b標記的原子共同形成選自由1個苯環、1個雜芳環、1個以上的苯環縮合而成的芳香環、1個以上的雜芳環縮合而成的雜芳環、1個以上的苯環和1個以上的雜芳環縮合而成的混合縮合多環、以及環狀脂肪族組成的組中的環,所述環可以具有1個以上的作為氫原子、鹵原子或c1-6烷基的取代基,r4為氫原子、鹵原子或c1-6烷基。][a10]一種預防、改善、抑制惡化和/或治療精神神經疾病或惡性腫瘤的方法,所述方法包括:將如下式所示的化合物或其前體藥物或其制藥上可接受的鹽向對象給藥;[化學式23][a11]一種預防、改善、抑制惡化和/或治療精神神經疾病或惡性腫瘤的方法,所述方法包括:將通式(iii)所示的化合物或其前體藥物或其制藥上可接受的鹽向對象給藥;[化學式24][在通式(iii)中,r7及r8各自獨立,為氫原子、鹵原子、碳數1-6的直鏈或支鏈或環狀的烷基。][a12]一種預防、改善、抑制惡化和/或治療精神神經疾病或惡性腫瘤的方法,所述方法包括:將如下所示的化合物或其前體藥物或其制藥上可接受的鹽向對象給藥;[化學式25][a13]根據[a1]-[a12]中的任一項所述的化合物或其前體藥物或其鹽、醫藥組合物,用途或方法,其中,精神神經疾病為唐氏癥候群、阿爾茨海默病、和/或唐氏癥候群中可能發病的阿爾茨海默病。[a14]根據[a1]-[a12]中的任一項所述的化合物或其前體藥物或其鹽、醫藥組合物,用途或方法,其中,惡性腫瘤是選自腦瘤、膠質母細胞瘤、胰管癌、橫紋肌肉瘤、肺癌、胰腺癌、大腸癌、皮膚癌、前列腺癌、乳腺癌、及卵巢癌中的惡性腫瘤。[a15]根據[a1]-[a12]中的任一項所述的化合物或其前體藥物或其鹽、醫藥組合物,用途或方法,其中,惡性腫瘤為選自為選自由以下構成的組中的惡性腫瘤:現有的藥物耐受性惡性腫瘤;通過抑制或阻礙受體型酪氨酸激酶活性,從而能預防、改善、抑制惡化和/或治療已知的或未來可知的惡性腫瘤;通過抑制或阻礙表皮生長因子受體(egfr)酪氨酸激酶活性,從而能預防、改善、抑制惡化和/或治療已知的或未來可知的惡性腫瘤;利用阻礙受體型酪氨酸激酶或表皮生長因子受體(egfr)酪氨酸激酶的活性的藥劑,沒有觀察到預防、改善、抑制惡化和/或治療的顯著效果的已知或未來可知的惡性腫瘤;以及,用吉非替尼沒有觀察到顯著的預防、改善、抑制惡化和/或治療效果的已知或未來可知的惡性腫瘤。[通式(ii)所示的化合物]在一個或多個的實施方式中,本發明涉及一種下述通式(ii)所示的化合物或其前體藥物或其制藥上可接受的鹽。[化學式26][在通式(ii)中,x及y各自獨立,為s或nh,r5為下述基團:[化學式27]z與以a及b標記的原子共同形成選自由1個苯環、1個雜芳環、1個以上的苯環縮合而成的芳香環、1個以上的雜芳環縮合而成的雜芳環、1個以上的苯環和1個以上的雜芳環縮合而成的混合縮合多環、以及環狀脂肪族組成的組中的環,所述環可以具有1個以上的作為氫原子、鹵原子或c1-6烷基的取代基,r6為氫原子、鹵原子或c1-6烷基。]。在通式(ii)中,x為s或nh,在一個或多個的實施方式中為s。在通式(ii)中,y為s或nh。在通式(ii)中,r5在一個或多個的實施方式中,為下述基團:[化學式28]在一個或多個的實施方式中,z與以a及b標記的原子共同形成1個苯環。在通式(ii)中,r6在一個或多個的實施方式中為氫原子。在一個或多個的實施方式中,上述通式(ii)所示的化合物為如下式所示的化合物,[化學式29][精神神經疾病或惡性腫瘤的預防、改善、抑制惡化和/或治療]通式(ii)所示的化合物或其前體藥物或其制藥上可接受的鹽,對于精神神經疾病或惡性腫瘤的預防、改善、抑制惡化和/或治療顯示出效果。該機理推斷如下。即,通式(ii)所示的化合物或其制藥上可接受的鹽,能夠抑制tau蛋白的異常磷酸化,進而通過抑制淀粉狀蛋白前體蛋白(app)的磷酸化,能夠抑制淀粉狀蛋白β(ab)肽的產生,由此推斷能預防、改善、抑制惡化和/或治療精神神經疾病。另外,推斷通過該磷酸化酶活性抑制作用,能預防、改善、抑制惡化和/或治療惡性腫瘤。但是,本發明可不限定于該推斷地進行解釋。另外,在一個或多個的實施方式中,通式(ii)所示的化合物或其前體藥物或其制藥上可接受的鹽發揮腦內轉移性及口服吸收性。從而能更加有效地預防、改善、抑制惡化和/或治療精神神經疾病或惡性腫瘤。在一個或多個的實施方式中,本發明涉及一種用于預防、改善、抑制惡化和/或治療精神神經疾病或惡性腫瘤的、上述通式(ii)所示的化合物或其前體藥物或其制藥上可接受的鹽。在一個或多個的實施方式中,本發明涉及一種含有上述通式(ii)所示的化合物或其制藥上可接受的鹽作為有效成分的醫藥組合物。另外,在一個或多個的實施方式中,本發明涉及一種用于預防、改善、抑制惡化和/或治療精神神經疾病或惡性腫瘤的醫藥組合物,且所述醫藥組合物含有上述通式(ii)所示的化合物或其制藥上可接受的鹽作為有效成分(以下也稱為“本發明的醫藥組合物ii”。)。另外,在一個或多個的實施方式中,本發明涉及上述通式(ii)所示的化合物或其前體藥物或其制藥上可接受的鹽在制造用于預防、改善、抑制惡化和/或治療精神神經疾病或惡性腫瘤的醫藥組合物中的用途。本發明的醫藥組合物ii的使用方法可根據癥狀、年齢、給藥方法等而不同。使用方法雖不限于這些,但可以作為有效成分的上述通式(ii)所示的化合物的體內濃度為100nm~1mm之間的任意濃度的方式,間歇地或持續地口服、經皮、向粘膜下、皮下、肌肉內、血管內、腦內或腹腔內給藥。作為非限定的實施方式,可舉出在口服給藥的情況下,對于對象(若人時為成人)每天,換算為上述通式(ii)所示的化合物,根據癥狀將下限0.01mg(優選為0.1mg),上限2000mg(優選為500mg,更優選為100mg)分成1次或數次給藥。作為非限定的實施方式,可舉出在靜脈內給藥的情況下,對于對象(若人時為成人)每天,根據癥狀將下限0.001mg(優選為0.01mg),上限500mg(優選為50mg)分成1次或數次給藥。在一個或多個的實施方式中,本發明涉及預防、改善、抑制惡化和/或治療精神神經疾病或惡性腫瘤的方法,所述方法包括將上述通式(ii)所示的化合物或其前體藥物或其制藥上可接受的鹽向對象給藥。在一個或多個的實施方式中,上述通式(ii)所示的化合物或其前體藥物或其制藥上可接受的鹽的給藥可依照上述的醫藥組合物ii的使用方法。作為對象可舉出人、人以外的動物。即,本發明可涉及以下一個或多個的實施方式;[b1]一種下述通式(ii)所示的化合物或其前體藥物或其制藥上可接受的鹽;[化學式30][在通式(ii)中,x及y各自獨立,為s或nh,r5為下述基團:[化學式31]z與以a及b標記的原子共同形成選自由1個苯環、1個雜芳環、1個以上的苯環縮合而成的芳香環、1個以上的雜芳環縮合而成的雜芳環、1個以上的苯環和1個以上的雜芳環縮合而成的混合縮合多環、以及環狀脂肪族組成的組中的環,所述環可以具有1個以上的作為氫原子、鹵原子或c1-6烷基的取代基,r6為氫原子、鹵原子或c1-6烷基。][b2]一種如下式所示的化合物或其前體藥物或其制藥上可接受的鹽;[化學式32][b3]一種醫藥組合物,其含有[b1]或[b2]所述的化合物或其前體藥物或其制藥上可接受的鹽作為有效成分;[b4]一種醫藥組合物,其是用于預防、改善、抑制惡化和/或治療精神神經疾病或惡性腫瘤的醫藥組合物,所述醫藥組合物含有[b1]或[b2]所述的化合物或其前體藥物或其制藥上可接受的鹽作為有效成分;[b5]一種[b1]或[b2]所述的化合物或其前體藥物或其制藥上可接受的鹽,其用于精神神經疾病或惡性腫瘤的預防、改善、抑制惡化和/或治療[b6][b1]或[b2]所述的化合物或其前體藥物或其制藥上可接受的鹽在制造用于預防、改善、抑制惡化和/或治療精神神經疾病或惡性腫瘤的醫藥組合物中的用途;[b7]一種預防、改善、抑制惡化和/或治療精神神經疾病或惡性腫瘤的方法,所述方法包括:將下述通式(ii)所示的化合物或其前體藥物或其制藥上可接受的鹽向對象給藥;[化學式33][在通式(ii)中,x及y各自獨立,為s或nh,r5為下述基團:[化學式34]z與以a及b標記的原子共同形成選自由1個苯環、1個雜芳環、1個以上的苯環縮合而成的芳香環、1個以上的雜芳環縮合而成的雜芳環、1個以上的苯環和1個以上的雜芳環縮合而成的混合縮合多環、以及環狀脂肪族組成的組中的環,所述環可以具有1個以上的作為氫原子、鹵原子或c1-6烷基的取代基,r6為、氫原子、鹵原子或c1-6烷基。][b8]一種預防、改善、抑制惡化和/或治療精神神經疾病或惡性腫瘤的方法,所述方法包括:將如下式所示的化合物或其前體藥物或其制藥上可接受的鹽向對象給藥;[化學式35][b9]根據[b1]-[b8]中的任一項所述的化合物或其前體藥物或其鹽、醫藥組合物,用途或方法,其中,精神神經疾病為唐氏癥候群、阿爾茨海默病、和/或唐氏癥候群中可能發病的阿爾茨海默病。[b10]根據[b1]-[b8]中的任一項所述的化合物或其前體藥物或其鹽、醫藥組合物,用途或方法,其中,惡性腫瘤是選自腦瘤、膠質母細胞瘤、胰管癌、橫紋肌肉瘤、肺癌、胰腺癌、大腸癌、皮膚癌、前列腺癌、乳腺癌、及卵巢癌中的惡性腫瘤。[b11]根據[b1]-[b8]中的任一項所述的化合物或其前體藥物或其鹽、醫藥組合物,用途或方法,其中,惡性腫瘤為選自為選自由以下構成的組中的惡性腫瘤:現有的藥物耐受性惡性腫瘤;通過抑制或阻礙受體型酪氨酸激酶活性,從而能預防、改善、抑制惡化和/或治療已知的或未來可知的惡性腫瘤;通過抑制或阻礙表皮生長因子受體(egfr)酪氨酸激酶活性,從而能預防、改善、抑制惡化和/或治療已知的或未來可知的惡性腫瘤;利用阻礙受體型酪氨酸激酶或表皮生長因子受體(egfr)酪氨酸激酶的活性的藥劑,沒有觀察到預防、改善、抑制惡化和/或治療的顯著效果的已知或未來可知的惡性腫瘤;以及,用吉非替尼沒有觀察到顯著的預防、改善、抑制惡化和/或治療效果的已知或未來可知的惡性腫瘤。實施例下面通過實施例進一步詳述本發明,但它們僅為示例,本發明并不局限于這些實施例。需要說明的是,在本發明中所引用文獻均作為本發明的一部分被編入。制造例1:化合物1的制造[化學式36]以以下方式制備了化合物1。[化學式37]n-(3-甲氧基苯基)三甲基乙酰胺(1a)的合成[化學式38]在氬氣氣氛下,對于間氨基苯甲醚(m-anisidine)(21.9ml,195mmol,商用品)及碳酸鈉一水合物(sodiumcarbonatemonohydrate)(62.0g,500mmol,商用品)的乙酸乙酯(etoac)(300ml)及純凈水(860ml)的混合溶液,在0℃下緩慢地滴加三甲基乙酰氯(pivaloylchloride)(25.0ml,205mmol,商用品)。在0℃攪拌了1小時后,分離有機層,將水層用乙酸乙酯(etoac)提取。將合并的有機層用硫酸鈉干燥、過濾后,將濾液進行了減壓濃縮。通過用乙酸乙酯(etoac)將得到的殘渣進行再結晶,得到了n-(3-甲氧基苯基)三甲基乙酰胺(n-(3-methoxyphenyl)pivalamide)(化合物1a)(40.2g,194mmol,99.5%)的無色的固體。tlcrf=0.50(正己烷/乙酸乙酯=6/1)n-[2-(2-羥乙基)-3-甲氧苯基]三甲基乙酰胺(1b)的合成[化學式39]在氬氣氣氛下,對于化合物1a(30.0g,145mmol)的四氫呋喃(thf)(400ml,脫水,商用品)溶液,在0℃緩慢地滴加正丁基鋰(nbuli)(2.6minthf,111ml,289mmol,商用品)。保持0℃同時攪拌了2小時后,緩慢地加入環氧乙烷(ethyleneoxide)(1.3m乙醚溶液,175ml,228mmol,商用品),在0℃下攪拌了1小時。升溫至室溫后再進行2小時攪拌。減壓濃縮并加入飽和氯化銨水溶液(sat.nh4claq.),用乙酸乙酯(etoac)(100ml×4)提取混合物。用硫酸鈉將合并的有機層干燥、過濾后,將濾液進行了減壓濃縮。通過用乙酸乙酯(etoac)將得到的殘渣進行再結晶,得到了n-[2-(2-羥乙基)-3-甲氧苯基]三甲基乙酰胺(n-[2-(2-hydroxyethyl)-3-methoxyphenyl]pivalamide)(化合物1b)(28.1g,112mmol,77.1%)的無色的固體。tlcrf=0.40(正己烷/乙酸乙酯=3/1)4-氨基-2,3-二氫苯并呋喃(1c)的合成[化學式40]將化合物1b(4.10g,16.3mmol)溶解于氫溴酸(hbr)(48%aqueous,20.0ml,商用品),在110℃將混合溶液加熱攪拌了16小時。放置冷卻至室溫后,在0℃每次加入少量的氫氧化鈉顆粒,將其ph值調節至9附近。用乙酸乙酯(etoac)(50ml×4)提取混合物,用硫酸鈉干燥合并的有機層。過濾后,減壓濃縮濾液,通過中壓柱層析(smartflashepclcw-prep2xysystem)(正己烷/乙酸乙酯=1/1)精制得到的殘渣,從而得到了4-氨基-2,3-二氫苯并呋喃(4-amino-2,3-dihydrobenzofuran)(化合物1c)(1.49g,11.0mmol,67.6%)的無色的固體。tlcrf=0.30(正己烷/乙酸乙酯=1/1)1hnmr(400mhz,cdcl3)δ(6.94(dd,j=8.4,8.4hz,1h),6.28(dd,j=0.4,7.6hz,1h),6.23(dd,j=0.4,7.6hz,1h),4.59(t,j=8.4hz,2h),3.60(brs,2h),3.02(t,j=8.4hz,2h)。4-乙酰基氨基-2,3-二氫苯并呋喃(1d)的合成[化學式41]將化合物1c(2.00g,14.8mmol)溶解于醋酐(aceticanhydride)(15.0ml,商用品),在室溫下攪拌混合溶液16小時。反應結束后,減壓濃縮混合物,將得到的茶色的固體用乙酸乙酯(etoac)進行再結晶,從而得到了4-乙酰基氨基-2,3-二氫苯并呋喃(4-acetylamino-2,3-dihydrobenzofuran)(化合物1d)(2.10g,11.9mmol,80.1%)的無色的固體。tlcrf=0.15(正己烷/乙酸乙酯=1/1)1hnmr(400mhz,cdcl3)δ7.18(d,j=6.4hz,1h),7.09(t,j=6.4hz,1h),7.04(brs,1h),6.62(d,j=6.0hz,1h),4.59(t,j=6.8hz,2h),3.13(t,j=6.8hz,2h),2.18(s,3h)。4-乙酰基氨基-5-溴-2,3-二氫苯并呋喃(1e)的合成[化學式42]對于化合物1d(2.10g,11.9mmol)的二氯甲烷(dichloromethane)(50ml,脫水,商用品)溶液,在-78℃每次少量地加入n-溴代琥珀酰亞胺(n-bromosuccinimide)(2.31g,13.0mmol,商用品),用10小時將其升溫至室溫。反應結束后,減壓濃縮混合物,將得到的殘渣通過中壓柱層析(smartflashepclcw-prep2xysystem)(正己烷/乙酸乙酯=1/1)精制,從而得到了4-乙酰基氨基-5-溴-2,3-二氫苯并呋喃(4-acetylamino-5-bromo-2,3-dihydrobenzofuran)(化合物1e)(1.76g,6.87mmol,57.8%)無色的固體。需要說明的是,此時,從1hnmr的解析確認了被認為是二溴體1e'的生成物(tlcrf=0.15(正己烷/乙酸乙酯=1/1))的副產物。tlcrf=0.25(正己烷/乙酸乙酯=1/1)1hnmr(400mhz,cdcl3)δ7.29(d,j=8.4hz,1h),7.11(brs,1h),6.58(d,j=8.4hz,1h),4.60(t,j=8.8hz,2h),3.22(t,j=8.8hz,2h),2.23(s,3h)5-溴-4-硫代乙酰基氨基-2,3-二氫苯并呋喃(1f)的合成[化學式43]將化合物1e(1.76g,6.87mmol)和勞森試劑(lawesson'sreagent)(1.01g,2.50mmol,商用品)溶解于甲苯(toluene)(25ml,脫水,商用品),加熱回流了16小時。放置冷卻至室溫后,減壓濃縮混合物,通過中壓柱層析(smartflashepclcw-prep2xysystem)(正己烷/乙酸乙酯=1/1)精制,得到了5-溴-4-硫代乙酰基氨基-2,3-二氫苯并呋喃(5-bromo-4-thioacetylamino-2,3-dihydrobenzofuran)(化合物1f)(1.86g,6.83mmol,99.5%)的淺棕色固體。tlcrf=0.35(正己烷/乙酸乙酯=1/1)1hnmr(400mhz,cdcl3)兩種旋轉異構體的混合物(70:30)δ8.85(brs,0.3h),8.33(brs,0.7h),7.41(d,j=8.8hz,0.3h),7.36(d,j=8.4hz,0.7h),6.73(d,j=8.8hz,0.3h),6.69(d,j=8.4hz,0.7h),4.69-4.59(m,2h),3.19-3.27(m,2h),2.76(s,2.1h),2.36(s,0.9h)。2-甲基-7,8-二氫苯并呋喃并[4,5-d]噻唑(1g)的合成[化學式44]在氬氣氣氛下,向三(二亞芐基丙酮)二鈀(pd2(dba)3)(237mg,0.259mmol,商用品)、(2-聯苯基)-二叔丁基膦(2-biphenyl)-di-tert-butylphosphine(johnphos,154mg,0.516mmol,商用品)、碳酸銫(cs2co3)(2.50g,7.67mmol,商用品)中加入二惡烷(dioxane)(30ml,脫水,商用品),攪拌了10分鐘。對于該懸濁液,加入化合物1f(1.40g,5.14mmol)的二惡烷溶液(20ml,脫水,商用品)后,加熱回流了16小時。放置冷卻至室溫后,減壓濃縮混合物,將得到的殘渣通過中壓柱層析(smartflashepclcw-prep2xysystem)精制,得到了2-甲基-7,8-二氫苯并呋喃并[4,5-d]噻唑(2-methyl-7,8-dihydrobenzofuro[4,5-d]thiazole)(化合物1g)(780mg,4.08mmol,79.2%)的淡黃色的固體。tlcrf=0.25(正己烷/乙酸乙酯=1/1)1hnmr(400mhz,cdcl3)δ7.45(d,j=8.4hz,1h),6.82(d,j=8.4hz,1h),4.63(t,j=8.8hz,2h),3.51(t,j=8.8hz,2h),2.75(s,3h)。1-乙基-2-甲基-7,8-二氫苯并呋喃并[4,5-d]噻唑-1-鎓碘化物(1h)的合成[化學式45]將化合物1g(182mg,0.952mmol)溶解于碘乙烷(eti)(3.0ml,商用品),在130℃(鋁加熱塊溫度)加熱攪拌混合溶液82小時。放置冷卻至室溫后,減壓蒸餾將碘乙烷除去,用日本桐山漏斗將析出的固體過濾。在漏斗上用乙酸乙酯(3ml×4)洗滌固體后,減壓下干燥,得到了1-乙基-2-甲基-7,8-二氫苯并呋喃并[4,5-d]噻唑-1-鎓碘化物(1-ethyl-2-methyl-7,8-dihydrobenzofuro[4,5-d]thiazol-1-iumiodide)(化合物1h)(327mg,0.942mmol,98.9%)的淡黃色的固體。tlc拖尾斑(atailingspot)rf=0.25(二氯甲烷/甲醇=5/1)1hnmr(400mhz,cd3od)δ8.00(d,j=8.8hz,1h),3.17(s,3h),7.27(d,j=8.8hz,1h),4.82(t,j=8.8hz,2h),4.76(q,j=7.2hz,2h),3.86(t,j=8.8hz,2h),1.59(t,j=7.2hz,3h)。(z)-1-[1-乙基-7,8-二氫苯并呋喃并[4,5-d]噻唑-2(1h)-亞基]丙-2-酮(化合物1)的合成[化學式46]在氬氣氣氛下,對于化合物1h(150mg,0.432mmol)的吡啶(pyridine)(4.0ml,商用品)溶液,在0℃下,加入了乙酰氯(61μl,0.86mmol,商用品)。升溫至室溫后,攪拌混合物5小時。反應結束后,加入鹽酸(0.25m,25ml),用乙酸乙酯(etoac)(3ml×4)提取。用硫酸鈉干燥合并的有機層,過濾,將濾液進行了減壓濃縮。將得到的殘渣通過中壓柱層析(smartflashepclcw-prep2xysystem)(正己烷/乙酸乙酯=1/1)精制,從而得到了(z)-1-[1-乙基-7,8-二氫苯并呋喃并[4,5-d]噻唑-2(1h)-亞基]丙-2-酮((z)-1-[1-ethyl-7,8-dihydrobenzofuro[4,5-d]thiazol-2(1h)-ylidene]propan-2-one)(化合物1)(57.9mg,0.222mmol,51.3%)的淡黃色的固體。通過將該固體通過乙腈(acetonitirile)進行再結晶,從而得到了淡黃色的結晶。tlcrf=0.25(正己烷/乙酸乙酯=1/1)mp226-227℃1hnmr(500mhz,cdcl3)δ7.29(d,j=8.5hz,1h),6.67(d,j=8.5hz,1h),5.84(s,1h),4.65(t,j=8.5hz,2h),4.12(q,j=7.0hz,2h),3.55(t,j=8.5hz,2h),2.23(s,3h),1.40(t,j=7.0hz,3h)。制造例2:化合物2的制造[化學式47]以以下方式制備了化合物2。[化學式48]1-(2-氨基-3-溴-6-甲氧基苯基)-2-氯乙酮(化合物2b)的合成[化學式49]對于三氯化硼(bcl3)(1m己烷溶液,540ml,0.540mol)的二氯甲烷(dichloromethane)(540ml)溶液,在0℃緩慢地滴加2-溴-5-甲氧基苯基胺(化合物2a)(2-bromo-5-methoxyphenylamine)(100g,0.495mol)的二氯甲烷(500ml)溶液。在0℃將得到的黑色反應液攪拌30分鐘,加入氯乙腈(chloroacetonitrile)(76ml,1.2mol)和氯化鋁(alcl3)(72g,0.54mol),在室溫下攪拌1小時后,加熱回流了一夜。反應結束后,用冰冷卻到0℃,加入鹽酸(2m,100ml),再加入鹽酸(5m,200ml)后,在室溫下攪拌了1小時。收集有機層后,用二氯甲烷提取水層。用水洗滌合并的有機層,用硫酸鈉干燥、過濾,通過將濾液進行減壓濃縮,得到了1-(2-氨基-3-溴-6-甲氧基苯基)-2-氯-乙酮(1-(2-amino-3-bromo-6-methoxyphenyl)-2-chloroethanone)(化合物2b)(138g,0.495mol,100%)暗綠色的固體。1hnmr(400mhz,cdcl3)δ7.46(d,j=8.8hz,1h),6.74(brs,2h),6.11(d,j=8.8hz,1h),4.75(s,2h),3.88(s,3h)。4-氨基-5-溴-苯并呋喃-3-酮(化合物2c)的合成[化學式50]對于氯化鋁(alcl3)(100g,0.75mol)的二氯甲烷(dichloromethane)(400ml,脫水)的懸濁液,緩慢地滴加化合物2b(70g,0.25mol)的二氯甲烷(dichloromethane)(300ml)溶液后,加熱回流了12小時。反應結束后,用冰冷卻到0℃,緩慢地滴加鹽酸(2m)后,加入甲醇和二氯甲烷,收集有機層。用二氯甲烷提取水層,用硫酸鈉干燥合并的有機層,過濾,減壓濃縮濾液后,通過硅膠柱層析精制,從而得到了4-氨基-5-溴-苯并呋喃-3-酮(4-amino-5-bromo-benzofuran-3-one)(化合物2c)(30g,0.13mol,53%)的綠褐色的固體。1hnmr(400mhz,cdcl3)δ7.49(d,j=8.8hz,1h),6.28(d,j=8.8hz,1h),5.78(brs,2h),4.63(s,2h)。4-氨基-5-溴-2,3-二氫苯并呋喃-3-醇(化合物2d)的合成[化學式51]對于化合物2c(140g,0.614mol)的乙醇(etoh)(3l)溶液,在0℃加入硼氫化鈉(nabh4)(47g,1.2mol),升溫至室溫后,攪拌了一夜。反應結束后,加入丙酮(acetone),在室溫下攪拌30分鐘,減壓濃縮后加入水,用二氯甲烷提取(1000ml×2)。用硫酸鈉干燥合并的有機層,過濾,通過減壓濃縮濾液,得到4-氨基-5-溴-2,3-二氫苯并呋喃-3-醇(4-amino-5-bromo-2,3-dihydrobenzofuran-3-ol)(化合物2d)的無色的固體后,保持未精制的狀態,用于下一個反應。1hnmr(400mhz,cdcl3)δ7.28(d,j=8.4hz,1h),6.18(d,j=8.4hz,1h),5.42(brs,1h),4.64-4.60(m,1h),4.42-4.39(m,3h),1.81(brs,1h)。4-氨基-5-溴苯并呋喃(化合物2e)的合成[化學式52]對于化合物2d(<0.614mol)的丙酮(acetone)溶液,加入鹽酸(1m,100ml),在室溫下攪拌30分鐘后減壓濃縮,加入二氯甲烷和水稀釋。用硫酸鈉干燥有機層,過濾,通過減壓濃縮濾液,得到4-氨基-5-溴苯并呋喃(4-amino-5-bromobenzofuran)(化合物2e)的黃色的固體后,保持未精制的狀態,用于下一個反應。1hnmr(400mhz,cdcl3)δ7.52(d,j=2.4hz,1h),7.30(d,j=8.8hz,1h),6.84(d,j=8.8hz,1h),6.67(d,j=2.4hz,1h),4.33-4.29(brs,2h)。4-乙酰氨基-5-溴苯并呋喃(化合物2f)的合成[化學式53]將化合物2e(<0.614mol)的醋酐(aceticanhydride)(1.5l)溶液,在室溫下攪拌2小時。過濾析出的無色的固體,減壓濃縮濾液后,通過再結晶精制殘渣。通過將由過濾得到的固體和由再結晶得到的固體共同干燥,從而得到4-乙酰氨基-5-溴苯并呋喃(4-acetamino-5-bromobenzofuran)(化合物2f)(120g,0.47mol,77%,for3steps)。1hnmr(400mhz,cdcl3)δ7.56(d,j=2.0hz,1h),7.49(brs,1h),7.42(d,j=8.8hz,1h),7.23(d,j=8.8hz,1h),6.73(d,j=2.0hz,1h),2.27(s,3h)。4-(硫代乙酰基)氨基-5-溴苯并呋喃(化合物2g)的合成[化學式54]將化合物2f(120g,0.472mol)和勞森試劑(lawesson'sreagent)(76g,0.19mol)的甲苯(toluene)(2l)溶液,加熱回流了16小時。放置冷卻至室溫后,減壓濃縮,將得到的殘渣通過硅膠柱層析精制,從而得到了4-(硫代乙酰基)氨基-5-溴苯并呋喃(4-(thioacetyl)amino-5-bromobenzofuran)(化合物2g)(98g,0.36mol,77%)的淡黃色的固體。1hnmr(300mhz,dmso-d6)δ11.60(brs,1h),8.01(d,j=2.1hz,1h),7.56(s,2h),6.77(d,j=2.1hz,1h),2.66(s,3h)。2-甲基-7,8-苯并呋喃并[4,5-d]噻唑(化合物2h)的合成[化學式55]在氮氣氛下,對于三(二亞芐基丙酮)二鈀(pd2(dba)3)(33g,36mmol)、4,5-雙二苯基膦-9,9-二甲基氧雜蒽(xantphos,9,9-dimethyl-4,5-bis(diphenylphosphino)xanthene)(41g,71mmol)、碳酸銫(cesiumcarbonate)(234g,0.72mol)的二惡烷(dioxane)(1.5l)的懸濁液加入化合物2g(98g,0.36mol),加熱回流了16小時。放置冷卻至室溫后,將其減壓濃縮,通過硅酸鎂載體(florisil)將得到的殘渣進行了粗精制(etoac)。減壓濃縮得到的溶液后,通過硅膠柱層析精制,得到了2-甲基-7,8-苯并呋喃并[4,5-d]噻唑(2-methyl-7,8-benzofuro[4,5-d]thiazole)(化合物2h)(60g,0.32mol,88%)的黃色的固體。1hnmr(300mhz,cdcl3)δ7.73(d,j=2.1hz,1h),7.67(d,j=8.7hz,1h),7.53(d,j=8.7hz,1h),7.28(d,j=2.1hz,1h),2.90(s,3h)。1-乙基-2-甲基-7,8-苯并呋喃并[4,5-d]噻唑-1-鎓碘化物(化合物2i)的合成[化學式56]將化合物2h(50g,0.26mol)的碘乙烷(iodoethane)(400ml)溶液在密封、高壓釜中,130℃加熱攪拌了50小時。放置冷卻至室溫后,通過減壓濃縮除去碘乙烷,用乙酸乙酯使得到的殘渣懸浮。過濾該懸濁液,通過用乙酸乙酯洗滌,從而得到了1-乙基-2-甲基-7,8-苯并呋喃并[4,5-d]噻唑-1-鎓碘化物(1-ethyl-2-methyl-7,8-benzofuro[4,5-d]thiazol-1-iumiodide)(化合物2i)(66g,0.19mol,74%)的綠色的固體。1hnmr(400mhz,dmso-d6)δ8.49(d,j=2.1hz,1h),8.36(d,j=8.8hz,1h),8.16(d,j=8.8hz,1h),7.77(d,j=2.1hz,1h),4.90(q,j=7.2hz,2h),3.26(s,3h),1.53(t,j=7.2hz,3h)。(z)-1-[1-乙基-7,8-苯并呋喃并[4,5-d]噻唑-2(1h)-亞基]丙-2-酮(化合物2)的合成[化學式57]對于化合物2i(66g,0.19mol)的乙腈(actetonitrile)(250ml)的懸濁液加入醋酐(aceticanhydride)(43ml,0.46mol)、三乙胺(triethylamine)(80ml,0.57mol),加熱回流了3小時。放置冷卻至室溫后減壓濃縮,通過硅膠柱層析(petroleumether/etoac=1/1)精制得到的殘渣,從而得到了(z)-1-[1-乙基-7,8-苯并呋喃并[4,5-d]噻唑-2(1h)-亞基]丙-2-酮((z)-1-[1-ethyl-7,8-benzofuro[4,5-d]thiazol-2(1h)-ylidene]propan-2-one)(化合物2)(42g,0.16mol,84%)的黃色的固體。1hnmr(400mhz,cdcl3)δ7.71(t,j=1.2hz,1h),7.44(d,j=8.8hz,1h),7.33(dd,j=8.8,0.9hz,1h),6.94(dd,j=2.1,0.9hz,1h),5.92(s,1h),4.27(q,j=7.2hz,2h),2.24(s,3h),1.47(t,j=7.2hz,3h)。制造例3:化合物3的制造[化學式58]以以下方式制備了化合物3。[化學式59]4-溴-5-甲氧基-2-甲基苯并[d]噻唑(化合物3a)的合成[化學式60]對于5-甲氧基-2-甲基苯并[d]噻唑(5-methoxy-2-methylbenzo[d]thiazole)(5.54g,30.9mmol,商用品)的二氯甲烷(dichloromethane)(60ml,脫水,商用品)溶液,在0℃將n-溴代琥珀酰亞胺(n-bromosuccinimide)(6.05g,34.0mmol,商用品)一點一點地加入,在室溫下攪拌了40小時。反應結束后,加入硫代硫酸鈉水溶液(5ml),用二氯甲烷(dichloromethane)提取混合物,用硫酸鈉干燥有機層,進行過濾。減壓濃縮濾液,通過中壓柱層析(smartflashepclcw-prep2xysystem)(正己烷/乙酸乙酯=5/1)精制,從而得到了4-溴-5-甲氧基-2-甲基苯并[d]噻唑(4-bromo-5-methoxy-2-methylbenzo[d]thiazole)(化合物3a)(7.02g,27.2mmol,88.0%)無色的固體。另外此時,根據1hnmr確認到被認為是位置異構體的6-溴化物3a'(tlcrf=0.20(正己烷/乙酸乙酯=5/1),約12%)的生成。tlcrf=0.35(正己烷/乙酸乙酯=5/1)1hnmr(500mhz,cdcl3)δ7.68(d,j=9.0hz,1h,aromatic),7.02(d,j=9.0hz,1h,aromatic),3.98(s,3h,och3),2.87(s,3h,arch3)。13cnmr(126mhz,cdcl3)δ169.7,154.9,153.1,128.2,120.3,110.5,104.7,57.2,20.5。4-(2-氯苯基)-5-甲氧基-2-甲基苯并[d]噻唑(化合物3b)的合成[化學式61]在氬氣氣氛下,將化合物3a(516mg,2.00mmol)、2-氯苯基硼酸(2-chlorophenylboronicacid)(375mg,2.40mmol,商用品)、四三苯基膦鈀(tetrakis(triphenylphosphine)palladium)(116mg,0.100mmol,商用品)、碳酸鈉一水合物(sodiumcarbonatemonohydrate)(424mg,3.42mmol,商用品)的甲苯(toluene)(7.0ml,脫水,商用品)、乙醇(ethanol)(7.0ml,脫水,商用品)、h2o(7.0ml)溶液,在90℃加熱攪拌了20小時。放置冷卻至室溫后,通過硅酸鎂載體(florisil)(75~150μm,商用品)將混合物進行了粗精制。減壓濃縮得到的溶液,通過中壓柱層析(smartflashepclcw-prep2xysystem)(正己烷/乙酸乙酯=5/1)精制,從而得到了4-(2-氯苯基)-5-甲氧基-2-甲基苯并[d]噻唑(4-(2-chlorophenyl)-5-methoxy-2-methylbenzo[d]thiazole)(化合物3b)(490mg,1.69mmol,84.5%)的淡黃色的油狀物質。tlcrf=0.35(正己烷/乙酸乙酯=5/1)**tlcrf=0.45(以正己烷/乙酸乙酯=10/1進行三次或四次展開(tripleorquadrupledevelopmentwithn-hexane/etoac)),cf.tlcof3a:rf=0.40(以正己烷/乙酸乙酯=10/1進行三次或四次展開(tripleorquadrupledevelopmentwithn-hexane/etoac))ir(kbr,cm-1)3404,3057,2937,1459,1395,1275,1216,1100,749,642。1hnmr(500mhz,cdcl3)δ7.79(d,j=8.5hz,1h,aromatic),7.53-7.51(m,1h,aromatic),7.39-7.33(m,3h,aromatic),7.11(d,j=8.5hz,1h,aromatic),3.83(s,3h,och3),2.74(s,3h,hetarch3)。13cnmr(126mhz,cdcl3)δ168.2,155.5,153.3,134.8,134.4,132.4,129.4,128.9,128.2,126.4,121.8,121.2,110.0,56.8,20.5。4-(2-氯苯基)-3-乙基-5-甲氧基-2-甲基苯并[d]噻唑-3-鎓三氟甲磺酸鹽(化合物3c)的合成[化學式62]在氬氣氣氛下,將化合物3b(661mg,2.28mmol)溶解于三氟甲磺酸乙酯(ethyltriflate)(2.0ml,商用品),在50℃(水浴溫度)下加熱攪拌混合溶液17小時。放置冷卻至室溫后,用日本桐山漏斗過濾析出的結晶,用正己烷(n-hexane)(3ml×4)洗滌,從而得到了4-(2-氯苯基)-3-乙基-5-甲氧基-2-甲基苯并[d]噻唑-3-鎓三氟甲磺酸鹽(4-(2-chlorophenyl)-3-ethyl-5-methoxy-2-methylbenzo[d]thiazol-3-iumtriflate)(化合物3c)(744mg,1.59mmol,69.7%)的淡橙色的固體。ir(kbr,cm-1)3404,3057,2937,1459,1395,1275,1216,1100,749,642。1hnmr(500mhz,dmso-d6)δ8.52(d,j=9.0hz,1h,aromatic),7.74-7.67(m,2h,aromatic),7.61-7.50(m,3h,aromatic),4.15-4.06(m,1h,nchgem-aa'ch3),3.98-3.90(m,1h,nchgem-aa'ch3),3.81(s,3h,och3),3.12(s,3h,hetarch3)0.99(t,j=7.0hz,3h,ch2ch3)。13cnmr(126mhz,dmso-d6)δ179.0,158.2,138.6,133.9,132.7,131.2,130.7,129.6,127.5,125.8,121.9,120.7(q,j=324hz),116.1,113.4,57.2,45.6,17.3,13.1。(z)-1-[4-(2-氯苯基)-3-乙基-5-甲氧基苯并[d]噻唑-2(3h)-亞基]丙-2-酮(化合物3d)的合成[化學式63]在氬氣氣氛下,對于化合物3c(468mg,1.00mmol)的乙腈(mecn)(10ml,脫水,商用品)溶液在室溫加入三乙胺(triethylamine)(0.56ml,4.02mmol,商用品)和醋酐(aceticanhydride)(0.28ml,2.96μmol,商用品)。在80℃攪拌混合物2.5小時。反應結束后加入蒸餾水(約5ml),用二氯甲烷(dichloromethane)(3ml×4)提取。用硫酸鈉干燥合并的有機層,過濾,減壓濃縮濾液后,通過中壓柱層析(smartflashepclcw-prep2xysystem)(正己烷/乙酸乙酯=1/1)精制,從而得到了(z)-1-[4-(2-氯苯基)-3-乙基-5-甲氧基苯并[d]噻唑-2(3h)-亞基]丙-2-酮((z)-1-[4-(2-chlorophenyl)-3-ethyl-5-methoxybenzo[d]thiazole-2(3h)-ylidene]propan-2-one)(化合物3d)(288mg,0.800mmol,80.0%)的淡黃色的固體。tlcrf=0.30(正己烷/乙酸乙酯=1/1)ir(kbr,cm-1)2935,2839,1458,1424,1194,1091,1044,969,765。1hnmr(500mhz,cdcl3)δ7.55-7.50(m,2h,aromatic),7.42-7.31(m,3h,aromatic),6.84(d,j=9.0hz,1h,aromatic),5.78(s,1h,olefinic),3.72(s,3h,och3),3.65-3.46(m,2h,ch2ch3),2.21(s,3h,c(o)ch3),0.93(t,j=7.2hz,3h,ch2ch3)。13cnmr(126mhz,cdcl3)δ191.1,161.6,156.8,137.5,135.3,134.0,132.2,129.6,129.4,126.6,122.3,120.3,112.9,106.3,90.7,56.7,41.9,29.1,11.9。(z)-1-[4-(2-氯苯基)-3-乙基-5-羥基-苯并[d]噻唑-2(3h)-亞基]丙-2-酮(化合物3e)的合成[化學式64]在氬氣氣氛下,在0℃下在化合物3d(144mg,0.400mmol)的二氯甲烷(dichloromethane)(4.0ml,脫水,商用品)溶液中加入三溴化硼(borontribromide)(1.0m二氯甲烷溶液,1.20ml,1.20mmol,商用品),升溫至室溫后,攪拌混合物5小時。反應結束后加入蒸餾水(約5ml),用二氯甲烷(dichloromethane)(3ml×4)和少量的甲醇(methanol)(約0.5ml)提取。用硫酸鈉干燥合并的有機層,過濾,減壓濃縮濾液后,通過硅膠柱層析(正己烷/乙酸乙酯=1/1)精制,從而得到了(z)-1-[4-(2-氯苯基)-3-乙基-5-羥基-苯并[d]噻唑-2(3h)-亞基]丙-2-酮((z)-1-[4-(2-chlorophenyl)-3-ethyl-5-hydroxybenzo[d]thiazole-2(3h)-ylidene]propan-2-one)(化合物3e)(138mg,0.399mmol,99.8%)的黃色的固體。tlcrf=0.20(正己烷/乙酸乙酯=1/1,寬點(broadspot))ir(kbr,cm-1)3118,1473,1420,1287,991,814,765。1hnmr(500mhz,dmso-d6)δ9.62(s,1h,aroh),7.59(d,j=8.0hz,1h,aromatic),7.54(d,j=8.5hz,1h,aromatic),7.48-7.40(m,3h,aromatic),6.80(d,j=8.5hz,1h,aromatic),5.93(s,1h,olefinic),3.63-3.55(m,1h,chaa'-gemch3),3.46-3.38(m,1h,chaa'-gemch3),2.05(s,3h,c(o)ch3),0.81(t,j=7.0hz,3h,ch2ch3)。13cnmr(126mhz,dmso-d6)δ189.9,160.4,155.2,137.4,134.7,134.4,133.2,130.4,129.5,127.5,122.9,116.9,111.5,111.0,90.7,41.7,29.2,12.1。(z)-1-(1-乙基苯并[2,3]苯并呋喃并[4,5-d]噻唑-2(1h)-亞基)丙-2-酮(化合物3)的合成[化學式65]氬氣氣氛下,將化合物3e(69.2mg,0.200mmol)和噻吩-2-羧酸銅(i)(copper(i)thiophene-2-carboxylate)(45.8mg,0.240mmol,商用品)的n,n-二甲基乙酰胺(n,n-dimethylacetamide)(2ml,脫水,商用品)溶液,在微波照射下,在250℃加熱攪拌了30分鐘。放置冷卻至室溫后加入稀鹽酸(0.1m,3ml),用二氯甲烷(dichloromethane)(3ml×4)提取。用硫酸鈉干燥有機層,過濾,減壓濃縮濾液后,通過硅膠柱層析(正己烷/乙酸乙酯=1/1)精制,從而得到了(z)-1-(1-乙基苯并[2,3]苯并呋喃并[4,5-d]噻唑-2(1h)-亞基)丙-2-酮((z)-1-(1-ethylbenzo[2,3]benzofuro[4,5-d]thiazol-2(1h)-ylidene)propan-2-one)(化合物3)(35.3mg,0.114mmol,57.0%)的淺棕色固體。tlcrf=0.30(正己烷/乙酸乙酯=1/1)mp190-192℃ir(kbr,cm-1)3058,2987,2931,1346,1203,1011,741,647,542。1hnmr(500mhz,cdcl3)δ8.07(d,j=8.5hz,1h,aromatic),7.67-7.64(m,2h,aromatic),7.52(dd,j=8.0,1.5hz,1h,aromatic),7.46-7.39(m,2h,aromatic),6.05(s,1h,olefinic),4.69(q,j=7.0hz,2h,ch2ch3),2.30(s,3h,c(o)ch3),1.75(t,j=7.0hz,3h,ch2ch3)。13cnmr(126mhz,cdcl3)δ191.1,160.7,156.7,156.1,135.2,127.2,123.3,122.6,121.4,121.3,121.1,112.4,109.3,107.0,90.2,43.7,29.1,14.4。制造例4:化合物4的制造[化學式66]以以下方式制備了化合物4。(z)-5-[(2,3-二氫苯并呋喃-5-基)亞甲基]-2-硫酮噻唑烷-4-酮(化合物4)的合成在氬氣氣氛下,在室溫下向2,3-二氫苯并呋喃-5-甲醛(296mg,2.00mmol,商用品)、醋酸銨(nh4oac)(77.0mg,1.00mmol,商用品)、羅丹寧(rhodanine)(266mg,2.00mmol,商用品)的乙腈(mecn)(2ml,脫水,商用品)溶液中添加醋酸(acoh)(120μl,2.10mmol,商用品),加熱回流混合物3.5小時。放置冷卻至室溫后,用日本桐山漏斗過濾析出的結晶,用水(3ml×4)、乙醚(3mlx2)洗滌,從而得到了(z)-5-[(2,3-二氫苯并呋喃-5-基)亞甲基]-2-硫酮噻唑烷-4-酮((z)-5-[(2,3-dihydrobenzofuran-5-yl)methylene]-2-thioxothiazolidin-4-one)(化合物4)(488mg,1.86mmol,92.7%)的黃色的固體。mp247-248℃1hnmr(400mhz,dmso-d6)δ13.70(brs,1h),7.58(s,1h),7.47(s,1h),7.41(d,j=8.4hz,1h),6.93(d,j=8.4hz,1h),4.63(t,j=8.4hz,2h),3.25(t,j=8.4hz,2h)。制造例5:化合物5的制造[化學式67]以以下方式制備了化合物5。(z)-5-[(苯并呋喃-5-基)亞甲基]-2-硫酮噻唑烷-4-酮(化合物5)的合成在氬氣氣氛下,在室溫下向苯并呋喃-5-甲醛(146mg,1.00mmol,按照j.med.chem.,2009,52,6270-6286.合成)、醋酸銨(nh4oac)(38.5mg,0.500mmol,商用品)、羅丹寧(rhodanine)(133mg,1.00mmol,商用品)的乙腈(mecn)(2ml,脫水,商用品)溶液中添加醋酸(acoh)(60μl,1.1mmol,商用品),加熱回流混合物2小時。放置冷卻至室溫后,用日本桐山漏斗過濾析出的結晶,用水(3ml×4)、乙醚(3mlx2)洗滌,從而得到了(z)-5-[(苯并呋喃-5-基)亞甲基]-2-硫酮噻唑烷-4-酮((z)-5-[(benzofuran-5-yl)methylene]-2-thioxothiazolidin-4-one)(化合物5)(212mg,0.812mmol,81.2%)的黃色的固體。mp264-265℃1hnmr(400mhz,dmso-d6)δ13.84(brs,1h),8.13(d,j=2.0hz,1h),7.96(d,j=2.0hz,1h),7.81-7.78(m,2h),7.61(dd,j=8.8,2.0hz,1h),7.12(d,j=2.0hz,1h).制造例6:化合物6的制造[化學式68]以以下方式制備了化合物6。(z)-5-[(二苯并呋喃-2-基)亞甲基]-2-硫酮噻唑烷-4-酮(化合物6)的合成在氬氣氣氛下,在室溫下向二苯并呋喃-2-甲醛(196mg,0.999mmol,按照eur.j.med.chem.2011,46,4827-4833.合成)、醋酸銨(nh4oac)(38.5mg,0.499mmol,商用品)、羅丹寧(rhodanine)(133mg,0.999mmol,商用品)的乙腈(mecn)(脫水,2ml,商用品)溶液中添加醋酸(acoh)(57μl,1.0mmol,商用品),加熱回流混合物2小時。放置冷卻至室溫后,用日本桐山漏斗過濾析出的結晶,用水(3ml×4)、乙醚(3mlx2)洗滌,從而得到了(z)-5-[(二苯并呋喃-2-基)亞甲基]-2-硫酮噻唑烷-4-酮((z)-5-(dibenzo[b,d]furan-2-ylmethylene)-2-thioxothiazolidin-4-one)(化合物6)(351mg,>0.999mmol,>100%,純度約85%)的淡黃色的固體。mp287-288℃1hnmr(400mhz,dmso-d6)δ13.85(brs,1h,nh),8.37(s,1h,aromatic),8.29(d,j=7.2hz,1h,aromatic),7.88(d,j=8.4hz,1h,aromatic),7.82(s,1h,olefinic),7.80-7.74(m,2h,aromatic),7.60(dd,j=8.4,0.8hz,1h,aromatic),7.45(dd,j=8.4,1.2hz,1h,aromatic)。制造例7:化合物7的制造[化學式69]以以下方式制備了化合物7。(z)-5-[(2,3-二氫苯并呋喃-5-基)亞甲基)-2-亞氨基噻唑烷-4-酮(化合物7)的合成在氬氣氣氛下,在室溫下向2,3-二氫苯并呋喃-5-甲醛(296mg,2.00mmol,商用品)、醋酸銨(nh4oac)(77.0mg,1.00mmol,商用品)、假乙內酰硫脲(pseudothiohydantoin)(232mg,2.00mmol,商用品)的乙腈(mecn)(2ml,脫水,商用品)溶液中添加醋酸(acoh)(120μl,2.10mmol,商用品),加熱回流混合物6小時。放置冷卻至室溫后,用日本桐山漏斗過濾析出的結晶,用水(3ml×4)、乙醚(3mlx2)洗滌,從而得到了(z)-5-[(2,3-二氫苯并呋喃-5-基)亞甲基)-2-亞氨基噻唑烷-4-酮((z)-5-[(2,3-dihydrobenzofuran-5-yl)methylene]-2-iminothiazolidin-4-one)(化合物7)(468mg,1.90mmol,95.1%)的淡黃色的固體。mp280℃(dec)1hnmr(400mhz,dmso-d6)δ9.33(brs,1h),9.07(brs,1h),7.55(s,1h),7.46(s,1h),7.36(dd,j=7.2,0.8hz,1h),6.92(d,j=7.2hz,1h),4.62(t,j=7.2hz,2h),3.26(t,j=7.2hz,2h)。制造例8:化合物8的制造[化學式70]以以下方式制備了化合物8。(z)-5-[(苯并呋喃-5-基)亞甲基)-2-亞氨基噻唑烷-4-酮(化合物8)的合成在氬氣氣氛下,在室溫下向苯并呋喃-5-甲醛(146mg,1.00mmol,按照j.med.chem.,2009,52,6270-6286.合成)、醋酸銨(nh4oac)(38.5mg,0.500mmol,商用品)、假乙內酰硫脲(pseudothiohydantoin)(133mg,1.00mmol,商用品)的乙腈(mecn)(2ml,脫水,商用品)溶液中添加醋酸(acoh)(60μl,1.1mmol,商用品),加熱回流混合物2小時。放置冷卻至室溫后,用日本桐山漏斗過濾析出的結晶,用水(3ml×4)、乙醚(3mlx2)洗滌,從而得到了(z)-5-[(苯并呋喃-5-基)亞甲基)-2-亞氨基噻唑烷-4-酮((z)-5-[(benzofuran-5-yl)methylene]-2-iminothiazolidin-4-one)(化合物8)(94.8mg,0.389mmol,38.9%)的淡黃色的固體。mp250℃(dec)1hnmr(400mhz,dmso-d6)δ9.43(brs,1h),9.17(brs,1h),8.13(d,j=2.0hz,1h),7.93(d,j=2.0hz,1h),7.79-7.76(m,2h),7.59(dd,j=8.8,2.0hz,1h),7.11(d,j=2.0hz,1h)。制造例9:化合物9的制造[化學式71]以以下方式制備了化合物9。(z)-5-[(二苯并呋喃-5-基)亞甲基)-2-亞氨基噻唑烷-4-酮(化合物9)的合成在氬氣氣氛下,在室溫下向二苯并呋喃-2-甲醛(196mg,0.999mmol,按照eur.j.med.chem.2011,46,4827-4833.合成)、醋酸銨(nh4oac)(38.5mg,0.499mmol,商用品)、假乙內酰硫脲(pseudothiohydantoin)(133mg,1.15mmol,商用品)的乙腈(mecn)(脫水,2ml,商用品)溶液中添加醋酸(acoh)(57μl,1.0mmol,商用品),加熱回流混合物2小時。放置冷卻至室溫后,用日本桐山漏斗過濾析出的結晶,用水(3ml×4)、乙醚(3mlx2)洗滌,從而得到了(z)-5-[(二苯并呋喃-5-基)亞甲基)-2-亞氨基噻唑烷-4-酮((z)-5-(dibenzo[b,d]furan-2-ylmethylene)-2-iminothiazolidin-4-one)(化合物9)(263mg,0.894mmol,89.5%,純度約85%)的淡黃色的固體。mp290-291℃(dec).1hnmr(400mhz,dmso-d6)δ9.43(brs,1h,nh),9.17(brs,1h,nh),8.35(s,1h,aromatic),8.17(d,j=6.8hz,1h,aromatic),7.85(d,j=7.2hz,1h,aromatic),7.77(s,1h,olefinic),7.75-7.71(m,2h,aromatic),7.58(dd,j=8.0,1.2hz,1h,aromatic),7.46(dd,j=8.0,0.8hz,1h,aromatic)。制造例10:化合物10的制造[化學式72]以以下方式制備了化合物10。[化學式73]2-(2-氯-4,5-二甲基苯基)-4,4,5,5-四甲基-1,3,2-二氧硼戊環(化合物10a)的合成[化學式74]在氬氣氣氛下,向(1,5-環辛二烯)(甲氧基)銥(i)的二聚物((1,5-cyclooctadiene)(methoxy)iridium(i)dimer)(331mg,0.499mmol,商用品)、4,4'-二叔丁基聯吡啶(4,4'-di-tert-butylbipyridine)(268mg,0.999mmol,商用品)、雙(頻哪醇合)二硼(bis(pinacolato)diboron)(3.81g,15.0mmol,商用品)的四氫呋喃(thf)(脫水,30ml,商用品)溶液中加入4-氯-1,2-二甲基苯(4-chloro-1,2-dimethylbenzene)(1.30ml,9.68mmol,商用品),加熱回流了4小時。放置冷卻至室溫后,通過硅酸鎂載體(florisil)(75-150μm,商用品)將混合物進行了粗精制(正己烷/乙酸乙酯=20/1)。減壓濃縮得到的溶液,通過硅膠柱層析(正己烷/乙酸乙酯=20/1)精制,從而得到了2-(2-氯-4,5-二甲基苯基)-4,4,5,5-四甲基-1,3,2-二氧硼戊環(2-(2-chloro-4,5-dimethylphenyl)-4,4,5,5-tetramethyl-1,3,2-dioxaborolane)(化合物10a)(1.99g,7.47mmol,77.1%)的無色的液體。tlcrf=0.40(正己烷/乙酸乙酯=20/1)1hnmr(400mhz,cdcl3)δ7.45(s,1h,aromatic),7.13(s,1h,aromatic),2.23(s,3h,arch3),2.21(s,3h,arch3),1.36(s,12h,(ch3)2c-c(ch3)2)。4-(2-氯-4,5-二甲基苯基)-5-甲氧基-2-甲基苯并[d]噻唑(化合物10b)的合成[化學式75]在氬氣氣氛下,將化合物3a(141mg,0.546mmol)、化合物10a(159mg,0.596mmol)、醋酸鈀(pd(oac)2)(5.6mg,0.025mmol,商用品)、(2-聯苯基)二環己基膦((2-biphenyl)dicyclohexylphosphine)(17.5mg,49.9μmol,商用品)、磷酸三鉀·水合物(tri-potassiumphosphaten-hydrate)(265mg,0.992mmol,商用品)的二惡烷(dioxane)(脫水,5.0ml,商用品)、純凈水(0.5ml)的混合溶液在90℃加熱攪拌了14.5小時。放置冷卻至室溫后加入水(5ml),用乙酸乙酯(5ml×4)提取。用硫酸鈉干燥合并的有機層,減壓濃縮混合物,通過中壓柱層析(smartflashepclcw-prep2xysystem)(正己烷/乙酸乙酯=5/1)精制,從而從而得到了4-(2-氯-4,5-二甲基苯基)-5-甲氧基-2-甲基苯并[d]噻唑(4-(2-chloro-4,5-dimethylphenyl)-5-methoxy-2-methylbenzo[d]thiazole)(化合物10b)(106mg,0.334mmol,61.1%)的無色的固體。tlcrf=0.40(正己烷/乙酸乙酯=5/1)1hnmr(400mhz,cdcl3)δ7.77(d,j=8.8hz,1h,aromatic),7.31(s,1h,aromatic),7.16(s,1h,aromatic),7.11(d,j=8.8,1h,aromatic),3.84(s,3h,och3),2.75(s,3h,hetarch3),2.30(s,3h,arch3),2.28(s,3h,arch3)。4-(2-氯-4,5-二甲基苯基)-3-乙基-5-甲氧基-2-甲基苯并[d]噻唑-3-鎓三氟甲磺酸鹽(化合物10c)的合成[化學式76]在氬氣氣氛下,將化合物10b(106mg,0.334mmol)的三氟甲磺酸乙酯(etotf)(0.5ml,商用品)的懸濁液在50℃(油浴溫度)加熱攪拌了2.5小時。放置冷卻至室溫后,用日本桐山漏斗過濾析出的結晶,用正己烷(n-hexane)(3ml×4)洗滌,從而得到了4-(2-氯-4,5-二甲基苯基)-3-乙基-5-甲氧基-2-甲基苯并[d]噻唑-3-鎓三氟甲磺酸鹽(4-(2-chloro-4,5-dimethylphenyl)-3-ethyl-5-methoxy-2-methylbenzo[d]thiazol-3-iumtriflate)(化合物10c)(156mg,0.315mmol,94.2%)的無色的固體。1hnmr(400mhz,cdcl3)δ8.06(d,j=8.8hz,1h,aromatic),7.42(d,j=8.8hz,1h,aromatic),7.32(s,1h,aromatic),7.27(s,1h,aromatic),4.28(q,j=7.2hz,2h,ch2ch3),3.86(s,3h,och3),3.19(s,3h,hetarch3),2.35(s,3h,arch3),2.30(s,3h,arch3),1.14(t,j=7.2hz,3h,ch2ch3)。(z)-1-(2-氯-4,5-二甲基苯基)-3-乙基-5-甲氧基苯并[d]噻唑-2(3h)-亞基)丙-2-酮(化合物10d)的合成[化學式77]在氬氣氣氛下,對于化合物10c(149mg,0.300mmol)的二氯甲烷(dichloromethane)(脫水,3.0ml,商用品)溶液,在-78℃加入了三乙胺(triethylamine)(167μl,1.20mmol,商用品)和乙酰氯(acetylchloride)(64μl,0.90μmol,商用品)。升溫至室溫后,攪拌混合物1小時。反應結束后加入水(約3ml),用二氯甲烷(3ml×4)提取。用硫酸鈉干燥合并的有機層,過濾,減壓濃縮濾液后,通過中壓柱層析(smartflashepclcw-prep2xysystem)(正己烷/乙酸乙酯=1/1)精制,從而得到了(z)-1-(2-氯-4,5-二甲基苯基)-3-乙基-5-甲氧基苯并[d]噻唑-2(3h)-亞基)丙-2-酮((z)-1-(2-chloro-4,5-dimethylphenyl)-3-ethyl-5-methoxybenzo[d]thiazole-2(3h)-ylidene)propan-2-one)(化合物10d)(74.8mg,0.193mmol,64.3%)的黃色的固體。tlcrf=0.35(正己烷/乙酸乙酯=1/1)1hnmr(400mhz,cdcl3)δ7.51(d,j=8.8hz,1h,aromatic),7.28(s,1h,aromatic),7.06(s,1h,aromatic),6.82(d,j=8.8hz,1h,aromatic),5.77(s,1h,olefinic),3.72(s,3h,och3),3.62-3.49(m,2h,ch2ch3),2.32(s,3h,arch3),2.26(s,3h,arch3),2.21(s,3h,c(o)ch3),0.95(t,j=7.2hz,3h,ch2ch3)。(z)-1-(2-氯-4,5-二甲基苯基)-3-乙基-5-羥基苯并[d]噻唑-2(3h)-亞基)丙-2-酮(化合物10e)的合成[化學式78]在氬氣氣氛下,對于化合物10d(74.8mg,0.193mmol)的二氯甲烷(dichloromethane)(脫水、2.0ml、商用品)溶液,在0℃下加入了三溴化硼(borontribromide)(1.0m二氯甲烷溶液,0.58ml,0.58mmol,商用品)。升溫至室溫后,攪拌混合物5小時。反應結束后在0℃加入水(約2ml),用二氯甲烷(2ml×4)和少量的甲醇(methanol)(約0.3ml)提取。用硫酸鈉干燥合并的有機層,過濾,減壓濃縮濾液后,用日本桐山漏斗過濾得到的固體,用冷甲醇(3ml×4)洗滌,從而得到了(z)-1-(2-氯-4,5-二甲基苯基)-3-乙基-5-羥基苯并[d]噻唑-2(3h)-亞基)丙-2-酮((z)-1-(2-chloro-4,5-dimethylphenyl)-3-ethyl-5-hydroxybenzo[d]thiazol-2(3h)-ylidene)propan-2-one)(化合物10e)(56.2mg,0.150mmol,77.9%)的橙色的固體。tlcrf=0.20(二氯甲烷/甲醇=20/1)1hnmr(400mhz,dmso-d6)δ9.53(s,1h,aroh),7.50(d,j=8.4,1h,aromatic),7.35(s,1h,aromatic),7.20(s,1h,aromatic),6.78(d,j=8.4hz,1h,aromatic),5.91(s,1h,olefinic),3.66-3.56(m,1h,chaa'-gemch3),3.51-3.41(m,1h,chaa'-gemch3),2.29(s,3h,arch3),2.23(s,3h,arch3),2.06(s,3h,c(o)ch3),0.84(t,j=6.8hz,3h,ch2ch3)。(z)-1-(9-氯-1-乙基苯并[2,3]苯并呋喃并[4,5-d]噻唑-2(1h)-亞基)丙-2-酮(化合物10)的合成[化學式79]在氬氣氣氛下,將化合物10e(52.5mg,0.140mmol)和噻吩-2-羧酸銅(i)(copper(i)thiophene-2-carboxylate)(32.0mg,0.168mmol,商用品)的n,n-二甲基乙酰胺(n,n-dimethylacetamide)(1.4ml,脫水,商用品)溶液在微波照射下,在250℃加熱攪拌30分鐘。放置冷卻至室溫后,加入鹽酸(1m,0.2ml),用二氯甲烷(dichloromethane)(2ml×4)提取。用硫酸鈉干燥合并的有機層,過濾,減壓濃縮濾液后,通過中壓柱層析(smartflashepclcw-prep2xysystem)(正己烷/乙酸乙酯=1/1)精制,從而得到了(z)-1-(9-氯-1-乙基苯并[2,3]苯并呋喃并[4,5-d]噻唑-2(1h)-亞基)丙-2-酮((z)-1-(8,9-dimethyl-1-ethylbenzo[2,3]benzofuro[4,5-d]thiazol-2(1h)-ylidene)propan-2-one)(化合物10)(25.8mg,76.5μmol,54.6%)的褐色的固體。tlcrf=0.40(正己烷/乙酸乙酯=1/1)mp263-265℃ir(kbrcm-1)3074,2977,2941,1607,1506,1489,1330,1316,1115,975,863,802,777。1hnmr(500mhz,cdcl3)δ7.72(s,1h,aromatic),7.54(d,j=8.5hz,1h,aromatic),7.38(s,1h,aromatic),7.35(d,j=8.5hz,1h,aromatic),6.00(s,1h,olefinic),4.60(q,2h,j=6.5hz,ch2ch3),2.41(s,6h,arch3×2),2.29(s,3h,c(o)ch3),1.70(t,j=6.5hz,3h,ch2ch3)。13cnmr(126mhz,cdcl3)δ190.9,160.7,156.6,154.9,136.7,134.9,131.5,122.9,121.0,120.2,118.8,112.6,109.3,106.9,90.0,43.5,29.0,20.6,20.4,14.3。制造例11:化合物11的制造[化學式80]以以下方式制備了化合物11。[化學式81]4-(2-氯-4-甲基苯基)-5-甲氧基-2-甲基苯并[d]噻唑(化合物11a)的合成[化學式82]在氬氣氣氛下,將化合物3a(285mg,1.10mmol)、(2-氯-4-甲基苯基)硼酸((2-chloro-4-methylphenyl)boronicacid)(226mg,1.33mmol,商用品)、四三苯基膦鈀(tetrakis(triphenylphosphine)palladium)(63.6mg,55.0μmol,商用品)、碳酸鈉一水合物(sodiumcarbonatemonohydrate)(233mg,1.88mmol,商用品)的甲苯(toluene)(脫水,4ml,商用品)、乙醇(etoh)(脫水,4ml,商用品)、純凈水(4ml)的混合溶液在90℃加熱攪拌2.5小時。放置冷卻至室溫后,減壓濃縮混合物,通過中壓柱層析(smartflashepclcw-prep2xysystem)(正己烷/乙酸乙酯=5/1)進行精制,從而得到了4-(2-氯-4-甲基苯基)-5-甲氧基-2-甲基苯并[d]噻唑(4-(2-chloro-4-methylphenyl)-5-methoxy-2-methylbenzo[d]thiazole)(化合物11a)(188mg,0.619mmol,56.3%)的無色的固體。tlcrf=0.40(正己烷/乙酸乙酯=5/1)1hnmr(400mhz,cdcl3)δ7.77(d,j=8.8hz,1h,aromatic),7.35(d,j=0.8hz,1h,aromatic),7.27(d,j=7.6hz,1h,aromatic),7.17(d,j=7.6,0.8hz,1h,aromatic),7.10,(d,j=8.8hz,1h,aromatic),3.83(s,3h,och3),2.74(s,3h,hetarch3),2.40(s,3h,arch3)。4-(2-氯-4-甲基苯基)-3-乙基-5-甲氧基-2-甲基苯并[d]噻唑-3-鎓三氟甲磺酸鹽(化合物11b)的合成[化學式83]在氬氣氣氛下,將化合物11a(606mg,1.99mmol)的三氟甲磺酸乙酯(etotf)(約1ml,商用品)的懸濁液在50℃(油浴溫度)加熱物攪拌13.5小時。放置冷卻至室溫后,用日本桐山漏斗過濾析出的結晶,用正己烷(n-hexane)(3ml×4)洗滌,從而得到了4-(2-氯-4-甲基苯基)-3-乙基-5-甲氧基-2-甲基苯并[d]噻唑-3-鎓三氟甲磺酸鹽(4-(2-chloro-4-methylphenyl)-3-ethyl-5-methoxy-2-methylbenzo[d]thiazol-3-iumtriflate)(化合物11b)(899mg,1.87mmol,93.7%)的淡黃色的固體。1hnmr(400mhz,cdcl3)δ8.09(d,j=9.2hz,1h,aromatic),7.44-7.41(m,3h,aromatic),7.28(d,j=9.2hz,1h,aromatic),4.28(q,2h,j=7.2hz,ch2ch3),3.85(s,3h,och3),3.18(s,3h,hetarch3),2.46(s,3h,arch3),1.13(t,j=7.2hz,3h,ch2ch3)。(z)-1-(4-(2-氯-4-甲基苯基)-3-乙基-5-甲氧基苯并[d]噻唑-2(3h)-亞基)丙-2-酮(化合物11c)的合成[化學式84]在氬氣氣氛下,對于化合物11b(145mg,0.301mmol)的二氯甲烷(dichloromethane)(脫水、3.0ml,商用品)溶液,在-78℃下加入三乙胺(triethylamine)(170μl,1.22mmol,商用品)和乙酰氯(acetylchloride)(64μl,0.90μmol,商用品),升溫至室溫后攪拌混合物1.5小時。反應結束后加入水(約5ml),二氯甲烷(3ml×4)提取。用硫酸鈉干燥合并的有機層,過濾,減壓濃縮濾液后,通過中壓柱層析(smartflashepclcw-prep2xysystem)(正己烷/乙酸乙酯=1/1)精制,從而得到了(z)-1-(4-(2-氯-4-甲基苯基)-3-乙基-5-甲氧基苯并[d]噻唑-2(3h)-亞基)丙-2-酮((z)-1-(4-(2-chloro-4-methylphenyl)-3-ethyl-5-methoxybenzo[d]thiazole-2(3h)-ylidene)propan-2-one)(化合物11c)(54.3mg,0.145mmol,48.2%)的黃色的固體。tlcrf=0.30(正己烷/乙酸乙酯=1/1)1hnmr(400mhz,cdcl3)δ7.52(d,j=8.4hz,1h,aromatic),7.34(s,1h,aromatic),7.21-7.14(m,2h,aromatic),6.83(d,j=8.4hz,1h,aromatic),5.78(s,1h,olefinic),3.72(s,3h,och3),3.65-3.48(m,2h,ch2ch3),2.43(s,3h,c(o)ch3),2.21(s,3h,arch3),0.95(t,j=7.2hz,3h,ch2ch3)。(z)-1-[4-(2-氯-4-甲基苯基)-3-乙基-5-羥基苯并[d]噻唑-2(3h)-亞基]丙-2-酮(化合物11d)的合成[化學式85]在氬氣氣氛下,對于化合物11c(37.4mg,0.100mmol)的二氯甲烷(dichloromethane)(脫水,1.0ml,商用品)溶液,在0℃下,加入了三溴化硼(borontribromide)(1.0m二氯甲烷溶液,0.30ml,0.30mmol,商用品)。升溫至室溫后,攪拌混合物1.5小時。反應結束后在0℃下加入水(約5ml),用二氯甲烷(3ml×4)和少量的甲醇(methanol)(約0.5ml)提取。用硫酸鈉干燥合并的有機層,過濾,通過減壓濃縮濾液,從而得到了(z)-1-[4-(2-氯-4-甲基苯基)-3-乙基-5-羥基苯并[d]噻唑-2(3h)-亞基]丙-2-酮((z)-1-[4-(2-chloro-4-methylphenyl)-3-ethyl-5-hydroxybenzo[d]thiazol-2(3h)-ylidene]propan-2-one)(化合物11d)的黃色的固體后,保持未精制的狀態,用于下一個反應。1hnmr(400mhz,dmso-d6)δ9.55(s,1h,aroh),7.52(d,j=8.4hz,1h,aromatic),7.42(s,1h,aromatic),7.32(d,j=8.4hz,1h,aromatic),7.23(d,j=8.4hz,1h,aromatic),6.79(d,j=8.4hz,1h,aromatic),5.92(s,1h,olefinic),3.67-3.57(m,1h,chaa'-gemch3),3.53-3.41(m,1h,chaa'-gemch3),2.38(s,3h,arch3),2.06(s,3h,c(o)ch3),0.83(t,j=7.2hz,3h,ch2ch3)。(z)-1-(1-乙基-8-甲基苯并[2,3]苯并呋喃并[4,5-d]噻唑-2(1h)-亞基)丙-2-酮(化合物11)的合成[化學式86]在氬氣氣氛下,將化合物11d(<0.100mmol)和噻吩-2-羧酸銅(i)(copper(i)thiophene-2-carboxylate)(22.9mg,0.120mmol、商用品)的n,n-二甲基乙酰胺(n,n-dimethylacetamide)(1.0ml,脫水,商用品)溶液,在微波照射下,在250℃加熱攪拌了30分鐘。放置冷卻至室溫后,加入鹽酸(1m,0.2ml),用二氯甲烷(dichloromethane)(3ml×4)提取。用硫酸鈉干燥合并的有機層,過濾,減壓濃縮濾液后,通過硅膠柱層析(正己烷/乙酸乙酯=1/1)精制,從而得到了(z)-1-(1-乙基-8-甲基苯并[2,3]苯并呋喃并[4,5-d]噻唑-2(1h)-亞基)丙-2-酮((z)-1-(1-ethyl-8-methylbenzo[2,3]benzofuro[4,5-d]thiazol-2(1h)-ylidene)propan-2-one)(化合物11)(13.2mg,40.8μmol,40.8%in2steps)的淺棕色固體。tlcrf=0.25(正己烷/乙酸乙酯=1/1)mp204-205℃ir(kbr,cm-1)3062,2970,2360,1606,1470,1187,1014,805,723。1hnmr(500mhz,cdcl3)δ7.90(d,j=8.5hz,1h,aromatic),7.60(d,j=8.0hz,1h,aromatic),7.45(s,1h,aromatic),7.41(d,j=8.0hz,1h,aromatic),7.21,(d,j=8.5hz,1h,aromatic),6.04(s,1h,olefinic),4.66(q,j=7.0hz,2h,ch2ch3),2.55(s,3h,arch3),2.30(s,3h,c(o)ch3),1.72(t,j=7.0hz,3h,ch2ch3)。13cnmr(126mhz,cdcl3)δ191.1,160.7,156.6,156.5,137.9,134.9,124.6,122.1,121.2,120.5,118.6,112.5,109.3,107.0,90.1,43.6,29.1,21.6,14.3。制造例12:化合物12的制造[化學式87]以以下方式制備了化合物12。[化學式88]4-(2-氯-5-甲基苯基)-5-甲氧基-2-甲基苯并[d]噻唑(化合物12a)的合成[化學式89]在氬氣氣氛下,將化合物3a(521mg,2.02mmol)、(2-氯-5-甲基苯基)硼酸((2-chloro-5-methylphenyl)boronicacid)(409mg,2.40mmol,商用品)、四三苯基膦鈀(tetrakis(triphenylphosphine)palladium)(116mg,0.100mmol,商用品)、碳酸鈉一水合物(sodiumcarbonatemonohydrate)(424mg,3.42mmol,商用品)的甲苯(toluene)(脫水,7ml,商用品)、乙醇(etoh)(脫水,7ml,商用品)、純凈水(7ml)的混合溶液在90℃下加熱回流了7小時。放置冷卻至室溫后,減壓濃縮混合物,通過中壓柱層析(smartflashepclcw-prep2xysystem)(正己烷/乙酸乙酯=5/1)進行精制,從而得到了4-(2-氯-5-甲基苯基)-5-甲氧基-2-甲基苯并[d]噻唑(4-(2-chloro-5-methylphenyl)-5-methoxy-2-methylbenzo[d]thiazole)(化合物12a)(399mg,1.31mmol,65.0%)的無色的固體。tlcrf=0.40(正己烷/乙酸乙酯=5/1)1hnmr(400mhz,cdcl3)δ7.77(d,j=8.8hz,1h,aromatic),7.39(d,j=8.0hz,1h,aromatic),7.18-7.12(m,2h,aromatic),7.10(d,j=8.8hz,1h,aromatic),3.83(s,3h,och3),2.74(s,3h,hetarch3),2.37(s,3h,arch3)。(4-(2-氯-5-甲基苯基)-3-乙基-5-甲氧基-2-甲基苯并[d]噻唑-3-鎓三氟甲磺酸鹽(化合物12b)的合成[化學式90]在氬氣氣氛下,將化合物12a(399mg,1.31mmol)溶解于三氟甲磺酸乙酯(etotf)(1ml,商用品),將混合溶液在50℃(油浴溫度)加熱攪拌了14小時。放置冷卻至室溫后,用日本桐山漏斗過濾析出的結晶,用正己烷(n-hexane)(約3ml×4)洗滌,得到了(4-(2-氯-5-甲基苯基)-3-乙基-5-甲氧基-2-甲基苯并[d]噻唑-3-鎓三氟甲磺酸鹽(4-(2-chloro-5-methylphenyl)-3-ethyl-5-methoxy-2-methylbenzo[d]thiazol-3-iumtriflate)(化合物12b)(584mg,1.21mmol,92.5%)的無色的固體。1hnmr(400mhz,cdcl3)δ8.08(d,j=9.2hz,1h,aromatic),7.45-7.41(m,2h,aromatic),7.34-7.26(m,2h,aromatic),4.31-4.21(m,2h,nch2ch3),3.86(s,3h,och3),3.18(s,3h,hetarch3),2.41(s,3h,arch3),1.13(t,j=7.2hz,3h,nch2ch3)。((z)-1-(4-(2-氯-5-甲基苯基)-3-乙基-5-甲氧基苯并[d]噻唑-2(3h)-亞基)丙-2-酮(化合物12c)的合成[化學式91]在氬氣氣氛下,對于化合物12b(584mg,1.21mmol)的二氯甲烷(dichloromethane)(脫水,12ml,商用品)溶液,在-78℃加入三乙胺(triethylamine)(670μl,4.81mmol,商用品)和乙酰氯(acetylchloride)(260μl,3.66μmol,商用品)。升溫至室溫后,攪拌混合物30分鐘。反應結束后,加入水(約15ml),用二氯甲烷(約10ml×4)提取。用硫酸鈉干燥合并的有機層,過濾,減壓濃縮濾液后,通過中壓柱層析(smartflashepclcw-prep2xysystem)(正己烷/乙酸乙酯=1/1)精制,得到了((z)-1-(4-(2-氯-5-甲基苯基)-3-乙基-5-甲氧基苯并[d]噻唑-2(3h)-亞基)丙-2-酮((z)-1-(4-(2-chloro-5-methylphenyl)-3-ethyl-5-methoxybenzo[d]thiazole-2(3h)-ylidene)propan-2-one)(化合物12c)(335mg,0.896mmol,74.0%)的黃色的固體。1hnmr(400mhz,cdcl3)δ7.53(d,j=8.4hz,1h,aromatic),7.38(d,j=8.0hz,1h,aromatic),7.19(dd,j=8.0,2.0hz,1h,aromatic),7.12(d,j=0.8hz,1h,aromatic),6.83(d,j=8.4hz,1h,aromatic),5.78(s,1h,olefinic),3.73(s,3h,och3),3.60-3.47(m,2h,nch2ch3),2.37(s,3h,arch3),2.22(s,3h,c(o)ch3),0.95(t,j=7.2hz,3h,nch2ch3)。((z)-1-(4-(2-氯-5-甲基苯基)-3-乙基-5-羥基苯并[d]噻唑-2(3h)-亞基)丙-2-酮(化合物12d)的合成[化學式92]在氬氣氣氛下,對于化合物12c(277mg,0.741mmol)的二氯甲烷(dichloromethane)(脫水,7.5ml,商用品)溶液在0℃下,加入三溴化硼(borontribromide)(2.2ml,2.2mmol、商用品),升溫至室溫后,將混合物攪拌了4.5小時。反應結束后,在0℃下加入水(約10ml),二氯甲烷(約5ml×4)和少量的甲醇(methanol)(約0.5ml)提取。用硫酸鈉干燥合并的有機層,過濾,減壓濃縮濾液后,通過硅膠柱層析(正己烷/乙酸乙酯=1/1)精制,得到了((z)-1-(4-(2-氯-5-甲基苯基)-3-乙基-5-羥基苯并[d]噻唑-2(3h)-亞基)丙-2-酮((z)-1-(4-(2-chloro-5-methylphenyl)-3-ethyl-5-hydroxybenzo[d]thiazole-2(3h)-ylidene)propan-2-one)(化合物12d)(220mg,0.611mmol,82.5%)的黃褐色的固體。tlcrf=0.30(二氯甲烷/甲醇=20/1)1hnmr(400mhz,dmso-d6)δ9.57(s,1h,aroh),7.52(d,j=8.4hz,1h,aromatic),7.45(d,j=8.8hz,1h,aromatic),7.28-7.26(m,2h,aromatic),6.80(d,j=8.4hz,1h,aromatic),5.92(s,1h,olefinic),3.63-3.56(m,1h,nchgem-aa'ch3),3.47-3.39(m,1h,nchgem-aa'ch3),2.32(s,3h,arch3),2.06(s,3h,c(o)ch3),0.83(t,j=6.8hz,3h,nch2ch3)。((z)-1-(1-乙基-9-甲基苯并[2,3]苯并呋喃并[4,5-d]噻唑-2(1h)-亞基)丙-2-酮(化合物12)的合成[化學式93]在氬氣氣氛下,將化合物12d(144mg,0.400mmol)和噻吩-2-羧酸銅(i)(copper(i)thiophene-2-carboxylate)(91.5mg,0.480mmol,商用品)的n,n-二甲基乙酰胺(n,n-dimethylacetamide)(20ml,脫水,商用品)溶液,在微波照射下,在250℃加熱攪拌了30分鐘。放置冷卻至室溫后加入稀鹽酸(0.1m,0.4ml),用二氯甲烷(dichloromethane)(約10ml×4)提取。用硫酸鈉干燥合并的有機層,過濾,減壓濃縮濾液后,通過硅膠柱層析(正己烷/乙酸乙酯=1/1)進行精制,從而得到了((z)-1-(1-乙基-9-甲基苯并[2,3]苯并呋喃并[4,5-d]噻唑-2(1h)-亞基)丙-2-酮((z)-1-(1-ethyl-9-methylbenzo[2,3]benzofuro[4,5-d]thiazol-2(1h)-ylidene)propan-2-one)(化合物12)(96.4mg,0.298mmol,74.5%)的茶色的固體。tlcrf=0.30(正己烷/乙酸乙酯=1/1)mp191-192℃ir(kbr,cm-1)3357,2973,2921,2360,1610,1360,1193,1013,803。1hnmr(500mhz,cdcl3)δ7.84(s,1h,aromatic),7.63(d,j=8.5hz,1h,aromatic),7.54(d,j=8.5hz,1h,aromatic),7.43(d,j=8.5hz,1h,aromatic),7.34,(d,j=8.5hz,1h,aromatic),6.05(s,1h,olefinic),4.68(q,2h,j=7.0hz,ch2ch3),2.56(s,3h,arch3),2.31(s,3h,c(o)ch3),1.75(t,j=7.0hz,3h,ch2ch3)。13cnmr(126mhz,cdcl3)δ191.1,160.8,156.9,154.4,135.2,132.5,128.2,122.7,121.2,121.1,120.9,111.8,109.3,107.0,90.2,43.7,29.1,22.0,14.4。制造例13:化合物13的制造[化學式94]以以下方式制備了化合物13。[化學式95](4-(2,4-二氯苯基)-5-甲氧基-2-甲基苯并[d]噻唑(化合物13a)的合成[化學式96]在氬氣氣氛下,將化合物3a(3.26g,12.6mmol)、(2,4-二氯苯基)硼酸((2,4-dichlorophenyl)boronicacid)(3.40g,17.8mmol,商用品)、醋酸鈀(pd(oac)2)(135mg,0.601mmol,商用品)、(2-聯苯基)二環己基膦((2-biphenyl)dicyclohexylphosphine)(421mg,1.20mmol,商用品)、磷酸三鉀·n水合物(tri-potassiumphosphaten-hydrate)(5.10g,19.1mmol,商用品)的二惡烷(dioxane)(脫水,120ml,商用品)、純凈水(12ml)的混合溶液在90℃加熱攪拌了16小時。放置冷卻至室溫后加入水(50ml)和飽和鹽水(50ml),用乙酸乙酯(100ml×4)提取。用硫酸鈉干燥合并的有機層,減壓濃縮混合物,通過中壓柱層析(smartflashepclcw-prep2xysystem)(正己烷/乙酸乙酯=5/1)精制,從而得到了4-(2,4-二氯苯基)-5-甲氧基-2-甲基苯并[d]噻唑(4-(2,4-dichlorophenyl)-5-methoxy-2-methylbenzo[d]thiazole)(化合物13a)(4.08g,12.6mmol,quantitative)的橙褐色的固體。tlcrf=0.45(正己烷/乙酸乙酯=5/1)1hnmr(400mhz,cdcl3)δ7.71(d,j=8.8hz,1h,aromatic),7.50(s,1h,aromatic),7.29(s,2h,aromatic),7.02(d,j=8.8hz,1h,aromatic),3.75(s,3h,och3),2.66(s,3h,hetarch3)。4-(2,4-二氯苯基)-3-乙基-5-甲氧基-2-甲基苯并[d]噻唑-3-鎓三氟甲磺酸鹽(化合物13b)的合成[化學式97]在氬氣氣氛下,將化合物13a(3.89mg,12.0mmol)的三氟甲磺酸乙酯(etotf)(5.5ml,商用品)的懸濁液在50℃(油浴溫度)加熱攪拌了19.5小時。放置冷卻至室溫后,用日本桐山漏斗過濾析出的結晶,用正己烷(n-hexane)(3ml×4)洗滌,得到了(4-(2,4-二氯苯基)-3-乙基-5-甲氧基-2-甲基苯并[d]噻唑-3-鎓三氟甲磺酸鹽(4-(2,4-dichlorophenyl)-3-ethyl-5-methoxy-2-methylbenzo[d]thiazol-3-iumtriflate)(化合物13b)(5.50g,10.9mmol,91.2%)的灰色的固體。1hnmr(400mhz,cdcl3)δ8.12(d,j=9.2hz,1h,aromatic),7.58(d,j=2.4hz,1h,aromatic),7.54(d,j=8.4hz,1h,aromatic),7.48-7.41(m,2h,aromatic),7.28(d,j=9.2hz,1h,aromatic),4.27(q,j=7.2hz,2h,ch2ch3),3.85(s,3h,och3),3.16(s,3h,hetarch3),1.14(t,j=7.2hz,3h,ch2ch3)。(z)-1-(4-(2,4-二氯苯基)-3-乙基-5-甲氧基苯并[d]噻唑-2(3h)-亞基)丙-2-酮(化合物13c)的合成[化學式98]在氬氣氣氛下,對于化合物13b(5.50g,10.9mmol)的二氯甲烷(dichloromethane)(脫水,110ml,商用品)溶液,在-78℃加入了三乙胺(triethylamine)(6.10ml,43.8mmol,商用品)和乙酰氯(acetylchloride)(2.30ml,32.3μmol,商用品)。升溫至室溫后,攪拌混合物1.5小時。反應結束后加入水(約50ml),用二氯甲烷(50ml×4)提取。用硫酸鈉干燥合并的有機層,過濾,減壓濃縮濾液后,通過中壓柱層析(smartflashepclcw-prep2xysystem)(正己烷/乙酸乙酯=1/1)精制,得到了(z)-1-(4-(2,4-二氯苯基)-3-乙基-5-甲氧基苯并[d]噻唑-2(3h)-亞基)丙-2-酮)((z)-1-(4-(2,4-dichlorophenyl)-3-ethyl-5-methoxybenzo[d]thiazole-2(3h)-ylidene)propan-2-one)(化合物13c)(2.54g,6.44mmol,59.1%)的黃色的固體。tlcrf=0.30(正己烷/乙酸乙酯=1/1)1hnmr(400mhz,cdcl3)δ7.55(d,j=6.4hz,1h,aromatic),7.54(s,1h,aromatic),7.37(d,j=6.4hz,1h,aromatic),7.27(d,j=6.4hz,1h,aromatic),6.83(d,j=6.4hz,1h,aromatic),5.80(s,1h,olefinic),3.72(s,3h,och3),3.64-3.48(m,2h,ch2ch3),2.23(s,3h,c(o)ch3),0.97(t,j=5.6hz,3h,ch2ch3)。(z)-1-(4-(2,4-二氯苯基)-3-乙基-5-羥基苯并[d]噻唑-2(3h)-亞基)丙-2-酮(化合物13d)的合成[化學式99]在氬氣氣氛下,對于化合物13c(2.54g,6.44mmol)的二氯甲烷(dichloromethane)(脫水、65ml、商用品)溶液,在0℃加入了三溴化硼(borontribromide)(1.0m二氯甲烷溶液,18.5ml,18.5mmol,商用品)。升溫至室溫后,將混合物攪拌了3小時。反應結束后,在0℃下加入水(約50ml),用二氯甲烷(30ml×4)和少量的甲醇(methanol)(約2ml)提取。用硫酸鈉干燥合并的有機層,過濾,減壓濃縮濾液。用日本桐山漏斗過濾得到的固體,用冷甲醇(3ml×4)洗滌,得到了(z)-1-(4-(2,4-二氯苯基)-3-乙基-5-羥基苯并[d]噻唑-2(3h)-亞基)丙-2-酮((z)-1-(4-(2,4-dichlorophenyl)-3-ethyl-5-hydroxybenzo[d]thiazol-2(3h)-ylidene)propan-2-one)(化合物13d)(1.73g,4.55mmol,70.6%)的黃色的固體。tlcrf=0.20(二氯甲烷/甲醇=20/1)1hnmr(400mhz,dmso-d6)δ9.72(s,1h,aroh),7.78(d,j=1.2hz,1h,aromatic),7.57(d,j=8.4hz,1h,aromatic),7.52(brs,2h,aromatic),6.82(d,j=8.4hz,1h,aromatic),5.96(s,1h,olefinic),3.70-3.60(m,1h,chaa'-gemch3),3.50-3.41(m,1h,chaa'-gemch3),2.07(s,3h,c(o)ch3),0.85(t,j=6.8hz,3h,ch2ch3)。(z)-1-(8-氯-1-乙基苯并[2,3]苯并呋喃并[4,5-d]噻唑-2(1h)-亞基)丙-2-酮(化合物13)的合成[化學式100]在氬氣氣氛下,將化合物13d(152mg,0.400mmol)和噻吩-2-羧酸銅(i)(copper(i)thiophene-2-carboxylate)(91.5mg,0.480mmol,商用品)的n,n-二甲基乙酰胺(n,n-dimethylacetamide)(20ml,脫水,商用品)溶液在微波照射下,在250℃加熱攪拌了30分鐘。放置冷卻至室溫后,加入鹽酸(1m,0.8ml),用二氯甲烷(dichloromethane)(10ml×4)提取。用硫酸鈉干燥合并的有機層,過濾,減壓濃縮濾液后,通過中壓柱層析(smartflashepclcw-prep2xysystem)(正己烷/乙酸乙酯=1/1)精制,從而得到了(z)-1-(8-氯-1-乙基苯并[2,3]苯并呋喃并[4,5-d]噻唑-2(1h)-亞基)丙-2-酮((z)-1-(8-chloro-1-ethylbenzo-[2,3]benzofuro[4,5-d]thiazol-2(1h)-ylidene)propan-2-one)(化合物13)(82.6mg,0.240mmol,60.1%)的黃色的固體。tlcrf=0.35(正己烷/乙酸乙酯=1/1)mp224-225℃ir(kbr,cm-1)3066,2970,2928,1607,1589,1270,1125,600,500。1hnmr(500mhz,cdcl3)δ7.92(d,j=9.0hz,1h,aromatic),7.64(s,1h,aromatic),7.63(dd,j=9.0,1.5hz,1h,aromatic),7.41(d,j=8.5hz,1h,aromatic),7.37(dd,j=8.5,1.5hz,1h,aromatic),6.04(s,1h,olefinic),4.61(q,j=7.5hz,2h,ch2ch3),2.30(s,3h,c(o)ch3),1.71(t,j=7.5hz,3h,ch2ch3)。13cnmr(126mhz,cdcl3)δ191.3,160.6,157.0,156.3,135.0,132.8,123.8,123.1,121.8,121.4,120.1,112.8,108.6,106.9,90.4,43.6,29.1,14.3。制造例14:化合物14的制造[化學式101]以以下方式制備了化合物14。[化學式102]4-(2,5-二氯苯基)-5-甲氧基-2-甲基苯并[d]噻唑(化合物14a)的合成[化學式103]在氬氣氣氛下,將化合物3a(3.10g,12.0mmol)、(2,5-二氯苯基)硼酸((2,5-dichlorophenyl)boronicacid)(3.26g,17.1mmol,商用品)、醋酸鈀(pd(oac)2)(135mg,0.601mmol,商用品)、(2-聯苯基)二環己基膦((2-biphenyl)dicyclohexylphosphine)(421mg,1.20mmol,商用品)、磷酸三鉀·水合物(tri-potassiumphosphaten-hydrate)(6.40g,24.0mmol,商用品)的二惡烷(dioxane)(脫水,120ml,商用品)、純凈水(12ml)的混合溶液在90℃加熱攪拌8.5小時。放置冷卻至室溫后,加入水(50ml)和飽和鹽水(50ml),用乙酸乙酯(100ml×4)提取。將合并的有機層用硫酸鈉干燥、減壓濃縮混合物,通過中壓柱層析(smartflashepclcw-prep2xysystem)(正己烷/乙酸乙酯=5/1)精制,從而得到了4-(2,5-二氯苯基)-5-甲氧基-2-甲基苯并[d]噻唑(4-(2,5-dichlorophenyl)-5-methoxy-2-methylbenzo[d]thiazole)(化合物14a)(3.61g,11.1mmol,92.8%)茶色的固體。tlcrf=0.45(正己烷/乙酸乙酯=5/1)1hnmr(400mhz,cdcl3)δ7.80(d,j=8.8hz,1h,aromatic),7.44(d,j=8.4hz,1h,aromatic),7.37(d,j=2.4hz,1h,aromatic),7.30(dd,j=8.4,2.4hz,1h,aromatic),7.10,(d,j=8.8hz,1h,aromatic),3.84(s,3h,och3),2.75(s,3h,hetarch3)。4-(2,5-二氯苯基)-3-乙基-5-甲氧基-2-甲基苯并[d]噻唑-3-鎓三氟甲磺酸鹽(化合物14b)的合成[化學式104]在氬氣氣氛下,將化合物14a(3.61mg,11.1mmol)的三氟甲磺酸乙酯(etotf)(10ml,商用品)的懸濁液在50℃(油浴溫度)加熱攪拌了11.5小時。放置冷卻至室溫后,用日本桐山漏斗過濾析出的結晶,用正己烷(n-hexane)(3ml×4)洗滌,從而得到了4-(2,5-二氯苯基)-3-乙基-5-甲氧基-2-甲基苯并[d]噻唑-3-鎓三氟甲磺酸鹽(4-(2,5-dichlorophenyl)-3-ethyl-5-methoxy-2-methylbenzo[d]thiazol-3-iumtriflate)(化合物14b)(4.98g,9.91mmol,89.3%)的淺棕色固體。1hnmr(400mhz,cdcl3)δ8.18(d,j=7.2hz,1h,aromatic),7.53-7.43(m,4h,aromatic),4.32-4.17(m,2h,ch2ch3),3.86(s,3h,och3),3.18(s,3h,hetarch3),1.16(t,j=7.2hz,3h,ch2ch3)。(z)-1-(4-(2,5-二氯苯基)-3-乙基-5-甲氧基苯并[d]噻唑-2(3h)-亞基)丙-2-酮(化合物14c)的合成[化學式105]在氬氣氣氛下,對于化合物14b(1.26g,2.51mmol)的二氯甲烷(dichloromethane)(脫水,25ml,商用品)溶液,在-78℃加入了三乙胺(triethylamine)(1.40ml,10.0mmol,商用品)和乙酰氯(acetylchloride)(530μl,7.45μmol,商用品)。升溫至室溫后,攪拌混合物30分鐘。反應結束后加入水(約5ml),用二氯甲烷(20ml×4)提取。用硫酸鈉干燥合并的有機層,過濾,減壓濃縮濾液后,通過中壓柱層析(smartflashepclcw-prep2xysystem)(正己烷/乙酸乙酯=1/1)精制,從而得到了(z)-1-(4-(2,5-二氯苯基)-3-乙基-5-甲氧基苯并[d]噻唑-2(3h)-亞基)丙-2-酮((z)-1-(4-(2,5-dichlorophenyl)-3-ethyl-5-methoxybenzo[d]thiazole-2(3h)-ylidene)propan-2-one)(化合物14c)(545mg,1.38mmol,55.1%)的黃色的固體。tlcrf=0.30(正己烷/乙酸乙酯=1/1)1hnmr(400mhz,cdcl3)δ7.54(d,j=7.6hz,1h,aromatic),7.45(d,j=8.8hz,1h,aromatic),7.39-7.33(m,2h,aromatic),6.82(d,j=8.8hz,1h,aromatic),5.80(s,1h,olefinic),3.73(s,3h,och3),3.64-3.45(m,2h,ch2ch3),2.22(s,3h,c(o)ch3),0.99(t,j=7.2hz,3h,ch2ch3)。(z)-1-(4-(2,5-二氯苯基)-3-乙基-5-羥基-苯并[d]噻唑-2(3h)-亞基)丙-2-酮(化合物14d)的合成[化學式106]在氬氣氣氛下,對于化合物14c(805mg,2.04mmol)的二氯甲烷(dichloromethane)(脫水、20ml、商用品)溶液,在0℃下,加入了三溴化硼(borontribromide)(1.0m二氯甲烷溶液,6.0ml,6.0mmol,商用品)。升溫至室溫后,將混合物攪拌了2.5小時。反應結束后,在0℃下加入水(約5ml),用二氯甲烷(3ml×4)和少量的甲醇(methanol)(約0.5ml)提取。用硫酸鈉干燥合并的有機層,過濾,減壓濃縮濾液后,通過中壓柱層析(smartflashepclcw-prep2xysystem)(二氯甲烷/甲醇=20/1)進行精制,從而得到了(z)-1-(4-(2,5-二氯苯基)-3-乙基-5-羥基-苯并[d]噻唑-2(3h)-亞基)丙-2-酮((z)-1-(4-(2,5-dichlorophenyl)-3-ethyl-5-hydroxybenzo[d]thiazol-2(3h)-ylidene)propan-2-one)(化合物14d)(740mg,1.95mmol,95.4%)的淡黃色的固體。tlcrf=0.20(二氯甲烷/甲醇=20/1)1hnmr(400mhz,dmso-d6)δ9.72(s,1h,aroh),7.64-7.62(m,2h,aromatic),7.57-7.53(m,2h,aromatic),6.81(d,j=8.8hz,1h,aromatic),5.95(s,1h,olefinic),3.68-3.58(m,1h,chaa'-gemch3),3.47-3.30(m,1h,chaa'-gemch3),2.07(s,3h,c(o)ch3),0.87(t,j=6.8hz,3h,ch2ch3)。(z)-1-(9-氯-1-乙基苯并[2,3]苯并呋喃并[4,5-d]噻唑-2(1h)-亞基)丙-2-酮(化合物14)的合成[化學式107]在氬氣氣氛下,將化合物14d(152mg,0.400mmol)和噻吩-2-羧酸銅(i)(copper(i)thiophene-2-carboxylate)(91.5mg,0.480mmol,商用品)的n,n-二甲基乙酰胺(n,n-dimethylacetamide)(20ml,脫水,商用品)溶液在微波照射下,在250℃加熱攪拌了30分鐘。放置冷卻至室溫后加入鹽酸(1m,0.8ml),用二氯甲烷(dichloromethane)(10ml×4)提取。用硫酸鈉干燥有機層,過濾,減壓濃縮濾液后,通過中壓柱層析(smartflashepclcw-prep2xysystem)(正己烷/乙酸乙酯=1/1)精制,從而得到了(z)-1-(9-氯-1-乙基苯并[2,3]苯并呋喃并[4,5-d]噻唑-2(1h)-亞基)丙-2-酮((z)-1-(9-chloro-1-ethylbenzo[2,3]benzofuro[4,5-d]thiazol-2(1h)-ylidene)propan-2-one)(化合物14)(103mg,0.300mmol,74.9%)的橙褐色的固體。tlcrf=0.40(正己烷/乙酸乙酯=1/1)mp231-232℃ir(kbrcm-1)3099,2962,2360,1485,1201,1013,809,773。1hnmr(500mhz,cdcl3)δ7.99(d,j=2.0hz,1h,aromatic),7.65(d,j=8.5hz,1h,aromatic),7.56(d,j=8.5hz,1h,aromatic),7.47(dd,j=8.5,2.0hz,1h,aromatic),7.41,(d,j=8.5hz,1h,aromatic),6.05(s,1h,olefinic),4.59(q,2h,j=7.2hz,ch2ch3),2.30(s,3h,c(o)ch3),1.74(t,j=7.5hz,3h,ch2ch3)。13cnmr(126mhz,cdcl3)δ191.3,160.6,157.3,154.4,135.2,128.7,127.2,122.7,122.5,121.9,121.7,113.2,108.4,107.0,90.4,43.7,29.1,14.4。制造例15:化合物15的制造[化學式108]以以下方式制備了化合物15。在氬氣氣氛下,向二苯并呋喃-2-甲醛(196mg,0.999mmol,按照eur.j.med.chem.2011,46,4827-4833.合成)、醋酸銨(nh4oac)(38.5mg,0.499mmol,商用品)、乙內酰硫脲(thiohydantoin)(133mg,1.15mmol,商用品)的乙腈(mecn)(脫水,2ml,商用品)溶液中,在室溫下添加醋酸(acoh)(57μl,1.0mmol,商用品),加熱回流混合物2小時。放置冷卻至室溫后,用日本桐山漏斗過濾析出的結晶,用水(3ml×4)、乙醚(3mlx2)洗滌,從而得到了(z)-5-[(二苯并[b,d]呋喃-2-基)亞甲基]-2-硫酮咪唑烷-4-酮((z)-5-(dibenzo[b,d]furan-2-ylmethylene)-2-thioxoimidazolidin-4-one)(化合物15)(261mg,0.887mmol,88.8%,純度約90%)的無色的固體。mp291-292℃1hnmr(400mhz,dmso-d6)δ12.40(brs,1h,nh),12.25(brs,1h,nh),8.58(d,j=1.6hz,1h,aromatic),8.20(d,j=7.6hz,1h,aromatic),7.84(dd,j=8.8,2.0hz,1h,aromatic),7.75-7.71(m,2h,aromatic),7.59-7.54(m,1h,aromatic),7.49-7.44(m,1h,aromatic),6.67(s,1h,olefinic)。實驗例1:tau蛋白磷酸化抑制活性的評價關于在制造例合成的化合物,將對于tau蛋白的磷酸化的抑制活性使用下述培養細胞通過評價體系評價。[評價體系]作為用于評價體系的培養細胞,使用了以下培養細胞:可分別分開地誘導表達tau蛋白及dyrk1a蛋白,而且依賴dyrk1a蛋白的活性地可評價tau蛋白的磷酸價的培養細胞。圖1表示使用對于該培養細胞特異地識別tau蛋白的212位的蘇氨酸殘基的磷酸化的抗體(上層)及特異地識別tau蛋白的抗體(下層)的蛋白質印跡的結果的一個例子。如圖1所示,在該培養細胞內,可分別分開地表達tau蛋白及dyrk1a蛋白,另外,tau蛋白因dyrk1a蛋白的存在而促進其磷酸化。因此,通過誘導表達tau蛋白及dyrk1a蛋白的兩者、評價tau蛋白的212位的蘇氨酸殘基的磷酸化程度,從而能夠評價tau蛋白磷酸化的抑制活性。[評價結果]在上述評價體系中加入10μm的化合物1、4、6-9,通過特異地識別tau蛋白的212位的蘇氨酸殘基的磷酸化的抗體檢測出了tau蛋白的磷酸化。圖2中表示該結果的一個例子。圖2是在10μm的化合物存在下,在誘導表達tau蛋白及dyrk1a蛋白兩者的上述培養細胞中,顯示了使用特異地識別tau蛋白的212位的蘇氨酸殘基的磷酸化的抗體進行蛋白質印跡的結果的一個例子。需要說明的是,“空白(control)”表示不添加化合物的情況的結果。對照化合物a-c為無tau蛋白的磷酸化阻礙抑制作用的對照化合物。如圖2所示,化合物1、6、7、及8顯示出強大的tau蛋白磷酸化抑制作用。另外,化合物4及9也顯示出tau蛋白磷酸化抑制作用。實驗例2:腦內轉移性的評價用下述條件評價了化合物1的腦內轉移性。作為結果,在血漿中濃度13.5μm的情況下,得到了腦脊液中濃度1.88μm的結果。即,證實了化合物1的腦內轉移性。[腦內轉移性評價條件]使用動物:wistar大鼠♂8周齡(約300g),尾靜脈給藥給藥溶劑:20%ppg/8%吐溫80/鹽水(2ml/head)化合物給藥量:2mg/head采樣時間:血漿:給藥3分鐘后腦脊液:給藥7分鐘后分析樣品:從下腔靜脈取血后的血漿、及腦脊液實驗例3:口服吸收性的評價用下述條件評價了化合物1的口服吸收性。圖3表示該結果的一個例子。如圖3所示,證實了化合物1的口服吸收。[腦內轉移性評價條件]使用動物:b6j小鼠♂7周齡,口服給藥給藥溶劑:5%阿拉伯樹膠化合物給藥量:100mg/kg分析樣品:從下腔靜脈取血后的血漿實驗例4:tau蛋白磷酸化抑制活性的評價與實施例1相同地評價了化合物1及2的對于tau蛋白的磷酸化的抑制活性。圖4表示該結果的一個例子。圖4表示,在圖中所示濃度(0.3~10μm)的化合物的存在下,在誘導表達tau蛋白及dyrk1a蛋白的兩者的上述培養細胞中,使用特異地識別tau蛋白的212位的蘇氨酸殘基的磷酸化的抗體進行蛋白質印跡的結果的一個例子。需要說明的是,“control”表示不添加化合物情況下的結果。如圖4所示,化合物1及2顯示出強大的tau蛋白磷酸化抑制作用。需要說明的是,在體外的dyrk1a抑制能力(ic50),化合物1為49nm、化合物2為40nm。實驗例5:腦內的tau蛋白磷酸化抑制活性的評價評價了化合物1及2對于腦內的tau蛋白的磷酸化的抑制活性。使用通過對小鼠施加應激(在冰冷的水中水浴,5分鐘)誘導tau蛋白的磷酸化的體系。圖5表示該結果的一個例子。圖5為在應激負荷前預先給藥化合物(100mg/kg),在應激負荷后摘出腦組織,通過western-blot評價的結果的一個例子。如圖5所示,證實了在體內化合物1及2可抑制在應激誘導時的tau蛋白的磷酸化。實驗例6:口服吸收性及腦內轉移性的評價用下述條件評價了化合物1及2的口服吸收性及腦內轉移性。圖6及表1表示該結果的一個例子。[腦內轉移性評價條件]使用動物:icr小鼠♂7周齡,口服給藥給藥溶劑:0.5%羧甲基纖維素化合物給藥量:100mg/kg分析樣品:從下腔靜脈取血后的血漿及腦組織圖6及表1為測定化合物1及2的口服給藥后的血漿濃度及腦組織中的濃度的結果的一個例子。如圖6及表1所示,對于化合物1及2而言,斷定了口服吸收性,且證實了腦內轉移性。[表1]化合物1化合物2血中最大濃度1900ng/ml8400ng/ml腦組織中最大濃度1700ng/ml8500ng/ml血中及腦組織中最大濃度的時間15分鐘以內2小時血中及腦組織中半衰期60分鐘以內4小時以上腦組織/血漿中的比率(b/p:ml/g)約0.9約1.0化合物給藥量:100mg/kg實驗例7:tau蛋白磷酸化抑制活性的評價與實施例1相同地評價了化合物3、6、9~15對于tau蛋白的磷酸化的抑制活性。圖7~9表示該結果的一個例子。分別在圖7中表示化合物6、15及9的結果、在圖8中表示化合物3,11及12的結果、在圖9中表示化合物13、14及10的結果的一個例子。如圖7~9所示,化合物3、6、9~15的化合物顯示出tau蛋白磷酸化抑制作用。實驗例8:癌細胞增殖抑制作用的評價評價了對于由唐氏綜合癥引起的急性巨核細胞白血病(amkl)細胞的化合物1~3、6、9及15的增殖抑制作用。具體而言,在24孔培養板中播種細胞,添加規定濃度的化合物,培養5天后,通過使用阿爾瑪藍(alamarblue)通過檢出熒光強度計算出了細胞數。需要說明的是,每天更換含有化合物的培養基。圖10~12表示該結果的一個例子。圖10為對于由唐氏綜合癥引起的急性巨核細胞白血病(amkl)細胞cmk11-5的增殖抑制作用的結果的一個例子。如圖10所示,在全部的評價化合物中,可確認具有優異的癌細胞增殖抑制作用。圖11為對于由唐氏綜合癥引起的急性巨核細胞白血病(amkl)細胞j425的增殖抑制作用的結果的一個例子。如圖11所示,特別在化合物1~3、6、9中確認了優異的癌細胞增殖抑制作用。圖12為對于由唐氏綜合癥引起的急性巨核細胞白血病(amkl)細胞kpam1的增殖抑制作用的結果的一個例子。如圖12所示,特別在化合物3中確認了具有優異的癌細胞增殖抑制作用。實驗例9:癌細胞增殖抑制作用的評價與實驗例8相同地評價了化合物1~3、6、9及15對于retinoblastoma(成視網膜細胞瘤)細胞株weri的增殖抑制作用。圖13表示該結果的一個例子。如圖13所示,特別是化合物1及3確認了癌細胞的增殖抑制作用。實驗例10:癌細胞增殖抑制作用的評價化合物2、3、11及12對于源自人肺腺癌的細胞株(pc-9)的增殖抑制作用與實驗例8同樣地進行,顯微鏡觀察了該結果的培養細胞。圖14~16表示它們的結果。圖14為pc-9株、圖15為以pc-9為基礎的egfr抑制劑(吉非替尼)-抗性亞株系(egfrinhibitor(gefitinib)-resistantsub-lines)的pc-9-gr-step株、圖16為pc-9-gr-high株的結果的一個例子。如圖14~16所示,特別是化合物3、12對于癌細胞顯示出了優異的細胞凋亡誘導活性。實驗例11:癌細胞增殖抑制作用的評價除了與實驗例8相同地評價化合物3、6、9及15對于人乳腺癌細胞(triple-negative)的2種細胞株(mda-mb-453及mda-mb-468)的增殖抑制作用以外,還確認了在不使對象細胞緊貼的培養的情況下的效果。圖17中表示mda-mb-453的結果,圖18中表示mda-mb-468。如圖17及18所示,特別是化合物3及化合物15顯示出了不依賴于基地的增殖抑制作用。實驗例12:記憶·學習障礙糾正作用的評價評價了化合物2的記憶·學習障礙糾正作用。在本評價中,向小鼠的腦室內給藥淀粉狀蛋白-β肽,使用了引起記憶·學習障礙的評價體系(mauriceetal.,1996)。小鼠使用swiss小鼠6周齡♂,每組n=12進行了實驗。用蒸餾水溶解淀粉狀蛋白-β肽(25-35、序列:gly-ser-asn-lys-gly-ala-ile-ile-gly-leu-met)、或作為對照肽的合成的淀粉狀蛋白-β(scrambledamyloid-β)(25-35、序列:ala-lys-ile-gly-asn-ser-ile-gly-leu-met-gly),在37度培養溶解后的各自的肽溶液4天。用于給藥的化合物2溶解于dmso后,通過用0.5%甲基纖維素稀釋,作成了10mg/ml溶液。從實驗第一天開始到實驗第12天每天2次以100mg/kg的容量給藥化合物2溶液、或溶劑。而且,實驗第一天在給藥化合物2或溶劑的1小時后,將培養后的各自的肽溶液以每只小鼠9nmol的量,向小鼠的腦室內給藥。在實驗第8天開始到第12天之間為了評價參考記憶(referencememory),使用直徑140cm、高40cm的圓形水池、直徑10cm的平臺,每天實施了3次水迷宮試驗。實驗第13天作為探索測試,使用前述的圓形水池,在沒有平臺的狀態下記錄小鼠的行動60秒。在記錄時,記錄了小鼠停留在包括到前一天為止有平臺的場所的圓的1/4區域的總時間。圖19表示該結果的一個例子。圖19a表示從實驗第8天(訓練測試1)到第12天(訓練測試5)之間實施的參考記憶的結果。在左圖中,繪制了作為對照肽的合成的淀粉狀蛋白-β/溶劑給藥組。在中央圖中僅剩下左圖的結果的實線,繪制了淀粉狀蛋白-β/溶劑給藥組。在右圖中僅剩下中央圖的結果的實線、虛線,繪制了淀粉狀蛋白-β/化合物2給藥組。結果在中央圖的淀粉狀蛋白-β/溶劑給藥組中,與左圖的合成的淀粉狀蛋白-β/溶劑給藥組相比,即使天數增加小鼠到達平臺也需要很長時間,即,得到了記憶·學習能力下降的結果。另一方面,在右圖的淀粉狀蛋白-β/化合物2給藥組中,與中央圖的淀粉狀蛋白-β/溶劑給藥組相比,隨著天數增加小鼠到達平臺的時間縮短了,即,得到了通過投入化合物2糾正了因投入淀粉狀蛋白-β所產生的記憶·學習能力的下降的結果。圖19b表示實驗第13天的探索測試的結果。結果在淀粉狀蛋白-β/溶劑給藥組中,與作為對照的合成的淀粉狀蛋白-β/溶劑給藥組相比,因在平臺周圍停留的時間減少了,即,得到了記憶·學習能力下降的結果。另一方面,在淀粉狀蛋白-β/化合物2給藥組中,與淀粉狀蛋白-β/溶劑給藥組相比,在平臺周圍的停留時間增加,得到了與合成的淀粉狀蛋白-β/溶劑給藥組基本相同的數值的結果。即,得到了通過投入化合物2糾正了因投入淀粉狀蛋白-β所產生的記憶·學習能力下降的結果。從本實驗例的結果看出,在體內確認了化合物2具有糾正因淀粉狀蛋白-β給藥所產生的記憶·學習能力的下降的作用。當前第1頁12
相關技術
網友詢問留言
已有0條留言
- 還沒有人留言評論。精彩留言會獲得點贊!
1