一種優(yōu)化的基于細(xì)菌細(xì)胞表面展示系統(tǒng)的目標(biāo)物捕獲體系的制作方法
本發(fā)明屬于生物工程領(lǐng)域,涉及目標(biāo)物捕獲體系,尤其涉及一種優(yōu)化的基于細(xì)菌細(xì)胞表面展示系統(tǒng)的目標(biāo)物捕獲體系,目標(biāo)物如病毒受體或特異性吸附配體等。
背景技術(shù):
分析和鑒定病毒受體是探索研究病毒入侵細(xì)胞和宿主感染機(jī)制的關(guān)鍵步驟。目前,病毒受體分析主要依賴于免疫共沉淀方法和dna介導(dǎo)的轉(zhuǎn)化;再以體外培養(yǎng)并富集的大量病毒顆粒對病毒受體進(jìn)行驗證;最后,獲得病毒受體的組分和結(jié)構(gòu)。但是,很多病毒暫無成熟的體外增殖體系,這些方法不具有實際操作性。即,缺少病毒吸附介質(zhì)的分離體系是阻礙深入研究病毒與宿主互作的主要瓶頸。因此,如何大量獲得易于后期試驗操作的病毒替代物,成為解析不可體外培養(yǎng)的病毒的受體的關(guān)鍵。以下以人源諾如病毒(humannoroviruses,hunovs)為例展開描述。
在桿狀病毒體系中,外源表達(dá)的hunovsvp1蛋白可以自動折疊并形成類病毒粒子(virus-likeparticles,vlps);在原核表達(dá)體系中,只有p結(jié)構(gòu)域的外源表達(dá)產(chǎn)物可以折疊成24個單位的p顆粒(pparticles);vlps和p顆粒具有良好的免疫原性和與已知受體(如:組織血型抗原(histo-bloodgroupantigens,hbgas))結(jié)合的特性,常被用于研究hunovs與載體互作的替代物。但是,兩者的表達(dá)系統(tǒng)操作繁瑣且難以從復(fù)雜體系中分離獲得病毒衣殼蛋白與受體(吸附介質(zhì))的復(fù)合物。為了克服上述技術(shù)瓶頸,目前的研發(fā)技術(shù)通過建立細(xì)菌細(xì)胞表面展示系統(tǒng)來構(gòu)建約百倍放大的假hunovs。
細(xì)菌細(xì)胞表面展示系統(tǒng)是指通過脫氧核糖核酸重組技術(shù),將某外源蛋白的編碼基因與可錨定于受體細(xì)菌表面的編碼基因進(jìn)行融合,通過融合蛋白在宿主細(xì)胞中表達(dá)、分泌,最終將融合蛋白跨膜錨定在宿主細(xì)胞的表面,達(dá)到研究融合蛋白功能或?qū)θ诤系鞍走M(jìn)行應(yīng)用的目的。冰晶核蛋白(ice-nucleationprotein,inp)可通過糖基磷脂酰肌醇而錨定在細(xì)菌表面,利于大分子蛋白的表面展示。inp的n端結(jié)構(gòu)域(inaqn)也具有完整inp的表面展示功能。錨定于細(xì)胞表面的外源蛋白可以克服融合蛋白在胞內(nèi)無法正確折疊等弊端。研究發(fā)現(xiàn):假hunovs的承載體(大腸桿菌)會嚴(yán)重干擾病毒受體的分析。因此,需要開發(fā)優(yōu)化的假hunovs,用來構(gòu)建新的細(xì)菌表面展示系統(tǒng)。
因此,本領(lǐng)域的技術(shù)人員致力于開發(fā)一種優(yōu)化的基于細(xì)菌細(xì)胞表面展示系統(tǒng)的目標(biāo)物捕獲體系。
技術(shù)實現(xiàn)要素:
發(fā)明人前期已經(jīng)通過構(gòu)建重組表達(dá)質(zhì)粒pet28a-inaqn-p(gii.4)建立了一種基于細(xì)菌細(xì)胞表面展示系統(tǒng)的病毒受體捕獲體系,前期的發(fā)明內(nèi)容由于應(yīng)用中病毒受體(介質(zhì))分析容易受到所展示病毒衣殼蛋白承載體(大腸桿菌)的背景干擾,影響分析結(jié)果。本發(fā)明所要解決的技術(shù)問題是降低背景干擾,提高吸附效率并提供一種基于細(xì)菌細(xì)胞表面展示系統(tǒng)的目標(biāo)物捕獲體系,在原有病毒受體捕獲體系的基礎(chǔ)上,通過簡單的誘導(dǎo)使病毒衣殼蛋白高效表達(dá)并錨定于宿主細(xì)菌的細(xì)胞表面,通過加入可被蛋白酶識別且作用的接頭蛋白,降低背景干擾、提升目標(biāo)物分離效率,從而應(yīng)用于病毒受體的捕獲、富集和分析,以及目標(biāo)外源蛋白的分離純化。
為實現(xiàn)上述目的,本發(fā)明的一方面提供了一種基于優(yōu)化的細(xì)菌細(xì)胞表面展示系統(tǒng)的目標(biāo)物捕獲體系,該目標(biāo)物捕獲體系包括能錨定在宿主菌細(xì)胞表面的冰核蛋白n端結(jié)構(gòu)域,與冰核蛋白n端結(jié)構(gòu)域相連的接頭蛋白,以及與接頭蛋白相連的病毒的衣殼蛋白。
進(jìn)一步地,接頭蛋白能被蛋白酶處理而斷裂,使得病毒的衣殼蛋白脫離宿主菌的表面。
進(jìn)一步地,病毒衣殼蛋白的編碼基因片段,其dna序列如seqidno:1所示。
進(jìn)一步地,冰核蛋白n端結(jié)構(gòu)域的編碼基因片段,其dna序列如seqidno:2所示。
進(jìn)一步地,接頭蛋白的氨基酸序列如seqidno:3所示。
優(yōu)選地,宿主菌為大腸桿菌bl21。
本發(fā)明的另一方面提供了一種優(yōu)化的基于細(xì)菌細(xì)胞表面展示系統(tǒng)的目標(biāo)物捕獲體系,包括以下步驟:
(1)將病毒的衣殼蛋白編碼基因片段與編碼冰核蛋白n端結(jié)構(gòu)域的編碼基因片段之間插入接頭蛋白的編碼基因片段,獲得融合基因片段;
(2)驗證所述融合基因片段的脫氧核糖核酸序列;
(3)將融合基因片段插入誘導(dǎo)型原核表達(dá)質(zhì)粒,獲得重組誘導(dǎo)型表達(dá)質(zhì)粒;
(4)將重組誘導(dǎo)型表達(dá)質(zhì)粒轉(zhuǎn)化入宿主菌,獲得病毒的衣殼蛋白的細(xì)菌細(xì)胞表面展示系統(tǒng);
(5)在誘導(dǎo)劑的誘導(dǎo)下使病毒的衣殼蛋白展示在宿主菌細(xì)胞表面,獲得目標(biāo)物捕獲體系。
進(jìn)一步地,步驟(1)中的病毒的衣殼蛋白編碼基因片段,其序列如seqidno:1所示。
進(jìn)一步地,步驟(1)中的編碼冰核蛋白n端結(jié)構(gòu)域的編碼基因片段,其序列如seqidno:2所示。
進(jìn)一步地步驟(1)中的接頭蛋白,其氨基酸序列如seqidno:3所示。
其中,接頭蛋白的編碼基因片段用于優(yōu)化的細(xì)菌細(xì)胞表面展示系統(tǒng)的構(gòu)建。
進(jìn)一步地,步驟(4)中的宿主菌為大腸桿菌(escherichiacoli)bl21。
進(jìn)一步地,步驟(5)中誘導(dǎo)包括以下誘導(dǎo)步驟:
(a)將轉(zhuǎn)化有重組誘導(dǎo)型表達(dá)質(zhì)粒的宿主菌接種于液體培養(yǎng)基中,在30℃~39℃條件下震搖培養(yǎng)8h~16h;
(b)將步驟(a)中的細(xì)菌培養(yǎng)物以1.0%~20.0%接種量,轉(zhuǎn)接于新鮮培養(yǎng)基中,在30℃~39℃條件下震搖培養(yǎng);
(c)待步驟(b)中的細(xì)菌培養(yǎng)物od600為0.6~1.0時,無菌條件下加入誘導(dǎo)劑后,15℃~30℃繼續(xù)震搖培養(yǎng)8h~24h;
(d)收集步驟(c)中細(xì)菌培養(yǎng)物的菌體,將菌體重懸至無菌磷酸鹽緩沖液中,得到菌懸液,即獲得目標(biāo)物捕獲體系。
進(jìn)一步地,步驟(c)中的誘導(dǎo)劑為異丙基硫代-β-d-半乳糖苷(isopropylβ-d-1-thiogalactopyranoside,iptg),誘導(dǎo)終濃度為0.1mmol/l~2.0mmol/l。
進(jìn)一步地,步驟(d)中無菌磷酸鹽緩沖液的ph=7.2。
進(jìn)一步地,步驟(d)獲得的菌懸液的od600為0.6~1.0。
進(jìn)一步地,步驟(d)獲得的菌懸液的保存溫度為1℃~6℃。
另一方面,本發(fā)明還提供了上述基于優(yōu)化的細(xì)菌細(xì)胞表面展示系統(tǒng)的目標(biāo)物捕獲體系的應(yīng)用,用于捕獲和分離病毒受體,或用于目標(biāo)外源蛋白的分離純化。
當(dāng)細(xì)菌細(xì)胞表面展示的外源蛋白與細(xì)胞外環(huán)境中的特定反應(yīng)物直接接觸,并捕獲環(huán)境中的特定反應(yīng)物,再通過蛋白酶處理接頭蛋白并輔以簡單的低速離心即可獲得特定反應(yīng)物與衣殼蛋白的復(fù)合物;在分析該特定反應(yīng)物前剔除大腸桿菌,大大降低了背景干擾,為發(fā)掘hunovs新(類)受體及目標(biāo)物分離純化提供技術(shù)支撐。
本發(fā)明通過基因工程手段將病毒衣殼蛋白錨定并展示在細(xì)菌細(xì)胞的表面,免去了純化病毒衣殼蛋白的繁雜步驟,這不僅大大降低了獲取病毒衣殼蛋白的成本,大幅縮短病毒衣殼與病毒受體復(fù)合物的回收周期,并且避免了展示體系承載體對分析捕獲的病毒受體(介質(zhì))時的背景干擾,更容易分離環(huán)境中相應(yīng)的病毒受體,具有高效、節(jié)約、環(huán)保的效果。
相對于現(xiàn)有技術(shù),本發(fā)明具有以下技術(shù)優(yōu)點:
1、以細(xì)菌細(xì)胞表面展示體系將病毒衣殼蛋白錨定在大腸桿菌表面。所展示的衣殼蛋白可以與病毒(類)受體結(jié)合。通過蛋白酶消化輔以低速離心即可獲得衣殼蛋白和病毒(類)受體的復(fù)合物,并進(jìn)行病毒(類)受體的分析、鑒定;
2、無需特殊試劑和設(shè)備即可完成病毒(類)受體的分離;
3、以蛋白酶消化輔以低速離心即可剝離衣殼蛋白和病毒(類)受體的復(fù)合物與其承載體(大腸桿菌),大幅降低了承載體對病毒(類)受體分析的干擾;
4、該細(xì)菌細(xì)胞表面展示體系僅需普通培養(yǎng)和誘導(dǎo)過程,周期短。
以下將結(jié)合附圖對本發(fā)明的構(gòu)思、具體結(jié)構(gòu)及產(chǎn)生的技術(shù)效果作進(jìn)一步說明,以充分地了解本發(fā)明的目的、特征和效果。
附圖說明
圖1是本發(fā)明hunovsgii.4重組衣殼蛋白e.coli細(xì)胞表面展示重組菌sds-page檢測結(jié)果示意圖。
其中1:pet28a誘導(dǎo)菌體;2:重組菌pet28a-inaqn-p誘導(dǎo)菌體;3:重組菌pet28a-inaqn-tb-p誘導(dǎo)菌體;4:蛋白酶酶切pet28a-inaqn-tb-p菌體:5:酶切上清p結(jié)構(gòu)域蛋白;6:濃縮后的p結(jié)構(gòu)域蛋白;m:pagerulerprestainedproteinladder(sm0671)。
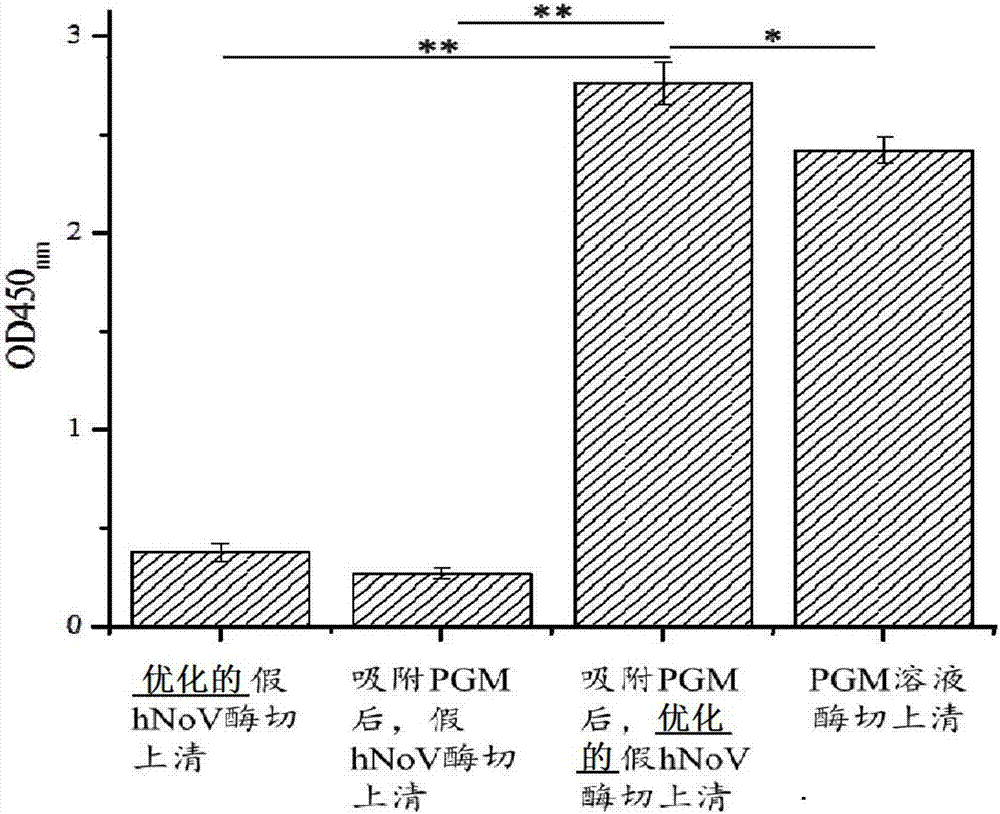
圖2是本發(fā)明的一個較佳實施方式中的優(yōu)化的細(xì)菌細(xì)胞表面展示體系吸附相應(yīng)病毒受體的能力的示意圖。
具體實施方式
以下結(jié)合附圖和具體實施方式對本發(fā)明進(jìn)行更詳細(xì)地說明。
發(fā)明人前期已經(jīng)構(gòu)建了重組表達(dá)質(zhì)粒pet28a-inaqn-p(gii.4),其構(gòu)建方法如下:
1)序列擴(kuò)增:
根據(jù)人源諾如病毒主要衣殼蛋白編碼基因(orf2),其序列如seqidno:4所示,設(shè)計擴(kuò)增orf2及orf2的3’端基因片段(即p基因片段)的引物對p1和p2、p5和p6,以人源諾如病毒腹瀉臨床樣本rna進(jìn)行rt-pcr擴(kuò)增orf2,以orf2為模板、用引物對p5和p6進(jìn)行pcr擴(kuò)增獲得p基因片段。根據(jù)如seqidno:2所示的基因序列設(shè)計擴(kuò)增inaqn基因片段的引物對p3和p4,以丁香假單胞菌基因組dna為模板進(jìn)行pcr擴(kuò)增,得到inaqn基因片段。引物信息如下:
p1(5’→3’):ggaagatctatgaagatggcgtcg
p2(5’→3’):ccggaattcttataaagcacgtctg
p3(5’→3’):ccatggatggatctcgacaaggcg
p4(5’→3’):agatctggtctgcaaattctgcgg
p5(5’→3’):agatcttcaagaactaaaccattctc
p6(5’→3’):gaattcttatagtgcacgcctacgcc
引物p1、p4和p5含有bglii酶切位點,引物p2和p6含有ecori酶切位點,引物p3含有ncoi酶切位點。
orf2的rt-pcr反應(yīng)條件為:42℃反轉(zhuǎn)錄10min;95℃變性1min;95℃預(yù)變性5min;95℃變性30s,53℃退火30s,72℃延伸2min,32個循環(huán);72℃延伸10min;4℃保溫。
inaqn的pcr反應(yīng)條件為:95℃預(yù)變性5min;95℃變性30s,55℃退火30s,72℃延伸45s,32個循環(huán);72℃延伸10min;4℃保溫。
orf2的3’端(即p基因片段)pcr反應(yīng)條件為:95℃預(yù)變性5min;95℃變性30s,52℃退火30s,72℃延伸1min,32個循環(huán);72℃延伸10min;4℃保溫。
經(jīng)序列測定證實,獲得了正確的orf2的3’端基因片段(即p基因片段)和inaqn基因片段。
2)pet28a-inaqn-p(gii.4)的構(gòu)建
將上述獲得的orf2的3’端基因片段(即p基因片段)和inaqn基因片段分別連接至pmd19-t載體,將連接產(chǎn)物以42℃熱激法轉(zhuǎn)入大腸桿菌dh5α,進(jìn)行藍(lán)白斑篩選后,挑取白斑單菌落,將所挑取出的單菌落進(jìn)行培養(yǎng)后從中提取質(zhì)粒,得到重組質(zhì)粒pmd19-p和pmd19-inaqn。
用bglii/ecori對pmd19-p進(jìn)行雙酶切處理,用bglii/ncoi對pmd19-inaqn進(jìn)行雙酶切處理,并分別經(jīng)過1.5%瓊脂糖凝膠電泳分析,回收約為960bp和525bp的dna片段,并對誘導(dǎo)型表達(dá)質(zhì)粒pet-28a進(jìn)行ecori/ncoi雙酶切。將上述回收的基因片段(inaqn+p+pet-28a)在t4dna連接酶的作用下進(jìn)行連接,酶連接后的產(chǎn)物轉(zhuǎn)化大腸桿菌dh5α。在含有kan的lb平板上篩選陽性克隆子,并進(jìn)行培養(yǎng),提取質(zhì)粒。進(jìn)行雙酶切驗證及測序正確后,即得到質(zhì)粒pet28a-inaqn-p。
本具體實施方式中的病毒的衣殼蛋白3’端片段(p)、編碼冰核蛋白n端結(jié)構(gòu)域的編碼基因片段來自于重組表達(dá)質(zhì)粒pet28-inaqn-p(gii.4),這兩個基因的脫氧核糖核酸(下文稱為dna)序列,分別如序列表seqidno:1、seqidno:2所示,用于插入在這二者之間的接頭蛋白編碼基因(以下簡稱為tb)來源于人工合成的核酸片段,接頭蛋白編碼基因編碼的氨基酸序列如seqidno:3所示,用于優(yōu)化的細(xì)菌表面展示系統(tǒng)的構(gòu)建。
首先,利用重組表達(dá)質(zhì)粒pet28a-inaqn-p(gii.4),進(jìn)行雙酶切回收目的基因片段:約5.3kb的pet28載體核酸片段和960bp的p蛋白編碼基因核酸片段;人工合成的543bp的tb蛋白編碼基因片段(含inaqn片段)。將三種dna片段通過t4連接酶連接后得到重組誘導(dǎo)型表達(dá)質(zhì)粒pet28-inaqn-tb-p(gii.4),通過序列測定來驗證重組表達(dá)質(zhì)粒的真實性和準(zhǔn)確性。將上述重組的誘導(dǎo)型表達(dá)質(zhì)粒轉(zhuǎn)化入大腸桿菌宿主菌,攜帶上述重組誘導(dǎo)型表達(dá)質(zhì)粒的大腸桿菌便成為重組病毒衣殼蛋白的細(xì)菌細(xì)胞表面展示系統(tǒng)。
本領(lǐng)域技術(shù)人員可知,上述構(gòu)建方法僅是舉例說明,還可以通過其他方法構(gòu)建獲得重組誘導(dǎo)型表達(dá)質(zhì)粒pet28-inaqn-tb-p(gii.4)或其他病毒衣殼蛋白細(xì)菌的細(xì)胞表面展示體系。
在添加誘導(dǎo)劑的條件下誘導(dǎo)在上述細(xì)菌表面展示系統(tǒng)表達(dá)tb-p所編碼的蛋白質(zhì)。
上述細(xì)菌表面展示系統(tǒng)誘導(dǎo)表達(dá)的誘導(dǎo)步驟如下。
(1)將攜帶有重組的誘導(dǎo)型表達(dá)質(zhì)粒的大腸桿菌單菌落接種于培養(yǎng)基例如luria-bertani培養(yǎng)基(lb培養(yǎng)基)中,在30℃~37℃條件下震搖培養(yǎng)8h~16h,獲得細(xì)菌培養(yǎng)物。根據(jù)重組質(zhì)粒所攜帶的抗生素標(biāo)記基因,培養(yǎng)基中須含有相應(yīng)的抗生素例如卡那霉素(kan)。
(2)從步驟(1)的細(xì)菌培養(yǎng)物中取菌液轉(zhuǎn)接到含卡那霉素的新鮮培養(yǎng)基中,接種量優(yōu)選為占培養(yǎng)基體積的1.0%~20.0%,繼續(xù)在30℃~39℃條件下震搖培養(yǎng)。
(3)當(dāng)步驟(2)的培養(yǎng)物的od600=0.6~1.0時,加入誘導(dǎo)劑例如異丙基硫代-β-d-半乳糖苷,添加后的終濃度為0.1mmol/l~2.0mmol/l,將培養(yǎng)溫度降至15℃~30℃,繼續(xù)震搖培養(yǎng)8h~24h,此時即可使重組病毒衣殼蛋白表達(dá)后錨定在大腸桿菌的細(xì)胞表面。
(4)通過低速離心收集菌體細(xì)胞,將菌體細(xì)胞重懸至無菌磷酸鹽緩沖液(ph=7.2)中,得到菌懸液,即獲得所述的優(yōu)化的病毒受體捕獲體系。其中,菌懸液的od600=0.6~1.0,1℃~6℃保存?zhèn)溆谩?/p>
上述得到的菌懸液就是優(yōu)化的基于細(xì)菌細(xì)胞表面展示系統(tǒng)的病毒受體捕獲體系,可直接用于病毒受體的吸附和分離,以及目標(biāo)外源蛋白的分離純化。
實施例1
誘導(dǎo)型表面展示病毒衣殼蛋白原核表達(dá)質(zhì)粒載體的構(gòu)建:
將人工合成的inaqn-tb融合基因片段,其序列如seqidno:5所示,連接至原核克隆載體puc57中,連接產(chǎn)物以熱激法轉(zhuǎn)入大腸桿菌dh5α,在含有氨芐青霉素(amp)的lb平板上篩選陽性克隆子,將所挑取出的單菌落進(jìn)行培養(yǎng)后從中提取質(zhì)粒,得到重組質(zhì)粒puc57-inaqn-tb。
用ncoi/ecori和bglii/ecori分別對pet28a-inaqn-p(gii.4)進(jìn)行雙酶切處理,再用ncoi/bglii對puc57-inaqn-tb進(jìn)行雙酶切,分別回收約5.3kb、960bp、543bp的dna片段。將上述三個片段在t4dna連接酶的作用下進(jìn)行連接,酶連接后的產(chǎn)物轉(zhuǎn)化大腸桿菌dh5α。在含有卡那霉素(kan)的lb平板上篩選陽性克隆子,培養(yǎng),并抽提重組質(zhì)粒。首先對重組質(zhì)粒進(jìn)行雙酶切驗證,之后,對重組質(zhì)粒進(jìn)行測序,測序結(jié)果表明讀碼框正確。即得到誘導(dǎo)型表面展示病毒衣殼蛋白的原核表達(dá)質(zhì)粒pet28-inaqn-tb-p(gii.4)。
實施例2
誘導(dǎo)型表面展示病毒衣殼蛋白原核表達(dá)質(zhì)粒的表達(dá)及表面展示系統(tǒng)的功能鑒定:
將實施例1中制備的原核表達(dá)質(zhì)粒pet28-inaqn-tb-p(gii.4)轉(zhuǎn)化大腸桿菌bl21,攜帶該誘導(dǎo)型表面展示病毒衣殼蛋白原核表達(dá)質(zhì)粒pet28-inaqn-tb-p(gii.4)的大腸桿菌bl21命名為il-2.4p。挑取其單菌落,接種于含有100μg/ml卡那霉素的lb培養(yǎng)基中,37℃培養(yǎng)12h~14h后,以1.0%接種量接種于新鮮的培養(yǎng)基中,繼續(xù)震搖培養(yǎng)至od600nm為0.6時,添加終濃度為0.4mmol/l的iptg,在26℃條件下繼續(xù)震搖培養(yǎng)16h。4℃,5000rpm離心10min收集菌體,然后將菌體重懸于ph7.2的無菌pbs緩沖液中,od600nm調(diào)至1.0,于4℃保存?zhèn)溆谩?/p>
如圖1所示,通過重組菌sds-page檢測,空載pet28a誘導(dǎo)菌中沒有出現(xiàn)目標(biāo)條帶;重組菌pet28a-inaqn-p(gii.4)誘導(dǎo)菌體、重組菌pet28a-inaqn-tb-p(gii.4)誘導(dǎo)菌體中出現(xiàn)了目標(biāo)蛋白。通過蛋白酶酶切后,酶切上清中出現(xiàn)了背景干擾小的p結(jié)構(gòu)域蛋白。
以包被液(ph9.60.05mol/lna2co3-nahco3)溶解豬胃黏膜(porcinegastricmucin,以下簡稱:pgm;含hunovs受體hbgas)至終濃度為1.0mg/ml,將誘導(dǎo)菌液與等體積不同稀釋度的pgm溶液于37℃孵育0.5h,離心去上清;pbs洗滌3次后,用100u/ml蛋白酶(按照切割質(zhì)量比1:2000)37℃振蕩水浴酶切處理3h后。然后4℃,10,000rpm離心5min,收集上清。對照組不與pgm孵育,其他處理一致;pet28a作為陰性對照。
將上述樣品各取100μl加入酶標(biāo)板,4℃包被過夜;棄液后pbs洗滌三次,120μl/孔1.0%bsa進(jìn)行封閉,37℃孵育1h;棄液后pbs洗滌三次,100μl/孔添加一抗(hbgas單克隆抗體bg2,1:1000稀釋,signetlaboratories,dedham,ma,usa),37℃孵育60min。棄液后tbst洗滌三次,100μl/孔二抗[hrp-羊抗鼠igg(h+l)購于上海翊圣生物科技有限公司]稀釋液(1:3000稀釋于含1.0%bsa的tbst溶液中),經(jīng)37℃孵育60min。棄液后tbst洗滌三次,100μl/孔tmb[福因德科技(武漢)有限公司]混勻后避光反應(yīng)10min。每孔加入50μl終止液(2mol/lh2so4),15min內(nèi)于450nm處測定od值。
如圖2所示,通過測定od值,結(jié)果證明優(yōu)化的假hunovs酶切上清對pgm具有極其顯著的吸附能力;優(yōu)化的假hunovs酶切上清對pgm的吸附能力極其顯著大于假hunovs酶切上清。說明本設(shè)計構(gòu)建的優(yōu)化的病毒受體捕獲體系對對應(yīng)的病毒有極其顯著的吸附能力,且本設(shè)計的吸附能力顯著高于已有的病毒受體捕獲體系。
以上詳細(xì)描述了本發(fā)明的較佳具體實施例。應(yīng)當(dāng)理解,本領(lǐng)域的普通技術(shù)無需創(chuàng)造性勞動就可以根據(jù)本發(fā)明的構(gòu)思做出諸多修改和變化。因此,凡本技術(shù)領(lǐng)域中技術(shù)人員依本發(fā)明的構(gòu)思在現(xiàn)有技術(shù)的基礎(chǔ)上通過邏輯分析、推理或者有限的實驗可以得到的技術(shù)方案,皆應(yīng)在由權(quán)利要求書所確定的保護(hù)范圍內(nèi)。
序列表
<110>上海交通大學(xué)
<120>一種優(yōu)化的基于細(xì)菌細(xì)胞表面展示系統(tǒng)的目標(biāo)物捕獲體系
<160>5
<170>patentinversion3.5
<210>1
<211>960
<212>dna
<213>諾如病毒衣殼蛋白3'端結(jié)構(gòu)域編碼基因p基因
<400>1
tcaagaactaaaccattctctgtcccagttttaactgttgaggagatgaccaattcaaga60
ttccccattcctttggaaaagttgttcacgggtcccagcagtgcctttgttgtccaacca120
caaaacggtaggtgcacgactgatggcgtgctcctaggcgccacccaactgtctcctgtc180
aacatctgcaccttcagaggagatgtcacccatatcacaggtagtcgtaactacacaatg240
aatttggcttctcaaaattggagcaattatgacccaacagaagaaatcccagcccctcta300
ggaactccagattttgtggggaagattcaaggcgtgctcacccaaaccacaaggacagat360
ggctcaacacgcggccacaaagccacagtgtacactgggagcgccgactttgctccaaaa420
ctgggtagagttcaatttgaaactgacacagaccgtgattttgaagctaaccaaaacaca480
aagttcaccccagttggtgtcatccaagatggtagcaccacccaccgaaatgaaccccaa540
cagtgggtgctcccaagttactcaggcagaaatactcctaatgtgcatctggcccccgct600
gtagcccccacttttccgggtgagcaacttctcttcttcagatccaccatgcccggatgc660
agcgggtaccccaacatggatttggactgtctgctcccccaggaatgggtgcagtacttc720
taccaagaggcagccccagcacaatctgatgtggctctgctaagatttgtgaatccagac780
acaggtagggttttgtttgagtgtaagcttcataaatcaggctatgttacagtggctcac840
actggccaacatgatttggttatcccccccaatggttattttaggtttgattcctgggtc900
aaccagttttacacgcttgcccccatgggaaatggaacggggcgtaggcgtgcactataa960
<210>2
<211>525
<212>dna
<213>冰核蛋白n端結(jié)構(gòu)域編碼基因inaqn
<400>2
atggatctcgacaaggcgttggtgctgcgtacctgtgcaaataacatggccgatcattgc60
ggccttatatggcccgcttctggcacggtggaatccaaatactggcagtcaaccaggcgg120
catgagaatggtctggtcggtttactgtggggcgctggaaccagcgcttttctaagcgtg180
catgccgatgcgcgatggattgtccgtgaagtcgccgttgccgacatcatcagcctggaa240
gagcccggaatggtcaagtttccgcgggccgaggtggttcatgtcggcgacaggatcagc300
gcgtcacactttatttcggcacgtcaggccgaccctgcatcaacgccaacgccaacgcca360
acgccaatgaccgcggccacgcccccacccacgcccgcgacagcaaatgtcacgttaccg420
gtggccgaacaggccagtcatgaagtgttcgatgtggcgttggtcagcgcggctgccccc480
ccggtaaataccctgccggtgacgacgccgcagaatttgcagacc525
<210>3
<211>6
<212>prt
<213>人工蛋白
<400>3
leuvalproargglyser
15
<210>4
<211>1623
<212>dna
<213>諾如病毒衣殼蛋白編碼基因orf2
<400>4
atgaagatggcgtcgagtgacgccaacccatctgatgggtccgcagccaacctcgtccca60
gaggtcaataatgaggttatggctctggagcccgttgttggtgccgccattgcggcacct120
gtagcgggccaacaaaatgtaattgacccctggattagaaataattttgtaccagcccct180
ggtggagagtttacagtatcccctagaaacgctccaggtgaaatactatggagcgcgccc240
ttgggccctgatctaaatccctacctatcccatttggccagaatgtacaatggttatgca300
ggtggttttgaagtgcaggtaattctcgcggggaacgcgttcaccgccgggaaggtcata360
tttgcagcagtcccaccaaattttccaactgaaggcttgagccccagccaggtcactatg420
ttcccccatatagtagtagatgttaggcaactagaacctgtgttgattcccttacccgat480
gttaggaataatttctatcattacaatcaatcaaatgaccccaccattaagttgatagca540
atgttgtacacaccacttagggctaacaatgctggggatgatgtcttcacagtttcttgc600
cgagttctcacgagaccatcccccgattttgatttcatatttctagtgccacccacagtt660
gagtcaagaactaaaccattctctgtcccagttttaactgttgaggagatgaccaattca720
agattccccattcctttggaaaagttgttcacgggtcccagcagtgcctttgttgtccaa780
ccacaaaacggtaggtgcacgactgatggcgtgctcctaggcgccacccaactgtctcct840
gtcaacatctgcaccttcagaggagatgtcacccatatcacaggtagtcgtaactacaca900
atgaatttggcttctcaaaattggagcaattatgacccaacagaagaaatcccagcccct960
ctaggaactccagattttgtggggaagattcaaggcgtgctcacccaaaccacaaggaca1020
gatggctcaacacgcggccacaaagccacagtgtacactgggagcgccgactttgctcca1080
aaactgggtagagttcaatttgaaactgacacagaccgtgattttgaagctaaccaaaac1140
acaaagttcaccccagttggtgtcatccaagatggtagcaccacccaccgaaatgaaccc1200
caacagtgggtgctcccaagttactcaggcagaaatactcctaatgtgcatctggccccc1260
gctgtagcccccacttttccgggtgagcaacttctcttcttcagatccaccatgcccgga1320
tgcagcgggtaccccaacatggatttggactgtctgctcccccaggaatgggtgcagtac1380
ttctaccaagaggcagccccagcacaatctgatgtggctctgctaagatttgtgaatcca1440
gacacaggtagggttttgtttgagtgtaagcttcataaatcaggctatgttacagtggct1500
cacactggccaacatgatttggttatcccccccaatggttattttaggtttgattcctgg1560
gtcaaccagttttacacgcttgcccccatgggaaatggaacggggcgtaggcgtgcacta1620
taa1623
<210>5
<211>543
<212>dna
<213>inaqn-tb融合基因片段
<400>5
atggatctcgacaaggcgttggtgctgcgtacctgtgcaaataacatggccgatcattgc60
ggccttatatggcccgcttctggcacggtggaatccaaatactggcagtcaaccaggcgg120
catgagaatggtctggtcggtttactgtggggcgctggaaccagcgcttttctaagcgtg180
catgccgatgcgcgatggattgtccgtgaagtcgccgttgccgacatcatcagcctggaa240
gagcccggaatggtcaagtttccgcgggccgaggtggttcatgtcggcgacaggatcagc300
gcgtcacactttatttcggcacgtcaggccgaccctgcatcaacgccaacgccaacgcca360
acgccaatgaccgcggccacgcccccacccacgcccgcgacagcaaatgtcacgttaccg420
gtggccgaacaggccagtcatgaagtgttcgatgtggcgttggtcagcgcggctgccccc480
ccggtaaataccctgccggtgacgacgccgcagaatttgcagaccggatccacgcggaac540
cag543
- 還沒有人留言評論。精彩留言會獲得點贊!
- 高復(fù)雜度哺乳動物展示文庫及其篩選方法
- 一種在細(xì)胞表面展示外源蛋白的方法及產(chǎn)品的制作方法
- 嗜酸乳桿菌s-層蛋白表面展示系統(tǒng)的構(gòu)建的制作方法
- 一種快速篩選葉酸高產(chǎn)菌的方法
- 細(xì)胞展示文庫的制作方法
- 一種蛋白質(zhì)表達(dá)質(zhì)粒及其在將蛋白展示在細(xì)胞表面并自動釋放出來方面的應(yīng)用的制作方法
- 畢赤酵母壁蛋白Gcw5及其表面展示系統(tǒng)和構(gòu)建方法
- 畢赤酵母壁蛋白Gcw3及其表面展示系統(tǒng)和構(gòu)建方法
- 畢赤酵母壁蛋白Gcw21及其表面展示系統(tǒng)和構(gòu)建方法
- 畢赤酵母壁蛋白Gcw19及其表面展示系統(tǒng)和構(gòu)建方法
- 一種加快環(huán)氧樹脂材料表面電荷消散的方法
- 一種表面帶電荷的可以調(diào)節(jié)冷凝水凍結(jié)溫度的材料及其制備方法與應(yīng)用
- 組合式表面不帶電ptc發(fā)熱器的制造方法
- 一種表面電荷可轉(zhuǎn)變的納米凝膠及其制備方法以及一種表面電荷可轉(zhuǎn)變的納米凝膠載藥顆粒的制作方法
- 用于在細(xì)菌表面呈遞目的蛋白的dna分子及其應(yīng)用
- 用于油浸包裝中表面電荷抗擾的mems壓力傳感器場屏蔽布置的制作方法
- 管式表面不帶電的ptc發(fā)熱器的制作方法
- 一種表面不帶電型ptc發(fā)熱器的制造方法
- 表面不帶電ptc發(fā)熱器的制作方法
- 一種表面不帶電ptc發(fā)熱器的制作方法