一種鋰離子電池過充電熱失控建模方法與流程
本發明屬于電池領域,具體涉及一種鋰離子電池過充電熱失控建模方法。
背景技術:
鋰離子電池具有能量密度/功率密度高、使用壽命長等特點,是目前應用最為廣泛的車用化學動力源。然而,近年來,電動汽車的電池系統的熱失控事故層出不窮,危害了人們的生命財產安全,同時打擊了公眾對電動汽車的信心。
過充電是最常見的電池濫用情況之一,指的是電池在到達充電截止電壓后仍然被繼續充入電流,通常由電池管理系統失效引起。過充電過程中,電池內部會發生一系列化學反應,這些反應產生大量的熱量,使得電池溫度升高,最終導致電池發生熱失控,造成起火、爆炸等事故。為了更好地防止電池發生過充電,需要建立電池的過充電熱失控模型,模擬過充電過程中電池電壓和溫度的變化,根據電壓和溫度的變化規律評估電池安全狀態的變化,實現對過充電熱失控隱患的早期檢測。另外,電池過充電熱失控模型還可以模擬過充電引起的電池系統熱失控擴散,仿真模擬結果可以用于指導電池系統熱失控擴展防范設計,更好地保障電池系統的安全。然而,目前為止,尚沒有能夠模擬真實電池過充電熱失控過程電壓和溫度變化的模型。
技術實現要素:
本發明的目的是為克服已有技術的空白之處,提供一種鋰離子電池過充電熱失控建模方法。該方法能夠同時模擬過充電熱失控過程中電壓和溫度的變化規律,準確地模擬鋰離子電池的過充電熱失控行為,更好地保障電池系統的安全。
本發明提出了一種鋰離子電池過充電熱失控建模方法,其特征在于,該方法首先對第一鋰離子電池進行絕熱過充電熱失控實驗,并記錄第一鋰離子電池在不同時刻的溫度、電壓及內阻;然后將與第一鋰離子相同的第二鋰離子電池拆解,制作分別包含所述第二鋰離子電池正負極的兩個紐扣電池,并對兩個紐扣電池進行過充電測試,分別獲取包含第二鋰離子電池正負極電壓與鋰離子化學計量數的關系曲線;然后,對第一鋰離子電池絕熱過充電熱失控過程進行階段劃分,確定不同階段對應的電池內部化學反應;最后建立所述第一鋰離子電池在絕熱過充電熱失控實驗過程中的數學模型。該方法包括以下步驟:
1)提供一第一鋰離子電池,對所述第一鋰離子電池進行絕熱過充電熱失控實驗,并記錄該第一鋰離子電池在不同時刻的溫度T’(t)、電壓V’(t)以及內阻R’(t);
2)提供一第二鋰離子電池,所述第二鋰離子電池型號與第一鋰離子電池相同,將所述第二鋰離子電池拆解,制作分別包含所述第二鋰離子電池的正負極的兩個紐扣電池,對兩個紐扣電池進行過充電測試,分別獲取包含所述第二鋰離子電池正負極電壓與鋰離子化學計量數的關系曲線;
3)根據步驟1)所記錄的溫度T’(t)、電壓V’(t)以及內阻R’(t),對所述第一鋰離子電池絕熱過充電熱失控過程進行階段劃分,確定不同階段對應的電池內部化學反應;
4)根據步驟3)得到的不同階段對應的化學反應,建立所述第一鋰離子電池在絕熱過充電熱失控實驗過程中的數學模型{T(t),V(t)},并利用所述T’(t)及V’(t)標定該數學模型{T(t),V(t)}。
本發明提供的鋰離子電池過充電熱失控建模方法,通過將鋰離子電池絕熱過充電熱失控過程劃分為不同的階段,總結不同階段的化學反應,并根據不同階段的化學反應,建立所述鋰離子電池絕熱過充電熱失控過程的數學模型{T(t),V(t)},并利用該數學模型進行仿真計算,可以定量分析鋰離子電池過充電熱失控過程中化學反應情況,同時預測鋰離子電池在過充電熱失控過程中的溫度和電壓變化,為電池過充電過程中的安全狀態監控和熱失控擴散防范設計提供重要依據。
附圖說明
圖1為本發明的鋰離子電池過充電熱失控建模方法的流程圖。
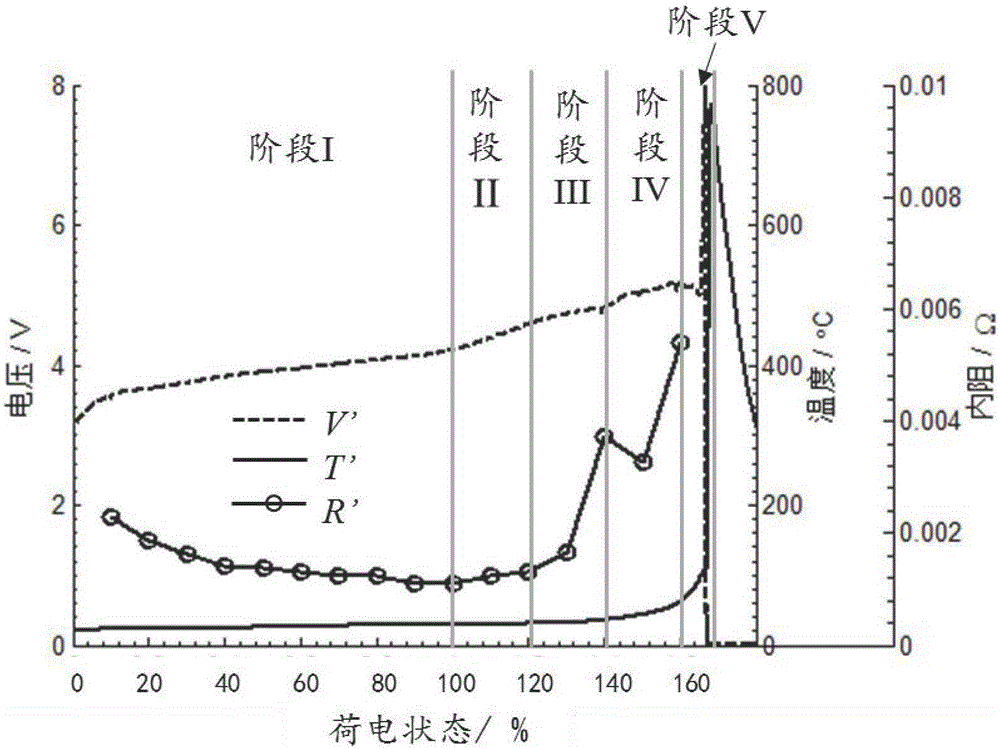
圖2為本發明實施例中第一鋰離子電池的絕熱過充電熱失控實驗結果及階段劃分結果示意圖。
圖3為本發明實施例中第二鋰離子電池正極電壓Vca與鋰離子化學計量數y的關系曲線圖。
圖4為本發明實施例中第二鋰離子電池負極電壓Van與鋰離子化學計量數x的關系曲線圖。
圖5為本發明實施例中過充電熱失控模型的仿真結果與第一鋰離子電池實驗結果對比圖。
圖6為本發明實施例中過充電熱失控模型的仿真結果與第三鋰離子電池實驗結果對比圖。
圖7為本發明實施例中過充電熱失控模型的仿真結果與第四鋰離子電池實驗結果對比圖。
具體實施方式
本發明提出一種鋰離子電池過充電熱失控建模方法,下面結合附圖及具體實施例對本發明作進一步的詳細說明。
本發明提出一種鋰離子電池過充電熱失控建模方法,首先對第一鋰離子電池進行絕熱過充電熱失控實驗,并記錄第一鋰離子電池在不同時刻的溫度、電壓及內阻;然后將與第一鋰離子相同的第二鋰離子電池拆解,制作分別包含所述第二鋰離子電池正負極的兩個紐扣電池,并對兩個紐扣電池進行過充電測試,分別獲取包含第二鋰離子電池正負極電壓與鋰離子化學計量數的關系曲線;然后,對第一鋰離子電池絕熱過充電熱失控過程進行階段劃分,確定不同階段對應的電池內部化學反應;最后建立所述第一鋰離子電池在絕熱過充電熱失控實驗過程中的數學模型。本發明流程如圖1所示,包括以下步驟:
S1:提供一第一鋰離子電池,對所述第一鋰離子電池進行常規絕熱過充電熱失控測試(即在絕熱環境下進行過充電測試,直至發生熱失控),并記錄該第一鋰離子電池在不同時刻的溫度T’(t)、電壓V’(t)以及內阻R’(t);
S2:提供一第二鋰離子電池,所述第二鋰離子電池型號與第一鋰離子電池一致,將所述第二鋰離子電池拆解,制作分別包含所述第二鋰離子電池的正負極的兩個紐扣電池,對兩個紐扣電池進行過充電測試,分別獲取包含所述第二鋰離子電池正負極電壓與鋰離子化學計量數的關系曲線;
S3:根據步驟S1中記錄的溫度T’(t)、電壓V’(t)以及內阻R’(t),對所述第一鋰離子電池絕熱過充電熱失控過程進行階段劃分,確定不同階段對應的電池內部化學反應;
S4:根據步驟S3不同階段對應的化學反應,建立所述第一鋰離子電池在絕熱過充電熱失控實驗過程中的數學模型{T(t),V(t)},并利用所述T’(t)及V’(t)標定該數學模型{T(t),V(t)}。
步驟S1中,所述鋰離子電池的正、負極材料以及隔膜可以為常用的鋰離子電池的正、負極材料以及隔膜。在本實施例中,所述鋰離子電池的正極材料為鎳鈷錳三元材料與錳酸鋰材料混合組成,負極材料為石墨,隔膜為具有陶瓷涂層的聚乙烯。
在絕熱環境下對所述第一鋰離子電池進行過充電熱失控實驗,有利于準確獲得所述鋰離子電池在過充電熱失控過程中釋放的全部能量。本實施例中,采用常規大型絕熱加速量熱儀中進行所述第一鋰離子電池的過充電熱失控實驗,并記錄了該第一鋰離子電池在不同時刻的溫度T’(t)、電壓V’(t)以及內阻R’(t),如圖2所示。其中,圖2的橫坐標為電池的荷電狀態,即充電容量與電池標稱容量的比值;虛線為第一鋰離子電池過充電熱失控實驗過程中電壓的變化曲線,對應的縱坐標軸為左邊的電壓坐標軸,可以看到,過充電熱失控過程中,電池電壓逐漸上升,在充電容量達到電池標稱容量的160%時,達到極大值5.23V,然后開始下降,在熱失控發生時急劇下降至0V;實線為第一鋰離子電池過充電熱失控實驗過程中溫度的變化曲線,對應的縱坐標軸為右邊第一個坐標軸——溫度縱坐標軸,可以看到,過充電熱失控過程中,電池溫度也逐漸上升,在充電容量達到電池標稱容量的140%后,電池升溫速率加快,熱失控發生時,電池溫度急劇升高至最大值800℃;實線與圓圈標志組成的曲線為第一鋰離子電池過充電熱失控實驗過程中內阻的變化曲線,對應的縱坐標軸為右邊第二個坐標軸——內阻縱坐標軸,可以看到在過充電熱失控實驗過程中,電池內阻先是慢慢下降,在充電容量達到電池標稱容量的120%后,電池內阻開始快速上升,在充電容量達到電池標稱容量的140%時,電池內阻出現極大值,隨后,電池內阻經歷了輕微的下降后又開始上升,直至電池發生熱失控。
步驟S2中,所述的第二鋰離子電池型號與第一鋰離子電池一致;分別獲取包含所述第二鋰離子電池正負極電壓與鋰離子化學計量數的關系曲線,具體包括以下步驟:
S21:將所述第二鋰離子電池放電至放電截止電壓,將第二鋰離子電池拆解,獲取該電池的正負極極片;
S22:利用S21中獲得的電池正負極極片,在常規的手套箱中分別制作兩個紐扣電池;其中,第一紐扣電池的正極為所述第二鋰離子電池的正極材料,負極為金屬鋰;第二紐扣電池的正極為所述第二鋰離子電池的負極材料,負極為金屬鋰;
S23:對S22得到的分別包含所述第二鋰離子電池的正、負極的兩個紐扣電池進行過充電測試,獲取過充電過程中正極電壓Vca與鋰離子化學計量數y以及負極電壓Van與鋰離子化學計量數x的關系曲線,如圖3和圖4所示。圖3中的橫坐標為正極鋰離子化學計量數y,縱坐標為正極電壓Vca,可以看到正極鋰離子化學計量數y從0變化到0.1時,電池電壓逐漸上升,正極鋰離子化學計量數y等于0.1時,正極電壓達到極大值5.24V,隨后,隨著正極鋰離子化學計量數y從0.1增加至1,正極電壓逐漸下降。圖4中的橫坐標為負極鋰離子化學計量數x,縱坐標為正極電壓Van,可以看到負極鋰離子化學計量數x從0逐漸增加到1.2的過程中,負極電壓從1.1V逐漸下降至-0.0058V,負極鋰離子化學計量數x大于1.2時,負極電壓基本保持不變,為-0.0058V。
步驟S3中,根據步驟S1中記錄的溫度T’(t)、電壓V’(t)以及內阻R’(t),對所述鋰離子電池絕熱過充電熱失控過程進行階段劃分,確定不同階段對應的電池內部化學反應,具體包括:參照圖2,根據步驟S1中記錄的溫度T’(t)、電壓V’(t)以及內阻R’(t),不考慮降溫階段,將所述第一鋰離子電池過充電熱失控過程劃分為階段I、階段II、階段III、階段IV以及階段V。
階段I:從所述第一鋰離子電池開始充電開始,到電池充電電壓到達充電截止電壓時結束。此階段內,電池在進行正常的充電,過充電尚未發生。此時,電池內部的熱量主要來自于自身內阻產生的焦耳熱,以及正負極材料可逆的脫鋰/嵌鋰反應產生的可逆熱;
階段II:從所述第一鋰離子電池的充電電壓超過其充電截止電壓時開始,到充電容量達到電池標稱容量的120%結束。從充電電壓超過充電截止電壓開始,電池開始發生過充電,但由于鋰離子電池正負極均留有一定的余量,此時正負極材料發生的仍然是可逆的脫鋰/嵌鋰反應,即鋰離子從正極材料中脫出,通過電解液,到達負極材料表面,并嵌入負極材料內部。此時電池內的熱量主要來自于自身內阻產生的焦耳熱以及脫鋰/嵌鋰反應產生的可逆熱;
階段III:從所述第一鋰離子電池的充電容量超過電池標稱容量的120%開始,到充電容量達到電池標稱容量的140%結束。當充電容量超過電池標稱容量的120%后,負極材料已經完全嵌滿鋰,多余的鋰離子將很難繼續嵌入負極中,開始在負極表面以鋰金屬的形式析出。析出的金屬鋰非常活潑,容易與電解液發生反應,消耗電解液,同時生成新的SEI膜,將導致電池內阻增加。對于正極,正極電壓將達到錳酸鋰材料中的3價錳離子的溶解電壓,導致3價錳離子發生溶解;
階段IV:從所述第一鋰離子電池的充電容量超過電池標稱容量的140%開始,到充電容量達到電池標稱容量的160%結束。隨著過充電的進行,正極電壓持續升高,達到電解液的分解電壓,氧化性強的正極材料開始與電解液發生反應,將電解液氧化分解,產生大量的氣體和熱量。同時,負極的SEI膜在高溫下也開始發生分解,導致還原性強的負極材料直接與電解液接觸,在負極表面與電解液發生還原反應,消耗負極材料和電解液,同時產生氣體和熱量。在本階段后期,正極材料發生結構坍塌,無法繼續維持高電壓,電池電壓在到達極大值點后開始下降。
階段V:從所述第一鋰離子電池的充電容量超過電池標稱容量的160%開始,到電池發生熱失控并且達到熱失控的最高溫度結束。從此階段開始,電池內部的電解液消耗完畢,電池內阻急劇增加,電池電壓也開始快速增加,直接到達充放電機的最高電壓(20V)。同時,電池的溫度也開始快速上升,體積明顯膨脹。電池隔膜在快速升溫的過程中發生收縮,引起電池內部的大規模內短路,釋放大量的熱量,熱失控發生,電池電壓急劇下降至0V,溫度急劇升高至最大值。
步驟S4中,建立所述第一鋰離子電池在絕熱過充電熱失控實驗過程中的數學模型{T(t),V(t)},具體包括以下步驟:
S41:建立所述第一鋰離子電池在過充電熱失控過程中的正極電壓Vca(t)、負極電壓Van(t)以及全電池電壓V(t)的計算公式;
S42:建立所述第一鋰離子電池在過充電熱失控過程中產熱速率Q(t)的計算公式;
S43:建立所述第一鋰離子電池在過充電熱失控過程中的能量守恒方程,得到不同時刻電池升溫速率dT(t)/dt的計算公式,進而得出不同時刻的電池溫度T(t)的計算公式。
步驟S41中,鋰離子電池在過充電熱失控過程中的正極電壓Vca與正極的鋰離子化學計量數y一一對應,對應關系由步驟2)得到,如圖3所示。同樣,負極電壓Van與負極的鋰離子化學計量數x一一對應,對應關系對應關系由步驟2)得到,如圖4所示。而在所述第一鋰離子電池過充電熱失控過程中,正極材料發生脫鋰反應,負極材料發生嵌鋰反應,即正極鋰離子化學計量數y不斷減少,而負極鋰離子化學計量數x不斷增加。因此,在所述第一鋰離子電池過充電熱失控過程中,正極鋰離子化學計量數y的計算公式如式(1)所示:
其中,y0為充電開始時刻正極鋰離子化學計量數,本實施例中設為0.996;I為充電電流,Qca為正極材料的容量。如前面所述,隨著過充電的進行,正極材料會發生分解,正極容量也隨之會發生衰減,需要根據正極材料的分解情況計算正極材料容量Qca。由于圖3中正極紐扣電池測試得到的正極電壓Vca(t)與正極內部的鋰離子化學計量數y對應關系也已經納入正極容量衰減的影響(因為正極紐扣電池過充電測試中正極材料也會有衰減)。在進行建模時,僅需要根據正極材料的分解情況修正正極材料容量Qca,如式(2)所示:
Qca=Qca,0·(1-kQ,ca·(cca,0-cca)) (2)
式(2)中,Qca,0為正極材料的初始容量,kQ,ca為修正系數,取值范圍為0~1,cca為正極材料的歸一化濃度,取值范圍為0~1,cca,0=1為正極材料的初始歸一化濃度。在本實施例所述第一鋰離子電池的數學模型中,Qca,0設為78.503Ah,kQ,ca設為0.1,cca根據正極材料的分解反應計算得到。
在所述第一鋰離子電池過充電熱失控過程中,負極鋰離子化學計量數x的計算公式如式(3)所示:
其中,x0為充電開始時刻負極鋰離子化學計量數,本實施例中設為0.0167;I為充電電流,Qan為負極材料的容量,取值范圍為40~90Ah。本實施例所述第一鋰離子電池的數學模型,Qan=52.52Ah。需要注意的是,實際中負極鋰離子化學計量數x的值應當在0和1之間,x大于1意味著負極材料已經嵌滿鋰,多余的鋰離子將析出。另外,在進行負極鋰離子化學計量數x的計算時,原則上也需要考慮負極容量Qan衰減的影響,但從圖4中可以看出,負極發生析鋰后,負極電壓基本穩定在-0.0058V左右。此時,盡管負極容量Qan衰減對負極鋰離子化學計量數x的取值有影響,但對負極電壓并沒有影響,方便起見,便不再考慮負極容量Qan衰減的影響。
負極電壓Van(t)的計算公式如式(4)所示:
其中,Van(x(t))的意思是在充電過程中,負極電壓Van(t)與負極鋰離子化學計量數x(t)存在一一對應關系,對應關系由步驟2)得到,如圖4所示。在計算過程中,先由公式(3)計算得到負極鋰離子化學計量數x(t),然后根據步驟2)中得到的對應關系,線性插值獲得負極電壓Van(t),故表示為Van(x(t))。
在充電過程中,全電池的電壓為正極電壓Vca(t)和負極電壓Van(t)之差,加上電池自身內阻通過電流帶來的電壓,如式(5)所示,其中Rohm為電池內阻,在步驟S1中可以測得。
V(t)=Vca(y(t))-Van(t)+I·Rohm(t) (5)
其中,Vca(y(t))的意思是在充電過程中,正極電壓Vca(t)與正極鋰離子化學計量數y(t)存在一一對應關系,對應關系由步驟2)得到,如圖3所示。在計算過程中,先由公式(1)計算得到正極鋰離子化學計量數y(t),然后根據步驟2)中得到的對應關系,線性插值獲得正極電壓Vca(t),故表示為Vca(y(t))。
步驟S42中,電池過充電過程中,電池的內部產熱速率包括以下幾部分:
(1)電池正負極材料發生可逆脫鋰/嵌鋰反應產生的可逆產熱速率Qrev(t);
(2)電池自身內阻通過電流時產生的焦耳產熱速率Qohm(t);
(3)過充電過程中電池內部化學反應產熱速率Qr(t);
(4)電池大規模內短路產熱速率Qshort(t);
在過充電熱失控過程中,電池產熱速率Q(t)即為上述四種產熱速率之和。
所述可逆產熱速率Qrev(t)由電池正負極材料脫鋰/嵌鋰的可逆反應產生,當充電容量超過電池標稱容量的120%,即充電荷電狀態(SOC)大于120%,電池內部開始發生副反應,Qrev(t)可以忽略不計。因此可逆產熱速率Qrev(t)的計算公式如式(6)所示。
其中dU/dT為反應熵變,可以通過實驗標定,本實施例所述的第一鋰離子電池在不同SOC下的反應熵變如表1所示。
表1第一鋰離子電池在不同SOC下的反應熵變取值表
所述焦耳產熱速率Qohm(t)的計算公式如式(7)所示:
Qohm(t)=I2Rohm(t) (7)
所述化學反應產熱速率Qr(t)的表達式如式(8)所示:
Qr(t)=QLi+Qca,d+Qe+QSEI+Qan+Qca (8)
其中,QLi為負極表面析出的鋰金屬與電解液反應的產熱速率,Qca,d為正極材料中錳離子溶解導致的產熱速率,Qe為電解液氧化分解的產熱速率,QSEI為SEI膜分解反應的產熱速率,Qan為負極材料分解反應的產熱速率,Qca為正極材料分解反應的產熱速率。
所述QLi的計算公式如式(9)所示,其中HLi為單位摩爾鋰金屬與電解液反應釋放的能量,單位為J/mol,RLi為鋰金屬與電解液反應的速率,單位為mol/s。
QLi=HLi·RLi (9)
RLi符合阿倫尼烏斯公式,如式(10)所示,其中ALi表示金屬鋰與電解液反應的頻率因子,單位是s-1,EaLi為反應的活化能,單位是J/mol,R是理想氣體常量,R=8.314J/(mol·K),T為所述第一鋰離子電池的溫度,cLi為析出的鋰的物質的量,單位為mol,ce為代表電解液的歸一化濃度,kLi為人為設置的常數,使得cLi為0時,反應速率為0,而cLi為趨向于無窮大時,反應速率不再受鋰金屬的量影響。
在過充電過程中,析出的鋰金屬的量遵循式(11)、(12)所示的質量守恒方程,其中cLi,0為初始鋰金屬的量,本實施例中設為0,F為法拉第常數,表示1mol電子所帶的電量,F=96487C/mol。
iLi為析鋰電流,遵循BV方程,如式(13)所示,其中i0為反應交換電流,單位為A,αc和αa為傳遞常數,rSEI為SEI膜內阻,Van,ref為析鋰反應的平衡電勢。析鋰反應只有在負極表面電勢低于平衡電勢Van,ref,即Van-I·rSEI-Van,ref<0時,才會發生。
在本實施例中,上述鋰金屬與電解液反應的公式中相關參數的取值如表2所示:
表2鋰金屬與電解液反應的公式中相關參數的取值表
所述Qca,d來自于正極材料中的3價錳離子溶解,計算公式如式(15)所示,其中Hca,d為單位質量的正極材料中的3價錳離子全部溶解釋放的能量,單位為J/g,Rca,d為3價錳離子溶解的速率,mca為所述第一鋰離子電池中正極材料的質量,單位為g。
Qca,d=Hca,d·Rca,d·mca (15)
Rca,d符合阿倫尼烏斯公式,如式(16)所示,其中Aca,d表示錳離子溶解反應的頻率因子,單位是s-1,Eaca,d為反應的活化能,單位是J/mol,cMn為代表3價錳離子的歸一化濃度,αd為傳遞常數,Vca,d,ref為溶解反應的平衡電勢。錳離子溶解反應只有在正極電壓大于平衡電勢Vca,d,ref時,即Vca-Vca,d,ref>0時才會發生。
在過充電過程中,正極材料中3價錳離子的含量遵循式(17)、(18)所示的質量守恒方程,其中cMn,0為錳離子歸一化濃度的初始值,本實施例中設為1。隨著充電的進行,3價錳離子逐漸被氧化,因此充電電流也對錳離子的量有影響,如式(18)所示,kd為相關系數。
在本實施例中,上述錳離子溶解相關反應的公式中相關參數的取值如表3所示:
表3錳離子溶解相關反應的公式中相關參數的取值表
所述Qe由高電壓下,電解液被正極材料氧化分解產生,計算公式如式(19)所示,其中He為單位質量的電解液氧化分解釋放的能量,單位為J/g,Re為電解液氧化分解速率,me為所述第一鋰離子電池中電解液的質量,單位為g。
Qe=He·Re·me (19)
Re符合阿倫尼烏斯公式,如(20)式所示,其中Ae表示電解液氧化分解反應的頻率因子,單位是s-1,Eae為反應的活化能,單位是J/mol,ce為代表電解液的歸一化濃度,αe為傳遞常數,Ve,ref為電解液分解反應的平衡電勢。電解液氧化分解只有在正極表面電壓大于平衡電勢Ve,ref時,即Vca+I·re-Ve,ref>0時才會發生。re為正極表面阻抗,受到電解液氧化分解的影響,如式(21)所示,re,0為阻抗初始值,kr,e為影響系數。
re=re,0+kr,e∫Redt (21)
在過充電過程中,電池中電解液的含量遵循式(22)、(23)所示的質量守恒方程,其中ce,0為電解液歸一化濃度的初始值,本實施例中設為1。電解液的消耗速率受三個方面的影響:(1)自身的氧化分解速率Re;(2)金屬鋰與電解液的反應速率ke,1·RLi,ke,1為影響系數;(3)負極材料與電解液的反應速率ke,2·Ran,ke,2為影響系數。
在本實施例中,上述電解液分解反應相關公式中相關參數的取值如表4所示:
表4電解液分解反應相關公式中相關參數的取值表
所述QSEI由SEI膜分解反應產生,該反應在電池溫度T(t)大于40℃時才會進行。QSEI計算公式如式(24)所示,其中HSEI為單位質量的負極中的SEI膜全部分解釋放的能量,單位為J/g,RSEI為SEI膜分解速率,man為所述第一鋰離子電池中負極材料的質量,單位為g。
QSEI=HSEI·RSEI·man (24)
RSEI符合阿倫尼烏斯公式,如式(25)所示,其中ASEI表示SEI膜分解反應的頻率因子,單位是s-1,EaSEI為反應的活化能,單位是J/mol,cSEI為代表SEI膜的歸一化濃度。
SEI膜的含量遵循式(26)、(27)所示的質量守恒方程,其中cSEI,0為SEI膜歸一化濃度的初始值,取值范圍為0~1,本實施例中設為0.15。鋰金屬與電解液的反應將生成新的SEI膜,對SEI膜的含量有影響,kSEI為影響系數,取值范圍為0~1,本實施例中設為0.1。SEI膜分解會影響SEI膜阻抗,如式(14)所示,rSEI,0為阻抗的初始值,kr,SEI為影響系數,取值范圍為0~0.1,本實施例中設為0.05。
在本實施例中,上述SEI膜分解反應公式中相關參數的取值如表5所示:
表5SEI膜分解反應公式中相關參數取值表
所述Qan由負極材料分解反應產生,該反應在電池溫度T(t)大于65℃時才會進行。Qan計算公式如式(28)所示,其中Han為單位質量的負極材料全部分解釋放的能量,單位為J/g,Ran為負極材料分解速率,man為所述第一鋰離子電池中負極材料的質量,單位為g。
Qan=Han·Ran·man (28)
Ran符合阿倫尼烏斯公式,如(29)式所示,其中Aan表示負極材料分解反應的頻率因子,單位是s-1,Eaan為反應的活化能,單位是J/mol,can為代表SEI膜的歸一化濃度。表征SEI膜厚度對負極材料分解反應的影響。
負極材料的含量遵循式(30)、(31)所示的質量守恒方程,其中can,0為負極材料歸一化濃度的初始值,本實施例中設為0.85。
在本實施例中,上述負極材料分解反應相關公式中相關參數的取值如表6所示:
表6負極分解反應相關公式中相關參數取值表
所述Qca由正極材料分解產生,本實施例中采用的鋰離子電池的正極材料為三元材料與錳酸鋰材料組成的混合材料,具有兩個不同的化學反應,分別在電池溫度T(t)大于180℃和220℃時才會進行。因此Qca計算公式如式(32)所示,其中Hca,1和Hca,2分別為單位質量的正極材料發生兩個不同的化學反應釋放的能量,單位為J/g,Rca,1和Rca,2分別為兩個化學反應的反應速率,mca為所述第一鋰離子電池中正極材料的質量,單位為g。
Qca=Hca,1·Rca,1·mca+Hca,2·Rca,2·mca (32)
Rca,1和Rca,2符合阿倫尼烏斯公式,如式(33)、(34)所示,其中Aca,1、Aca,2為反應的頻率因子,單位是s-1,Eaca,1、Eaca,2為反應的活化能,單位是J/mol,cca為代表正極材料的歸一化濃度。
在電池溫度T(t)大于180℃下進行:
在電池溫度T(t)大于220℃下進行:
正極材料的含量遵循式(35)、(36)所示的質量守恒方程,其中cca,0為正極材料歸一化濃度的初始值,本實施例中設為1。錳離子溶解以及電解液的分解反應也會消耗部分的正極材料,kca,1和kca,2分別為影響系數。
在本實施例中,上述公式中相關參數的取值如下表7所示:
表7正極材料分解反應相關公式中相關參數取值表
所述大規模內短路產熱速率Qshort(t)的表達式如下:
ΔHshort代表釋放的總能量,Δt代表平均反應時間,決定反應速度,∫Qshort(t)dt代表已經發生短路的能量。大規模內短路在電池溫度T(t)大于為大規模內短路溫度Tshort時才會發生。本實施例中,Tshort=110℃。上述各參數的取值如表8所示:
表8大規模內短路反應相關參數取值表
步驟S43中,根據能量守恒,建立所述第一鋰離子電池在過充電熱失控過程中的能量守恒方程,如下式所示:
其中,M為電池質量,本實施例中M=1kg;Cp為電池的比熱容,在本實施例中,Cp=1100J/(kg·K);hA(T(t)-Ta(t))表示過充電熱失控過程中的散熱量,在本實施例中,所述第一鋰離子電池的過充電熱失控實驗在絕熱環境下進行,因此散熱量為零。得到不同時刻電池升溫速率的計算公式如式(39)所示:
進一步地,得到不同時刻電池溫度T(t)的計算公式如式(40)所示,其中T0為所述第一鋰離子電池在過充電熱失控實驗前的溫度,為已知量,本實施例中,T0=19℃;
所述利用T’(t)以及V’(t)標定所述數學模型{T(t),V(t)}的步驟包括:
對于Qr(t),根據現有的文獻選定相關參數的值,利用所述數學模型{T(t),V(t)}進行仿真計算,得到所述第一鋰離子電池在不同時刻的電壓和溫度的仿真結果,如果仿真結果與步驟1中得到的實驗結果T’(t)和V’(t)相差較大,則在一定范圍內調整相關參數,每調整一次參數進行一次仿真計算,直至仿真計算結果與實驗結果相近為止。上述表1-表8的各個參數取值表中給出的即為使得仿真計算結果與實驗結果相近的優選參數取值結果。
利用所建立的數學模型{T(t),V(t)}對第一鋰離子電池進行仿真計算的結果與實驗結果的對比如圖5所示。圖5(a)中,橫坐標為時間,縱坐標為電壓,實線表示實驗得到的電壓變化曲線,而虛線表示使用本發明的建模方法建立的數學模型進行仿真計算得到的電壓變化曲線,可以看到,實線與虛線基本重合,表明本發明的建模方法可以準確模擬電池過充電熱失控過程中電池電壓的變化;圖5(b)中,橫坐標為時間,縱坐標為溫度,實線表示實驗得到的溫度變化曲線,而虛線表示使用本發明的建模方法建立的數學模型進行仿真計算得到的溫度變化曲線,可以看到,實線與虛線基本重合,表明本發明的建模方法建立的數學模型可以準確模擬過充電熱失控過程中電池溫度的變化。圖5(a)和(b)的結果說明通過本發明的建模方法建立的數學模型{T(t),V(t)}具有較好的精度。
本發明所述鋰離子電池過充電熱失控建模方法在步驟S4之后可進一步包括以下步驟:
S5:提供一第三、第四鋰離子電池,與所述第一鋰離子電池相同,對所述第三、第四鋰離子電池進行與第一鋰離子電池不同充電倍率的絕熱過充電熱失控實驗,分別記錄第三、第四鋰離子電池在不同時刻的溫度和電壓;
S6:利用第三、第四鋰離子電池的實驗結果,驗證S4所建立的數學模型{T(t),V(t)}。
在本實施例中,第一鋰離子電池實驗過程中采用的充電電流為20A,而第三、第四鋰離子電池實驗過程中采用的充電電流分別為13.33A和40A。圖6和圖7是模型仿真計算結果與第三、第四鋰離子電池的實驗結果的對比圖。圖6(a)中,橫坐標為時間,縱坐標為電壓,實線表示實驗得到的電壓變化曲線,而虛線表示使用本發明的建模方法建立的數學模型進行仿真計算得到的電壓變化曲線,可以看到,實線與虛線基本重合,表明本發明的建模方法可以準確模擬充電電流為13.33A的電池過充電熱失控過程中電池電壓的變化;圖6(b)中,橫坐標為時間,縱坐標為溫度,實線表示實驗得到的溫度變化曲線,而虛線表示使用本發明的建模方法建立的數學模型進行仿真計算得到的溫度變化曲線,可以看到,實線與虛線基本重合,表明本發明的建模方法建立的數學模型可以準確模擬充電電流為13.33A的過充電熱失控過程中電池溫度的變化。圖7(a)中,橫坐標為時間,縱坐標為電壓,實線表示實驗得到的電壓變化曲線,而虛線表示使用本發明的建模方法建立的數學模型進行仿真計算得到的電壓變化曲線,可以看到,實線與虛線基本重合,表明本發明的建模方法建立的數學模型可以準確模擬充電電流為40A的電池過充電熱失控過程中電池電壓的變化;圖7(b)中,橫坐標為時間,縱坐標為溫度,實線表示實驗得到的溫度變化曲線,而虛線表示使用本發明的建模方法建立的數學模型進行仿真計算得到的溫度變化曲線,可以看到,實線與虛線基本重合,表明本發明的建模方法建立的數學模型可以準確模擬充電電流為40A的過充電熱失控過程中電池溫度的變化。從圖5、圖6和圖的對比結果,可以看出通過本發明的建模方法建立的數學模型能夠準確模擬仿真不同倍率下的過充電熱失控過程中電池電壓和溫度的變化,具有較好的精度。
另外,本領域技術人員還可以在本發明精神內做其他變化,這些依據本發明精神所作的變化,都應包含在本發明所要求保護的范圍內。
- 還沒有人留言評論。精彩留言會獲得點贊!