一種調控玻璃化冷凍牛卵母細胞中鈣離子濃度的方法與流程
本發明涉及牛卵母細胞超低溫冷凍技術領域,具體地說,涉及一種調控玻璃化冷凍牛卵母細胞中鈣離子濃度的方法。
背景技術:
哺乳動物卵母細胞的冷凍保存是保護物種資源多樣性和拯救瀕危動物的有效手段,也可以為體外受精、單精子注射和體細胞核移植等胚胎生物技術提供豐富的實驗材料,使卵母細胞的供給和使用不受時間和空間的限制。因此,卵母細胞的冷凍保存具有非常重要的理論意義和實用價值,一直是低溫生物學領域的研究熱點和焦點。目前,由于玻璃化冷凍具有降溫速度快、冷凍損傷低、操作簡單等優點,已經成為卵母細胞冷凍保存的有效手段(larmanandgardner,2014)。
盡管哺乳動物卵母細胞的玻璃化冷凍保存取得很大進展(vajtaetal.,1998;dinnyésetal.,2000;houetal.,2005;zhaoetal.,2011),但其仍遠遠滿足不了畜牧業生產和胚胎生物技術快速發展的需要。究其原因,主要是由于玻璃化冷凍能引起卵母細胞中ca2+濃度異常升高,進而導致皮質顆粒的提前釋放,透明帶硬化,受精率降低(larmaneta1.,2006,2007;tianetal.,2007;boglioloetal.,2012;nikiforakietal.,2014),嚴重影響了玻璃化冷凍卵母細胞應用范圍。目前,玻璃化冷凍引起卵母細胞中ca2+濃度升高的機制還不十分清楚,更缺乏能夠有效調控玻璃化冷凍卵母細胞中ca2+濃度,提高玻璃化冷凍牛卵母細胞受精能力的有效措施。
技術實現要素:
本發明的目的是提供一種有效調控玻璃化冷凍牛卵母細胞中鈣離子濃度的方法,進而提高玻璃化冷凍牛卵母細胞的體外受精及發育能力。
為了實現本發明目的,本發明首先提供一種用于牛卵母細胞冷凍保存的玻璃化冷凍液,所述冷凍液中含有5-20μmbapta-am(鈣螯合劑)和0.5-2μmrr(線粒體鈣單向轉運體抑制劑,釕紅),用edfsf40液配制。其中,所述edfsf40液由eg(乙二醇)、dmso(二甲基亞砜)和fsf液按照體積比2﹕2﹕6組成。fsf液為含有30w/v%聚蔗糖70(ficoll70)、0.5m蔗糖和20%fbs(胎牛血清)的dpbs溶液,不含鈣鎂。
優選地,本發明的玻璃化冷凍液中bapta-am的濃度為5μm、10μm、20μm,rr的濃度為0.5μm、1μm、2μm。更優選地,bapta-am的濃度為10μm,rr的濃度為1μm。
本發明還提供一種用于牛卵母細胞冷凍保存的試劑組合,包括體外成熟液、含bapta-am的體外成熟液、預處理液、玻璃化冷凍液、解凍液以及含rr的體外成熟液。
所述體外成熟液為含有10μg/mlfsh(卵泡刺激素)、10μg/mllh(黃體生成素)、1μg/ml雌二醇和10%fbs的m199培養液。
所述含bapta-am的體外成熟液為含有5-20μmbapta-am的體外成熟液。優選地,bapta-am的濃度為5μm、10μm、20μm。更優選地,bapta-am的濃度為10μm。
所述預處理液為含有10%eg和10%dmso的dpbs溶液(不含鈣鎂)。
所述解凍液為含有0.15-0.25m蔗糖的dpbs溶液(不含鈣鎂)。優選地,所述解凍液為含有0.15m或0.25m蔗糖的dpbs溶液。
所述含rr的體外成熟液為含有0.5-2μmrr的體外成熟液。優選地,rr的濃度為0.5μm、1μm、2μm。更優選地,rr的濃度為1μm。
本發明還提供所述試劑組合在制備用于玻璃化冷凍保存牛卵母細胞的試劑盒中的應用。
本發明還提供bapta-am和rr在調控玻璃化冷凍牛卵母細胞胞內ca2+、線粒體ca2+水平,提高玻璃化冷凍牛卵母細胞的卵裂率、囊胚率、受精及發育能力中的應用。
本發明進一步提供一種調控玻璃化冷凍牛卵母細胞中鈣離子濃度的方法,其是將體外成熟22h的牛卵母細胞置于含bapta-am的體外成熟液中孵育2h,然后采用ops法進行冷凍,解凍后在含rr的體外成熟液中恢復30min。
所述方法包括以下步驟:
1)將卵丘-卵母細胞復合體(cocs)置于體外成熟液中培養22h,然后用透明質酸酶脫去卵丘細胞,收集mii期卵母細胞,轉入含bapta-am的體外成熟液中孵育2h;
2)將卵母細胞在預處理液中孵育30s,再轉入玻璃化冷凍液中處理25s,然后裝入ops管中直接投入液氮中凍存;
3)解凍時,將ops管從液氮中取出,將裝有卵母細胞的部分迅速置于38.5℃含0.25m蔗糖的dpbs溶液中,用吸管將卵母細胞從ops管吹出放于38.5℃含0.25m蔗糖的dpbs溶液中1min,然后轉入38.5℃含0.15m蔗糖的dpbs溶液中5min,進行解凍;
4)解凍后,將卵母細胞在含rr的體外成熟液中恢復30min。
在本發明的一個具體實施方式中,所述方法包括以下步驟:
s1、從屠宰場收集牛卵巢,保存于含75μg/ml青霉素和50μg/ml鏈霉素的35℃生理鹽水中2h內送回實驗室,從直徑為2-8mm的卵泡中抽出卵丘-卵母細胞復合體,挑選至少有3層致密卵丘細胞的復合體清洗后用于體外成熟,約50個卵丘-卵母細胞復合體為一組置于盛有500μl體外成熟液、且表面覆蓋有礦物油的4孔板(即每500μl成熟液中含有約50個cocs)中,于38.5℃、5%co2培養箱中培養22h,然后用透明質酸酶脫去卵丘細胞,收集mii期卵母細胞,轉入含bapta-am的體外成熟液中在38.5℃、5%co2的培養箱中孵育2h;
s2、將卵母細胞在預處理液中孵育30s,再轉入玻璃化冷凍液中處理25s,然后裝入ops管中直接投入液氮中凍存;
s3、解凍時,將ops管從液氮中取出,將裝有卵母細胞的部分迅速置于38.5℃含0.25m蔗糖的dpbs溶液中,用吸管將卵母細胞從ops管吹出放于38.5℃含0.25m蔗糖的dpbs溶液中1min,然后轉入38.5℃含0.15m蔗糖的dpbs溶液中5min,進行解凍;
s4、解凍后,將卵母細胞在含rr的體外成熟液中恢復30min。
本發明中采用的ops管為兩端開口式塑料管(i.m.v,萊格勒,法國),管壁厚0.02mm,體積0.25ml;所述ops管的一端被人工拉細,用來盛放卵母細胞,拉細一端ops管的頂端外直徑為0.23mm。
研究表明,玻璃化冷凍會顯著性提高牛卵母細胞中胞內ca2+水平、線粒體ca2+水平,rr、bapta-am處理能夠顯著降低冷凍卵母細胞中線粒體ca2+水平和胞內ca2+水平,且與新鮮對照組無顯著性差異。進一步研究表明,玻璃化冷凍會使牛卵母細胞中cg分布異常、atp含量減少。將牛卵母細胞采用含有1μmrr的玻璃化冷凍液冷凍、冷凍后在含有1μmrr的體外成熟液中恢復30min,能夠有效維持玻璃化冷凍牛卵母細胞中線粒體ca2+水平、atp含量正常,進而提供玻璃化冷凍牛卵母細胞孤雌激活后的發育能力。而將體外成熟22h的牛卵母細胞放入10μmbapta-am中孵育2h,然后采用含10μmbapta-am的玻璃化冷凍液進行冷凍,能夠有效維持玻璃化冷凍牛卵母細胞中胞內ca2+水平、cg分布正常,進而提高玻璃化冷凍牛卵母細胞體外受精后的卵裂率。最終,將體外成熟22h的牛卵母細胞放入10μmbapta-am孵育2h,然后采用含10μmbapta-am和1μmrr的玻璃化冷凍液進行冷凍,解凍后在含1μmrr的體外成熟液中恢復30min,可使玻璃化冷凍牛卵母細胞的卵裂率、囊胚率、囊胚細胞數,以及體外受精能力、發育能力得到顯著性提高。
本發明提供的玻璃化冷凍牛卵母細胞方法具有操作簡單,成本低,對卵母細胞無毒無害,能有效保護冷凍卵母細胞的線粒體功能及其發育能力,這對于拓展冷凍卵母細胞的應用范圍,具有重要的理論和實際意義,將在牛卵母細胞超低溫冷凍研究領域發揮巨大作用。
附圖說明
圖1為本發明實施例1中牛卵母細胞線粒體ca2+染色圖。其中,a:新鮮卵母細胞中線粒體ca2+水平;b:冷凍卵母細胞中線粒體ca2+水平。
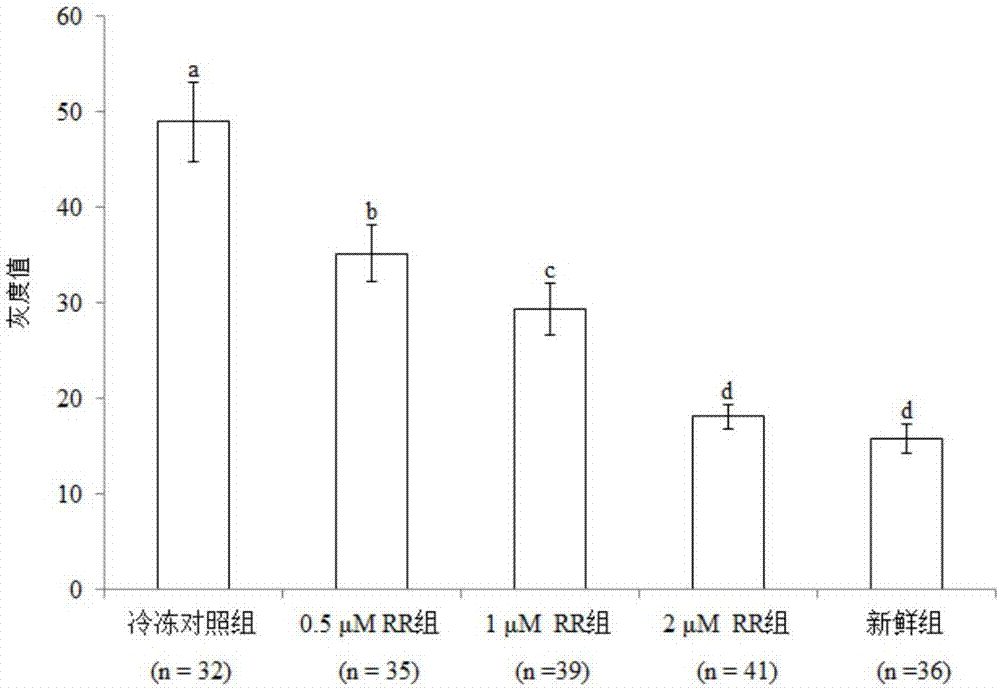
圖2為本發明實施例1中rr處理對玻璃化冷凍牛卵母細胞線粒體ca2+的影響。其中,肩標不同小寫字母表示差異顯著(p<0.05)。
圖3為本發明實施例1中atp測量過程中的標準曲線。
圖4為本發明實施例1中rr處理對玻璃化冷凍牛卵母細胞atp含量的影響。
圖5為本發明卵實施例1中卵母細胞胞內ca2+染色圖。其中,a:正常情況下牛卵母細胞胞內ca2+濃度較低;b:玻璃化冷凍卵母細胞中胞內ca2+濃度顯著升高。
圖6為本發明實施例1中玻璃化冷凍對牛卵母細胞中胞內胞胞內ca2+的影響。
圖7為本發明實施例1中牛卵母細胞中cg的染色圖。其中,a:正常分布,cgs分布在胞質皮質區,呈環狀分布。箭頭:環狀分布;b:異常分布,胞質中有大量分布,無環狀分布。bar=20μm。
圖8為本發明實施例1中牛卵母細胞精子穿卵染色圖。其中,a:正常受精后形成雌、雄原核;b:異常受精后除雌、雄元原核外,還有未解聚的精子。bar=20μm。
具體實施方式
以下實施例用于說明本發明,但不用來限制本發明的范圍。若未特別指明,實施例中所用的技術手段為本領域技術人員所熟知的常規手段,所用原料均為市售商品。
本發明中m199培養液購自gibcobrl公司(格蘭德島,紐約,美國),胎牛血清購自gibcobrldivision公司(格蘭德島,紐約,美國)。
實施例1rr、bapta-am處理對玻璃化冷凍牛卵母細胞體外受精能力的影響
1、卵母細胞的收集和體外成熟
牛卵母細胞從當地屠宰場收集,保存于含有75μg/ml青霉素和50μg/ml鏈霉素的35℃生理鹽水中2h內送回實驗室,從直徑為2-8mm的卵泡中抽出卵丘-卵母細胞復合體,挑選至少有3層致密卵丘細胞的復合體清洗后用于體外成熟,50個卵丘-卵母細胞復合體為一組置于盛有500μl體外成熟液,且表面覆蓋有礦物油的4孔板中,于38.5℃5%co2的培養箱內培養22-24h,然后用透明質酸酶脫去卵丘細胞,收集mii期卵母細胞,用于后續實驗。。
體外成熟液:含有10μg/mlfsh、10μg/mllh、1μg/ml雌二醇和10%fbs的m199培養液。
2、ops管的制備
按照vajta等(1998)公開的方法,稍作改進制備ops管,0.25ml的塑料管(i.m.v,萊格勒,法國),高溫變軟后人工拉長,用顯微控制儀測量使頂端外直徑為0.23mm,管壁厚約0.02mm。
3、預處理和玻璃化冷凍液
預處理液:含有10%eg和10%dmso的dpbs溶液(不含鈣鎂)。
用于配制玻璃化冷凍液的edfsf40液:eg、dmso和fsf液按體積比2﹕2﹕6混勻。其中,fsf液:含有30w/v%聚蔗糖70、0.5m蔗糖和20%fbs的dpbs溶液,不含鈣鎂。
解凍液:含有0.15m或0.25m蔗糖的dpbs溶液。
4、卵母細胞的冷凍與解凍
卵母細胞在預處理液中孵育30s轉入玻璃化冷凍液中處理25s,然后裝入ops管中直接投入液氮中凍存。
解凍時,將ops管從液氮中取出,將裝有卵母細胞的部分迅速溶于38.5℃含0.25m蔗糖的dpbs溶液中,用口吸管將卵母細胞從ops管吹出放于38.5℃含0.25m蔗糖的dpbs溶液中1min,然后轉入38.5℃含0.15m蔗糖的dpbs溶液中5min。觀察卵母細胞膜和透明帶的完整性判斷其存活情況。根據實驗設計挑選存活的卵母細胞用于后續實驗。
5、胞質ca2+水平檢測
將卵母細胞置于10μmfluo-3/am中在38.5℃下孵育45min,然后用dbps/bsa液洗滌,最后在熒光顯微鏡下觀察。利用nikonez-c1freeviewer分析熒光強度來反映胞質內ca2+的水平。所有操作均需在暗室中進行。
6、線粒體鈣ca2+濃度測定
線粒體鈣檢測試劑盒購自美國杰美公司。線粒體ca2+濃度測定步驟如下:體外成熟液清洗卵母細胞3次,取300μla液放入1.5ml離心管中,并加入30μl染色液制成染色工作液;將清洗后的卵母細胞放入染色工作液中,室溫(25℃)避光孵育30min,再放入37℃培養箱中孵育30min;用體外成熟液洗去細胞表面殘余染色工作液,即刻封片后在激光共聚焦熒光顯微鏡下進行觀察,激發波長550nm,散發波長590nm,線粒體ca2+呈現紅色。采用圖像分析軟件(ez-c1freeviewer)進行熒光強度定量分析。
7、atp含量分析
采用vanblerkom等公開的方法,稍作改進分析atp數目,利用atp依賴性熒光素-熒光素酶,進行生物熒光分析(atp生物熒光分析,kithsii瑞士羅氏診斷股份有限公司,曼海姆,德國),測定熒光產生量定量測定atp數目。
將20μl細胞裂解試劑加到有20個卵母細胞的0.5ml離心管中,吹打混勻使這些細胞均勻地溶解。溶液中atp的濃度從0.01pm升至10.0pm,每個濃度分析一次,繪制一條標準曲線。atp待測液放到96孔板中平衡3-5min,隨后分析標準液和樣品發出的光,用光度計(infinitem200,tecan集團有限公司,奧地利)10s內即可測得。用連續稀釋液的相對光強度繪制出一條標準曲線,從標準曲線上即可看出樣品atp的濃度。
8、精子穿卵檢測
精子穿卵檢測:卵母細胞在含有精子的受精液中孵育12h后,在50μl0.1%的透明質酸酶中用口吸管吹打精子脫除干凈。卵母細胞在固定液中4℃固定48h,用h33342染色9min,用脫色液脫去染色液,用指甲油封片。在相差顯微鏡測定細胞核狀態。
9、體外受精
體外受精:凍精37℃水浴解凍,解凍后置于7ml洗精液中,輕輕混勻,1800rpm離心5min2次。離心后吸去上清,用受精液調整精子密度為5×106個/ml。吸取20μl精液加入含有20枚卵母細胞的80μl受精液中,在38.5℃、5%co2培養箱中進行體外受精。受精18-20h后,置于cr1aa中培養,培養48h后更換培養液(含10%fbs的cr1aa)。體外培養7d后,獲得體外受精囊胚。
10、實驗設計
(1)bapta-am處理對玻璃化冷凍牛卵母細胞胞內ca2+水平、cg分布和體外受精能力的影響
在cocs體外成熟過程中,在第22h時將其用透明質酸酶脫去卵丘細胞,選擇胞質均勻的mii期卵母細胞,將卵母細胞分別移至含5μm、10μm、20μmbapta-am的體外成熟液中繼續培養2h,而后分別用含5μm、10μm、20μmbapta-am的冷凍液進行玻璃化冷凍(先將卵母細胞在預處理液中孵育30s,再轉入玻璃化冷凍液中處理25s,然后裝入ops管中直接投入液氮中凍存),解凍后恢復30min,分別進行牛卵母細胞胞內ca2+水平、cg分布和精子穿卵能力、體外受精胚胎發育能力的檢測。進而研究bapta-am處理對牛卵母細胞胞內ca2+、cg分布和體外受精能力的影響。
(2)rr處理對玻璃化冷凍牛卵母細胞中線粒體ca2+水平、atp含量和孤雌激活發育能力的影響
在cocs體外成熟24h后用透明質酸酶脫去卵丘細胞,選擇胞質均勻的mii期卵母細胞,分別用含0.5μm、1μm、2μmrr的冷凍液進行玻璃化冷凍(先將卵母細胞在預處理液中孵育30s,再轉入玻璃化冷凍液中處理25s,然后裝入ops管中直接投入液氮中凍存),解凍后分別在含0.5μm、1μm、2μmrr的體外成熟液中恢復30min,進而研究rr處理對線粒體ca2+水平、atp含量和孤雌激活發育能力的影響。
(3)rr與bapta-am聯合處理對玻璃化冷凍牛卵母細胞體外受精能力的影響
在cocs體外成熟過程中,在第22h時將其用透明質酸酶脫去卵丘細胞,選擇胞質均勻的mii期卵母細胞,將卵母細胞移入含有10μmbapta-am的體外成熟液中繼續培養2h,然后用含有10μmbapta-am和1μmrr的玻璃化冷凍液進行冷凍,解凍后放入含有1μmrr的體外成熟液中恢復30min,然后分別進行牛卵母細胞體外受精能力的檢測。
13、數據統計
采用sas軟件對實驗數據進行分析,百分數比較時經反正旋轉化后采用方差分析,結果以平均數依標準差表示,p<0.05為差異顯著性標準。各處理組至少重復3次以上。
實驗結果:
(一)rr處理對玻璃化冷凍牛卵母細胞中線粒體ca2+水平的影響
(1)不同濃度rr處理對玻璃化冷凍牛卵母細胞中線粒體ca2+水平的影響
牛卵母細胞線粒體ca2+染色圖片見圖1,新鮮牛卵母細胞(圖1a)中線粒體ca2+濃度較低,而玻璃化冷凍對照組卵母細胞(圖1b)中線粒體ca2+濃度較高。如圖2所示,玻璃化冷凍組牛卵母細胞線粒體ca2+水平顯著高于新鮮組(p<0.05);rr處理組線粒體ca2+水平均顯著低于玻璃化冷凍組(p<0.05),其中0.5μm和1μm處理組仍顯著高于新鮮組(p<0.05),而2μm組與新鮮組差異不顯著(p>0.05)。
(2)rr處理對解凍后牛卵母細胞atp含量的影響
atp含量測定過程中繪制的標準曲線如圖3所示,所得標準方程為:y=0.0049x+0.2133,標準曲線相關系數(r2)為0.9991。樣品值除以樣品數,即為每個卵母細胞中atp含量。如圖4所示,玻璃化冷凍顯著降低了牛卵母細胞中atp含量(p<0.05),rr處理組atp含量顯著低于新鮮對照組(p<0.05),但顯著高于冷凍對照組(p<0.05),且各處理組之間相互存在顯著性差異(p<0.05)。
(3)rr處理對解凍后牛卵母細胞孤雌激活發育潛力的影響
如表1所示,卵母細胞孤雌激活后玻璃化冷凍組的卵裂率(72.22%)、囊胚率(23.08%)顯著低于新鮮對照組(84.30%,41.18%;p<0.05),1μmrr處理組卵裂率(88.20%)、囊胚率(42.25%)與新鮮對照組(84.30%,41.18%)相比無顯著性差異、但顯著高于0.5μmrr處理組(77.18%,27.83%)。1μmrr處理組卵裂率(88.20%)顯著性高于2μmrr處理組(79.29%)、但囊胚率兩組(42.25%vs.34.23%)之間無顯著性差異。1μmrr處理效果高于2μmrr,原因可能是由于2μmrr濃度較高,進而產生的毒性作用所致。
表1rr處理對玻璃化冷凍牛卵母細胞發育潛力的影響
注:同列數據肩標不同小寫字母表示差異顯著(p<0.05)。
(二)bapta-am處理對玻璃化冷凍牛卵母細胞胞內ca2+水平、cg分布和體外受精能力的影響
(1)bapta-am處理對玻璃化冷凍牛卵母細胞胞內ca2+和cg分布的影響
卵母細胞中胞內ca2+的染色如圖5所示,正常情況下牛卵母細胞胞內ca2+濃度較低(圖5a),玻璃化冷凍卵母細胞中胞內ca2+濃度顯著升高(圖5b)。如圖6所示,新鮮對照組胞內ca2+濃度顯著性低于玻璃化冷凍對照組,bapta-am各組胞內ca2+水平均顯著低于玻璃化冷凍組(p<0.05),其中5μm處理組仍顯著高于新鮮組(p<0.05),而10μm、20μm處理組與新鮮組差異不顯著(p>0.05)。
卵母細胞cg的染色如圖7示,正常情況下cg分布在胞質皮質區呈現環狀分布(圖7a),異常情況下cg從皮質區提前釋放進入胞質內(圖7b)。如表2所示,玻璃化冷凍組cg正常分布率(56.25%)顯著性低于新鮮對照組(86.11%),bapta-am處理后cg正常分布率均顯著提升(65.85%,75.56%,84.21%,86.11%),且10μmbapta-am冷凍組(75.56%)、20μmbapta-am冷凍組(84.21%)cg正常分布率與新鮮對照組(86.11%)無顯著性差異。
表2bapta-am處理對玻璃化冷凍牛卵母細胞cg分布的影響
注:同列數據肩標不同小寫字母表示差異顯著(p<0.05)。
(2)bapta-am處理對玻璃化冷凍牛卵母細胞精子穿卵能力的影響
精子穿卵染色如圖8所示,正常受精后卵母細胞中形成雌、雄原核(圖8a),異常受精后卵母細胞中除雌、雄原核外,還有未解聚的精子(圖8b)。如表3所示,玻璃化冷凍組正常受精率(60%)顯著低于新鮮對照組(87.5%;p<0.05),10μmrr冷凍組正常受精率(84.85%)顯著高于5μmrr冷凍組(63.33%)和20μmrr冷凍組(70.97%),且與新鮮對照組(87.5%)無顯著性差異。
表3bapta-am處理對玻璃化冷凍牛卵母細胞體外受精能力的影響
注:同列數據肩標不同小寫字母表示差異顯著(p<0.05)。
(3)bapta-am處理對玻璃化冷凍牛卵母細胞體外受精效率的影響
實驗結果如表4所示,冷凍對照組體外受精卵裂率(41.63%)、囊胚率(12.37%)顯著低于新鮮對照組(75%,34.09%)。rr處理組中,10μmrr冷凍組卵裂率(65.73%)顯著高于冷凍對照組(41.63%)、5μmrr冷凍組(52.54%)、20μmrr冷凍組(49.73%),但與新鮮對照組(75%)無顯著性差異。各組之間囊胚率無顯著性差異(11.96%-15.71%)、均顯著性低于新鮮對照組(34.09%)。
表4bapta-am處理對玻璃化冷凍牛卵母細胞體外受精能力的影響
注:同列數據肩標不同小寫字母表示差異顯著(p<0.05)。
(三)rr與bapta-am聯合處理對玻璃化冷凍牛卵母細胞體外受精能力的影響
經過rr、bapta-am前期實驗,確定1μmrr和10μmbapta-am進行聯合處理實驗。實驗結果如表5所示,冷凍對照組的卵裂率(58.24%)、囊胚率(10.53%)顯著低于新鮮對照組(83.55%,34.72%;p<0.05),rr、bapta-am聯合處理組的卵裂率(79.42%)、囊胚率(29.09%)顯著性高于冷凍對照組(58.24%%,10.53%%;p<0.05)
表5rr與bapta-am聯合處理對玻璃化冷凍牛卵母細胞體外受精效率的影響
注:同列數據肩標不同小寫字母表示差異顯著(p<0.05)。
雖然,上文中已經用一般性說明及具體實施方案對本發明作了詳盡的描述,但在本發明基礎上,可以對之做一些修改或改進,這對本領域技術人員而言是顯而易見的。因此,在不偏離本發明精神的基礎上所做的這些修改或改進,均屬于本發明要求保護的范圍。
參考文獻
[1]larmanmg,gardnerdk.ultrarapidvitrificationofmouseoocytesandembryos.methodsmol.biol.2014;1092:153-165.
[2]vajtag,holmp,kuwayamam,boothpj,jacobsenh,grevet,callesenh.openpulledstraw(ops)vitrification:anewwaytoreducecryoinjuriesofbovineovaandembryos.mol.reprod.dev.1998;51(1):53-58.
[3]dinnyésa1,daiy,jiangs,yangx.highdevelopmentalratesofvitrifiedbovineoocytesfollowingparthenogeneticactivation,invitrofertilization,andsomaticcellnucleartransfer.biol.reprod.2000.63(2):513-518.
[4]houyp,daiyp,zhuse,zhuhb,wuty,gonggc,wanghp,wangll,liuy,lir,wanr,lin.bovineoocytesvitrifiedbytheopenpulledstrawmethodandusedforsomaticcellcloningsupporteddevelopmenttoterm.theriogenology.2005;64(6):1381-1391.
[5]zhaoxm,duwh,wangd,haohs,liuy,qint,zhuhb.effectofcyclosporinepretreatmentonmitochondrialfunctioninvitrifiedbovinematureoocytes.fertil.steril.2011;95(8):2786-2788.
[6]larmanmg,katz-jaffemg,sheehancb,gardnerdk.1,2-propanediolandthetypeofcryopreservationprocedureadverselyaffectmouseoocytephysiology.hum.reprod.22(1):2007;250-259.
[7]larmanmg,sheehancb,gardnerdk.calcium-freevitrificationreducescryoprotectant-inducedzonapellucidahardeningandincreasesfertilizationratesinmouseoocytes.reproduction.2006;131(1):53-61.
[8]tiansj,yancl,yanghx,zhougb,yangzq,zhuse.vitrificationsolutioncontainingdmsoandegcaninduceparthenogeneticactivationofinvitromaturedovineoocytesanddecreasespermpenetration.anim.reprod.sci.2007;101(3-4):365-371.
[9]bogliolol,leddas,innocenzip,ariuf,bebbered,rosatii,leonigg,piccininim.ramanmicrospectroscopyasanon-invasivetooltoassessthevitrification-inducedchangesofovineoocytezonapellucida.cryobiology.2012;64:267-272.
[10]nikiforakid,vandenmeerschautf,qianc,decrooi,luy,deroot,vandenabbeele,heindryckxb,desutterp.oocytecryopreservationandinvitrocultureaffectcalciumsignallingduringhumanfertilization.hum.reprod.2014;29(1):29-40。
- 還沒有人留言評論。精彩留言會獲得點贊!