一種沼澤小葉樺離體芽快繁方法與流程
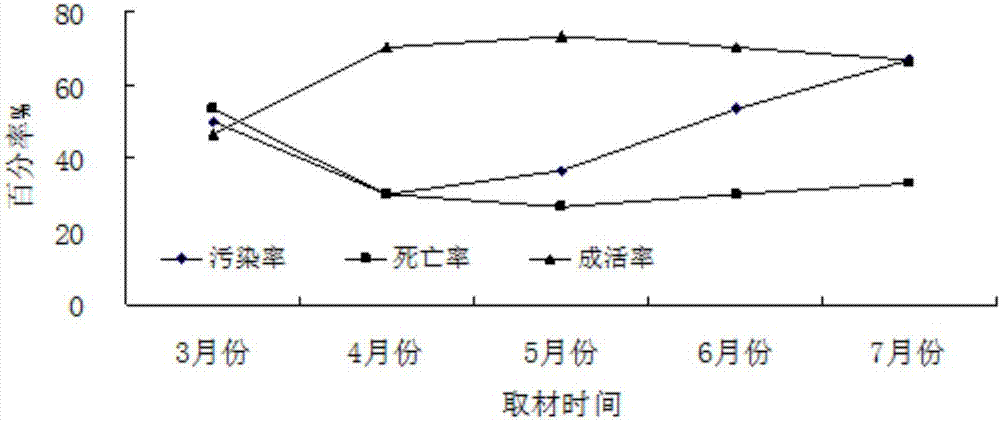
本發明涉及植物組織培養領域,尤其涉及一種沼澤小葉樺離體芽快繁方法。技術背景我國大陸沿海海岸線長18000km,擁有灘涂面積21709km2,且以每年300km2的速度繼續淤長。灘涂生態系統受海陸系統的雙重干擾,土壤發育時間短,鹽分含量高,造成了灘涂自然生態新系統的脆弱性和不穩定性。加之臺風、暴雨、冰雹、龍卷風等災害性天氣頻繁,每年造成的經濟損失達10.6億元,當地生態安全和社會經濟發展受到嚴重影響。目前,沿海灘涂造林樹種缺乏,大面積的灘涂處于荒蕪狀態,選育和引進耐鹽樹種成為沿海灘涂造林綠化、合理開發和利用的關鍵。沼澤小葉樺為落葉小喬木,具有較強的耐鹽和耐水能力,可在高鹽、高水位環境下生長,在沿海和低濕地上具有應用的潛力。調查發現,我國約有500余種鹽生植物,其中木本植物所占比例稀少,由于沼澤小葉樺在改造和利用鹽漬土方面特性,將是優良的候選樹種之一。在我國廣闊的東部沿海灘涂地區,如果能將沼澤小葉樺引種到這些地區,將能豐富該地區的植被類型,改善生態環境。然而,沼澤小葉樺是極為稀有和瀕臨滅絕的溫帶落葉闊葉樹種,為國家二級重點保護瀕危植物,其嫩枝扦插極難生根,目前主要采用種子繁殖,不能規模化育苗,嚴重限制了沼澤小葉樺的引種移栽及深入研究。因此,需要采取其他方式來提高其繁殖能力。技術實現要素:本發明目的在于克服現有技術存在的外植體污染、褐化、玻璃化現象等阻礙植物組培工作的問題,提供一種繁殖速度快,生產周期短、增殖系數高且成活率高的沼澤小葉樺離體芽快繁方法,通過外植體選擇及消毒、啟動誘導培養、繼代增殖培養、生根誘導培養、煉苗移栽等過程實現沼澤小葉樺離體快繁。為實現上述發明目的,本發明采用的技術方案為:一種沼澤小葉樺的離體芽快繁方法,包括以下步驟:1)挑選株高1~1.5m的未萌動的健壯植株,4~5月份采主枝頂芽、主枝側芽、側枝頂芽的新生芽作為外植體;2)在超凈工作臺上,先用70%的酒精處理外植體20s,再用0.1%升汞消毒5~20min,10%naclo消毒0~20min,用無菌水沖洗數次;3)將處理好的外植體在無菌的條件下接種到初代培養基上,初代培養基成分為:ms+0.6~1.5mg/l6-ba+0.5~1.0g/lpvp,培養20d以上;4)將外植體轉入增殖培養基,增殖培養基成分為:ms+0.4~0.6mg/l6-ba+0.02mg/lnaa,培養時間20d以上獲得小苗;5)將小苗進行生根培養,生根培養基成分:ms+0.1~0.5mg/lnaa,或1/2ms+0~0.5mg/lnaa,培養20d以上;7)煉苗移栽:選擇健壯的無菌苗,用多菌靈溶液浸泡清洗后,移栽到已消毒的蛭石+珍珠巖的基質中,先保濕培養一周,逐漸去掉蓋子。步驟1)中,在新生芽萌動前,用50%的多菌靈可濕性粉劑噴灑植株,一周兩次,直到植株吐芽、取材為止。步驟1)中,從健壯枝條上采回新生芽,用試管刷蘸洗衣粉輕輕刷洗,流水沖洗表面污物2~3h。步驟2)中,先用70%酒精處理20s,再配合0.1%升汞處理10min,后用無菌水沖洗4-5次。步驟3)中,初代培養基成分為:ms+0.8~1.0mg/l6-ba+1.0g/lpvp。步驟4)中,增殖培養基成分為:ms+0.6mg/l6-ba+0.02mg/lnaa,或ms+0.4mg/l6-ba+0.02mg/lnaa。步驟5)中,生根培養基成分:ms或1/2ms+0.1或0.5mg/lnaa。有益效果:與現有的技術相比,本發明以沼澤小葉樺離體芽為外植體,建立了組培繁殖體系。通過酒精和升汞預處理母本材料,大大降低了外植體的污染率,使外植體成活率最高可達74.19%,污染率降為25.81%。初代培養基中添加pvp,使褐化現象消失,大大降低了組培風險,提高了成活率。本方法得到的組培苗具有增殖系數高,生根率高,栽植成活力高等特點。有利于沼澤小葉樺的保護與開發,具有廣泛應用前景。附圖說明圖1是6-ba濃度過高時,初生代培養無菌苗圖。圖2是取材時間對污染率的影響結果圖。圖3是不同植物調節劑對沼澤小葉樺無菌苗生根的影響圖(a.ms無添加劑的生根;b.0.1mg/lnaa生根;c.少量多效唑生根;d.多量多效唑生根)。具體實施方式以下結合實例對本發明進一步詳細說明。以下實施例中,所使用的材料和試劑如下:材料:挑選株高1~1.5m左右的未萌動的健壯植株,3~7月間采健壯枝條上的新生芽作為試材。在新生芽萌動前,用50%的多菌靈可濕性粉劑噴灑植株,一周兩次,直到植株吐芽、取材為止。從健壯枝條上采回新生芽,用試管刷蘸洗衣粉輕輕刷洗,流水沖洗表面污物2~3h,在無菌條件下,用70%酒精進行表面消毒,再用消毒劑溶液處理。消毒后切除芽體基部與藥液接觸的部分,接種于無菌培養基上。ms培養基:瓊脂粉7.0g/l,蔗糖30g/l,用1mol/l的hcl和naoh將培養基ph調到6.0,煮沸,待瓊脂徹底融化后,分裝到廣口培養瓶中,用透氣性無菌塑料封口膜包扎培養瓶,在121℃下,高壓滅菌20min,后取出,放于培養室內,冷卻凝固后待用。若無特殊說明,所有培養條件均為:日光燈照明,培養溫度為(25±2)℃,空氣相對濕度50~60%,光照時間12~13h/d,光強為1500~2000lx。數據統計與分析方法:用excel進行數據處理和作圖,spss軟件進行數據分析。污染率(%)=污染的外植體數/接種外植體總數×100%;死亡率(%)=未污染外植體的死亡數/接種外植體總數×100%;萌芽率(%)=未污染外植體芽萌動個數/接種外植體總數×100%;增殖系數=增殖周期結束時苗高大于1.0cm的芽苗總數/增殖周期起始時的芽苗數平均株高(cm)=培養周期結束時幼苗株高之和/接種時幼苗總數;生根率(%)=生根的苗數/培養的苗數×100%;平均根數(條)=根總數/生根株數;平均根長(cm)=生根苗根總長/生根苗總數。實施例1沼澤小葉樺的離體芽快繁方法,以沼澤小葉樺的新生芽為外植體,在超凈工作臺上,先用70%的酒精處理20s,后用0.1%的hgcl2或10%的naclo消毒劑采用不同的消毒時間(表1)消毒后,用無菌水沖洗5次。經消毒后的外植體放到鋪有無菌濾紙的培養皿中,吸干材料表面的水分,用手術刀切掉基部與藥液接觸的部分,將芽鱗和未展開的托葉切除,接種到ms+6-ba1.0mg/l生長培養基上,每個處理接12瓶,每瓶接3個外植體,定期觀察記錄,接種25d后統計污染率、死亡率及萌芽率。表1不同消毒劑和消毒時間的設計處理號70%酒精(s)0.1%hgcl2(min)10%naclo(min)120002205032010042015052020062005720010820015920020外植體消經毒處理后接種到培養基中培養,2~3d后部分外植體基部接觸培養基的部分周圍有水浸狀物質產生,呈無色或透明乳白色。隨著時間的延長,部分該物質逐漸消失。5d左右,部分培養基表面變得粗糙,有細菌污染的現象,菌落點點狀或帶水狀,顏色紅色或黃色等。一周左右開始有霉菌污染,主要分布在芽的表面或芽鱗片的傷口處,菌絲有白色或黑色,并且呈逐漸擴大的趨勢。部分芽無污染,不啟動,褐變死亡。在只用70%酒精處理20s時,污染很嚴重,成活率極低,雖然存活下來的外植體生長良好,也不能將其作為消毒的最佳方式(表2)。而當70%酒精和0.1%hgcl2或10%naclo搭配使用時,外植體消毒效果明顯改善,污染率降低,且成活率顯著提高。0.1%的hgcl2處理時,最佳消毒時間為10min,成活率最高達74.19%,并且外植體長勢良好,葉片深綠。10%naclo處理的最佳時間為10min,成活率最高可達72.22%,葉片淺綠色,長勢良好。當兩種消毒劑處理20min時,污染率雖降低,但由于時間過長,外植體成活率明顯下降,生長狀況不理想,長勢不佳。表2不同消毒處理的影響處理號接種總數污染率成活率生長狀況13683.00%10.10%葉片深綠,長勢良好23635.00%65.00%葉片深綠,長勢良好33625.81%74.19%葉片深綠,長勢良好43620.57%71.43%葉片深綠,長勢一般53617.89%42.11%萌動較慢63638.89%61.11%葉片淺綠,長勢良好73627.78%72.22%葉片淺綠,長勢良好83622.22%66.67%葉片淺綠,長勢良好93616.67%47.78%葉片淺綠,莖稈細弱實施例2一種沼澤小葉樺的離體芽快繁方法,包括以下步驟:1)外植體的建立:挑選株高1~1.5m左右的未萌動的健壯植株,4~5月份采主枝頂芽、側芽以及側枝頂芽等新生芽作為植體材料。在新生芽萌動前,用50%的多菌靈可濕性粉劑噴灑植株,一周兩次,直到植株吐芽、取材為止。為減少材料污染,從健壯枝條上采回新生芽,用試管刷蘸洗衣粉輕輕刷洗,流水沖洗表面污物2~3h。2)外植體的消毒:用步驟1)得到的外植體,在超凈工作臺上,先用70%的酒精處理20s,再用0.1%升汞消毒10min,用無菌水沖洗5次。3)初代培養:將處理好的外植體在無菌的條件下接種到初代培養基上,成分為:ms+1.0mg/l6-ba+0~1.0g/lpvp,培養溫度:25±2℃,空氣相對濕度50~60%,光照時間:12~13h/d,光強:1500~2000lx,培養時間:25d。初代培養處理好的外植體需放到鋪有無菌濾紙的培養皿中,吸干材料表面的水分,用手術刀切掉基部與藥液接觸的部分,將芽鱗和未展開的托葉切除。5)增殖培養:將外植體轉入增殖培養基,成分為:ms+1.0g/lpvp+0.6mg/l6-ba+0.02mg/lnaa,培養時間25d。6)生根培養:將小苗進行生根培養,生根培養基成分:ms+1.0g/lpvp+0.1~0.5mg/lnaa,培養至25d。7)煉苗移栽:選擇健壯的無菌苗,用多菌靈溶液浸泡清洗后,移栽到已消毒的蛭石+珍珠巖(體積比1:1)的基質中,先保濕培養一周,逐漸去掉蓋子。采用pvp防治外植體的褐化,向培養基中添加不同濃度的pvp(表3),接種處理好的外植體,每處理10瓶,每瓶3個,定期觀察記錄,25d后統計褐化率、褐斑直徑大小。表3不同濃度的pvp防褐化處理從表3可以看出,防治外植體褐化的最佳處理為3號處理,即在培養基中添加1.0g/l的pvp,可以有效降低褐化率,達到較好的防治效果,后續實施例君采用此操作。未添加pvp的1號處理,接種當天外植體基部即出現淺色褐斑,3~4天時褐斑顏色最深,褐斑直徑最大可達1.2cm。隨時間延長,褐斑有變淺消失的跡象,但外植體長勢不佳,基部切口處有長約0.2cm變的干枯、褐色,植株吸收營養受限制,生長受到抑制,嚴重時褐變死亡,如1號、2號處理。4號處理雖無褐化現象發生,但由于pvp濃度偏高,外植體葉尖有干黃現象發生。實施例3一種沼澤小葉樺的離體芽快繁方法,同實施例2,其中在初生代培養時,以ms為基本培養基,在培養基中添加1.0g/l的pvp和不同濃度的6-ba(表4),每個處理10瓶,每瓶3個外植體,25d后統計萌芽率。表4表明,外植體的萌芽率隨著6-ba濃度的增加而升高。未添加6-ba時,萌芽率最低,為16.67%,無愈傷形成,但生長較為緩慢;添加量大于0.8mg/l時萌芽率可達90%以上,雖基部有半球狀愈傷形成,但植株長勢良好;添加量為1.5mg/l時,萌芽率最高為96.67%,此時莖稈細長,基部愈傷呈球狀(圖1a),較大較硬,葉片較薄,顏色發黃,長勢不佳(圖1b)。表4外植體萌芽率結果實施例4一種沼澤小葉樺的離體芽快繁方法,同實施例2,其中分別于2013年3~7月份取當年生新芽,經70%酒精處理20s,再用0.1%hgcl2處理10min后,接種于ms+6-ba1.0mg/l+1.0g/lpvp。每個處理15瓶,每瓶3個外植體,接種25d后統計污染率、死亡率及啟動率。由圖2可以看出外植體的污染率呈先降低后升高的趨勢,在4月份取最低值為30%,到7月份污染率最高為66.67%;成活率曲線先升高后緩慢降低,4月份的成活率為70%,5月份成活率為73.33%,然后緩慢下降,7月份雖有66.67%,但明顯高出3月的成活率很多。外植體的死亡率在3月份最高,5月份最低,6、7月份稍有增加,但仍明顯低于3月份。綜合3條曲線來看,外植體的最佳取材時間為4月底至5月底。實施例5一種沼澤小葉樺的離體芽快繁方法,同實施例3,其中于4月下旬取主枝和側枝的頂芽和側芽,經70%酒精處理20s,在用0.1%hgcl2處理10min后,接種于ms+6-ba1.0mg/l+1.0g/lpvp。每處理15瓶,每瓶3個外植體,接種后25d統計污染率、死亡率、啟動率及外植體生長狀況。對比不同取材部位外植體萌動情況如表5,結果表明主枝頂芽的萌芽率最高達83.33%,與主枝側芽、側枝頂芽的萌芽率沒有顯著差異,而與側枝側芽的萌芽率50%差異顯著,并且其萌動快、葉色綠、苗健壯,是最佳的取材部位。由于頂芽的頂端優勢,使得側枝頂芽的萌芽率73.33%與主枝上營養較為充足的側芽萌芽率76.67%間差異不顯著,外植體生長狀況較好,可以作為摘取外植體的選擇部位。因此,此試驗應選取主枝頂芽、主枝側芽、側枝頂芽為外植體,三者平均萌芽率為77.77%。表5不同取材部位外植體萌動情況比較不同部位萌芽率(%)苗高生長狀況主枝頂芽83.33±14.14a3.5cm萌動快,后期苗高生長快,健壯主枝側芽76.67±4.72a2.8cm萌動慢,長勢較均勻,苗高較低側枝頂芽73.33±9.42ab3.2cm萌動較快,苗高生長較快,較健壯側枝側芽50.00±4.71b2.5cm萌動慢,長勢較弱,苗高較低實施例6一種沼澤小葉樺的離體芽快繁方法,同實施例2,其中在增殖培養階段,以ms為基本培養基,添加6-ba、naa,濃度及組合配比如(表6),每處理10瓶,每瓶3個外植體,定期觀察芽的長勢,培養25d后,統計增殖芽的數目,并計算增殖系數。不同濃度的6-ba和naa對繼代苗增殖的影響如表6所示,4號處理組合即ms+0.6mg/l6-ba+0.02mg/lnaa的增殖系數最高,增殖系數達3.70,顯著高于其他處理組合;其次是8號處理,增殖系數為3.40;再次優選處理組合為3號,即ms+0.4mg/l6-ba+0.02mg/lnaa,增殖系數為2.80;增殖系數最小的是13號組合ms+0.05mg/l6-ba+1.5mg/lnaa,增殖系數僅為1.07。試驗過程中,繼代苗的生長狀態相差很大。1~4號處理中繼代苗基部無愈傷產生,形成腋芽及叢生芽,且長勢良好;13~16號處理中,繼代苗基部腫大,有愈傷組織形成,愈傷組織上產生大量的不定根,并且下部葉片的切口和葉脈處也形成了大量的不定根,不定根較短,外披絨毛,植株葉片發黃,長勢不佳,可以看出此類不定根的吸收功能較差。表6植物生長調節劑對繼代苗增殖的影響編號6-banaa增殖系數10.10mg/l0.02mg/l1.53±0.12defg20.20mg/l0.02mg/l1.80±0.36d30.40mg/l0.02mg/l2.80±0.18c40.60mg/l0.02mg/l3.70±0.14a50.10mg/l0.05mg/l1.20±0.09ij60.20mg/l0.05mg/l1.50±0.17efg70.40mg/l0.05mg/l1.70±0.50edf80.60mg/l0.05mg/l3.40±0.18b90.10mg/l0.10mg/l1.27±0.13ij100.20mg/l0.10mg/l1.53±0.13defg110.40mg/l0.10mg/l1.67±0.07edf120.60mg/l0.10mg/l1.77±0.12de130.05mg/l1.50mg/l1.07±0.06j140.10mg/l1.50mg/l1.17±0.06ij150.15mg/l1.50mg/l1.43±0.09fgh160.20mg/l1.50mg/l1.17±0.08ij實施例7一種沼澤小葉樺的離體芽快繁方法,同實施例2,其中在生根培養階段,選用材料為1.5~2.0cm,較健壯、長勢一致的無根苗。選用1/3ms培養基、1/2ms培養基和ms培養基作為不同處理,相互對照。每個處理20瓶,每瓶3株無根苗,進行生根培養。25d后統計每個處理的生根率、平均生根條數、平均根長和植株生長狀況。待小苗長至2.0~3.0cm,接種到生根培養基中進行生根培養。一周左右在無菌苗的基部產生白色點狀突起,隨著時間的延長,這些點狀突起繼續伸長,長出白色的根。表7中可以看出,1/3ms培養基生根較早,生根率為86.67%,但平均生根條數和根的長度均較1/2ms和ms培養基的少和短,并且由于大量元素的不足,無菌苗莖稈細長葉片發黃,植株長勢不佳。1/2ms培養基的生根率最高,為90.0%,但平均生根條數低于ms培養基,且沒有側根形成。ms培養基的生根率較低,但無菌苗植株健壯,根較粗有側根形成,長勢良好。表7不同培養基對生根的影響以1/2ms培養基和ms培養基以及不同濃度的naa組合成10個處理(表8),每個處理接種10瓶,每瓶3個外植體,25d后統計各處理的生根率、平均生根數、平均根長以及植株生長狀況。表8生根培養基中naa濃度添加量處理號1/2ms(mg/l)ms(mg/l)10.1-20.5-31.0-41.5-52.0-6-0.17-0.58-1.09-1.510-2.0不同濃度的naa對生根的影響如表9和圖3a、圖3b所示,以1/2ms為基本培養基時,隨著naa濃度的增加,無菌苗的生根率逐漸降低,最高94.44%,最低為61.11%;平均生根數逐漸升高,最低3.12,最高9.45;根長下降趨勢明顯,最長為4.0~4.5cm,最短1.5~2.0cm;以ms為基本培養基時,除生根率先升高后降低外,平均生根數、根長范圍的變化規律均與1/2ms培養基一致。結果表明,naa在調節沼澤小葉樺無菌苗生根過程中起著重要的促進所用,,但濃度高于1.0mg/l時,無菌苗基部愈傷較大,分化出大量的根,這些根呈短粗的錐形,土黃色或淺紅色,根尖紅色,暴露在培養基外部的根有絨毛,上部植株矮小,葉片枯黃,發育不良。控制naa濃度在0.1~0.5mg/l時促進單株生根,促進根長生長。表9不同濃度naa對生根的影響以ms為基本培養基,添加不同濃度的多效唑(表10),研究多效唑對生根的影響。每個處理接種8瓶,每瓶3株無根苗,25d后統計各處理的生根率、平均生根條數、平均根長及植株生長狀況。多效唑對無菌苗生根的作用見表10和圖3c、圖3d,相對于零添加的ms培養基,0.25mg/l的多效唑對無菌苗生根具有促進作用,可使生根率達83.33%,平均生根數為3.40,根長稍短縮,為2.5~3.0cm。多效唑濃度增加,生根率呈逐漸降低至33.33%,根伸長減短至1.0cm以下,而已生根的無菌苗平均生根數變化規律不明顯。多效唑的應用,使得無菌苗植株節間短縮,株高生長不明顯,苗高在1.5~2.5cm間;每株3~6片葉不等,葉片生長受到抑制,較小較厚,葉色深綠;基部無愈傷組織形成,根較短較粗,呈均勻短棒形,隨時間的延長由米白色漸變為褐色或黑色,發生老化。表10不同濃度多效唑多生根的影響將優選的基本培養基和添加naa、多效唑的優選生根培養基進行差異顯著性分析如表11,添加naa的2、3、5、6號培養基的生根率與其他培養基差異顯著,生根率最高為97.30%;就平均生根比較,3、5、6、8號培養基明顯優于其他生根方法,平均生根最多的為8號處理,3.93,其次是6號處理平均生根3.83;多效唑的添加明顯抑制了根的伸長生長,最佳處理為添加naa的2、3、5、6號培養基。對比分析,得出最佳生根培養方法是6號處理,即ms+0.5mg/lnaa,獲得無菌苗植株健壯,株高5.0~6.0cm,葉片綠色,根星狀分布,白色,細長,部分有側根形成。表11優選生根培養基的對比分析編號生根方法生根率/%生根數(條)根長(cm)11/2ms90.00±2.36b2.78±0.65d3.75±0.54a21/2ms+0.1mg/lnaa94.44±2.21a3.12±0.11cd4.25±0.26a31/2ms+0.5mg/lnaa94.44±0.85a3.59±0.12abc4.25±0.42a4ms81.66±1.75c2.90±0.22d3.75±0.21a5ms+0.1mg/lnaa94.44±3.56a3.71±0.15ab4.25±0.39a6ms+0.5mg/lnaa97.30±1.46a3.83±0.14ab4.25±0.23a7ms+0.25mg/l多效唑83.33±3.00c3.40±0.64bc2.75±0.22b8ms+0.5mg/l多效唑77.78±1.04d3.93±0.13a1.25±0.23c當前第1頁12
相關技術
網友詢問留言
已有0條留言
- 還沒有人留言評論。精彩留言會獲得點贊!
1