包含龍眼肉提取物作為有效成分的骨疾病的預防、改善或治療用組合物的制作方法
本發明是在韓國農林畜產食品部的援助下基于課題編號114030-3而提出的,上述課題的研究管理專門機構為農林水產食品技術企劃評價院,研究項目名稱為“高增食品技術開發項目”,研究課題名稱為“具有骨形成促進作用的骨健康(骨質疏松癥)改善功能性食品材料開發”,主管機構為安德太生物科技株式會社,研究期間為2014年08月01日至2014年07月31日。本專利申請主張2014年4月4日向韓國特許廳提交的韓國專利申請第10-2014-0040678號的優先權,上述專利申請的揭示內容均作為參照插入于本說明書。本發明涉及骨質疏松癥的預防、改善或治療用組合物。
背景技術:
:骨密度的減少在閉經期之后的女性中發生較多,65歲以上的女性中有2名中的1名,男性的情況下有5名中的1名發生骨密度的減少,并誘發骨質疏松癥。骨質疏松癥在世界上發病率僅次于心血管類疾病且可能發生骨折的危險的疾病。目前有多種骨質疏松癥的治療劑處于銷售中,例如對閉經期的女性主要處方的雌性激素制劑、二膦酸鹽(bisphosphonate)制劑及甲狀旁腺激素制劑等,然而存在乳腺癌的發病危險率上升或給藥方式繁瑣且導致消化系統的異常反映等副作用的問題。骨質疏松癥治療劑分為骨形成抑制劑和骨形成促進劑。骨形成抑制劑作為用于調節起到破壞骨質的作用的破骨細胞(osteoclast)的形成或活性的治療劑,包括二膦酸鹽(bisphosphonates)、選擇性雌激素受體調節劑(SERM)、降血鈣素(calcitonin)等,骨形成促進劑包括甲狀旁腺激素劑(parathyroidhormone,PTH)、氟素劑等。然而,至今開發出的骨質疏松癥治療劑中除了甲狀旁腺激素劑以外,骨形成作用微乎其微,只不過是預防、改善癥狀的發展的效果,不能起到治療效果。可通過抑制破骨細胞(osteoclast)的活性或誘導參與骨的新生的成骨細胞(osteoblast)的活性增加來抑制骨密度的減少。其中,作為增加成骨細胞的活性的物質主要使用甲狀旁腺激素類,然而在動物模型中發現可能誘發骨癌的可能性,因此使用期限限制為最長一年半。為了開發抑制骨密度的減少的治療劑,目前正進行關于低密度脂蛋白受體相關蛋白5(LRP-5)的拮抗劑(agonist)的研究,然而到目前為止還處于學術水平,且沒有關于低分子化合物的報告。據報告,用于抑制GSK-3β的活性的LiCl或作為低分子化合物的Chir99021或LY603281-31-8促進成骨細胞的分化,然而到目前為止還是處于學術水平。因此,為了骨質疏松癥患者,需要開發能夠以骨形成過程的信號傳遞機制為基礎促進成骨細胞的分化的新穎的物質。本說明書全文中,參照多篇的論文及專利文獻,并表示其引用內容。所引用的論文及專利文獻的揭示內容,作為參照全部插入于本說明書中,而將更加明確地說明本發明所屬
技術領域:
的水準及本發明的內容。技術實現要素:技術問題本發明人為了開發用于治療骨疾病的對人體安全且能夠促進成骨細胞的分化的新穎的物質而努力研究。其結果,發現了龍眼肉提取物對細胞無毒性且能夠促進成骨細胞的分化,由此完成了本發明。因此,本發明的目的在于,提供骨疾病的預防、改善或治療用組合物。本發明的另一目的在于,提供骨疾病的預防、改善或治療方法。將通過發明的具體實施方式、發明要求保護范圍及附圖,更明確地說明本發明的其他目的及優點。解決問題的手段根據本發明的一實施方式,本發明提供包含龍眼肉提取物作為有效成分的骨疾病的預防、改善或治療用組合物。根據本發明的再一實施方式,本發明提供骨疾病的預防、改善或治療方法,其包括向對象(subject)給藥包含龍眼肉提取物或其分餾物的有效量的組合物的步驟。本發明人為了預防、改善或治療骨疾病,而努力研究開發能夠促進成骨細胞的分化的物質。其結果,發現了龍眼肉提取物無毒性且能夠促進成骨細胞的分化。龍眼肉(LonganArillus)為龍眼(DimocarpuslonganLoureiro)的假種皮(aril),通常黏糊附著有多個縱向破裂的不規則的薄片,長度為2-4cm,寬度為1-2cm,厚度為2-4mm。外部面為深赤褐色或者黑褐色且半透明,一面褶皺而不均勻,另一面潤澤并具有縱向皺紋。質感柔軟且具有粘性。傳統醫學中,龍眼肉通常用于心重而心跳不規則或者健忘癥、失眠癥、消化不良及便稀等癥狀。藥理作用包括疥瘡(Scabies)抑制、強壯作用、抗氧化作用、免疫功能活性化作用等。龍眼肉又稱為桂圓、鮫淚、蜜脾、亞荔枝、驪珠、燕卵、龍眼、龍眼乾、圓眼、元眼肉、益智、川彈子及荔枝奴。本發明的組合物包含龍眼肉提取物作為有效成分。本說明書中提及龍眼肉時所使用的術語“提取物”不僅意味著對龍眼肉進行提取溶劑處理而得的提取結果物,而且包括將龍眼肉制備成能夠直接向動物給藥的劑型化(例如,粉末化)的龍眼肉加工物。本發明的組合物中利用的龍眼肉提取物可對龍眼肉進行多種提取溶劑處理而得。具體地,可利用極性溶劑及非極性溶劑。極性溶劑優選地包括(i)水;(ii)醇(甲醇、乙醇、丙醇、丁醇、正丙醇、異丙醇、正丁醇、1-戊醇、2-丁氧基乙醇或乙二醇);(iii)乙酸;(iv)二甲基甲酰胺(DMFO,dimethyl-formamide)以及(V)二甲亞砜(DMSO,dimethylsulfoxide)。非極性溶劑優選地包括丙酮、乙腈、乙酸乙酯、乙酸甲酯、氟代烷、戊烷、己烷、2,2,4-三甲基戊烷、癸烷、環己烷、環戊烷、二異丁烯、1-戊烯、1-氯丁烷、1-氯戊烷、鄰二甲苯、二異丙醚、2-氯丙醇、甲苯、1-氯丙醇、氯苯、苯、二乙醚、二乙硫、三氯甲烷、二氯甲烷、1,2-二氯乙烷、苯胺、二乙胺、醚、四氯化碳、四氫呋喃(THF)。進而優選地使用水或C1至C4的醇,最優選地使用水、乙醇或甲醇來提取。并且,上述提取溶劑優選地添加原材料的總量的兩倍至十倍來提取,更加優選地添加三倍至五倍來提取,但并不局限于此。如上所示,本說明書中所使用的術語“提取物或其分餾物”意味著本領域中的對粗提物(crudeextract)及提取物的追加分餾(fractionation)的分餾物。即,龍眼肉提取物不僅包括利用如上所示的提取溶劑得到的,還包括對此追加地進行提純過程的。例如,使上述提取物通過具有規定的分子量截留(cut-off)值的超濾膜獲得的分餾物、利用多種層析法(基于根據大小、電荷、疏水性或親水性的分離制造)的分離等通過追加實施的多種提純方法獲得的分餾物也包括在本發明的龍眼肉提取物。根據本發明的一例,利用甲醇提取之后,利用己烷、乙醚、二氯甲烷、丁醇來追加獲得分餾物。本發明中所利用的龍眼肉提取物可使用超臨界提取、亞臨界提取、高溫提取、高壓提取及超聲波提取法等提取裝置的方法或者利用包含XAD及HP-20的吸附樹脂的方法等本領域中的常規提取方法來制備。具體地,可進行加溫并進行回流提取或常溫提取來制備,但并不局限于此。另一方面,提取次數優選為一次至五次,進而優選為三次,但并不局限于此。本發明的組合物中,對龍眼肉提取物的含量不進行限制。本發明的組合物可制備為藥劑學組合物。具體地,本發明的組合物是一種藥劑學組合物,其包含:(a)本發明的龍眼肉提取物的藥劑學有效量;以及(b)藥劑學上可接受的載體。本說明書中的術語“藥劑學有效量”能夠達成龍眼肉提取物的功效的充分的量。在本發明的組合物制備為藥劑學組合物的情況下,本發明的藥劑學組合物包含藥劑學上可接受的載體。本發明的藥劑學組合物中所包含的藥劑學上可接受的載體為在制劑通常利用的載體,包含乳糖、葡萄糖、蔗糖、山梨糖醇、甘露醇、淀粉、阿膠、磷酸鈣、藻酸鹽、凝膠、硅酸鈣、微晶纖維素、聚乙烯吡咯烷酮、纖維素、水、糖漿、甲基纖維素、羥基苯甲酸甲酯、丙基苯甲酸甲酯、滑石、硬脂酸鎂以及礦油等,但并不局限于此。除了上述成分以外,本發明的藥劑學組合物還可包含潤滑劑、濕潤劑、甜味劑、香味劑、乳化劑、懸浮劑、保存劑等。優選地,藥劑學上可接受的載體及制劑詳細記載于雷明頓制藥科學(Remington'sPharmaceuticalSciences,19thed.,1995)。本發明的藥劑學組合物能夠以口服或非口服方式進行給藥,優選為利用口服給藥方式。本發明的藥劑學組合物的合適的給藥量能夠根據制劑化方式、給藥方式、患者的年齡、體重、性別、病態、飲食、給藥時間、給藥途徑、排泄速度及反應敏感性等因素,以多種方式進行處方。本發明的藥劑學組合物的普通給藥量為以成人為基準,在0.001mg/kg-1000mg/kg的范圍內。本發明的藥劑學組合物根據本發明所屬
技術領域:
的普通技術人員可容易實施的方法,并利用藥劑學上可接受的載體和/或賦形劑來進行制劑化,由此能夠以單位容量形態制備或者內裝于多容量容器內進行制備。此時,劑型可以是油性或者水性介質中的溶液、懸浮液、糖漿劑或者乳化液形態,還可以是浸膏劑、散劑、粉末劑、顆粒劑、錠劑或者膠囊劑形態,還可以包含分散劑或者穩定化劑。本發明的組合物可提供為功能性食品組合物。具體地,本發明的組合物是食品學組合物,其包含:(a)本發明的龍眼肉提取物的食品學有效量;以及(b)食品學上可接受的載體。本發明的組合物制備為食品組合物的情況下,作為有效成分不僅包含龍眼肉提取物,還包含制備食品時通常添加的成分,例如,包含蛋白質、碳水化合物、脂肪、營養素、調味劑及香味劑。上述碳水化合物的例子包含:單糖,例如葡萄糖、果糖等;二糖,例如麥芽糖、蔗糖、低聚糖等;以及多糖,例如糊精、環糊精等常規的糖以及木糖醇、山梨糖醇及赤蘚糖醇等糖醇。作為香味劑可使用天然香味劑(索馬甜、甜葉菊提取物(例如,萊鮑迪甙A、甘草素等))及合成香味劑(糖精、阿斯巴甜等)。例如,在本發明的食品組合物制備為保健飲料的情況下,除了本發明的龍眼肉提取物以外,還可包含檸檬酸、液態果糖、食糖、葡萄糖、醋酸、蘋果酸、果汁、杜仲提取液、大棗提取液、甘草提取液等。發明的效果本發明的簡要特征及優點如下:(ⅰ)本發明提供利用龍眼肉提取物的骨疾病的預防、改善或治療用組合物。(ⅱ)本發明的組合物中作為有效成分的龍眼肉提取物向來用作中藥材,因此安全性優秀。附圖說明圖1為示出從龍眼肉甲醇提取物制備多種分餾物的整個過程的圖表。圖2是為了分析龍眼肉甲醇提取物對細胞的毒性而分析根據龍眼肉甲醇提取物的濃度的細胞生存率的圖表。圖3a是為了分析Saos-2細胞中龍眼肉甲醇提取物的成骨細胞分化促進效果而測定根據龍眼肉甲醇提取物的濃度的堿性磷酸酶活性的圖表。圖3b是為了分析MC-3T3-E1細胞中龍眼肉甲醇提取物的成骨細胞分化促進效果而測定根據龍眼肉甲醇提取物的濃度的堿性磷酸酶活性的圖表。圖3c是為了分析MC-3T3-E1細胞中龍眼肉水或乙醇提取物的成骨細胞分化促進效果而對龍眼肉的水、30%乙醇或50%乙醇提取物進行處理后測定堿性磷酸酶活性的圖表。圖3d是為了分析MC-3T3-E1細胞中龍眼肉水、乙醇提取物的成骨細胞分化促進效果而對多種濃度的龍眼肉水、乙醇提取物進行處理后測定堿性磷酸酶活性的圖表。圖3e是示出MC-3T3-E1細胞中利用多種溶劑分析龍眼肉提取物的成骨細胞分化促進效果的圖表。龍眼肉M是龍眼肉甲醇提取物,龍眼肉H是龍眼肉己烷分餾物,龍眼肉E是龍眼肉乙酸乙酯分餾物,龍眼肉D是龍眼肉二氯甲烷分餾物,龍眼肉B是龍眼肉丁醇分餾物。圖4a是為了分析C2C12細胞中在Wnt3a的存在下龍眼肉甲醇提取物的成骨細胞分化促進效果而測定根據龍眼肉甲醇提取物的濃度的堿性磷酸酶活性的圖表。圖4b是為了分析MC-3T3-E1細胞中在Wnt3a的存在下龍眼肉甲醇提取物的成骨細胞分化促進效果而測定根據龍眼肉提取物的濃度的堿性磷酸酶活性的圖表。圖5是為了分析利用龍眼肉提取物的成骨細胞的鈣無機物的沉積而實施茜素紅染色試驗(AlizarinRedSassay)的圖片。具體實施方式以下,通過實施例對本發明進行更詳細地說明。這些實施例僅用于更具體地說明本發明,根據本發明的主旨,對于本發明所屬
技術領域:
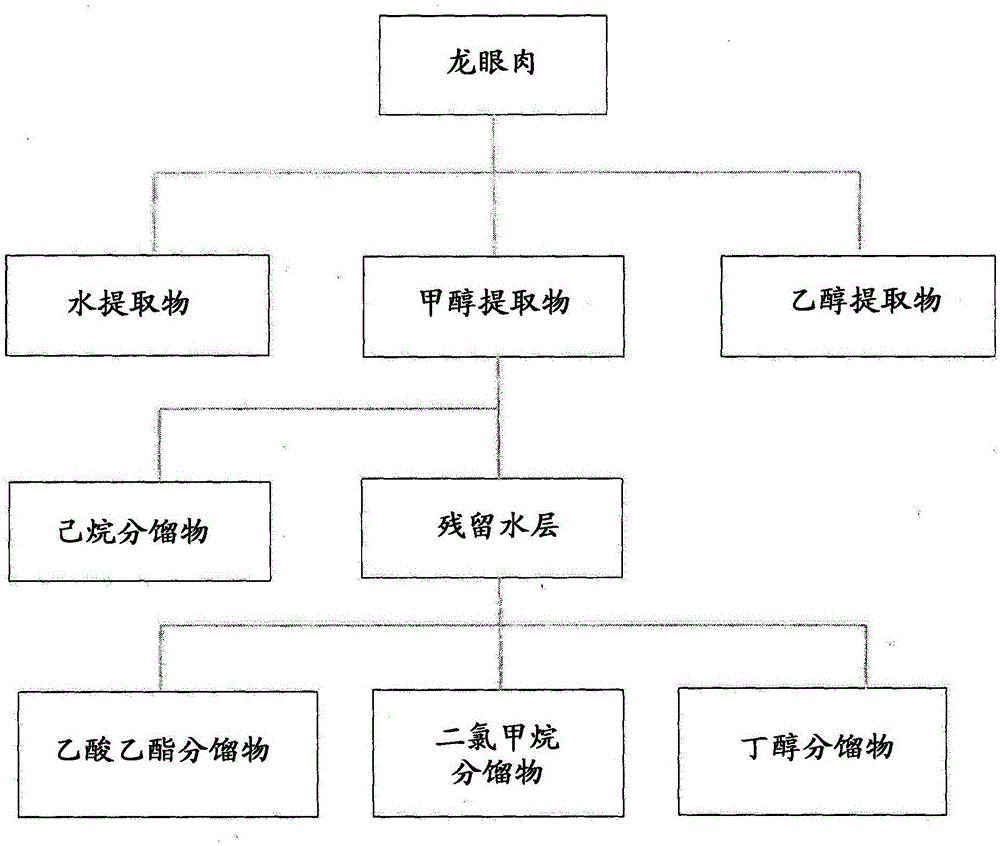
的普通技術人員而言本發明的范圍不局限于這些實施例是顯而易見的。實施例實施例1:從龍眼肉制備甲醇提取物對細致粉碎的龍眼肉(韓國京東市場)原材料20g中添加200ml的甲醇,在65℃進行4小時的一次回流提取之后,在常溫下冷卻30分鐘,利用過濾紙(WhatmanNo.4filterpaper)來去除雜物。接著,利用減壓濃縮機(冰凍干燥器,愛德華茲,美國(Freezedryer,Edwards,USA))使過濾的提取液完全干燥,結果得到12.5g的濃縮物,提取效率為62.5%。之后,以適當濃度在蒸餾水中溶解完全干燥的濃縮物,并用于成骨細胞的分化促進試驗。實施例2:從龍眼肉制備水、乙醇提取物將龍眼肉20g細致粉碎后,對粉碎物分別添加水、30%乙醇、50%乙醇或100%乙醇后,在100℃的溫度下對水提取物進行6小時的一次回流提取,在90的溫度下對30%乙醇、50%乙醇或100%乙醇提取物進行6小時的一次回流提取。使提取物冷卻后進行過濾來去除雜質。接著,利用減壓濃縮機使過濾的提取液進行完全干燥,算出最終干燥物的提取效率,水、30%乙醇、50%乙醇或100%乙醇提取物的提取效率分別為54.1%,59.5%,58.6%,57.2%。實施例3:從龍眼肉制備甲醇提取物的分餾物從龍眼肉甲醇提取物制備多種分餾物,整個制備過程如圖1。將龍眼肉20g細致粉碎后,添加200ml的甲醇,在65℃的槽(bath)進行4小時的回流提取。利用減壓濃縮機來在上述甲醇總提取液中完全去除溶劑后,分別添加200ml的己烷(Hexane)和蒸餾水(DW),進行層分離來回收己烷層。利用回收后留下的殘留水層,分別通過如下的方法制備分餾物。對殘留水層添加200ml的乙酸乙酯(Ethylacetate),通過相同的方法進行層分離來回收乙酸乙酯層。對殘留水層添加200ml的二氯甲烷(Dichloromethane)并進行層分離來回收二氯甲烷層。對殘留水層添加200ml的丁醇(n-Butanol)并進行層分離來回收丁醇層和水層。為了算出不同溶劑的提取效率,對各個步驟中獲得的分餾物進行減壓干燥,以濃縮物的重量為基準算出提取效率(表1)。表1提取溶劑濃縮物重量(g)提取效率(yield)甲醇12.562.5%丁醇0.162.8%二氯甲烷0.080.4%乙酸乙酯0.10.5%己烷0.140.7%實施例4:龍眼肉提取物的細胞毒性測定試驗中所使用的C2C12細胞株來自韓國細胞株銀行(KCLB)。C2C12細胞的培養所需的培養基使用杜爾伯科改良伊格爾培養基(Dulbecco'smodifiedEaglesmedium,DMEM),培養基中添加的抗生劑(120μg/ml青霉素、200μg/ml鏈霉素)及胎牛血清(fetalbovineserum,FBS)使用海克隆(Hyclon,Logan,UT)的產品,在37℃、5%的CO2條件下進行培養。將C2C12細胞以2×104/孔分株在96孔板(Greinerbio-one)并培養24小時后,分別以0.1%、0.5%及1.0%濃度處理龍眼肉甲醇提取物(50㎎/ml)。之后再培養48小時后,使用細胞生存率分析試劑盒(LuminescentCellViabilityAssaykit,Promega)分析細胞生存率。利用VICTORTMX3(珀金埃爾默,PerkinElmer)測定發光,以百分比表示對照組的細胞生存率。試驗結果,將龍眼肉甲醇提取物的濃度提高至1.0%處理也對細胞生存率幾乎沒有影響(圖2)。由此確認到本發明的龍眼肉甲醇提取物至少1.0%的濃度細胞無毒性。實施例5:測定利用龍眼肉提取物的成骨細胞分化促進效果為了測定通過多種方法測定的龍眼肉提取物的成骨細胞分化促進效果,分析了在細胞株中利用龍眼肉提取物的堿性磷酸酶(alkalinephosphatase,ALP)的活性變化。堿性磷酸酶(alkalinephosphatase,ALP)存在于所有組織,尤其在骨組織中存在的堿性磷酸酶的活性在骨成長活潑時會增加,因此堿性磷酸酶的活性用作得知成骨細胞的活性的生物標記。對作為骨癌(osteosarcoma)的Saos-2細胞株及作為成骨細胞前體(osteoblastprecursor)的MC-3T3-E1細胞株進行龍眼肉提取物處理后,測定堿性磷酸酶活性來分析龍眼肉提取物對成骨細胞的活性產生的影響。實驗中所使用的Saos-2細胞株及MC-3T3-E1細胞株來自韓國細胞株銀行(KCLB)。Saos-2細胞的培養所需的培養基使用RPMI1640培養基,培養基中添加的抗生劑(120μg/ml青霉素、200μg/ml鏈霉素)及胎牛血清(fetalbovineserum,FBS)使用海克隆(Hyclon,Logan,UT)的產品,MC-3T3-E1細胞的培養所需的MEM-α培養基使用賽默飛世爾(LifeTechnologies)的產品。所有細胞都在37℃、5%的CO2條件下進行培養。將Saos-2細胞或MC-3T3-E1細胞以2×104/孔分別分株在96孔板(Greinerbio-one)并培養24小時后,利用多種方法提取的龍眼肉提取物進行處理。之后再培養72小時后,去除培養基并使用磷酸鹽緩沖液(PBS)清洗一次后,利用被動裂解液(Passivelysisbuffer,Promega)使細胞溶解30分鐘。使用Phospha-LightTM報告基因檢測系統(ReporterGeneAssaySystem)(美國應用生物系統公司,AppliedBiosystem)來分析溶解的上清液的堿性磷酸酶活性。利用VICTORTMX3(PerkinElmer)測定發光。此時,細胞數的差異可能影響堿性磷酸酶活性度,因此利用剩下的上清液實施蛋白質定量,利用蛋白質濃度補正來算出堿性磷酸酶活性度。以0.5%、1%的濃度處理實施例1的龍眼肉甲醇提取物(50mg/ml)的情況下,確認到Saos-2細胞(圖3a)及MC-3T3-E1細胞(圖3b)均濃度依賴性地促進堿性磷酸酶活性。實施例2中制備的龍眼肉提取物(50mg/ml)或30%、50%乙醇提取物(50mg/ml)分別以最終濃度0.2%、0.5%處理,其結果,在MC-3T3_E1細胞可確認到堿性磷酸酶的促進活性增加1.5-2倍(圖3c)。為了進而分析水或乙醇提取物的效果,利用多種濃度的水或乙醇(100%)提取物處理MC-3T3_E1細胞后,測定了堿性磷酸酶活性(圖3d)。分析結果,確認到水或乙醇(100%)提取物的情況下,均濃度依賴性地促進堿性磷酸酶活性。并且,實施例3中制備的龍眼肉己烷分餾物(50mg/ml)、乙酸乙酯分餾物(50mg/ml)及二氯甲烷分餾物(50mg/ml)分別以最終濃度0.5%處理,其結果,在MC-3T3-E1細胞可確認到堿性磷酸酶的促進活性增加(圖3e)。這種結果表示使用多種溶劑提取的龍眼肉提取物或分餾物對成骨細胞的分化促進有效果。實施例6:測定Wnt3a的存在下利用龍眼肉甲醇提取物的成骨細胞分化促進效果為了測定據知為對骨細胞的分化起到重要作用的Wnt信號傳遞機制和龍眼肉提取物之間的協同效應,對C2C12細胞株及MC-3T3-E1細胞株同時處理龍眼肉提取物和包含Wnt3a的培養基,并測定了堿性磷酸酶活性。試驗中所使用的C2C12細胞株、MC-3T3-E1細胞株及分泌Wnt3a的L細胞株來自韓國細胞株銀行(KCLB)。C2C12細胞及MC-3T3-E1細胞以如上所示的方式培養。分泌Wnt3a的L細胞株利用包含10%的胎牛血清的杜爾伯科改良伊格爾培養基來培養4天后,收集培養液并利用0.22-㎜過濾器進行滅菌。利用新鮮的培養基替換再培養3天之后,收集培養液并利用0.22-㎜過濾器進行滅菌,與之前收集的培養液混合來制備Wnt3a條件培養基(CM,conditionedmedia)。將C2C12細胞或MC-3T3-E1細胞以2×104/孔分別分株在96孔板(Greinerbio-one)并培養24小時后,利用0.5%及1.0%龍眼肉提取物和通過上述方法制備的Wnt3a條件培養基(CM,conditionedmedia)進行處理。之后再培養72小時后,去除培養基并使用磷酸鹽緩沖液(PBS)清洗一次后,利用被動裂解液(Passivelysisbuffer,Promega)使細胞溶解30分鐘。使用Phospha-LightTM報告基因檢測系統(ReporterGeneAssaySystem)(美國應用生物系統公司,AppliedBiosystem)來分析溶解的上清液的堿性磷酸酶活性。利用VICTORTMX3(PerkinElmer)測定發光。此時,細胞數的差異可能影響堿性磷酸酶活性度,因此利用剩下的上清液實施蛋白質定量,利用蛋白質濃度補正來算出堿性磷酸酶活性度。試驗結果,對MC-3T3-E1細胞僅利用Wnt3a處理的情況下堿性磷酸酶活性的增加程度微乎其微,然后與實施例1的龍眼肉甲醇提取物一同處理的情況下,與對照組相比堿性磷酸酶活性增加將近5倍(圖4a)。對C2C12細胞僅利用Wnt3a處理的情況下堿性磷酸酶活性的增加程度微乎其微,然后與實施例1的龍眼肉甲醇提取物一同處理的情況下,與對照組相比堿性磷酸酶活性增加將近2倍(圖4b)。這種結果表示龍眼肉提取物在MC-3T3-E1細胞及C2C12細胞存在Wnt3a的情況下也促進堿性磷酸酶的活性,即,表示龍眼肉提取物在Wnt信號傳遞機制作用的情況下也可促進成骨細胞的分化。實施例7:評價利用龍眼肉甲醇提取物的成骨細胞的鈣沉積(茜素紅染色)為了分析利用龍眼肉提取物的成骨細胞的鈣無機物沉積,對MC-3T3-E1細胞處理多種濃度(0%、0.1%、0.5%、1.0%)的龍眼肉甲醇提取物之后,使細胞培養20天后,利用相差顯微鏡觀察鈣化結節。并且,為了確認成骨細胞的分化與否,利用陰性對照組來分析未包含分化培養基的情況。為了重新確認在顯微鏡上觀察的結節是否為鈣化結節,利用如下的方法實施茜素紅染色試驗。利用3.7%甲醛溶液(formaldehyde)固定MC-3T3-E1細胞后,利用2%茜素紅染色溶液(10%的氫氧化銨(ammoniumhydroxide),PH為4.2)對所固定的細胞進行20分鐘的染色,利用三次蒸餾水清洗后,肉眼與對照組比較觀察紅色的鈣化結節形成與否。分析結果,陰性對照組幾乎觀察不到鈣化結節,未處理龍眼肉的細胞分化對照組及龍眼肉提取物0.1%或0.5%的處理組觀察到的結節程度不顯著。然而,在龍眼肉提取物1.0%處理組的情況下,可確認到與對照組相比結節程度大大增加。通過這種結果可確認到龍眼肉提取物具有在成骨細胞增加鈣無機物沉積且增加骨分化的效果(圖5)。以上,詳細說明了本發明的特定部分,對于本發明所屬
技術領域:
的普通技術人員而言,這些具體的說明僅作為優選實例,本發明的范圍并不局限于此是顯而易見的。因此,應視為本發明的實質性范圍根據所附的發明要求保護范圍及其等同物來定義。當前第1頁1 2 3
相關技術
網友詢問留言
已有0條留言
- 還沒有人留言評論。精彩留言會獲得點贊!
1