使用能夠穿透細胞質的完整免疫球蛋白類型的抗體抑制在細胞中活化的RAS的方法及其用途與流程
本發明涉及使用能夠穿透細胞溶膠的完整免疫球蛋白類型的抗體抑制細胞內活化的(gtp結合的)ras的方法并涉及其用途。
另外,本發明涉及誘導完整免疫球蛋白類型的抗體穿透細胞溶膠且與細胞溶膠中活化的ras結合的重鏈可變區(vh)并涉及包含所述重鏈可變區(vh)的抗體。
另外,本發明涉及使用所述抗體抑制癌癥或腫瘤細胞生長的方法并涉及治療癌癥或腫瘤的方法。
另外,本發明涉及篩選與細胞溶膠中的ras特異性結合的重鏈可變區的方法。
另外,本發明涉及與所述抗體融合且選自以下的生物活性分子:肽、蛋白、小分子藥物、納米粒和脂質體。
另外,本發明涉及用于預防、治療或診斷癌癥的組合物,其包含:所述抗體;或與所述抗體融合且選自以下的生物活性分子:肽、蛋白、小分子藥物、納米粒和脂質體。
另外,本發明涉及編碼所述輕鏈可變區和所述抗體的多核苷酸。
背景技術:
完整免疫球蛋白類型的抗體具有高度穩定的y形結構(分子量:150kda),其由兩條重鏈(50kda)蛋白和兩條輕鏈(25kda)蛋白組成。抗體輕鏈和重鏈分為可變區(其氨基酸序列在抗體間不同)和恒定區(其氨基酸序列在抗體間相同)。重鏈恒定區包括ch1、鉸鏈、ch2和ch3結構域且輕鏈恒定區包含cκ或cλ結構域。抗體重鏈和輕鏈可變區具有氨基酸序列在抗體間特別不同的部分且這些部分構成抗原結合位點且因此也稱為“互補決定區(cdr)”。當檢查抗體的三維結構時,這些cdr形成抗體表面的環。環以下存在結構上支持環的框架區。在重鏈和輕鏈中,分別存在三個環結構且這六個環結構彼此組合且與抗原直接接觸。抗體的重鏈恒定區(fc)通過其與fcrn(新生fc受體)的結合保證在血液中的長半衰期且由于該特征,與小分子藥物不同的是,抗體在機體中可為持久的。另外,抗體與fcγr(fcγ受體)等的結合使其可能特異性地通過抗體依賴的細胞的細胞毒性和補體依賴的細胞的細胞毒性誘導過表達靶物質的細胞的死亡。近來出于治療多種疾病的目的已開發的許多產品可通過多種人源化的方法展現改善的治療效果,如使用人抗體fr(框架)的cdr移植方法從而克服免疫原性。
常規的抗體由于其大尺寸和親水性而不能直接穿透活細胞。因此,最常規的抗體特異性靶向細胞外分泌蛋白或細胞膜蛋白(kimsj等人,2005)。一般的抗體和大分子生物藥物具有的局限在于其不能穿過疏水細胞膜且因此不能結合且抑制多種疾病相關物質。一般而言,在用于與機制如細胞生長、特異性抑制等有關的研究的實驗中使用的特異性地與細胞內物質結合的商業抗體不能直接用于處理活細胞且為使這些抗體結合細胞內物質,通過細胞膜滲透方法使用兩親糖苷皂苷的在細胞膜中形成孔的預處理過程是必須的。小分子物質、核酸或納米粒等可通過使用多種試劑或方法如電穿孔或熱激轉運到活細胞中,但由于上述的大多試劑和實驗條件負面影響蛋白或抗體的特征三維結構,蛋白或抗體可喪失其活性。已開發了特異性地與細胞內蛋白結合且抑制其活性的細胞內抗體(胞內抗體),但這些抗體還不具有穿透活細胞的膜的能力且因此僅可應用于基因療法且其在未來的應用性非常有限(manikandanj等人,2007)。
與多種類型的抗體片段包括如上文所述的完整免疫球蛋白類型的抗體、大分子物質如重組蛋白等不同的是,小分子物質由于其小尺寸和疏水性質容易且有效地穿透活細胞。然而,為使小分子藥物與多種細胞中的疾病相關物質特異性結合,需要靶物質的表面具有疏水口袋。具有該疏水口袋的靶物質僅形成細胞中總的疾病相關物質的約10%且由于該原因,小分子藥物不能特異性地靶向大多細胞中的致病性蛋白(imaik等人,2006)。
在多種疾病包括癌癥中,存在在細胞中的蛋白-蛋白相互作用(ppi)中發揮重要作用的蛋白或與轉錄或信號相關的多種蛋白的突變和異常過表達。這樣的蛋白中,通過其大和平的表面顯示復雜的相互作用的與疾病特別相關的物質難以特異性地通過如上文所述的小分子藥物抑制(blundell等人,2006)。例如ras,其為細胞溶膠重要的腫瘤相關因子之一(目前尚不存在治療劑),作為通過細胞膜受體傳輸細胞外信號至細胞內信號系統的分子開關發揮作用。在約30%的人類癌癥特別是結腸直腸癌和胰腺癌中,ras在細胞中總是由于癌癥相關突變活化且這樣的致癌相關突變已知為賦予常規抗癌療法強抗性的主要腫瘤相關因子(scheffzekk等人,1997)。
在克服目前的技術限制的嘗試中,已實施多項研究以為可有效抑制蛋白-蛋白相互作用的抗體片段或大分子物質賦予細胞穿透能力。發現了具有堿性氨基酸序列和疏水或兩親性質的蛋白轉導結構域(ptd)具有穿透活細胞的能力(leenan等人,2007)。另外,已作出許多嘗試以使蛋白轉導結構域與多種類型的抗體片段通過基因工程化方法融合從而識別特異性細胞內蛋白。然而,大多融合蛋白不從動物細胞分泌且僅以非常小的量釋放到上清中(nakajimao等人,2004)且具有富集精氨酸的蛋白轉導結構域的融合蛋白具有的問題是其在產生過程中弱抵抗宿主弗林蛋白酶(chauhana等人,2007)。另外,存在的問題是融合蛋白的細胞穿透效率低,使得難以將這些融合蛋白開發成為治療性抗體(falnesp等人,2001)。在克服表達相關問題的嘗試中,已進行研究以在蛋白純化后通過化學共價鍵或生物素-鏈霉親和素鍵融合細胞穿透結構域,但這些方法導致蛋白的結構變形。
另外,使用一些自身抗體實施的研究報導了抗體和短鏈可變區(scfv)抗體片段可通過胞吞作用穿透進入細胞。自身抗體是在具有自身免疫疾病的人和小鼠中發現的抗dna抗體且這些抗體中的一些具有穿透活細胞的特征(michaelr等人,1995;michaelp等人,1996;jeskezackd等人,1996)。至今報導的穿透細胞的自身抗體在其引入細胞后大多定位于核且已積極進行研究以將這些穿透細胞的自身抗體與在核中顯示效應的特定蛋白融合(weisbart等人,2012)。然而,蛋白通過使用自身抗體穿透進入活細胞具有的局限是蛋白最終定位于核且因此不能特異性地與胞內細胞溶膠中的多種疾病相關物質結合且抑制其活性。
天然存在的大分子物質中,具有穿透細胞的性質的典型物質包括病毒(hiv、hsv)、毒素(霍亂毒素、白喉毒素)等。已知這些物質通過為細胞內活躍的轉運機制的胞吞作用穿透細胞。該胞吞作用主要分為三種途徑:通過由配體結合參與受體內化的網格蛋白的胞吞作用;在一些毒素如霍亂毒素中發現的通過小窩的胞吞作用;和在葡聚糖、埃博拉病毒等中發現的巨吞飲。其中網格蛋白和小窩參與的胞吞作用主要開始于當分布在細胞膜上的受體與特異性配體結合時。網格蛋白定位于細胞膜的內表面。當物質與受體結合時,網格蛋白使得纖維殼形成囊泡,其運動進入細胞。小窩通過小窩蛋白-1的作用形成低聚體同時形成運動進入細胞溶膠的穩定囊泡(小窩體)。在巨吞飲中,細胞膜的一部分突出以圍繞物質由此形成運動進入細胞溶膠的大染色體(gerber等人,2013)。其他內體逃逸機制不存在時,通過這樣的胞吞作用通路穿透細胞溶膠的物質大多通過溶酶體通路降解。
為避免通過溶酶體通路的降解,病毒、毒素等具有的機制是通過該機制其從內體逃逸進入細胞溶膠。盡管內體逃逸機制尚不清楚,至今已知三種內體逃逸機制的假設。第一種假設的機制是通過該機制形成內體膜中發現的孔。在該假設中,內體膜中的物質如陽離子兩親肽與帶負電荷的細胞脂質雙層結合以引起內部壓力或內膜收縮由此形成桶形孔或環形通道(jenssen等人,2006)。第二種假設的機制是通過該機制內體破裂成為質子海綿效應的結果。在該假設中,由于具有質子化氨基的物質的高緩沖效應,內體的滲透壓可增加從而內體膜可降解(lin和engbersen,2008)。在第三種假設中,特定的基序(其在中性環境中維持親水線圈形狀但在酸性環境如內體中變為疏水螺旋結構)通過與內體的膜融合從內體逃逸(horth等人,1991)。然而,基于上述假設所實施的證明多種天然存在的物質的內體逃逸機制的研究仍不充分。
因此,本發明的發明人構建了重鏈可變區(vh)文庫以選擇具有與活化的ras特異性結合的能力的重鏈可變區(vh)且將具有人源化的輕鏈可變區(vl)的輕鏈(其穿透活細胞且定位與細胞溶膠中)與所選重鏈可變區(vh)共表達由此構建了完整免疫球蛋白類型的抗ras的穿透細胞溶膠的抗體(imab(內化和干擾單克隆抗體)),其可穿透活細胞且與細胞溶膠中活化的ras特異性結合。
另外,本發明的發明人開發了穿透細胞且定位在細胞溶膠中的人源化的輕鏈可變(vl)單結構域以發明穿透活細胞且定位在細胞溶膠中的完整免疫球蛋白類型的抗體。另外,為構建穩定的完整免疫球蛋白類型的單克隆抗體,本發明的發明人改進了局域穿透細胞溶膠的能力的單鏈可變單結構域(vl)抗體片段從而其容易與多種人重鏈可變區(vh)相互作用并結合同時保持其穿透細胞且定位在細胞溶膠中的能力由此開發穿透細胞且定位在細胞溶膠中的完整免疫球蛋白類型的單克隆抗體。
另外,本發明的發明人發現了穿透細胞溶膠的抗ras單克隆抗體穿透多種ras依賴性癌細胞系且通過特異性地中和細胞溶膠中的ras抑制細胞生長且發現了即使當抗體與肽融合用于賦予腫瘤組織特異性時,其在ras依賴的腫瘤中展現特異性抑制活化的ras的活性而不負面影響穿透細胞溶膠和中和活化的ras的能力由此完成了本發明。
技術實現要素:
技術問題
因此,本發明的目的是提供使用能夠穿透細胞溶膠的完整免疫球蛋白類型的抗體抑制細胞內活化的ras的方法。
本發明的另一個目的是提供誘導完整免疫球蛋白類型的抗體穿透細胞溶膠且與細胞溶膠中活化的ras結合的重鏈可變區(vh)和包含所述重鏈可變區(vh)的抗體。
本發明的另一個目的是提供使用所述抗體抑制癌癥或腫瘤細胞生長的方法和用于治療癌癥或腫瘤的方法。
本發明的另一個目的是提供對與細胞溶膠中的ras特異性結合的重鏈可變區進行篩選的方法。
本發明的另一個目的是提供與所述抗體融合且選自以下的生物活性分子:肽、蛋白、小分子藥物、納米粒和脂質體。
本發明的另一個目的是提供用于預防、治療或診斷癌癥的組合物,其包含:所述抗體;或與所述抗體融合且選自以下的生物活性分子:肽、蛋白、小分子藥物、納米粒和脂質體。
本發明的另一個目的是提供編碼所述輕鏈可變區和所述抗體的多核苷酸。
技術方案
為了實現上述目的,本發明提供使用以下完整免疫球蛋白類型的抗體抑制細胞內活化的ras的方法,所述抗體通過胞吞作用和內體逃逸主動穿透活細胞的細胞溶膠,其中所述抗體與細胞溶膠中活化的ras特異性結合。
以下將對本發明進行詳細描述。
本發明的方法通過誘導完整免疫球蛋白類型的抗體穿透細胞溶膠且與細胞溶膠中活化的ras結合的重鏈可變區(vh)抑制細胞內活化的ras。
根據本發明,可誘導完整免疫球蛋白類型的抗體通過胞吞作用滲透活細胞的膜且通過內體逃逸定位在細胞溶膠中的輕鏈可變區(vl)允許完整免疫球蛋白類型的抗體穿透細胞膜且定位在細胞溶膠中。
也就是說,本發明的方法提供誘導抗體穿透細胞溶膠且與細胞溶膠中活化的(grp結合的)ras(腫瘤相關因子)特異性結合且抑制ras的活性的方法。
所述抗體可為嵌合、人或人源化抗體。
所述抗體可為igg、igm、iga、igd或ige。例如,所述抗體可為igg1、igg2、igg3、igg4、igm、ige、iga1、iga5或igd且最優選可為igg型單克隆抗體。
在本發明中,完整免疫球蛋白類型的抗體所具有的結構擁有兩條全長輕鏈和兩條全長重鏈且每條輕鏈通過二硫鍵(ss-鍵)與每條重鏈連接。抗體的恒定區分為重鏈恒定區和輕鏈恒定區且重鏈恒定區具有γ、μ、α、δ和ε型及γ1、γ2、γ3、γ4、α1和α2亞類。輕鏈恒定區具有κ和λ型。
本文使用的術語“重鏈”可被理解為包括含有可變區結構域vh和三個恒定區結構域ch1、ch2和ch3的全長重鏈及其片段,所述可變區結構域vh所包含的氨基酸序列具有足以賦予抗原特異性的可變區序列。另外,本文使用的術語“輕鏈”可被理解為包括含有可變區結構域vl和恒定區結構域cl的全長輕鏈及其片段,所述可變區結構域vl所包含的氨基酸序列具有足以賦予抗原特異性的可變區序列。
在本發明的一個實施方案中,抗體可為靶向于細胞溶膠中活化的ras且與其特異性結合的抗體。活化的ras可為gtp結合的腫瘤相關因子且ras可為突變的ras。ras的突變可為與疾病相關的各種突變且其實例包括但不限于在kras、hras或nras的甘氨酸12、甘氨酸13和谷氨酰胺61處發生的取代突變。
完整免疫球蛋白類型的抗體與細胞內活化的ras的結合通過與細胞溶膠中活化的ras特異性結合的重鏈可變區(vh)引起。
在本發明的一個方面,與細胞溶膠中活化的ras特異性結合的重鏈可變區(vh)可包含:
cdr1,其含有與選自以下的氨基酸序列具有至少90%同源性的氨基酸序列:seqidno:8、11、14、17、20、23和26;
cdr2,其含有與選自以下的氨基酸序列具有至少90%同源性的氨基酸序列:seqidno:9、12、15、18、21、24和27;和
cdr3,其含有與選自以下的氨基酸序列具有至少90%同源性的氨基酸序列:seqidno:10、13、16、19、22、25和28。
關于重鏈可變區的序列的信息如下:
在本發明的一個實施方案中,本發明的重鏈可變區可包含seqidno:8的cdr1、seqidno:9的cdr2和seqidno:10的cdr3。
在本發明的一個實施方案中,本發明的重鏈可變區可包含seqidno:11的cdr1、seqidno:12的cdr2和seqidno:13的cdr3。
在本發明的一個實施方案中,本發明的重鏈可變區可包含seqidno:14的cdr1、seqidno:15的cdr2和seqidno:16的cdr3。
在本發明的一個實施方案中,本發明的重鏈可變區可包含seqidno:17的cdr1、seqidno:18的cdr2和seqidno:19的cdr3。
在本發明的一個實施方案中,本發明的重鏈可變區可包含seqidno:20的cdr1、seqidno:21的cdr2和seqidno:22的cdr3。
在本發明的一個實施方案中,本發明的重鏈可變區可包含seqidno:23的cdr1、seqidno:24的cdr2和seqidno:25的cdr3。
在本發明的一個實施方案中,本發明的重鏈可變區可包含seqidno:26的cdr1、seqidno:27的cdr2和seqidno:28的cdr3。
另外,在本發明的優選實施方案中,重鏈可變區(vh)可由選自以下的氨基酸序列構成:seqidno:1至7。
關于重鏈可變區的序列的信息如下:
與ras特異性結合且抑制其活性的重鏈可變區通過以下方法篩選。
在本發明的實施例中,篩選使用以下文庫進行,其中cdr1、cdr2和cdr3區中共18個殘基處的人工突變在所構建的人重鏈可變區(vh)和重鏈恒定區(ch1)彼此融合的狀態下誘導。
在本發明的實施例中,使用其中人重鏈可變區(vh)和重鏈恒定區(ch1)彼此融合的文庫對重鏈可變區進行選擇,其可與活化的(gtp結合的)ras特異性結合,即使在其與穿透細胞溶膠的人源化輕鏈可變區(vl)融合的狀態下。
在本發明的實施例中,krasg12d(一種活化的(gtp結合的)ras突變體)用作靶分子。在一個實施方案中,與癌癥相關的ras突變主要發生在殘基12、13和61處,其中殘基12和13位于ras蛋白的p環中且影響gap(gtp酶活化蛋白)的結合,而gap水解與ras蛋白結合的gtp以誘導蛋白結構變為失活形式。另外,殘基61與gap的水解活性位點結合以防止gtp水解。因此,多種與癌癥相關的ras突變不限于krasg12d突變,這是因為其信號傳導相關區(開關i和開關ii)與rasg12d突變的信號傳導相關區(開關i和開關ii)等同。
另外,在一個實施方案中,nras和hras中范圍在殘基1和殘基165之間的催化結構域與kras中的催化結構域都具有至少85%類似性。在催化結構域中,與下游信號傳導物質結合的開關i(殘基32-38)和開關ii(殘基59-67)與kras中的那些完全一致。然而,范圍在殘基165和殘基189之間的c末端早期結構域具有15%類似性,但是其結構不影響下游信號傳導。因此,所使用的靶分子不限于活化的krasg12d。
在本發明的實施例中,使用酵母細胞表面展示系統針對活化的(gtp結合的)ras以表達重鏈可變區(vh)和重鏈恒定區(ch1)的狀態進行初始篩選。然后fab通過與表達且分泌含有穿透細胞溶膠的輕鏈可變區(vl)和輕鏈恒定區(cl)的輕鏈的酵母進行配對來篩選。
在本發明的一個實施方案中,抗體能夠主動穿透活細胞。該穿透細胞溶膠的能力為通過胞吞作用穿透細胞且然后通過內體逃逸定位在細胞溶膠中的能力。
該穿透細胞溶膠的能力可通過抗體的穿透細胞溶膠的輕鏈可變區(vl)展現。
在本發明的一個實施方案中,輕鏈可變區可包含:
cdr1,其含有與選自以下的氨基酸序列具有至少90%同源性的氨基酸序列:seqidno:32、35和38;和
cdr3,其含有與選自以下的氨基酸序列具有至少90%同源性的氨基酸序列:seqidno:34、27和40。
關于輕鏈可變區的序列的信息如下:
另外,在本發明的一個實施方案中,輕鏈可變區可進一步包含由選自以下的氨基酸序列構成的cdr2或與所述cdr2具有至少90%同源性的序列:seqidno:33、36和39。
在本發明的一個實施方案中,輕鏈可變區可包含seqidno:32的
cdr1、seqidno:33的cdr2和seqidno:34的cdr3。
另外,在本發明的另一個實施方案中,輕鏈可變區可包含seqidno:35的cdr1、seqidno:36的cdr2和seqidno:37的cdr3。
另外,在本發明的另一個實施方案中,輕鏈可變區可包含seqidno:38的cdr1、seqidno:39的cdr2和seqidno:40的cdr3。
在本發明的一個實施方案中,輕鏈可變區可為以下輕鏈可變區,其中由輕鏈可變區的n末端開始編號的第2個和第4個氨基酸分別用亮氨酸(l)和甲硫氨酸(m)取代。
該輕鏈可變區為通過取代第2個和第4個殘基獲得的輕鏈可變區,所述第2個和第4個殘基在位于fr(框架)中的cdr游標區所包含的殘基中就獲得保持其穿透細胞溶膠的能力的cdr結構而言是重要的。
在本發明的一個實施方案中,輕鏈可變區可為以下輕鏈可變區,其中由輕鏈可變區的n末端開始編號的第9個、第10個、第13個、第15個、第17個、第19個、第21個、第22個、第42個、第45個、第58個、第60個、第79個和第85個氨基酸分別用絲氨酸(s)、絲氨酸(s)、丙氨酸(a)、纈氨酸(v)、天冬氨酸(d)、纈氨酸(v)、異亮氨酸(i)、蘇氨酸(t)、賴氨酸(k)、賴氨酸(k)、纈氨酸(v)、絲氨酸(s)、谷氨酰胺(q)和蘇氨酸(t)取代。
該輕鏈可變區為基于以下測序結果獲得的輕鏈可變區,所述測序結果表明共14個殘基不同于曲妥單抗(herceptin),而曲妥單抗在由fda批準的市售人源化抗體中是高度穩定的且包含vh3亞基的重鏈可變區和vκ1亞基的輕鏈可變區。
在本發明的另一個實施方案中,輕鏈可變區可為以下輕鏈可變區,其中由輕鏈可變區的n末端開始編號的第89個和第91個氨基酸分別用谷氨酰胺(q)和酪氨酸(y)取代。
該輕鏈可變區基于對人抗體可變區之間的vh-vl界面殘基進行分析的結果獲得,所述結果表明常規的穿透細胞溶膠的輕鏈可變區的小鼠cdr3中的兩個殘基是不同的。
在本發明的優選實施方案中,輕鏈可變區可包含選自以下的氨基酸序列:seqidno:29、30和31。
關于輕鏈可變區的序列的信息如下:
應該注意的是,在本文提供的seqidno中表示的所有殘基根據kabat編號系統進行編號(kabatea等人,1991)。在本發明的一個實施方案中,抗體與細胞溶膠中活化的ras的結合可抑制活化的ras與b-raf、c-raf或pi3k的結合。
本發明的一個方面提供誘導完整免疫球蛋白類型的抗體穿透細胞溶膠且與細胞溶膠中活化的ras結合的重鏈可變區(vh)。
在本發明的一個方面,重鏈可變區(vh)可包含:
cdr1,其含有與選自以下的氨基酸序列具有至少90%同源性的氨基酸序列:seqidno:8、11、14、17、20、23和26;
cdr2,其含有與選自以下的氨基酸序列具有至少90%同源性的氨基酸序列:seqidno:9、12、15、18、21、24和27;和
cdr3,其含有與選自以下的氨基酸序列具有至少90%同源性的氨基酸序列:seqidno:10、13、16、19、22、25和28。
另外,在本發明的一個實施方案中,重鏈可變區(vh)可包含選自以下的氨基酸序列:seqidno:1至7。
另外,本發明的一個方面提供包含所述重鏈可變區(vh)的抗體。
另外,在本發明的一個實施方案中,抗體為以下抗體,其主動穿透活細胞且與細胞溶膠中活化的ras特異性結合。
所述抗體可為嵌合、人或人源化抗體。
另外,在本發明的一個實施方案中,抗體可為選自以下的任何一種:igg、igm、iga、igd和ige。
另外,抗體可包含能夠穿透細胞溶膠的輕鏈可變區(vl)。穿透細胞溶膠的能力可為通過胞吞作用穿透細胞且然后通過內體逃逸定位在細胞溶膠中的能力。
在本發明的一個實施方案中,輕鏈可變區可包含:
由選自以下的氨基酸序列構成的cdr1或與所述cdr1具有至少90%同源性的序列:seqidno:32、35和38;和
由選自以下的氨基酸序列構成的cdr3或與所述cdr3具有至少90%同源性的序列:seqidno:34、27和40。
在本發明的一個實施方案中,輕鏈可變區可為以下輕鏈可變區,其中由輕鏈可變區的n末端開始編號的第2個和第4個氨基酸分別用亮氨酸(l)和甲硫氨酸(m)取代。
在本發明的一個實施方案中,輕鏈可變區可為以下輕鏈可變區,其中由輕鏈可變區的n末端開始編號的第9個、第10個、第13個、第15個、第17個、第19個、第21個、第22個、第42個、第45個、第58個、第60個、第79個和第85個氨基酸分別用絲氨酸(s)、絲氨酸(s)、丙氨酸(a)、纈氨酸(v)、天冬氨酸(d)、纈氨酸(v)、異亮氨酸(i)、蘇氨酸(t)、賴氨酸(k)、賴氨酸(k)、纈氨酸(v)、絲氨酸(s)、谷氨酰胺(q)和蘇氨酸(t)取代。
在本發明的另一個實施方案中,輕鏈可變區可為以下輕鏈可變區,其中由輕鏈可變區的n末端開始編號的第89個和第91個氨基酸分別用谷氨酰胺(q)和酪氨酸(y)取代。
在本發明的優選實施方案中,輕鏈可變區可包含選自以下的氨基酸序列:seqidno:29、30和31。
本發明的一個方面提供抑制癌癥或腫瘤細胞生長的方法,所述方法包括將受試者的細胞暴露于與細胞溶膠中活化的ras特異性結合的抗體的步驟。
本發明的一個方面還提供治療癌癥或腫瘤的方法,所述方法包括向受試者給藥藥物有效量的與細胞溶膠中活化的ras特異性結合的抗體的步驟。
與細胞溶膠中活化的ras特異性結合的抗體可為以下抗體,其可穿透活細胞且特異性識別細胞溶膠中活化的(gtp結合的)ras且其可靶向于活細胞的細胞溶膠中活化的(gtp結合的)ras且抑制ras的活性。因此,根據本發明的抗體重鏈可變區或包含所述可變區的抗體可選擇性地抑制多種常規腫瘤治療劑的主要藥物抗性相關因子ras的突變且因此可抑制癌癥或腫瘤生長且可治療癌癥或腫瘤。
本發明的另一個方面提供對與細胞溶膠中的ras特異性結合的重鏈可變區進行篩選的方法。
所述篩選方法包括以下步驟:
(1)通過使用酵母表面展示系統表達可與結合有gtp的ras結合的重鏈可變區文庫;
(2)使所述文庫與結合有gtp的ras結合;和
(3)測量所述文庫對結合有gtp的ras的親和力。
本發明的另一個方面涉及與所述抗體融合且選自以下的生物活性分子:肽、蛋白、小分子藥物、納米粒和脂質體。
蛋白可為抗體、抗體片段、免疫球蛋白、肽、酶、生長因子、細胞因子、轉錄因子、毒素、抗原肽、激素、載體蛋白、運動功能蛋白、受體、信號傳導蛋白、儲存蛋白、膜蛋白、跨膜蛋白、內部蛋白、外部蛋白、分泌蛋白、病毒蛋白、糖蛋白、裂解的蛋白、蛋白復合物、化學修飾的蛋白等。
本發明的具體實施方案提供包含seqidno:41的氨基酸序列的rgd4c肽或包含seqidno:42的氨基酸序列的rgd10肽,其與完整免疫球蛋白類型的抗體的輕鏈可變區的n末端融合,其通過穿透細胞溶膠與活化的(ctp結合的)ras特異性結合并對其進行抑制。在一個實施方案中,rgd4c肽通過(g4s)1接頭與輕鏈可變區的n末端融合且優選通過(g4s)1接頭與輕鏈可變區的n末端融合,但是不限于此。
本文使用的術語“小分子藥物”是指分子量小于約1000da且作為對抗疾病的治療劑具有活性的有機化合物、無機化合物或有機金屬化合物。所述術語在本文中以廣義使用。本文中的小分子藥物涵蓋分子量小于約1000da的寡肽和其它生物分子。
在本發明中,“納米粒”是指包含物質的直徑為1-1,000nm的顆粒。納米粒可為金屬納米粒、由金屬納米粒核和包封所述核的金屬殼構成的金屬/金屬核殼復合體、由金屬納米粒核和包封所述核的非金屬殼構成的金屬/非金屬核殼或由非金屬納米粒核和包封所述核的金屬殼構成的非金屬/金屬核殼復合體。根據一個實施方案,金屬可選自金、銀、銅、鋁、鎳、鈀、鉑、磁性鐵及其氧化物,但是不限于此且非金屬可選自硅、聚苯乙烯、膠乳和丙烯酸類物質,但是不限于此。
在本發明中,脂質體包含至少一個包封內部水性小室的能夠自身締合的脂質雙層。脂質體可通過膜類型及其大小表征。小單層囊泡(suv)可具有單膜且直徑可為20-50nm。大單層囊泡(luv)的直徑可為至少50nm。寡層大囊泡和多層大囊泡可具有多重通常是同心的膜層且直徑可為至少100nm。具有數重非同心膜的脂質體(即在較大的囊泡中包含數個小囊泡)稱為多泡囊泡。
本文使用的術語“融合”是指使具有相同或不同功能或結構的兩個分子成為一體且融合方法可包括能夠使腫瘤組織穿透肽與蛋白、小分子藥物、納米粒或脂質體結合的任何物理、化學或生物方法。優選地,融合可通過接頭肽進行且例如接頭肽可介導與生物活性分子在本發明的抗體輕鏈可變區、抗體或其片段的多個位置的融合。
本發明還提供用于預防或治療癌癥的藥物組合物,其包含:所述抗體;或與所述抗體融合且選自以下的生物活性分子:肽、蛋白、小分子藥物、納米粒和脂質體。
癌癥可選自鱗狀細胞癌、小細胞肺癌、非小細胞肺癌、肺腺癌、鱗狀細胞肺癌、腹膜癌、皮膚癌、皮膚或眼黑素瘤、直腸癌、肛門癌、食道癌、小腸癌、內分泌癌、甲狀旁腺癌、腎上腺癌、軟組織肉瘤、尿道癌、慢性或急性白血病、淋巴瘤、肝癌、胃腸癌、胰腺癌、膠質母細胞瘤、宮頸癌、卵巢癌、肝癌、膀胱癌、肝腫瘤、乳腺癌、結腸癌、結腸直腸癌、子宮內膜癌或子宮癌、唾液腺癌、腎癌、肝癌、前列腺癌、外陰癌、甲狀腺癌、肝癌和頭頸癌。
當將組合物制備成用于預防或治療癌癥或血管生成相關疾病的藥物組合物時,組合物可包含藥用載體。包含在組合物中的藥用載體通常在制劑中使用。包含在組合物中的藥用載體的實例可包括但不限于乳糖、葡萄糖、蔗糖、山梨醇、甘露醇、淀粉、阿拉伯膠、磷酸鈣、藻酸鹽、明膠、硅酸鈣、微晶纖維素、聚乙烯基吡咯烷酮、纖維素、水、糖漿、甲基纖維素、羥基苯甲酸甲酯、羥基苯甲酸丙酯、滑石、硬脂酸鎂和礦物油等,但是不限于此。除上述成分外,藥物組合物可進一步包含潤滑劑、潤濕劑、甜味劑、矯味劑、乳化劑、助懸劑、防腐劑等。
用于預防或治療癌癥或血管生成相關疾病的藥物組合物可口服或胃腸外給藥。上述胃腸外給藥包括靜脈內注射、皮下注射、肌內注射、腹膜內注射、內皮給藥、局部給藥、經鼻給藥、肺內給藥、直腸內給藥等。由于蛋白或肽當口服給藥時被消化,因此優選將用于口服給藥的組合物配制成包覆活性物質或被保護以對抗在胃中降解。另外,藥物組合物可通過任何可轉運活性物質至靶細胞的裝置給藥。
用于預防或治療癌癥或血管生成相關疾病的藥物組合物的合適劑量可隨多種因素而變化,例如配制方法、給藥方法、患者的年齡、體重、性別、病理狀態、食物、給藥時間、給藥途徑、排泄率和反應敏感性等。優選地,組合物的合適劑量基于成人為0.001-100mg/kg。本文使用的術語“藥物有效劑量”是指足以預防或治療癌癥或血管生成相關疾病的量。
組合物可用藥用載體和/或賦形劑根據本領域技術人員可容易實施的方法配制且可按單位劑量形式提供或包封在多劑量小瓶中。在本申請中,藥物組合物的制劑可為油性或水性介質中的溶液、混懸液、糖漿或乳液形式或可為提取物、粉末、顆粒、片劑或膠囊且可進一步包含分散劑或穩定劑。另外,組合物可單獨或與其它治療劑組合給藥且可與常規治療劑先后或同時給藥。同時,組合物包含抗體或抗原結合片段且因此可配制成為免疫脂質體。包含抗體的脂質體可根據本領域已知的方法制備。免疫脂質體為包含磷脂酰膽堿、膽固醇和聚乙二醇衍生的磷脂酰乙醇胺的脂質組合物且可通過反相蒸發法制備。例如,抗體的fab’片段可通過二硫化物交換反應與脂質體綴合。脂質體可進一步包含化學治療劑例如多柔比星。
本發明還提供用于診斷癌癥的組合物,其包含:所述抗體;或與所述抗體融合并選自以下的生物活性分子:肽、蛋白、小分子藥物、納米粒和脂質體。
本文使用的術語“診斷”是指證實病理生理狀況的存在或特征。本發明中的診斷是指證實癌癥的發生和進展。
完整免疫球蛋白類型的抗體及其片段可與熒光物質結合用于分子成像從而通過圖像診斷癌癥。
用于分子成像的熒光物質是指產生熒光的所有物質。優選地發射紅色或近紅外熒光且更優選地發射具有高量子產率的熒光。然而,熒光不限于此。
優選地,用于分子成像的熒光物質為熒光物質、熒光蛋白或用于成像的其它物質,其可與特異性結合于完整免疫球蛋白類型的抗體及其片段的腫瘤組織穿透肽結合,但是不限于此。
優選地,熒光物質為熒光素、bodypy、四甲基羅丹明、alexa、花青素、allopicocyanine或其衍生物,但是不限于此。
優選地,熒光蛋白為dronpa蛋白、增強綠色熒光蛋白(egfp)、紅色熒光蛋白(dsrfp)、cy5.5(其為發射近紅外熒光的花青素熒光物質)或其它熒光蛋白,但是不限于此。
優選地,用于成像的其它物質為氧化鐵、放射性同位素等,但是不限于此且其可應用于成像設備例如mr、pet。
本發明還提供編碼所述輕鏈可變區或包含所述輕鏈可變區的抗體或其片段的多核苷酸。
本文使用的術語“多核苷酸”是指以單鏈或雙鏈形式存在的脫氧核糖核苷酸或核糖核苷酸聚合物。其包括rna基因組序列、dna(gdna和cdna)及由其轉錄的rna序列。除非另有描述,其還包括天然多核苷酸的類似物。
多核苷酸不但包括編碼上述輕鏈區的核苷酸序列,而且包括與其互補的序列。互補序列包括與核苷酸序列完全互補的序列和與核苷酸序列基本上互補的序列。例如,這是指以下序列,其可在本領域已知的嚴格條件下與編碼seqidno:1至seqidno:3中任意一個的氨基酸序列的核苷酸序列雜交。
另外,多核苷酸可為經修飾的。修飾包括核苷酸的添加、缺失、非保守性取代或保守性取代。編碼氨基酸序列的多核苷酸被理解為包括與核苷酸序列具有基本同一性的核苷酸序列。基本同一性可指序列當與核苷酸序列比對以盡可能多地與任何其它序列對應且使用本領域通常使用的算法對所比對的序列進行分析時具有至少80%同源性、至少90%同源性或至少95%同源性。
本發明的另一個方面可提供使用穿透活細胞且定位在細胞溶膠中的完整免疫球蛋白類型的抗體產生穿透細胞溶膠且與細胞溶膠中活化的(gtp結合的)腫瘤相關因子ras特異性結合且抑制ras的活性的完整免疫球蛋白類型的抗體的方法。
在本發明的一個實施方案中,穿透動物細胞且定位在細胞溶膠中且與細胞溶膠中活化的(gtp結合的)ras特異性結合的完整免疫球蛋白類型的抗體使用能夠與活化的(gtp結合的)ras特異性結合的重鏈可變區(vh)產生且可通過包括以下步驟的方法產生:
(1)構建克隆有以下核酸的重鏈表達載體,所述核酸包含與活化的(gtp結合的)ras特異性結合的人重鏈可變區(vh)和重鏈恒定區(ch1-鉸鏈-ch2-ch3);
(2)將所構建的重鏈表達載體和包含能夠穿透細胞溶膠的輕鏈可變區的輕鏈表達載體共轉化到蛋白表達動物細胞中且在所述細胞中表達穿透活細胞且定位在細胞溶膠中以特異性識別活化的(gtp結合的)ras的完整免疫球蛋白類型的抗體;和
(3)純化和回收所表達的能夠穿透細胞溶膠且特異性識別活化的(gtp結合的)ras的完整免疫球蛋白類型的抗體。
本文使用的術語“載體”是指在宿主細胞中表達靶基因的方式。例如,載體可包括質粒載體、粘粒載體、噬菌體載體和病毒載體如例如腺病毒載體、逆轉錄病毒載體和腺相關病毒載體。可用作重組載體的載體可通過操作本領域通常使用的質粒(例如psc101、pgv1106、pacyc177、cole1、pkt230、pme290、pbr322、puc8/9、puc6、pbd9、phc79、pij61、plafr1、phv14、pgex系列、pet系列和puc19等)、噬菌體(例如λgt4λb、λ-charon、λδz1和m13等)或病毒(例如cmv、sv40等)產生。
重組載體中本發明的輕鏈可變區、輕鏈恒定區(cl)、重鏈可變區(vh)和重鏈恒定區(ch1-鉸鏈-ch2-ch3)可與啟動子可操作地連接。本文使用的術語“可操作地連接”是指核苷酸表達控制序列(例如啟動子序列)和第二核苷酸序列之間的功能性連接基。因此,控制序列可控制第二核苷酸序列的轉錄和/或翻譯。
重組載體通常可構建成用于克隆的載體或用于表達的載體。作為用于表達的載體,可使用本領域通常用于表達來自植物、動物或微生物的外源蛋白的載體。重組載體可通過本領域已知的多種方法構建。
可將重組載體構建成使用原核細胞或真核細胞作為宿主的載體。例如,當所使用的載體為表達載體且使用原核細胞作為宿主時,載體通常包括可促進轉錄的強啟動子(例如plλ啟動子、trp啟動子、lac啟動子、tac啟動子、t7啟動子等)、用于啟動翻譯的核糖體結合位點和針對轉錄/翻譯的終止序列。當載體使用真核細胞作為宿主時,在載體所包括的真核細胞中操作的復制起點可包括f1復制起點、sv40復制起點、pmb1復制起點、腺復制起點、aav復制起點、cmv復制起點和bbv復制起點等,但是不限于此。另外,可使用源自哺乳動物細胞的基因組的啟動子(例如金屬硫蛋白啟動子)或源自哺乳動物細胞的病毒的啟動子(例如腺病毒后期啟動子、痘苗病毒7.5k啟動子、sv40啟動子、巨細胞病毒(cmv)啟動子或hsv的tk啟動子)且啟動子通常具有作為轉錄終止序列的聚腺苷酸化序列。
本發明的另一個方面提供用所述重組載體轉化的宿主細胞。
本領域已知的任何種類的宿主細胞可用作宿主細胞。原核細胞的實例包括屬于芽孢桿菌屬的菌株例如大腸桿菌jm109、大腸桿菌bl21、大腸桿菌rr1、大腸桿菌le392、大腸桿菌b、大腸桿菌x1776、大腸桿菌w3110、枯草芽孢桿菌和蘇云金芽孢桿菌、鼠傷寒沙門氏菌、腸道菌群和菌株例如粘質沙雷氏菌和多種假單胞菌屬種等。另外,當將載體轉化到真核細胞中時,可使用宿主細胞例如酵母(釀酒酵母)、昆蟲細胞、植物細胞和動物細胞例如sp2/0、cho(中國倉鼠卵巢)k1、chodg44、per.c6、w138、bhk、cos-7、293、hepg2、huh7、3t3、rn和mdck細胞系等。
重組載體可使用本領域已知的插入方法插入到宿主細胞中。例如,當宿主細胞為原核細胞時,轉移可根據cacl2法或電穿孔法等進行且當宿主細胞為真核細胞時,載體可根據顯微鏡注射法、磷酸鈣沉淀法、電穿孔法、脂質體介導的轉化方法和基因轟擊法等轉移到宿主細胞中,但是轉移方法不限于此。當使用微生物例如大腸桿菌等時,生產率比使用動物細胞高。然而,盡管其由于糖基化不適于產生完整ig形式的抗體,其可用于產生抗原結合片段例如fab和fv。
用于選擇所轉化的宿主細胞的方法可根據本領域已知的方法使用由所選標簽表達的表型容易地進行。例如,當所選標簽為特異性抗生素抗性基因時,轉化體可通過在包含抗生素的培養基中培養轉化體容易地選擇。
有利的效果
根據本發明,使用能夠穿透細胞溶膠的完整免疫球蛋白類型的抗體抑制細胞內活化的ras的方法通過允許抗體穿透活細胞且特異性識別細胞溶膠中活化的(gtp結合的)ras來進行。因此,所述抗體可靶向于活細胞的細胞溶膠中活化的(gtp結合的)ras且抑制ras的活性。
另外,根據本發明的抗體輕鏈可變區和包含所述可變區的抗體能夠通過胞吞作用和內體逃逸穿透活細胞且定位在細胞溶膠中而不必使用特別的外部蛋白遞送系統。具體地,根據本發明的抗體輕鏈可變區可容易與多種人重鏈可變區(vh)相互作用且具有穿透細胞溶膠且保留在細胞溶膠中的能力且包含所述輕鏈可變區的完整igg型單克隆抗體可穿透細胞且定位在細胞溶膠中且沒有顯示出非特異性針對靶細胞的細胞毒性。
根據本發明的抗體重鏈可變區和包含所述可變區的抗體可選擇性地抑制多種常規腫瘤治療劑的主要藥物抗性相關因子ras的突變且可與常規治療劑一起展現出協同抗癌活性。另外,根據本發明的穿透細胞溶膠的完整免疫球蛋白類型的抗體可穿透細胞且保留在細胞溶膠中而不影響人抗體重鏈可變區(vh)對抗原的高特異性和親和力且因此可定位在目前基于小分子藥物被分類為疾病治療靶標的細胞溶膠中且同時可展現出高效地治療和診斷通過蛋白和蛋白之間寬且平的表面顯示出在結構上復雜的相互作用的腫瘤和疾病相關因子。
附圖說明
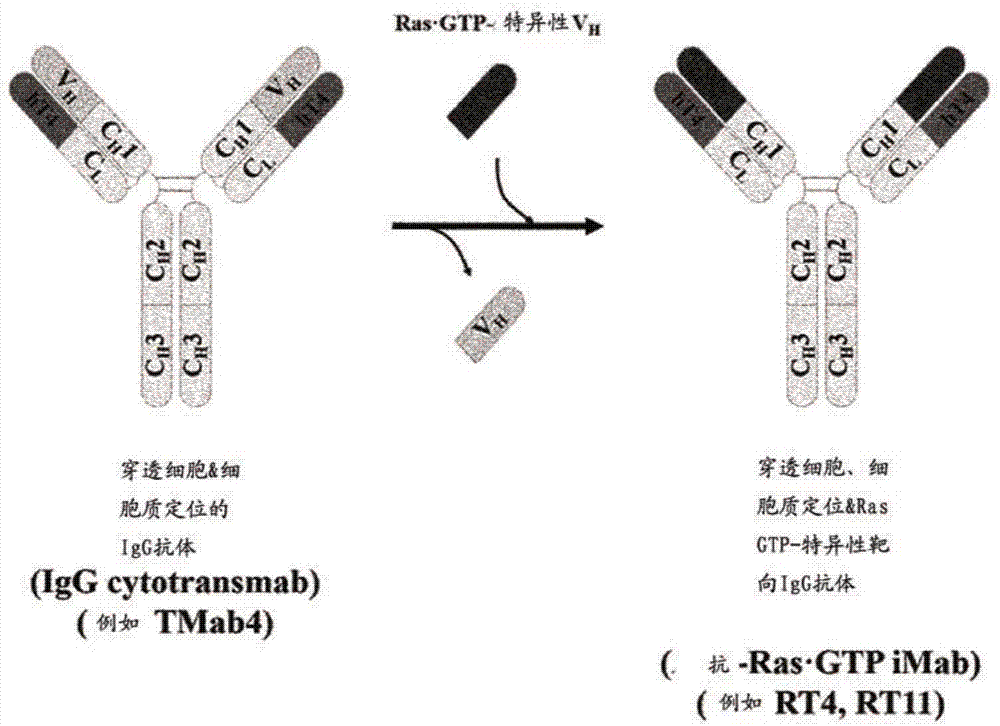
圖1的示意圖顯示了通過使用以下單克隆抗體(抗ras·gtpimab:內化和干擾單克隆抗體)誘導特異性針對ras突變細胞的細胞毒性的策略,所述抗體通過將igg類型的cytotransmab的重鏈可變區(vh)(僅具有穿透細胞溶膠的能力)用與結合有gtp的kras特異性結合的重鏈可變區(vh)進行替換來構建且所述抗體穿透細胞且在細胞溶膠中與結合有gtp的ras特異性結合。
圖2的示意圖顯示了通過將僅能夠穿透細胞溶膠的完整igg類型的cytotransmab的重鏈可變區(vh)用與結合有gtp的kras特異性結合的重鏈可變區(vh)進行替換來構建抗ras·gtpimab的方法。
圖3的示意圖顯示了獲得僅對gtp結合的krasg12d蛋白具有高親和力的人源化抗體重鏈可變單結構域的文庫篩選策略。
圖4顯示了在獲得對結合有gtp的krasg12d的高親和力的上述過程的每個步驟中對單獨的結合有gtp的krasg12d的條件下和與結合有gtp的krasg12d競爭的條件下的結合進行facs分析的結果
圖5a顯示了對以下序列進行分析的結果,所述序列包含在由小鼠輕鏈可變區m3d8vl獲得改進的穿透細胞溶膠的與人源化抗體重鏈可變區穩定結合的人源化輕鏈可變單結構域ht3vl的過程中使用的克隆。
圖5b使用m3d8vl、人源化輕鏈可變單結構域ht0vl及其突變體(ht2vl和ht3vl)的wam建模通過疊加法比較了模型結構。
圖6a顯示了對輕鏈可變單結構域穿透細胞溶膠的能力進行共聚焦顯微鏡觀察的結果。
圖6b顯示了為了確認輕鏈可變單結構域穿透細胞溶膠的機制而進行共聚焦顯微鏡觀察的結果。
圖7a顯示了對ht3vl的氨基酸序列及常規人抗體阿達木單抗(humira)和人源化抗體貝伐單抗(avastin)的輕鏈可變域(vl)的氨基酸序列進行分析的結果從而確認ht3vl是否可應用于多種人抗體重鏈可變域。
圖7b顯示了對可變區之間的界面殘基進行分析的結果從而構建與人抗體重鏈可變區最佳相互作用的穩定的cytotransmab。
圖8的示意圖顯示了用能夠穿透細胞溶膠的人源化輕鏈可變區替換不能穿透細胞的輕鏈可變區從而構建cytotransmab的方法。
圖9a顯示了通過共聚焦顯微鏡對多種細胞系中的1-2個細胞進行觀察的結果從而確認其中輕鏈可變區用穿透細胞溶膠的輕鏈區ht4vl替換的cytotransmab具有穿透細胞溶膠的能力。
圖9b顯示了檢查數種細胞穿透細胞溶膠的能力的結果,其通過如圖9a所示的共聚焦顯微鏡觀察以減小的倍率進行從而在細胞溶膠穿透能力檢查實驗中檢查細胞穿透效率。
圖10a的圖顯示了通過在體外用cytotransmab處理hela和panc-1細胞系且評估對細胞生長的抑制而獲得的結果。
圖10b的圖像顯示了通過在體外用cytotransmab處理hela和panc-1細胞系且評估對細胞的抑制程度而獲得的結果。
圖11顯示了純化后通過12%sds-page在還原或非還原條件下分析抗ras·gtpimabrt4的結果。
圖12顯示了進行elisa以測量對gtp結合的和gdp結合的野生型kras及gtp結合的和gdp結合的kras突變體(krasg12d、krasg12v和krasg13d)的親和力的結果。
圖13顯示了通過使用spr(biacore2000)(gehealthcare)分析抗ras·gtpimabrt4對gtp結合的krasg12d的親和力的結果。
圖14顯示了進行共聚焦顯微鏡觀察以檢查抗ras·gtpimabrt4穿透細胞溶膠的能力的結果。
圖15顯示了通過在體外用抗ras·gtpimabrt4處理nih3t3、nih3t3krasg12v和nih3t3hrasg12v細胞系并評估對細胞生長的抑制而獲得的結果。
圖16顯示了在nih3t3hrasg12v細胞系中評估對非粘附細胞生長的抑制的結果。
圖17顯示了對抗rasrt4是否與細胞中活化的hrasg12v突變體疊加進行共聚焦顯微鏡觀察的結果。
圖18顯示了對抗rasrt4是否與細胞中結合有gtp的krasg12v突變體疊加進行共聚焦顯微鏡觀察的結果。
圖19顯示了通過在體外用rgd-tmab4和rgd-rt4處理hct116和panc-1細胞系并評估對細胞生長的抑制而獲得的結果。
圖20a顯示了在異種移植有hct116細胞的小鼠中對rgd融合的抗ras·gtpimabrt4的腫瘤生長抑制作用進行分析的結果。
圖20b的圖顯示了測量小鼠體重從而檢查rgd融合的抗ras·gtpimabrt4的非特異性副作用的結果。
圖21a顯示了構建人重鏈可變區文庫以改進rt4的親和力的策略。
圖21b的示意圖顯示了通過pcr技術構建所設計的文庫且通過用經限制酶nhei和apai處理的重鏈單酵母表面展示載體(pyds-h)進行同源重組將所構建的文庫轉化到酵母表面上的方法。
圖22顯示了進行facs分析的結果以在每個步驟中就文庫表達酵母而言確定與結合有gtp的krasg12d和結合有gdp的krasg12d的結合從而確認在上述文庫篩選過程中特異性針對結合有gtp的krasg12d的富集。
圖23顯示了對使用三種文庫的各個克隆進行測序的結果。
圖24顯示了通過12%sds-page在還原或非還原條件下分析具有改進的親和力的抗ras·gtpimab的結果。
圖25顯示了通過用具有改進的親和力的ras·gtp特異性重鏈可變區替換抗ras·gtpimab的重鏈可變區且然后進行共聚焦顯微鏡觀察以確認抗ras·gtpimab是否能夠穿透細胞的結果。
圖26a顯示了進行elisa以測量具有改進的親和力的抗ras·gtpimab克隆對gtp結合的krasg12d和gdp結合的krasg12d的親和力的結果。
圖26b顯示了進行elisa分析以確認以基于elisa的結合分析為基礎而選擇的rt11對多種gtp結合的ras突變體的親和力的結果。
圖27a顯示了通過使用spr(biacore2000)(gehealthcare)分析抗ras·gtpimabrt11對gtp結合的krasg12d的親和力的結果。
圖27b的傳感圖顯示了分析rt11對最高濃度(1000nm)的gtp或gdp結合的krasg12d的親和力的結果。
圖28顯示了進行競爭性elisa以確認抗ras·gtpimabrt11是否可抑制效應分子raf和細胞內kras之間的結合的結果。
圖29顯示了進行共聚焦顯微鏡觀察以確認具有改進的親和力的抗ras·gtpimab是否能夠穿透多種類型的腫瘤細胞的結果。
圖30顯示了使用非穿透細胞的自身淬滅染料(鈣黃綠素(sigma))進行共聚焦顯微鏡觀察以觀察具有改進的親和力的抗ras·gtpimab保留在細胞溶膠中的能力的結果。
圖31顯示了通過在體外用抗ras·gtpimabrt11處理多種ras野生型和ras突變細胞系并評估對細胞生長的抑制而獲得的結果。
圖32的一組圖像顯示了進行偏振光顯微鏡觀察以確定每種細胞系的細胞密度的結果。
圖33顯示了進行共聚焦顯微鏡觀察以檢查rt11是否與細胞中活化的krasg12v突變體疊加的結果。
圖34顯示了進行免疫沉淀測定以確認rt11是否與細胞中活化的ras結合的結果。
圖35a和35b顯示了進行免疫沉淀測定以檢查rt11是否抑制ras·gtp和效應蛋白之間的結合的結果。
圖36顯示了通過測量所構建的rgd10肽融合的rt11對多種gtp結合的和gdp結合的ras突變體的親和力而獲得的elisa結果。
圖37和38顯示了通過在體外用rgd10-tmab4和rgd10-rt11處理colo320dm、hct116、panc-1、sw480和dld-1細胞系且評估對細胞生長的抑制而獲得的結果。
圖39顯示了進行分析以檢查rgd10-tmab4和rgd10-rt11是否與細胞表面上的整聯蛋白ανβ3特異性結合的結果。
圖40顯示了進行共聚焦顯微鏡觀察以檢查rgd10-rt11是否與細胞中活化的krasg12v突變體疊加的結果。
具體實施方式
以下將參照實施例對本發明進行進一步詳細描述。對于本領域技術人員顯而易見的是,這些實施例僅為示意性目的而不應被理解為是對本發明范圍的限制。
實施例1:通過高度多樣性人vh文庫對與結合有gtp的kras特異性結合的重鏈可變區(vh)進行選擇
圖1的示意圖顯示了通過使用以下單克隆抗體(抗ras·gtpimab:內化和干擾單克隆抗體)誘導特異性針對ras突變細胞的細胞毒性的策略,所述抗體通過將igg類型的cytotransmab的重鏈可變區(vh)(僅具有穿透細胞溶膠的能力)用與結合有gtp的kras特異性結合的重鏈可變區(vh)進行替換來構建且所述抗體穿透細胞且在細胞溶膠中與結合有gtp的ras特異性結合。
圖2的示意圖顯示了通過將僅能夠穿透細胞溶膠的完整igg類型的cytotransmab的重鏈可變區(vh)用與結合有gtp的kras特異性結合的重鏈可變區(vh)進行替換來構建抗ras·gtpimab的方法。
具體地,所使用的文庫的fr(框架)為在常規抗體中最常使用的v基因ighv3-23*04,jh4且文庫中的cdr3具有9個殘基。文庫的構建和酵母表面展示方法詳細描述在先前報道的論文(baek和kim,2014)中。
為了選擇待引入到抗ras·gtpimab中且與結合有gtp的kras特異性結合的穩定的人源化重鏈可變單結構域(vh)抗體片段而使用在先前的研究中構建的酵母展示vh文庫。
實施例2:制備gtp結合的krasg12d蛋白
為了制備用于文庫篩選和親和力分析的gtp結合的krasg12d抗原而在大腸桿菌中進行的表達和純化詳細描述在先前報道的論文(tanakat等人,2007)中。
具體地,通過使用限制酶bamhi/ecori將對包含野生型kras和突變體krasg12d、krasg12v和krasg13d(以較高至較低突變頻率列出)各自的caax基序的殘基1-188進行編碼的dna克隆到大腸桿菌表達載體pgex-3x中。在本申請中,將表達載體設計成具有t7啟動子-gst-kras。所有kras突變使用重疊pcr技術誘導且使用上述方法構建表達載體。通過電穿孔將pgex-3x-kras載體轉化到大腸桿菌中且在選擇培養基中選擇。在lb培養基中在100μg/ml氨芐西林抗生素存在下在37℃培養所選擇的大腸桿菌直至在600nm的吸光度達到0.6。然后將0.1mmiptg添加至其中用于蛋白表達且然后將大腸桿菌細胞在30℃再培養5小時。然后通過離心收集大腸桿菌細胞且然后通過超聲(sonics)破壞。所破壞的大腸桿菌細胞通過離心去除并收集剩余的上清液且使用特異性純化gst標簽蛋白的谷胱甘肽樹脂(clontech)純化。谷胱甘肽樹脂用50ml洗滌緩沖液(140mmnacl,2.7mmkcl,10mmnah2po4,1.8mmkh2po4,1mmedta,2mmmgcl2ph7.4)(sigma)洗滌且然后蛋白用洗脫緩沖液(50mmtris-hclph8.0,10mm還原型谷胱甘肽,1mmdtt,2mmmgcl2)(sigma)洗脫。對所洗脫的蛋白進行透析以將緩沖液用儲存緩沖液(50mmtris-hclph8.0,1mmdtt,2mmmgcl2)(sigma)替換。通過測量在280nm的吸光度和吸光系數對所純化的蛋白進行定量。sds-page分析表明蛋白具有約98%或更高的純度。
然后為了使gtpλs(millipore)或gdp(millipore)底物與kras蛋白結合,使kras與底物以1:20的分子比例在反應緩沖液(50mmtris-hclph8.0,1mmdtt,5mmmgcl2,15mmedta)(sigma)中在30℃反應30分鐘并向其中添加60mmmgcl2以停止反應且然后儲存在-80℃。
實施例3:對特異性針對gtp結合的krasg12d的重鏈可變區(vh)進行選擇
圖15的示意圖顯示了獲得僅對gtp結合的krasg12d蛋白具有高親和力的人源化抗體重鏈可變單結構域的文庫篩選策略。
具體地,對實施例14所純化的gtp結合的krasg12d進行生物素化(ez-linktmsulfo-nhs-lc-biotinylation試劑盒(pierceinc.,usa))且然后與在酵母細胞表面上展示的重鏈可變區文庫在室溫反應1小時。使酵母細胞表面上與生物素化的結合有gtp的krasg12d反應的重鏈可變區文庫與鏈霉親和素(microbeadtm(miltenyibiotec)在4℃反應20分鐘且然后使用macs(磁力活化細胞分選)來富集展示出對gtp-krasg12d具有高親和力的重鏈可變區的酵母。將所選擇的文庫展示酵母在選擇培養基中培養且在sg-caa+ura培養基(20g/l半乳糖,6.7g/l不含有氨基酸的酵母氮堿,5.4g/lna2hpo4,8.6g/lnah2po4,5g/l酪蛋白氨基酸,0.2mg/l尿嘧啶)(sigma)中培養以誘導蛋白表達。然后將酵母與以比結合有gtp的krasg12d高10倍的濃度與單獨的結合有gtp的krasg12d或非生物素化的結合有gtp的krasg12d抗原競爭性地展示文庫的酵母在室溫溫育1小時,然后使其與綴合有pe的鏈霉親和素(鏈霉親和素-r-藻紅蛋白綴合物(sa-pe)(invitrogen)反應且通過facs(熒光活化細胞分選)(facscaliber)(bdbiosciences)富集。通過facs分析對篩選條件進行選擇后,使抗原與展示所富集的文庫的酵母在與所述相同的條件下結合且然后使用facsariaii分選儀富集酵母。使通過第一macs和第一facs篩選富集的人源化重鏈區文庫與分泌穿透細胞溶膠的輕鏈可變單結構域(ht4vl)的酵母配對并以fab形式展示在酵母表面上且然后經歷第二facs和第三facs篩選。
具體地,為了構建待與重鏈可變域(vh)文庫配對并分泌穿透細胞溶膠的輕鏈可變域(vl)的酵母,通過限制酶nhei和bsiwi將編碼穿透細胞溶膠的ht4vl的dna克隆到輕鏈可變域酵母分泌載體pyds-k中由此獲得pyds-k-ht4vl。通過電穿孔將所獲得的pyds-k-ht4vl轉化到配對α型酵母配對株yvh10中且與在選擇培養基sd-caa+trp(20g/l葡萄糖,6.7g/l不含有氨基酸的酵母氮堿,5.4g/lna2hpo4,8.6g/lnah2po4,5g/l酪蛋白氨基酸,0.4mg/l色氨酸)(sigma)中培養的酵母配對。
具體地,就酵母配對而言,當在600nm的吸光度為1時存在1×107個酵母細胞。在所培養的酵母細胞中,將表達所選重鏈可變域文庫的1.5×107個酵母細胞和包含ht4vl的1.5×107個酵母細胞添加至gtp結合的krasg12d且用ypd(20g/l右旋糖,20g/l蛋白胨,10g/l酵母提取物,14.7g/l檸檬酸鈉,4.29g/l檸檬酸,ph4.5)(sigma)洗滌三次。然后將酵母細胞重新混懸在100μlypd中并滴到ypd板上而不鋪開,然后干燥這些酵母細胞且在30℃培養6小時。然后涂覆有干燥的酵母的部分用ypd培養基洗滌三次且然后在選擇培養基sd-caa中在30℃溫育24小時至最終酵母濃度為1×106個細胞或更少且僅選擇配對的酵母細胞。將所選擇的酵母細胞在sg-caa培養基中溫育以誘導人源化抗體fab片段的表達且通過第二和第三facs富集從而使酵母細胞在結合有gdp的krasg12d的濃度為100nm時與結合有gdp的krasg12d具有100倍競爭性。
圖16顯示了在獲得對結合有gtp的krasg12d的高親和力的上述篩選過程的每個步驟中對單獨的結合有gtp的krasg12d的條件下和與結合有gtp的krasg12d競爭的條件下的結合進行facs分析的結果。由此發現的是,可選擇出可按重鏈可變域(vh)依賴性方式與結合有gtp的krasg12d特異性結合的文庫。
在上述高通量篩選中,最終通過各個克隆分析從對gtp結合的krasg12d蛋白具有高親和力和特異性的文庫中選擇出rt4克隆。
實施例4:開發穿透細胞溶膠的人源化輕鏈可變(vl)單結構域的原理
圖5的示意圖顯示了被稱為“cytotransmab”的穿透細胞且定位在細胞溶膠中的完整免疫球蛋白抗體的概念。為了實現該抗體并理解人源化抗體輕鏈可變區穿透細胞溶膠的能力,參照了關于小鼠輕鏈可變單結構域m3d8vl穿透細胞溶膠的能力和與輕鏈可變區片段對應的cdr之間的相關性的常規研究(lee等人,2013)。
圖5a顯示了對以下序列進行分析的結果,所述序列包含在由小鼠輕鏈可變區m3d8vl獲得改進的穿透細胞溶膠的與人源化抗體重鏈可變區穩定結合的人源化輕鏈可變單結構域ht3vl的過程中使用的克隆。
具體地,基于在小鼠輕鏈可變單結構域m3d8vl和通過使用cdr移植技術對單結構域m3d8vl進行人源化而獲得的ht0vl之間比較穿透細胞溶膠的能力而確認的是,即使輕鏈可變區(vl)的cdr1序列是保守的,仍然喪失了穿透細胞溶膠的能力。
因此,為了改進cdr1的結構以具有與m3d8vl類似的結構由此恢復人源化抗體輕鏈可變單結構域穿透細胞溶膠的能力,對fr(框架)中的cdr區(游標區)進行了比較性分析。由此發現殘基2和4不同于能夠穿透細胞溶膠的小鼠m3d8vl的那些。具體地,由于殘基2和4作為顯著影響cdr1結構(游標區)的上部核心,因此通過對ht0vl進行反向突變開發出具有與m3d8vl的cdr1結構類似的cdr1結構的ht2vl(參見圖5a)。
然后為了構建穩定的cytotransmab并生成vh3和vκ1亞基之間的配對(其在穩定的抗體中是非常普遍的)由此開發出與多種人抗體重鏈可變區互補穩定結合并保持其穿透到細胞溶膠中的能力的輕鏈可變區,比較性地分析了ht2vl的fr(框架)和人源化治療性單克隆抗體曲妥單抗(herceptin)(其具有vh3和vκ1亞基且是非常穩定的)的輕鏈可變區fr(框架)。由此證實ht2vl的fr(框架)中的14個殘基不同于曲妥單抗的輕鏈可變區fr(框架)中的那些。這14個殘基用曲妥單抗的輕鏈可變區fr(框架)的序列進行突變由此開發出ht3vl(參見圖5a)。
圖5b使用m3d8vl、人源化輕鏈可變單結構域ht0vl及其突變體(ht2vl和ht3vl)的wam建模通過疊加法比較了模型結構。所發現的是,cdr1區與m3d8vl的cdr1區的結構差異通過如上所述對殘基2和4進行反向突變而減小。
實施例5:對能夠穿透細胞溶膠的人源化輕鏈可變(vl)單結構域進行表達和純化
為了比較在上述實施例4中設計的ht2vl和ht3vl實際穿透細胞溶膠的能力,對人源化輕鏈可變(vl)單結構域進行了純化。
具體地,通過nhei/bamhi限制酶將在n末端包含phoa信號肽且在c末端包含蛋白a標簽的穿透細胞溶膠的輕鏈可變單結構域克隆到pig20載體中且然后通過電穿孔將載體轉化到用于蛋白表達的大腸桿菌bl21(de3)plyse中。在包含100μg/ml氨芐西林的lba培養基中以180rpm和37℃培養大腸桿菌直至在600nm的吸光度達到0.6-0.8。然后用0.5mmiptg(異丙基β-d-1-硫代半乳糖苷)處理培養物且然后在23℃溫育20小時以表達蛋白。表達后,通過高速離心機以8,000rpm離心培養物30分鐘并收集上清液且然后與igg-瓊脂糖樹脂(gehealthcare)反應。用50mltbs(tris-hcl,137mmnacl,2.7mmkcl,ph7.4)洗滌樹脂且然后用5ml5mmnh4ac(ph5.0)緩沖液洗滌。然后通過使用0.1mhac(ph3.0)緩沖液由樹脂洗脫蛋白且緩沖液用tbs(ph7.4)通過透析替換。然后蛋白濃度通過bca(二辛可寧酸(pierce))測定測量且蛋白純度通過sds-page分析。
實施例6:對穿透細胞溶膠的人源化輕鏈可變(vl)單結構域穿透細胞溶膠的能力和細胞穿透機制進行確認
圖6a顯示了對輕鏈可變單結構域穿透細胞溶膠的能力進行共聚焦顯微鏡觀察的結果。
具體地,為了確認m3d8vl、ht0vl、ht2vl和ht3vl穿透細胞溶膠的能力,將蓋玻片添加至24孔板且將5×104個hela細胞/孔添加至0.5ml含有10%fbs(胎牛血清)的培養基中且在5%co2和37℃的條件下培養12小時。當細胞穩定化時,用在0.5ml新鮮培養基中的10μmm3d8vl、ht0vl、ht2vl或ht3vl處理每個孔且在5%co2和37℃的條件下溫育6小時。然后去除培養基且用pbs洗滌每個孔且然后用弱酸性溶液(200mm甘氨酸,150mmnacl,ph2.5)處理以由細胞表面去除蛋白。然后用pbs洗滌每個孔且在4%多聚甲醛中在25℃固定細胞10分鐘。用pbs洗滌后,每個孔用包含0.1%皂苷、0.1%疊氮化鈉和1%bsa的pbs緩沖液在25℃溫育10分鐘以在細胞膜中形成孔。用pbs洗滌后,每個孔用包含2%bsa的pbs緩沖液在25℃溫育1小時以消除非特異性結合。然后每個孔用識別輕鏈可變單結構域的蛋白a標簽的兔igg(sigma)處理且將每個孔在25℃溫育2小時,用pbs洗滌三次且然后用經紅色熒光(tritc)標記的抗兔抗體(sigma)處理,然后在25℃溫育1小時。最后細胞核用hoechst33342進行藍色染色且用共聚焦顯微鏡觀察。由此證實除ht0vl外,m3d8vl、ht2vl和ht3vl具有細胞穿透能力。
圖6b顯示了為了確認輕鏈可變單結構域穿透細胞溶膠的機制而進行共聚焦顯微鏡觀察的結果。
具體地,當如圖6a所示制備hela細胞并使其穩定化時,將在0.5ml新鮮培養基中的10μmm3d8vl、ht2vl或ht3vl和10μg/mlalexafluor488-轉鐵蛋白(tf,綠色熒光)、fitc-霍亂毒素b(ctx-b,綠色熒光)或oregon綠色葡聚糖(dextran,綠色熒光)的稀釋液添加至每個孔中且在5%co2和37℃的條件下溫育2小時。然后如圖3a所示對輕鏈可變單結構域進行染色。如圖3b所示,所有輕鏈可變單結構域都與霍亂毒素-b疊加,這表明這些結構域通過胞膜窖穿透細胞溶膠。
實施例7:開發容易與人抗體重鏈可變域相互作用的穿透細胞溶膠的人源化輕鏈可變(vl)單結構域
圖7a顯示了對ht3vl的氨基酸序列及常規人抗體阿達木單抗(humira)和人源化抗體貝伐單抗(avastin)的輕鏈可變域(vl)的氨基酸序列進行分析的結果從而確認ht3vl是否可應用于多種人抗體重鏈可變域。
具體地,對參與重鏈和輕鏈可變域之間的相互作用的vh-vl界面殘基進行了分析。由此發現vl結構域的cdr3中處于89位的賴氨酸(k)和處于91位的絲氨酸(s)與人抗體中處于89位的谷氨酰胺(q)和酪氨酸(y)是對應的。
為了謀劃對殘基進行改進的策略,更詳細地分析了vh-vl界面殘基對重鏈可變域和輕鏈可變區的cdr的作用。
圖7b顯示了對可變區之間的界面殘基進行分析的結果從而構建與人抗體重鏈可變區最佳相互作用的穩定的cytotransmab。
具體地,基于文獻所報道的關于人抗體可變區之間的界面殘基的位置、與位于相對的可變區中的特定界面殘基結合的頻率和界面殘基在人抗體中的豐度的信息,對ht3vl及在貝伐單抗(avastin)和阿達木單抗(humira)(由fda批準的抗體)的重鏈和輕鏈可變區之間的界面殘基進行了分析(vargas-madrazo和paz-garcia,2003)。分析結果表明在ht3vl的小鼠cdr中,參與可變區之間的締合的cdr3中的殘基89和91在人抗體中是高度豐富的且可影響重鏈可變區(vh)的cdr3結構。這兩個殘基用在人抗體中高度豐富的氨基酸進行突變由此得到可與人抗體重鏈可變區最佳結合的ht4vl。
下表1和2顯示了所設計的能夠穿透細胞溶膠的人抗體輕鏈可變區的序列。表1顯示了根據kabat編號系統進行編號的人抗體輕鏈可變區的全長序列且表2顯示了表1所示抗體序列的cdr序列。
表1:穿透細胞溶膠的人抗體輕鏈可變區的全長序列
表2:穿透細胞溶膠的人抗體輕鏈可變區的cdr序列
實施例8:通過用穿透細胞溶膠的人源化輕鏈區(vl)進行替換來開發cytotransmab及對cytotransmab進行表達和純化
圖8的示意圖顯示了用能夠穿透細胞溶膠的人源化輕鏈可變區替換不能穿透細胞的輕鏈可變區從而構建cytotransmab的方法。
具體地,為了構建用于產生完整免疫球蛋白類型的單克隆抗體的重鏈表達載體,將對包含抗體重鏈可變區(貝伐單抗vh、阿達木單抗vh或人源化ht0vh)和重鏈恒定區(ch1-鉸鏈-ch2-ch3)的重鏈進行編碼的dna(其具有融合至5’末端的編碼分泌信號肽的dna)通過noti/hindiii克隆到pcdna3.4載體(invitrogen)中。另外,為了構建表達輕鏈的載體,將對穿透細胞溶膠的輕鏈可變區(ht4vl)或輕鏈可變區(貝伐單抗vl或阿達木單抗vl)和模型抗體的輕鏈恒定區(cl)進行編碼的dna(其具有融合至5’末端的編碼分泌信號肽的dna)通過使用noti/hindiii克隆到pcdna3.4載體(invitrogen)中。
對輕鏈和重鏈表達載體進行瞬時轉染并對蛋白進行表達和純化,然后比較蛋白產率。在搖瓶中,在不含有血清的freestyle293表達培養基(invitrogen)中混懸生長的hek293-f細胞(invitrogen)用質粒和聚乙烯亞胺(pei)(polyscience)的混合物進行轉染。在搖瓶(corning)中進行200ml轉染后,將hek293-f細胞以2.0×106個細胞/ml的密度接種到100ml培養基中并以150rpm在8%co2中培養。為了產生每種單克隆抗體,在10mlfreestyle293表達培養基(invitrogen)中稀釋適當的重鏈和輕鏈質粒(125μg重鏈,125μg輕鏈,共250μg(2.5μg/ml))且將稀釋液與10ml包含750μg(7.5μg/ml)pei的培養基混合且在室溫溫育混合物10分鐘。添加所溫育的培養基混合物至100ml所接種的細胞培養物,然后其以150rpm在8%co2中培養4小時,然后將100mlfreestyle293表達培養基添加至細胞培養物中,然后培養6天。按照標準方案從所收集的細胞培養物上清液中純化蛋白。將抗體加載于蛋白a瓊脂糖柱(gehealthcare)且用pbs(ph7.4)洗滌。抗體使用0.1m甘氨酸緩沖液(ph3.0)洗脫且然后立即用1mtris緩沖液中和。濃縮所洗脫的抗體級份同時緩沖液通過透析用pbs(ph7.4)替換。通過測量在280nm的吸光度和吸光系數對所純化的蛋白進行定量。
下表3顯示了每升培養物體積產生的純化的cytotransmab和蛋白的產率。對三次測量進行統計學處理且±表示標準差值。對于所得蛋白的產率,包含改進的ht4vl以促進其與人重鏈可變區(vh)相互作用的cytotransmab沒有顯著不同于野生型單克隆抗體。
表3:cytotransmab的純化產率與野生型igg類型的單克隆抗體(阿達木單抗和貝伐單抗)的純化產率的比較
這些結果表明通過額外地修飾界面殘基獲得的人源化輕鏈可變區(ht4
vl)可與人源化抗體重鏈可變區最佳相互作用且因此可穩定地表達和純化。
實施例9:確認cytotransmab穿透細胞溶膠的能力
圖9a顯示了通過共聚焦顯微鏡對多種細胞系中的1-2個細胞進行觀察的結果從而確認其中輕鏈可變區用穿透細胞溶膠的輕鏈區ht4vl替換的cytotransmab具有穿透細胞溶膠的能力。
具體地,在24孔板中將5×104個hela、panc-1、ht29或mcf-7細胞/孔添加至0.5ml含有10%fbs的培養基中且在5%co2和37℃的條件下培養12小時。當細胞穩定化時,每個孔用1μmtmab4、阿達木單抗(humira)、貝伐單抗(avastin)、hut4或avat4各自在0.5ml新鮮培養基中的稀釋液在5%co2和37℃的條件下溫育6小時。然后去除培養基且每個孔用pbs洗滌且然后用弱酸性溶液(200mm甘氨酸,150mmnacl(ph2.5))處理以由細胞表面去除蛋白。用pbs洗滌后,將細胞在4%多聚甲醛中在25℃固定10分鐘。然后每個孔用pbs洗滌且用包含0.1%皂苷、0.1%疊氮化鈉和1%bsa的pbs緩沖液在25℃溫育10分鐘以在細胞膜中成孔。然后每個孔用pbs洗滌且然后用包含2%bsa的pbs緩沖液在25℃溫育1小時從而消除非特異性結合。然后每個孔用經fitc(綠色熒光)標記的特異性識別人fc的抗體在25℃溫育1.5小時且細胞核用hoechst33342進行藍色染色且用共聚焦顯微鏡觀察。與igg類型的靶向于細胞外分泌的蛋白的單克隆抗體(阿達木單抗和貝伐單抗)不同的是,tmab4、hut4和avat4顯示出在細胞中的綠色熒光。
圖9b顯示了檢查數種細胞穿透細胞溶膠的能力的結果,其通過如圖9a所示的共聚焦顯微鏡觀察以減小的倍率進行從而在細胞溶膠穿透能力檢查實驗中檢查細胞穿透效率。
所證實的是,引入有穿透細胞溶膠的人源化輕鏈可變區的cytotransmab穿透所有細胞的細胞溶膠且定位在細胞溶膠中。
實施例10:評估cytotransmabs的細胞毒性
為了檢查在實施例7中確認能夠穿透細胞溶膠的cytotransmab是否在體外具有細胞毒性,hela或panc-1細胞用tmab4、hut4、阿達木單抗、avat4和貝伐單抗中的每種處理且通過mtt測定(sigma)檢查對細胞生長的抑制。
具體地,在96孔板中在5%co2和37℃的條件下在0.1ml含有10%fbs的培養基中將1×104個hela或panc-1細胞/孔培養12小時。然后每個孔用1μmtmab4、hut4、阿達木單抗、avat4和貝伐單抗各自處理20小時或44小時且然后將20μlmtt溶液(1mg/mlpbs)添加至每個孔中,然后溫育4小時。將所形成的甲臜溶于200μldmso(二甲基亞砜)中并測量在595nm的吸光度以確定細胞活力。
圖10a的圖顯示了通過在體外用cytotransmab處理hela和panc-1細胞系且評估對細胞生長的抑制而獲得的結果。圖10b的圖像顯示了通過在體外用cytotransmab處理hela和panc-1細胞系且評估對細胞的抑制程度而獲得的結果。如圖10a和10b所示,所有抗體都沒有顯示出細胞毒性。
實施例11:表達和純化抗ras·gtpimab且分析抗ras·gtpimab對kras突變體的親和力
具有穿透細胞且定位在細胞溶膠中的性質的cytotransmab的重鏈可變區(vh)用在實施例3中選擇的rt4vh替換由此構建可穿透細胞且特異性靶向于細胞溶膠中的gtp結合的ras的抗ras·gtpimab。將所構建的抗ras·gtpimab在動物細胞中表達。
具體地,為了構建用于產生完整免疫球蛋白類型的單克隆抗體的重鏈表達載體,將對包含rt11重鏈可變區(rt11vh)和重鏈恒定區(ch1-鉸鏈-ch2-ch3)的重鏈進行編碼的dna(其具有融合至5’末端的編碼分泌肽的dna)通過noti/hindiii克隆到pcdna3.4載體(invitrogen)中。另外,為了構建輕鏈表達載體,將對包含穿透細胞溶膠的輕鏈可變區(ht4vl)和輕鏈恒定區(cl)的輕鏈進行編碼的dna(其具有融合至5’末端的編碼分泌肽的dna)通過noti/hindiii克隆到pcdna3.4載體(invitrogen)中。
對輕鏈和重鏈表達載體進行瞬時轉染并對蛋白進行表達和純化,然后比較蛋白產率。在搖瓶中,在不含有血清的freestyle293表達培養基(invitrogen)中混懸生長的hek293-f細胞(invitrogen)用質粒和聚乙烯亞胺(pei)(polyscience)的混合物進行轉染。就在搖瓶(corning)中進行200ml轉染而言,將hek293-f細胞以2.0×106個細胞/ml的密度接種到100ml培養基中并以150rpm在8%co2中培養。為了產生每種單克隆抗體,在10mlfreestyle293表達培養基(invitrogen)中稀釋適當的重鏈和輕鏈質粒(125μg重鏈,125μg輕鏈,共250μg(2.5μg/ml))且將稀釋液與10ml包含750μg(7.5μg/ml)pei的培養基混合且在室溫溫育混合物10分鐘。添加所溫育的培養基混合物至100ml所接種的細胞培養物,然后其以150rpm在8%co2中培養4小時,然后將100mlfreestyle293表達培養基添加至細胞培養物中,然后培養6天。按照標準方案從所收集的細胞培養物上清液中純化蛋白。將抗體加載于蛋白a瓊脂糖柱(gehealthcare)且柱用pbs(ph7.4)洗滌。抗體使用0.1m甘氨酸緩沖液(ph3.0)洗脫且然后立即用1mtris緩沖液中和。濃縮所洗脫的抗體級份同時緩沖液通過透析用pbs(ph7.4)替換。通過測量在280nm的吸光度和吸光系數對所純化的蛋白進行定量。
圖11顯示了純化后通過12%sds-page在還原或非還原條件下分析抗ras·gtpimabrt4的結果。
具體地,在非還原條件下出現約150kda的分子量且在還原條件下出現約50kda的重鏈分子量和約25kda的輕鏈分子量。這表明所表達和純化的抗ras·gtpimab在不具有非共價鍵的溶液狀態下以單體形式存在且不通過非天然二硫鍵形成二聚體或低聚體。
圖12顯示了進行elisa以測量對gtp結合的和gdp結合的野生型kras及gtp結合的和gdp結合的kras突變體(krasg12d、krasg12v和krasg13d)的親和力的結果。
具體地,將作為靶分子的gtp結合的kras突變體和gdp結合的kras突變體各自在96孔eia/ria板(costarcorning)中在37℃溫育1小時且然后板用0.1%tbst(0.1%吐溫20,ph7.4,137mmnacl,12mmtris,2.7mmkcl,5mmmgcl2)(sigma)以10分鐘洗滌三次。然后板的每個孔用4%tbsb(4%bsa,ph7.4,137mmnacl,12mmtris,2.7mmkcl,10mmmgcl2)(sigma)溫育1小時且然后用0.1%tbst以10分鐘洗滌三次。然后每個孔用在4%tbsb中以不同濃度稀釋的抗ras·gtpimabrt4(和僅具有穿透細胞溶膠的能力而不具有ras結合能力的cytotransmabtmab4)溫育,然后每個孔用0.1%pbst以10分鐘洗滌三次。山羊堿性磷酸酶綴合的抗人mab(sigma)用作標志物抗體。每個孔用pnpp(棕櫚酸對硝基苯基酯)(sigma)處理并測量在405nm的吸光度。
為了進一步定量分析抗ras·gtpimabrt4對gtp結合的krasg12d的親和力,使用biacore2000儀器(gehealthcare)進行spr(表面等離子體共振)。
具體地,在10mm乙酸鈉緩沖液(ph4.0)中稀釋抗ras·gtpimabrt4且以約1100響應單位(ru)的濃度固定在cm5傳感器芯片(gehealthcare)上。為了分析,以30μl/min的流速沖洗tris緩沖液(20mmtris-hcl,ph8.0,100mmnacl,5mmmgcl2,0.005%吐溫20)并以1000nm-62.5nm的濃度使用gtp結合的krasg12d。對締合和解離進行分析后,通過以30μl/min的流速沖洗緩沖液(10mmnaoh,1mnacl,ph10.0)1.5分鐘使cm5芯片再生。對在締合3分鐘和解離3分鐘獲得的每張傳感圖進行歸一化并扣除空白細胞由此確定親和力。
圖13顯示了通過使用spr(biacore2000)(gehealthcare)分析抗ras·gtpimabrt4對gtp結合的krasg12d的親和力的結果。
實施例12:檢查抗ras·gtpimabrt4穿透細胞溶膠的能力
圖14顯示了進行共聚焦顯微鏡觀察以檢查抗ras·gtpimabrt4穿透細胞溶膠的能力的結果。在具有突變的kras的細胞系(panc-1和hct116)和具有野生型kras的細胞系(ht29、hela)中分析了抗ras·gtpimabrt4穿透細胞的能力。
具體地,將每種細胞系以5×104個細胞/孔的密度添加至24孔板中且在0.5ml含有10%fbs的培養基中在5%co2和37℃的條件下培養12小時。當細胞穩定化時,將在0.5ml新鮮培養基中以1μm的濃度稀釋的tmab4和rt4各自添加至每個孔中,然后在5%co2和37℃的條件下溫育6小時。然后去除培養基且每個孔用pbs洗滌且然后用弱酸性溶液(200mm甘氨酸,150mmnacl(ph2.5))處理以由細胞表面去除蛋白。用pbs洗滌后,將細胞在4%多聚甲醛中在25℃固定10分鐘。然后每個孔用pbs洗滌且用包含0.1%皂苷、0.1%疊氮化鈉和1%bsa的pbs緩沖液在25℃溫育10分鐘以在細胞膜中成孔。然后每個孔用pbs洗滌且然后用包含2%bsa的pbs緩沖液在25℃溫育1小時從而消除非特異性結合。然后每個孔用經fitc(綠色熒光)標記的特異性識別人fc的抗體(sigma)在25℃溫育1.5小時且細胞核用hoechst33342進行藍色染色且用共聚焦顯微鏡觀察。觀察到抗ras·gtpimab顯示出在細胞中的熒光,這表明cytotransmab沒有喪失其穿透細胞溶膠的能力,即使在其用與結合有gtp的kras特異性結合的重鏈可變區替換后。
實施例13:評估抗ras·gtpimabrt4的細胞毒性
(1)評估抗ras·gtpimab對粘附細胞生長的抑制作用
圖15顯示了通過在體外用抗ras·gtpimabrt4處理nih3t3、nih3t3krasg12v和nih3t3hrasg12v細胞系并評估對細胞生長的抑制而獲得的結果。
具體地,為了檢查抗ras·gtpimab是否在體外具有特異性針對kras突變體依賴性細胞的細胞毒性,野生型krasnih3t3小鼠成纖維細胞、具有人工過表達的ras突變體的nih3t3krasg12v細胞、nih3t3hrasg12v突變細胞和krasg13d突變體人胰腺細胞(panc-1)用1μmtmab4和rt4中的每種處理并評估對粘附細胞生長的抑制。
具體地,將每種類型的nih3t3和panc-1細胞以2×103個細胞/孔的密度添加至24孔板中且在0.5ml含有10%fbs的培養基中在5%co2和37℃的條件下培養12小時。然后細胞用1μmtmab4或rt4處理兩次每次72小時且觀察共144小時且然后對活細胞的數目進行計數由此確定細胞生長程度。
如圖21所示,用tmab4處理的細胞沒有顯示出細胞毒性,而rt4抑制kras突變細胞系(nih3t3krasg12v和nih3t3hrasg12v)的生長且nih3t3細胞沒有顯示出細胞毒性。還抑制了krasg13d突變體panc-1細胞生長。因此,tmab4不具有細胞毒性,而rt4抑制細胞生長。
(2)評估抗ras·gtpimabrt4對非粘附細胞生長的抑制作用
圖16顯示了在nih3t3hrasg12v細胞系中評估對非粘附細胞生長的抑制的結果。
具體地,為了檢查抗ras·gtpimab是否在kras突變細胞中抑制非粘附細胞生長,通過集落形成測定對nih3t3hrasg12v突變細胞進行分析。具體地,將0.5ml2×dmem培養基和0.5ml1%瓊脂糖溶液的混合物鋪板在12孔板上并硬化以形成0.5%凝膠。然后將0.4ml2×dmem培養基、0.5ml0.7%瓊脂糖和0.05ml1×103個nih3t3hrasg12v細胞與0.05ml(20μm)pbs、tmab4、rt4或lonafarnib(20μm)混合且將混合物鋪板在0.5%瓊脂糖凝膠上并硬化。然后0.35%瓊脂糖凝膠用1μmpbs、tmab4、rt4或lonafarnib在0.5ml1×dmem中的分散液以3天間隔處理共21天。在第21天,細胞用nbt(硝基藍四唑鎓)溶液染色且然后對集落的數目進行計數。
與就對粘附細胞生長的抑制所進行的上述實驗的結果類似的是,rt4抑制集落形成,而tmab4不抑制集落形成。
上述結果表明抗ras·gtpimabrt4與細胞溶膠中的ras突變體特異性結合且抑制粘附和非粘附細胞生長。
實施例14:檢查抗ras·gtpimabrt4是否與細胞中結合有gtp的kras特異性結合
圖17顯示了抗ras·gtpimabrt4是否與細胞中活化的hrasg12v突變體疊加的結果。圖18顯示了對抗ras·gtpimab是否與細胞中結合有gtp的krasg12v突變體疊加進行共聚焦顯微鏡觀察的結果。
具體地,24孔板用纖連蛋白(sigma)涂覆且然后將0.5ml表達mcherry(紅色熒光)hrasg12v或mcherry(紅色熒光)krasg12v的nih3t3細胞的稀釋液以2×104個細胞/孔的密度添加至板中且在5%co2和37℃的條件下培養12小時。然后細胞用2μmtmab4和rt4中的每種處理且在37℃培養12小時。然后去除培養基且每個孔用pbs洗滌且然后用弱酸性溶液(200mm甘氨酸,150mmnacl(ph2.5))處理以由細胞表面去除蛋白。用pbs洗滌后,將細胞在4%多聚甲醛中在25℃固定10分鐘。然后每個孔用pbs洗滌且用包含0.1%皂苷、0.1%疊氮化鈉和1%bsa的pbs緩沖液在25℃溫育10分鐘以在細胞膜中成孔。然后每個孔用pbs洗滌且然后用包含2%bsa的pbs緩沖液在25℃溫育1小時從而消除非特異性結合。然后每個孔用經fitc(綠色熒光)標記的特異性識別人fc的抗體在25℃溫育1.5小時且細胞核用hoechst33342進行藍色染色且用共聚焦顯微鏡觀察。
如圖17和18所示,綠色熒光的rt4與紅色熒光的活化的ras所處的細胞內膜疊加,而tmab沒有疊加。
上述實驗結果表明抗ras·gtpimabrt4與細胞中結合有gtp的ras特異性結合。
實施例15:評估rgd融合的抗ras·gtpimabrt4的細胞毒性
體內實驗需要賦予腫瘤組織特異性。常規的cytotransmab與細胞表面上的hspg結合且不具有針對任何其它腫瘤組織的特異性且由于該原因而不能在體內實驗中特異性抑制腫瘤生長。為了克服該問題,經由一個ggggs接頭通過遺傳工程化方法使對在血管生成細胞和多種腫瘤中過表達的整聯蛋白αvβ3具有特異性的rgd4c肽(cdcrgdcfc;seqidno:41)與輕鏈的n末端融合。rgd4c肽的特征在于其具有比常規的rgd肽高的親和力且可使用遺傳工程化方法融合且可維持其特異性結構,即使當其與n末端融合時(koivunene等人,1995)。
圖19顯示了通過在體外用rgd-tmab4和rgd-rt4處理hct116和panc-1細胞系并評估對細胞生長的抑制而獲得的結果。
為了檢查rgd-tmab4和rgd-rt4本身是否在體外具有細胞毒性,具有krasg13d突變體的人結腸直腸癌hct116細胞和具有krasg12d突變體的人胰腺癌panc-1細胞用rgd-tmab4和rgd-rt4中的每種處理并評估對細胞生長的抑制。
具體地,將每種類型的hct116和panc-1細胞以5×103個細胞/孔的密度添加至24孔板中且在0.5ml含有10%fbs的培養基中在5%co2和37℃的條件下培養12小時。然后細胞用1μmrgd-tmab4和rgd-rt4中的每種處理兩次每次72小時且觀察共144小時且然后對細胞的數目進行計數由此確定細胞生長程度。
如圖19所示,rgd-tmab4將hct116細胞生長抑制約20%且將panc-1細胞生長抑制約15%且rgd-rt4將hct116和panc-1細胞生長分別抑制約40%和約50%。根據先前的研究,rgd4c肽對整聯蛋白αvβ5所具有的親和力為對整聯蛋白αvβ3的親和力的約1/3。然而,整聯蛋白αvβ3主要在血管生成細胞中過表達且整聯蛋白αvβ5在多種腫瘤細胞中表達。因此,rgd4c肽具有與hct116和panc-1細胞的αvβ5結合的能力由此抑制細胞粘附(caol等人,2008)。
因此,rgd4c肽融合的tmab4沒有表現出具有細胞毒性。另外,在rgd-tmab4和rgd-rt4之間進行的比較間接確認了tmab4可抑制ras特異性細胞生長,即使當rgd與其融合時。
實施例16:檢查rgd融合的抗ras·gtpimab在抑制腫瘤生長方面的作用
圖20a顯示了在異種移植有hct116細胞的小鼠中對rgd融合的抗ras·gtpimabrt4的腫瘤生長抑制作用進行分析的結果。圖20b的圖顯示了測量小鼠體重從而檢查rgd融合的抗ras·gtpimabrt4的非特異性副作用的結果。
具體地,為了基于實施例15的體外實驗結果檢查rgd-rt4在體內的腫瘤生長抑制作用,將krasg13d突變體人結腸直腸hct116細胞以5×106個細胞/小鼠的密度皮下注射到balb/c裸鼠中。約6天后,當腫瘤體積達到約50mm3時,小鼠被靜脈內注射20mg/kgpbs、rgd-tmab4和rgd-rt4中的每種。歷時18天以2天間隔共進行9次注射且使用卡尺測量腫瘤體積。
如圖20a所示,與對照pbs不同的是,rgd-tmab4和rgd-rt4抑制癌細胞生長且rgd-rt4與rgd-tmab4相比更有效地抑制腫瘤生長。另外,如圖20b所示,在用rgd-rt4處理的測試組中不存在體重變化,這表明rgd-rt4不具有其它毒性。
實施例17:構建和篩選用于改進抗ras·gtpimabrt4的親和力的文庫
抗ras·gtpimabrt4顯示出ras特異性生物活性,但是其通過spr分析確定的親和力為約110nm。因此,其對抗原具有非常低的親和力,即使其為igg型抗體。為了彌補該缺點并允許抗ras·gtpimabrt4即使在低濃度也展現出提高的生物活性而需要改進抗ras·gtpimabrt4的親和力。
圖21a顯示了構建人重鏈可變區文庫以改進rt4的親和力的策略。為了改進親和力,對在與抗原結合中發揮重要作用的cdr3(殘基95-100a)進行設計以具有6個殘基(文庫6)、7個殘基(文庫7)和9個殘基(文庫9)的長度且使用能夠編碼所有氨基酸殘基的簡并密碼子(nnk)。另外,為了改進親和力且保留rt4的抗原結合位點,將能夠以50%的比例維持野生型rt4殘基的穗狀低聚體用于顯示出高溶劑可及性的cdr1(殘基31-33)和cdr2(殘基50和52-56)。在該技術中,對引物進行設計從而使三種對每種殘基的氨基酸進行編碼的核苷酸中野生型核苷酸的百分比維持在79%且剩余的核苷酸的百分比為7%從而使pcr過程中的野生型氨基酸將維持在50%。
圖21b的示意圖顯示了通過pcr技術構建所設計的文庫且通過用經限制酶nhei和apai處理的重鏈單酵母表面展示載體(pyds-h)進行同源重組將所構建的文庫轉化到酵母表面上的方法。
具體地,編碼每種所設計的文庫的dna通過pcr技術擴增且然后通過乙醇沉淀富集。用于同源重組的pyds-h重鏈酵母表面展示載體用nhei和apai限制酶處理,然后通過瓊脂糖凝膠提取對其進行純化且通過乙醇沉淀富集。對于12μg每種編碼文庫的dna,通過電穿孔將5μg載體轉化到配對用a型酵母jar200中用于酵母表面展示(baekd.s和kimy.s,2014;lorenzob等人,2010),然后進行連續稀釋。對選擇介質sd-caa+ura(20g/l葡萄糖,6.7g/l不含有氨基酸的酵母氮堿,5.4g/lna2hpo4,8.6g/lnah2po4,5g/l酪蛋白氨基酸,0.2mg/l尿嘧啶)中集落的數目進行測量以確定文庫的大小。
在每個文庫篩選過程中,根據實施例3和4所示方法使用僅展示重鏈可變區的酵母文庫針對gtp結合的krasg12d以100nm的抗原濃度進行第一macs。然后對于通過酵母配對的fab文庫,通過競爭性結合于在第一、第二和第三facs中沒有生物素化的結合有gdp的krasg12d來選擇特異性針對結合有gtp的krasg12d的克隆。
圖22顯示了進行facs分析的結果以在每個步驟中就文庫表達酵母而言確定文庫6(其為具有6個殘基的cdr3長度的文庫)對gtp結合的krasg12d和gdp結合的krasg12d的親和力從而確認在上述文庫篩選過程中特異性針對gtp結合的krasg12d的富集。如在此所示那樣,所篩選的文庫的確與結合有gtp的krasg12d特異性結合且顯示出比用作模板的rt4高的親和力。
圖23顯示了對使用三種文庫的各個克隆進行測序的結果。如在此所示那樣,僅對具有通過文庫誘導的突變的cdr區中的殘基進行了突變。
表4顯示了通過使用rt4作為模板從具有改進的親和力的文庫中選擇的各個克隆的人抗體重鏈可變區(vh)序列且下表5顯示了特異性針對ras·gtp的所選重鏈可變區(vh)序列的cdr1、cdr2和cdr3的序列。
表4:在抗ras·gtpimab中使用的針對ras·gtp顯示出特異性親和力的人抗體重鏈可變區(vh)序列
表5:在抗ras·gtpimab中使用的針對ras·gtp顯示出特異性親和力的人抗體重鏈可變區(vh)的cdr序列
實施例18:對具有改進的親和力的抗ras·gtpimab進行表達和純化
如實施例11所述,將包含通過文庫篩選獲得且對ras·gtp具有改進的親和力的重鏈可變區和重鏈恒定區(ch1-鉸鏈-ch2-ch3)的重鏈克隆到動物表達載體中。將所述表達載體和表達穿透細胞溶膠的人源化輕鏈的載體瞬時共轉染到hek293f蛋白表達細胞中。在細胞中表達抗ras·gtpimab并以與實施例11所述相同的方式純化。
圖24顯示了通過12%sds-page在還原或非還原條件下分析具有改進的親和力的抗ras·gtpimab的結果。
具體地,如實施例11所述,在非還原條件下出現約150kda的分子量且在還原條件下出現約50kda的重鏈分子量和約25kda的輕鏈分子量。這表明所表達和純化的抗ras·gtpimab在溶液狀態下以單體形式存在且不通過非天然二硫鍵形成二聚體或低聚體。
實施例19:檢查具有改進的親和力的ras·gtpimab穿透細胞的能力
圖25顯示了通過用具有改進的親和力的ras·gtp特異性重鏈可變區替換抗ras·gtpimab的重鏈可變區且然后進行共聚焦顯微鏡觀察以確認抗ras·gtpimab是否能夠穿透細胞的結果。
具體地,用0.5ml含有10%fbs的培養基將hela細胞以5×104個細胞/孔的細胞密度添加至24孔板的每個孔中且在5%co2和37℃的條件下培養12小時。當細胞穩定化時,將tmab4、rt11、rt13、rt14、rt15、rt16和rt17各自在0.5ml新鮮培養基中的1:17稀釋液添加至每個孔中,然后將其在5%co2和37℃的條件下溫育6小時。后續操作以與實施例14所述rt4染色操作相同的方式進行。觀察到rt11、rt13、rt14、rt15、rt16和rt17(其為具有改進的親和力的抗ras·gtpimab)的細胞內熒光,這表明其具有穿透細胞的能力。
實施例20:分析具有改進的親和力的抗ras·gtpimab克隆對gtp結合的ras的特異性親和力
圖26a顯示了進行elisa以測量具有改進的親和力的抗ras·gtpimab克隆對gtp結合的krasg12d和gdp結合的krasg12d的親和力的結果。
具體地,根據與實施例11所述相同的方法,將作為靶分子的gtp結合的kras突變體和gdp結合的kras突變體各自在96孔eia/ria板(costarcorning)中在37℃溫育1小時且然后板用0.1%tbst(0.1%吐溫20,ph7.4,137mmnacl,12mmtris,2.7mmkcl,5mmmgcl2)(sigma)以10分鐘洗滌三次。然后板的每個孔用4%tbsb(4%bsa,ph7.4,137mmnacl,12mmtris,2.7mmkcl,10mmmgcl2)(sigma)溫育1小時且然后用0.1%tbst以10分鐘洗滌三次。然后每個孔用在4%tbsb中以不同濃度稀釋的每種抗ras·gtpimab克隆溫育,然后每個孔用0.1%tbst以10分鐘洗滌三次。山羊堿性磷酸酶綴合的抗人mab(sigma)用作標志物抗體。每個孔用ultratmb-elisa底物溶液(thermoscientific)溫育且然后測量在450nm的吸光度。
如圖26a所示,在具有改進的親和力的抗ras·gtpimab克隆中,將rt11選作對gtp結合的krasg12d具有高特異性親和力的克隆。
圖26b顯示了進行elisa分析以確認以基于elisa的結合分析為基礎而選擇的rt11對多種gtp結合的ras突變體的親和力的結果。
具體地,使用與對具有改進的親和力的抗ras·gtpimab的親和力進行的上述分析所用相同的elisa方法分析了抗ras·gtpimabrt11對gtp或gdp結合的野生型kras、krasg12d、krasg12v、krasg13d、野生型hras和hrasg12v的親和力。
如圖26b所示,抗ras·gtpimabrt11不與多種gtp結合的ras突變體結合。
實施例21:定量分析抗ras·gtpimabrt11對krasg12d的親和力
為了定量分析抗ras·gtpimabrt11對gtp結合的krasg12d的親和力,使用biacore2000儀器(gehealthcare)進行spr(表面等離子體共振)。
圖27a顯示了通過使用spr(biacore2000)(gehealthcare)分析抗ras·gtpimabrt11對gtp結合的krasg12d的親和力的結果。
圖27b的傳感圖顯示了分析rt11對最高濃度(1000nm)的gtp或gdp結合的krasg12d的親和力的結果。
具體地,根據與實施例11所述相同的方法,將抗ras·gtpimabrt11以約1100響應單位(ru)的濃度固定在cm5傳感器芯片(gehealthcare)上。為了分析,以30μl/min的流速沖洗tris緩沖液(20mmtris-hcl,ph8.0,100mmnacl,5mmmgcl2,0.005%吐溫20)并以1000nm-62.5nm的濃度使用gtp或gdp結合的krasg12d。
由此證實rt11的確以高親和力(12.9nm)與krasg12d結合。
實施例22:分析抗ras·gtpimabrt11抑制gtp結合的kras和raf之間的結合的能力
圖28顯示了進行競爭性elisa以確認抗ras·gtpimabrt11是否可抑制效應分子raf和細胞內kras之間的結合的結果。
具體地,通過限制酶bamhi/ecori將效應蛋白craf(nm_002880.2)的ras結合位點(rbd:1-149)片段克隆到大腸桿菌表達載體pgex-3x中且然后根據與實施例2所述相同的方法表達和純化。將所純化的craf-rbd在96孔eia/ria板(costarcorning)中在37℃溫育1小時且然后板用0.1%tbst(0.1%吐溫20,ph7.4,137mmnacl,12mmtris,2.7mmkcl,5mmmgcl2)(sigma)以10分鐘洗滌三次。板的每個孔用4%tbsb(4%bsa,ph7.4,137mmnacl,12mmtris,2.7mmkcl,10mmmgcl2)(sigma)溫育1小時且然后用0.1%tbst以10分鐘洗滌三次。然后以不同濃度(1μm-5.64pm)在4%tbsb中稀釋的每種濃度的抗ras·gtpimabrt11用1μm生物素化的結合有gtp的krasg12d溫育且然后每個孔用0.1%tbst以10分鐘洗滌三次。山羊堿性磷酸酶綴合的抗人mab(sigma)用作標志物抗體。每個孔用pnpp(棕櫚酸對硝基苯基酯)(sigma)溫育并測量在405nm的吸光度。
如圖28所示,抗ras·gtpimabrt11顯示出對與效應蛋白craf的結合進行抑制的能力(ic50=35nm)。
實施例23:檢查抗ras·gtpimabrt11穿透多種腫瘤細胞的能力
圖29顯示了進行共聚焦顯微鏡觀察以確認具有改進的親和力的抗ras·gtpimab是否能夠穿透多種類型的腫瘤細胞的結果。
包括人結腸直腸癌細胞系(sw480(krasg12v突變體)、panc-1(krasg12d突變體)、dld-1(krasg13d突變體)、hct116(krasg13d突變體))和人纖維肉瘤細胞系(ht1080(nrasq61l突變體)在內的多種腫瘤細胞系用作ras突變細胞系且人乳腺癌細胞系(mcf7)和人結腸直腸癌細胞系(ht29、caco2、colo320dm)用作ras野生型細胞系。
具體地,用0.5ml含有10%fbs的培養基將上述ras突變體和ras野生型細胞系各自以5×104個細胞/孔的密度添加至24孔板的每個孔中且在5%co2和37℃的條件下培養12小時。當細胞穩定化時,將在新鮮孔中以2μm的濃度稀釋的tmab4和rt11各自添加至每個孔中,然后將其在5%co2和37℃的條件下溫育12小時。后續操作以與實施例14所述rt4染色操作相同的方式進行。作為結果,具有改進的親和力的抗ras·gtpimabrt11顯示出在多種類型的腫瘤細胞中的熒光,這表明其具有以與tmab4相同的方式穿透多種腫瘤細胞系的能力。
實施例24:檢查抗ras·gtpimabrt11保留在細胞溶膠中的能力
圖30顯示了使用非穿透細胞的自身淬滅染料(鈣黃綠素(sigma))進行共聚焦顯微鏡觀察以觀察具有改進的親和力的抗ras·gtpimab保留在細胞溶膠中的能力的結果。
具體地,用0.5ml含有10%fbs的培養基將hct116細胞以5×104個細胞/孔的密度添加至24孔板的每個孔中且在5%co2和37℃的條件下培養12小時。然后每個孔用1μmtmab4和rt4處理4小時且然后用100μm鈣黃綠素處理2小時。然后去除培養基且每個孔用pbs洗滌且然后用弱酸性溶液(200mm甘氨酸,150mmnaclph2.5)處理以由細胞表面去除鈣黃綠素。用pbs洗滌后,細胞用4%多聚甲醛在25℃固定10分鐘。然后每個孔用pbs洗滌且細胞核用hoechst33342進行藍色染色且用共聚焦顯微鏡觀察。如圖30所示,抗ras·gtpimabrt11和cytotransmabtmab4都顯示出貫穿細胞溶膠的鈣黃綠素熒光。然而,pbs僅顯示出囊泡形熒光。上述結果表明抗ras·gtpimabrt11保留在細胞溶膠中。
實施例25:評估抗ras·gtpimabrt11的細胞毒性
圖31顯示了通過在體外用抗ras·gtpimabrt11處理多種ras野生型和ras突變細胞系并評估對細胞生長的抑制而獲得的結果且圖32的一組圖像顯示了進行偏振光顯微鏡觀察以確定每種細胞系的細胞密度的結果。
具體地,為了在體外檢查抗ras·gtpimabrt11是否具有特異性針對ras突變細胞系的細胞毒性,使用小鼠nih3t3成纖維細胞和人結腸直腸癌colo320dm細胞作為ras野生型細胞系且使用小鼠nih3t3krasg12v突變細胞、人結腸直腸癌細胞系(hct116細胞(krasg13d)、hct116(krasg13d)、sw480(krasg12v)、dld-1(krasg13d))和人胰腺細胞系(panc-1(krasg12d))評估對細胞生長的抑制。
具體地,用0.5ml含有10%fbs的培養基將每種類型的上述細胞系以2-5×103個細胞/孔的密度添加至24孔板的每個孔中且在37℃和5%co2的條件下培養12小時。然后每個孔用tmab4和rt11中的每種處理兩次每次72小時且觀察共144小時且然后對活細胞的數目進行計數由此確定細胞生長程度。
如圖31和32所示,tmab4沒有顯示出細胞毒性,而rt11僅抑制ras突變細胞(nih3t3krasg12v、hct116、panc-1、sw480和dld-1)的生長且在ras野生型細胞系(nih3t3和colo320dm)中沒有顯示出細胞毒性。
實施例26:檢查抗ras·gtpimabrt11與細胞內活化的ras特異性結合及抑制活化的ras和效應蛋白之間的結合的能力
(1)檢查抗ras·gtpimabrt11與細胞內ras·gtp特異性結合的能力
圖33顯示了進行共聚焦顯微鏡觀察以檢查rt11是否與細胞中活化的krasg12v突變體疊加的結果。
具體地,24孔板用纖連蛋白(sigma)涂覆且然后將0.5ml表達mcherry(紅色熒光)hrasg12v的nih3t3細胞的稀釋液以2×102個細胞/孔的密度添加至板中且在5%co2和37℃的條件下培養12小時。然后細胞用2μmtmab4和rt11中的每種處理且在37℃培養12小時。然后細胞在與實施例14所述相同的條件下染色且用共聚焦顯微鏡觀察。
如圖33所示,綠色熒光的rt11與紅色熒光的活化的ras所處的細胞內膜疊加,而tmab沒有疊加。
圖34顯示了進行免疫沉淀測定以確認rt11是否與細胞中活化的ras結合的結果。
具體地,將表達krasg12v突變體的nih3t3細胞系和hct116細胞系中的每種的10ml稀釋液以2×106個細胞/孔的密度添加至100mm3板中且在37℃和5%co2的條件下培養12小時。然后細胞用2μmtmab4和rt11中的每種處理且在37℃培養12小時。然后使用細胞裂解緩沖液(25mmtris-clph7.4,150mmnacl,1%np-40,10mmmgcl2,10%甘油,蛋白酶抑制劑)裂解細胞且通過沉淀去除細胞碎片。將蛋白a/g瓊脂糖添加至細胞裂解物中且溫育2小時且然后使抗體沉淀。然后使用抗kras抗體(santacruz)和人fc抗體(sigma)進行western印跡分析。
如圖34所示,僅在rt11中觀察到kras,但是沒有在tmab4和pbs中觀察到kras。
上述實驗結果表明rt11與細胞內活化的ras特異性結合。
(2)檢查抗ras·gtpimabrt11抑制ras·gtp和效應分子之間的結合的能力
圖35a和35b顯示了進行免疫沉淀測定以檢查rt11是否抑制ras·gtp和效應蛋白之間的結合的結果。
具體地,將表達krasg12v突變體的nih3t3細胞系和hct116細胞系中的每種的10ml稀釋液以2×106個細胞/孔的密度添加至100mm3板中且在37℃和5%co2的條件下培養12小時。然后細胞用2μmtmab4和rt11中的每種處理且在37℃培養12小時。然后使用細胞裂解緩沖液(25mmtris-clph7.4,150mmnacl,1%np-40,10mmmgcl2,10%甘油,蛋白酶抑制劑)裂解細胞且通過沉淀去除細胞碎片。krasg12v突變細胞裂解物用抗ha抗體(covance)溫育2小時且然后用蛋白a/g瓊脂糖處理以使抗ha抗體沉淀。將raf-1rbd瓊脂糖(millipore)添加至hct116細胞裂解物中且溫育2小時且然后沉淀。然后使用抗b-raf、c-raf、pi3k和kras抗體(santacruz)及人fc抗體(sigma)進行western印跡分析。
如圖35a所示,抗ras·gtpimabrt11抑制ras·gtp和效應蛋白(b-raf和c-raf)之間的結合,而tmab4沒有抑制所述結合。類似地,圖35b顯示僅抗ras·gtpimabrt11抑制效應蛋白c-raf和ras·gtp之間的結合,而tmab4沒有抑制所述結合。
上述實驗結果表明rt11與細胞內ras·gtp特異性結合由此抑制ras·gtp和效應蛋白(b-raf和c-raf)之間的結合。
實施例27:構建rgd10肽融合的抗ras·gtpimabrt11和分析與ras·gtp結合的能力
如實施例15所述,抗ras·gtpimabrt11通過與細胞表面上的hspg結合來進行穿透。因此,需要向抗ras·gtpimabrt11賦予組織特異性用于體內實驗。出于該目的,經由包含共10個殘基(ggggsggggs)的接頭通過遺傳工程化方法使對在血管生成細胞和多種腫瘤中過表達的整聯蛋白αvβ3具有特異性的rgd10肽(dgarycrgdcfdg;seqidno:42)與輕鏈的n末端融合。rgd10肽將對整聯蛋白具有親和力,這與上述融合至rt4的rgd4c肽是類似的且其在肽中具有一個二硫鍵且因此被預期較容易與抗體的n末端融合。因此,通過遺傳工程化方法使rgd10肽與抗ras·gtpimabrt11融合。
圖36顯示了通過測量所構建的rgd10肽融合的rt11對多種gtp結合的和gdp結合的ras突變體的親和力而獲得的elisa結果。
具體地,根據與實施例11所述相同的方法,將作為靶分子的gtp結合的krasg12d和gdp結合的ras各自在96孔eia/ria板(costarcorning)中在37℃溫育1小時且然后板用0.1%tbst(0.1%吐溫20,ph7.4,137mmnacl,12mmtris,2.7mmkcl,5mmmgcl2)(sigma)以10分鐘洗滌三次。然后板的每個孔用4%tbsb(4%bsa,ph7.4,137mmnacl,12mmtris,2.7mmkcl,10mmmgcl2)(sigma)溫育1小時且然后用0.1%tbst以10分鐘洗滌三次。然后每個孔用在4%tbsb中以不同濃度稀釋的每種抗ras·gtpimab克隆溫育,然后每個孔用0.1%pbst以10分鐘洗滌三次。山羊堿性磷酸酶綴合的抗人mab(sigma)用作標志物抗體。每個孔用ultratmb-elisa底物溶液(thermoscientific)溫育且然后測量在450nm的吸光度。
如圖36所示,rgd10肽融合的rt11(rgd10-rt11)顯示出對gtp結合的ras突變體具有相同的親和力。
實施例28:評估rgd10融合的抗ras·gtpimabrt11的細胞毒性
圖37和38顯示了通過在體外用rgd10-tmab4和rgd10-rt11處理colo320dm、hct116、panc-1、sw480和dld-1細胞系且評估對細胞生長的抑制而獲得的結果。
為了評估rgd10-tmab4和rgd-rt11本身是否在體外具有細胞毒性,使用人結腸直腸癌colo320dm細胞作為ras野生型細胞系且使用人結腸直腸癌細胞系(hct116(krasg13d)、sw480(krasg12v)、dld-1(krasg13d))和人胰腺癌細胞系(panc-1(krasg12d))評估對細胞生長的抑制。
具體地,用0.5ml含有10%fbs的培養基將細胞以5×103個細胞/孔的密度添加至24孔板的每個孔中且在37℃和5%co2的條件下培養12小時。然后細胞用1μmrgd10-tmab4和rgd10-rt11中的每種處理兩次每次72小時且觀察共144小時且然后對活細胞的數目進行計數以確定細胞生長程度。
如圖37所示,在rgd10-tmab4和rgd10-rt11之間進行的比較表明kras突變細胞系(hct116、sw480、dld-1和panc-1)在細胞生長方面顯示出約8-12%的差異,而ras野生型細胞系在細胞生長方面沒有顯示出差異。因此,在rgd10-tmab4和rgd10-rt11之間進行的比較表明rt11可抑制ras特異性細胞生長,即使當rgd10肽與其融合時。
實施例29:檢查rgd10融合的抗ras·gtpimabrt11是否與整聯蛋白ανβ3特異性結合
圖39顯示了進行分析以檢查rgd10-tmab4和rgd10-rt11是否與細胞表面上的整聯蛋白ανβ3特異性結合的結果。
具體地,將k562細胞系和k562整聯蛋白ανβ3過表達細胞系中的每種以2×105個細胞的密度添加至1.5ml,然后用洗滌緩沖液(ph7.4pbs,2%fbs)洗滌兩次。將100nmtmab4、rgd10-tmab4和rgd10-rt11中的每種與300iu/ml肝素(sigma)混合且將細胞與混合物在4℃溫育1小時。細胞用洗滌緩沖液洗滌兩次且然后用特異性識別人igg的經alexa488(綠色熒光)標記的抗體(invitrogen)在4℃染色1小時。然后細胞用洗滌緩沖液洗滌兩次且通過facs分析。
如圖39所示,與tmab4不同的是,rgd10-tmab4和rgd10-rt11的確與k562整聯蛋白ανβ3細胞特異性結合。這表明rgd10肽與整聯蛋白ανβ3特異性結合。
實施例30:檢查抗ras·gtpimabrt11是否與細胞內ras·gtp特異性結合
圖40顯示了進行共聚焦顯微鏡觀察以檢查rgd10-rt11是否與細胞中活化的krasg12v突變體疊加的結果。
具體地,24孔板用纖連蛋白(sigma)涂覆且然后將0.5ml表達mcherry(紅色熒光)krasg12v的nih3t3細胞的稀釋液以2×102個細胞/孔的密度添加至每個孔中且在5%co2和37℃的條件下培養12小時。然后細胞用1μmrgd10-tmab4和rgd10-rt11中的每種處理且在37℃的條件下溫育12小時。然后細胞在與實施例14所述相同的條件下染色且用共聚焦顯微鏡觀察。
如圖40所示,綠色熒光的rgd10-rt11與紅色熒光的活化的ras所處的細胞內膜疊加,而rgd10-tmab沒有疊加。
上述實驗結果表明rgd10-rt11與細胞內活化的ras特異性結合。
序列表
<110>奧隆制藥
<120>使用能夠穿透細胞質的完整免疫球蛋白類型的抗體抑制在細胞中活化的ras的方法及其用途
<130>pf-b1812
<140>pct/kr2015/007627
<141>2015-07-22
<150>10-2014-0092687
<151>2014-07-22
<150>10-2015-0103214
<151>2015-07-21
<160>42
<170>patentinversion3.2
<210>1
<211>118
<212>prt
<213>人工
<220>
<223>rt4
<400>1
gluvalglnleuvalgluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrphesersertyr
202530
alametsertrpvalargglnalaproglylysglyleuglutrpval
354045
serthrileserargserglyhisserthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysargpheglyserilevalpheasptyrtrpglyglnglythr
100105110
leuvalthrvalserser
115
<210>2
<211>115
<212>prt
<213>人工
<220>
<223>rt11
<400>2
gluvalglnleuvalgluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrphesersertyr
202530
sermetsertrpvalargglnalaproglylysglyleuglutrpval
354045
sertyrileserargthrserhisthrthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alaargglyphephemetasptyrtrpglyglnglythrleuvalthr
100105110
valserser
115
<210>3
<211>116
<212>prt
<213>人工
<220>
<223>rt13
<400>3
gluvalglnleuvalgluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheserthrphe
202530
sermetsertrpvalargglnalaproglylysglyleuglutrpval
354045
sertyrileserargthrserhisthrthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alaargglythrpheglypheasptyrtrpglyglnglythrleuval
100105110
thrvalserser
115
<210>4
<211>116
<212>prt
<213>人工
<220>
<223>rt14
<400>4
gluvalglnleuvalgluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheserthrphe
202530
sermetsertrpvalargglnalaproglylysglyleuglutrpval
354045
sertyrileserargthrserhisthrthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alaargproargglytrppheasptyrtrpglyglnglythrleuval
100105110
thrvalserser
115
<210>5
<211>116
<212>prt
<213>人工
<220>
<223>rt15
<400>5
gluvalglnleuvalgluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheserthrphe
202530
sermetsertrpvalargglnalaproglylysglyleuglutrpval
354045
sertyrileserargthrserhisthrthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysargpheglyserpheasptyrtrpglyglnglythrleuval
100105110
thrvalserser
115
<210>6
<211>118
<212>prt
<213>人工
<220>
<223>rt16
<400>6
gluvalglnleuvalgluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheserthrphe
202530
sermetsertrpvalargglnalaproglylysglyleuglutrpval
354045
sertyrileserargthrserhisthrthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alaargserserglyargphevalpheasptyrtrpglyglnglythr
100105110
leuvalthrvalserser
115
<210>7
<211>118
<212>prt
<213>人工
<220>
<223>rt17
<400>7
gluvalglnleuvalgluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheserthrphe
202530
sermetsertrpvalargglnalaproglylysglyleuglutrpval
354045
sertyrileserargthrserhisthrthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alalysglyargpheglyservalpheasptyrtrpglyglnglythr
100105110
leuvalthrvalserser
115
<210>8
<211>5
<212>prt
<213>人工
<220>
<223>rt4cdr1
<400>8
sertyralametser
15
<210>9
<211>17
<212>prt
<213>人工
<220>
<223>rt4cdr2
<400>9
thrileserargserglyhisserthrtyrtyralaaspservallys
151015
gly
<210>10
<211>9
<212>prt
<213>人工
<220>
<223>rt4cdr3
<400>10
argpheglyserilevalpheasptyr
15
<210>11
<211>5
<212>prt
<213>人工
<220>
<223>rt11cdr1
<400>11
sertyrsermetser
15
<210>12
<211>17
<212>prt
<213>人工
<220>
<223>rt11cdr2
<400>12
tyrileserargthrserhisthrthrtyrtyralaaspservallys
151015
gly
<210>13
<211>6
<212>prt
<213>人工
<220>
<223>rt11cdr3
<400>13
glyphephemetasptyr
15
<210>14
<211>5
<212>prt
<213>人工
<220>
<223>rt13cdr1
<400>14
thrphesermetser
15
<210>15
<211>17
<212>prt
<213>人工
<220>
<223>rt13cdr2
<400>15
tyrileserargthrserhisthrthrtyrtyralaaspservallys
151015
gly
<210>16
<211>7
<212>prt
<213>人工
<220>
<223>rt13cdr3
<400>16
glythrpheglypheasptyr
15
<210>17
<211>5
<212>prt
<213>人工
<220>
<223>rt14cdr1
<400>17
thrphesermetser
15
<210>18
<211>17
<212>prt
<213>人工
<220>
<223>rt14cdr2
<400>18
tyrileserargthrserhisthrthrtyrtyralaaspservallys
151015
gly
<210>19
<211>7
<212>prt
<213>人工
<220>
<223>rt14cdr3
<400>19
proargglytrppheasptyr
15
<210>20
<211>5
<212>prt
<213>人工
<220>
<223>rt15cdr1
<400>20
thrphesermetser
15
<210>21
<211>17
<212>prt
<213>人工
<220>
<223>rt15cdr2
<400>21
tyrileserargthrserhisthrthrtyrtyralaaspservallys
151015
gly
<210>22
<211>7
<212>prt
<213>人工
<220>
<223>rt15cdr3
<400>22
argpheglyserpheasptyr
15
<210>23
<211>5
<212>prt
<213>人工
<220>
<223>rt16cdr1
<400>23
thrphesermetser
15
<210>24
<211>17
<212>prt
<213>人工
<220>
<223>rt16cdr2
<400>24
tyrileserargthrserhisthrthrtyrtyralaaspservallys
151015
gly
<210>25
<211>9
<212>prt
<213>人工
<220>
<223>rt16cdr3
<400>25
serserglyargphevalpheasptyr
15
<210>26
<211>5
<212>prt
<213>人工
<220>
<223>rt17cdr1
<400>26
thrphesermetser
15
<210>27
<211>17
<212>prt
<213>人工
<220>
<223>rt17cdr2
<400>27
tyrileserargthrserhisthrthrtyrtyralaaspservallys
151015
gly
<210>28
<211>9
<212>prt
<213>人工
<220>
<223>rt17cdr3
<400>28
glyargpheglyservalpheasptyr
15
<210>29
<211>114
<212>prt
<213>人工
<220>
<223>ht2vl
<400>29
aspleuvalmetthrglnserproalathrleuserleuserprogly
151015
gluargalathrleusercyslysserserglnserleupheasnser
202530
argthrarglysasntyrleualatrptyrglnglnlysproglygln
354045
alaproargleuleuiletyrtrpalaserthrarggluserglyile
505560
proaspargpheserglyserglyserglythraspphethrleuthr
65707580
ileserserleugluprogluaspphealavaltyrtyrcyslysgln
859095
sertyrtyrhismettyrthrpheglyglnglythrlysvalgluile
100105110
lysarg
<210>30
<211>114
<212>prt
<213>人工
<220>
<223>ht3vl
<400>30
aspleuvalmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcyslysserserglnserleupheasnser
202530
argthrarglysasntyrleualatrptyrglnglnlysproglylys
354045
alaprolysleuleuiletyrtrpalaserthrarggluserglyval
505560
proserargpheserglyserglyserglythraspphethrleuthr
65707580
ileserserleuglnprogluaspphealathrtyrtyrcyslysgln
859095
sertyrtyrhismettyrthrpheglyglnglythrlysvalgluile
100105110
lysarg
<210>31
<211>114
<212>prt
<213>人工
<220>
<223>ht4vl
<400>31
aspleuvalmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcyslysserserglnserleupheasnser
202530
argthrarglysasntyrleualatrptyrglnglnlysproglylys
354045
alaprolysleuleuiletyrtrpalaserthrarggluserglyval
505560
proserargpheserglyserglyserglythraspphethrleuthr
65707580
ileserserleuglnprogluaspphealathrtyrtyrcysglngln
859095
tyrtyrtyrhismettyrthrpheglyglnglythrlysvalgluile
100105110
lysarg
<210>32
<211>17
<212>prt
<213>人工
<220>
<223>ht2vlcdr1
<400>32
lysserserglnserleupheasnserargthrarglysasntyrleu
151015
ala
<210>33
<211>7
<212>prt
<213>人工
<220>
<223>ht2vlcdr2
<400>33
trpalaserthrarggluser
15
<210>34
<211>9
<212>prt
<213>人工
<220>
<223>ht2vlcdr3
<400>34
lysglnsertyrtyrhismettyrthr
15
<210>35
<211>17
<212>prt
<213>人工
<220>
<223>ht3vlcdr1
<400>35
lysserserglnserleupheasnserargthrarglysasntyrleu
151015
ala
<210>36
<211>7
<212>prt
<213>人工
<220>
<223>ht3vlcdr2
<400>36
trpalaserthrarggluser
15
<210>37
<211>9
<212>prt
<213>人工
<220>
<223>ht3vlcdr3
<400>37
lysglnsertyrtyrhismettyrthr
15
<210>38
<211>17
<212>prt
<213>人工
<220>
<223>ht4vlcdr1
<400>38
lysserserglnserleupheasnserargthrarglysasntyrleu
151015
ala
<210>39
<211>7
<212>prt
<213>人工
<220>
<223>ht4vlcdr2
<400>39
trpalaserthrarggluser
15
<210>40
<211>9
<212>prt
<213>人工
<220>
<223>ht4vlcdr3
<400>40
glnglntyrtyrtyrhismettyrthr
15
<210>41
<211>9
<212>prt
<213>人工
<220>
<223>rgd4c
<400>41
cysaspcysargglyaspcysphecys
15
<210>42
<211>13
<212>prt
<213>人工
<220>
<223>rgd10
<400>42
aspglyalaargtyrcysargglyaspcyspheaspgly
1510
- 還沒有人留言評論。精彩留言會獲得點贊!