抗癌組合物的制作方法
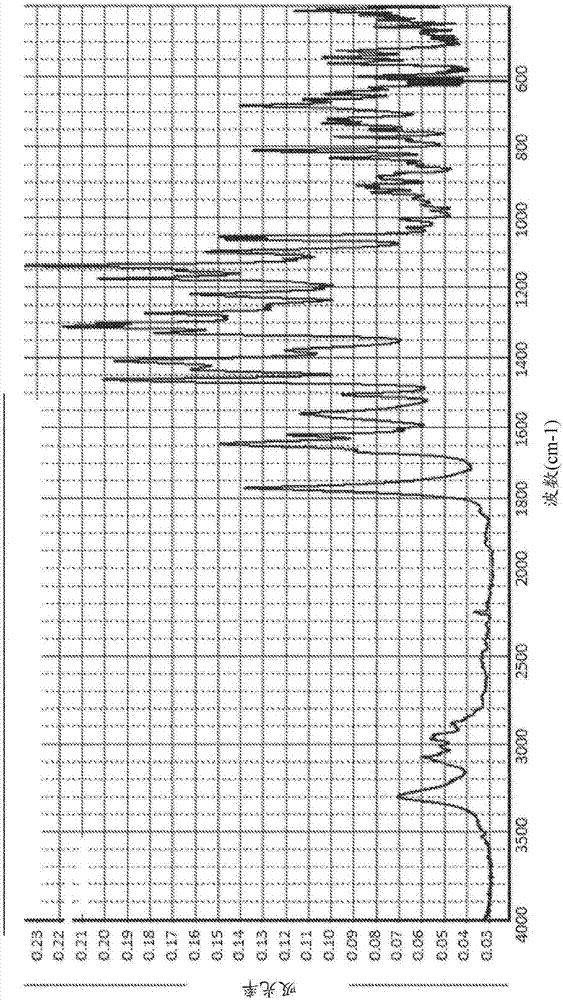
本發明涉及藥物制劑arn-509,其可以施用于患有雄激素受體(ar)相關疾病或病癥的哺乳動物,具體地人,所述ar相關疾病或病癥具體地是癌癥,更具體地是前列腺癌,包括但不限于去勢抵抗性前列腺癌、轉移性去勢抵抗性前列腺癌、未經化療轉移性去勢抵抗性前列腺癌、生化復發性激素敏感性前列腺癌,或高風險非轉移性去勢抵抗性前列腺癌。在一個方面,這些制劑包含arn-509和hpmcas的固體分散體。在一個方面,arn-509和hpmcas的固體分散體可通過如下方式獲得,具體地通過如下方式獲得:熔融擠出包含arn-509和hpmcas的混合物并且任選地隨后研磨所述熔融擠出的混合物。在一個方面,arn-509和hpmcas的固體分散體可通過如下方式獲得,具體地通過如下方式獲得:噴霧干燥包含溶解于合適溶劑中的arn-509和hpmcas的混合物。arn-509和hpmcas的固體分散體還可以用藥學上可接受的載體配制成藥物制劑,這種制劑提供改善的穩定性或改善的儲存壽命。使用本發明的制劑可以減輕患者(具體地癌癥患者)的服藥負擔,并因此可以提高治療依從性和治療效率。附圖說明圖1:arn-509b型的x射線衍射(xrd)圖。圖2:arn-509b型的紅外光譜。圖3:arn-509b型的差示掃描量熱(dsc)曲線。具體實施方式arn-509是雄激素受體(ar)的有效且特異性拮抗劑。arn-509的作用機制是通過抑制ar核轉位和dna與雄激素反應元件的結合來拮抗雄激素受體信號傳導。雄激素與雄激素受體的作用與許多疾病或病癥有關,諸如雄激素依賴性癌癥、女性男性化以及痤瘡等等。減弱雄激素與雄激素受體的效應和/或降低雄激素受體濃度的化合物可用于治療其中雄激素受體起作用的疾病或病癥。ar相關的疾病或病癥包括但不限于,良性前列腺增生,多毛癥,痤瘡,前列腺的腺瘤和腫瘤,含有雄激素受體的良性或惡性腫瘤細胞,超多毛癥,脂溢性皮炎,子宮內膜異位癥,多囊卵巢綜合征,雄激素源性脫發,性腺機能減退,骨質疏松癥,抑制精子形成、性欲,惡病質,厭食癥,對年齡相關的降低睪酮水平的雄激素補充,前列腺癌,乳腺癌,子宮內膜癌,子宮癌,潮熱,肯尼迪病、肌無力和萎縮,皮膚萎縮,骨質疏松,貧血癥,動脈硬化,心血管疾病,能量損失,健康喪失,2型糖尿病,以及腹部脂肪堆積。鑒于ar在前列腺癌發生和進展中的核心作用,arn-509可用于治療癌癥,具體地治療前列腺癌,包括但不限于去勢抵抗性前列腺癌、轉移性去勢抵抗性前列腺癌、未經化療轉移性去勢抵抗性前列腺癌、生化復發性激素敏感性前列腺癌,或高風險非轉移性去勢抵抗性前列腺癌。arn-509的化學結構是:arn-509或4-[7-(6-氰基-5-三氟甲基吡啶-3-基)-8-氧代-6-硫代-5,7-二氮雜螺[3.4]辛-5-基]-2-氟-n-甲基苯甲酰胺目前在處于臨床開發階段,用作填充到軟膠囊中的非水性、基于脂質的溶液,每個軟膠囊含有30mgarn-509。正在研究中的口服日劑量為240mg/天(或8粒軟膠囊)。已經發現,在使用中,含有arn-509的軟膠囊的儲存壽命僅為6個月并且需要冷鏈儲存。本發明的一個方面涉及藥物制劑,具體地涉及固體藥物制劑,更具體地涉及用于口服arn-509的固體藥物制劑,其中這些制劑具有改善的穩定性,更長的儲存壽命,或給患者(具體地癌癥患者)帶來更小的服藥負擔。本發明的藥物制劑提供了增加治療依從性和治療效率的手段。本發明的一個方面是包含arn-509和hpmcas的固體分散體。hpmcas或醋酸琥珀酸羥丙基甲基纖維素或醋酸琥珀羥丙甲纖維素(cas號71138-97-1)是羥丙基甲基纖維素(iupac名稱:醋酸酯化丁二酸氫酯化的纖維素-2-羥基丙基甲基醚)的醋酸酯和單琥珀酸酯的混合物。不同等級可以根據取代度/取代率(乙酰基含量、琥珀酰基含量)和粒度(微粉化和顆粒狀)進行區分。在本發明的一個方面,與arn-509一起存在于分散體中的hpmcas是hpmcaslg(顆粒級)或hpmcaslf(微粉級)(信越化學工業株式會社(shin-etsuchemicalco.,ltd)),具體地hpmcaslg。本發明的一個方面是包含arn-509和hpmcaslg的固體分散體。本發明的一個方面是包含arn-509和hpmcaslf的固體分散體。本發明的一個方面是由arn-509和hpmcas組成的固體分散體。本發明的一個方面是由arn-509和hpmcaslg組成的固體分散體。本發明的一個方面是由arn-509和hpmcaslf組成的固體分散體。本發明的固體分散體中hpmcas的優選等級是hpmcaslg,因為其具有更好和更安全的處理性質。在本發明的一個方面,如本文所描述的固體分散體中arn-509:hpmcas的重量比在1:1至1:10的范圍內,優選地在1:1至1:5的范圍內,更優選地在1:1至1:3的范圍內,或在1:2至1:3的范圍內。在本發明的一個方面,arn-509:hpmcas的重量比為1:2。在本發明的一個方面,arn-509:hpmcas的重量比為1:3。在本發明的一個方面,arn-509:hpmcaslg的重量比為1:2。在本發明的一個方面,arn-509:hpmcaslg的重量比為1:3。在本發明的一個方面,arn-509:hpmcaslf的重量比為1:2。在本發明的一個方面,arn-509:hpmcaslf的重量比為1:3。本發明的一個方面是由如本文所述的固體分散體組成的顆粒。本發明的一個方面是由包含arn-509和hpmcas的固體分散體組成的顆粒,具體地其中arn-509:hpmcas的重量比為1:2或1:3。本發明的一個方面是由包含arn-509和hpmcaslg的固體分散體組成的顆粒,具體地其中arn-509:hpmcaslg的重量比為1:2或1:3。本發明的一個方面是由包含arn-509和hpmcaslf的固體分散體組成的顆粒,具體地其中arn-509:hpmcaslf的重量比為1:2或1:3。本發明的一個方面是由以arn-509和hpmcas組成的固體分散體組成的顆粒,具體地其中arn-509:hpmcas的重量比為1:2或1:3。本發明的一個方面是由以arn-509和hpmcaslg組成的固體分散體組成的顆粒,具體地其中arn-509:hpmcaslg的重量比為1:2或1:3。本發明的一個方面是由以arn-509和hpmcaslf組成的固體分散體組成的顆粒,具體地其中arn-509:hpmcaslf的重量比為1:2或1:3。本發明的一個方面是包含如上所述的固體分散體的顆粒。本發明的一個方面是包含含有arn-509和hpmcas的固體分散體的顆粒,具體地其中arn-509:hpmcas的重量比為1:2或1:3。本發明的一個方面是包含含有arn-509和hpmcaslg的固體分散體的顆粒,具體地其中arn-509:hpmcaslg的重量比為1:2或1:3。本發明的一個方面是包含含有arn-509和hpmcaslf的固體分散體的顆粒,具體地其中arn-509:hpmcaslf的重量比為1:2或1:3。本發明的一個方面是包含由arn-509和hpmcas組成的固體分散體的顆粒,具體地其中arn-509:hpmcas的重量比為1:2或1:3。本發明的一個方面是包含由arn-509和hpmcaslg組成的固體分散體的顆粒,具體地其中arn-509:hpmcaslg的重量比為1:2或1:3。本發明的一個方面是包含由arn-509和hpmcaslf組成的固體分散體的顆粒,具體地其中arn-509:hpmcaslf的重量比為1:2或1:3。在本發明的一個方面,如本文所述的顆粒可通過如下方式獲得,具體地通過如下方式獲得:熔融擠出包含arn-509和hpmcas的混合物以及隨后研磨所述熔融擠出的混合物。在一個方面,如本文所述的顆粒可通過如下方式獲得,具體地通過如下方式獲得:熔融擠出由arn-509和hpmcas組成的混合物以及隨后研磨所述熔融擠出的混合物。在一個方面,arn-509:hpmcas的重量比為1:2或1:3。在本發明的一個方面,如本文所述的顆粒可通過如下方式獲得,具體地通過如下方式獲得:熔融擠出包含arn-509和hpmcaslg的混合物以及隨后研磨所述熔融擠出的混合物。在一個方面,如本文所述的顆粒可通過如下方式獲得,具體地通過如下方式獲得:熔融擠出由arn-509和hpmcaslg組成的混合物以及隨后研磨所述熔融擠出的混合物。在一個方面,arn-509:hpmcaslg的重量比為1:2或1:3。在本發明的一個方面,如本文所述的顆粒可通過如下方式獲得,具體地通過如下方式獲得:熔融擠出包含arn-509和hpmcaslf的混合物以及隨后研磨所述熔融擠出的混合物。在一個方面,如本文所述的顆粒可通過如下方式獲得,具體地通過如下方式獲得:熔融擠出由arn-509和hpmcaslf組成的混合物以及隨后研磨所述熔融擠出的混合物。在一個方面,arn-509:hpmcaslf的重量比為1:2或1:3。在本發明的一個方面,如本文所述的顆粒可通過如下方式獲得,具體地通過如下方式獲得:噴霧干燥包含溶解于合適溶劑中的arn-509和hpmcas的混合物。在一個方面,如本文所述的顆粒可通過如下方式獲得,具體地通過如下方式獲得:噴霧干燥由溶解于合適溶劑中的arn-509和hpmcas組成的混合物。在一個方面,arn-509:hpmcas的重量比為1:2或1:3。在本發明的一個方面,如本文所述的顆粒可通過如下方式獲得,具體地通過如下方式獲得:噴霧干燥包含溶解于合適溶劑中的arn-509和hpmcaslg的混合物。在一個方面,如本文所述的顆粒可通過如下方式獲得,具體地通過如下方式獲得:噴霧干燥由溶解于合適溶劑中的arn-509和hpmcaslg組成的混合物。在一個方面,arn-509:hpmcaslg的重量比為1:2或1:3。在本發明的一個方面,如本文所述的顆粒可通過如下方式獲得,具體地通過如下方式獲得:噴霧干燥包含溶解于合適溶劑中的arn-509和hpmcaslf的混合物。在一個方面,如本文所述的顆粒可通過如下方式獲得,具體地通過如下方式獲得:噴霧干燥由溶解于合適溶劑中的arn-509和hpmcaslf組成的混合物。在一個方面,arn-509:hpmcaslf的重量比為1:2或1:3。本發明的一個方面是包含如本文所述的藥學上可接受的載體和固體分散體的藥物制劑。本發明的一個方面是包含如本文所述的藥學上可接受的載體和顆粒的藥物制劑。本發明的一個方面是包含藥學上可接受的載體和固體分散體的藥物制劑,所述固體分散體包含arn-509和hpmcas。本發明的一個方面是包含藥學上可接受的載體和固體分散體的藥物制劑,所述固體分散體由arn-509和hpmcas組成。在一個方面,arn-509:hpmcas的重量比為1:2或1:3。本發明的一個方面是包含藥學上可接受的載體和固體分散體的藥物制劑,所述固體分散體包含arn-509和hpmcaslg。本發明的一個方面是包含藥學上可接受的載體和固體分散體的藥物制劑,所述固體分散體由arn-509和hpmcaslg組成。在一個方面,arn-509:hpmcaslg的重量比為1:2或1:3。本發明的一個方面是包含藥學上可接受的載體和固體分散體的藥物制劑,所述固體分散體包含arn-509和hpmcaslf。本發明的一個方面是包含藥學上可接受的載體和固體分散體的藥物制劑,所述固體分散體由arn-509和hpmcaslf組成。在一個方面,arn-509:hpmcaslf的重量比為1:2或1:3。本發明的一個方面是包含藥學上可接受的載體和包含固體分散體的顆粒的藥物制劑,所述固體分散體包含arn-509和hpmcas。本發明的一個方面是包含藥學上可接受的載體和包含固體分散體的顆粒的藥物制劑,所述固體分散體由arn-509和hpmcas組成。在一個方面,arn-509:hpmcas的重量比為1:2或1:3。在一方面,該顆粒可通過如本文所述的噴霧干燥方式獲得,具體地通過如本文所述的噴霧干燥方式獲得。在一方面,該顆粒可通過如本文所述的熔融擠出方式獲得,具體地通過如本文所述的熔融擠出方式獲得。本發明的一個方面是包含藥學上可接受的載體和由固體分散體組成的顆粒的藥物制劑,所述固體分散體包含arn-509和hpmcas。本發明的一個方面是包含藥學上可接受的載體和由固體分散體組成的顆粒的藥物制劑,所述固體分散體由arn-509和hpmcas組成。在一方面,該顆粒可通過如本文所述的噴霧干燥方式獲得,具體地通過如本文所述的噴霧干燥方式獲得。在一方面,該顆粒可通過如本文所述的熔融擠出方式獲得,具體地通過如本文所述的熔融擠出方式獲得。本發明的一個方面是包含藥學上可接受的載體和包含固體分散體的顆粒的藥物制劑,所述固體分散體包含arn-509和hpmcaslg。本發明的一個方面是包含藥學上可接受的載體和包含固體分散體的顆粒的藥物制劑,所述固體分散體由arn-509和hpmcaslg組成。在一個方面,arn-509:hpmcaslg的重量比為1:2或1:3。在一方面,該顆粒可通過如本文所述的噴霧干燥方式獲得,具體地通過如本文所述的噴霧干燥方式獲得。在一方面,該顆粒可通過如本文所述的熔融擠出方式獲得,具體地通過如本文所述的熔融擠出方式獲得。本發明的一個方面是包含藥學上可接受的載體和包含固體分散體的顆粒的藥物制劑,所述固體分散體包含arn-509和hpmcaslf。本發明的一個方面是包含藥學上可接受的載體和包含固體分散體的顆粒的藥物制劑,所述固體分散體由arn-509和hpmcaslf組成。在一個方面,arn-509:hpmcaslf的重量比為1:2或1:3。在一方面,該顆粒可通過如本文所述的噴霧干燥方式獲得,具體地通過如本文所述的噴霧干燥方式獲得。在一方面,該顆粒可通過如本文所述的熔融擠出方式獲得,具體地通過如本文所述的熔融擠出方式獲得。本發明的一個方面是包含藥學上可接受的載體和由固體分散體組成的顆粒的藥物制劑,所述固體分散體包含arn-509和hpmcaslg。本發明的一個方面是包含藥學上可接受的載體和由固體分散體組成的顆粒的藥物制劑,所述固體分散體由arn-509和hpmcaslg組成。在一個方面,arn-509:hpmcaslg的重量比為1:2或1:3。在一方面,該顆粒可通過如本文所述的噴霧干燥方式獲得,具體地通過如本文所述的噴霧干燥方式獲得。在一方面,該顆粒可通過如本文所述的熔融擠出方式獲得,具體地通過如本文所述的熔融擠出方式獲得。本發明的一個方面是包含藥學上可接受的載體和由固體分散體組成的顆粒的藥物制劑,所述固體分散體包含arn-509和hpmcaslf。本發明的一個方面是包含藥學上可接受的載體和由固體分散體組成的顆粒的藥物制劑,所述固體分散體由arn-509和hpmcaslf組成。在一個方面,arn-509:hpmcaslf的重量比為1:2或1:3。在一方面,該顆粒可通過如本文所述的噴霧干燥方式獲得,具體地通過如本文所述的噴霧干燥方式獲得。在一方面,該顆粒可通過如本文所述的熔融擠出方式獲得,具體地通過如本文所述的熔融擠出方式獲得。本發明的一個方面是如本文所述的固體分散體,該固體分散體中不存在表面活性劑。本發明的一個方面是如本文所述的顆粒,該顆粒中不存在表面活性劑。本發明的一個方面是如本文所述的藥物制劑,該藥物制劑中不存在表面活性劑。本發明的一個方面是如本文所述的固體分散體,該固體分散體中arn-509是唯一的活性藥物成分。本發明的一個方面是如本文所述的顆粒,該顆粒中arn-509是唯一的活性藥物成分。本發明的一個方面是如本文所述的藥物制劑,該藥物制劑中arn-509是唯一的活性藥物成分。在如本文所述的固體分散體或顆粒或藥物制劑中,arn-509以堿形式存在或作為藥學上可接受的加成鹽存在,具體地是作為藥學上可接受的酸加成鹽存在。優選地,arn-509以堿形式存在。藥學上可接受的加成鹽意指包含具有治療活性的無毒鹽形式。酸加成鹽形式可以通過用合適的酸處理堿形式的arn-509來獲得,該合適的酸為諸如無機酸或有機酸,無機酸包括但不限于:氫鹵酸,例如鹽酸、氫溴酸等酸類;硫酸;硝酸;磷酸;偏磷酸等酸;有機酸包括但不限于:醋酸、三氟醋酸、三甲基醋酸、丙酸、羥基乙酸、2-羥基丙酸、2-氧代丙酸、乙醇酸、草酸、丙二酸、琥珀酸、馬來酸、富馬酸、蘋果酸、扁桃酸、酒石酸、2-羥基-1,2,3-丙三酸、甲磺酸、乙磺酸、1,2-乙二磺酸、2-羥乙基磺酸、苯甲酸、肉桂酸、氫化肉桂酸、苯磺酸、4-甲基苯磺酸、2-萘磺酸、環己氨磺酸、2-羥基苯甲酸、4-氨基-2-羥基苯甲酸、己酸、環戊基丙酸、3-(4-羥基苯甲酰基)苯甲酸、4-甲基雙環-[2.2.2]辛-2-烯-1-羧酸、葡庚糖酸、叔丁基醋酸、月桂基硫酸、葡糖酸、谷氨酸、羥基萘甲酸、硬脂酸、粘康酸、丁酸、苯醋酸、苯丁酸、丙戊酸等酸。相反,所述鹽形式可以通過用合適的堿處理而轉化為游離堿形式。還包括arn-509及其鹽能夠形成的水合物、溶劑加成形式,以及它們的混合物。這種形式的示例是例如水合物、醇化物等,如乙醇化物。一般來講,用于成人治療的劑量通常在每天0.01mg至5000mg的范圍內。在一個方面,用于成人治療的劑量為每天約1mg至約1000mg。在另一個方面,用于成人治療的劑量為每天約100mg至約500mg。在另一個方面,用于成人治療的劑量為每天240mg。如本領域技術人員已知的,arn-509施用的確切劑量和頻率可取決于所治療的特定病癥、所治療病癥的嚴重性、特定患者的年齡、體重和總體身體狀況以及個人可能正在服用的其他藥劑。此外,很明顯,所述每日量可根據接收治療的受試者的響應和/或根據開具arn-509的醫師的評價降低或增加。因此,本文提及的劑量僅供指導,并不意圖在任何程度上限制本發明的范圍或用途。在本發明的一個方面,日劑量適宜地以單次劑量或以同時(或在短時間段內)或適當間隔,例如兩個、三個、四個或更多個亞劑量/天施用的分次劑量提供。在本發明的一個方面,日劑量以4次分劑量施用。在本發明的一個方面,日劑量以同時(或在短時間段內)施用的4次分劑量施用。在本發明的一個方面,日劑量以3次分劑量施用。在本發明的一個方面,日劑量以同時(或在短時間段內)施用的3次分劑量施用。在本發明的一個方面,日劑量以2次分劑量施用。在本發明的一個方面,日劑量以同時(或在短時間段內)施用的2次分劑量施用。在本發明的一個方面,藥物制劑包含240mgarn-509。在本發明的一個方面,藥物制劑包含120mgarn-509。在本發明的一個方面,藥物制劑包含60mgarn-509。在本發明的一個方面,藥物制劑包含240mgarn-509。該藥物制劑每天施用一次。在本發明的一個方面,藥物制劑包含120mgarn-509。所述制劑中的兩種每天施用,優選地同時(或在短時間段內)施用。在本發明的一個方面,藥物制劑包含60mgarn-509。所述制劑中的四種每天施用,優選地同時(或在短時間段內)施用。本發明的制劑還可以與另一種抗癌劑,具體地與另一種抗前列腺癌劑,更具體地與抑制17α-羥化酶/c17,20-裂解酶(cyp17)的雄激素生物合成抑制劑(具體地醋酸阿比特龍)組合使用。本發明的制劑還可與潑尼松組合。因此,本發明還涉及根據本發明的藥物制劑與另一種抗癌劑的組合,具體地與另一種抗前列腺癌劑的組合,更具體地與抑制17α-羥化酶/c17,20-裂解酶(cyp17)的雄激素生物合成抑制劑(具體地醋酸阿比特龍)的組合。所述組合還可包含潑尼松。術語“固體分散體”是指包含至少兩種組分的固態(與液態或氣態相反)的體系,其中一種組分或多或少均勻地分散遍及在其它一種或多種組分中。當各組分的所述分散體使得整個體系是化學上及物理上均勻或均質的,或者由如熱動力學中定義的一個相組成時,這種固體分散體在本文中將被稱為“固溶體”。固溶體是優選的物理體系,因為其中的組分對于施用該組分的生物體而言通常是可輕易生物利用的。此優點可以通過以下事實來解釋:當與液體介質如胃液接觸時,所述固溶體可以輕易形成液體溶液。易于溶解可至少部分歸因于以下事實:從固溶體中溶出組分所需的能量小于從結晶或微晶固相溶出組分所需的能量。術語“固體分散體”還包括整體均質性比固溶體差的分散體。這種分散體是在化學和物理上整體均勻的,或者包含多于一個相。例如,術語“固體分散體”還涉及這樣的固態體系:其包含至少兩種組分(a)和(b),并且具有多個域或小區域,其中(a)無定形、微晶或結晶、或(b)無定形、微晶或結晶、或兩者或多或少地均勻分散在包含(b)或(a)的另一相中或包含(a)和(b)的固溶體中。所述域是指這樣的區域:其與體系的整體尺寸相比,具有一些顯著不同的物理特征、尺寸較小,并且在整個系統中均勻且隨機分布。優選的是其中arn-509為非結晶相的如本文所述的固體分散體或顆粒,因為它們相較于其中部分或全部arn-509為微晶或結晶形式的那些固體分散體或顆粒來說,在本質上具有更快的溶解速率。另選地,固體分散體可以是分散體的形式,其中無定形或微晶arn-509或無定形或微晶hpmcas或多或少地均勻分散在包含arn-509和hpmcas的固溶體中。在本發明的一個方面,arn-509以無定形形式存在于如本文所述的固體分散體中。在本發明的一個方面,如本文所述的固體分散體是固溶體。用于制備本發明的固體分散體的各種技術包括熔融擠出(例如熱熔融擠出)、噴霧干燥和溶液蒸發,具體地在熱熔融擠出和噴霧干燥中,噴霧干燥是優選的。根據本發明的顆粒可以通過首先制備各組分的固體分散體,然后任選地粉碎或研磨所述分散體來制備。熔融擠出方法包括以下步驟:a)混合arn-509與hpmcas,b)任選地將添加劑與如此獲得的混合物共混,c)加熱由此獲得的共混物,直到獲得均質的熔體,d)迫使由此獲得的熔體穿過一個或多個噴嘴;以及e)將熔體冷卻直至凝固。術語“熔融(melt/melting)”不僅意味著從固態到液態的改變,而且還可以指過渡到玻璃態或橡膠態,并且其中混合物的一種組分可能或多或少地嵌入到另一種組分中。在特定情況下,一種組分將熔融,并且其它組分將溶解在該熔體中從而形成溶液,該溶液在冷卻時可形成具有有利溶解性質的固溶體。熔融擠出的一個重要參數是熔融擠出機工作的溫度。對于本發明的熔融擠出方法,工作溫度優選地在約160℃和約190℃之間的范圍內,更優選地在約160℃和175℃之間的范圍內。溫度下限由在使用一組給定擠出條件的擠出過程中arn-509仍然在熔融的溫度點限定。當arn-509未完全熔融時,擠出物可能無法提供所需的生物利用度。當混合物的粘度太高時,熔融擠出的過程將較為困難。在較高的溫度下,組分可能分解至不可接受的水平。本領域的技術人員會認出要使用的最合適的溫度范圍。吞吐率也是重要的,因為當組分與加熱元件保持太長時間的接觸時可能開始分解。應當理解,本領域的技術人員將能夠在上述給定范圍內優化熔融擠出過程的參數。工作溫度也可以由擠出機的類型或所使用的擠出機內的構造類型決定。在擠出機中熔融、混合和溶解組分所需的大部分能量可由加熱元件提供。然而,擠出機內材料的摩擦力也可以為混合物提供大量能量,并且有助于形成組分的均質熔體。本領域的技術人員將認識到用于制備本發明主題的最合適擠出機,諸如例如單螺桿、雙螺桿擠出機或多螺桿擠出機。對溶于合適溶劑中的各組分的混合物進行噴霧干燥,還產生了所述組分的固體分散體,或包含所述組分的固體分散體,或由所述組分的固體分散體組成的顆粒,并且可以是熔融擠出方法的可用替代形式,在其中hpmcas未穩定到足以承受擠出條件和其中殘留溶劑可以有效地從固體分散體中去除的那些情況下尤為如此。另一種可能的制備由以下步驟組成:在合適的溶劑中制備組分的混合物,將所述混合物倒到大表面上以形成薄膜,并從薄膜中蒸發溶劑。適用于噴霧干燥的溶劑可以是使arn-509和hpmcas(具體地hpmcaslg或hpmcaslf)易于混合在其中的任何有機溶劑。在本發明的一個方面,溶劑的沸點低于固體分散體的tg(玻璃化轉變溫度)。此外,溶劑應具有相對較低的毒性,并被從分散體中去除至根據國際(藥品注冊)協調會議(ich)指南的可接受水平。將溶劑去除至此水平可能需要后續干燥步驟,諸如在噴霧干燥過程之后進行盤式干燥。溶劑包括:醇類,諸如甲醇、乙醇、正丙醇、異丙醇和丁醇,特別是甲醇;酮類,諸如丙酮、甲基乙基酮和甲基異丁基酮;酯類,諸如乙酸乙酯和乙酸丙酯;以及各種其他溶劑,諸如乙腈、二氯甲烷、甲苯和1,1,1-三氯乙烷。還可以使用較低揮發性的溶劑,諸如二甲基乙酰胺或二甲基亞砜。在本發明的一個方面,適用于噴霧干燥的溶劑是多種溶劑的混合物。在本發明的一個方面,用于噴霧干燥的溶劑是醇和二氯甲烷的混合物,具體地是甲醇和二氯甲烷的混合物,更具體地是甲醇和二氯甲烷的6:4(w:w)或5:5(w/w),優選地6:4(w:w)混合物。如本文所述的顆粒具有約1500μm,約1000μm,約500μm,約400μm,約250μm,約200μm,約150μm,約125μm,約100μm,約70μm,約65μm,約60μm,約55μm,約50μm,約45μm,約40μm,約35μm,約30μm,約25μm,或約20μm的d50。通過噴霧干燥獲得的顆粒優選地具有落入約20μm至約100μm的范圍內的d50值,具體地落入約20μm至約70μm的范圍內的d50值,更具體地約20μm、約25μm、約30μm、約35μm、約40μm、約45μm、約50μm、約55μm、約60μm、約65μm,或約70μm的d50值。如本文所用,術語d50具有本領域技術人員已知的常規含意,并且可以通過本領域已知的粒度測量技術,諸如例如沉降場流分級分離法、光子相關光譜學、激光衍射或圓盤離心進行測量。本文提及的d50可與顆粒的體積分布有關。在這種情況下,“50μm的d50”意指至少50%體積的顆粒具有小于50μm的粒度。這同樣適用于所提及的其他粒徑。以類似的方式,d50粒度可能與顆粒的重量分布有關。在這種情況下,“50μm的d50”意指至少50%重量的顆粒具有小于50μm的粒度。這同樣適用于所提及的其他粒徑。通常,體積和重量分布導致平均粒度值相同或大致相同。粒度可以是確定壓片速度的重要因素,具體地是確定流動性并且因此確定大規模的特定劑型或制劑的可制造性以及最終產品質量的重要因素。例如,對于膠囊劑,粒度可優選地在約100至約1500μm的范圍內(d50);對于片劑,粒度優選地小于250μm,更優選地小于100μm(d50)。太小的顆粒(<10-20μm)通常會導致片劑沖頭上發生粘附并帶來可制造性問題。如本文所述的顆粒或固體分散體還可包含一種或多種藥學上可接受的賦形劑,諸如例如增塑劑、風味劑、著色劑、防腐劑等。尤其是在通過熱熔融擠出制備的情況下,所述賦形劑不應該是熱敏感的,換句話說,它們在熔融擠出機的工作溫度下不應表現出任何可感知的降解或分解。合適的增塑劑是藥學上可接受的,并且包括低分子量多元醇,諸如乙二醇、丙二醇、1,2-丁二醇、2,3-丁二醇、苯乙二醇;聚乙二醇,諸如二甘醇、三甘醇、四甘醇;分子量低于1,000g/mol的其他聚乙二醇;分子量低于200g/mol的聚丙二醇;乙二醇醚,諸如單丙二醇單異丙基醚;丙二醇單乙醚;二乙二醇單乙基醚;酯類增塑劑,諸如檸檬酸三乙酯、乳酸山梨醇酯、乳酸乙酯、乳酸丁酯、乙醇酸乙酯、乙醇酸烯丙酯;以及胺,諸如單乙醇胺、二乙醇胺、三乙醇胺、單異丙醇胺;三亞乙基四胺、2-氨基-2-甲基-1,3-丙二醇等。其中優選的是低分子量聚乙二醇、乙二醇、低分子量聚丙二醇,特別是丙二醇。在本發明的一個方面,如本文所述的顆粒或固體分散體不含增塑劑。本發明的固體分散體或顆粒可以配制成包含治療有效量的arn-509的藥物制劑。盡管首先設想了用于口服的藥物制劑如片劑和膠囊劑,但本發明的固體分散體或顆粒也可用于制備例如用于經直腸給藥的藥物制劑。優選的制劑是適于成形為片劑而口服的那些制劑。它們可以通過常規壓片技術,使用常規成分或賦形劑(藥學上可接受的載體)并使用常規壓片機來制備。為了方便哺乳動物吞咽這種制劑,有利的是為所述制劑,尤其是片劑賦予適當的形狀。片劑上的膜包衣可進一步有助于片劑的易于可吞咽性。本發明的制劑,具體地是片劑,可包含一種或多種常規賦形劑(藥學上可接受的載體),諸如崩解劑、稀釋劑、填充劑、粘結劑、緩沖劑、潤滑劑、助流劑、增稠劑、甜味劑、風味劑和著色劑。一些賦形劑可用于多種目的。優選地,本發明的制劑包含崩解劑、稀釋劑或填充劑、潤滑劑和助流劑。合適的崩解劑是具有大膨脹系數的那些崩解劑。其示例是親水性、不溶性或難溶于水的交聯聚合物,諸如聚乙烯吡咯烷酮(交聯聚乙烯吡咯烷酮)和交聯羧甲纖維素鈉(交聯羧甲基纖維素鈉)。根據本發明的片劑中的崩解劑的量可以合宜地在約3%至約15%(w/w)的范圍內,并且優選地在約3%至7%的范圍內,具體地為約5%(w/w)。由于崩解劑因其性質而在批量使用時產生緩釋制劑,所以有利的是用稱為稀釋劑或填充劑的惰性物質稀釋它們。可以使用各種材料作為稀釋劑或填充劑。稀釋劑或填充劑的示例是乳糖一水合物、無水乳糖、蔗糖、葡萄糖、甘露糖醇、山梨糖醇、淀粉、纖維素(例如微晶纖維素(aviceltm)、硅化微晶纖維素)、二水合或無水二堿式磷酸氫鈣,以及本領域已知的其他物質,以及它們的混合物(例如乳糖一水合物(75%)與微晶纖維素(25%)的噴霧干燥混合物,其可作為microcelactm)商購獲得。優選的是微晶纖維素和硅化微晶纖維素。片劑中稀釋劑或填充劑的量可以合宜地在約20%至約70%(w/w)的范圍內,并且優選地在約55%至約60%(w/w)的范圍內。潤滑劑和助流劑可以用于制造某些劑型,并且將通常在制造片劑時使用。潤滑劑和助流劑的示例是氫化植物油,例如氫化棉籽油、硬脂酸鎂、硬脂酸、月桂基硫酸鈉、月桂基硫酸鎂、膠態二氧化硅、膠態無水二氧化硅滑石,它們的混合物,以及本領域中已知的其他物質。受關注的潤滑劑是硬脂酸鎂,以及硬脂酸鎂與膠態二氧化硅的混合物。優選的潤滑劑是硬脂酸鎂。優選的助流劑是膠態無水二氧化硅。助流劑通常占總片劑重量的0.2%至7.0%,具體地0.5%至1.5%,更具體地1%至1.5%(w/w)。潤滑劑通常占總片劑重量的0.2%至7.0%,具體地0.2%至1%,更具體地0.5%至1%(w/w)。其他賦形劑如著色劑和顏料也可加入到本發明的制劑中。著色劑和顏料包括二氧化鈦和適用于食品的染料。著色劑是本發明制劑中的任選成分,在使用著色劑時,著色劑可以基于總片劑重量計至多3.5%的量存在。風味劑在制劑中是任選的,并且可以選自合成風味油和調味芳香劑或天然油,來自植物葉、花、果實等的提取物,以及它們的組合。這些風味劑可包括肉桂油、冬青油、胡椒薄荷油、月桂油、茴香油、桉樹、百里香油。還可用作風味劑的是香草、柑橘油(包括檸檬、橙子、葡萄、酸橙和柚子),以及水果香精(包括蘋果、香蕉、梨、桃、草莓、懸鉤子、櫻桃、李子、菠蘿、杏等)。風味劑的量可取決于許多因素,包括所需的感官效果。通常,風味劑將以約0%至約3%(w/w)的量存在。如在本領域中已知的,可在壓片之前對片劑共混物進行干法制粒或濕法制粒。壓片過程本身原是標準的,并且易于通過使用常規壓片機使得自所需各成分共混物或混合物的片劑形成為適當形狀來實踐。可對本發明的片劑進一步進行膜包衣,例如以改善味道,從而提供易吞咽性和美觀大方的外觀。許多合適的聚合物膜包衣材料是本領域中已知的。優選的膜包衣材料是opadryii85f210036green。在此也可使用其他合適的成膜聚合物,包括羥丙基纖維素、羥丙基甲基纖維素(hpmc),尤其是hpmc29105mpa.s和丙烯酸酯-甲基丙烯酸酯共聚物。除了成膜聚合物之外,膜包衣還可包含增塑劑(例如丙二醇)和任選地顏料(例如二氧化鈦)。膜包衣懸浮液還可包含滑石作為抗粘合劑。在根據本發明的片劑中,膜包衣按重量計優選地占總片劑重量的約3%(w/w)或更低。優選的制劑是其中如本文所述的顆粒或固體分散體的重量的范圍為制劑總重量的20%至40%,具體地30%至40%的那些。本發明還涉及一種制備如本文所述的固體分散體的方法,包括共混arn-509和hpmcas,以及在約160℃至約190℃范圍內的溫度下擠出所述共混物。本發明還涉及一種制備如本文所述的顆粒的方法,包括共混arn-509和hpmcas,在約160℃至約190℃范圍內的溫度下擠出所述共混物,研磨擠出物,以及任選地篩分顆粒。可使用的合適的擠出機是haake微型擠出機(haakemini-extruder)、leistritz18mm擠出機以及leistritz27mm擠出機。本發明還涉及一種制備如本文所述的顆粒或固體分散體的方法,包括在合適的溶劑中混合arn-509和hpmcas,以及噴霧干燥所述混合物。在一個方面,合適的溶劑是二氯甲烷和甲醇的混合物。在一個方面,合適的溶劑是二氯甲烷和甲醇的混合物,其中混合物中二氯甲烷與甲醇的重量比為4:6或5:5,4:6為優選的。用于制備如本文所述的固體分散體或顆粒的arn-509的優選結晶形式是b型,其為無水結晶形式(參見下文,并參考wo2013/184681,該專利以引用方式并入本文)。本發明的另一個目的是提供一種制備如本文所述的藥物制劑,具體地為片劑或膠囊劑形式的藥物制劑的方法,其特征在于將治療有效量的如本文所述的固體分散體或顆粒與藥學上可接受的載體共混,并且將所述共混物壓制成片劑或將所述共混物填充在膠囊中。此外,本發明涉及如本文所述的固體分散體或顆粒,其用于制備施用(具體地口服施用)于患有雄激素受體(ar)相關疾病或病癥的哺乳動物(具體地人)的藥物制劑,所述ar相關疾病或病癥具體地是癌癥,更具體地是前列腺癌,包括但不限于去勢抵抗性前列腺癌、轉移性去勢抵抗性前列腺癌、未經化療轉移性去勢抵抗性前列腺癌、生化復發性激素敏感性前列腺癌,或高風險非轉移性去勢抵抗性前列腺癌。本發明還涉及如本文所述的固體分散體或顆粒用于制備施用(具體地口服施用)于患有雄激素受體(ar)相關疾病或病癥的哺乳動物(具體地人)的藥物制劑的用途,所述ar相關疾病或病癥具體地是癌癥,更具體地是前列腺癌,包括但不限于去勢抵抗性前列腺癌、轉移性去勢抵抗性前列腺癌、未經化療轉移性去勢抵抗性前列腺癌、生化復發性激素敏感性前列腺癌,或高風險非轉移性去勢抵抗性前列腺癌。本發明還涉及一種治療哺乳動物(具體地人)的雄激素受體(ar)相關疾病或病癥的方法,所述ar相關疾病或病癥具體地是癌癥,更具體地是前列腺癌,包括但不限于去勢抵抗性前列腺癌、轉移性去勢抵抗性前列腺癌、未經化療轉移性去勢抵抗性前列腺癌、生化復發性激素敏感性前列腺癌或高風險非轉移性去勢抵抗性前列腺癌,所述方法包括將有效抗癌量的如本文所述的藥物制劑施用(具體地口服施用)于所述哺乳動物(具體地人)。本發明還涉及如本文所指定的藥物制劑用于制造用于治療雄激素受體(ar)相關疾病或病癥的藥物的用途,所述ar相關疾病或病癥具體地是癌癥,更具體地是前列腺癌,包括但不限于去勢抵抗性前列腺癌、轉移性去勢抵抗性前列腺癌、未經化療轉移性去勢抵抗性前列腺癌、生化復發性激素敏感性前列腺癌,或高風險非轉移性去勢抵抗性前列腺癌。或者另選地,本發明涉及如本文所指定的藥物制劑,其用于治療雄激素受體(ar)相關疾病或病癥,所述ar相關疾病或病癥具體地是癌癥,更具體地是前列腺癌,包括但不限于去勢抵抗性前列腺癌、轉移性去勢抵抗性前列腺癌、未經化療轉移性去勢抵抗性前列腺癌、生化復發性激素敏感性前列腺癌,或高風險非轉移性去勢抵抗性前列腺癌。本發明還涉及適用于商業銷售的藥物包裝,其包括容器、如本文所述的藥物制劑,并且關聯有所述包裝書面材料。本文中結合數值所使用的術語“約”意指在數值的上下文中具有其通常含義。必要時,字詞“約”可用數值±10%或±5%或±2%或±1%代替。本文所引用的所有文獻全文以引用方式并入本文中。以下實施例旨在說明本發明。實施例1:arn-509形式關于制備不同(結晶)形式的arn-509,參考wo2013/184681,其以引用方式并入本文。可使用不同的(結晶或無定形)形式的arn-509來制備根據本發明的固體分散體、顆粒或制劑。用于制備根據本發明的固體分散體、顆粒或制劑的arn-509的優選形式是arn-509b型,其為無水晶體。其通過以下步驟來制備:在usp水中懸浮arn-509a型(參考wo2013/184681,包括衍射數據)并將漿液加熱至55±5℃,在所述溫度下保持至少24小時,然后將漿液冷卻至25±5℃。過濾所得漿液,并將濕濾餅用usp水洗滌一次。將濕濾餅從過濾器中卸下并真空干燥,以得到arn-509b型。還參考下述實施例2。a型的溶解度:在水中0.01mg/ml。b型的溶解度:在水中0.004mg/ml。實施例2arn-509b型的表征粉末xrd在panalytical(飛利浦公司(philips))x’pertprompd衍射儀上進行x射線粉末衍射(xrpd)分析。該儀器配備有culffx射線管。將化合物涂抹在零背景樣本夾持器上。儀器參數測量條件arn-509b型的x射線粉末衍射圖示出了衍射峰而沒有衍射暈,表明該化合物作為結晶產物存在。arn-509b型的xrd圖示于圖1中。紅外光譜分析(顯微atr-ir)使用合適的顯微atr附件分析樣品。arn-509b型的光譜示于圖2中。差示掃描量熱分析(dsc)將化合物轉移到標準鋁制ta儀器(ta-instrument)樣品盤中。用適當的蓋子將樣品盤封閉,并在配備有rcs冷卻單元的ta-instrumentsq1000mtdsc上記錄dsc曲線,使用以下參數:初始溫度:25℃加熱速率:10℃/min最終溫度:250℃arn-509b型的dsc曲線顯示產品在194.9℃熔化,其中熔化熱為73j/g。參見圖3。實施例3.1:制備arn-509:hpmcaslg為1:3的固體分散體a在處理過程中去除將二氯甲烷和甲醇轉移到合適的容器中并開始攪拌。在連續攪拌下將arn-509b型加入到溶劑混合物中,并攪拌至溶解。將hpmcas加入溶液并攪拌過夜。獲得淡黃色粘稠混濁混合物。通過grid過濾器直列式地過濾混合物。使用合適的噴霧干燥器(例如,具有高壓噴嘴的niroa/spsd3),使用以下參數將混合物噴霧干燥:供料流速為75kg/h,出口溫度為46℃,冷凝器溫度為-9℃。在合適的干燥器(例如托盤干燥器)中,使用真空、氮氣流和40℃的干燥溫度將噴霧干燥產物(sdp)干燥。實施例3.2:制備包含arn-509:hpmcas為1:3的固體分散體的片劑a植物級針對30,000個片劑對sdp進行篩分,并使用合適的共混機與膠態無水二氧化硅的一部分(10/13)混合成均勻的共混物。對交聯羧甲基纖維素鈉的一部分(1/2)和微晶纖維素(全部)進行篩分,然后加入到共混物中并使用合適的共混機混合。通過使用合適的壓實技術(例如輥碾壓實)制備干燥顆粒。對硅化微晶纖維素、剩余的交聯羧甲基纖維素鈉(1/2)和膠態無水二氧化硅(3/13)進行篩分,然后加入到干燥顆粒中并使用合適的共混機混合。對硬脂酸鎂進行篩分,加入到共混物中,并使用合適的共混機混合。使用合適的壓片機將共混物壓制成片劑(含有60mgarn509)。實施例3.3:制備包衣片劑arn-509(60mg)片劑(參見實施例3.2)599.9gopadryii85f210036green17.997g純化水a71.988ga在每批857個片劑的加工過程中去除將純化水轉移到合適的容器中。加入包衣粉末并用合適的混合器混合。使用合適的包衣機,用包衣懸浮液對芯片劑進行膜包衣。實施例4.1:制備arn-509:hpmcaslf為1:2的固體分散體arn-509333.33mghpmcaslf666.67mg丙酮a19000mga在處理過程中去除(所報告的量針對1gsdp(噴霧干燥產物))將丙酮轉移到合適的容器中,并加入hpmcas和arn-509b型。在使用合適的混合器混合各成分后,使用合適的噴霧干燥器(例如,buchi微型噴霧干燥器(buchiminispraydryer))以如下參數噴霧干燥混合物:噴霧速率在6.2至6.7克/分鐘范圍內,出口溫度在46℃至49℃范圍內,并且冷凝器溫度在-18℃至-21℃范圍內。在合適的干燥器(例如托盤干燥器)中,使用真空、氮氣流和40℃的干燥溫度將噴霧干燥產物(sdp)干燥。實施例4.2:制備包含arn-509:hpmcas為1:2的固體分散體的片劑對sdp、硅化微晶纖維素的一部分(7110/9448)、膠態無水二氧化硅的一部分(10/13)和交聯羧甲基纖維素鈉的一部分(1/2)進行篩分,并使用合適的共混機混合成均勻的共混物。通過使用合適的壓實技術制備干燥顆粒。對剩余的硅化微晶纖維素(2338/9448)、膠態無水二氧化硅(3/13)和交聯羧甲基纖維素鈉(1/2)進行篩分,然后加入到干燥顆粒中并使用合適的共混機進一步混合。對硬脂酸鎂進行篩分,加入到共混物中,并使用合適的共混機進一步混合。使用合適的壓片機將共混物壓制成片劑。實施例5.1:通過熱熔融擠出(hme)制備arn-509:hpmcaslf為1:3的固體分散體arn-509250mghpmcaslf750mg(所報告的量針對1ghme產物)使用合適的共混機,在合適的容器中將hpmcas和arn-509b型共混。在haake擠出機中,于沖洗模式、180℃的最高溫度、50rpm的螺桿轉速下進行熱熔融擠出。收集熱熔融擠出物并在合適的研磨機中研磨。使用合適的篩(250μm)篩分經研磨的熱熔融擠出物。實施例5.2:制備包含arn-509:hpmcaslf為1:3的固體分散體的片劑(hme)對硅化微晶纖維素、交聯羧甲基纖維素鈉和膠態無水二氧化硅進行篩分,并使用合適的共混機與熱熔融擠出物混合成均勻的共混物。對硬脂酸鎂進行篩分,加入到共混物中,并使用合適的共混機進一步混合。使用偏心壓片機將共混物壓制成片劑。實施例6.1:制備arn-509:hpmcaslf為1:3的固體分散體sdparn-509250.0mghpmcaslf750.0mg丙酮a19000.0mga在處理過程中去除(所報告的量針對1gsdp(噴霧干燥產物))將丙酮轉移到合適的容器中,并加入hpmcaslf和arn-509b型。在使用合適的混合器混合各成分后,使用合適的噴霧干燥器(例如,buchi微型噴霧干燥器(buchiminispraydryer))以如下參數噴霧干燥混合物:噴霧速率在5.9至6.6克/分鐘范圍內,出口溫度在46℃至49℃范圍內,冷凝器溫度在-15℃至-21℃范圍內。在合適的干燥器(例如托盤干燥器)中,使用真空、氮氣流和40℃的干燥溫度將噴霧干燥產物(sdp)干燥。實施例6.2:制備包含arn-509:hpmcas為1:3的固體分散體的片劑對sdp、硅化微晶纖維素的一部分(2955/4124)、膠態無水二氧化硅的一部分(10/13)和交聯羧甲基纖維素鈉的一部分(1/2)進行篩分,并使用合適的共混機混合成均勻的共混物。通過使用合適的壓實技術制備干燥顆粒。對剩余的硅化微晶纖維素(1169/4124)、膠態無水二氧化硅(3/13)和交聯羧甲基纖維素鈉(1/2)進行篩分,然后加入到干燥顆粒中并使用合適的共混機進一步混合。對硬脂酸鎂進行篩分,加入到共混物中,并使用合適的攪拌器進一步混合。使用偏心壓片機將共混物壓制成片劑。生物利用率研究測試體系物種:瑪斯比格犬(marshallbeagledog)供應商:意大利/美國的瑪斯農場(marshallfarms,italy/usa)性別與年齡:雄性(n=12),約1-7歲體重:在實驗階段開始時為8至13kg飲食和給水:連續給水給藥:給藥前禁食約21小時,直至給藥后±2小時。此后,犬可自由進食,直至下午晚些時候。測試化合物和制劑制劑1:60mg片劑,含有arn-509與hpmcas-lf之比為1/3的sdp制劑2:60mg片劑,含有arn-509與hpmcas-lf之比為1/3的hme制劑3:填充到軟膠囊中的非水性、基于脂質的溶液,每粒軟膠囊含有30mgarn-509采血和血漿制備從頸靜脈采集血樣(2ml置于edta中)。在取樣1小時內將血樣離心,并且在離心開始后2小時內將血漿儲存在冷凍機中。施用劑量生物分析使用合格的lc-ms/ms方法分析所有研究樣品。對樣品進行選擇性樣品凈化,然后進行hplc-ms/ms。使用非手性反相液相色譜進行hplc分離。使用三重四極桿質譜法以多重反應監測(mrm)模式進行后續ms/ms分析,分析方法針對化合物進行了優化。根據繪制的校正曲線對樣品進行定量,覆蓋各研究樣品的濃度范圍。以與研究樣品相同的基質繪制曲線。對于每個分析批次,將在與樣品相同的基質中制備的獨立質量控制樣品與研究樣品和校正曲線一起分析。根據符合現行fda指南的校正曲線和qc驗收標準接受所有分析批次。數據分析使用經驗證的phoenix軟件對各個血漿濃度-時間曲線進行藥代動力學分析。對所有數據使用采用線性上升/對數下降梯形法則的非房室分析。結果單次口服所述3種制劑后,雄性比格犬體內arn-509的平均cmax、tmax、auc和frel值如下:1)大部分動物的tlast為168h;2)n=3制劑1:hpmcas-lf比率1/3(sdp)制劑2:hpmcas-lf比率1/3(hme)制劑3:對照軟膠囊對實施例3.1和5.1的粉末進行的穩定性測試對包裝在ldpe/alu袋中的粉末進行測試。1.外觀測試對如在下表a1和a2所示的不同儲存條件下儲存的實施例3.1和實施例5.1的粉末進行目視檢查。結果記錄在下表a1和a2中。2.水含量根據美國藥典/歐洲藥典,利用氣化卡爾費休庫侖法(vaporizedcoulometrickarlfischerdetermination)測定水含量。實施例3.1或實施例5.1的粉末如下表a1或a2所示儲存。將約50.00mg(±5.00mg)的樣品精確地稱量到小瓶中,并將該小瓶牢固地壓接封蓋。結果記錄在下表a1和a2中。使用以下儀器、試劑和溶液以及參數。器械庫侖計:萬通831kf庫侖計(831kfcoulometermetrohm)烘箱:萬通774樣品加熱進樣器(774sampleovenprocessormetrohm)發電機電極:萬通帶隔膜電極6.0344.100(electrodewithdiapraghmmetrohm6.0344.100)指示電極:萬通雙鉑絲電極6.0341.100(doublept-wireelectrodemetrohm6.0341.100)試劑和溶液陽極液:hydranalcoulomatagoven(fluka34739)陰極液:hydranalcoulomatcg(fluka34840)水標準品:hydranal水標準品1.00(hydranalwaterstandard1.00)(fluka34828)烘箱參數載氣:n2流速:設定值為60ml/min讀出最小值為20ml/min烘箱溫度:120℃庫侖計參數滴定參數萃取時間:60s漂移校正:自動起始條件暫停:60s起始漂移:最大12μg/min電導時間ok:10s停止參數相對漂移:5μg/min可使用另選的庫倫計參數,前提條件是滿足體系適用性要求3.用于檢測結晶arn-509的pxrd測試使用粉末x射線衍射跟蹤在不同儲存條件下儲存的實施例3.1和實施例5.1的粉末的物理穩定性。將粉末的xrd圖與在計時起點處測量的相應粉末(無定形產物)的xrd圖進行比較。將粉末放到零背景樣本夾持器上。對樣品進行x射線測量。結果記錄在下表a1和a2中。使用以下器械和參數。器械pananalyticalx’pertprompd衍射儀pw3050/60x射線管culffpw3373/10檢測器:x’celerator樣品臺:回旋臺樣本夾持器:零背景樣本夾持器儀器設置回旋旋轉時間:1rps發電機電壓:45kv發電機電流:40max射線束路徑中的光學部件入射光束路徑:可編程發散狹縫:輻射長度為15mm索勒狹縫:0.04拉德光束掩模:15mm防散射狹縫:1°光束刀+衍射光束路徑:可編程防散射狹縫:1°索勒狹縫:0.04拉德過濾器:ni儀器參數幾何:布拉格-布倫塔諾(bragg-brentano)輻射:cukα步長:0.02°掃描范圍:3°2θ至50°2θ每步計數時間:60秒表a1:儲存在ldpe/alu袋中的實施例3.1的粉末的測試條件和結果—外觀和水含量以及結晶度結果a合格:白色至淺黃色,細粒狀粉末表a2:儲存在ldpe/alu袋中的實施例5.1的粉末的測試條件和結果—外觀和水含量以及結晶度結果a合格:白色至淺黃褐色,細粒狀粉末對于外觀,在不同儲存條件下儲存藥物產品中間體粉末期間沒有觀察到顯著的穩定性相關變化。對于水含量,在不同儲存條件下儲存藥物產品中間體粉末期間沒有觀察到顯著的穩定性相關變化。對于結晶度,在不同儲存條件下儲存藥物產品期間沒有觀察到顯著的穩定性相關變化。4.arn-509色譜分離純度的測定通過帶有uv檢測的梯度反相uhplc測定在不同儲存條件下儲存的實施例3.1和實施例5.1的粉末中的arn-509及其降解產物的濃度。粉末如下表b1和b2所示儲存。將約240.00mg粉末精確稱量到250ml容量瓶中。用量筒添加約125ml乙腈,并將整體機械振蕩30分鐘,然后用水稀釋至一定體積,直至到標記下約1cm。手動劇烈振蕩整體。使樣品溶液平衡至環境溫度,然后用水稀釋至一定體積。緊接在過濾之前手動振蕩容量瓶。通過耐化學腐蝕的0.2μm過濾器過濾樣品溶液。將前3ml濾液棄入廢液容器中,不返回到容量瓶中。如果樣品溶液儲存在冰箱中,則將樣品溶液避光(置于封閉的櫥柜中)穩定4天。結果記錄在下表b1和b2中。使用以下溶液、儀器以及參數。流動相流動相a10mmnh4ac+0.1%tfa/乙腈(90/10,v/v)。流動相b乙腈uhplc鑒定條件、測定和色譜純度色譜柱:acquitybehc18,150mm長度×j2.1mm內徑,1.7μm粒度柱溫:45℃自動進樣器溫度:5℃流速:0.40ml/min檢測:uv=uv波長:268nm進樣體積:3μl數據收集時間:35分鐘分析運行時間:40分鐘如下表所示編程設計線性梯度。線性梯度程序時間(min)a(體積%)b(體積%)01000353070361000401000表b1:儲存在ldpe/alu袋中的實施例3.1的粉末的測試條件和結果—測定和降解產物結果表b2:儲存在ldpe/alu袋中的實施例5.1的粉末的測試條件和結果—測定和降解產物結果在不同儲存條件下儲存藥物產品中間體粉末期間沒有觀察到顯著的穩定性相關變化。5.水活度水活度用novasinaaw水活度儀測定。對實施例3.1和實施例5.1的粉末進行測試。結果記錄在下表c1和c2中。表c1:儲存在ldpe/alu袋中的實施例3.1的粉末的測試條件和結果—水活度結果表c2:儲存在ldpe/alu袋中的實施例5.1的粉末的測試條件和結果—水活度結果對實施例3.3的片劑進行的穩定性測試對儲存在含有干燥劑(硅膠)的hdpe瓶中的片劑進行測試。1.外觀測試對如在下表1所示的不同儲存條件下儲存的實施例3.3的片劑進行目視檢查。結果記錄在下表1中。2.水含量根據美國藥典/歐洲藥典,利用氣化卡爾費休庫侖法(vaporizedcoulometrickarlfischerdetermination)測定水含量。實施例3.3的片劑如下表1所示儲存。使用retsch混合球磨儀(retschmixermill)研磨片劑。在研磨之后,立即將約50.00mg(±5.00mg)的樣品精確地稱量到小瓶中,并將該小瓶牢固地壓接封蓋。結果記錄在下表1中。使用以下儀器、試劑和溶液以及參數。器械庫侖計:萬通831kf庫侖計(831kfcoulometermetrohm)烘箱:萬通774樣品加熱進樣器(774sampleovenprocessormetrohm)發電機電極:萬通帶隔膜電極6.0344.100(electrodewithdiapraghmmetrohm6.0344.100)指示電極:萬通雙鉑絲電極6.0341.100(doublept-wireelectrodemetrohm6.0341.100)試劑和溶液陽極液:hydranalcoulomatagoven(fluka34739)陰極液:hydranalcoulomatcg(fluka34840)水標準品:hydranal水標準品1.00(hydranalwaterstandard1.00)(fluka34828)烘箱參數載氣:n2流速:設定值為60ml/min讀出最小值為20ml/min烘箱溫度:120℃庫侖計參數滴定參數萃取時間:60s漂移校正:自動起始條件暫停:60s起始漂移:最大12μg/min電導時間ok:10s停止參數相對漂移:5μg/min可使用另選的庫倫計參數,前提條件是滿足體系適用性要求表1:儲存在含有干燥劑(硅膠)的hdpe瓶中的實施例3.3的片劑的測試條件和結果—外觀和水含量結果a合格:綠色長方形片劑光ich:整體近紫外線能量不低于200w·h/m2,總體照度不低于1200klux·h對于外觀,在不同儲存條件下儲存藥物產品期間沒有觀察到顯著的穩定性相關變化。觀察到水含量略有增加。3.用于檢測結晶arn-509的pxrd測試使用粉末x射線衍射跟蹤在不同儲存條件下儲存的實施例3.3的不同片劑的物理穩定性。將片劑的xrd圖與在計時起點處的相應片劑(無定形產物)的xrd圖進行比較。用研缽和研杵將一個片劑輕輕研磨成細粉。使用回載(backloading)技術將粉末裝載到16mm樣本夾持器中。對樣品進行x射線測量。結果記錄在下表2中。使用以下器械和參數。器械philipsx’pertprompd衍射儀pw3050/60x射線管culffpw3373/10檢測器:x’celerator樣品臺:回旋臺樣本夾持器:腔直徑16mm,腔深度2.5mm儀器設置回旋旋轉時間:1rps發電機電壓:45kv發電機電流:40max射線束路徑中的光學部件入射光束路徑:可編程發散狹縫:輻射長度為10mm索勒狹縫:0.04拉德光束掩模:10mm防散射狹縫:1°光束刀+衍射光束路徑:可編程防散射狹縫:1°索勒狹縫:0.04拉德過濾器:ni儀器參數幾何:布拉格-布倫塔諾(bragg-brentano)輻射:cukα步長:0.02°掃描范圍:3°2θ至50°2θ每步計數時間:100秒表2:儲存在含有干燥劑(硅膠)的hdpe瓶中的實施例3.3的片劑的測試條件和結果—結晶度結果光ich:整體近紫外線能量不低于200w·h/m2,總體照度不低于1200klux·h在不同儲存條件下儲存藥物產品期間沒有觀察到顯著的穩定性相關變化。4.arn-509色譜分離純度的測定通過帶有uv檢測的梯度反相uhplc測定在不同儲存條件下儲存的實施例3.3的片劑中的arn-509及其降解產物的濃度。片劑如下表3所示儲存。精確稱量五個片劑。測定平均片劑重量。將片劑研磨成細粉。將相當于平均片劑重量的量的均勻粉末精確稱量到250ml容量瓶中。用量筒添加約125ml乙腈,并將整體機械振蕩30分鐘,然后用水稀釋至一定體積,直至到標記下約1cm。手動劇烈振蕩整體。使樣品溶液平衡至環境溫度,然后用水稀釋至一定體積。緊接在過濾之前手動振蕩容量瓶。通過耐化學腐蝕的0.45μm過濾器過濾樣品溶液。將前3ml濾液棄入廢液容器中,不返回到容量瓶中。如果樣品溶液儲存在冰箱中,則將樣品溶液避光(置于封閉的櫥柜中)穩定4天。結果記錄在下表3中。使用以下溶液、儀器以及參數。流動相流動相a10mmnh4ac(乙酸銨水溶液)+0.1%tfa(三氟乙酸)/乙腈(90/10,v/v)。流動相b乙腈uhplc鑒定條件、測定和色譜純度色譜柱:acquitybehc18,150mm長度×2.1mm內徑,1.7μm粒度柱溫:45℃自動進樣器溫度:5℃流速:0.40ml/min檢測:uv=uv波長:268nm進樣體積:3μl數據收集時間:35分鐘分析運行時間:40分鐘如下表所示編程設計線性梯度。線性梯度程序時間(min)a(體積%)b(體積%)01000353070361000401000表3:儲存在含有干燥劑(硅膠)的hdpe瓶中的實施例3.3的片劑的測試條件和結果—測定和降解產物結果光ich:整體近紫外線能量不低于200w·h/m2,總體照度不低于1200klux·h在不同儲存條件下儲存藥物產品期間沒有觀察到顯著的穩定性相關變化。5.溶出度使用槳式裝置(paddleapparatus)(usp2型,歐洲藥典,日本藥典),以75rpm的速度,在900ml的0.5%(w/v)十六烷基三甲基溴化銨(ctab)在ph4.5的0.05m磷酸鈉緩沖液中的溶液中進行溶出度測試。使用具有固體外殼的取樣針對樣品取樣,并用直徑30mm的0.45μmrc(再生纖維素)膜過濾器過濾樣品。溶出樣品中存在的arn-509的量的測定基于帶有uv檢測的等度超高效液相色譜(uhplc)方法。對如在下表4所示的不同儲存條件下儲存的實施例3.3的片劑進行測試。使用以下儀器、試劑和溶液以及參數。器械溶出儀器:槳式裝置(usp2型,歐洲藥典,日本藥典)。uhplc儀器:帶有紫外檢測器的watersacquityh-class。數據采集系統:watersempower。分析天平:靈敏至0.01g。分析天平:靈敏至0.01mg。ph計:靈敏至0.01ph單位。溫度計:靈敏至0.1℃。試劑和溶液試劑溴化十六烷基三甲銨,十六烷基三甲基溴化銨,(ctab):分析用,99.0%純度。磷酸二氫鈉一水合物(nah2po4.h2o):acs級。三氟乙酸:hplc級,99.0%純度。乙腈:hplc級。流動相流動相a:0.1%(v/v)tfa的水溶液流動相b:乙腈步驟溶出參數設備:槳式裝置(usp2型,歐洲藥典,日本藥典)。器皿:1-l級。旋轉速度:75rpm。溶出介質:0.5%(w/v)ctab在ph4.5的0.05m磷酸鹽緩沖液中的溶液。介質的體積:900ml。介質脫氣:不需要。介質替換:不需要。溫度:37.0±0.5℃。沉降籃:不使用沉降籃。樣品引入:將1個片劑轉移到每個溶出器皿中。分析整理—uhplc參數條件色譜柱:acquitycshc18,1.7μm粒度,2.1×50mm內徑。柱溫:60±5℃。樣品溫度:室溫。流速:0.6ml/min。檢測:242nm下的uv。進樣體積:3μl。洗脫模式:等度。移動相:50/50(v:v),0.1%tfa的水溶液:乙腈。使用合適的手段進行脫氣。運行時間(指導):1.5分鐘。保留時間(指導):對于arn-509為約0.7分鐘洗滌溶劑:乙腈。針洗液:乙腈。密封墊沖洗溶劑:90/10(v:v),水:乙腈。吹掃溶劑:90/10(v:v),水:乙腈。取樣速率:20個點/秒,過濾常數正常。表4:儲存在含有干燥劑(硅膠)的hdpe瓶中的實施例3.3的片劑的測試條件和結果—溶出度結果光ich:整體近紫外線能量不低于200w·h/m2,總體照度不低于1200klux·h在不同儲存條件下儲存藥物產品期間沒有觀察到顯著的穩定性相關變化。6.水活度水活度用novasinaaw水活度儀測定。對實施例3.3的片劑進行測試。結果記錄在下表5中。表5:儲存在含有干燥劑(硅膠)的hdpe瓶中的實施例3.3的片劑的測試條件和結果—水活度結果在測試條件下儲存12個月后,觀察到水活度略有下降。7.微生物純度根據美國藥典<61>和<62>以及歐洲藥典2.6.12和2.6.13測試實施例3.3的片劑的微生物純度。結果記錄在下表6中。表6:儲存在含有干燥劑(硅膠)的hdpe瓶中的實施例3.3的片劑的測試條件和結果—微生物純度結果在不同儲存條件下儲存藥物產品期間沒有觀察到顯著的穩定性相關變化。識別與上述相同的條件、溶液、試劑、參數和器械在技術人員的知識范圍內。識別適當的參考解決方案、計算方法、適用性測試在技術人員的知識范圍內。當前第1頁12
相關技術
網友詢問留言
已有0條留言
- 還沒有人留言評論。精彩留言會獲得點贊!
1