具有活性離子釋放功能的天然高分子生物活性創(chuàng)傷修復(fù)材料及其制備方法與流程
本發(fā)明涉及硅酸鹽生物陶瓷浸提液滲透法制備離子可控釋放的天然高分子生物活性創(chuàng)傷修復(fù)材料的方法,屬生物醫(yī)用材料領(lǐng)域。
背景技術(shù):
各種創(chuàng)傷、燒傷、手術(shù)、供血不足等原因?qū)е碌能浗M織或器官的損傷是臨床常見的疾病。人體的表層組織如皮膚,若發(fā)生大面積的破損,會造成水分和蛋白質(zhì)過度流失、新陳代謝加劇、免疫系統(tǒng)失調(diào)等局部甚至全身性問題;內(nèi)部組織如心肌,若由于缺血而造成心肌的壞死,可能會惡化導(dǎo)致心力衰竭,且心肌組織很難再生(j.footanklesurg.1997,36,2.;am.j.cardiol.2012,109,187.)。據(jù)統(tǒng)計(jì),全球創(chuàng)傷治療的費(fèi)用在2016年預(yù)計(jì)將達(dá)到115億美元(medmarketdiligencereport#s245)。目前常見的治療手段包括中西醫(yī)結(jié)合技術(shù)的應(yīng)用、創(chuàng)面覆蓋物的應(yīng)用、營養(yǎng)輔助治療、氧氣治療等(ann.anat.2009,191,33.;j.invest.dermatol.2008,128,1852.),但是仍然存在一些有待改進(jìn)的缺陷,如創(chuàng)面愈合后容易形成疤痕組織,給患者帶來長期的生理障礙和心理負(fù)擔(dān)。因此,研制出能夠加速創(chuàng)面愈合,抑制絕痕,促進(jìn)創(chuàng)傷組織在結(jié)構(gòu)和功能上得到雙重修復(fù)的材料和藥物一直是創(chuàng)傷治療領(lǐng)域的重點(diǎn)和難點(diǎn),具有非常重要的意義。
大量研究表明,生長因子可在各類組織器官的創(chuàng)傷修復(fù)中起到重要的作用(burns.2009,35,89.;circ.res.2010,106,818.;arch.dermatol.res.2004,295,521.),向創(chuàng)傷局部補(bǔ)充外源性的生長因子也成為了創(chuàng)傷治療的一條重要思路。但是,生長因子具有半衰期短、易失活、成本高和難以與負(fù)載材料復(fù)合加工的缺點(diǎn),因此臨床應(yīng)用一直受到限制。近年來,有文獻(xiàn)報(bào)道了硅基生物材料,如生物活性硅酸鹽玻璃和硅基生物陶瓷等,具有促進(jìn)血管生成及創(chuàng)傷愈合的作用(j.mater.chem.b2015,3,8856;biomaterials2011,32,2757.;actabiomaterialia,2013,9,5379.;tissueeng.partb-reviews2010,16,199.)。研究表明,用硅酸鈣的浸提液培養(yǎng)成纖維細(xì)胞-內(nèi)皮細(xì)胞體系,可促進(jìn)共培養(yǎng)體系中成纖維細(xì)胞的血管內(nèi)皮生長因子(vegf)的表達(dá)量,并因此上調(diào)了內(nèi)皮細(xì)胞vegf受體的表達(dá),在此過程中內(nèi)皮細(xì)胞的鈣粘著蛋白量增多,增強(qiáng)了細(xì)胞間的連接促使環(huán)狀結(jié)構(gòu)的形成(actabiomaterialia,2013,9,6981.)。由于硅酸鹽陶瓷彌補(bǔ)了生長因子的缺陷,且具有良好的生物相容性和可降解性,成本低廉,所以將其應(yīng)用于創(chuàng)傷修復(fù)材料的制備中,替代生長因子的作用使材料具備成血管活 性,是一個(gè)非常具有前景的方向。
在運(yùn)用生長因子、藥物或其他活性成分進(jìn)行創(chuàng)傷治療的過程中,選取有效的負(fù)載體是非常重要的。以動物軟組織或膠原蛋白來源的天然高分子材料制備的補(bǔ)片材料是一類比較先進(jìn)的創(chuàng)傷修復(fù)材料。這類材料具有良好的生物相容性,透氣保濕性好,能阻擋自然空氣中微生物細(xì)菌與創(chuàng)傷面接觸,有效防止細(xì)菌感染,且易與愈合后的創(chuàng)傷組織面剝離(plast.reconstr.surg.2002,110,560.)。因此,以天然高分子材料為基底,負(fù)載藥物或其他活性成分,可充分發(fā)揮兩方面的優(yōu)勢,在創(chuàng)傷修復(fù)中起到重要的作用。
目前,傳統(tǒng)的制備無機(jī)生物陶瓷-高分子復(fù)合材料的方式包括將生物陶瓷粉體與液相聚合物攪拌混合并澆鑄成型,但是該方法難以用于補(bǔ)片材料的制備中,因?yàn)榱W(xué)作用會破壞高分子基質(zhì)的結(jié)構(gòu)(pharm.res.2008,25,1222.)。其他方式還包括通過噴涂的方法將兩者以表面接觸的形式復(fù)合,但很明顯該方法中復(fù)合相未能進(jìn)入基底的內(nèi)部,不能達(dá)到離子緩釋的效果。此外,采用陶瓷或玻璃顆粒與高分子復(fù)合制備的復(fù)合材料還存在顆粒掉落的問題,在體內(nèi)創(chuàng)傷修復(fù)應(yīng)用中的安全性仍需驗(yàn)證。
技術(shù)實(shí)現(xiàn)要素:
針對上述問題,本發(fā)明的目的在于提供一種離子可控釋放的天然高分子生物活性創(chuàng)傷修復(fù)材料及其制備方法。
一方面,本發(fā)明提供一種離子可控釋放的天然高分子生物活性創(chuàng)傷修復(fù)材料的制備方法,所述制備方法包括:將天然高分子材料浸泡于硅酸鹽浸提液中一段時(shí)間后,取出并干燥,得到離子可控釋放的天然高分子生物活性創(chuàng)傷修復(fù)材料。
本發(fā)明中創(chuàng)新性地采用了硅酸鹽浸提液滲透的方法,以水溶液為介質(zhì),將具有成血管活性的硅酸鹽成分均勻分散至天然高分子材料的內(nèi)部,不產(chǎn)生顆粒狀團(tuán)聚,制備出生物活性的復(fù)合創(chuàng)傷修復(fù)材料,無機(jī)離子均勻吸附分布于高分子基質(zhì)中,具有可控的離子釋放濃度。該方法可廣泛應(yīng)用于無機(jī)相均勻分散的生物陶瓷—天然高分子復(fù)合補(bǔ)片類材料的制備中。
較佳地,天然高分子材料采用硅酸鹽生物陶瓷浸提液浸泡后,具有可控的離子釋放與促成血管的生物活性。
較佳地,所述硅酸鹽是硅酸鹽生物陶瓷和/或硅酸鹽生物玻璃,優(yōu)選為硅酸鈣和/或鎂黃長石。
較佳地,所述硅酸鹽浸提液中含有鈣離子和硅離子,其中鈣離子濃度范圍是67.3~96.8ppm,硅離子濃度范圍是0.2~20.6ppm。
較佳地,所述天然高分子材料為補(bǔ)片類材料,優(yōu)選為脫細(xì)胞組織基質(zhì)和/或天然來源高分子膜。
較佳地,天然高分子材料在硅酸鹽浸提液中的浸泡時(shí)間為36~72小時(shí)。
較佳地,通過改變所述硅酸鹽浸提液的濃度來調(diào)控所述離子可控釋放的天然高分子生物活性創(chuàng)傷修復(fù)材料的離子釋放行為。根據(jù)本發(fā)明,通過調(diào)節(jié)初始的硅酸鹽浸提液的濃度,可精確調(diào)控復(fù)合材料中的離子釋放濃度,使之在促成血管的有效濃度范圍內(nèi)。
較佳地,通過對硅酸鹽浸提液原液進(jìn)行稀釋以改變所述硅酸鹽浸提液的濃度。
較佳地,所述硅酸鹽鹽浸提液原液通過將硅酸鹽粉體浸泡于水溶液中,搖晃、離心取上清液制備獲得,其中所述水溶液優(yōu)選為細(xì)胞培養(yǎng)液。
另一方面,本發(fā)明提供由上述任意一種制備方法制備的離子可控釋放的天然高分子生物活性創(chuàng)傷修復(fù)材料,其包括天然高分子基質(zhì)和均勻吸附分布于所述天然高分子基質(zhì)中的硅酸鹽,所述生物活性創(chuàng)傷修復(fù)材料具有可控的離子釋放濃度。
較佳地,所述可控的離子釋放濃度在促成血管的有效范圍內(nèi)。
本發(fā)明的生物活性創(chuàng)傷修復(fù)材料具有可控的離子釋放濃度,可調(diào)節(jié)在成血管活性的有效范圍內(nèi),能夠應(yīng)用于多種器官和軟組織的創(chuàng)傷修復(fù)中。
附圖說明
圖1為采用本發(fā)明提供的方法,硅酸鈣浸提液初始濃度分別1/64、1/16、1/4的稀釋倍數(shù)時(shí),制備所得的硅酸鈣—脫細(xì)胞基質(zhì)復(fù)合材料的離子釋放過程(分別對應(yīng)圖中的p01/cs1/64、p01/cs1/16、p01/cs1/4)。p01表示未與硅酸鈣復(fù)合的組分;
圖2為采用本發(fā)明提供的方法,硅酸鈣浸提液初始濃度分別1/64、1/16、1/4的稀釋倍數(shù)時(shí),制備所得的硅酸鈣—脫細(xì)胞基質(zhì)復(fù)合材料的細(xì)胞增殖結(jié)果。blank表示采用常規(guī)培養(yǎng)基培養(yǎng)的種植與培養(yǎng)板中的細(xì)胞組分;
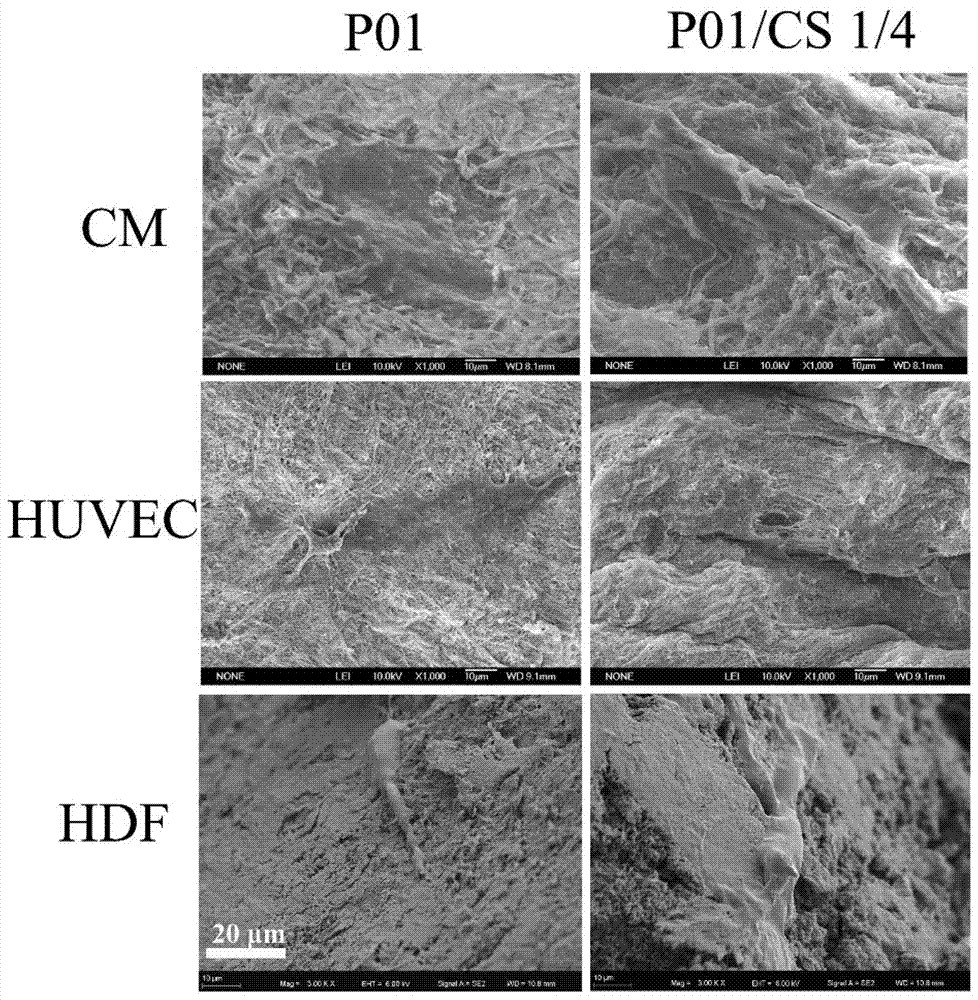
圖3為采用本發(fā)明提供的方法,硅酸鈣浸提液初始濃度為1/4稀釋倍數(shù)時(shí),制備所得的硅酸鈣—脫細(xì)胞基質(zhì)復(fù)合材料的細(xì)胞粘附24小時(shí)的形態(tài);
圖4為采用本發(fā)明提供的方法,硅酸鈣浸提液初始濃度為1/4稀釋倍數(shù)時(shí),制備所得的硅酸鈣—脫細(xì)胞基質(zhì)復(fù)合材料的7天后的細(xì)胞成活狀態(tài);
圖5為采用本發(fā)明提供的方法,硅酸鈣浸提液初始濃度為1/4稀釋倍數(shù)時(shí),制備所得的硅酸鈣—脫細(xì)胞基質(zhì)復(fù)合材料的離子釋放液培養(yǎng)huvec3天后的細(xì)胞中成血管基因的表達(dá)量;
圖6為采用本發(fā)明提供的方法,硅酸鈣浸提液初始濃度為1/4稀釋倍數(shù)和原液時(shí),制備所得的硅酸鈣—膠原蛋白膜復(fù)合材料的離子釋放過程(分別對應(yīng)圖中的col/cs1/4、col/cs 1)。col表示未與硅酸鈣復(fù)合的組分;
圖7為采用本發(fā)明提供的方法,硅酸鈣浸提液初始濃度為1/4稀釋倍數(shù)和原液時(shí),制備所得的硅酸鈣—膠原蛋白膜復(fù)合材料的細(xì)胞增殖結(jié)果;
圖8為采用本發(fā)明提供的方法,硅酸鈣浸提液初始濃度為1/4稀釋倍數(shù)和原液時(shí),制備所得的硅酸鈣—膠原蛋白膜復(fù)合材料表面種植huvec,培養(yǎng)3天后的細(xì)胞中成血管基因的表達(dá)量。
具體實(shí)施方式
以下結(jié)合附圖和下述實(shí)施方式進(jìn)一步說明本發(fā)明,應(yīng)理解,附圖及下述實(shí)施方式僅用于說明本發(fā)明,而非限制本發(fā)明。
本發(fā)明采用硅酸鹽浸提液滲透的方法,以水溶液為介質(zhì),將具有成血管活性的硅酸鹽成分均勻分散至天然高分子材料的內(nèi)部。
本發(fā)明中,硅酸鹽優(yōu)選為具有成血管生物活性的硅酸鹽,包括但不限于硅酸鈣、鎂黃長石、鋅黃長石等一系列生物陶瓷及硅酸鹽生物玻璃。該硅酸鹽中,作為活性離子,除了硅離子以外,還可含有鈣離子、鎂離子、鋅離子等。硅酸鹽可為商用或自制,例如在其為硅酸鈣時(shí),可將硅酸鈉(na2sio3)與硝酸鈣(ca(no3)2)反應(yīng)制得。
所述硅酸鹽浸提液可以是硅酸鹽浸提液原液或是對硅酸鹽浸提液原液進(jìn)行稀釋而得。硅酸鹽浸提液原液是指將硅酸鹽粉體以200mg/ml的濃度于37度下浸泡于溶劑中24小時(shí)獲得的溶解有離子的溶液。所述溶劑可為水、細(xì)胞培養(yǎng)液、pbs緩沖溶液等,優(yōu)選為細(xì)胞培養(yǎng)液,因其含有良好的離子環(huán)境,且可以直接用于細(xì)胞的培養(yǎng)。所述細(xì)胞培養(yǎng)液可為商用或自制,例如mem、dmem、rpmi等。
在一個(gè)示例中,硅酸鹽浸提液原液通過如下方法制備:將硅酸鹽粉體以200mg/ml的濃度浸泡于細(xì)胞培養(yǎng)液中,37度下以120轉(zhuǎn)/分的轉(zhuǎn)速搖晃24小時(shí),離心取上清液制備獲得。離心轉(zhuǎn)速可為3000~4000轉(zhuǎn)/分。
對硅酸鹽浸提液原液進(jìn)行稀釋時(shí),可以采用用于制備硅酸鹽浸提液原液的水溶液進(jìn)行稀釋。稀釋倍數(shù)可根據(jù)所需的離子濃度來選擇。在一個(gè)示例中,硅酸鹽浸提液中含有鈣離子和硅離子。鈣離子濃度可控范圍可為67.3~96.8ppm。硅離子濃度可控范圍可為0.2~20.6ppm。
天然高分子材料包括但不限于脫細(xì)胞組織基質(zhì)如脫細(xì)胞真皮、骨、血管、肌腱、心肌、心臟瓣膜等,以及天然來源高分子制備的膜、海綿等材料,如膠原蛋白、明膠、殼聚糖、透明質(zhì)酸膜和海綿等一系列補(bǔ)片類的材料。對于脫細(xì)胞基質(zhì),可以采用酶-化學(xué)法脫細(xì) 胞而制得。在一個(gè)示例中,所用的脫細(xì)胞基質(zhì)為豬左心室心肌和皮膚來源,經(jīng)酶-化學(xué)法脫細(xì)胞,0.1mg/ml的原花青素交聯(lián)12小時(shí)制備獲得。所用的脫細(xì)胞心肌基質(zhì)具有豐富的膠原蛋白含量和良好的彈性,例如其膠原蛋白含量可為192.22μg/mg,抗張強(qiáng)度可為866.63kpa,彈性模量可為2.95mpa。天然來源高分子制備的膜、海綿等材料可以購自商用。
將天然高分子材料浸泡于硅酸鹽浸提液中,以水溶液為介質(zhì),將硅酸鹽成分均勻分散至高分子材料內(nèi)部。浸泡溫度可在25~37度下。浸泡時(shí)間可為36~72小時(shí)。硅酸鹽浸提液可以采用不同稀釋梯度的硅酸鹽浸提液,例如對硅酸鹽浸提液原液稀釋1/64、1/16、1/4倍等。最終硅酸鹽浸提液中ca和si離子的濃度例如可分別為60.7~123.5ppm和0.1~67.1ppm。天然高分子材料可以根據(jù)需要,制成不同的尺寸。
浸泡完畢后,取出天然高分子材料,進(jìn)行干燥,得到生物活性復(fù)合創(chuàng)傷修復(fù)材料。為了不破壞天然高分子材料的結(jié)構(gòu),優(yōu)選進(jìn)行真空冷凍干燥。
制備得到的生物活性復(fù)合創(chuàng)傷修復(fù)材料,無機(jī)離子(例如硅離子、鈣離子等)均勻吸附分布于高分子基質(zhì)中。將復(fù)合材料浸泡于常規(guī)培養(yǎng)基中1~7天,浸泡溫度可在25~37度,通過icp-oes測試每天釋放的離子濃度,累計(jì)相加可知高分子基質(zhì)中無機(jī)離子的濃度。
該復(fù)合創(chuàng)傷修復(fù)材料具有可控的離子釋放濃度。通過改變初始的硅酸鹽浸提液濃度,可以精確調(diào)控復(fù)合材料的離子釋放濃度,使其限定在具有成血管生物活性的有效的離子濃度范圍內(nèi)。
本發(fā)明中,高分子基質(zhì)的結(jié)構(gòu)不會被破壞,具有成血管活性的硅酸鹽成分均勻分散至天然高分子基底內(nèi)部,不產(chǎn)生顆粒狀團(tuán)聚,可以達(dá)到離子緩釋的效果。
本發(fā)明具有容易調(diào)控復(fù)合材料中離子的釋放行為、制備工藝溫和簡單、技術(shù)路線環(huán)保、成本低廉且便于推廣等優(yōu)點(diǎn),尤其適用于難以通過噴涂、沉降等常規(guī)方法獲得的內(nèi)部硅酸鹽成分均勻分散的補(bǔ)片類材料。
本發(fā)明的方法可以根據(jù)實(shí)際需要,通過調(diào)節(jié)硅酸鹽浸提液的初始濃度,實(shí)現(xiàn)對復(fù)合創(chuàng)傷修復(fù)材料中的離子釋放范圍的調(diào)控,且具備條件溫和、簡單易行、成本低廉、適合量產(chǎn)的優(yōu)點(diǎn),可以推廣到多個(gè)領(lǐng)域要求無機(jī)相均勻分散的生物陶瓷—天然高分子復(fù)合補(bǔ)片類材料的制備中。
該硅酸鹽浸提液滲透法制備獲得的硅酸鹽-天然高分子復(fù)合材料具有可控的離子釋放濃度和緩慢的釋放速率,具有促進(jìn)血管生成的生物活性,可應(yīng)用于多種器官和軟組織的創(chuàng)傷修復(fù)中。
以下,作為示例,更具體地說明本發(fā)明具體實(shí)施工藝步驟。
1、制備方法
(1)硅酸鈣生物陶瓷粉體
將1m硅酸鈉(na2sio3)與1m硝酸鈣(ca(no3)2)的水溶液等體積混合。室溫條件下不斷攪拌過夜。得到的硅酸鈣(cs)沉淀經(jīng)過濾、去離子水洗和醇洗后,在80度下干燥過夜,在800度下煅燒2小時(shí)。
(2)硅酸鈣浸提液
稱取硅酸鈣(cs)粉體,加入內(nèi)皮細(xì)胞培養(yǎng)基中,制備成200mg/ml的懸液,置于搖床內(nèi)37度、以120轉(zhuǎn)/分的轉(zhuǎn)速搖晃24小時(shí)。后以4000轉(zhuǎn)/分的轉(zhuǎn)速離心,取上清液,得到硅酸鈣浸提液原液。后采用內(nèi)皮細(xì)胞培養(yǎng)基梯度稀釋,得到不同濃度的硅酸鈣(cs)浸提液。
(3)脫細(xì)胞基質(zhì)材料
去除新鮮豬心左心室的脂肪,并將心室壁切成2mm薄片。心肌組織經(jīng)1%十二烷基硫酸鈉(sds)、0.01%胰蛋白酶、1mm苯甲基磺酰氟(pmsf)和20μg/mlrna酶、0.2mg/mldna酶脫細(xì)胞兩周,并每天50hz超聲10分鐘。脫細(xì)胞后的心肌組織經(jīng)0.1mg/ml的原花青素交聯(lián)液交聯(lián)12小時(shí),后用pbs沖洗去未交聯(lián)的pc,成功制備出pc交聯(lián)的脫細(xì)胞心肌基質(zhì)。脫細(xì)胞真皮基質(zhì)取自豬的皮膚組織,同樣采用酶-化學(xué)法制備所得。
(4)硅酸鈣—天然高分子復(fù)合材料
將10mm直徑的脫細(xì)胞基質(zhì)和膠原蛋白膜材料置于300μl不同濃度的硅酸鈣浸提液中,37度下浸泡48小時(shí),而后將所得材料冷凍干燥24小時(shí)。
2、性能評價(jià)
(1)離子釋放濃度
將10mm直徑的復(fù)合材料浸沒于300μl細(xì)胞培養(yǎng)基中,在細(xì)胞培養(yǎng)箱內(nèi)孵育不同的時(shí)間。在選取的時(shí)間點(diǎn),收集離子釋放液并重新?lián)Q液。采用電感耦合等離子體發(fā)射光譜法(icp-oes)測試收集的離子釋放液中鈣和硅離子的濃度。
(2)細(xì)胞相容性
采用3到7代的人臍靜脈內(nèi)皮細(xì)胞(huvec)、h9c2心肌細(xì)胞(cm)和人皮膚成纖維細(xì)胞(hdf)考察硅酸鈣—天然高分子復(fù)合材料的細(xì)胞相容性。首先將10mm直徑的樣品置于48孔板中,采用紫外照射30min以殺菌。在細(xì)胞粘附的實(shí)驗(yàn)中,每孔中加入300μl的細(xì)胞懸液(2×104細(xì)胞/ml),孵育24h后,用pbs洗去未貼附的細(xì)胞,固定、脫水、干燥后采用掃描電鏡(sem)觀察細(xì)胞的粘附形態(tài)。在細(xì)胞增殖的實(shí)驗(yàn)中,每孔中加入300μl的細(xì) 胞懸液(104細(xì)胞/ml),孵育1、3、7天后采用cck-8試劑盒進(jìn)行檢測,通過分光光度計(jì)在450nm處檢測od值。
(3)rna的提取和定量逆轉(zhuǎn)錄聚合酶鏈反應(yīng)(qrt-pcr)
脫細(xì)胞基質(zhì)中將huvec以3×105/孔的密度種植于6孔板中培養(yǎng)12小時(shí)。后改用(1)中所收集的樣品的離子釋放液培養(yǎng)細(xì)胞3天,每天換液。膠原蛋白膜中,將huvec以3×105/孔的密度種植于10cm直徑的復(fù)合材料表面,培養(yǎng)3天。采用trizol和氯仿提取huvec中的rna,采用revertraace-akit合成cdna。然后通過qrt-pcr測試vegf、kdr和gapdh的表達(dá)量,其反應(yīng)體系中包含1μl稀釋的cdna、9μlsybr-green和9μl的正向和反向引物。
結(jié)果表明,本發(fā)明的生物活性創(chuàng)傷修復(fù)材料可通過對初始浸提液濃度的調(diào)節(jié),精確控制材料中釋放的離子濃度在促成血管的有效范圍內(nèi)。而且本發(fā)明的生物活性創(chuàng)傷修復(fù)材料具有良好的細(xì)胞相容性,且能促進(jìn)成血管相關(guān)基因的表達(dá)。
下面進(jìn)一步例舉實(shí)施例以詳細(xì)說明本發(fā)明。同樣應(yīng)理解,以下實(shí)施例只用于對本發(fā)明進(jìn)行進(jìn)一步說明,不能理解為對本發(fā)明保護(hù)范圍的限制,本領(lǐng)域的技術(shù)人員根據(jù)本發(fā)明的上述內(nèi)容作出的一些非本質(zhì)的改進(jìn)和調(diào)整均屬于本發(fā)明的保護(hù)范圍。下述示例具體的工藝參數(shù)等也僅是合適范圍中的一個(gè)示例,即本領(lǐng)域技術(shù)人員可以通過本文的說明做合適的范圍內(nèi)選擇,而并非要限定于下文示例的具體數(shù)值。
實(shí)施例1:
(1)硅酸鈣浸提液的配制:
采用細(xì)胞培養(yǎng)基將cs浸提液原液分別稀釋64、16、4倍,于室溫下?lián)u晃均勻,后通過0.22mm的濾器除菌,置于4℃冰箱保存,備用。
(2)硅酸鈣—脫細(xì)胞心肌基質(zhì)復(fù)合材料的制備:
將10mm直徑的脫細(xì)胞心肌基質(zhì)浸沒于300μl的稀釋倍數(shù)分別為64、16、4倍的硅酸鈣浸提液中。置于細(xì)胞培養(yǎng)箱中,37度、5%co2的環(huán)境下浸泡48小時(shí)。然后將復(fù)合材料取出,置于零下80度冰箱冷凍,最后冷凍干燥24小時(shí)。
離子釋放的測試結(jié)果表明(圖1),各組中鈣、硅離子在7天內(nèi)可穩(wěn)定釋放,每天的釋放量分別在8ppm和4ppm以下,且每天平均的釋放量以及累計(jì)釋放量均隨初始的硅酸鈣浸提液濃度的增大而增大,說明通過調(diào)節(jié)硅酸鈣浸提液的初始濃度,可以控制復(fù)合支架中離子的釋放濃度。細(xì)胞相容性測試結(jié)果表明,隨著初始的硅酸鈣浸提液濃度的增大,細(xì)胞的增殖速率也逐漸提高(圖2),其中浸泡于4倍稀釋的硅酸鈣浸提液中的復(fù)合材料(p01/cs 1/4),可以明顯地促進(jìn)huvec的增殖。sem和死活細(xì)胞染色結(jié)果也表明,該復(fù)合材料可支持細(xì)胞的正常粘附與增殖(圖3和圖4)。采用p01/cs1/4組分的復(fù)合材料的離子釋放液培養(yǎng)huvec3天后,發(fā)現(xiàn)血管內(nèi)皮生長因子vegf及其受體kdr的表達(dá)量明顯提高(圖5),說明通過硅酸鈣浸提液滲透法制備的脫細(xì)胞基質(zhì)復(fù)合材料,可通過對初始浸提液濃度的調(diào)節(jié),精確控制材料中釋放的離子濃度在促成血管的有效范圍內(nèi)。
實(shí)施例2:
(1)硅酸鈣浸提液的配制:
采用細(xì)胞培養(yǎng)基將cs浸提液原液分別稀釋64、16、4倍,于室溫下?lián)u晃均勻,后通過0.22mm的濾器除菌,置于4℃冰箱保存,備用。
(2)硅酸鈣—脫細(xì)胞真皮基質(zhì)復(fù)合材料的制備:
將10mm直徑的脫細(xì)胞真皮基質(zhì)浸沒于300μl的稀釋倍數(shù)分別為64、16、4倍的硅酸鈣浸提液中。置于細(xì)胞培養(yǎng)箱中,37度、5%co2的環(huán)境下浸泡48小時(shí)。然后將復(fù)合材料取出,置于零下80度冰箱冷凍,最后冷凍干燥24小時(shí),得到硅酸鈣—脫細(xì)胞真皮基質(zhì)的復(fù)合材料。
實(shí)施例3:
(1)硅酸鈣浸提液的配制:
采用細(xì)胞培養(yǎng)基將cs浸提液原液稀釋4倍,于室溫下?lián)u晃均勻,后通過0.22mm的濾器除菌,置于4℃冰箱保存,備用。
(2)硅酸鈣—膠原蛋白膜復(fù)合材料的制備:
將10mm直徑的膠原蛋白膜浸沒于300μl的稀釋倍數(shù)為4倍的硅酸鈣浸提液和原液中。置于細(xì)胞培養(yǎng)箱中,37度、5%co2的環(huán)境下浸泡48小時(shí)。然后將復(fù)合材料取出,置于零下80度冰箱冷凍,最后冷凍干燥24小時(shí)。
離子釋放的測試結(jié)果表明(圖6),各組中鈣、硅離子在第一天的釋放量較多,分別為21.0ppm和12.9ppm,而后逐漸減少,且每天平均的釋放量以及累計(jì)釋放量均隨初始的硅酸鈣浸提液濃度的增大而增大。細(xì)胞增殖實(shí)驗(yàn)結(jié)果表明,復(fù)合硅酸鈣的膠原蛋白膜表面的細(xì)胞,其增殖速率明顯高于未復(fù)合的膠原膜組。且浸泡于硅酸鈣原液中的復(fù)合材料(col/cs1)與浸泡于4倍稀釋的硅酸鈣浸提液中的復(fù)合材料(col/cs1/4)相比,huvec的增殖速率有了明顯提高(圖7)。將huvec種植于各組材料表面,培養(yǎng)3天后測試成血管相關(guān)基因的表達(dá)量,發(fā)現(xiàn)復(fù)合材料的vegf及其受體kdr以及一氧化氮合酶enos的表達(dá)量與未復(fù)合的膠原膜相比有了明顯的提高(圖8),且col/cs1組較col/cs 1/4組有了進(jìn)一步的上調(diào)。說明通過硅酸鈣浸提液滲透法制備的膠原蛋白膜復(fù)合材料,已通過對初始浸提液濃度的調(diào)節(jié),成功地將材料中釋放的離子濃度控制在促成血管的有效范圍內(nèi)。
實(shí)施例4:
(1)鎂黃長石浸提液的配制:
采用細(xì)胞培養(yǎng)基將鎂黃長石浸提液原液分別稀釋16和4倍,于室溫下?lián)u晃均勻,后通過0.22mm的濾器除菌,置于4℃冰箱保存,備用。
(2)鎂黃長石—膠原蛋白膜復(fù)合材料的制備:
將10mm直徑的膠原蛋白膜浸沒于300μl的稀釋倍數(shù)為16和4倍的鎂黃長石浸提液以及原液中。置于細(xì)胞培養(yǎng)箱中,37度、5%co2的環(huán)境下浸泡48小時(shí)。然后將復(fù)合材料取出,置于零下80度冰箱冷凍,最后冷凍干燥24小時(shí)。
實(shí)施例5:
(1)鋅黃長石浸提液的配制:
采用細(xì)胞培養(yǎng)基將鋅黃長石浸提液原液分別稀釋16和4倍,于室溫下?lián)u晃均勻,后通過0.22mm的濾器除菌,置于4℃冰箱保存,備用。
(2)鋅黃長石—膠原蛋白膜復(fù)合材料的制備:
將10mm直徑的膠原蛋白膜浸沒于300μl的稀釋倍數(shù)為16和4倍的鋅黃長石浸提液以及原液中。置于細(xì)胞培養(yǎng)箱中,37度、5%co2的環(huán)境下浸泡48小時(shí)。然后將復(fù)合材料取出,置于零下80度冰箱冷凍,最后冷凍干燥24小時(shí)。
- 還沒有人留言評論。精彩留言會獲得點(diǎn)贊!
- 一種含貝殼粉、可連續(xù)釋放負(fù)氧離子的無紡布及其制備方法與流程
- 一種驅(qū)蟲的、可連續(xù)釋放負(fù)氧離子的無紡布及其制備方法與流程
- 一種能釋放負(fù)氧離子除甲醛的乳膠漆及其制備方法與流程
- 一種釋放負(fù)氧離子的脫硫石膏膩?zhàn)拥闹谱鞣椒ㄅc工藝
- 一種耐洗的、可連續(xù)釋放負(fù)氧離子的無紡布及其制備方法與流程
- 一種耐磨的、可連續(xù)釋放負(fù)氧離子的無紡布及其制備方法與流程
- 一種抗菌的、可連續(xù)釋放負(fù)氧離子的無紡布及其制備方法與流程
- 一種阻燃防腐、可連續(xù)釋放負(fù)氧離子的無紡布及其制備方法與流程
- 一種可連續(xù)釋放負(fù)氧離子的無紡布及其制備方法與流程
- 一種具有催化功能、可連續(xù)釋放負(fù)氧離子的無紡布及其制備方法與流程
- 能給手機(jī)充電的永久性放出大量負(fù)離子服裝的制作方法與工藝
- 一種新風(fēng)系統(tǒng)中集塵式負(fù)離子加速釋放裝置的制作方法
- 一種基于無甲醛基材并釋放負(fù)離子的木門的制作方法與工藝
- 一種基于無甲醛基材并釋放負(fù)離子的集成吊頂?shù)闹谱鞣椒ㄅc工藝
- 貼有可釋放負(fù)離子硅膠片的服裝及其制作方法與流程
- 釋放負(fù)離子的無機(jī)防水材料及其制備方法和應(yīng)用與流程
- 一種可釋放負(fù)離子的雙層包膜保水緩釋肥及其制備方法與流程
- 一種氧化鋁包覆鈉離子電池正極材料的制備方法與流程
- 一種持續(xù)釋放負(fù)離子的膩?zhàn)臃鄣闹谱鞣椒ㄅc工藝
- 可釋放負(fù)離子的定做服飾的制作方法與工藝