一種以氫氧化鐵膠體為乳液法水相制備聚合物微球的方法與流程
本發明涉及聚合物微球的制備方法,特別涉及一種以氫氧化鐵膠體為乳液法水相制備聚合物微球的方法。
背景技術:
在生物醫學材料領域中,生物可降解聚合物微球具有藥物靶向運輸、藥物緩釋以及模擬細胞外基質以刺激細胞響應的功能。乳液法是最常用于制備聚合物微球的方法,傳統乳液法制備生物醫用微球,總是需要在外水相中加入一定量的表面活性劑以穩定油相乳液滴,如聚乙烯醇(Biomaterials, 2002, 23, 1649-1656)、甲基纖維素(Journal of Biomedical Materials Research, 1992, 26, 467-479)等。但是有研究表明殘留在微球上的表面活性劑會對人體產生不利的影響,比如會產生免疫反應或者致癌(Advanced Drug Delivery Reviews, 2008, 60, 939-954)。有研究表明,采用Pickering乳液法制備的生物醫用聚合物微球可避免有毒表面活性劑所帶來的不利影響。
Pickering乳液法,即采用固體顆粒代替表面活性劑作為乳液的穩定劑(Progress in Chemistry, 2009, 21, 1418-1426)。目前常用于Pickering乳液中的固體顆粒穩定劑主要是納米級或者微米級顆粒,常用在生物醫學材料領域的Pickering乳液固體穩定劑有羥基磷灰石(Acta Biomaterialia, 2011, 7, 821-828)、SiO2(Colloids and Surfaces B: Biointerfaces, 2012, 91, 97-105)、CaCO3(International Journal of Pharmaceutics, 2008, 351, 104-112)等。采用該方法制備的聚合物微球,微球表面會摻有部分固體顆粒穩定劑。
Fe元素是人體所必需的微量元素之一,是骨骼和牙齒中重要的微量元素,對骨組織具有一定的調節作用(Physical Review B, 2002, 66, 648-679)。研究表明摻雜Fe元素的骨水泥具有良好的生物相容性和骨誘導能力(Acta Biomaterialia, 2010, 6, 607-616)。采用氫氧化鐵膠體作為Pickering乳液法的水相時,其中的Fe(OH)3膠體納米粒子作為Pickering乳液法的固體穩定劑,制備出聚合物微球。同時,Fe(OH)3膠體納米粒子可摻在聚合物微球表面,從而使微球表面含有微量的Fe元素,與傳統乳液法所制備的聚合物微球表面成分有所差異。
技術實現要素:
本發明的目的在于提供一種以氫氧化鐵膠體為乳液法水相制備聚合物微球的方法。該方法可使聚合物微球表面摻入少量的鐵元素成分,同時這種方法制備得到的微球具有良好的細胞相容性,可以促使小鼠骨髓間充質干細胞的黏附和增殖。
本發明的目的通過以下技術方案實現。
一種以氫氧化鐵為乳液法水相制備聚合物微球的方法,包括如下步驟:
(1)將聚合物材料添加到有機溶劑中,攪拌,得到聚合物油相溶液;
(2)將FeCl3溶液加入到沸騰的去離子水中,持續加熱,水解反應制備得到氫氧化鐵膠體溶液;
(3)將聚合物油相溶液分散到氫氧化鐵膠體溶液中,得到水包油的單乳液;
(4)持續攪拌水包油的單乳液,揮發除去聚合物油相溶液中的有機溶劑,得到固化的聚合物微球,去離子水洗滌,干燥,得到所述聚合物微球。
進一步地,步驟(1)中,所述聚合物材料包括聚乳酸-羥基乙酸共聚物(PLGA)、聚左旋乳酸(PLLA)或聚己內酯(PCL)。
進一步地,步驟(1)中,所述有機溶劑包括二氯甲烷。
更進一步地,步驟(1)中,所述聚乳酸-羥基乙酸共聚物的分子量Mw=30~100 kDa;所述聚乳酸-羥基乙酸共聚物中,乳酸單體的比例為50%~90%。
更進一步地,步驟(1)中,所述聚左旋乳酸的分子量Mw=30~100 kDa。
更進一步地,步驟(1)中,所述聚己內酯的分子量Mw=50~150 kDa。
更進一步地,步驟(1)中,所述聚乳酸-羥基乙酸共聚物與二氯甲烷的質量體積比為1:5~20g/ml。
更進一步地,步驟(1)中,所述聚左旋乳酸與二氯甲烷的質量體積比為1:5~25g/ml,優選為1:10~25g/ml。
更進一步地,步驟(1)中,所述聚己內酯與二氯甲烷的質量體積比為1:5~25g/ml,優選為1:10~25g/ml。
進一步地,步驟(2)中,所述FeCl3溶液中,FeCl3的質量分數是1%~10%。
進一步地,步驟(2)中,所述FeCl3溶液與沸騰的去離子水的體積比為1:3~50。
進一步地,步驟(2)中,所述持續加熱的時間為0.5~3 min。
進一步地,步驟(2)中,持續加熱的溫度保持在80℃以上。
進一步地,步驟(3)中,所述聚合物油相溶液與氫氧化鐵膠體溶液的體積比為1:4~100。
進一步地,步驟(4)中,所述持續攪拌的轉速為200~500 rpm,時間為2~24 h。
本發明采用Pickering乳液法原理,將氫氧化鐵膠體粒子作為Pickering乳液法的固體乳化劑,與聚合物的二氯甲烷溶液在攪拌下形成水包油乳液;在水包油乳液中,氫氧化鐵膠體粒子存在水相與油相液滴的界面上,不斷攪拌使二氯甲烷揮發以使聚合物微球固化,氫氧化鐵膠體粒子在微球固化過程中會留在微球表面,于是形成了表面含鐵元素成分的聚合物微球。
與現有技術相比,本發明具有以下優點和有益效果:
(1)本發明方法制備的聚合物微球表面含有鐵元素成分,且具有良好的細胞相容性;相對傳統的聚乙烯醇(PVA)乳液法制備的微球,含有鐵元素成分的聚合物微球對小鼠骨髓間充質干細胞具有促進增殖作用。
附圖說明
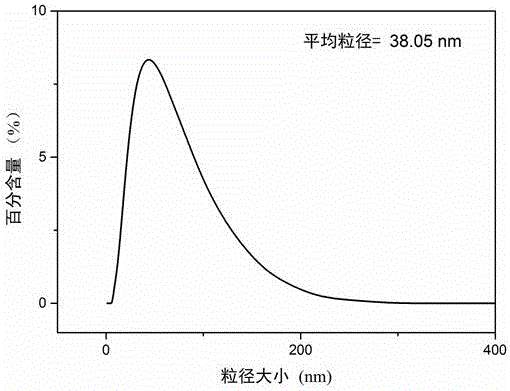
圖1為實施例1制備的水相中Fe(OH)3膠體納米粒子的粒徑分布圖;
圖2為實施例1制備的Fe(OH)3-PLGA微球的整體形貌圖;
圖3為實施例1制備的Fe(OH)3-PLGA微球的表面XPS測試結果圖;
圖4為實施例1制備的Fe(OH)3-PLGA微球與小鼠骨髓間充質干細胞共培養5天后的活死細胞染色圖;
圖5為實施例2制備的PVA-PLGA微球的整體形貌圖;
圖6為實施例1、2制備Fe(OH)3-PLGA微球和PVA-PLGA微球的細胞增殖情況柱狀圖;
圖7為實施例3中制備的Fe(OH)3-PLLA微球的整體形貌圖;
圖8為實施例4中制備的Fe(OH)3-PCL微球的整體形貌圖。
具體實施方式
下面結合實施例,對本發明作進一步地詳細說明,但本發明的實施方式不限于此。
實施例1
(1)稱取0.5 g PLGA(LA/GA =85/15, Mw=100 kDa)加入到5 ml 二氯甲烷中,在300 rpm轉速攪拌30 min,得到PLGA的油相溶液;
(2)取60 ml質量分數為3%的FeCl3溶液加入到240 ml 沸騰的去離子水中,持續加熱2 min,制成氫氧化鐵膠體溶液,作為乳液的水相;
圖1為水相中Fe(OH)3膠體納米粒子的粒徑分布圖,由圖1可知,大部分Fe(OH)3膠體納米粒子粒徑分布于0~200nm之間,平均粒徑為38.05nm;
(3)在轉速為300 rpm攪拌條件下,將PLGA的油相溶液逐滴加入到氫氧化鐵膠體溶液中,得到水包油的單乳液;
(4)持續攪拌單乳液5 h,揮發除去有機溶劑,得到表面含鐵元素成分的PLGA微球;收集固化的PLGA微球,用去離子水洗滌3遍后,冷凍干燥,標記為Fe(OH)3-PLGA微球。
圖2為制備的Fe(OH)3-PLGA微球的整體形貌圖,由圖2可知,制備得到的Fe(OH)3-PLGA微球表面光滑。
圖3為制備的Fe(OH)3-PLGA微球的表面XPS測試結果圖,測試結果顯示,在結合能為708.5eV處有屬于Fe元素2p軌道電子的峰出現,表明在微球表面含有鐵元素。
圖4為制備的Fe(OH)3-PLGA微球與小鼠骨髓間充質干細胞共培養5天后的活死細胞染色圖,由圖4可知,在第5天的時候,微球表面黏附了大量的細胞,并且沒有發現死細胞,說明該微球具有良好的細胞相容性,對小鼠骨髓間充質干細胞不具有毒害作用。
實施例2
(1)稱取0.5 g PLGA(LA/GA =85/15, Mw=100 kDa)加入到5 ml 二氯甲烷中,在300 rpm轉速攪拌30 min,得到PLGA油相溶液;
(2)稱取1.50 g PVA加入到250 ml 90℃的去離子水中,持續加熱60min,使PVA充分溶解,冷卻后得到PVA的水相溶液;
(3)在轉速為300 rpm攪拌條件下,將PLGA的油相溶液逐滴加入到PVA水相溶液中,得到水包油的單乳液;
(4)持續攪拌單乳液5 h,揮發除去有機溶劑,得到表面不含鐵元素的PLGA微球;收集固化的PLGA微球,用去離子水洗滌3遍后,冷凍干燥,標記為PVA-PLGA微球。
圖5為制備的PVA-PLGA微球整體形貌圖,由圖5可知,傳統的PVA乳液法制備得到的PVA-PLGA微球的表面光滑。
圖6為實施例1、2制備Fe(OH)3-PLGA微球和PVA-PLGA微球的細胞增殖情況圖,由圖6可知,兩種方法制備的PLGA微球上,細胞均能呈現良好的增殖情況,且在相同時間點上,Fe(OH)3-PLGA微球的增殖情況比PVA-PLGA微球更好,具有顯著性差異。
實施例3
(1)稱取0.5 g PLLA(Mw=50 kDa)加入到5 ml 二氯甲烷中,在300 rpm轉速攪拌30 min,得到PLLA的油相溶液;
(2)取60 ml質量分數為3%的FeCl3溶液加入到240 ml 沸騰的去離子水中,持續加熱2 min,制成氫氧化鐵膠體溶液,作為乳液的水相;
(3)在轉速為300 rpm攪拌條件下,將PLLA的油相溶液逐滴加入到氫氧化鐵膠體溶液中,得到水包油的單乳液;
(4)持續攪拌單乳液5 h,揮發除去有機溶劑,得到表面含鐵元素的PLLA微球;收集固化的PLLA微球,用去離子水洗滌3遍后,冷凍干燥,標記為Fe(OH)3-PLLA微球。
圖7為制備的Fe(OH)3-PLLA微球的整體形貌圖,圖7顯示成功制備微Fe(OH)3-PLLA微球。
制得的Fe(OH)3-PLLA微球表面含有鐵元素成分,且具有良好的細胞相容性,對小鼠骨髓間充質干細胞不具有毒害作用。
實施例4
(1)稱取0.5 g PCL(Mw=80 kDa)加入到5 ml 二氯甲烷中,在300 rpm轉速攪拌30 min,得到PCL的油相溶液;
(2)取60 ml質量分數為3%的FeCl3溶液加入到240 ml 沸騰的去離子水中,持續加熱2 min,制成氫氧化鐵膠體溶液,作為乳液的水相;
(3)在轉速為300 rpm攪拌條件下,將PCL的油相溶液逐滴加入到氫氧化鐵膠體溶液中,得到水包油的單乳液;
(4)持續攪拌單乳液5 h,揮發除去有機溶劑,得到表面含鐵元素的PCL微球;收集固化的PCL微球,用去離子水洗滌3遍后,冷凍干燥,標記為Fe(OH)3-PCL微球。
圖8為制備的Fe(OH)3-PCL微球的整體形貌圖,圖8顯示成功制備出Fe(OH)3-PCL微球。
制得的Fe(OH)3-PCL微球表面含有鐵元素成分,且具有良好的細胞相容性,對小鼠骨髓間充質干細胞不具有毒害作用。
實施例5
(1)稱取0.25g PLGA(LA/GA =90/10, Mw=30 kDa)加入到5 ml 二氯甲烷中,在300 rpm轉速攪拌30 min,得到PLGA的油相溶液;
(2)取5 ml質量分數為10%的FeCl3溶液加入到15 ml 沸騰的去離子水中,持續加熱0.5 min,制成氫氧化鐵膠體溶液,作為乳液的水相;
(3)在轉速為300 rpm攪拌條件下,將PLGA的油相溶液逐滴加入到氫氧化鐵膠體溶液中,得到水包油的單乳液;
(4)持續攪拌單乳液24 h,揮發除去有機溶劑,得到表面含鐵元素成分的PLGA微球;收集固化的PLGA微球,用去離子水洗滌3遍后,冷凍干燥,標記為Fe(OH)3-PLGA微球。
制得的Fe(OH)3-PLGA微球表面含有鐵元素成分,且具有良好的細胞相容性,對小鼠骨髓間充質干細胞不具有毒害作用。
實施例6
(1)稱取1g PLGA(LA/GA =50/50, Mw=70 kDa)加入到5 ml 二氯甲烷中,在300 rpm轉速攪拌30 min,得到PLGA的油相溶液;
(2)取5 ml質量分數為10%的FeCl3溶液加入到250 ml 沸騰的去離子水中,持續加熱0.5 min,制成氫氧化鐵膠體溶液,作為乳液的水相;
(3)在轉速為500 rpm攪拌條件下,將PLGA的油相溶液逐滴加入到氫氧化鐵膠體溶液中,得到水包油的單乳液;
(4)持續攪拌單乳液2 h,揮發除去有機溶劑,得到表面含鐵元素成分的PLGA微球;收集固化的PLGA微球,用去離子水洗滌3遍后,冷凍干燥,標記為Fe(OH)3-PLGA微球。
制得的Fe(OH)3-PLGA微球表面含有鐵元素成分,且具有良好的細胞相容性,對小鼠骨髓間充質干細胞不具有毒害作用。
實施例7
(1)稱取1g PLLA(Mw=30 kDa)加入到5 ml 二氯甲烷中,在300 rpm轉速攪拌30 min,得到PLLA的油相溶液;
(2)取100 ml質量分數為1%的FeCl3溶液加入到400 ml 沸騰的去離子水中,持續加熱3 min,制成氫氧化鐵膠體溶液,作為乳液的水相;
(3)在轉速為500 rpm攪拌條件下,將PLLA的油相溶液逐滴加入到氫氧化鐵膠體溶液中,得到水包油的單乳液;
(4)持續攪拌單乳液5 h,揮發除去有機溶劑,得到表面含鐵元素的PLLA微球;收集固化的PLLA微球,用去離子水洗滌3遍后,冷凍干燥,標記為Fe(OH)3-PLLA微球。
制得的Fe(OH)3-PLLA微球表面含有鐵元素成分,且具有良好的細胞相容性,對小鼠骨髓間充質干細胞不具有毒害作用。
實施例8
(1)稱取0.2 g PLLA(Mw=100 kDa)加入到5 ml 二氯甲烷中,在300 rpm轉速攪拌30 min,得到PLLA的油相溶液;
(2)取60 ml質量分數為3%的FeCl3溶液加入到240 ml 沸騰的去離子水中,持續加熱2 min,制成氫氧化鐵膠體溶液,作為乳液的水相;
(3)在轉速為200 rpm攪拌條件下,將PLLA的油相溶液逐滴加入到氫氧化鐵膠體溶液中,得到水包油的單乳液;
(4)持續攪拌單乳液5 h,揮發除去有機溶劑,得到表面含鐵元素的PLLA微球;收集固化的PLLA微球,用去離子水洗滌3遍后,冷凍干燥,標記為Fe(OH)3-PLLA微球。
制得的Fe(OH)3-PLLA微球表面含有鐵元素成分,且具有良好的細胞相容性,對小鼠骨髓間充質干細胞不具有毒害作用。
實施例9
(1)稱取1 g PCL(Mw=50 kDa)加入到5 ml 二氯甲烷中,在300 rpm轉速攪拌30 min,得到PCL的油相溶液;
(2)取60 ml質量分數為3%的FeCl3溶液加入到240 ml 沸騰的去離子水中,持續加熱2 min,制成氫氧化鐵膠體溶液,作為乳液的水相;
(3)在轉速為300 rpm攪拌條件下,將PCL的油相溶液逐滴加入到氫氧化鐵膠體溶液中,得到水包油的單乳液;
(4)持續攪拌單乳液5 h,揮發除去有機溶劑,得到表面含鐵元素的PCL微球;收集固化的PCL微球,用去離子水洗滌3遍后,冷凍干燥,標記為Fe(OH)3-PCL微球。
制得的Fe(OH)3-PCL微球表面含有鐵元素成分,且具有良好的細胞相容性,對小鼠骨髓間充質干細胞不具有毒害作用。
實施例10
(1)稱取0.2 g PCL(Mw=150 kDa)加入到5 ml 二氯甲烷中,在300 rpm轉速攪拌30 min,得到PCL的油相溶液;
(2)取60 ml質量分數為3%的FeCl3溶液加入到240 ml 沸騰的去離子水中,持續加熱2 min,制成氫氧化鐵膠體溶液,作為乳液的水相;
(3)在轉速為300 rpm攪拌條件下,將PCL的油相溶液逐滴加入到氫氧化鐵膠體溶液中,得到水包油的單乳液;
(4)持續攪拌單乳液5 h,揮發除去有機溶劑,得到表面含鐵元素的PCL微球;收集固化的PCL微球,用去離子水洗滌3遍后,冷凍干燥,標記為Fe(OH)3-PCL微球。
制得的Fe(OH)3-PCL微球表面含有鐵元素成分,且具有良好的細胞相容性,對小鼠骨髓間充質干細胞不具有毒害作用。
- 還沒有人留言評論。精彩留言會獲得點贊!