黃芪散在制備預防或治療阿爾茨海默病的藥物中的應用的制作方法
本發明屬于中藥領域,涉及黃芪散,具體來說是黃芪散在制備預防或治療阿爾茨海默病的藥物中的應用。
背景技術:
阿爾茨海默病(Alzheimer’s disease,AD),是一種最常見的中樞神經系統退行性疾病,也是老年癡呆的最常見類型,AD臨床病理主要表現為持續性認知能力下降,進行性記憶能力減退,運動功能障礙,性格改變,語言功能障礙,最終發展為癡呆。阿爾茨海默病的神經病理學特征主要表現為沉積在細胞外的老年斑(Senile plaques,SPs),細胞內聚集的神經纖維纏結(Neurofibrillary tangles,NFTs)以及特定腦區的神經元死亡。這種疾病最早是在1906年11月3日,由德國精神病醫生阿爾茲海默(Alois Alzheimer)在德國西南地區精神病醫師學會第37屆大會上首次報道的,他采用Bielschowsky銀染技術研究了病人的腦組織,發現在癡呆病人的腦內存在兩種罕見的銀染呈深色的沉積:一種是位于特定腦區的胞外沉積,現在被稱作淀粉樣蛋白斑;另一種是位于胞內的沉積,阿爾茲海默將其描述為神經纖維纏結。后來,Kraepelin便以發現者的名字命名了該疾病:阿爾茲海默病。自從阿爾茲海默醫生發現AD病人腦內存在這兩種異常沉積后,科學家們便開始研究它們的組成成分。目前,關于AD的發病原因及其病理機制了解還不清楚,并且尚沒有有效的治療方法。上世紀60年代,利用電子顯微鏡技術,Michael Kidd和Robert Terry分別獨立的描述了老年斑的精細結構,老年斑主要是由具有淀粉樣結構的物質組成。所謂的“淀粉樣結構”是指具有反式β-折疊結構的直徑在10納米左右的細絲(fibril)。由于反式β-折疊結構的物質很容易與染料結合從而被著色,所以可以通過一些染料來標記老年斑,Thioflavine S是其中較為常用的,用于標記淀粉樣蛋白斑的一種染料。而神經纖維纏結的主要成分是高度磷酸化的微管蛋白。
隨著世界人口的不斷老齡化,AD的發病率也呈現出了不斷上升的趨勢,根據現有人口及患病率可以推算,到2020年全球的AD患者將到達4230萬。2040年,患者將突破8110萬人口。如此龐大的患者數量,將給社會造成極大的負擔。由于AD發病時間較晚,并且沒有特異性指標,在早期是很容易被忽略的,因而會錯過了最佳的治療時期,當被確診時通常已經到了晚期。AD已經成為了繼心血管疾病、腫瘤和腦卒中之后的第4位殺手,嚴重的危害老年人的身體健康和老年人的生活質量,成為當前老年醫學所面臨的最為嚴峻的問題之一。關于AD的流行病學調查,揭示了多個與AD相關的因素,如衰老、性別、基因多態性、心腦血管疾病史、腦外傷和受教育水平等。其中衰老是最主要的因素。隨著年齡的增長,AD的發病率及病情的惡化程度也會呈明顯上升趨勢。據統計,65歲人群中的平均患病率為1%,75歲為5%,85歲為18%,95歲上升至53%,也就是說每兩個人中至少有一個人為老年癡呆患者。
β-淀粉樣多肽(β-amyloid peptid,Aβ)是一種分子量略大于4KDa的多肽,關于Aβ的生理作用,目前尚不清楚。早期文獻報道,低濃度的Aβ可以促進神經元存活和突觸可塑性。近來文獻報道,Aβ可以促進海馬神經元突觸前釋放神經遞質。關于Aβ的毒性也得到了很多方面證據支持。人們首先在培養的細胞中發現Aβ可以導致神經元死亡,之后在APP轉基因小鼠中發現Aβ可以導致突觸的丟失,另外Aβ也可以通過位于星形膠質細胞和小膠質細胞上的受體,激活星形膠質細胞和小膠質細胞,使其釋放細胞因子和炎癥因子等,反過來作用于神經元,導致神經元的死亡。到底是細胞內還是細胞外的Aβ有神經毒性仍存在爭議。在AD病人腦內,Aβ的構象發生了改變,形成了β-折疊二級結構而易于發生聚集。Aβ是生理代謝的自然產物,由β-淀粉樣多肽前體蛋白(amyloid precursor protein,APP)剪切產生的。APP是一種分子量在110-130KDa的單次跨膜的Ⅰ型膜蛋白,包含有一個大的N端胞外結構域和一個短小的C端胞內結構域,有三種蛋白酶參與了APP的蛋白加工過程(APP processing),根據酶切位點發現的早晚順序分別稱為α-分泌酶、β-分泌酶和γ-分泌酶(如圖1所示)。APP的剪切過程有淀粉樣途徑和非淀粉樣途徑兩種途徑,淀粉樣途徑是由β-分泌酶剪切,APP被剪切為游離形式的N-端蛋白片段(sAPPβ)和留在膜上的含β-淀粉樣多肽的C-端(C99),因其所含的氨基酸個數而被稱為C99,C99片段被膜上的γ-分泌酶復合體進一步剪切,產生Aβ和APP胞內結構域片段(APP intracellular domain,AICD)。由于γ-分泌酶可以在多個位點剪切APP,導致了產生的Aβ的長度是可變的,比較常見的是40或42個氨基酸殘基的多肽片段,命名為Aβ40和Aβ42。大部分全長的Aβ是由40個氨基酸組成的,有一小部分(大約10%)是由42個氨基酸組成的。由于Aβ42多了兩個疏水的氨基酸殘基而更易于聚集。
非淀粉樣途徑是由α-分泌酶剪切APP,產生游離形式的N-端sAPPα和C-端片段C83,C83片段進一步被γ-分泌酶復合體剪切生成P3和AICD,由于α-分泌酶的酶切位點位于Aβ的結構域內部,所以不會產生Aβ。Aβ可以自發的聚集,形成多種共存的形式。可以由2-6個多肽形成寡聚體,并進一步融合形成中間聚集體;也可形成纖維,并列為β-折疊片,進一步形成不可溶性纖維。在AD病人的腦組織中,構象發生改變的Aβ聚集并在細胞外沉積,與變性的神經突起構成了老年斑,并且在老年斑的周圍常常伴隨有膠質細胞的激活。可溶性的寡聚體和淀粉樣中間聚集體是Aβ毒性最高的兩種形式。
目前研究的比較多的常染色體上的三個基因的突變會導致家族性遺傳阿爾茲海默病(familiar Alzheimer disease,FAD),分別是位于21號染色體上的APP基因、位于14號染色體上的早老素1(presenilin 1,PS1)基因以及位于1號染色體上的早老素2(presenilin2,PS2)基因。在APP基因上目前發現大約有25個與AD相關的突變。其中的一些突變如K670N/M671L的Swedish突變,可增加APP被β-分泌酶的剪切;另一些突變如1716V的Florida突變或V7171的London突變,可促進γ-分泌酶的切割產生更多的Aβ42;還有一些突變如E693G的Arctic突變,可促進Aβ的聚集,產生更多的更具有毒性的寡聚體。這些在FAD中發現的基因突變為AD的轉基因動物模型提供了理論依據,使得研究者可以在動物水平研究AD的病理過程。我們在該實驗中所用到的AD轉基因動物模型就是過表達人類APP蛋白的Swedish突變(K595N/M596L)和PS1的第9個外顯子敲出突變的轉基因小鼠(APPswe/PS1ΔE9)。這種轉基因的小鼠通常在6個月齡時就會出現老年斑,并且9個月齡時老年斑就已經比較多。
圖1顯示了淀粉樣途徑:β-分泌酶將APP剪切成兩個片段,游離形式的N-端蛋白片段(sAPPβ)和留在摸上的含β淀粉樣多肽的C-端(C99)。C99片段進一步被γ-分泌酶復合體剪切,產生Aβ和APP胞內結構域片段(AICD)。
圖1同時顯示了非淀粉樣途徑:APP經由α-分泌酶剪切,產生游離形式的N-端sAPPα和C-端片段C83,C83片段進一步被γ-分泌酶復合體剪切生成P3和AICD。
除了家族性遺傳的早發性AD病人,絕大多數的AD病人屬于散發型。AproE的多態性是與散發型AD關聯性最好的遺傳因子,因此AproE被稱為AD的危險因子。AproE是一個與膽固醇運輸和代謝相關的載脂蛋白,在腦內主要是由星形膠質細胞和小膠質細胞分泌,可以將膽固醇從星形細胞運輸到神經元,神經元則表達其受體。ApoE包含299個氨基酸,包含有三種形式,AproE2、AproE3以及AproE4。在AD病人中AproE4的比例顯著提高,說明ApoE4的升高可能導致AD的發病。AproE4基因突變體是目前已知最具危險性的散發型AD的遺傳性因素之一,40%~60%的AD患者是該基因變異型的攜帶者,說明ApoE4基因與AD的發病密切相關,它可能增加了患者對AD的易感性,從而增加發生AD的危險性,但關于ApoE4基因增加AD易感性的確切機制目前還不清楚,相反ApoE2則具有保護功能。綜上所述,APP、PS1和PS2基因的突變可導致家族性AD的發生,ApoE4則是散發型AD的危險因子。
下面描述AD的發病機理:
目前關于AD的發病機理有很多假說,包括淀粉樣級聯假說、Tau蛋白假說、炎癥與免疫假說、鈣穩態失衡假說、早老素假說和膽堿能假說等。其中淀粉樣級聯假說占主導地位,淀粉樣級聯假說認為,遺傳或環境因素可導致Aβ的產生和清除之間的不平衡狀態,以及Aβ的聚集,會導致Aβ的過度積累,當Aβ過度積累則會發生聚集、形成寡聚體的纖維絲。寡聚體形式的Aβ毒性最強。可導致神經突起的損傷和突觸功能的異常,引起神經元內離子濃度失衡,細胞產生氧化應激;打破蛋白激酶和磷酸酶的平衡,導致Tau蛋白的過度磷酸化,產生神經元纖維纏結。最終,Aβ會引起突觸和神經元的死亡,神經環路的破壞,最終導致癡呆。Aβ的過度產生和積累,被認為是導致AD的主要原因。近年來,可溶性形式的、寡聚體的以及胞內的Aβ在促進阿爾茲海默病中的機制也越來越受到重視。Tau蛋白是一種微管相關蛋白,主要存在于神經元的軸突中,是由352-441個氨基酸組成的。在AD病人腦中神經元內纖維纏結(NFTs)的主要成分就是過度磷酸化的tau蛋白,異常tau蛋白的病理性沉積導致了NFTs的形成,而NFTs作為大腦早老化的標志之一是隨著AD病程的發展而逐漸增多的,并與臨床上患者的癡呆程度相關的。越來越多的證據表明tau蛋白在AD的進程中發揮著關鍵的作用,特別是tau蛋白水平及其磷酸化修飾對線粒體功能的影響。Tau蛋白在嗅皮質和海馬至整個大腦皮質聚集的擴散,與AD的病程相關性也深受學者們的重視,體外的實驗也已經證實tau蛋白可以在細胞間擴散。現在的大多研究主要集中在Aβ生成的機制上,包括β-分泌酶和γ-分泌酶的功能研究。Aβ生成量的增加可解釋一部分的病例,主要是攜帶突變的APP和早老素1或早老素2基因的患者。隨著對AD的深入研究,越來越多的研究者認為,很多AD患者可能是由于腦內清除Aβ的功能出現障礙,導致生命過程中生成的Aβ無法被及時清除,從而使Aβ聚集,導致了AD。遺傳有載脂蛋白E4(ApoE4)等位基因的個體更容易患AD,通過對病因的研究發現,攜帶ApoE4等位基因的個體Aβ的生成量并沒有增加,在細胞水平上共表達APP和ApoE4也沒有改變細胞Aβ的生成量。根據人的神經病理性損傷分析和動物模型研究,發現ApoE能使腦中的Aβ總體水平穩定升高,可能是因為增加了Aβ的纖維形成能力和/或是降低了Aβ的清除。盡管它的具體機制還尚未研究清楚,但ApoE介導的大腦中Aβ水平的增高至少示提了細胞在Aβ清除方面可能存在功能障礙。
關于中藥治療阿爾茲海默病的研究:
目前對于AD的治療,尚缺乏療效滿意的治療藥物.針對病因不清、多因素相關的復雜性疾病,中醫藥多靶點、多環節治療的特點可能比單靶點治療具有優勢。目前用于臨床治療AD的藥物主要是膽堿酯酶抑制劑和谷氨酸受體激動劑,但其作用還很有限,且有副作用。中草藥資源在我國含量豐富,有著悠久的治療疾病歷史。研究表明,有些中草藥成分能夠改善動物模型的認知和記憶能力,但是具體的作用機制尚不清楚。AD屬于中醫學“呆證”、“癡證”、“虛勞”、“善忘”等范疇,中醫學對AD的認識由來已久。近年來大量的實驗研究也證明中醫藥在治療AD時有著顯著的調節神經遞質、減輕炎癥與免疫反應、減少神經元的凋亡、抑制Aβ和tau蛋白的過度沉積等作用。目前認為神經原纖維纏結和老年斑均是AD的病理學標志物,它們究竟與中醫病理的哪個環節關系更為密切,可能會成為將來研究的一個方向。隨著對中醫藥治療AD機制的深入研究,探索AD中醫病理與西醫病理之間的交叉點,發現兩者之間的內在聯系,可成為篩選有效治療AD中藥的有效途徑。
李林等人的研究發現中藥復方和單味中藥的提取物都可以作用在AD發病機制的多靶點和多途徑,特別是部分補腎中藥,如何首烏二苯乙烯苷、山茱萸環烯醚萜苷、淫羊藿苷等,具有神經保護和神經營養再生作用,對于治療AD具有比較明顯的特點和優勢。張云玲等人通過觀察黃芪提取物對Aβ25-35所致阿爾茲海默病模型大鼠的學習記憶能力及腦內海馬神經元Bcl-2和Bcl-xl表達的影響,發現黃芪提取物能改善AD模型大鼠的學習記憶能力,對海馬組織有一定的保護作用,其機制可能是通過增加Bcl-2和Bcl-xl的表達而抑制海馬神經元的凋亡。魯國等利用β-淀粉樣肽(Aβ25-35)右側杏仁核注射制備AD大鼠模型,發現葛根素可顯著改善AD模型大鼠的空間記憶障礙,提高其腦內神經元Bcl-2的表達,降低Bax表達,說明葛根素能對抗β-淀粉樣肽的神經毒性,機制可能與抑制神經元凋亡有關。朱燃等人利用雙基因轉染細胞模型探究了黃芪總皂苷、天麻素、三七總皂苷、鹽酸川芎嗪、葛根素、蛇床子素、淫羊藿黃苷、人參皂苷Rb1、隱丹參酮和芍藥苷這10種對動物腦認知和記憶損傷有改善作用的中藥活性成分,篩選結果表明,其中的黃芪總皂苷、天麻素、隱丹參酮和芍藥苷4種中草藥成分對細胞模型分泌到細胞培養液中的Aβ水平有明顯的降低作用,而且這種降低作用呈劑量依賴性。2006年北京中醫藥大學學報報道了銀杏葉中提取的一種混合物EGb761,能夠通過抑制β淀粉樣蛋白前體蛋白的mRNA表達,抑制Aβ激活膠質細胞,降低皮層和海馬中星形膠質細胞的增生,改善AD大鼠的認知記憶能力。也有報道指出黃芪三仙湯、中藥地黃飲子夜可抑制神經膠質細胞的激活、減少炎癥細胞因子的表達,從而改善AD模型大鼠的學習記憶能力。這些研究表明,很多中藥的有效成分都能夠通過抑制中樞神經系統的免疫炎癥級聯反應以及降低Aβ的量,來預防和治療AD。現在臨床上以及仍處在實驗研究階段的藥物大都是針對AD的一個靶點設計的,這也可能是現有藥物療效并不是那么好的原因所在。
黃芪散出自《圣濟總錄》組方為黃芪,葛根,桑白皮(1:2:1)。其主治三消渴疾,肌膚瘦弱、飲水不休,小便不止。用法為黃耆銼桑根白皮銼細各一兩葛根銼二兩搗羅為散,每服三錢匕(引自原文),煎殺豬湯,澄清調下,不拘時。
技術實現要素:
針對現有技術中的上述技術問題,本發明提供了黃芪散的新的用途,所述的這種黃芪散的新的用途要解決現有技術中的中藥防治阿爾茨海默病的效果不佳的技術問題。
本發明提供了黃芪散在制備預防或治療阿爾茨海默病的藥物中的應用,所述的黃芪散由黃芪、葛根和桑白皮組成,黃芪、葛根和桑白皮的質量比為1:2:1。
本發明和已有技術相比,其技術進步是顯著的。本發明源自北宋《圣濟總錄》,全方由葛根、黃芪、桑白皮組成,其主治三消渴疾,肌膚瘦弱、飲水不休,小便不止。通過藥效學試驗證明本發明黃芪散有抑制阿爾茨海默病發生,改善阿爾茨海默病的任職減退等功能,并具有標本兼治之功,能有效地防治阿爾茨海默病。
附圖說明
圖1為APP的加工過程示意圖。
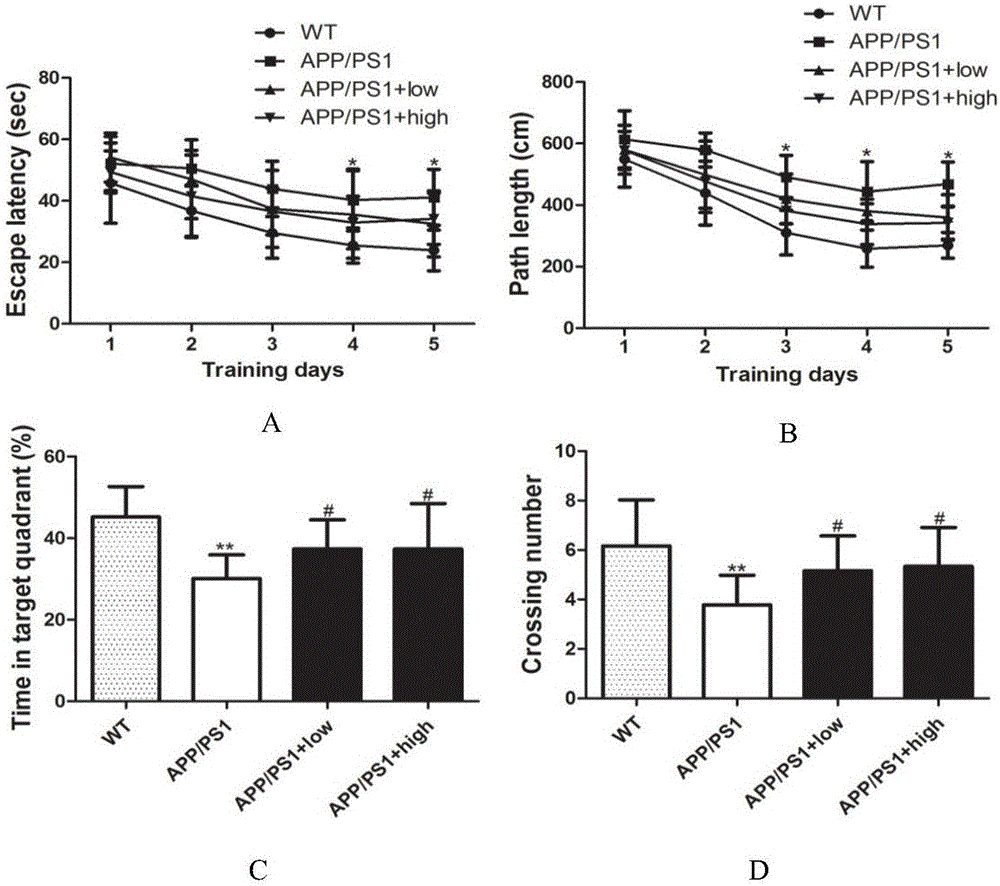
圖2顯示了中藥復方HQ201508能改善APP/PS1小鼠的空間學習記憶能力;圖A和B:中藥復方HQ201508飼料干預6個月后,對小鼠進行Morris水迷宮實驗,統計訓練階段不同組小鼠尋找水中平臺所用的平均時間,即A圖顯示的潛伏期。以及統計了小鼠找到平臺的平均距離,即B圖中顯示的路徑距離,每組有10~12只小鼠。APP/PS1小鼠與野生型小鼠(WT)比較*P<0.05。圖C和D:撤去平臺后,統計了不同組小鼠在平臺所處象限停留的時間比例(C)和小鼠穿越平臺所在區域的次數(D)。與WT小鼠比較*P<0.05,與模型組的APP/PS1小鼠比較#P<0.05。
圖3示了中藥復方HQ201508改善APP/PS1小鼠自主性活性以及對新事物識別的行為;圖A:各組小鼠在曠場實驗中5min內活動的總路程;圖B:各組小鼠在曠場試驗中5min內活動的平均速度;圖C:各組小鼠在曠場試驗中5min內在周圍區域所停留的時間占總時間的百分比。每組有10~12只小鼠。與WT小鼠比較***P<0.0001,與模型組的APP/PS1小鼠比較#P<0.05。圖D:新事物識別試驗中小鼠對新物體的鑒別指數;圖E:新事物識別實驗中訓練階段和測試階段,小鼠對物體的識別的總時間,小鼠在每組有10~12只小鼠。與WT小鼠比較**P<0.001,與模型組的APP/PS1小鼠比較#P<0.05。
圖4顯示了中藥復方HQ201508能提高APP/PS1小鼠的探索性行為和好奇性行為;A和B:中藥復方HQ201508藥飼料干預6個月后,對各組小鼠進行Y-迷宮實驗,統計小鼠在第二次檢測時,8分鐘內,小鼠進入目標臂中的次數(A)和小鼠在目標臂中停留的時間(B),每組小鼠10~12只,與野生型組的WT小鼠比較**P<0.001,與AD模型組的APP/PS1小鼠比較#P<0.05。
圖5顯示了中藥復方黃芪散減少APP/PS1小鼠腦中的β淀粉樣蛋白的累積,其中,圖A:中藥復方HQ201508飼料干預6個月后,用Thioflavine S染料標記各組小鼠大腦皮層和海馬中的β淀粉樣蛋白斑。標尺為50μm。圖B:對不同分組中的小鼠大腦皮層和海馬中的β淀粉樣蛋白斑分別進行定量,用比例表達。每組有5只小鼠,與APP/PS1轉基因AD模型組比較*P<0.05。圖C:對不同分組中的小鼠大腦皮層和海馬中的β淀粉樣蛋白斑分別進行定量,用絕對值表達。每組有5只小鼠,與APP/PS1轉基因AD模型組比較*P<0.05。
圖6顯示了中藥復方HQ201508能減少APP/PS1小鼠腦中小膠質細胞的激活;圖A和C:中藥復方HQ201508飼料干預6個月后,對小鼠腦片進行Iba1抗體的免疫組織化學染色。A圖顯示的是大腦皮層的染色,C圖顯示的是海馬的染色。標尺為50μm。圖B和D顯示的是大腦皮層(B)和海馬(D)的Iba1免疫組化陽性小膠質細胞的計數統計結果。每組有5只小鼠,與WT小鼠比較*P<0.05,與APP/PS1小鼠比較#P<0.05。
圖7顯示了中藥復方HQ201508能減少APP/PS1小鼠腦中星形膠質細胞的激活;A和C表示加藥飼料干預6個月后,對小鼠腦片進行GFAP抗體的免疫組織化學染色。A圖顯示的是大腦皮層的染色,C圖顯示的是海馬的染色。標尺為50μm。B和D顯示的是大腦皮層(B)和海馬(D)的Iba1免疫組化陽性星形膠質細胞的計數統計結果。每組有5只小鼠,與WT小鼠比較*P<0.05,與APP/PS1小鼠比較#P<0.05。
圖8顯示了中藥復方HQ201508能減少APP/PS1小鼠腦中Aβ40和Aβ42的水平;中藥復方HQ201508飼料干預6個月后,各組APP/PS1小鼠皮層和海馬中可溶性和不可溶性Aβ42和Aβ40的Elisa檢測結果。A,皮層和海馬中可溶性形式的Aβ42水平;B,皮層和海馬中可溶性形式的Aβ40;C,皮層和海馬中不可溶性形式的Aβ42水平,D,皮層和海馬中不可溶性形式的Aβ40水平。每組有5只小鼠,與APP/PS1小鼠比較*P<0.05。
圖9顯示了中藥復方HQ201508能減少APP/PS1小鼠腦中Aβ40和Aβ42的水平;中藥復方HQ201508飼料干預6個月后,各組APP/PS1小鼠腦組織皮層和海馬中APP和Bace1蛋白檢測結果。A,皮層中的APP和Bace1蛋白檢測結果;B,皮層中的APP和Bace1蛋白分析結果;C海馬中的APP和Bace1蛋白檢測結果;D,海馬中的APP和Bace1蛋白分析結果。每組中有5只小鼠。
具體實施方式
下面結合實施例對本發明作進一步描述。
本發明實施例所用的葛根、黃芪、桑白皮均符合中國藥典2005年版一部正文各藥材項下的有關各項規定。各藥材已經過凈制、切制、炮制、粉碎等加工處理,投料前,通過鑒定,各味藥材實物與名稱相符,質量符合國家藥典標準(具體藥材鑒定辦法參照藥典標準執行)。本發明所用的試劑及抗體如下:
本發明的主要試劑如下:
PB緩沖液:NaH2PO4.2H2O 4.37g/L;Na2HPO4.12H2O 25.79g/L;PH7.2;
PBS緩沖液:PB溶液100ml、NaCL 9g溶入1L水中,調節PH至7.2;
麻醉劑:12%的水合氯醛,溶劑用Ⅰ級水;
多聚甲醛:用PB溶液配制4%的PFA,70℃,攪拌4~5小時至澄清;
生理鹽水:0.9%NaCL(每只小鼠灌注50ml);
High PB溶液:NaCl 24.04g/L;KCl/L 0.604;Na2HPO4.12H2O 10.74g/L;
KH2PO4 0.708g;
RIPA buffer:150mM NaCl;50mM Tris PH8.0;1.0%Nonidet P-40;0.1%SDS;
0.5%Sodium deoxycholic aci;
TBST溶液:20ml 1mol/L Tris-Hcl PH7.6,8g NaCl,0.5ml Tween20。
實施例1
1.1轉基因小鼠模型:
本發明所使用的阿爾茲海默病雙轉基因小鼠模型APPswe/PS1dE9(APPswe,瑞士家族性AD誘發突變型,presenilin1,早老素1))模型購自南京模式動物研究所。飼養于上海中醫藥大學動物房。Jackson Laboratory的株名:B6C3-Tg(APPswe,PSEN1dE9)85Dbo/J;序號004462。這種雙轉基因阿爾茲海默病模型小鼠表達人源APP的瑞士家族性AD誘發突變型的突變體和人源刪除第九個內顯子突變位點的PS1的突變體,這兩個基因突變在這種小鼠中遺傳共分離。這種小鼠模型通常在6個月齡時腦內開始出現淀粉樣蛋白斑沉積,9個月齡時出現學習和記憶障礙,具有類似于阿爾茲海默病的病理表現。飼養于SPF級鼠房,給予充足的水和飼料,鼠房溫度維持在23℃,12小時光照,12小時黑暗,實驗所用的阿爾茲海默病轉基因小鼠是由APP/PS1雙轉基因阿爾茲海默病小鼠模型與C57BL/6J背景的小鼠繁殖自主培育并鑒定的。本實驗中所有動物實驗均遵守實驗動物管理及動物使用規定。
1.2轉基因小鼠的鑒定:
在小鼠出生后3周左右,利用剪腳趾法對小鼠進行標記,收集剪下的組織用來進行基因型鑒定;選擇APP/PS1陽性的雄性小鼠入實驗組。并以同窩野生型C57BL/6J雄性小鼠作為正常對照組。此外,在飼養結束后處死小鼠進行取材的時,剪取小鼠尾(3-5mm)進行基因型的重新鑒定;兩次鑒定的結果進行比較,在統計數據時應去除基因型為假陽性的小鼠數據。
1.3基因組DNA的提取:
1)配制裂解液:500uL lysis buffer+120uL 0.5M pH8.0EDTA+10uL 20mg/ml蛋白酶K,共630uL,可用2個樣品。把收集的組織(小鼠腳趾),用裂解液裂解,在55℃加熱(烘箱)過夜。每只老鼠300ul裂解液裂解。
2)次日向EP管中加入100uL蛋白沉淀劑(Protein Precipitation Solution),最高轉速渦旋20秒,或者上下顛倒EP管劇烈搖晃,然后冰上放置10min。
3)離心機4℃,轉速13000rpm,離心40-60min,將上清轉移至新的1.5mL EP管中。或可先離心30min,轉移上清于新EP管后,再離心30min取上清。可得上清約350-400uL。
4)向管中加入300-400uL異丙醇(等體積的異丙醇),上下顛倒數次混勻(不要劇烈搖晃,以免DNA鏈斷裂),可見白色絮狀沉淀。置于-20度冷凍2h,沉淀會更多。
5)離心機4℃,轉速13000rpm,離心20min。可見管底透明沉淀,棄上清。
6)加入800uL70%的乙醇,上下顛倒數次,沉淀變白,更加明顯;
7)離心機4℃,轉速13000rpm離心10min,倒掉上清,在吸水紙上晾干,根據沉淀的量估計確定下一步驟加水的量,室溫干燥30min(使酒精和水充分揮發)。
8)用20-50uL ddH2O溶解DNA,于4℃保存,以備PCR用。
1.4 PCR鑒定基因型:
1)APP、PS1引物由生工生物工程有限公司合成
①APP擴增引物為:
轉入基因的正意基因鏈(Transgene sense)
5’GACTGACCACTCGACCAGGTTCTG3’
轉入基因的反意基因鏈(Transgene Antisense):
5’CTTGTAAGTTGGATTCTCATATCCG3’
內參陽性對照正向基因鏈(Internal Positive Control Forward):
5‘CTAGGCCACAGAATTGAAAGATCT3’
內參陽性對照反向基因鏈(Internal Positive Control Reverse):
5‘GTAGGTGGAAATTCTAGCATCATCC3’
②PS1擴增引物為
轉入基因的正意基因鏈(Transgene sense):
5’AATAGAGAACGGCAGGAGCA3’
轉入基因的反意基因鏈(Transgene Antisense):
5’GCCATGAGGGCACTAATCAT3’
內參陽性對照正向基因鏈(Internal Positive Control Forward):
5‘CTAGGCCACAGAATTGAAAGATCT3’
內參陽性對照反向基因鏈(Internal Positive Control Reverse):
5‘GTAGGTGGAAATTCTAGCATCATCC3’
2)PCR反應體系:
3)PCR反應條件:
PCR循環參數設置:94℃預變性3min;94℃變性30sec;引物54℃復性1min;72℃延伸1min;35個循環后;72℃延伸2min;10℃維持。
4)瓊脂糖凝膠電泳:
用去離子水配制1.5%的瓊脂糖凝膠,取7μl PCR反應產物,140V,跑膠15分鐘,EB曝光。PCR反應產物長度APP Transgene=350bp,Internal positive control=324bp;PS1Transgene=~608bp,Internal positive control=324bp
上述實驗證實實驗所用小鼠是由APP/PS1雙轉基因的阿爾茲海默病小鼠模型。
實施例2
2.1中藥提取及飼料制備
本發明由黃芪、葛根和桑白皮組成,黃芪、葛根和桑白皮的質量比為1:2:1,葛根、黃芪、桑白皮三味藥材均購自上海華宇藥業有限公司,葛根、黃芪、桑白皮一起粉碎后用質量百分比濃度為70%的乙醇回流提取2次,每次提取2小時,100目過濾后,合并2次提取液,減壓濃縮至2g/ml,75℃真空干燥至干浸膏,得786.5g,得率為19.66%。(下述的實驗均采用此組份喂養)
本實驗制備了兩個劑量的本發明小鼠飼料:1)低劑量飼料,按每千克飼料中添加20g黃芪、40g葛根、20g桑白皮生藥的浸膏制作成低劑量的小鼠飼料。2)高劑量飼料,按低劑量飼料的3倍劑量制作,即按每千克飼料中添加60g黃芪、120g葛根、60g桑白皮生藥的浸膏制作成高劑量的小鼠飼料。實驗中基礎飼料中所添加的本發明的浸膏量是根據人和動物體表面積折算系數法確定。
2.2小鼠分組及中藥干預方式
將滿3個月齡的APP/PS1雙轉基因雄性小鼠,隨機分為模型組、本發明低劑量組以及本發明高劑量組,并以同窩野生型C57BL/6J雄性小鼠作為正常對照組,每組12只,本發明干預組的小鼠分別飼喂添加有低劑量本發明的飼料和添加有高劑量本發明的飼料,模型組和正常對照組飼喂普通的小鼠飼料,連續喂養6個月,即在小鼠9月齡時,對其進行行為學實驗---Morris水迷宮實驗,Y迷宮實驗以及曠場和新事物識別實驗,行為學實驗檢測之后進行取材(腦組織)。
2.3行為學檢測:
2.3.1 Morris水迷宮(Morris water maze)
Morris水迷宮實驗是英國心理學家Morris于20世紀80年代初設計的一種主要用于測試動物的空間學習記憶能力的實驗手段。水迷宮實驗原理:老鼠是天生的游泳健將,但小鼠卻很厭惡在水中的環境,在水中小鼠會尋找出路,它們通常會沿水池壁的周圍尋找出路,因此水迷宮實驗中,訓練的第一天通常會看到小鼠沿著水池壁繞圈,目的是能是找到隱藏在水下的平臺,最終從水中逃脫出來。這一行為中涉及到復雜的記憶過程,包括信息的收集和空間定位相關的視覺信息,以及對信息處理,記憶以及整理的過程。水迷宮實驗的具體操作方法如下:在一個直徑為120厘米,高50厘米的圓形池中注入深約30厘米的水,水溫控制在21-23℃,并在水中加入白色素攪拌均勻使水渾濁,以便于對黑色小鼠進行追蹤標記。將該池水平面劃分為四個等分的象限,然后把一直徑為5厘米的平臺放置于第四象限的水下1.5厘米處,確保小鼠看不到平臺。用黑色窗簾圍繞水池,窗簾上有三個不同形狀不同顏色的物體(圓形,三角形,正方形),便于小鼠用來記憶位置。在整個實驗過程中,平臺始終處于相同的位置。其它實驗條件也維持原樣不變。從其中的一個象限開始,使小鼠面向池壁,溫和的把小鼠放入水中,使它在60秒內尋找水下的平臺,記錄下找到平臺時所花費的時間,當小鼠自己爬上平臺時,讓它在平臺上停留30秒再把它取出放入單獨的籠中,開始下一個象限時休息約60分鐘。如果小鼠在規定的時間內沒有找到平臺,實驗操作者應引導小鼠至平臺上,人為的讓小鼠在平臺上停留30秒。訓練小鼠找平臺5天,自動攝像機同步記錄小鼠的運動軌跡,第5天訓練結束后撤去平臺,觀察小鼠在60s內穿越平臺區域的次數。
2.3.1.1本發明能改善APP/PS1小鼠的空間學習記憶能力
阿爾茲海默病的病人通常會表現出認知能力下降以及記憶功能的喪失,同樣的在APP/PS1轉基因小鼠中也存在著類似的空間學習記憶能力的下降。這一行為學的異常是可以通過Morris水迷宮實驗來進行驗證的。本發明飼料干預6個月后,我們對各組小鼠進行了Morris水迷宮實驗,統計結果發現模型組中的APP/PS1轉基因小鼠在訓練學習的5天里,與野生型小鼠相比尋找平臺比較困難,且其潛伏期以及找到平臺所需的平均運動距離明顯高于野生型組(*P<0.05)(圖2A和B),而且當撤掉平臺后,模型組中的APP/PS1轉基因小鼠對平臺所在象限及平臺的具體位置的記憶也相對的較差,模型組中的APP/PS1轉基因小鼠在目標象限中的時間比例及穿過平臺所在區域的次數明顯小于野生型小鼠,且差異顯著(**P<0.001)(圖2C和D)。但無論是低劑量本發明飼料喂養組還是高劑量本發明飼料喂養組的APP/PS1小鼠對平臺位置的學習和記憶能力都要好于APP/PS1轉基因模型小鼠,潛伏期以及尋找平臺的所需運動的平均距離低于模型組小鼠,在目標象限中的時間比例以及穿過平臺所在區域的次數明顯高于模型組(#P<0.05)。這一結果說明本發明能夠改善APP/PS1轉基因小鼠的學習記憶能力。
2.3.2新事物識別實驗(Object recognition task)
新事物識別實驗是由高25cm的木板組裝成的,曠場有效區域為38x38cm的方形區域,內部為白色。實驗分為三個階段:習慣階段、訓練階段和測試階段。在整個實驗過程中,保持實驗環境和參照體系盡量一致。習慣階段主要是為了使實驗小鼠熟悉新的環境,同時檢測小鼠的自主活動。該階段可以作為曠場實驗來記錄,曠場有效區平均劃分為9個方形區域(3x3)。每只小鼠在中間區域放入,記錄5分鐘內小鼠運動的總路程/平均速度以及進入中間區域的時間和次數。次日開始新事物識別實驗的訓練階段,在曠場中放入兩個顏色和形狀完全相同的塑料玩具(底面積5cm2,高4cm),玩具放置在與曠場壁相距12cm的對角處,物體粘牢固,以防被隨意的移動。放入小鼠,使小鼠適應兩個相同的玩具5分鐘。1h后把其中一個玩具換為形狀不同的新玩具,檢測小鼠的學習和識別記憶能力,記錄小鼠5分鐘內的識別行為。24h后再次檢測小鼠識別新玩具的時間和頻率。自發識別行為被認為是實驗小鼠用鼻子嗅或是用前爪接觸物體的行為,其它行為如小鼠坐在物體上或是圍繞著物體轉圈都不算是識別行為,當小鼠鼻子靠近玩具2cm內即為識別該物體。在每只小鼠實驗完成后,均需要用70%的酒精擦拭物體及曠場內部,以防止氣味干擾下一只小鼠的識別行為。實驗測定的鑒別指數是指小鼠識別新事物的時間與識別的總時間比值,即新事物識別時間/識別總時間×100%。鑒別指數越高則表明實驗小鼠對物體的識別記憶能力越好。
2.3.2.1本發明對APP/PS1小鼠新事物識別行為的影響
小鼠對新事物的識別行為可以用鑒別指數(識別新事物的時間/總的識別時間×100%)。為了評估不同實驗組小鼠的自發活動行為,我們在新事物識別實驗的習慣階段,記錄了小鼠在5分鐘內活動的總距離、平均速度以及在中央區域的停留時間。實驗結果表明AD模型組中的APP/PS1小鼠與野生型小鼠相比,運動的總路程和平均速度均明顯降低(*P<0.0001),低劑量本發明飼料和高劑量本發明飼料干預6個月后的實驗組APP/PS1小鼠的總路程和平均速度均明顯高于模型組中的APP/PS1小鼠,且低劑量本發明干預組與模型組AD模型小鼠相比,統計學差異顯著(#P<0.05),高劑量本發明干預組與模型組AD模型小鼠相比,統計學差異不顯著。這些數據表明,APP/PS1小鼠的自主活動性比野生型組小鼠自主活動性降低,而本發明飼料干預6個月,能夠改善APP/PS1小鼠的自主活動性(圖3A和B)。小鼠天生具有趨避性,且畏懼未知開闊的場所,具有喜好沿周邊區域活動的天性。所以從小鼠在周圍區域停留的時間的百分比上來看,都大于90%以上,并且各組之間均沒有顯著性的差異(圖3C)。這表明,本發明干預后,并不會影響小鼠的趨避性。
小鼠在新事物識別實驗中,本發明干預6個月后,各組小鼠在識別事物的總時間上并沒有顯著的變化,但在識別新事物的時間上有差異,APP/PS1小鼠的鑒別指數明顯低于野生型組的小鼠,而低劑量本發明和高劑量的本發明組小鼠的鑒別指數則明顯高于模型組中的APP/PS1小鼠,低劑量本發明干預組與模型組APP/PS1小鼠相比,其統計學差異顯著(#P<0.05),但高劑量本發明干預組與APP/PS1小鼠比較,差異不顯著(圖3D)。各組小鼠新事物識別實驗的訓練階段和測試階段,對物體的識別的總時間是沒有顯著變化的(圖3E)。
2.3.3 Y迷宮(A two--trial recognition Y--maze)
Y迷宮實驗是方位記憶檢測中常見的實驗方式,它是對短期記憶的檢測,也通常被用來測試嚙齒類動物的空間認知能力。Y迷宮又稱三等分輻射式迷路箱,包括三個等長的臂和連接區域,三臂互為120°角,臂長30厘米,寬10厘米,高15厘米。實驗的具體操作如下,三個臂設為三個區域,首次檢測時,其中一個臂用擋板關閉(目標臂),小鼠從一個臂末端(起始臂)放入,8分鐘內讓小鼠在開放的起始臂和剩余臂兩個臂中自由活動,然后取出小鼠,放回籠中。一個小時后把小鼠從同樣的位置放入,同時把關閉的擋板打開,使小鼠在三個臂中自由探索8分鐘,攝像系統記錄小鼠在8分鐘內進入各個臂中的頻率和停留時間,每當檢測完一次小鼠后,都需用70%的乙醇擦拭設備,以減少氣味的干擾[81]。具有正常空間記憶的小鼠相比于進入已探索過的臂,它更傾向于進入未探索過的臂中,而空間記憶受損傷的小鼠既會探索已探索過的臂同樣的也會探索未探索過的臂。已被證實,小鼠在目標臂中停留的時間反應了小鼠的探索性行為,而進入目標臂中的次數,表示小鼠的好奇行為。
2.3.3.1本發明能改善APP/PS1小鼠的空間工作記憶能力
利用Y-迷宮實驗檢測了各組小鼠空間辨別的定位學習記憶能力,在一個“Y”字形的設備中進行檢測,通常具有正常空間記憶的小鼠相比于進入已探索過的臂,它更傾向于進入未探索過的臂中,而空間記憶受損傷的小鼠既會探索已探索過的臂同樣的也會探索未探索過的臂。實驗結果統計顯示,與野生型組的小鼠比較,模型組APP/Ps1小鼠進入目標臂的次數和在目標臂中停留的時間均明顯減少,且差異顯著,具有統計學差異(**P<0.001),這表明APP/PS1模型小鼠的探索性行為和好奇性行為明顯降低,低劑量本發明飼料和高劑量本發明飼料干預后的實驗組APP/PS1小鼠,進入目標臂中的次數則明顯升高,且與模型組中的APP/PS1小鼠相比,差異顯著,有統計學意義(#P<0.05)(圖4A和B)。這說明本發明能改善APP/PS1小鼠的空間工作記憶能力,可以明顯提高APP/PS1小鼠的探索性行為和好奇性行為。
實施例3免疫組織化學及定量
3.1小鼠腦組織的固定、切片
本發明飼料喂養APP/PS1阿爾茲海默病轉基因小鼠6個月后,通過腹腔注射12%的水合氯醛(400mg/Kg)對小鼠進行麻醉,待小鼠深度麻醉后,迅速打開胸腔,暴露心臟,心臟灌流50mL 0.9%的氯化鈉水溶液后繼續灌注100mL的固定液(4%的多聚甲醛),快速剝離腦組織后,將剝離的腦組織放入固定液中繼續后固定24小時,然后把腦組織放入30%的蔗糖溶液中。待腦組織沉降后,在滑動切片機(Lecia公司)上進行冰凍切片。我們主要研究了腦片的海馬和皮層區域(從bregma-1.92到-4.36mm),腦片厚度為25μm,隔6取1放置于同一孔內,可以得到6套腦組織的切片用于染色。
3.1.1本發明能減少APP/PS1小鼠腦內β--淀粉樣蛋白沉積
在AD病人中,β-淀粉樣蛋白沉積是一個重要的病理特征,所以我們在本發明飼料干預6個月后,對各組小鼠腦中β淀粉樣蛋白的沉積狀況,進行了檢測。小鼠麻醉后,打開胸腔,心臟灌注生理鹽水后,再灌注4%的多聚甲醛固定,取腦組織,后固定及30%蔗糖沉降處理完畢后,做腦組織冰凍切片。然后我們采用硫黃素S(Thioflavine S)染色,對小鼠腦片中的蛋白斑進行了染色,并對皮層和海馬中的蛋白斑分別進行了定量。通過染色我們發現正常的對照組野生型小鼠腦中并沒有蛋白斑的沉積,而模型組中的APP/PS1雙轉基因小鼠的腦內,在海馬和皮層中都有大量的蛋白斑沉積,低劑量本發明和高級量本發明干預組中小鼠腦內蛋白斑沉積相對減少(圖5A)。統計結果顯示,低劑量本發明飼料和高劑量本發明飼料干預后的APP/PS1雙轉基因AD小鼠無論是大腦皮層中還是海馬中的β淀粉樣蛋白斑均明顯少于使用普通飼料喂養的APP/PS1轉基因AD小鼠,且差異顯著,有統計學意義(*P<0.05)(圖5B)。
3.2免疫組織化學ABC法染色方法
1)3%的過氧化氫溶液(PBS:甲醇:30%過氧化氫=5:4:1),室溫下處理腦片30分鐘。用磷酸鹽緩沖液(PBS)洗滌3次,每次10分鐘;
2)0.1%Triton-X 100,室溫處理腦片10分鐘。磷酸鹽緩沖液(PBS溶液)洗滌3次,每次10分鐘;
3)抗體封閉液(1%牛血清白蛋白)封閉,室溫搖床震蕩2小時;
4)腦切片轉入一抗(1%牛血清白蛋白)溶液,Iba1抗體,GFAP抗體均按1:1000稀釋,4℃孵育搖床震蕩過夜。第二天磷酸鹽緩沖液洗滌3次,每次10分鐘;
5)腦切片轉入二抗溶液(羊抗小鼠或羊抗兔,1:1000)室溫孵育搖床震蕩2小時。磷酸鹽緩沖液洗滌3次,每次10分鐘;
6)腦切片轉入辣根過氧化物酶標記的鏈親和素(HRP,1:1000)溶液,室溫孵育搖床震蕩2小時。磷酸鹽緩沖液洗滌3次,每次10分鐘;
7)0.05%的DAB磷酸鹽緩沖液(25mg/mL儲液,使用時1:50稀釋),加入終濃度為0.03%的過氧化氫,顯色適當的時間。磷酸鹽緩沖液洗滌3次,每次10分鐘;
8)貼片,晾干后,脫水透明處理,中性樹脂封片,顯微鏡下觀察,拍照。所得圖片經Photoshop 9.0軟件編輯得到實驗結果圖片。
3.3.1免疫組織化學定量分析
不同倍數視野下拍攝腦片海馬和皮層的相同的部位,選取適當的視野拍攝圖片,用Image J軟件進行定量分析。首先將圖片轉換為8位字節形式,劃出用于定量的區域,調節閾值使免疫組織化陽性信號被選中,測量所選區域內陽性信號的像素,以及所選區域的面積,得到單位面積陽性信號的像素值,用于統計分析。
3.3.2 Tioflavine S染色
1)腦片貼到預選經明膠包被的載玻片上,晾干。
2)貼好的腦片放入50%酒精配制的0.05%硫黃素S的染缸中避光染色8分鐘。
3)在80%的酒精中放置10秒鐘。重復一次
4)用大量蒸餾水洗4-5遍
5)腦片在高濃度的磷酸緩沖液中(high PB)孵育30分鐘分鐘以上,4℃搖床震蕩孵育30分鐘以上。
6)用蒸餾水洗滌4-5遍
7)用熒光封片劑封片,注意避光
8)片子在熒光顯微鏡下觀察,拍照。
3.3.3本發明能降低APP/PS1小鼠腦中的膠質細胞的激活
在AD病人和AD模型小鼠的腦組織中,通常可以發現有小膠質細胞和星形膠質細胞的大量激活,主要表現為膠質細胞的胞體增大和突起增多變粗,并且通常膠質細胞會聚集在β-淀粉樣蛋白斑的周圍。激活的膠質細胞會分泌炎癥因子和細胞因子,并且具有神經毒性,從而會加重AD的病情。因此我們研究了本發明加藥飼料干預后不同分組中的小鼠大腦中小膠質細胞和星形膠質細胞的激活狀況。
我們用Iba1抗體做免疫組化染色,標記了小膠質細胞,觀察了本發明飼料干預后,不同分組中的小鼠大腦皮層和海馬區域的Iba1陽性的小膠質細胞的激活狀況。野生型組中WT小鼠的大腦皮層和海馬中,Iba1陽性的小膠質細胞激活數目較少,而在模型組中的APP/PS1雙轉基因AD模型小鼠的大腦皮層和海馬中可以看到小膠質細胞的明顯激活(*P<0.05),主要表現為胞體的增大和突起的增多,相比較之下低劑量本發明飼料和高劑量本發明飼料干預6月后的APP/PS1轉基因小鼠的大腦皮層和海馬中的小膠質細胞激活數目比模型組中小鼠明顯減少(圖6A和C)。統計結果表明,低劑量本發明飼料干預組和高劑量本發明干預組的APP/PS1小鼠大腦皮層和海馬中的小膠質細胞激活程度與AD模型組中大腦皮層和海馬中的小膠質細胞激活程度相比,有明顯的差別,且統計學差異顯著(#P<0.05)(圖6B和D)。這一實驗結果表明本發明干預可以減少小膠質細胞的激活。
接著我們又用GFAP抗體標記星形膠質細胞,進行免疫組化染色。同樣的,免疫組化圖片顯示,在野生型組中的正常WT小鼠大腦皮層和海馬中的星形膠質細胞激活較少,而在APP/PS1轉基因AD模型小鼠中激活明顯增多(圖7A和C),低劑量本發明飼料和高劑量本發明飼料干預6月后的APP/PS1轉基因小鼠的大腦皮層和海馬中的星形膠質細胞與模型組AD小鼠相比,星形膠質細胞的激活程度明顯減少,有統計學意義(#P<0.05)(圖7B和D),說明本發明干預可以降低星形膠質細胞的活化程度。
3.4 Aβ酶聯免疫吸附檢測(ELISA)
酶聯免疫吸附檢測定量檢測Aβ的原理:96孔板上包被有特異性識別Aβ的N端區域單克隆抗體,可特異性的結合待測溶液中的Aβ40和Aβ42,加入C端特異性的Aβ40或Aβ42的兔源多克隆抗體后,4℃孵育過夜,與Aβ的C端結合。經過充分洗滌后,加入偶聯了辣根過氧化物酶的羊抗兔抗體,孵育30min后充分洗滌,加入辣根過氧化物酶的底物進行顯色,在讀板儀上測定標準品和樣品的光吸收值,根據標準品做出標準曲線,比較樣品的光吸收值,就可以得到樣品中Aβ的含量。人源的Aβ40和Aβ42的ELISA試劑盒均購自Invitrogen公司。本實驗主要檢測小鼠腦組織中的人源的RIPA溶液可溶性形式和不可溶性形式的Aβ40和Aβ42。樣品制備過程以及酶聯免疫吸附檢測的步驟如下:
1.取腦組織:小鼠深度麻醉后,迅速打開胸腔,暴露出心臟,心臟灌流50毫升0.9%的氯化鈉水溶液以去除腦組織中的血液。并快速分離出腦組織的海馬和皮層,組織投入液氮速凍。
2.樣品制備:稱重按照質量(mg):體積(μl)=1:9的比例加入組織中RIPA buffer裂解液。冰上裂解30分鐘,并不時搖晃。100000g轉速,4℃離心60分鐘,取上清也就是溶于RIPA的組分,用于檢測可溶性形式的Aβ40和Aβ42。沉淀部分加入與RIPA buffer等體積的5M guanineHCl溶液(pH8.0的50mM的TrisHCl溶液配制,含蛋白酶抑制劑)勻漿,室溫下震蕩3-4小時混勻。100000g轉速,4℃離心60分鐘,取上清再用BSAT-DPBS溶液(0.2g/L KCl,0.2g/L KH2PO4,8.0g/L NaCl,1.150g/L Na2HPO4,5%BSA,0.03%Tween-20,pH7.4)1:100稀釋,樣品保存于-80℃冰箱。開始ELISA檢測之前,取出樣品冰上化凍,先用RIPA或BSAT-DPBS溶液1:5稀釋,再加入等體積的標準品,用于不可溶性形式的Aβ40和Aβ42的ELISA檢測。
3.Aβ的ELISA檢測
1)配制Aβ1-40、Aβ1-42的標準品:向標準品中加入55mM的NaHCO3(pH9.0),配制成100ng/mL的儲液,然后用標準品稀釋液等比例稀釋到不同濃度1000pg/mL,500pg/mL,250pg/mL,125pg/mL,62.5pg/mL,31.25pg/mL,15.63pg/mL,分裝保存于-80℃冰箱。臨用前,取出冰上融化,并加入等體積的樣品稀釋液(RIPA或BSAT-DPBS溶液)。
2)將標準品和樣品依次加入試劑盒提供的96孔板,每孔50μl,然后立刻加入試劑盒提供的檢測抗體(Detection antibody)50μl,室溫孵育3小時或是4℃搖床上孵育過夜。
3)第二天,取出96孔板,棄去樣品溶液,用去離子水稀釋試劑盒提供的洗液(25X),每孔加入200μl的洗液,搖動30秒后,棄去洗液,在吸水紙上排干,洗滌5次。
4)用HRP稀釋液配制檢測用的兔抗體(1:100),每孔加入100μl室溫下搖床振動孵育30分鐘后,棄去溶液,洗滌5次。
5)每孔加入100μl顯色液,避光室溫下孵育30分鐘。
6)加入100μl終止液終止顯色反應,在450nm波長下測量光密度值,根據試劑盒提供的標準品計算得到的標準曲線,計算出待測樣品中的Aβ含量。
3.4.1本發明能減少APP/PS1小鼠腦中不可溶性形式的Aβ40和Aβ42蛋白含量
為了檢測本發明飼料干預后,各組小鼠腦組織中的Aβ40和Aβ42水平,我們利用酶聯免疫吸附(ELISA)實驗,檢測了小鼠腦中的可溶性和不可溶性形式的Aβ40和Aβ42的水平,目前認為可溶性形式的Aβ主要反映的是單體和寡聚體的水平,而不可溶性形式的Aβ則表示的是β-淀粉樣蛋白沉積水平。Elisa實驗檢測結果顯示,本發明飼料干預后,APP/PS1小鼠腦中的可溶性形式的Aβ40和Aβ42水平均有所降低。統計結果顯示,皮層中的可溶性形式的Aβ40和Aβ42水平與模型組中APP/PS1小鼠相比,無顯著性差異;海馬中的可溶性形式的Aβ40和Aβ42水平與模型組中APP/PS1小鼠相比,有顯著性差異(*P<0.05)(圖8A和B)。本發明飼料干預后,皮層中的不可溶性形式的Aβ40和Aβ42水平下降,高劑量本發明干預組的不可溶性形式的Aβ42水平與模型組APP/PS1小鼠比較有統計學差異(*P<0.05),不可溶性形式的Aβ40水平與模型組APP/PS1小鼠比較無統計學差異;低劑量本發明干預組皮層中不可溶性形式的Aβ40和Aβ42水平與模型組中APP/PS1小鼠相比無統計學差異;海馬中的不可溶性形式的Aβ40和Aβ42水平與模型組中APP/PS1小鼠比較均降低,高劑量本發明干預組的不可溶性形式的Aβ40水平與模型組APP/PS1小鼠比較有統計學差異(*P<0.05),低劑量本發明干預組的不可溶性形式的Aβ40水平與模型組APP/PS1小鼠比較有統計學差異(*P<0.05)(圖8C和D)。這說明本發明可以降低海馬中可溶性形式的Aβ40和Aβ42水平,明顯減少不可溶性形式的Aβ40和Aβ42水平,但對皮層中溶性形式的Aβ40和Aβ42水平影響不明顯。
實施例4
4.1免疫印跡實驗
小鼠的腦組織,用RIPA buffer(150mM NaCl,50mM Tris(PH8.0),1%NP-40,0.1%SDS,0.5%Deoxycholic acid sodium,蛋白酶抑制劑(1:100)提取總蛋白,冰上裂解30分鐘,小鼠腦組織勻漿后,冰上放置10-20分鐘,期間數次混勻樣品。14000g,4℃離心60分鐘,收集上清,-80℃保存。按BCA試劑盒(購自Pierce)的方法測定每個樣品的總蛋白濃度,調平各個樣品的蛋白濃度,取等體積的樣品加入上樣緩沖液(loading buffer,6x),煮沸10分鐘后,冷卻至室溫。樣品采用十二烷基磺酸鈉聚丙烯酰胺凝膠電泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)分離,凝膠的濃度是12%。采用濕轉法轉膜,硝酸纖維素膜(購自Schleicher&Schuell公司)的孔徑為0.2μm。轉膜后用TBST溶液充分洗滌,溶于TBST的5%脫脂奶粉室溫下封閉1小時,轉入一抗(primary antibody)溶液,用含5%牛血清白蛋白TPBST溶液稀釋抗體,一抗按1:1000稀釋,GADPH的單克隆抗體按1:20000稀釋。4℃孵育過夜后,TBST溶液充分洗滌,轉入辣根過氧化物耦連的相應二抗溶液,室溫孵育1小時,TBST充分洗滌。加入ECL溶液(購自GE health care公司)顯色,曝光。利用image-J軟件對圖片條帶的密度進行定量測定。
4.1.1本發明對APP和Bace1蛋白含量的影響
淀粉樣前體蛋白(APP)是一種單次跨膜的Ⅰ型膜蛋白,包含一個大的N端胞外結構域和一個短小的C端胞內結構域。APP與阿爾茨海默病有著密切的聯系。APP可以被α-,β-,γ-分泌酶分解;其中β-分泌酶(Bace1)和γ-分泌酶的連續分解作用,可以把APP分解并產生Aβ。Aβ可以導致腦內老年斑的形成和神經細胞的凋亡,是導致阿爾茨海默病的重要因素。為了檢測本發明對APP和Bace1總蛋白含量的影響,我們運用蛋白免疫印跡的方法檢測APP和Bace1蛋白的含量,利用APP-C端抗體檢測全長的APP的含量,Bace1抗體檢測Bace1蛋白含量,檢測統計結果顯示,本發明干預后APP/PS1小鼠腦組織皮層和海馬中的APP和Bace1總蛋白的含量變化并不明顯,與對照組的APP/PS1模型小鼠腦組織皮層和海馬中的APP和Bace1總蛋白的含量無統計學差異;同樣的,Bace1蛋白的含量也沒有明顯變化(圖9A-D)。這一結果說明,本發明可能對APP/PS1小鼠腦組織皮層和海馬中的APP和Bace1總蛋白的含量沒有太大影響。
統計分析
本實驗采用Graphpad Prism 4.0軟件分析實驗數據,實驗中的所有數據的統計均使用mean±SD,數據組間比較是通過單因素方差分析(one-way ANOVA)中的Newman-Keuls Multiple Comparison Test實現的,P<0.05時認為有顯著性差異,P<0.001表示差異極顯著;兩組數據間的比較是通過t tests分析。
序列表
<110> 上海中醫藥大學
<120> 黃芪散在制備預防或治療阿爾茨海默病的藥物中的應用
<160> 8
<170> PatentIn version 3.5
<210> 1
<211> 24
<212> DNA
<213> 轉入基因的正意基因鏈
<400> 1
gactgaccac tcgaccaggt tctg 24
<210> 2
<211> 25
<212> DNA
<213> 轉入基因的反意基因鏈
<400> 2
cttgtaagtt ggattctcat atccg 25
<210> 3
<211> 24
<212> DNA
<213> 內參陽性對照正向基因鏈
<400> 3
ctaggccaca gaattgaaag atct 24
<210> 4
<211> 25
<212> DNA
<213> 內參陽性對照反向基因鏈
<400> 4
gtaggtggaa attctagcat catcc 25
<210> 5
<211> 20
<212> DNA
<213> 轉入基因的正意基因鏈
<400> 5
aatagagaac ggcaggagca 20
<210> 6
<211> 20
<212> DNA
<213> 轉入基因的反意基因鏈
<400> 6
gccatgaggg cactaatcat 20
<210> 7
<211> 24
<212> DNA
<213> 內參陽性對照正向基因鏈
<400> 7
ctaggccaca gaattgaaag atct 24
<210> 8
<211> 25
<212> DNA
<213> 內參陽性對照反向基因鏈
<400> 8
gtaggtggaa attctagcat catcc 25
- 還沒有人留言評論。精彩留言會獲得點贊!