血液處理裝置及用于操作該裝置的控制系統的制作方法
本申請涉及醫療器械領域,尤其是涉及一種具有串并聯結構的血液處理裝置。
背景技術:
肝衰竭患者進行外周血干細胞移植,需進行干細胞采集,然而,此類患者病情重,往往需要進行人工肝(包括血漿置換、膽紅素吸附、生物人工肝等方式)支持治療。人工肝支持系統的治療機制是基于肝細胞的強大再生能力,通過體外機械、理化和生物裝置,清除各種有害物質,補充必需物質,改善內環境,暫時替代衰竭肝臟的部分功能,為肝細胞再生及肝功能恢復創造條件或等待機會進行肝移植。常規做法是(以血漿置換為例),患者接受單獨的血漿置換治療,先建立體外循環通路,將患者連接血漿治療機器,進行血漿置換治療,時間約2-4小時;自體外周血干細胞采集則采用單獨的血細胞分離機進行采集,需重新建立體外循環通路,耗時約需2-3小時。
人工肝支持系統、干細胞采集本是臨床單獨使用的技術,針對肝衰竭患者需要進行干細胞采集時,需要采用兩種治療方式,分別進行的缺點在于患者需反復建立體外循環通路,多次添加抗凝劑,并且體外抗凝風險加大,同時治療耗時加長,造成了患者的不適與臨床風險。
技術實現要素:
本實用新型的目的在于針對需要進行干細胞采集和人工肝支持系統的肝衰竭患者的治療,提供一種具有串并聯結構的血液處理裝置,操作該裝置的方法和治療方法,將人工肝處理裝置和血細胞分離器連接,同時進行人工肝支持系統、干細胞采集兩項治療,從而提高治療效率,降低患者治療風險。
本實用新型包含以下內容:
實施方式1.一種血液處理裝置,其特征在于,包括:
血細胞分離器;
人工肝處理裝置;
與人工肝處理裝置連接的第一上游血液導管和第一下游血液導管;和
與血細胞分離器連接的第二上游血液導管和第二下游血液導管;其中
所述第二上游血液導管和第二下游血液導管與所述第一上游血液導管分別在第二入口點和第二出口點連接,并且所述第二出口點比第二入口點更接近于所述人工肝處理裝置。
實施方式2.根據實施方式1所述的血液處理裝置,其特征在于,還包括:與所述第一上游血液導管連接的抗凝劑注入導管。
實施方式3.根據實施方式1所述的血液處理裝置,其特征在于,所述人工肝處理裝置包括血漿分離器,所述血液處理裝置還包括:與所述第一下游血液導管連接的血漿注入導管或置換液注入導管。
實施方式4.根據實施方式1-3中任一項所述的血液處理裝置,其特征在于,其中所述血細胞分離器配置為能夠分離來自第二上游血液導管的血液得到第二分離血液和干細胞,并使第二分離血液進入第二下游血液導管。
實施方式5.根據實施方式3所述的血液處理裝置,其特征在于,其中所述血漿分離器配置為能夠分離來自第一上游血液導管的血液得到第一分離血液和血漿,并使第一分離血液進入第一下游血液導管。
實施方式6.根據實施方式1-3中任一項所述的血液處理裝置,其特征在于,還包括:與所述第二上游血液導管連接的第二流量調節計。
實施方式7.根據實施方式1或2所述的血液處理裝置,其特征在于,還包括:與所述第一上游血液導管連接的第一流量調節計,所述第一流量調節計位于所述第二出口點的下游。
實施方式8.根據實施方式2所述的血液處理裝置,其特征在于,還包括與所述抗凝劑注入導管連接的抗凝劑注入器,其配置為用于注射抗凝劑。
實施方式9.根據實施方式3所述的血液處理裝置,其特征在于,還包括與所述血漿注入導管連接的血漿注入器,其配置為用于注射新鮮血漿;或者還包括與所述置換液注入導管連接的置換液注入器,其配置為用于注射置換液。
實施方式10.根據實施方式1所述的血液處理裝置,其特征在于,所述人工肝處理裝置包括選自以下的至少一種:血漿置換裝置、膽紅素吸附裝置、和生物人工肝裝置。
實施方式11.根據實施方式1所述的血液處理裝置,其特征在于,所述血液處理裝置中的血液容量低于500ml。
實施方式12.一種用于操作實施方式1-11中任一項所述的血液處理裝置的控制系統,其特征在于,所述控制系統包括軟件和硬件,所述控制系統配置為能夠如下操作所述血液處理裝置:使待處理的血液的第一部分流經第一上游血液導管進入人工肝處理裝置,并且待處理的血液的第二部分從第一上游血液導管在第二入口點進入第二上游血液導管并進入血細胞分離器;
血細胞分離器將待處理的血液的第二部分進行分離處理得到經分離的第二分離血液,將第二分離血液經第二下游血液導管在第二出口點與待處理的血液的第一部分合并得到合并的血液,合并的血液進入人工肝處理裝置,
人工肝處理裝置將合并的血液進行分離處理得到第一分離血液。
本實用新型也包含這樣的實施方式:
一種血液處理裝置,其特征在于,包括:
血細胞分離器;
人工肝處理裝置;
與人工肝處理裝置連接的第一上游血液導管和第一下游血液導管;和
與血細胞分離器連接的第二上游血液導管和第二下游血液導管;其中
所述第二上游血液導管和第二下游血液導管與所述第一下游血液導管分別在第二入口點和第二出口點連接,并且所述第二入口點比第二出口點更接近于所述人工肝處理裝置。
借助于本實用新型的技術方案,針對需要進行干細胞移植和人工肝支持系統的肝衰竭患者的治療,只需要建立一次體外血液循環,同時進行人工肝支持系統和干細胞采集兩項治療,從而縮短了治療時間,提高治療效率,降低患者治療風險。
附圖說明
為了更清楚地說明本公開實施例的技術方案,下面將對實施例的附圖作簡單地介紹,顯而易見地,下面描述中的附圖僅僅涉及本公開的一些實施例,而非對本公開的限制。
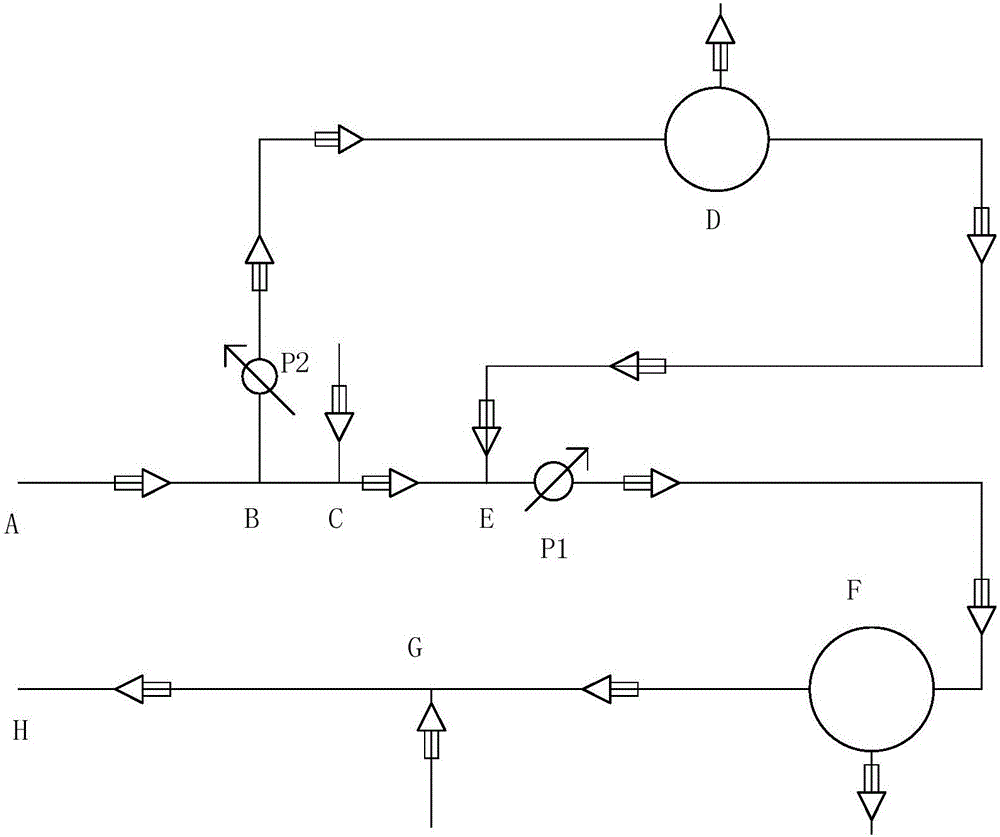
圖1是本申請一種實施方式的示意圖。
圖2是一種用于操作血液處理裝置的控制系統的示意圖。
圖中,附圖標記具有以下含義:
D:血細胞分離器;F:人工肝處理裝置;
ABEF:第一上游血液導管;B:第二入口點;E:第二出口點;
FGH:第一下游血液導管;
BD:第二上游血液導管;
DE:第二下游血液導管;
P1:第一流量調節計;
P2:第二流量調節計;
C:抗凝劑注入導管接入點;
G:血漿注入導管或置換液注入導管接入點;
11:控制系統。
具體實施方式
為使本公開實施例的目的、技術方案和優點更加清楚,下面將結合本公開實施例的附圖,對本公開實施例的技術方案進行清楚、完整地描述。顯然,所描述的實施例是本公開的一部分實施例,而不是全部的實施例。基于所描述的本公開的實施例,本領域普通技術人員在無需創造性勞動的前提下所獲得的所有其他實施例,都屬于本公開保護的范圍。
肝衰竭患者進行外周血干細胞移植,需進行干細胞采集,然而,此類患者病情重,往往需要通過人工肝支持系統來進行支持治療。
人工肝支持系統簡稱為人工肝臟或人工肝,是利用體外設備裝置,清除因肝衰竭而產生或增加的各種有害物質,補充需肝臟合成或代謝的蛋白質等必需物質,改善患者水、電解質及酸堿平衡等內環境,臨時替代肝臟的一些功能,從而輔助治療肝衰竭等疾病的治療手段。人工肝一般分為非生物型、生物型及混合型3種。非生物型人工肝包括血漿置換、血漿膽紅素吸附、血液透析濾過等治療肝衰竭的方法;生物型人工肝是指通過在體外培養的肝細胞的基礎上建立體外生物裝置代替衰竭的肝功能;混合型人工肝是聯合非生物型人工肝的解毒功能與生物型人工肝的合成和轉化等功能,代表了人工肝的發展趨勢。
以血漿置換為例,患者接受單獨的血漿置換治療,先建立體外循環通路,進行血漿置換治療,時間約2-4小時。血漿置換主要是先分離出血漿,將患 者的血液引出體外,經過膜式血漿分離方法將患者的血漿從全血中分離出來棄去,然后補充等量的新鮮冷凍血漿或人血白蛋白等置換液。血漿置換時,分離血漿可以使用血漿分離器。冷凍血漿的補充往往在血漿分離器的下游完成。
外周血干細胞(PBSC)的采集方法可以使用血細胞分離器分離采集外周血的單個核細胞組分。多采用分離淋巴細胞的程序分離。一般情況下行大靜脈穿刺即可,建立體外循環進行采集。采集成人時的血流速度為50—60ml/min,每次分離4—6循環(約2—3h),分離血液的總容積9L,依據情況連續或隔日采集。
人工肝支持系統、干細胞采集單獨進行均具有較好的安全性和效果。例如,血漿置換可以清除患者體內的各種代謝毒素和致病因子,從而達到治療目的。由于血漿置換法不僅可以清除體內中、小分子的代謝毒素,還清除了蛋白、免疫復合物等大分子物質,同時又補充了體內所缺乏的白蛋白、凝血因子等必需物質,較好的替代了肝臟某些功能。外周血干細胞(PBSC)的采集方法目前屬于成熟的臨床應用技術,能夠根據需求較好的采集到目標需求量的細胞數量。
人工肝支持系統、干細胞采集本是臨床單獨使用的技術,針對肝衰竭患者需要進行干細胞移植時,需要采用兩種治療方式,分別進行的缺點在于患者需反復建立體外循環通路,體外抗凝風險加大,治療耗時加成,造成了患者的不適與臨床風險。
本實用新型的目的在于針對需要進行干細胞移植和人工肝支持系統的肝衰竭患者的治療,提供一種具有串并聯結構的血液處理裝置,操作該裝置的方法和治療方法,將人工肝處理裝置和血細胞分離器連接,同時進行人工肝支持系統、干細胞采集兩項治療,從而提高治療效率,降低患者治療風險。
圖1示出了一種血液處理裝置,其包括:
血細胞分離器D;
人工肝處理裝置F;
與人工肝處理裝置連接的第一上游血液導管(ABEF)和第一下游血液導管(FGH);和
與血細胞分離器連接的第二上游血液導管(BD)和第二下游血液導管(DE);其中
所述第二上游血液導管和第二下游血液導管與所述第一上游血液導管分別在第二入口點(B)和第二出口點(E)連接,并且所述第二出口點(E)比第二入口點(B)更接近于所述人工肝處理裝置。
在圖1中,導管使用實線表示,其中實線上的箭頭表示導管中物質的流動方向。
該血液處理裝置通過將用于血細胞分離的第二血液循環以并聯方式連接于用于人工肝支持系統的第一血液循環的上游,從而使得,只需要建立一次體外血液循環即可同時進行血細胞分離和人工肝支持系統治療,并且由于血細胞分離循環的時間較短,借助于這種裝置,可以隨時開閉血細胞分離循環,而不影響人工肝支持系統循環,結果是無需單獨建立血細胞分離循環,并且節約了血細胞分離循環的時間,提高了治療效率,降低了患者治療風險。
在本申請中,與人工肝處理裝置連接的循環稱為第一循環或者第一血液循環。在本申請中,與血細胞分離器連接的循環稱為第二循環或者第二血液循環。
在一些示例中,所述血液處理裝置,還包括:與所述第一上游血液導管連接的抗凝劑注入導管。在本申請的實施例中,僅需在第一上游血液導管處設置抗凝劑注入導管,從該導管添加抗凝劑,就可以使得整個人體的血液被肝素化(抗凝化處理),從而整個血液流通管路能夠滿足抗凝的要求。
當然也可以在所述第二上游血液導管上連接抗凝劑注入導管。在一些示例中,所述第二上游血液導管上不連接抗凝劑注入導管。
在一些示例中,所述人工肝處理裝置包括血漿分離器,所述血液處理裝置還包括:與所述第一下游血液導管連接的血漿注入導管或置換液注入導管。在血漿置換中,在分離了血液中原有的血漿之后,需要補充等量的新鮮冷凍血漿或人血白蛋白等置換液,因此,該血漿注入導管也可以稱為是置換液注入導管。
在一些示例中,在所述血液處理裝置中,所述血細胞分離器配置為能夠分離來自第二上游血液導管的血液中的干細胞得到第二分離血液,并使第二分離血液進入第二下游導管。
在一些示例中,在所述血液處理裝置中,所述血漿分離器配置為能夠分離來自第一上游血液導管的血液中的血漿,得到第一分離血液,并使第一分離血液進入第一下游導管。
在一些示例中,所述血液處理裝置還包括:與所述第二上游血液導管連接的第二流量調節計P2。
在一些示例中,所述血液處理裝置,還包括:與所述第一上游血液導管連接的第一流量調節計P1,所述第一流量調節計P1位于所述第二出口點(E)的下游。
在一些示例中,所述血液處理裝置中的血液容量低于500ml,優選低于400ml,更優選低于300ml。使整個血液處理裝置中的血液容量較低是出于對患者的可承受能力而言的,對于正常的人而言,可能當血液缺失(體外循環)500ml以上時會出現不適,然而,對于肝病患者,可能血液在體外循環達到500ml之前就會出現不適癥狀,因此,所述血液處理裝置中的血液容量越低越好,優選低于400ml。
本申請的實施例還提供操作以上所述的血液處理裝置的方法,包括:
使待處理的血液的第一部分流經第一上游血液導管進入人工肝處理裝置F,并且待處理的血液的第二部分從第一上游血液導管在第二入口點(B)進入第二上游血液導管并進入血細胞分離器D;
血細胞分離器D將待處理的血液的第二部分進行分離處理得到經分離的第二分離血液,將第二分離血液經第二下游血液導管在第二出口點與待處理的血液的第一部分合并得到合并的血液,合并的血液進入人工肝處理裝置F,
人工肝處理裝置F將合并的血液進行分離處理得到第一分離血液。
在一些示例中,所述方法還包括:通過所述抗凝劑注入導管向第二上游血液導管中的待處理的血液的第二部分中添加抗凝劑。
在一些示例中,所述方法還包括:通過所述血漿注入導管向第一下游血液導管中的第一分離血液中添加血漿。
在一些示例中,在所述方法中,所述血細胞分離器配置為能夠分離來自第二上游血液導管的血液(待處理的血液的第二部分)中的干細胞得到第二分離血液,并使第二分離血液進入第二下游血液導管。
在一些示例中,所述血漿分離器配置為能夠分離來自第一上游血液導管的血液中的血漿,得到第一分離血液,并使第一分離血液進入第一下游血液導管。
在一些示例中,所述方法還包括:調節所述第二流量調節計P2和第一 流量調節計P1中的至少一個,從而使得第二血液循環中的流量和第一血液循環中的流量滿足外循環血液流速的要求。
在一些示例中,所述方法還包括預先對所述裝置(包括整個管道)采用肝素鹽水進行管路預沖洗。在所述裝置的運行過程中,僅在第一上游血液導管添加抗凝劑就可以實現整體循環的肝素化,整體肝素化的過程是通過人體循環達到的,在第二循環中不添加抗凝劑,從而可以減少抗凝劑(肝素)的用量。在本申請中,肝素化和抗凝化具有相同的含義,都是指向血液中添加抗凝劑如肝素從而達到使血液在體外處理的過程中不凝固的效果。
在一些示例中,所述方法還包括:通過所述血漿注入導管向第一下游血液導管中的第一分離血液中添加以下物質中的至少一種:新鮮血漿或置換液。因此,所述血漿注入導管也可以成為置換液注入導管。所述的置換液可以包括人血白蛋白。
在所述方法的一些示例中,所述血細胞分離器配置為能夠分離來自第二上游血液導管的血液(待處理的血液的第二部分)中的干細胞得到第二分離血液,并使第二分離血液進入第二下游血液導管。
在所述方法的一些示例中,所述血漿分離器配置為能夠分離來自第一上游血液導管的血液中的血漿,得到第一分離血液,并使第一分離血液進入第一下游血液導管。
在一些示例中,所述方法還包括:調節所述第二流量調節計P2和第一流量調節計P1中的至少一個,從而使得整個循環中流量和壓力達到平衡。
在一些示例中,所述方法還包括:啟動所述裝置的步驟:首先使第二循環處于關閉狀態(其可以通過例如關閉所述第二流量調節計P2,或者夾閉所述第二循環的管路與第一循環的管路連接處的出入口完成),然后啟動第一循環,開始進行人工肝支持系統治療,待血流動力學穩定后(例如P1保持在80ml/min以上時),啟動第二循環(其可以通過例如開啟所述第二流量調節計P2,或者取下所述第二循環的管路與第一循環的管路連接處的出入口處的夾子來完成),實現干細胞采集。
在一些示例中,所述方法還包括:停止所述裝置的步驟:首先結束第二循環,夾閉第二循環入口,進入返回紅細胞程序,待第二循環管路中紅細胞返回后,夾閉第二循環出口,血細胞分離器關機,在此過程中第一循環繼續進行;然后結束第一循環。
如圖2所示,本申請還提供一種用于操作所述的血液處理裝置的控制系統11,其特征在于,所述控制系統包括軟件和硬件,所述控制系統配置為能夠實現如上所述的方法。圖2是示意圖,并沒有示出控制系統的具體部件。然而,本領域技術人員應該理解,根據本申請目前已經提供的信息,形成所述控制系統是本領域技術人員的常規技術手段。因此,任何能夠實現所述方法的控制系統都在本申請的保護范圍內。
本申請還提供一種用于操作所述的血液處理裝置的控制系統,其特征在于,所述控制系統包括軟件和硬件,所述控制系統配置為能夠如下操作該血液處理裝置:使待處理的血液的第一部分流經第一上游血液導管進入人工肝處理裝置,并且待處理的血液的第二部分從第一上游血液導管在第二入口點進入第二上游血液導管并進入血細胞分離器;
血細胞分離器將待處理的血液的第二部分進行分離處理得到經分離的第二分離血液,將第二分離血液經第二下游血液導管在第二出口點與待處理的血液的第一部分合并得到合并的血液,合并的血液進入人工肝處理裝置,
人工肝處理裝置將合并的血液進行分離處理得到第一分離血液。
實施例
采用圖1所示的裝置,對10名患者進行了治療。結果如下表所示。
上表中,
“采集單個核細胞數(/L)”是指外周血單個核細胞(Peripheral blood mononuclear cell,PBMC)即外周血中具有單個核的細胞的濃度,包括淋巴細胞、單核細胞和以CD34+分子標記為特征的外周血造血干細胞。
“CD34+細胞數(/L)”是指CD34是造血干細胞表面的標志物,CD34+細胞數指造血干細胞的濃度.
“理論所需治療時間(h)”是指:傳統治療分別進行人工肝和干細胞采集所需治療時間的總和。
“實際治療花費時間(h)”是指:采用本實例進行人工肝和干細胞采集一共需要的實際時間。
經過對患者的生化指標的測量表明,采用本公開的血液處理裝置對患者進行治療與采用傳統的兩步分別進行治療的方法相比,治療效果沒有明顯差異,然而卻縮短了治療時間,減輕了患者的痛苦。
以上所述僅是本公開的示范性實施方式,而非用于限制本公開的保護范圍,本公開的保護范圍由所附的權利要求確定。
- 還沒有人留言評論。精彩留言會獲得點贊!