光熱化療精準協同抗腫瘤的溫敏金納米籠水凝膠載藥系統的制作方法
本發明屬于制藥領域,涉及一種具有光熱轉換效應的金納米籠,是可以負載化療藥物的新型納米給藥系統,涉及該金納米籠的制備方法和藥物負載方法,以及在抗腫瘤方面的應用。
背景技術:
目前,癌癥仍是威脅人類生命和健康的主要疾病之一,全世界癌癥發病率呈急劇上升趨勢。癌癥的治療一直以來都是國內外研究的難點,臨床治療癌癥的方法包括外科手術、放射治療、熱療和藥物化療。熱療由于具有顯著改善藥物抗腫瘤效果受到人們廣泛關注。通過將腫瘤組織加熱到39~42℃,熱療發揮了細胞凋亡、轉膜電導改變、Na/K-ATP酶活化以及谷胱甘肽的代謝等多重藥物增敏作用。近二十年來隨著納米材料快速的發展,多種熱轉換納米材料(如金納米材料、磁性納米粒、碳納米管等)通過選擇性地蓄積于腫瘤組織內,可有效地加熱那些與關鍵組織“混居”的惡性腫瘤。特別是與磁性納米粒磁熱療需要龐大昂貴的交變磁場設備、磁熱轉換效率低不同,基于金納米結構的近紅外光熱治療(Near-Infrared Region Photothermal Therapy,NIR-PTT)由于具有高效光熱轉換效率、深部組織穿透能力和良好的生物相容性近年來得到了快速的發展。
光熱治療的好壞直接取決于光熱轉換材料的選擇。熒光染料分子如靛青綠(ICG)首先應用于光熱治療研究,但是因其低的光熱轉化能力以及小分子易于分布于全身而缺乏特異性等缺點未能廣泛應用。近年來一些具有優異光熱轉換效應的貴金屬納米材料得到快速發展,金納米棒、金納米殼,以及金納米籠。這其中金納米籠因其穩定的光熱轉換能力與獨特的中空結構受到了廣泛研究。
然而單一的熱療并不能起到良好的腫瘤抑制效果,因為熱能在腫瘤部位不均勻的傳遞導致抑瘤不完全。另一方面,化療因其沒有靶向性而引起的副作用限制了它的發展。最近十年內,越來越多的研究結果表明,在腫瘤治療中,使用熱療和化療相結合的方法比單一接受化療或熱療效果更好,無瘤期更長。例如XiaogangQu等人通過領苯二酚鍵將透明質酸修飾到金納米籠表面,并利用金籠內部中空的結構負載抗腫瘤藥物阿霉素,在近紅外光照射下,同時具備化療和熱療的雙重功效,較單一治療手段呈現更強的抗腫瘤功效。上述技術的藥物負載量較低,雖說文章中沒有標明,其次,其表面修飾的透明質酸沒有刺激響應性。
技術實現要素:
為了解決上述技術問題,本發明目的在于提供一種可進行光熱轉換的光熱化療精準協同抗腫瘤的溫敏金納米籠水凝膠載藥系統,在金納米籠表面修飾有智能響應型聚合物,并利用硫酸銨遠程藥物負載技術將阿霉素(Dox)高效負載到金納米籠內。在近紅外光照射下,金納米籠將光轉換成熱能,導致溫度急劇升高,使得修飾于表面的聚合物收縮,分子布朗運動加快,實現藥物在熱療溫度下的脈沖釋藥,從而達到化療與熱療的協同作用。在小鼠皮下瘤模型上,通過瘤內注射的原位凝膠給藥體系,實現光熱治療與化療的聯合治療。
本發明所提供的光熱化療精準協同抗腫瘤的溫敏金納米籠水凝膠載藥系統包含可進行光熱轉換的金納米籠,智能響應型聚合物和抗腫瘤藥物。(1)金納米籠為立方體納米粒,表面帶有孔洞,內部中空;(2)粒徑為30~200nm,優選40~60nm,孔洞的尺寸1-5nm;(3)在近紅外光區(波長700~900nm)有特征峰吸收,最大的吸收峰范圍700~1100nm,優選780~810nm(金納米籠是由銀立方通過電化學置換得來,即:不斷腐蝕銀立方的同時,金元素沉積在銀顆粒表面,因金離子是三價的,所以沉積一個金原子要替換三個銀原子,所以納米粒會被掏空。隨著掏空程度的逐漸增大,其吸收光譜也逐漸變大,紅移到近紅外區域,因為近紅外區域的光在組織中的穿透性最好,因此可以透過一定程度的組織被納米粒吸收,因此根據以上關系將金納米籠的吸收峰調至800nm左右);(4)表面修飾的聚合物為N-異丙基丙烯酰胺(NIPAM)與丙烯酸(AA)的無規共聚物和嵌段聚合物;(5)藥物是以硫酸銨遠程藥物負載技術封裝于金納米籠內,載藥量1~10%,優選8%。
本發明提供的光熱化療精準協同抗腫瘤的溫敏金納米籠水凝膠載藥系統的制備方法,包括如下步驟:
1)取金納米籠與高溫配體混合,攪拌孵育后,離心,得到高溫配體修飾的金納米籠;其中,高溫配體為含有二硫鍵的鏈狀溫敏聚合物,其相變溫度為39~50℃;
2)取步驟1)得到的高溫配體修飾的金納米籠,分散于硫酸銨溶液中,攪拌,離心后,固體以阿霉素的水溶液分散,避光靜置,得到載藥金納米籠;
3)取步驟2)得到的載藥金納米籠與低溫配體混合,攪拌孵育后,離心,得到光熱化療精準協同抗腫瘤的溫敏金納米籠水凝膠載藥系統;其中,低溫配體為含有二硫鍵的鏈狀溫敏聚合物,其相變溫度為26~35℃。
優選地,所述光熱化療精準協同抗腫瘤的溫敏金納米籠水凝膠載藥系統中高溫配體的比例不少于6wt%,優選為6~11wt%,更優選為9wt%。金納米籠具有孔洞,藥物負載進去后需要其他物質堵住孔洞,我們就采用表面聚合物修飾的方法將金納米籠孔洞堵住,聚合物具有溫敏性,在較低的溫度時它處于舒張狀態,金籠孔洞被堵住,藥物不能釋放出來,當激光照射金籠時,溫度升高,聚合物收縮,藥物釋放。6%以上的修飾密度才能具有較好的金籠孔洞“封鎖”能力,另外沒有選擇11%以上的修飾量是為了后期讓低溫配體具有一定程度的修飾度。
優選地,所述高溫配體為N-異丙基丙烯酰胺與丙烯酸的無規共聚物;所述低溫配體為N-異丙基丙烯酰胺與丙烯酸的嵌段聚合物。
優選地,所述高溫配體的制備方法包括如下步驟:采用帶有二硫鍵的ATRP引發劑,以N-異丙基丙烯酰胺為溫敏單體,丙烯酸酯為pH敏感單體前物進行無規共聚,其中,N-異丙基丙烯酰胺與丙烯酸酯的摩爾比為400:8,然后通過三氟乙酸水解得到高溫配體PNA400-co-8。
優選地,所述高溫配體的制備方法包括如下步驟:取N-異丙基丙烯酰胺置于反應管中,加入丙酮、水混溶后,除去溶液中的氧氣,接著加入丙烯酸叔丁酯,氯化亞銅,Me6TREN,混勻后,除去溶液中的氧氣;放入0℃低溫恒溫反應浴中恒溫10分鐘,最后加入帶有二硫鍵的ATRP引發劑進行反應,反應24小時,然后通過三氟乙酸水解得到高溫配體PNA 400-co-8。
優選地,所述低溫配體的制備方法包括如下步驟:采用帶有二硫鍵的ATRP引發劑,先進行N-異丙基丙烯酰胺的聚合,待N-異丙基丙烯酰胺聚合完成后,再進行丙烯酸酯的聚合,然后通過三氟乙酸水解得到N-異丙基丙烯酰胺與丙烯酸的嵌段聚合物,即為低溫配體。
優選地,所述低溫配體的制備方法包括如下步驟:
稱取N-異丙基丙烯酰胺于反應試管中,加入丙酮與超純水,全部溶解后,將整個反應試管置于裝有液氮的保溫瓶中,除去溶液中的氧氣,加入氯化亞銅,配體Me6TREN,混勻,除去溶液中的氧氣,最后用進樣針加入帶有二硫鍵的ATRP引發劑,置于0℃低溫恒溫反應槽反應,反應后得到聚合物A;取丙烯酸叔丁酯于反應管,經液氮冷凍,真空泵抽真空和氬氣填充3個循環后,取無氧的丙烯酸叔丁酯加入聚合物A反應體系中再次反應,制備p(NIPAM-b-tBA)嵌段聚合物;清洗純化、干燥后,采用三氟乙酸水解,得到p(NIPAM-b-AA)嵌段聚合物,即低溫配體。
優選地,所述金納米籠粒徑為30~200nm,其表面孔洞的孔徑為1-5nm,所述金納米籠在近紅外光區波長700~900nm有特征峰吸收,最大的吸收峰范圍700~1100nm。
更優選地,所述金納米籠在近紅外光區波長700~900nm有特征峰吸收,最大的吸收峰范圍在780~810nm。
優選地,所述光熱化療精準協同抗腫瘤的溫敏金納米籠水凝膠載藥系統中阿霉素的含量為1~10wt%。
本發明還提供上述的制備方法制得的光熱化療精準協同抗腫瘤的溫敏金納米籠水凝膠載藥系統。
具體地,本發明提供的制備具有熱療-化療協同作用的納米藥物載體的方法,包括以下步驟:
步驟一,第一步采用醇還原法制備銀納米立方。
采用乙二醇作為反應溶劑,在150℃高溫下攪拌30分鐘,利用空氣中的氧氣將乙二醇氧化成乙二醛,然后由三氟乙酸銀提供的銀離子再被還原成銀原子(式1),因分子量55,000的聚乙烯吡咯烷酮特性性結合{100}晶面,最終形成銀納米立方,銀納米立方的尺寸可由反應時間進行簡單調控,通常反應時間為15到90分鐘,優選30到45分鐘。
2Ag++HOCH2CHO+H2O→2Ag+HOCH2COOH+2H+(式1)
步驟二,以銀納米立方為模板,采用電化學置換法制備金納米籠。
因Ag/Ag+(0.80V)電化學勢低于Au/AuCl4-(1.00V)。因此可通過置換反應將金電鍍于銀立方表面,與此同時將銀立方上的銀給置換下來(式2),因一個三價的金離子可以置換3個零價的銀原子,所以可以得到表面帶有孔洞且內部中空的金納米籠。
3Ag(s)+AuCl4-(aq)→Au(s)+3Ag+(aq)+4Cl-(aq)(式2)
步驟三,采用原子轉移自由基聚合制備具有NIPAM與AA無規共聚物,即高溫配體PNA400-co-8。
因聚合物要能與金納米籠進行結合,因此采用帶有二硫鍵的ATRP引發劑{雙[2-(2′-溴代異丁酰氧基)乙基]二硫化物(BiBOEDS)},以N-異丙基丙烯酰胺(NIPAM)為溫敏單體,丙烯酸叔丁酯(tBA)為pH敏感單體前物進行無規共聚,然后通過三氟乙酸水解得到高溫配體PNA 400-co-8。
步驟四,采用原子轉移自由基聚合反應制備NIPAM與丙烯酸的嵌段聚合物,即低溫配體PNA 100-b-50。
反應原理同步驟三,但首先進行的是NIPAM的聚合,待NIPAM聚合完成后,再進行tBA的聚合,得到NIPAM與tBA的嵌段聚合物,最后通過三氟乙酸水解得到低溫配體PNA100-b-50。
步驟五,將溫敏聚合物(高溫配體)孵育于金納米籠表面。
將純化后的10mL 200ug/mL的金納米籠與0.2g高溫配體PNA 400-co-8進行攪拌孵育,因聚合物含有二硫鍵,因此聚合物會以金硫鍵的方式結合于金納米籠表面,此外由于金納米籠表面孔洞處反映活性高,聚合物優先結合于孔洞處,48小時后,離心純化金納米籠。
步驟六,載藥,采用硫酸銨遠程藥物負載技術將Dox負載于步驟五得到的金納米籠內。
將孵育有溫敏聚合物(高溫配體)的金納米籠分散于10mL 100mM的硫酸銨溶液中,攪拌6小時,離心純化后,用5毫升1mg/mL的阿霉素溶液經行分散,避光靜置過夜,最后離心純化得到負載阿霉素的金納米籠。
步驟七,將金納米籠與溫敏聚合物(低溫配體)進行孵育。
將步驟六得到的負載阿霉素的金納米籠與0.2g低溫配體進行孵育,攪拌72小時,離心純化以備下一步使用。
本發明作用與效果:
本發明所提供的熱療-化療協同作用的金納米籠,因其表面被溫敏聚合物覆蓋,阻止了藥物的泄露,而當在近紅外光照射時,金納米籠吸收光能轉換成熱能,溫度迅速升高,一方面可以利用熱能殺死癌細胞,另一方面,溫敏聚合物在高溫下迅速收縮,金納米籠孔洞打開,并且高溫加快了化療小分子藥物的布朗運動,使得其產生一個藥物的脈沖釋放,最終達到一個熱療與化療的協同效應。
另外我們采取的瘤內注射的方式進行治療,低溫聚合物在生理溫度下從流動的溶液狀變成不能流動的凝膠態,將載藥金納米籠封鎖于腫瘤內,一方面降低了對正常組織的毒副作用,另一方面,金納米籠在較低的激光照射下就可以獲得較高的溫度,不但可以獲得良好的療效,而且降低了激光對皮膚的灼傷。
其中,篩選的高溫配體的溫度在40~45℃,那么在生理溫度下聚合物處于舒張狀態可以堵住金納米籠表面孔洞,在激光照射升溫后再打開孔洞,起到一個很好的開關作用。
附圖說明
圖1為本發明的具光熱化療抗腫瘤效應的溫敏金納米籠水凝膠載藥系統的作用示意圖;
圖2為本發明的具光熱化療抗腫瘤效應的溫敏金納米籠水凝膠載藥系統的載藥示意圖;
圖3A為銀納米立方的電鏡圖;
圖3B為金納米籠的掃描電鏡圖;
圖3C為本發明的光熱化療精準協同抗腫瘤的溫敏金納米籠水凝膠載藥系統的電鏡圖(TEM&SEM);
圖4A為銀納米立方、金納米籠和本發明的具光熱化療抗腫瘤效應的溫敏金納米籠水凝膠系統的吸收光譜圖;
圖4B為銀納米立方、金納米籠和本發明的具光熱化療抗腫瘤效應的溫敏金納米籠水凝膠系統的粒徑分布圖;
圖4C為銀納米立方、金納米籠和本發明的具光熱化療抗腫瘤效應的溫敏金納米籠水凝膠系統的電位圖;
圖5A為不同pH下高溫配體的透光率隨溫度變化曲線;
圖5B為不同pH下低溫配體的透光率隨溫度變化曲線;
圖6A為金納米籠的升溫曲線圖;
圖6B為金納米籠的升溫曲線圖;
圖6C為金納米籠的光熱穩定性評價圖
圖7為藥物釋放曲線;
圖8A為本發明的光熱化療精準協同抗腫瘤的溫敏金納米籠水凝膠載藥系統的相變曲線;
圖8B為本發明的光熱化療精準協同抗腫瘤的溫敏金納米籠水凝膠載藥系統的剪切變稀曲線;
圖8C為激光照射前后本發明的光熱化療精準協同抗腫瘤的溫敏金納米籠水凝膠載藥系統的相變照片;
圖8D為本發明的光熱化療精準協同抗腫瘤的溫敏金納米籠水凝膠載藥系統其粘彈性模量隨溫度變化曲線。
圖9為本發明的光熱化療精準協同抗腫瘤的溫敏金納米籠水凝膠載藥系統的體內光熱效果評價;
圖10A為瘤體積隨時間變化曲線;
圖10B為瘤照片;
圖10C是小鼠瘤重圖
圖10D是小鼠體重圖。
圖11為pNIPAM400-co-tBA6,pNIPAM400-co-tBA8,pNIPAM400-co-tBA10的GPC圖譜。
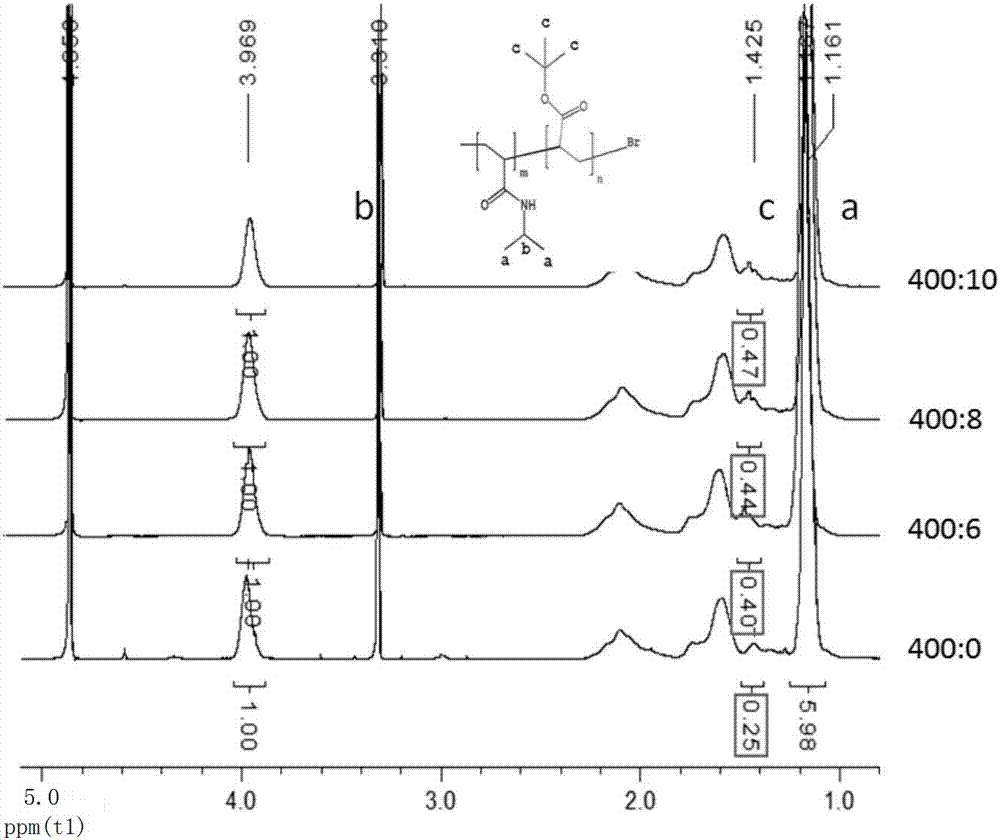
圖12為pNIPAM400-co-tBA6,pNIPAM400-co-tBA8,pNIPAM400-co-tBA10的核磁圖譜。
圖13為p(NIPAM-b-tBA)100-b-100和p(NIPAM-b-tBA)100-b-50的GPC圖譜。
圖14為p(NIPAM-b-tBA)100-b-100和p(NIPAM-b-tBA)100-b-50的核磁圖譜
具體實施方式
下面結合附圖和具體實施例對本發明作進一步說明,以使本領域的技術人員可以更好的理解本發明并能予以實施,但所舉實施例不作為對本發明的限定。
本發明提供了一種光熱化療精準協同抗腫瘤的溫敏金納米籠水凝膠載藥系統,其包含可進行光熱轉換的金納米籠,智能響應型聚合物和抗腫瘤藥物。(1)金納米籠為立方體納米粒,表面帶有孔洞,內部中空;(2)粒徑為30~200nm,優選40~60nm,孔洞的尺寸1-5nm;(3)在近紅外光區(波長700~900nm)有特征峰吸收,最大的吸收峰范圍700~1100nm,優選780~810nm;(4)金納米籠表面修飾的聚合物為NIPAM與AA的無規共聚物和嵌段聚合物;(5)藥物是以硫酸銨遠程藥物負載技術封裝于金納米籠內,載藥量1~10%,優選8%。
其制備方法,包括如下步驟:
1)取金納米籠與高溫配體混合,室溫攪拌孵育后,離心,得到高溫配體修飾的金納米籠;其中,高溫配體為含有二硫鍵的鏈狀溫敏聚合物,其相變溫度為39~50℃;(高溫配體用于封閉金納米籠表面孔洞。高溫配體在高溫下收縮,使得金納米籠的孔洞打開,從而金納米籠中的藥物得到釋放)
2)取步驟1)得到的高溫配體修飾的金納米籠,分散于硫酸銨溶液中,攪拌,離心后,固體以阿霉素的水溶液分散,避光靜置,得到載藥金納米籠;
3)取步驟2)得到的載藥金納米籠與低溫配體混合,攪拌孵育后,離心,得到光熱化療精準協同抗腫瘤的溫敏金納米籠水凝膠載藥系統;其中,低溫配體為含有二硫鍵的鏈狀溫敏聚合物,其相變溫度為26~35℃。(低溫配體修飾于金納米籠表面,在體溫下低溫配體發生相變收縮變疏水,使得金納米籠在凝膠化時與凝膠具有更好的相容性)
本發明的光熱化療精準協同抗腫瘤的溫敏金納米籠水凝膠載藥系統,是對具有中空結構的金納米籠進行選擇性表面修飾,在金納米籠表面孔洞附近修飾上具有較高相變溫度的高溫配體,實現所負載藥物在熱療溫度下的控制釋放。而在金納米籠表面其它區域修飾具有較低相變溫度的低溫配體,實現該載藥系統在體內溫度下的溶膠-凝膠相變。表面修飾的高溫配體具有溫敏相變特性,即在相變溫度下為親水膨脹狀態,堵塞金納米籠表面孔洞,防止藥物泄漏;而在相變溫度上轉變為疏水收縮狀態,表面孔洞打開,釋放藥物。低溫配體具有溫敏的溶膠-凝膠相變行為,即在相變溫度下為流動的溶膠狀態,而在相變溫度上轉變為不流動的凝膠狀態。高溫配體的相變溫度為39~50℃,優選為40~45℃;低溫配體的相變溫度為26~35℃,優選32~35℃。
本發明的光熱化療精準協同抗腫瘤的溫敏金納米籠水凝膠載藥系統可應用于近紅外光熱治療,保證藥物的可控釋放。金納米籠在激光照射下具有脈沖釋藥特性,即激光照射時,金納米籠將光能轉換成熱能,傳遞為金籠表面的溫敏聚合物,聚合物在高溫下變得疏水收縮,金納米籠表面孔洞打開,于此同時高溫使得金納米籠里面封裝的藥物的布朗運動加快,表現為光照下藥物的快速的脈沖釋放,體現為光照與藥物釋放的同時性,在腫瘤的治療中具有熱療與化療協同作用。
高溫配體和低溫配體所采用的聚合物是由具有二硫鍵的引發劑引發聚合,聚合物是通過金硫鍵結合于金納米籠表面。金納米籠表面的聚合物是通過金硫鍵孵育上去的,首先將金納米籠與高溫配體進行孵育,因金納米籠表面孔洞出的金活性較高,聚合物優先選擇結合于孔洞處,再將金納米籠與低溫配體進行孵育,使低溫配體結合于金納米籠表面。
本發明的高溫配體所采用的溫敏聚合物是由溫敏單體是由N-異丙基丙烯酰胺(NIPAM)、2-甲基-2-丙烯酸-2-(2-甲氧基乙氧基)乙酯(MEO2MA)和親水單體丙烯酸(AA)、甲基丙烯酸(MAA)和苯乙酸磺酸鈉(Sodium p-styrenesulfonate)等通過原子轉移自由基無規共聚而來,通過調控溫敏單體與親水單體之間的比例調控聚合物的相轉變溫度。
本發明的高溫配體所采用的溫敏聚合物是由溫敏單體是由氮-異丙基丙烯酰胺(NIPAM)、2-甲基-2-丙烯酸-2-(2-甲氧基乙氧基)乙酯(MEO2MA)和親水單體丙烯酸(AA)、甲基丙烯酸(MAA)和苯乙酸磺酸鈉(Sodium p-styrenesulfonate)等通過原子轉移自由基聚合按嵌段結構制備而來。
本發明采用硫酸銨遠程藥物負載技術將Dox高效負載到金納米籠內。首先將金納米籠分散于100mM的硫酸銨溶液中,攪拌6小時,離心除去游離的硫酸銨,然后用阿霉素溶液分散負載硫酸銨的金納米籠,避光靜置過夜,最后離心洗滌除去游離的阿霉素。
以下以具體實施例對本發明進行進一步說明:
實施例一
銀納米立方的制備方案,往潔凈的250mL圓底燒瓶中加入100mL乙二醇(Ethylene glycol,EG),于150℃油浴加熱,待燒瓶內溫度升至150℃,加入1.2mL 3mM硫氫化鈉EG溶液,兩分鐘后,加入3.0μmol/mL鹽酸EG溶液10mL,20mg/mL的PVP溶液25毫升,再等待兩分鐘,加入282mM的三氟乙酸銀溶液8mL,隨著反應時間的延長,銀納米立方的尺寸不斷增長,優選反應時間為45分鐘,尺寸大小約為60nm左右(見圖3中A圖),最后置于冰水浴中降溫終止反應即可
采用丙酮和超純水分別對銀立方溶液進行離心洗滌處理。
實施例二
采用電化學置換法制備金納米籠,將純化后的銀納米立方分散于超純水中,加入PVP至終濃度為1.5mg/mL,于100℃由于恒溫10分鐘后,采用微量注射泵加入1mM HAuCl4,流速為42mL/h。隨著HAuCl4不斷加入,溶液顏色不斷發生變化,因金離子不斷銀原子,其結構從實心不斷往空心變化,與此同時其最大特征吸收峰不斷往近紅外區域的長波長變化,待溶液顏色變成藍色時,定時取樣,測定其吸收光譜,優選最大吸收光譜為800nm的金納米籠,因此時金納米籠具有良好的空心結構和孔洞特征,另一方面800nm處的近紅外激光對組織具有良好的穿透效應。
實施例三
高溫配體的制備方法,采用原子轉移自由基聚合法制備溫敏聚合物,以N-異丙基丙烯酰胺(NIPAM)為溫敏單體,丙烯酸叔丁酯(tBA)為pH敏感單體前物,雙[2-(2′-溴代異丁酰氧基)乙基]二硫化物(BiBOEDS)為引發劑,三(2-二甲氨基乙基)胺(Me6TREN)為配體,氯化亞銅(CuCl)為催化劑,丙酮與水四比一的混合溶液為溶劑進行ATRP反應,NIPAM:tBA:BiBOEDS:Me6TREN:CuCl摩爾比=400:x:1:2:2。稱取5.66g NIPAM(50mmol)置于反應管中,加入8毫升丙酮,2毫升水混溶后,于液氮中冷卻,抽真空5分鐘后,用氬氣填充并于水中融溶,接著加入tBA(108μL(0.75mmol)、145μL(1mmol)、181μL(1.25mmol)),氯化亞銅25毫克,Me6TREN 67μL,混勻后再進行2次凍(液氮冷卻)-抽(抽真空)-通氣(氬氣填充)循環,放入0℃低溫恒溫反應浴中恒溫10分鐘,最后用微量進樣針加入BiBOEDS 38μL進行反應,反應24小時,最后優選tBA 145μL的配比(制得PNA 400-co-8),此配比的聚合物相變溫度為40℃附近,滿足設計要求。
24小時后過氧化鋁柱子除去銅離子,旋蒸除去溶劑,然后用乙醚將產物沉淀出,離心去除上清,再次用乙醚沉淀并洗滌兩遍,最后離心除去上清,70℃真空干燥過夜。
采用三氟乙酸將tBA水解成AA。稱取2g干燥后的聚合物于250毫升圓底燒瓶,加入40毫升二氯甲烷溶解,于30℃油浴恒溫10分鐘后,加入3毫升三氟乙酸進行水解,水解反應進行24小時,24小時后旋蒸除去溶劑,采用無水乙醚沉淀產物,離心除去上清,并加入適量乙醚后,用玻璃棒將沉淀物搗碎并超聲震蕩2分鐘(將混于產物中的三氟乙酸盡可能的洗出),再次離心除去上清,重復上述步驟2次,最后將離心獲得的產物置于70℃真空干燥箱干燥過夜。根據不同的tBA加入量,分別得到PNA 400-co-6,PNA 400-co-8和PNA 400-co-10。進行GPC和核磁測定:見圖11和圖12,圖11為pNIPAM400-co-tBA6,pNIPAM400-co-tBA8,pNIPAM400-co-tBA10GPC圖譜,三種聚合物的分子量相近,其對應的滯留體積也相似,同樣他們的分子量分布均一。圖12為pNIPAM,pNIPAM400-co-tBA6,pNIPAM400-co-tBA8,pNIPAM400-co-tBA10核磁圖譜,隨著丙烯酸叔丁酯的增加,其特征峰面積逐漸增大,且與單體設計設計的摩爾比例接近,表明聚合物已成功制備。
實施例四
低溫配體的制備,方法同高溫配體的制備,不同之處是先進行NIPAM的聚合再進行tBA的聚合。稱取NIPAM單體(2.26g,20mmol)于100mL反應試管,加入8mL丙酮與2mL超純水,攪拌使NIPAM單體全部溶解,將整個反應試管置于裝有液氮的1L的保溫瓶中,使整個體系凍成固態,再抽真空,接著用高純氬氣填充融溶,氬氣填充后加入氯化亞銅(20mg,0.2mmol),配體Me6TREN(54uL,0.2mmol),混勻,再次冷凍—抽真空—通氬氣溶融兩個循環,最后用進樣針加入二硫引發劑(BiBOEDS,32uL,0.1mmol),置于0℃低溫恒溫反應槽反應24小時。取4毫升tBA于反應管,經液氮冷凍,真空泵抽真空和氬氣填充3個循環后,用5mL的進樣針取無氧的丙烯酸叔丁酯tBA(3mL,0.1mol)加入polymer A反應體系中再次反應24小時,制備p(NIPAM-b-tBA)嵌段聚合物。24小時后,用等體積的丙酮稀釋產物,過三氧化二鋁柱子除去銅離子,接著用旋轉蒸發儀除去部分有機試劑,再用大量超純水將產物析出,抽濾混合物并用大量水洗滌產物,最后將得到的產物置于70℃真空干燥箱,干燥24小時后采用三氟乙酸水解得到PNA 100-b-50。進行GPC和核磁測定:見圖13和圖14,圖13為p(NIPAM-b-tBA)100-b-100和p(NIPAM-b-tBA)100-b-50的GPC圖譜,都是單峰表明分散性好,分子量分布均一。p(NIPAM-b-tBA)100-b-100分子量較大所以先被流動相洗出,滯留體積較小。圖14為p(NIPAM-b-tBA)100-b-100和p(NIPAM-b-tBA)100-b-50的核磁圖譜,叔丁基上特征峰c出現在化學位移1.47處,與NIPAM上異丙基上甲基的特征峰1.17處的峰面積之比為3:2,符合單體比例1:1的設計,p(NIPAM-b-tBA)100-b-50同樣符合比例設計。
表1為本發明的光熱化療精準協同抗腫瘤的溫敏金納米籠水凝膠載藥系統的表面修飾聚合物的表征數據;
從表1中可以看出,采用原子轉移自由基反應制備的聚合物具有良好的單分散性,實際分子量的分布與理論設計值很接近,另外在前3中共聚物中看出可以通過調控丙烯酸AA與NIPAM的摩爾比例調控聚合物的相變溫度(摩爾比為400:8,本文篩選了三種比例,400:6,400:8,400:10,400:6的相變溫度低于37℃,400:10相變溫度高于45℃,只有400:8相變溫度為40℃,滿足稍高于生理溫度這個條件)。低溫配體為NIPAM與AA嵌段聚合物,AA的比例幾乎不影響NIPAM的相變溫度。
圖5為兩種不同相變溫度的配體的透光率隨溫度變化曲線,因為NIPAM中含有親水的酰胺鍵和疏水的異丙基,在低溫時,酰胺鍵與水分子的氫鍵作用強于異丙基的疏水作用,宏觀上表現為透明溶液,隨著溫度的升高,酰胺鍵與水分子的氫鍵作用被破壞,進而異丙基的疏水作用就占據主導位置,宏觀上體現為不透明的濁液。從圖5的A圖看出隨著溫度的升高,聚合物的透光率逐漸降低,由原來的透明狀變成不透明的乳白狀,另外由于AA為pH敏感單體,pH的改變直接影響羧基的電離程度,因此調控溶液的pH值也可以調控聚合物的想變溫度。B圖為嵌段聚合物的透光率隨溫度變化曲線,因為聚合物是以嵌段的形式存在,那么NIPAM聚合中間就不會參雜親水單體AA,這樣NAPAM的想變溫度就不會受到AA的影響,從而也不會受到pH值改變的影響。
實施例五
將聚合物孵育于金納米籠表面,將純化后的10mL 200ug/mL的金納米籠與0.2g高溫配體PNA 400-co-8進行攪拌孵育,因聚合物含有二硫鍵,因此聚合物會以金硫鍵的方式結合于金納米籠表面,此外由于金納米籠表面孔洞處反映活性高,聚合物優先結合于孔洞處,72小時后,離心純化金納米籠。
實施例六
金納米籠的藥物負載,采用硫酸銨遠程藥物負載技術將Dox負載于金納米籠內。將孵育有高相變溫度的溫敏聚合物的金納米籠分散于10mL 100mM的硫酸銨溶液中,攪拌6小時,離心純化后,用5毫升1mg/mL的阿霉素溶液進行分散,避光靜置過夜,得到載藥納米金籠
實施例七
實施例六得到的載藥納米金籠與0.2g低溫配體PNA 100-b-50進行孵育,攪拌72小時,離心純化得到本發明的光熱化療精準協同抗腫瘤的溫敏金納米籠水凝膠載藥系統。其中高溫配體的含量為9wt%,低溫配體的含量為16.8%wt%,載藥量為8wt%。
圖1為本發明的光熱化療精準協同抗腫瘤的溫敏金納米籠水凝膠載藥系統的作用示意圖。
如圖1所示,金納米籠為表面帶有孔洞,內部中空的納米粒,通過金硫鍵將溫敏聚合物修飾于金納米籠表面,然后利用金納米籠中空的內部負載硫酸銨,然后再與阿霉素溶液孵育,使得阿霉素以硫酸銨的鹽沉淀的形式負載于金納米籠內部。接著再與低溫配體共混孵育后,注射于小鼠腫瘤中,在生理溫度下低溫配體發生相變行為,變成不能流動的凝膠態,在激光的照射下升溫并釋放藥物,起到熱療-化療協同治療的的效果。
圖2為金納米籠藥物負載示意圖,加熱使得金納米籠表面的聚合物收縮,孔洞打開,硫酸銨溶液進入金納米籠內部,再經冰水冷卻,使得聚合物舒張開,封住孔洞,將硫酸銨包裹于金納米籠內部,接著在低溫下讓金納米籠與阿霉素溶液共孵育,阿霉素分子因與硫酸銨可形成沉淀,因此不斷有阿霉素分子穿過聚合物層進入金納米籠內形成阿霉素硫酸銨鹽沉淀,進而起到藥物負載效果。
圖3A圖為銀納米立方的電鏡圖,從中可以看出銀立方在掃描電鏡下為實心的三維立方體結構,帶有明顯的棱邊和尖角,在TEM下顯示為二維的正方形,尺寸在50nm左右。以之為模板制備的金納米籠在掃描電鏡(圖3B)下為表面帶有孔洞的立方體結構,而TEM則反映出金納米籠帶有空心的內腔。將聚合物通過金硫修飾到金納米籠表面后,在電鏡下可以看到金納米籠表面覆蓋了一層3-5nm的聚合物層(圖3C),證明聚合物已經成功修飾到金納米籠表面。
圖4A為為三種材料的吸收光譜,銀納米立方的吸收峰,與夏幼南課題組報道(Facile synthesis of Ag nanocubes and Au nanocages)相符。從圖中可以看出,金納米籠和本發明的光熱化療精準協同抗腫瘤的溫敏金納米籠水凝膠載藥系統(HL-GNC)已經在圖上標注了不同材料的吸收峰在近紅外區域具有很強的吸收,且HL-GNCs的吸收光譜略有紅移,這主要是因為聚合物層修飾上后尺寸略有增加;圖4B為三種材料的粒徑數據,從中看以看出銀納米立方和金納米籠的粒徑很相似,因為金納米籠是以銀納米立方為模板,通過電化學置換反應制備而來。另外由于其表面吸附有聚乙烯吡咯烷酮,可以形成水化層,因此相較于TEM下50-60nm的尺寸,其水化粒徑在100nm左右。而當將聚合物修飾到金納米籠表面時,因其良好的親水性與致密的修飾程度,相較于金納米籠其水化粒徑增加到115nm。圖4C為三種材料的Zeta電位數據,銀納米立方表明吸附有聚乙烯吡咯烷酮,其體現出較低的Zeta電位值(-21mV),當通過化學置換反應制備金納米籠后,表面的聚乙烯吡咯烷酮密度減小,Zeta電位絕對值也相應變低(-8mV),而當p(NIPAM-co-AA)修飾到金納米籠表面時,因羧基強大的電負性,其Zeta電位有恢復到-24mV。
將金納米籠稀釋成不同的濃度,取1毫升至于2毫升離心管中,用激光照射,照射的同時,實時用近紅外成像儀監控溶液溫度的變化。
圖6A為金納米籠的升溫曲線圖,沒有載藥金納米籠代表一類在近紅外區有可調的吸收光譜的納米材料,因其具有強烈的局域表面等離子共振特性而被廣泛研究,其最有特色的一點是其優異的光熱轉換效率。當近紅外照射到金納米籠表面時,金原子表面的電子層會跟隨著一起震動,當其震動頻率與入射光頻率一致時會產生強烈的共振效應,表現為強大的吸收和散射特性。從上圖我們可以看出,隨著照射時間的延長,金納米籠溶液的溫度逐漸升高,并且高濃度的金納米籠具有更快的升溫速率和更高的升溫范圍,100ug/mL的金納米籠溶液在0.4W/cm2激光照射下其在十分鐘內溫度可以升高近23℃,而5ug/mL的金納米籠溶液只升高了10℃。圖6B說明金納米籠的升溫速率與照射激光的功率也相關,同樣的濃度,同樣的照射時間,高功率的升溫快切幅度大,同樣是5ug/mL的金納米籠溶液在1W/cm2的激光照射下溫度可以升高近20℃,100ug/mL的金納米籠溶液溫度更是升高了40℃。金納米籠優異的光熱轉換效率為此后的體內實驗做了良好的鋪墊。圖6B為金納米籠光熱穩定性評價,在激光照射前后,金納米籠的形貌沒有受到影響,結構沒有發生破壞,在TEM下依舊為中空的方形納米粒。并且連續照射5次,其升溫和降溫曲線幾乎一致,這表明金納米籠具有穩定的光熱轉換能力。圖6C說明了金納米籠的光熱穩定性,有些光熱材料在激光照射下會發生變化,再次用激光照射升溫效果變差,金納米籠一直都很穩定。圖6C為升溫降溫曲線,用激光照射1毫升金納米籠溶液體系,在照射的同時,用近紅外成像儀實時監控金納米籠溶液溫度的變化值,一直照射10分鐘,十分鐘后撤去激光,看溶液在后10分鐘的降溫情況,一共做5個循環,證明金納米籠在激光照射下不會變形,圖6C前后兩個電鏡圖為金納米籠在激光照射前后的電鏡圖,證明金納米籠結構的穩定性。
圖7為體外藥物釋放曲線。由于低溫配體對藥物釋放無影響。因此,對實施例六得到的載藥金納米籠進行體外藥物釋放的實驗。
實驗過程:取500uL實施例六得到的載藥金納米籠水溶液(濃度為金1mg/mL,溶于水),置于2毫升EP管中,用1W/cm2的808激光照射5分鐘,離心取上清,測定上清液中阿霉素的含量,沉淀用500uL超純水再次分散。1小時后再次用1W/cm2的808激光照射5分鐘,離心取上清,測定上清液中阿霉素的含量,按以上步驟一共重復照射8次,計算阿霉素的累積釋放量。
對照組(另取500uL實施例六得到的載藥金納米籠水溶液(濃度為金1mg/mL,溶于水)作為對照組),離心測定上清阿霉素濃度后,用水再次分散后,置于37℃搖床,待1小時后再次離心測定上清阿霉素的濃度,一共重復測定8次,計算阿霉素的累積釋放量。(圖7中階梯型的曲線為實驗組,較平的曲線為對照組)。
從圖中可以看出,在生理溫度下,隨著時間的延長,實施例6的載藥金納米籠的金納米籠內的藥物釋放很緩慢,因為高溫配體此時仍然處于舒張態,堵住孔洞,限制藥物的釋放,而在激光照射下,金納米籠吸收光能轉換成熱能,溫度迅速升高,一方面可以利用熱能殺死癌細胞,另一方面,溫敏聚合物在高溫下迅速收縮,金納米籠孔洞打開,并且高溫加快了化療小分子藥物的布朗運動,使得其產生一個藥物的脈沖釋放,撤去激光后藥物幾乎不釋放,再次采用激光照射,藥物又會出現脈沖釋放行為,這表明我們可以通過控制激光照射來靈活調控藥物的釋放。
本發明的光熱化療精準協同抗腫瘤的溫敏金納米籠水凝膠載藥系統的體外溶膠-凝膠相變行為實驗。實驗方法:將1毫升本發明的光熱化療精準協同抗腫瘤的溫敏金納米籠水凝膠載藥系統分散于1毫升水中,置于2毫升的樣品瓶中,置于恒溫水浴中加熱5分鐘,待載藥系統溫度恒定,倒置瓶子,看其是否凝膠化,能夠粘于瓶底不流下來)。
圖8A為本發明的光熱化療精準協同抗腫瘤的溫敏金納米籠水凝膠載藥系統的相變曲線,在相變溫度下,金納米籠混合液處于一個流動的溶膠態,便于注射;在相變溫度之上時,金納米籠混合液處于一個不能流動的凝膠態,從瓶倒轉照片可以看出,在相變溫度之上時,金納米籠混合液變現為不能流動的“固體”,粘附在瓶底,倒轉過來后依舊不往下落。圖8B為本發明的光熱化療精準協同抗腫瘤的溫敏金納米籠水凝膠載藥系統的剪切變稀曲線,這表明可以通過高速剪切,減低溶液的粘度,在進行瘤內注射時便于更好的操作。圖8C為激光照射前后金納米籠混合液的照片,這表明可以通過激光照射使得金納米籠混合液的溫度快速上升,進而形成凝膠態,增加其彈性強度,降低腫瘤內高的間質壓帶來的影響。圖8D為金納米籠混合液其粘彈性模量隨溫度變化曲線,從中可以看出,隨著溫度的上升,聚合的模量有數量級的增加,并且彈性模量顯著大于粘性模量,這表明此時材料呈現為“固體”特性,與瓶倒轉實驗相符。
圖9為本發明的光熱化療精準協同抗腫瘤的溫敏金納米籠水凝膠載藥系統的體內光熱行為的近紅外圖像。取雄性Balb/C雄性小鼠20±2g 20只,于小鼠右后腿皮下注射100uL H22腫瘤細胞,7~10天后待腫瘤長至150~200mm3,隨機分成4組,每組5只。采用瘤內注射的方式分布往腫瘤注射50uL生理鹽水(圖9中的生理鹽水+光照組),50uL 100ug/ml的阿霉素溶液(圖9中的阿霉素+光照組),50uL 1000ug/ml金納米籠溶液(圖9中的金納米籠+光照組),50uL光熱化療精準協同抗腫瘤的溫敏金納米籠水凝膠載藥系統的水溶液(圖9中的載藥金籠@聚合物+光照組),載藥系統中金籠的濃度為1000ug/ml,阿霉素的濃度為100ug/ml。采用0.4W/cm2激光照射腫瘤,實時用近紅外熱成像儀監控腫瘤溫度。
在注射生理鹽水、游離阿霉素、金納米籠、本發明的光熱化療精準協同抗腫瘤的溫敏金納米籠水凝膠載藥系統后,采用0.4W/cm2激光照射時,只有含有金納米籠的兩組,隨著照射時間的延長,瘤內的溫度會有顯著的上升,最高溫可達50℃,這表明金納米籠具有優異光熱轉換能力,可以滿足動物實驗的需求。
實施例八
圖10為本發明的光熱化療精準協同抗腫瘤的溫敏金納米籠水凝膠載藥系統的藥效研究數據。具體實施方法,取40只Balb/C雄性小鼠,于小鼠右后腿部皮下注射200萬H22腫瘤細胞,構建老鼠皮下瘤模型,一周后待腫瘤長至150mm3以上時,取35只腫瘤大小較均勻的小鼠按每組5只隨機分成7組:1)生理鹽水組;2)阿霉素組;3)阿霉素加光照組;4)金籠@聚合物組(金籠@聚合物是指修飾高溫配體的金納米籠與阿霉素的物理混合物,修飾高溫配體的金納米籠的制備方法見實施例5);5)金籠@聚合物加光照組;6)載藥金籠@聚合物組(即為實施例7制備的光熱化療精準協同抗腫瘤的溫敏金納米籠水凝膠載藥系統);7)載藥金籠@聚合物加光照組。分別往荷瘤小鼠瘤內注射50微升藥物(生理鹽水組注射生理鹽水;阿霉素組和阿霉素加光照組注射阿霉素(阿霉素的濃度為100ug/mL);金籠@聚合物組和金籠@聚合物加光照組注射結合有高溫配體的金納米籠和阿霉素的物理混合物(注射液中金納米籠的濃度為1mg/mL,阿霉素的濃度為100ug/mL);載藥金籠@聚合物組和載藥金籠@聚合物加光照組注射本發明制備的光熱化療精準協同抗腫瘤的溫敏金納米籠水凝膠載藥系統(注射液中金納米籠的濃度為1mg/mL)并根據分組進行對3)、5)、7)組采用功率為0.4W/cm2的激光進行照射,每只老鼠照射5分鐘,并且每天對小鼠進行體重、瘤長與瘤寬數據記錄,并根據公式:
瘤體積=瘤長×瘤寬×瘤寬/2,計算腫瘤體積,實驗進行兩周后,處死老鼠,取老鼠腫瘤稱重。
從圖10A可以看出,除載藥金籠@聚合物加光照組外,其余6組的腫瘤體積都具有增大趨勢,相較于單一化療組載藥金籠@聚合物組和單一熱療組金籠@聚合物加光照,第7組載藥金籠@聚合物加光照與之相比都具有極顯著性差異,體現出協同治療效果。圖10B的腫瘤照片與圖10A的結果相映襯,第7組載藥金籠@聚合物加光照實驗組相較于其他6組具有最小的腫瘤,圖10C的瘤重圖與圖10A,圖10B兩圖數據相映襯,顯示出載藥金籠@聚合物加光照實驗組具有最輕的腫瘤腫瘤。圖10D為試驗老鼠的體重數據,7組實驗老鼠體重無明顯改變,證明材料具有良好的生物安全性。
以上所述實施例僅是為充分說明本發明而所舉的較佳的實施例,本發明的保護范圍不限于此。本技術領域的技術人員在本發明基礎上所作的等同替代或變換,均在本發明的保護范圍之內。本發明的保護范圍以權利要求書為準。
- 還沒有人留言評論。精彩留言會獲得點贊!